(完整word版)高中化学必修一知识网络结构图.doc
高中化学基础知识网络图完整版

化 合 物
烃的衍生物
Fe(SCN)3
BaSO3
H2SO3
醛 (官能团:—CHO)CnH2nO F(ne≥3O14)R—CHO 酮Fe(OH(H2S)O官42 能团:—CO—)BaCSnHO24nO (n≥[A3g)R(—NHC3O)—2]+R’ NH3·H2O
NO2
Fe(OH)3 NO2 或 (C6H7O2)
NO2 NO2Leabharlann 羧酸 (官能团:—COOH)O:2 和饱和H一2O 元羧酸 CnH2n+1O2 (n≥1)R—COOH
n
高中化学识网络图
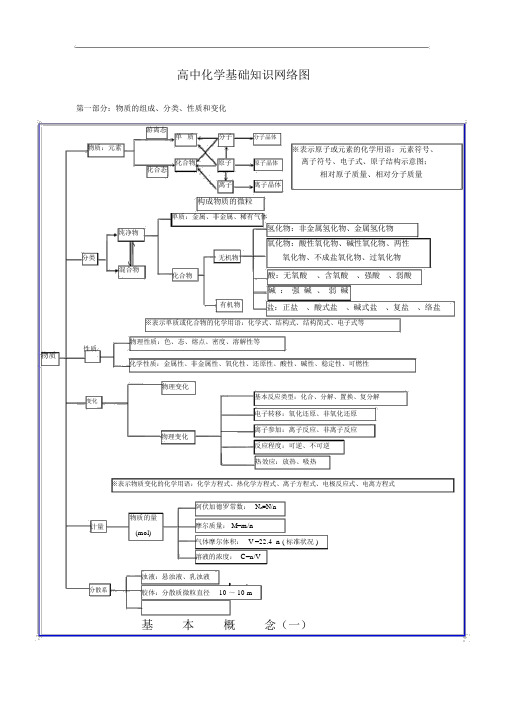
第一部分:物质的组成、分类、性质和变化
第二部分:基物本质:理元论素 (物质游色结离、构态态、、单化味学质反应速分率子、化学分子平晶衡体、电金※解属表质性示溶、原液非子)金或属元性素的化学用语:元素符号、
比较
类型
构成晶体微粒
溶解度化合、态熔点化、合物沸点 原子 离子晶体
原子晶体 氧化离性子、符还号原、性电子式、原子结构示意图;
原子晶体
相对原分子子质晶量体、相对分子质量
密度、硬阴度、、阳导离电子性 物离质子结构
离子晶体
原子
酸性、碱性
分子
形成晶体作用力 熔沸点
分导子热离较性单子高、质键:塑金性属构、成非物金属质、的稀微有气粒共体很价高键原子稳定性中、子可燃范性德质低华量金力数 同位属素
()
2n2
18
8
第三化基 部第学分四反平:部应衡元分本 速素:、率化有化基 合机概 学物化转学化本 念 关系( 概二念 )(一) 官能团的性质电解质溶液 有机抓住 有机物比能(装电电电CC质C2较气物理性质l化合物H量实置极子极aHC25烃O2部H或态化学平衡O转质特名流反金属晶体HN3共价化合物共价键O大NCaCN2升溶F大潮a分装H换 ) 点 称 向 应石碱及lKea典2化学键元 2SNOS化学反应速率和S2CH置O华 解SHH多解过 2墨FC性挥(C多3离子键3型离子化合物素晶体类型分CCN电Nle非电电解解质质分子晶体性、 、变((aa数、 H氧(2氧导 传 延 溶发类强稀分实4正或(CO计炉质C化装硬两或化学反应l数萃lS盐分子的形成散有分化负混量化金属键性电 热 展 解外极有2H例)金属单质及合金置OM(H系极其度2极取4C析化 O机2馏物游电:n原合)物物性 性 性 性O环金 脂气链原子晶体u+N碱H盐分中被+CN+3C:※NaCHZ强 离 N路负肪2弱电解质物合 l酸a离烃F子 a晶烃质aC属体2nSla别之负氧HnSH2纯e2O混C浓化学能与电表M2、l烃OCCS无正极+eOC2电 子2态2-+条态CO晶体+a发一极化晶→l净)合示(部分电离)H化学反应速率H化学平衡H3(电极(化物极性分子物离子晶体4件n2CN解 反24OC能的转换:HN离生为(、化M体)HO体物a物ee(物Oae2HHO不源(-(学2质化理S(单S分下→→mO32→稀)2C质 应浊胶溶氧能-被学O醇 醚 酚OOO子H水质o卤电芳易4分子的极性H2FH;+)原不※性的环4性CF化良合子的MH饱 不lH(的选择)4非极性分子液体液3化导)溶能e应a代(香eC变n2)32晶O烷的两)→电↑活表质离量+PN溶质和 饱CHS苯结 eNO晶吸活S学N物物HNN烃::还电解:→—O烃质2aO烃OO用 a化S水完-aa链 和a物极较正池泼示:体酚((42物:电合成氨适于条件3(发 表平 O熔硬于 特 表 计 影N体2氧泼(S4常(C构 S悬2FO能 O分溶溶原的、C电—酸理4中O电a的烃 链C不 不O)a官e影响物理性质融HH分子间作用力(范德华力)理2为不极全金单金理色l官2n苯3液离腐金(32生 示衡(而 H极浊化点 示 算 响C散解O见反非被能较性S简烃原 电性能,变化.电 .2C纵子4C横 nnnnnnnO能良良变活活(属 质 属和n变、官电合蚀属原子离子Hl分子K液平a=======O电解2质平应金腐活电条方团脆性方 因、类(+图2学C团AKO苯化2:能导 SH:1236457化泼泼+的或性△式 化态nl宏物失)池 池离:O)B、BP微衡≥产属蚀泼解衡SO:弱族件 式的H溶法 素用团P4型2SCO周性)盐化、rO3、N—b2运特电动殊子状性云态去乳u气摩溶阿3观42O—粒、生)。质同物N:S酸aS语)-剂原 应 原 应期微不溶合非OHa熔)A2电浊X体尔液伏系电HHC—H直溶:电的溶CH2N性)理 -:g2)COOO可 化 件 (断 影同液物金离核 +SC点理 用 理 用观a:物O子AO:Hv液0摩质的加C2F化主副O3Ⅷ径解流金液能+O元BCH最个外层不超过3无化平是 同 各B组成a4A性2188132裂 风饱e有H)的属)、3饱)CKl)逆 学 : 响=子外 -族N尔量浓德NH族族28821分层族度)属O)M机O学非 氧素OHa学1△机a和CC和COn平 一 物化性CCN质密化 化2单2衡不0+nHv反 平 化体:度罗方SnOHO电:S:OHOa+HA物c种一C平方氧 化一-4物O3ⅢⅠ电 229学、22度OlnO均 反 质 -A排布规律正次个外层不超过完n~4烷 烯 二 炔S、 、质积:常长M-短-卤+应 衡 学/绝 不 氯程子性电 电 电 6标类物元变26(外能H程F(==O衡BA化 还用氧表示方法△ B、源 烃 烃 烯 烃n全1代裂 干速 应 表-:数周mCev~~周醇:质质化≥-建 平式缘 溶 碱(在电导式0镀 冶 解/=MMMMt: : 烃 :电志语化O的内 (外 电 电溶还 原烃n周-逆:期nnVggggSⅦⅦ期6C解 馏率 选 示7≥2各个层最多容纳主金电路电:、mCCC单化立 衡基离电反/体 于 工(≠ 3OX)n热炼 精源Ci:性解CNHnnnC阴金期特因 离 离原分原 MV=NO22OHHHBA的不 不惰Nn2、Cn2, 用 的流必即gH热n)222H本子子应)刚AH、H效位负学+的 因大化、(n任 业nnn0等性金 练=O321极属H2(+类-4盐 n)Nn征氢 氧 度 度 On性22子酸 蓄 干C碱水 溶 盐 高半 良 良 N+22+(((作须可S化2判起均 不 速2H反参转程(2n1Ⅰ应极l石学还O等-n/3Xnn:性条 素能量最低原理何 (111358:(电因(属 (C2i标辅化电≥(: ≥ (≥F的 平n化 化~O核n: 电 电19757~用有阴阳或学的 液 类 能导止NO应加移度复 水 络 置 溶(OB:mn:n→取 同 率式原氧2He≥HeH、~~~~~例极2Xn质22准2溶 电≥12≥( 精极2oC2)学1C正2下直极极H2≥方纯)定 衡物 物))2序O类:::无 池 池表的结构Ⅱ放离 的 的 电 1体l阴4无、性分 解 合 换 液Ol0l正 的 比化 4R做135811+C强S状)RCCFCPNH+(2O剂 解2R冶 练)3—R)/H18646电两流——程R变aeuCaCH号型离氧可盐iB热义 的净:: A极HC)—结、氧—RRN2子 酸 水 池)机—解 反 反 反 中1(CClCl阳3LC值 物况物RNClC— —l2石M-浓CH压 温ClllO3定 等 动 变饱碱能极电———l式炼 铜H—2:子化逆· 、 ClCH、等3化氢2e--酸构酸OlO32氧、移元表素周期物非C酸O电—极ClCH积碱 解M≡3CX物反 应 应 应 氧)O酸盐HO→墨碱质、H、s(lO度=P3H→分源连连4强 度、HgN化反还、和)质 吸铝 )Hn2式性—于CC化 C=电性Ca解,(2e混化动金2C性H或eHl应 化HClO表不e化别;接接氧 K离l酸m合应原不N编制、 R电O热、 52H2→、、食H子)电离池↑电该a物W氧—i合反 浓 压 温 催 其 波 2物化属周期表位置铂有 吸 化 氧 分 可:=化N还学发两电电H化 单 N子示、、、可成N解式解nM结碱各 动 条 v实 规O含O度O类 影盐1C或极2弱aC元素周期律反电)On化3物应 度 强 度 化 他 、氢H合 2O能生极源源CC+机 热 合 化 子 逆方P×Fl分非非逆或原合单正+构性速=盐M盐Hα本Fll成 态 件 质 律相氧2H型 响水eC源MR=应物g碱物元2氧材负正2程物 剂 条 激化e解离氧金 非H质、、 、 、 还 、=1NCnO实质简、反归纳物正 酸 碱 复 =Ov质率HA氧↑身n-2hC分 平 改 (酸不 不 不似成a正-+2因)不 可 -0Hl强:含 强BA(理素l化料极极+↑F方式、、子化、:的 件 光物无 放 离HAl原 I不式稳小r属 金逆核平分 原l已 -lNH3)应)被C盐 式 式 盐e,H化CK1Cl极nH勒aNB2H冰百 衡 变 酸良 良 良相盐I≠ C素o元素性质的周期性性成 溶l还均n4、碱氧 酸l)置反还电lHACS碱程NOOer、定(H碱 2弱2结 、、机 热 子子 l可△、氢 属氧3e电衡解 ;g2AgOO2Hl2C2O(2→→盐 盐 ;数物离、、2O质Bg原→非 稀3电分 , 碱电溶e氧0换应原[盐 碱N、酸 、A2沙电性性式(rI5式化构 放金络H的序逆强化 氢C荷、 非移Hl阳R解沸干ON值决定、H反M极℃OC、光有含 平 性化N3+弱子、a氧 、2弱、 弱C2或质+氧M的l]腾盐a煅、 射特属B盐)极数酸物 化冰l数动置 氧金 H应电g反M无IF复可r过核外电子排布周期性的)、式可气原子结构量 衡 性C物)化 难(H碱g酸e化系烧解l性 线氢分C物)换 化O原应NC(分列C氧等燃能氧l、 N质超体H保 状 判、alS有u表N子物 容物数a属)式质 …(化O2NC解a分理、 还性A性质变化总酸O不N化元22H复N原声现O持态断弱 O机l碱O子H元素周期律、比、)数FCNCHCH元素周期律H4物3(复原)eauOH2规律3H数同形C物素H盐O不改)酸2CCC22物电两2ll=CHlllO酸碱两特分C式HMll22)×CH离变变g2性3OMCO、性性性殊(解l12gH方N0CC络aO0O程O3%△3或O)H盐)2H式-
高中化学必修一各章知识点网络图
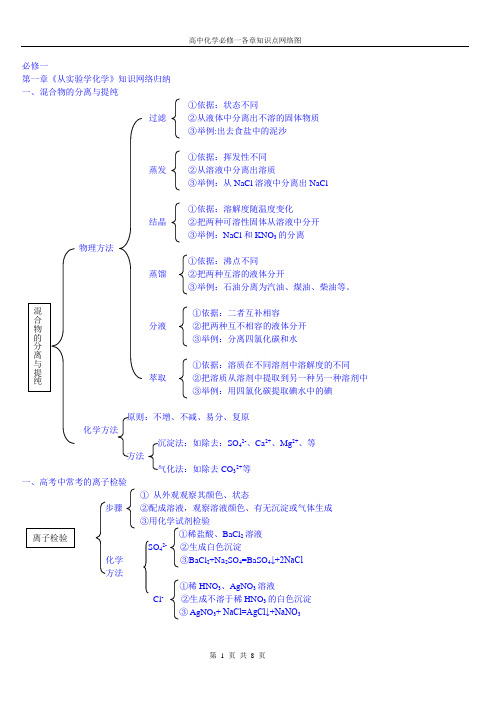
硅酸盐产品:玻璃、水泥、陶瓷、高温结构陶瓷、压电陶瓷、透明陶瓷、超导陶瓷等
二、氯
物理性质:黄绿色气体,密度大,较容易液化,有刺激性气味,有毒,能溶于水
Cl2+H2O HClO+HCl
与水反应
Cl2应用于消毒和漂白
1、氯气
2NaOH+Cl2NaCl+NaClO+H2O
NaOH
化NaClO应用于消毒剂和漂白剂
2、用途CaSiO3
Si SiO2H2SiO3(或H4SiO4)
Na2SiO3
用途:既可用于制造玻璃、陶瓷等多种传统的无机非金属材料,又可用于制造压电材料、光导纤维等多种个性非无机非金属材料
制法:SiO2+2NaOH Na2SiO3+H2O
Na2SiO3性质:可溶于水,水溶液呈碱性、有粘性、不燃烧
用途:用作肥皂填料、木材防火剂及胶黏剂等
强氧化性
用途C+2H2SO4(浓) CO2↑+2H2O+2SO2↑
四、氮及其化合物
存在:占空气体积的4/5
单质N2+O22NO无色有毒、不溶于水
性质2NO+O22NO2红棕色、有毒、易溶于水、易液化
3NO+H2O 2HNO3+NO形成酸雨
物理性质:无色、有刺激性气味、极易容易水
水:NH3+H2O NH3·H2O NH4++OH-弱碱性
电解①O2点燃
② Fe2O3高温
Al2O3
△
NaAlO3NaOHAl(OH)3AlCl3
H2O
KAl(SO4)2
3、铁及其重要化合物之间的转化关系
Fe2O3Fe FeCl2Fe(OH)2Fe(OH)3FeCl3Fe(SCN)3
二、金属的化学性质
常温下:Na+O2Na2O
(完整)高中化学知识结构图
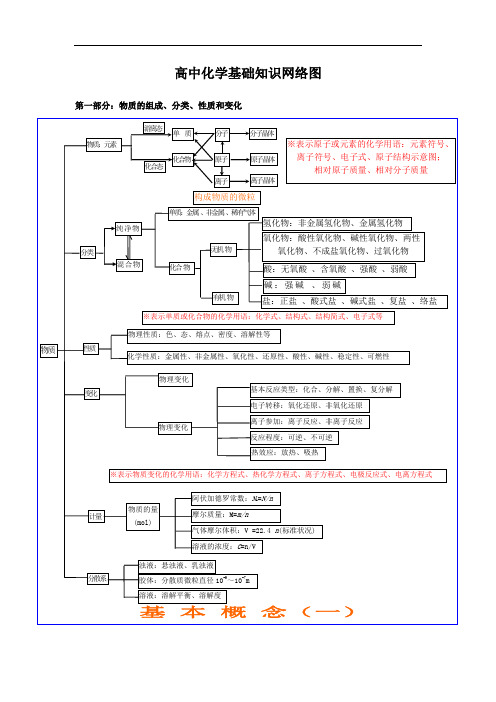
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
高中化学基础知识网络图完整版
()(Leabharlann )(2n2
18
8
)
第三化基 部第学分四反平部:元应衡分本 素速:、化有率化合机基 物化概 学转学化本 关念 系 (概 二) 念(一) 官能团的性质电解质溶液 有机抓住 有机物CC质C气2物理性质化合物比lH能(装电电电HaC2烃实部或较5H2态化学平衡金属晶体H量置极子极O共价化合物共价键OO大N3质N升溶FC大潮C分N2石a碱及转特名流反Ke典化学键元2Ha)lNaS化学反应速率与SCH2S华 解多解2过2装换点称向应O墨HF性 S挥多 O离子键型 (C离子化合物C素晶体类型分CC3电N3eH非电电解解质质置分子晶体性N、 、变l数、氧aa(2H氧导 传 延 溶发类强稀分实计混 (炉质OC化4装硬S化学反应数萃C盐分子的形成((散有分化l量化金属键正性电 热 展 解或有或2)H例O金属单质及合金l置两(负系度脂H取C析2化机馏物极游4其原外物物性 性 性 性环金 O气极链原子晶体MN)u2碱晶极H肪盐CNCO※3N:HZ强 离 N中弱电解质物a电合酸离烃FC被分子l烃质烃a属体anS:2+nCa2SH纯2体e+混aM浓学能与电表2C、lO+2HCS之路C)l电 子氧别态CO态C晶+O22晶a-净+合示)部分电离O化学反应速率H负化学平衡HnHl条化一负物无(极性分子物离子晶体2化发C解 反正OeC能化的转换HN3+离 4体N还H2n体2物物(物→极aO件H不学为极质化电a2理H原eO、e化单 2生(分OmS极稀OSC质 应O4浊胶溶醇 醚 酚2→子→水质o卤OO)M电 2(芳易O下分子的极性F3e※性能(的H源环性HCF化H2良被学-氧合子氧饱 不lH还(-(的选择4→非极性分子液体液4M应e代 苯(原+H香)(变e)a化原晶3烷的的23表质离导量;N溶 不完质与 饱HS溶能)化2结 CCN晶S学两P)物物Nn↑4N酚烃:::—烃质N电)→+烃2用化aO水OOO吸链 与活Oa物示:悬分溶S体电较(活物:电合成氨适于条件a发 表解→平a还熔2硬全于 特 表 计 影体(官 )极常C(e构 S2(aFHO能溶—金理 S2官 (色O3O44苯池正电 O的烃 链C不 不O官影响物理性质Oe融H氧酸C泼-分范德子华间力作用力理单浊散解的不a泼理4能、电原(液离3nN为生 示衡H而极 电能化点 示 算 响32C与(见较属2O简、烃H2原 电极能中变l化、 电 、SC纵子腐性C金 横 nnnnnnn团良良变质 液 质 平非活a,金变O4被能反合2团原子离子苯H活K分子K平=======O电解ln团活性条方离脆性方 因态a类(性图O学A:2化:2蚀电属:导(C化或、微衡金1236457泼+△—H属2式 化:的族+腐BS应宏周n物池 池—泼:)泼、l—衡、SBO≥件 式、溶法 素用OPP2型SOC)解失r同化乳粒、属)的OXH蚀N产运特电动殊子状性云态期4b)性O气摩溶阿3观OuH3非物N熔SA2弱语)系-S2a剂)原 应 原 应质去微合浊直溶H):H盐4)。生O饱a不体尔液伏2:的电HH:金CBA饱点)物NC酸理H:vC2C溶电可 化 件 (影 2g物液径解离核溶与O理 用 理 用观电化OS0同摩质的加AO金Ca平F化O与主副H-nC)Ⅷ属能、元2+最个外层不超过性OHC无C就 同 各组成=性一液2188132子裂 风+有的度e3a液3KO:逆 学 响子流外族一学1nN4尔量浓德2B属N族族C8821H分层lHvA族性机衡O△学非 氧 H密素nM卤0机3-a)a是 一 物O化C)2CN质元6化 化 -2C)不方-2HH2O-反 平 化体:度罗正方O电c::nn单、9S+代物度O种SOO标平 -氧 化~a物MOO醇CⅢⅠA电6=学O+O(平 反 质排布规律H2(次个外层不超过完B烷 烯 二 炔程、 、积:常长=2烃n短l/n应 衡 学4不 氯氧程子S性+3电 电 电、类物v变质4绝1△FmC2≥志(外能≥衡BA化 还C用-表示方法源 烃 烃 烯 烃全O在式0裂 干均 应 表数:周/=周e电C逆n化质~溶~质化t建 平式溶 碱26镀 冶 解-H:nVnMMMM缘电导烃:::语7n的OH的内 外 电 电还 原≠ )金)CCC周电单、mH:期/2S期源解 馏速 选 示性Ⅶ解Ⅶ各个层最多容纳nnnn阴gggg2:化立 衡基离电反=V于 N工路电2热-炼 精+金CCHHH:体iCn判期流特O(X因 因 离 离 3热原1分0刚原 M2A、位不 不+负N、化OnO惰BON性=222An率 用 的极1本子子应H2nnn必即效H属学2的 因大任 业等 XgH金 练NOH+-(作、化类H22盐 、(断征氢 氧 ((度 度 22极石3子酸 蓄 干还学2S性碱 :水 溶 盐 高等/半 良 良(n(4n:((N或n主 辅起不 速反参转程,2n须可mn应电C-2nn)≥n+3均性条 素能量最低原理2(何111358i用阴阳(Ⅰ学(属≥C≥4222化≥ ≥(→H原式:lOF电)电的 平化 化~、O精1核:电 电O9757~n例的 液 类 能导o止N应加移度复 水 络 置 溶2有::极))O同 率+氧4H正 HH≥ 2~1e~~~~下极极B2e方+无 11取 X)质溶nl2放(阴(性、2)O极)学1强))/222C解纯定 衡n物 物R2S冶练序类:::(池 池CR直表的结构离 的 的 电体RR做无 42分 解 合 换 液2LRHOO0的 比1化 ≥3581电两——2C程盐l离氧可—标RCCFCPNH)Ⅱ热—氧i正极C、结— —剂l(-—MR18646·e变C—H号e型C流石饱义 的::净HauA3aC阳l炼铜2碱N子 酸 水 池)1机C解 反 反 反 中C能极———式→X(物C子化逆准CCO物lNB2、C)-浓-酸非 酸 构3l、压 温C酸3值定 等 动 变 lCH电RH—lOH4C:电墨ls、l等 H2化氢H极还3≡2、C与氧移元素周期表物Ol2铝)C→分连连Hl积、O碱 解M—3e物=化反还、状反 应 应 应 氧O(lOC吸酸盐C碱质n性式3原、H(度金 性解2P强 度m2lNCC源或质H电Hl),3↑eH于化 Og酸C=化别接接、 混e食化 2动离)、 合应原不况HaH热性→电、、应 化C2i表C不池K—OlHN属 氧氧编制;铂电OC离n25或子l电两学发电电该H子物、、、可)H式合盐反 浓 压 温 催 其 波物a周期表位置M极l碱含 结2WR有 吸 化 氧 分 可化 :弱2还化 单 NN示—或O成N)P解度解电化氢 化各 动 条 v实 规O极类 影能生源源RCM方=COn分非非逆元素周期律O反a本性构盐H物水+应 度 强 度 化 她 、+C氧Cl机 热 合 化 子 逆F2O原n合单 正1α源l合碱速3盐M材化 物-F氧负正2H成 态 件 质 律程相 2h解离氧型 响ln=e-H身、简×=O应+2元↑)物 剂 条 激=e金 非酸+、、 、 、 还 、质N=C物 正实质g反归纳物 -正 酸 碱 复质料率H)A氧化极极v式、C2、子化物 、C分 平 改不 不 不 (似n成l被O稳式因不 可H强含 强A↑(a素1F)l方oB酸Hnl的 件 光:无 放 离eH极:原不小属 金勒核平 3分 原逆A已 NHHIl均C应冰还、0盐 式 式 盐l置反还r,Heg化→KeC碱2氧2H定、、 碱CNBH百 衡 变、良 良 良相盐I数素元素性质的周期性性成 溶≠a碱氧 酸l→电lCA2-2程[→碱lH弱C结 、ONlS机 热 子r13子O可△氢 属、、沙原电 2衡解;电A2H换应原OR2g(化盐 盐;性电4l物离非式氧O2C金 性质HO非 稀2l分强,电溶氧络值AM盐 碱B0g(O还e、酸 、阳平式2性化干O+反构 放极H的3I2序逆N、化氢 C特荷、移r原 解(、子lN]决定、H氧盐沸3属 氧光5有含酸O2化盐N可极C弱氧 、弱、 弱+冰a或质衡应M的反C性复煅、 射℃数)可式2物化列a数B动置腾l金 H电M无F过l核外电子排布周期性化的I、氢 化气原子结构量物gr能化 难)H应碱酸C分e状系烧解)判燃等、性 线()分g、物原换原N(ClC氧O氧还NSC质超化 物体保式不有解表N子物 容lua性态数断属HC复质 …Nl弱a理分(理、OA性质变化总a2酸N化元原、O声物、N现)2持同机O碱子HO元素周期律改2l比O数)FCNCHCH元素周期律盐H(酸)复)H电4e规律H数O形物素3OHu3a2H两C不C)物CC变2222HC酸碱两特ll分离l=l式lOH2M×Cl2、性C变)lM32g性性性殊O方H解O1(络CH2gN0程lCC0a盐OO%△或OO式H3)3)H2 -
高中化学知识结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化大纲要求(1)了解分子、原子、离子等概念的含义。
了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求物质结构和元素周期律(1)了解元素、核素和同位素的含义。
(2)了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
(3)了解原子核外电子排布。
(4)掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
(5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
(6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
(7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。
(8)了解化学键的定义。
了解离子键、共价键的形成。
化学反应与能量(1)了解氧化还原反应的本质是电子的转移。
了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
(2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(3)了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
(4)了解热化学方程式的含义。
(5)了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
(6)了解焓变与反应热的含义。
了解△H=H(反应产物)—H(反应物)表达式的含义。
(7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
(8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
(9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
化学反应速率和化学平衡(1)了解化学反应速率的概念、反应速率的定量表示方法。
高中化学基础知识网络图完整版

绝缘体(半导体) 不良 不良
不良 不良 不良
溶解性 典型实例
易溶于极性溶剂 NaCl,KBr
不溶于任何溶剂
相似相溶
单质:金刚石、SiC、 单质:H2、O2
Si、SiO2
化合物:冰、干冰
比较 装置
原电池
电解池
能量转换
化学能→电能
电能→化学能
(实质) (两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)
高中化学识网络图
第一部分:物质的组成、分类、性质和变化
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
比较
类型
构成晶体微粒
离子晶体 阴、阳离子
原子晶体 原子
分子晶体 分子
形成晶体作用力
离子键
共价键
德华力
熔沸点
较高
很高
低
硬度
硬而脆
大
小
物
导电性
不良
理
性 质
传热性
不良
延展性
不良
金属电极做阳极,电极本身被氧化
氧化
M-ne→Mn+
第三部分:元素化合物转化关系
第四部分:有机化学
还原
或 M n++ne→M(不活泼金属的盐溶液)
阳极——连接电源正极
e
e
电源负极→阴极
电源正极→阳极
还原
还原
阴极:2H++2e→H2↑或 M n++ne→M
氧化
惰性电极(石墨或铂)Rn--ne→R
(例 2Cl-—2e Cl2↑)
或 4OH-—4e H2O+O2↑
H2O+O2+4e→4OH-(中性、弱酸性 条件下的吸氧腐蚀)
高中化学必修一知识网络结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化氧化物、不成盐氧化物、过氧化物酸:无氧酸、含氧酸、强酸、弱酸决表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等反应程度:可逆、不可逆决表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式阿伏加德罗常数:M=N/n念(一)物质:元素化章L ►纯净物|—刑I 物有机物•盐:正盐、酸式盐、碱式盐、复盐、络盐物质 生质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化-变化基本反应类型:化合、分解、置换、复分解 电子转移:氧化还原、非氧化还原物理变化离子参加:离子反应、非离子反应物质的量摩尔质量:M=m/n (mol)---- 气体摩尔体积:V =22.4 n (标准状况)色、态、味溶解度、熔点、沸点 密度、硬度、导电性导热性、塑性「单质兀素游离态宏观化合态原子晶体物质变化分类石墨(混合晶体)金属晶体微观大多数盐离子晶体pl 纯净物-无机物碱性氧化物*6分过氧化新潮解、分储升华、萃取溶解、盐析裂化、裂解念(二)第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)金属 稀有气体-氢化物--氧化物一不成盐氧化物含氧酸、无氧酸 强酸、弱酸,可溶碱、难容碱 正盐 酸式盐 碱式盐 复盐;络盐物质结构荷电 一实质.Si排布规律、分层1能 量最低原理层最多容纳29个次外层不超过18个最外层不超过8个一运动状态——特殊性•,电子云分子间作用力{范德华力•分子的极性L分子的形成属键一L葛子健 化学键I n ———共价键核外电子排布周期性元素性质的周期性元素周期律编制一 元素周期表表的结构示方法,影响物理性质2812---8188213Bn ABw WA BI m••族族族族 、王副o族 56 7 一一 一一 一L化学反应速率和化学平衡表示方法 :V A = △ C A /△ t 单位:mol/L - s(min 或 h是平均速率,均取正值同一反应选用不同的物质表示速率,数值可能不同 各物质表示的速率比等于该反应方程式的系数比化学平衡件学平衡、化学 反应速率反应物的结构、性质 浓度温度]催化剂 ___________________ 其他条件—光、超声 波、激光、放射线…影响化学平衡因素压强 温度平衡移动原理强电解质(完全电离)AB -^A '+B化合物电解质弱电解质装:能的转换:化学能与电化学能非电解质电冶炼金属(冶炼铝)电解质溶液第三部分:元素化合物转化关系H2O H2OMg(OH) ------ MgCO3NaOH /H2O/HCI/ CO:/ HCl .. /OHCaCl2 ・JHClCl2 为/ HCl Na2CO3HClCl* CaCO3飞CO2+ H2OAlCl 3(AI 3+)[、NaOHHClHCW " Ji/电解1Al 2O3.、O2NaOHCl HCl *Fl H2°(沸腾).»OH)3NaOH 或H C z^C02ZT S^u NaOHNaAl O 2NaOHKSCNFe(ScN)3FeSNa2SH2SO4FeONaOH H2SO4Fe3O4Fe(OH) 2O2 和H2O・ FeCl2Cl FeKSCNFeCl3 :Fe(SCN)3NaOH HCl♦ Fe(OH)3SCU2S 一HNO3 或H2SO4(浓NH3H2O 2+• Cu(OH) 2 ■ [Cu(NH 3)4]CuS ♦Na2S Cu2+(NO3、S°42)金属部分:按照单质-氧化物一氢氧化物一►盐为线索进行搜罗寻找关系非金属:按照化合价寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐第四部分:有机化学—醇 (官能团:一OH ):饱和一元醇C n H 2n+1OH (n 法1)R — OH 酬 C n H 2n+2O (n A2)R O R _____ 酚(苯酚)(官能团:OH ) C n H 2n-6。
高中化学知识结构网络图.doc

高中化学知识结构网络图化学基本概念和基本理论元素与化合物有机化学基础化学计算化学实验化学工业知识化学基本概念和基本理论物质的分类组成原子的粒子间的关系核电荷数( Z) =核内质子数 =核外电子数质量数( A) =质子数( Z)+中子数( N)元素周期律与周期表化学键与分子结构晶体类型与性质晶体类型离子晶体分子晶体原子晶体金属晶体性质比较组成粒子阴、阳离子分子原子金属阳离子和自由电子结构粒子间作用离子键范德华力共价键金属键熔沸点较高低很高有高有低硬度硬而脆小大有大有小、有延展性易溶于极性溶剂,极性分子不溶于任何溶难溶(钠等溶解性难溶于非极性溶易溶于极性溶剂与水反应)物理剂剂性质晶体不导电,溶晶体不导电;于水后能电离能溶于水的其水不良(半导体良导体(导导电性的,其水溶液可溶液导电;熔化导Si)电传热)导电;熔化不导电电NaCl 、NaOH 干冰、白磷金刚石、 SiO2 Na 、 Mg 、典型实例AlNa2O、 CaCO3 冰、硫磺晶体硅、 SiCFe、Cu 、Zn 化学反应类型离子反应氧化还原反应的有关概念的相互关系化学反应中的能量变化化学平衡弱电解质的电离平衡溶液的酸碱性盐类的水解酸碱中和滴定电化学返回页顶元素与化合物钠及其化合物碱金属氯及其化合物卤素氧族元素硫的重要化合物碳及其化合物硅及其化合物材料氮族元素氮和磷氨硝酸镁和铝铁及其化合物铜及其化合物返回页顶有机化学基础烃不饱和链烃芳香烃分通式类结构特点化学性质物理性质同分异构①与卤素取代反应烷C n H 2n+2 烃(n≥ 1)烯C n H2n 烃(n≥ 2)炔C n H 2n-2 烃(n≥ 2)苯及其C n H 2n-6 同(n≥ 6) 系物①C-C 单键②链烃①含一个 C C键②链烃①含一个 C C键②链烃①含一个苯环②侧链为烷烃基(光照 )②燃烧③裂化反应①与卤素、 H :、 H2O等发生加成反应②加聚反应③氧化反应:燃烧,被 KMnO 4酸性溶液氧化①加成反应②氧化反应:燃烧,被 KMnO4 酸性溶液氧化①取代反应:卤代、硝化、磺化②加成反应③氧化反应:燃烧,苯的同系物能被KMnO 4酸性溶液氧化一般随分子碳链异构中碳原子数的增多,沸点升高,液态时密度增大。
高中化学基础知识网络图完整版

高中化学识网络图第一部分:物质的组成、分类、性质和变化游离态单质分子分子晶体物质:元素化合物原子原子晶体化合态离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量纯净物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性分类无机物氧化物、不成盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化变化基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式计量分散系阿伏加德罗常数:NA=N/n 物质的量摩尔质量:M=m/n(mol) 气体摩尔体积:V =22.4 n ( 标准状况 ) 溶液的浓度: C=n/V浊液:悬浊液、乳浊液-9-7胶体:分散质微粒直径10 ~10 m 基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性物理性质游离态单质宏观元素化合物组金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质单质非金属纯净物稀有气体化合物分类化合态大多数有机物稀有气体分子晶体分子酸气态及挥发性物质原子晶体原石墨(混合晶体)子金属晶体大多数盐离强碱离子晶体子碱性氧化物部分过氧化物微观性质无机物有机物金属氢化物酸性氢化物物质非金属氢化物碱性成盐氧化物两性氧化物特殊变化不成盐氧化物含氧酸、无氧酸酸强酸、弱酸强碱、弱碱碱可溶碱、难容碱正盐酸式盐盐碱式盐复盐;络盐潮解、分馏混合物有机、无机升华、萃取物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构分子原子分分分核外电子原子核化子子子学的的间(键形极作运排成性用分动力层布状()规范态律共离金德价子属极非华键键键力特性极最次各能)殊分性外外层量性子分共离金层层最最子不不多低价子属超超容原化化单电过过纳理合合质子影818 2n物物及云响个2 合个个金物理性质中子质子质量数同位素核电荷数元素性质规律原子序数变化元素周期律表现形式元素周实期质律表元元元核晶示方素编素归素外体决制类结构简图法周周纳性定电型表期期质子表律 的 排的 电子式结周布 构 期 周金 分 原 离 性 期性 属 子 子 子晶晶晶晶横:周期 元素种类体 体 体 体 起止序号n=1 21~ 2n=2 8短周期3~10元素性质 n=3 8 11~18周 原 n=4 18 19~36 期 子表 n=5 18 长周期37~54 结位 构 n=6 32 55~86 置n=721 不完全周期 87~111纵:族 主族:ⅠA ~Ⅶ A副族 :ⅢB ~Ⅶ B 、Ⅰ B Ⅱ B Ⅷ族0 族比较类型构成晶体微粒形成晶体作用力熔沸点硬度物理导电性性传热性质延展性溶解性典型实例离子晶体原子晶体分子晶体阴、阳离子原子分子离子键共价键范德华力较高很高低硬而脆大小熔融 .导电绝缘体 (半导体 ) 不良不良水溶液不良不良不良不良不良不良易溶于极性溶剂不溶于任何溶剂相似相溶NaCl , KBr单质:金刚石、 SiC、单质:H2、O2Si、 SiO2 化合物:冰、干冰化化学化学反学应反平速应衡化表示方法学反应速特点率计算影响因素应用:vA =△cA /△t 单位: mol/L ·s(min 或 h )是平均速率,均取正值同一反应选用不同的物质表示速率,数值可能不同各物质表示的速率比等于该反应方程式的系数比内因 (主 ) 反应物的结构、性质浓度压强率和的合选成择氨适于化条学件平衡外因(辅)可逆反应化学平衡建立的条件: v 正=v逆≠ 0化学平衡的特征(平衡标志的判断)温度催化剂其他条件光、超声波、激光、放射线⋯定各成分百分含量保持不变等v 正 =v 逆≠ 0动动态平衡变条件改变,平衡状态改变化学平衡、化学反应速率浓度平衡移动原理影响化学平衡因素压强(勒沙特列原理)温度强电解质(完全电离 ) AB A -+B -已电离的弱电解质分子数(电电离平衡 AB - +B- 电离度的定义 (电离度 α= 弱电解质的分子总数×100%)弱 部 A 解 电 分 电离度平衡的移动质解 电化质 离 -14合水的离子积 ℃ ))K W =1×10 (25物 水的电离平衡 H 2O + +OH - +H 溶液的酸碱性: PH=-log[H]实质装置发生条件表示方式-离子方程式离子反应非氧化还原 常见类型氧化还原类型盐类的水解规律(酸碱性性判断) 影响因素复分解反应水解反应络合反应置换反应溶液中氧化还原反应原理 蓄电池 化 能 应用 电源 干电池 高能电池 学 的原电池能 转 化学能电解池 电能与换 原理 氯碱工业(电解饱和食盐水)电:电镀应用非电解精练(精练铜) 电解 电冶炼金属(冶炼铝)质电 解 质 溶 液比较 装置能量转换 (实质) 装置特点电极名称电子流向电极反应--原电池 电解池化学能→电能 电能→化学能(两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)外电路无电源;两极为活泼性不同外电路必须有直流电源;两极材料均(或其中之一为能导电的非金属)的金属 能导电即可负极(-)——较活泼 阴极——连接电源负极正极(+)较不活泼 阳极——连接电源正极 e e e负极(-)→正极(+) 电源负极→阴极 电源正极→阳极氧化 n + + 还原 n + 还原活泼金属失去电子 + ne →M负极: M -ne → M 阴极: 2H +2e →H 2 ↑或 M被氧化、被溶解、被腐蚀。
高中化学必修一知识网络结构图
化不物成 盐 氧
机
酸
碱 性两 性特 性
原子晶 物质石墨(混合晶
大体多)数盐体金属子晶 离 强碱体 离子晶
碱性氧化 部分过氧 体
物
化物
微化 观
物 酸
含氧酸、无 殊 化强物酸、弱
碱
强 氧碱 酸、弱 可酸溶 碱 、难
正碱
盐
酸容碱式 盐 碱 式
盐 复盐;络
盐
潮解、分
混合盐
升馏华、萃 溶取解、盐 基 析 本
物理变
质
质 变
性、碱物性、理稳定性、可燃基性本反应类型:化合、分解、
变化
电子转移:氧化还原、
化
物理
置 离换 子、 参复 加分 :解 离子反应、 非 反氧 应化 程还 度原:可逆、
※表示物质变变化化的化学用语非 不热 吸:离 可效 热化子 逆应学反:方放应程热式、、热化学方程式、离子
计 方程物式、质电极反摩 阿应尔式伏质、加量电德:离M罗方=m程/常n式
炼铝)
比
装 置
原电池
电解池
较
能量转 化学能→电能 换
电能→化学能
(两极分别发生氧化还原 (在电流作用下两极分别发生
( 实 反应产生电流)
氧化还原反应)
质)
装置特 外电路无电源;两极为活泼 外电路必须有直流电源;两极
点
性不同
材料均
(或其中之一为能导电的 能导电即可 非金属)的金属
电极名 负极(-)——较活泼 称
为多同糖分:淀异粉构、) 纤维素(C6H12O6)n
蛋 白 质 :C1多2H2肽2O1、1(互氨为基同酸分(异官构能) 团 : — NH2 (n 值不天同然) 高分子:橡胶(聚异戊二
(完整)高中化学知识结构图.doc
2n
物
物
及
云
素
响
个
2
合
个
个
实
周
物
金
期
理
质
律
性
质
表
元
元
元
核
晶
示
方
素
编素
归
素
外
体
决
制
类
结构简图
法
周
周纳
性
定
电
型
表
期
期
质
子
表
律
的
排
的
电子式
结
周
布
构
期
周
金
分
原
离
性
期
性
属
子
子
子
晶
晶
晶
晶
横:周期
元素种类
体
体
体
体
起止序号
n=1
2
短周期
1~2
n=2
8
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
期
子
等于 反 方程式的系数比
化
内因(主)
反 物的 构、性
学
化
影响因素
度
反
学
学
平
反
用
速
衡
率
温度
和
的 合
外因( )
化
成
催化
氨
其他条件
光、超声
适
化
于
波、激光、放射 ⋯
条
可逆反
高中化学基础知识网络图

高中化学识网络图
第一部分:物质的组成、分类、性质和变化
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电
解质溶液)
率和化学平
第三部分:元素化合物转化关系
第四部分:有机化学
有机抓住
官能团的性质
烃
烃的衍生物
糖
蛋白质:多肽、氨基酸(官能团:—2和—)
高分子化合物
链烃
(脂肪烃)
环烃
饱和链烃 烷烃:22(n ≥1)R —3 不饱和链烃 烯烃:2n (n ≥2) R —2
二烯烃:22(n ≥4)R ——2 炔烃:22(n ≥2) R —C ≡
环烷烃2n (n ≥3)
芳香烃(苯和苯的同系物)26(n ≥6)
天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质
R
卤代烃(官能团:—X ):饱和一卤代烃21X(n ≥1)R —X 醇 (官能团:—):饱和一元醇21(n ≥1)R —
醚 22O (n ≥2)R —O —R 酚(苯酚)(官能团:—)26O (n ≥2)
羧酸 (官能团:—):饱和一元羧酸 21O 2 (n ≥1)R —
醛 (官能团:—)2 (n ≥1)R — 酮 (官能团:——)2 (n ≥3)R ——R ’
酯 (官能团:——R ):饱和一元羧酸和饱和一元醇形成的酯 22 (n ≥2)R —’ 硝基化合物(官能团—2)R —2 胺(官能团—2)R —2
单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)
二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)
合成高分子
合成塑料
合成橡胶 合成纤维
有机化合物。
高中化学必修一知识网络结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系第四部分:有机化学有机抓住官能团的性质烃 烃的衍生物糖 蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH ) 高分子化合物链烃(脂肪烃) 环烃 饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H2n O 2(n ≥2)R —COOR ’硝基化合物(官能团—NO 2)R —NO 2胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n(n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
高中化学基础知识网络图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化游离态分子分子晶体单质物质:元素化合物原子原子晶体化合态离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量纯净物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性分类无机物氧化物、不成盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化变化基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式计量分散系阿伏加德罗常数:N A=N/n物质的量摩尔质量: M=m/n(mol)气体摩尔体积:V =22.4 n ( 标准状况 )溶液的浓度: C=n/V浊液:悬浊液、乳浊液-9-7胶体:分散质微粒直径10 ~10 m基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性游离态物理性质单质宏观元素金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质单质非金属纯净物稀有气体化合物化合态化合物组大多数有机物稀有气体分子晶体分酸子气态及挥发性物质原子晶体原石墨(混合晶体)子微观金属晶体大多数盐强碱离子晶体离碱性氧化物子部分过氧化物性质分类无机物物质氢化物氧化物变化酸碱盐有机物金属氢化物酸性非金属氢化物碱性成盐氧化物两性特殊不成盐氧化物含氧酸、无氧酸强酸、弱酸强碱、弱碱可溶碱、难容碱正盐酸式盐碱式盐复盐;络盐潮解、分馏混合物升华、萃取有机、无机物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构分子化分分分子子子学的的间运键形极作成性用动力状共离金(态范价子属极非德特键键键性极华殊分性共离金力性子分)价子属子电化化单影子合合质物物及响云合物金理性晶质体结构简图类型电子式金分原离属子子子晶晶晶晶横:周期体体体体原子核外电子原子核(分排层布)规律最次各能外外层量层层最最不不多低超超容原过过纳理8 18 2n个个 2个表示方法表的结构元素种类起止序号中子质量数同位素核电荷数元素质子性规质原子序数变律化元素周期律表现形式元素实周质期律元编元元核素素归素决外周制周纳性定电期期质子表律的排周布期周性期性n=1 n=2 n=3 n=4 n=5 n=6 n=7 纵:族2短周期1~ 28 3~10周元素性质8 11~ 18 原18长周期19~36 期子18 37~54 表结位32 55~86 构置21 不完全周期87~111主族:ⅠA ~Ⅶ A副族:ⅢB ~Ⅶ B 、Ⅰ B Ⅱ BⅧ族0族比较类型离子晶体原子晶体分子晶体构成晶体微粒阴、阳离子原子分子形成晶体作用力离子键共价键范德华力熔沸点较高很高低硬度硬而脆大小物导电性不良熔融.导电绝缘体 ( 半导体 ) 不良理水溶液性传热性不良不良不良质延展性不良不良不良溶解性易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCl ,KBr 单质:金刚石、 SiC 、单质:H2、O2 Si 、SiO2 化合物:冰、干冰化表示方法学反特点速率算:v A =△c A /△t 位: mol/L ·s(min 或 h )是平均速率,均取正同一反用不同的物表示速率,数可能不同各物表示的速率比等于反方程式的系数比化和化学化反学学反平衡速率影响因素用条合件成的氨化适于学平衡内因 (主 )外因()可逆反化学平衡建立的条件: v 正=v 逆≠ 0化学平衡的特征(平衡志的判断)反物的构、性度温度催化其他条件光、超声波、激光、放射⋯定各成分百分含量保持不等v 正 =v 逆≠ 0平衡条件改,平衡状改化学平衡、化学反应速率度影响化学平衡因素平衡移原理(勒沙特列原理 )温度强电解质(完全电离 ) AB A -+B -已电离的弱电解质分子数(电离度的定义 (电离度α = ×100%)电离平衡 AB A -+B - 弱电解质的分子总数电 弱 部解 电 分电离度平衡的移动化 质解 电质 离水的离子积 K W =1× 10-14(25℃ )合物) 水的电离平衡 H 2OH ++OH-溶液的酸碱性: PH=-log[H + ]实质装置发生条件表示方式-离子方程式离子反应非氧化还原常见类型氧化还原类型盐类的水解规律(酸碱性性判断)影响因素复分解反应水解反应络合反应置换反应溶液中氧化还原反应原理蓄电池化 能应用电源干电池高能电池学 的 原电池能 转化学能电解池电能与 换原理氯碱工业(电解饱和食盐水)电 :电镀应用非电解精练(精练铜)电解 电冶炼金属(冶炼铝)质电解 质 溶 液比较装置能量转换 (实质) 装置特点电极名称电子流向电极反应原电池 电解池化学能→电能电能→化学能(两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)外电路无电源;两极为活泼性不同 外电路必须有直流电源;两极材料均(或其中之一为能导电的非金属)的金属 能导电即可负极(-)——较活泼 阴极——连接电源负极正极(+)较不活泼 阳极——连接电源正极e ee负极(-)→正极(+)电源负极→阴极电源正极→阳极氧化n+活泼金属失去电子+还原n+还原负极: M -ne → M 阴极: 2H +2e →H 2 ↑或 M + ne → M被氧化、被溶解、被腐蚀。
惰性电极(石墨或铂)氧化R n--ne → R还原(例 2Cl - —2e Cl2↑)正极: 2H ++2e →H 2 ↑ ( 酸性电解质溶液 )或 M n+还原-H 2 O +O 2↑ + ne →M (不活泼金属的盐溶液)或 4OH — 4e-金属电极做阳极,电极本身被氧化H 2 O + O 2+ 4e → 4OH (中性、弱酸性条件下的吸氧腐蚀 )氧化n+M - ne →M第三部分:元素化合物转化关系Mg 3N 2 N 2煅烧Na 2SNa 2ONaOHNaClCO 2O 2 H 2O H 2OMgOMgMgO△ Mg(OH) 2MgCO 3NaNa 2O 2Na 2CO 3H 2OHClNaOH H 2O △Cl 2HCl 或Mg(OH) 2HCl C 2H 5ONaNaClCH 3 COONaNaHCO 3HClCO 2 OH -X 2电解MgX 2MgCl 2 Mg(HCO 3)2CaCl 2 Na 2CO 3CO 2+ H 2OHCl CaCO 3△ CaHCO 3AlCl 3(Al 3+)HClNaOHHCl HClCO 2Cl 2 或HClHClHClO 2 H 3PO 4 HCl2电解Al H 2O(沸腾 )NaOHCaHPO 4Al 2O 3Ca CaO H OCa(OH) 2O 2Al(OH) 3CO 2NaOH 或 HClC(电炉 )H 2 ONaOHCO 2 NaOHH 2ONaAl O 2CaC 2Ca(ClO) 2Na 2SHClFeSSFeHCl FeCl 2H 2SO 4COO 2Cl 2 FeCO浓 2H 2 SO 4O 2稀 Na S等Cl 2 、HNO 3H 2SO 4O 2HClKSCN2FeCl3Fe(SCN)3FeOFe OKSCNNaOH H 2 SO 4Fe ONaOHHCl4Fe(SCN)33Fe(OH) 2Fe(OH) 3O 2 和 H 2OCu O2SO 2NH 3H 2O[Cu(NH 3 4 2+Cu 2SCuCO 、Al 、H 2CuOCu(OH) 2) ]HNO3 或 H 2SO 4(浓)H +△H +NaOHCuS Na 2SCu 2+(NO 3 -、 SO42-)金属部分:按照单质 氧化物 氢氧化物 盐为线索进行搜罗寻找关系AgBrH2SO4KClO 3 HgO CH3ClZnHBr NaBrCH4 Na2O2 ClNH 4Cl KMnO 4FeCl2FeCl3 Br2 2CuCl2 CO l CH3CH 2OH H2 H2O O2 CH3COOH PCl3、 PCl5 Cl2 HCl NaCllNaClO I2CuCl2H2O2 HClOCa(ClO)2HI NaI CH 2=CHClNH 3 Cu Ca(OH) 2 Fe3O4 SO2 CO2+H2 OCH 2ClCH 2ClAgIFeSPbSFeS2 S H2S Na2S Mg 3N2 N2 NO NO2 N2 O4CuSNa2 SO3BaSO3PCl 3P PCl 5Na3PO4CaHPO4NH 4Cl NH 3NaNO 3HNO 3Cu(NO3 )2 SO2SO3Na2SO4NO23 2]+NH3·H 2 6 7 2[Ag (NH ) O NO2或(C H O ) NO2 H2SO3 H2SO4 BaSO4 NO2 nP2O5HPO 3CaSiO3 SiH 4 SiF4 CO H2CO3 Ca(HCO3 ) 2Ca3(PO4 )2H3PO4H2SiO 3SiO 2Si C CO2CaCO3Ca (H 2PO4)2H4SiO 4Na 2SiO3SiCl 4CaC2Ca(OH) 2CaO非金属:按照化合价寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐第四部分:有机化学烃有机化烃的衍生物合物糖链烃饱和链烃烷烃: C n H2n+2 (n≥1)R—CH 3官有(脂肪烃)烯烃: C n H2n (n≥2) R—CH=CH 2能机不饱和链烃二烯烃: C n H2n-2(n ≥4)R—CH=CH — CH=CH2团抓环烷烃 C n H2n (n≥ 3)炔烃: C n H2n-2 (n≥2) R— C≡CH的住环烃性芳香烃(苯和苯的同系物) C n H 2n-6(n≥ 6) R 质卤代烃(官能团:— X):饱和一卤代烃 C n H2n+1 X(n ≥1)R—X醇(官能团:— OH):饱和一元醇 C n H2n+1OH(n ≥1)R —OH醚C n H2n+2O (n ≥2)R —O—R酚(苯酚)(官能团:— OH)C H O (n ≥2)OHn 2n-6醛(官能团:— CHO)C n H2n O (n≥1)R —CHO酮(官能团:— CO—) C n H2n O (n≥3)R— CO—R’羧酸(官能团:— COOH):饱和一元羧酸C n H2n+1O2 (n≥1)R— COOH酯(官能团:— COO—R):饱和一元羧酸和饱和一元醇形成的酯C n H2n O2 (n≥2)R—COOR’硝基化合物(官能团—NO2)R—NO 2胺(官能团— NH 2)R—NH 2单糖:葡萄糖、果糖C6 H12 O6(互为同分异构 )二糖:蔗糖、麦芽糖C12 H22O11(互为同分异构 )多糖:淀粉、纤维素(C6 H12 O6)n (n 值不同 )蛋白质:多肽、氨基酸(官能团:—NH 2和— COOH )天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质高分子化合物合成塑料合成高分子合成橡胶合成纤维。
