双氯芬酸钠肠溶片含量测定(UVis)
双氯芬酸钠肠溶片溶出度不合格的原因

双氯芬酸钠肠溶片溶出度不合格的原因双氯芬酸钠肠溶片是一种常用的非甾体抗炎药,主要用于缓解炎症和镇痛。
然而,有时候在质量控制过程中会发现双氯芬酸钠肠溶片的溶出度不合格。
下面将探讨导致双氯芬酸钠肠溶片溶出度不合格的原因。
可能是由于制药过程中出现了质量问题。
制药过程中的每个环节都可能会影响药物的溶出度,包括原料选择、配方设计、制备工艺和包装等。
如果在这些环节中出现了问题,例如原料品质不合格、配方比例错误、工艺参数不恰当或包装密封性差等,都可能导致双氯芬酸钠肠溶片的溶出度不合格。
药品储存和运输过程中的不当处理也可能导致溶出度不合格。
药品在储存和运输过程中必须保持适宜的温度和湿度条件,以确保其质量和稳定性。
如果药品在储存和运输过程中暴露在过高或过低的温度、湿度或光照条件下,可能会导致药物分解或降解,从而影响其溶出度。
药品的质量控制过程也可能存在问题。
质量控制是确保药品质量稳定性和一致性的重要环节。
但如果质量控制过程中的方法不准确、设备不合适、操作不规范或样品处理不当,都可能导致测试结果偏差,从而误判双氯芬酸钠肠溶片的溶出度。
患者使用药品的不当也可能导致药物的溶出度不合格。
患者在使用药品时必须按照医生的建议正确使用,包括服用时间、剂量和使用方法等。
如果患者不按照规定使用药物,例如忘记服药、剂量错误或不合理的饮食习惯等,都可能影响药物的吸收和溶出度。
药物的生物利用度也可能导致溶出度不合格。
生物利用度是指药物在体内被吸收和利用的程度,受多种因素影响,包括药物的溶解性、吸收速率和代谢过程等。
如果药物的生物利用度较低,即使药物的溶出度合格,也可能无法达到预期的治疗效果。
导致双氯芬酸钠肠溶片溶出度不合格的原因可能包括制药过程问题、储存和运输问题、质量控制问题、患者使用问题以及生物利用度问题等。
为了确保药物的质量和疗效,制药企业和医疗机构应加强质量控制,确保药物的制备、储存、运输和使用过程符合规范要求,并加强与患者的沟通和教育,以提高患者对药物正确使用的意识和能力。
HPLC法测定双氯芬酸钠肠溶片的含量

[] 9 吴鑫, 杨柳烨 , 曾果 .高效液相色谱法测定甘薯 中 p 一胡萝 索 .
中 国卫 生检 验 杂 志 ,0 6 1 () 1 5 ~ 15 . 2 0 ,6 9 :0 6 0 8
HP C法测 定 双 氯 芬 酸钠 肠 溶 片 的含 量 L
徐 迪
( 苏省 南通 药 品检 验 所 , 苏 南通 2 6 0 ) 江 江 2 0 6
.
・ 29 ・ 7
[] 7 胡朝 辉 , 志礼 .极 大 螺 旋 藻 中 8 胡 萝 素 的分 离 纯 化 及 定 量 刘 一
测定 .色 谱 ,0 11 ( ) 8 ~ 8 . 2 0 ,9 1 :5 7
[] 绍 荣 , 阳华 学 .反 相 高 效 液 相 色 谱 法 测 定 芦 荟 中 p 胡 萝 8雷 欧 一
n c S d u En e i- o t d Ta lt a o i m t rc c a e b e s KEY WORDS: LC; co e a d u En e i— o t d Ta lt ; e e mi a in HP Dil fn c S im t rc c a e b e s d t r n t o o
钠 肠 溶 片 中双 氯 芬 酸钠 的含 量 。
关 键 词 : 效 液 相 色谱 高
双 氯 芬 酸 钠 肠 溶 片 含 量 测 定
中图 分 类 号 : 9 7 2 文 献 标 识 码 : 文 章 编 号 :6 2 7 8 2 0 )5 2 9 2 R2 . A 1 7 —73 (0 8 0 —0 7 —0
t rcc a e be s M E e i- o t d Ta l t. THODS Usn a n i ODS ( 5 i g Dimo s1 1 0× 4 6 . mm , F 5 m) a o l sc u mn, h s h t u f r d s l t n p p o p a e b fe e o u i ( H2 5 o .) 一 me h n 1( 5:7 )a b l h s , n h o r t s 1 0 tao 2 5 smo i p a e a d t ef w a e wa . mL ・mi ~ , e e t n wa ee g h wa 8 n e l n d t c i v ln t s2 4 m. S o RE ULT Th S e 1 e r r n e wa 1 0 i a a g S . 4~ 2 . mg ・ L- f r d c o e a o i m (r 一 0 9 9 , n 08 1 o il f n c s d u . 9 9
双氯芬酸钠质量标准

双氯芬酸钠质量标准双氯芬酸钠是一种常用的非甾体类抗炎药,广泛应用于临床治疗疼痛和发热等症状。
为了确保双氯芬酸钠的质量安全和有效性,制定了一系列的质量标准,以保证药品的质量稳定和治疗效果。
本文将详细介绍双氯芬酸钠的质量标准内容,以便相关生产企业和医药从业者参考。
一、外观。
双氯芬酸钠的外观应为白色结晶性粉末,无异物和杂质,无明显气味。
在质量标准中,对外观的要求是非常严格的,因为外观是最直观的质量指标之一,也是最容易被消费者所观察到的。
因此,生产企业在生产过程中要严格控制原材料的质量,确保产品外观符合标准要求。
二、含量测定。
双氯芬酸钠的含量测定是非常重要的一项质量指标,直接关系到药品的药效和治疗效果。
含量测定的方法一般采用高效液相色谱法(HPLC)或者紫外分光光度法等,以确保双氯芬酸钠的含量在合格范围内。
生产企业在进行含量测定时,需要严格按照药典规定的方法和条件进行操作,确保测定结果的准确性和可靠性。
三、溶解度。
双氯芬酸钠的溶解度是指在一定温度下,单位体积溶剂中最多可溶解的双氯芬酸钠的质量。
溶解度的合格范围对于双氯芬酸钠的药效和治疗效果有着重要的影响。
因此,质量标准中对双氯芬酸钠的溶解度也有着明确的规定,生产企业需要根据标准要求进行检测,并确保产品的溶解度符合规定。
四、水分。
水分是影响双氯芬酸钠稳定性的重要因素之一,过高或者过低的水分含量都会对产品的质量产生不良影响。
因此,质量标准中对双氯芬酸钠的水分含量也有着严格的规定,生产企业需要通过严格的水分检测方法和设备,确保产品的水分含量符合标准要求。
五、杂质。
双氯芬酸钠的质量标准中对杂质的规定也是非常严格的,主要包括有机杂质、无机杂质和重金属等。
这些杂质对双氯芬酸钠的安全性和稳定性都有着重要的影响,因此生产企业需要建立完善的杂质检测方法和体系,确保产品中各项杂质的含量均符合标准要求。
六、微生物限度。
双氯芬酸钠作为一种口服药品,微生物限度的合格范围对于产品的安全性和稳定性至关重要。
双氯芬酸钠肠溶缓释胶囊 质量标准

双氯芬酸钠肠溶缓释胶囊质量标准在药品生产和监管领域,质量标准是确保药品质量和安全性的重要依据。
双氯芬酸钠肠溶缓释胶囊作为一种常用的非甾体抗炎药,其质量标准尤为重要。
本文将从深度和广度两个方面对双氯芬酸钠肠溶缓释胶囊的质量标准进行全面评估,并据此撰写一篇有价值的文章。
1. 质量标准的意义药品质量标准是指根据药物的独特属性、药效学及制备工艺等因素确定的指标、参考物质、测定方法及其容许的误差范围。
它不仅是保证药品质量的基本依据,也是判定药品是否合格的依据。
双氯芬酸钠肠溶缓释胶囊作为一种口服制剂,其质量标准直接关系到药效的稳定性和使用安全性。
2. 双氯芬酸钠肠溶缓释胶囊的质量标准内容双氯芬酸钠肠溶缓释胶囊的质量标准主要包括理化性质、药效学、微生物限度、重金属含量、杂质及掺杂物等方面。
在制定质量标准时,需要考虑药品的特性、稳定性以及药效目标,以保证药品的安全有效性。
3. 药效学指标双氯芬酸钠肠溶缓释胶囊的药效学指标是制定质量标准的重点之一。
药效学指标包括释放特性、溶出度、溶解度、稳定性等方面,这些指标直接关系到药品的治疗效果和药效持续时间。
4. 理化性质双氯芬酸钠肠溶缓释胶囊的理化性质是另一个重要的质量标准内容。
理化性质包括外观特征、溶解性、PH值、含量测定、纯度鉴别等方面,这些指标可以反映药品的物理状态、稳定性和质量一致性。
5. 微生物限度和重金属含量除了药效学和理化性质外,双氯芬酸钠肠溶缓释胶囊的质量标准还应包括微生物限度和重金属含量等指标。
微生物限度是评价制剂是否受细菌等微生物污染的重要依据,而重金属含量则是评价制剂是否受重金属污染的重要指标。
6. 杂质及掺杂物质量标准中还需要考虑到杂质及掺杂物的限度。
杂质及掺杂物的存在会影响药品的纯度和安全性,因此对其限度的要求也是非常严格的。
总结与展望通过对双氯芬酸钠肠溶缓释胶囊的质量标准进行全面评估,我们可以看到,质量标准内容涵盖了药效学、理化性质、微生物限度、重金属含量、杂质及掺杂物等多个方面。
【推荐下载】HPLC法测定双氯芬酸钠肠溶片的含量及含量均匀度探讨

HPLC法测定双氯芬酸钠肠溶片的含量及含量均匀度探讨 2012-12-20 【编者按】:医药论文是科技论文的一种是用来进行医药科学研究和描述研究成果的论说性文章。
论文网为您提供医药论文范文参考,以及论文写作指导和格式排版要求,解决您在论文写作中的难题。
HPLC法测定双氯芬酸钠肠溶片的含量及含量均匀度探讨 【摘要】目的:建立了高效液相色谱法测定双氯芬酸钠肠溶片中双氯芬酸钠的含量及含量均匀度的方法。
方法:色谱柱为KromasilC18(250mm 4.6mm,5 m),流动相为甲醇?水(75:25),用磷酸调节pH至3.50 0.05,检测波长为284nm,流速为1ml﹒min-1。
该方法对双氯芬酸钠的平均回收率为99.40%,RSD为1.24%(n=5)。
该法与与标准法比较,没有显著性差别。
结果:方法简便,结果准确,专属性强。
结论:可用于含量及含量均匀度的测定。
【关键词】HPLC法; 双氯芬酸钠肠溶片; 双氯芬酸钠 双氯芬酸钠肠溶片为解热镇痛及非甾体抗炎镇痛药,用于缓解各种关节炎的关节肿痛症状,治疗非关节性的各种软组织风湿性疼痛,急性的轻、中度疼痛,对成人和儿童的发热有解热作用。
国家药品标准[1]采用对照品比较法测定含量,且现行标准对其含量均匀度没有收载。
本研究采用HPLC法,对双氯芬酸钠肠溶片中双氯芬酸钠进行含量和含量均匀度的测定。
实验结果表明,本法简便、快速、专属性强,可用于含量及含量均匀度的测定。
1 仪器与试药 LC?10ATvp型高效液相色谱仪(日本岛津),SPD?10Avp型紫外检测器,N2000型色谱数据工作站,普利赛斯电子分析天平。
双氯芬酸钠对照品(批号:100334?200302,中国药品生物制品检定所),双氯芬酸钠肠溶片(辽源市迪康药业有限责任公司、新乡同心药业有限公司),甲醇为色谱纯,水为重蒸馏水。
2 方法与结果 2.1 色谱条件 色谱柱:KromasilC18(250mm 4.6mm,5 流动相:甲醇?水(75:25),用磷酸调节pH 至3.50 0.05;检测波长:284nm;流速:1ml﹒min-1;柱温:室温。
双氯芬酸钠肠溶片中间产品检验操作规程

目的:为检验双氯芬酸钠肠溶片中间产品规定一个标准的程序,以便获得准确的实验数据。
范围:适用于双氯芬酸钠肠溶片中间产品的检验。
职责:检验员、检验室主任对本规程实施负责。
规程:1 性状:本品除去肠溶衣后显白色或类白色。
2 鉴别:2.1 试剂与仪器2.1.1 盐酸 2.1.2 硫酸2.1.3 醋酸氧铀锌试液 2.1.4 量筒2.1.5 烧杯 2.1.6 漏斗2.1.7 移液管 2.1.8 容量瓶2.1.9 坩埚 2.1.10 铂丝2.1.11 干燥器 2.1.13 电子天平(万分之一克)2.1.14 小型三用水箱 2.1.15 紫外分光光度计2.1.16 IR-470型红外分光光度计 2.1.17 茂福式电阻炉项目与步骤2.2.1 取本品除去肠溶衣后置研钵中,研细,称取约相当于双氯芬酸钠0.5g,乙醇20ml搅拌使溶解,滤过,滤液置水浴上蒸干,残渣:a. 紫外分光光度法的鉴别: 加水制成每1ml中含有20ug的溶液,按分光光度法(SOP-QC-301-00) ,在240~340nm的波长范围处测定吸收度,在276nm的波长处有最大的吸收为符合规定。
b. 红外吸收光谱的鉴别:取残渣约1.5mg,按红外分光光度法 (SOP-QC-302-00)压片法检测,本品的红外吸收图谱应与对照的图谱一致,为符合规定。
C. 钠盐的鉴别:按炽灼残渣检查法 (SOP-QC-327-00) 炽灼后:①取铂丝,用盐酸湿润后,蘸取供试品,在火焰中燃烧,火焰即显鲜黄色为符合规定;②取残渣的中性溶液,加醋酸氧铀锌试液,即生成黄色沉淀为符合规定。
3 检查3.1 试剂与仪器:3.1.1 电子天平(万分之一克) 3.1.2 片剂崩解仪3.1.3 微孔滤膜,过滤器 3.1.4 0.8um微孔滤膜3.1.5 0.1mol/L盐酸 3.1.6 磷酸盐缓冲液3.2.1 重量差异:按片剂重量差异法 (SOP-QC-334-00) 检查,±7.5%重量差异限度为符合规定。
双氯芬酸钠肠溶片检验操作规程
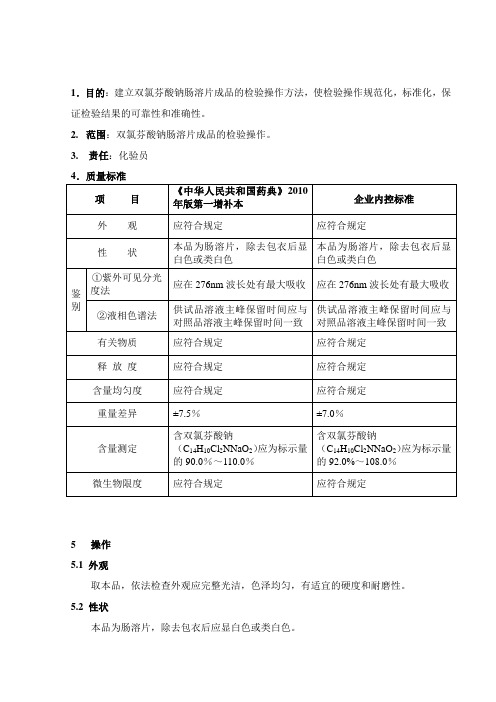
1.目的:建立双氯芬酸钠肠溶片成品的检验操作方法,使检验操作规范化,标准化,保证检验结果的可靠性和准确性。
2.范围:双氯芬酸钠肠溶片成品的检验操作。
3. 责任:化验员4.质量标准5 操作5.1 外观取本品,依法检查外观应完整光洁,色泽均匀,有适宜的硬度和耐磨性。
5.2 性状本品为肠溶片,除去包衣后应显白色或类白色。
5.3 鉴别5.3.1仪器:FA2204B电子分析天平(C04)、容量瓶(50ml、100ml)、移液管(5ml)、UV759紫外-可见分光光度计(C04)、Waters2695高效液相色谱仪(C01)5.3.2测定方法:5.3.2.1取本品细粉55mg,置50ml容量瓶中,加水溶解并稀释至刻度,再精密量取5ml,置100ml容量瓶中,用水稀释制成每1ml中含双氯芬酸钠20μg的溶液,滤过,取滤液,照紫外-可见分光光度法(SOP-QM-805-00),在276nm波长处有最大吸收。
5.3.2.2 在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰保留时间一致。
5.4 检查5.4.1有关物质5.4.1.1仪器:FA2204B电子分析天平(C04)、容量瓶(50ml、100ml)、超声波清洗器、移液管(1ml)、Waters2695高效液相色谱仪(C01)、量筒(1000ml)5.4.1.2试剂:甲醇(色谱纯)、邻苯二甲酸二乙酯、0.12%冰醋酸溶液5.4.1.3测定方法:取本品适量(约相当于双氯芬酸钠50mg),精密称定,置50ml的量瓶中,加甲醇适量,超声5分钟,放冷,用甲醇稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;另取邻苯二甲酸二乙酯2.5mg,置100ml的量瓶中,精密加供试品溶液1ml,用甲醇溶解并稀释至刻度,摇匀,作为对照溶液。
照高效液相色谱法(SOP-QM-801-00)试验,用十八烷基硅烷键合硅胶为填充剂;以甲醇-0.12%冰醋酸溶液(60:40)为流动相;检测波长为240nm。
HPLC法测定双氯芬酸钠缓释片的含量

0 . 9 9 9 9 , 表 明双氯芬酸钠浓 度在5 . 2—5 2 . 4 g ・ m l 范 围
1 中国药典[ S ] . 2 0 0 0年版. 2 0 0 2增补本. 3 4
( 2 0 0 5 - 1 2 1 4收稿 2 0 0 6 - 0 3 — 1 7修回 )
=
3 . 1 取相应 空 白辅 料的溶 液 , 在 相 同条 件下 实验 , 证 明对
样品测定不干扰 。 3 . 2 标 准法 浸泡溶解 样 品费 时较 长 , H P L C 法 可 用 超 声 法
溶解样品 , 且保 留时间适 宜 , 理论塔板 数较高 ( 均在 3 5 0 0以 上) , 具简便 、 快速 、 准确 的特点 。
2 . 1 色谱 条 件
制备所需溶 液并 测定 。结果 平均 回收率 为 1 0 0 . 3 0 %, ( R S D
=
色谱柱 : A p p l l o C 1 s ( 4 . 6 mm×1 5 0 mm, 5 m) ; 流动 相 :
p H 7 . 4 磷酸盐缓 冲液一 甲醇 ( 3 5 : 6 5 ) ; 流速 : 0 . 8 m l ・ m i n ~; 检 测波长 : 2 8 1 r i m; 柱温 : 室温 ; 进样量 : 2 0 1 x 1 。保 留时间见图 1 。
2 0 0 3 0 2 ) 。
取样品 1 ( 批号 0 5 0 2 0 2 ) 细 粉 5份 , 照 样品 溶液制 备 , 依 法分别测定含量 , 结果 R S D:1 . 1 6 %。
2 . 7 回收 率试 验
采用加样 回收 法 。精 密 称 取 已知 含 量 的 样 品 ( 批号 :
2 . 5 稳 定 性 试 验
双氯芬酸钠肠溶片含量均匀度测定

双氯芬酸钠肠溶片含量均匀度测定
王福贵
【期刊名称】《徐州医学院学报》
【年(卷),期】2005(025)004
【摘要】双氯芬酸钠(diclofenac sodium)肠溶片是一种非甾体类的消炎镇痛药,具有使用剂量小、疗效高、不良反应少等优点,被广泛应用于临床。
《中华人民共和国药典》2000年版对其含量均匀度未作规定,现参照现行标准采用紫外分光光度法探讨其含量均匀度的检查方法。
【总页数】2页(P364-365)
【作者】王福贵
【作者单位】徐州医学院附属医院药剂科,江苏,徐州,221002
【正文语种】中文
【中图分类】R917
【相关文献】
1.高效液相色谱法测定双氯芬酸钠肠溶片中有关物质 [J], 王剑霞;陈禧翎
2.HPLC法测定双氯芬酸钠肠溶片的含量 [J], 徐迪
3.HPLC法测定双氯芬酸钠肠溶片的含量 [J], 郑凯
4.离子色谱法测定双氯芬酸钠肠溶片的含量 [J], 陈漪
5.HPLC法测定双氯芬酸钠肠溶片的含量及含量均匀度 [J], 闫韶华
因版权原因,仅展示原文概要,查看原文内容请购买。
双氯芬酸钠肠溶片的血药浓度测定及人体药代动力学研究

双氯芬酸钠肠溶片的血药浓度测定及人体药代动力学研究任亦飞;张永东【期刊名称】《实用医技杂志》【年(卷),期】2004(11)05A【摘要】目的:研究双氯芬酸在正常志愿者的血药浓度及体内的药代动力学。
为临床用药提供依据。
方法:16名健康男性志愿者;单剂量口服双氯芬酸钠肠溶片100mg,在不同时间点取静脉血,血药浓度采用高效液相色谱法(HPLC)测定。
由血药浓度数据获得各自的主要药动力学参数。
结果:志愿者单次服用100mg双氯芬酸钠肠溶片后的药代动力学参数AUC0→0、AUC0→8、Cmax、Tmax分别为(5.98±1.47)mg.h/L、(6.15±1.52)mg.h/L、(2.96±0.84)mg.h /L、(2.25±0.32)h。
结论:双氯芬酸钠肠溶片在我国正常志愿者的药代动力学参数与国外的相似。
【总页数】3页(P547-549)【作者】任亦飞;张永东【作者单位】郴州市第五人民医院,湖南郴州423000;郴州市第一人民医院,湖南郴州423000【正文语种】中文【中图分类】R971.1【相关文献】1.微粒子捕捉酶免法测定极微量甲钴胺人体血药浓度及药代动力学研究 [J], 翟所迪;赵荣生;严宝霞;刘红鹰2.异烟肼人体血药浓度测定及药代动力学研究 [J], 曾德贵;刘玉琴3.人体氢氯噻嗪血药浓度测定与药代动力学研究 [J], 王蓉;杨昆;谭洁;胡云芳;程俊霖;于翠霞;余潜;樊宏伟4.双氯芬酸钠肠溶片的血药浓度测定及人体药代动力学研究 [J], 任亦飞;张永东5.妥舒沙星人体血药浓度测定及药代动力学研究 [J], 黄诗前因版权原因,仅展示原文概要,查看原文内容请购买。
紫外分光光度法测定双氯芬酸钠肠溶缓释胶囊的含量

紫外分光光度法测定双氯芬酸钠肠溶缓释胶囊的含量
王巨存;邢国胜;朱铁梁
【期刊名称】《天津医科大学学报》
【年(卷),期】2002(008)002
【摘要】目的:测定双氯芬酸钠肠溶缓释胶囊的含量.方法:以乙醇为溶剂,在280 nm处测定双氯芬酸钠的含量.结果:在10.0~30.0μg/ml浓度范围内呈线性关系,r=0.9998.平均回收率为99.41%,RSD=1.34%.结论:含量测定方法简便、快速、结果准确,适用于医院制剂的定量分析.
【总页数】2页(P162-163)
【作者】王巨存;邢国胜;朱铁梁
【作者单位】天津市天津医院,天津,300211;天津市天津医院,天津,300211;武警医学院附属医院
【正文语种】中文
【中图分类】R944.5
【相关文献】
1.蠲痹通络汤联合双氯芬酸钠肠溶缓释胶囊治疗强直性脊柱炎疗效观察 [J], 王新刚;黄立;林强;刘东钱;于继岗;李向阳;王明怀
2.紫外分光光度法测定阿司匹林肠溶衣片含量 [J], 庄惠清;单萍;黄婕
3.不除肠溶衣测定双氯芬酸钠片的含量 [J], 郭辉岩;刘宏英;隋译
4.双氯芬酸钠肠溶缓释胶囊辅助吗啡减轻经产妇剖宫产术后疼痛的临床观察 [J], 唐帅
5.紫外分光光度法测定酮洛芬缓释胶囊的含量 [J], 张苒青;马长青;刘学和;刘东明;牛国玲
因版权原因,仅展示原文概要,查看原文内容请购买。
GMP质量体系双氯芬酸钠肠溶片中间产品检验操作规程

GMP质量体系双氯芬酸钠肠溶片中间产品检验操作规程一、目的和适用范围本操作规程的目的是规范双氯芬酸钠肠溶片中间产品的检验流程,确保产品质量符合GMP要求。
本操作规程适用于双氯芬酸钠肠溶片中间产品的检验工作。
二、工具和设备1.天平:精确至0.01g;2.试剂瓶:用于储存化学试剂;3.试剂:标准物质和参比品;4.容器:用于样品的收集和储存;5.玻璃器皿:包括试剂瓶和容器等。
三、试验方法和步骤1.采样:从中间产品中随机采集适量样品;2.样品准备:将采样得到的样品放入容器中,并进行编号;3.外观检查:检查样品的颜色、形状、气味等外观特征;4.重量测定:使用天平测定样品的重量,记录结果;5.溶解度测定:将样品放入已知体积的溶剂中,搅拌一定时间后,离心,将上清液与下沉物分开,并测定上清液的浓度;6.纯度测定:使用指定方法测定样品的纯度;7.含量测定:按照规定的方法测定样品中双氯芬酸钠的含量;8.溶出度测定:将样品放入容器中,加入溶剂,定时取样检测溶出物的浓度;9.其它检测项:根据需要,进行其它项目的检测。
四、数据记录和处理1.在样品准备、外观检查、重量测定等步骤中,应及时记录原始数据;2.在溶解度测定、纯度测定、含量测定等步骤中,应记录仪器的型号和编号,温度、湿度等环境条件,以及实验数据和结果;3.实验数据的计算、统计和分析应根据GMP质量体系的要求进行。
五、质量控制1.在进行样品检验前,应校正和验证使用的仪器设备;2.在样品检验过程中,应使用标准物质和参比品进行校准和比对,确保实验结果的准确性和可靠性;3.为了确保检验结果的真实性,应采取必要的措施防止样品受到污染或其他外界因素的影响。
六、记录和报告1.对于每一个样品,应在检验完毕后填写实验记录,并签名确认;2.检验结果应根据GMP质量体系的要求进行书面报告,并归档保存。
七、规程的评估和修订1.根据实际情况,对本操作规程进行定期的评估和修订,确保其符合GMP质量体系的要求;2.对每一次修订后的操作规程,应及时进行培训并确保所有人员理解并遵守。
HPLC法同时测定双氯芬酸钠肠溶片中双氯芬酸钠的含量及有关物质

HPLC法同时测定双氯芬酸钠肠溶片中双氯芬酸钠的含量及有
关物质
何雨蓝;张丽容;肖健
【期刊名称】《广东药学院学报》
【年(卷),期】2004(20)6
【摘要】目的用HPLC法同时测定双氯芬酸钠肠溶片(OLFEN-50)中双氯芬酸钠的含量及有关物质.方法以十八烷基硅烷键合硅胶为填充剂;以ψ[乙腈∶甲醇∶磷酸二氢钾缓冲液(用ρ=85%磷酸调节pH至2.5)]=(10∶55∶35)为流动相;流速为1.0 mL/min;检测波长为245 nm.结果双氯芬酸钠在40.571~202.856 μg/mL范围内与峰面积呈现线性良好,回收率为100.9%,样品的有关物质分离完全.结论本法结果准确,分离效果好,重现性良好,方法简便、快捷.
【总页数】3页(P627-629)
【作者】何雨蓝;张丽容;肖健
【作者单位】广州市药品检验所,标准研究室,广东,广州,510160;广州市药品检验所,标准研究室,广东,广州,510160;广东药学院药学专业2002届毕业生
【正文语种】中文
【中图分类】R927.2
【相关文献】
1.HPLC法测定双氯芬酸钠肠溶片的含量 [J], 徐迪
2.HPLC法测定双氯芬酸钠凝胶的含量及有关物质 [J], 王晶;刘葵葵;李永贵;刘富强
3.HPLC法测定双氯芬酸钠肠溶片的含量 [J], 郑凯
4.RP-HPLC法测定双氯芬酸钠注射液的含量和有关物质 [J], 潘云雪;杨直;鲍黎;诸葛陇;林丽琴
5.HPLC法测定双氯芬酸钠肠溶片的含量及含量均匀度 [J], 闫韶华
因版权原因,仅展示原文概要,查看原文内容请购买。
多波长K系数法测定氯芬待因复方片剂的含量

多波长K系数法测定氯芬待因复方片剂的含量
张兰桐;和悦;王春英;周月绵;张爱华;刘伟娜;张振华
【期刊名称】《光谱学与光谱分析》
【年(卷),期】1999(19)3
【摘要】本文报道了多波长K系数法测定氯芬待因复方片剂中双氯芬酸钠、磷酸
可待因两组分含量的研究。
结果表明,双氯芬酸钠在11.18~25.40μg/mL、磷酸可待因在6.785~15.42μg/mL范围内ΔA值与浓度线性关系良好,回归方程分别为ΔA双=-0.00674c双-1.4185×10-3,r=0.9996;ΔA=-0.0130c可-1.822×10-3,r=0.9998。
双氯芬酸钠和磷酸可待因的平均回收率及相对标准偏差分别为100.1%,0.36%;100.7%,0.80%。
方法简便,快速,结果满意。
【总页数】2页(P476-477)
【关键词】双氯芬酸钠;磷酸可待因;氯芬待因;复方片剂;测定
【作者】张兰桐;和悦;王春英;周月绵;张爱华;刘伟娜;张振华
【作者单位】河北医科大学药学院药物分析教研室
【正文语种】中文
【中图分类】R971.3
【相关文献】
1.双波长分光光度法测定复方地氯霜中氯霉素的含量 [J], 卢今;柳涌
2.3.种方法测定复方氯唑沙宗片剂含量比较 [J], 王静;修荣;丁里玉;杨彩琴
3.双波长分光光度法测定复方替硝唑洗液中醋酸氯己定的含量 [J], 李广银;粟家言;刘刚
4.多波长吸收度比值差法测定复方新诺明片剂的含量 [J], 郑克敏;戴玉杰
因版权原因,仅展示原文概要,查看原文内容请购买。
市售双氯芬酸钠肠溶片探索性研究

市售双氯芬酸钠肠溶片探索性研究巩峰贤;齐衍超;李子静;谭颖;杨丽蓉;赵海鹏【期刊名称】《中国医药科学》【年(卷),期】2022(12)13【摘要】目的对山东省内销售的44批次双氯芬酸钠肠溶片的质量及质量标准进行探索性研究,为该品种的安全监管和质量标准完善提供参考。
方法采用法定质量标准对来自山东省药品质量风险监测抽检的44批次样品进行检验,将检验结果进行统计分析。
主要围绕不合格项目溶出度进行探索性研究,建立了该品种溶出度新的HPLC检测方法。
结果法定检验结果显示,44批次双氯芬酸钠肠溶片中1批次不合格,合格率为97.7%;探索性研究结果显示,现行标准在溶出度的检测方法的专属性方面尚存在不足;与原研药比较,其他国内企业该品种的溶出曲线批间波动较大,产品质量有待提升。
结论目前大部分双氯芬酸钠肠溶片的质量能达到现行标准的要求。
但通过探索性研究发现,与原研药比较,国内双氯芬酸钠肠溶片溶出均一性较差,企业在制剂工艺或包衣工艺存在一定缺陷;溶出度检验方法专属性不强,质量标准需进一步提高。
【总页数】5页(P106-110)【作者】巩峰贤;齐衍超;李子静;谭颖;杨丽蓉;赵海鹏【作者单位】潍坊市检验检测中心;山东医学高等专科学校【正文语种】中文【中图分类】R927.1【相关文献】1.中国零售企业竞争优势的构建路径--一个社会网络视角下的探索性案例2.产妇新媒体的使用状况对其坐月子观念的影响研究\r——基于对广州市产妇调查的探索性研究3.零售业企业战略、创新模式与创新能力共演路径——基于名创优品的探索性案例研究4.网上零售服务可靠性维度的探索性研究5.浙江省适龄女性三胎生育意愿探索性调查——以宁波市、绍兴市、湖州市为例因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
检验者校对者
大理州食品药品检验所实验原记录
检验依据:《中国药典》 2005年版第 页 双氯芬酸钠肠溶片(批号)
第 页 共 页
【性状】为
(标准规定:)
【含量测定】取本品20片,去除包衣后(薄膜衣肠溶片可不去除包衣),精密称定,研细,精密称取适量(约相当于双氯芬酸钠25mg)0.0903g和0.9072g分别置50mL容量瓶中,加乙醇35mL,振摇使双氯芬酸钠溶解,加乙醇稀释至刻度,摇匀,滤过,分别精密量取续滤液各1mL,置另另两个50mL容量瓶中,加乙醇稀释至刻度,摇匀,照紫外分光光度法(附录ⅣA)在286nm的波长处测定吸光度,另精密称取双氯芬酸钠对照品0.0184g,精密称定,计算即得。
