医疗器械-生产记录空白表格
医疗器械各种记录表格(横表)
产品出库、复核、销售记录
页脚内容
产品购进记录
页脚内容
页脚内容
产品销售记录
页脚内容
页脚内容
产品验收记录
页脚内容
页脚内容
出库单
购货单位:日期:
入库单
页脚内容
制单日期:
商品投诉、质量查询报告单
页脚内容
页脚内容
医疗器械商品养护记录
页脚内容
页脚内容
医疗器械售后服务反馈登记表
编号:
页脚内容
医疗器械效期产品管理记录
页脚内容
用户访问联系记录表
业务员:年度
页脚内容
页脚内容
页脚内容
医疗器械检测、维修和使用维护记录
医疗器质量管理及法规学习记录。
医疗器械各种记录表格(横表)

产品出库、复核、销售记录销售规格生产批灭菌批有效数量生产厂家质量购货单位产品名称号号期至复核员日期型号状况产品购进记录购进产品名称规格生产批灭菌批生产单位经办人供货单位数量号效期日期型号号产品销售记录销售产品名称规格生产批灭菌批生产单位经办人客户名称数量号效期日期型号号产品验收记录到货产品名称规格生产注册灭菌效期质量验收验收供货单位型号数量证号批号生产单位结论人日期批号状况出库单购货单位:日期:购货单位产品名称规格型号数量生产日期灭菌日期生产厂家注册证号质量情况有效期保管员:复核员:入库单制单日期:产品名称规格型号数量生产厂家生产批号灭菌批号注册证号有效期验收员签字:商品投诉、质量查询报告单投诉内容日期客户名称投诉生产效期生产厂家投诉内容产品批号医疗器械商品养护记录养护品名规格数量供货生产厂家生产效期温度湿度外观测试养护员日期单位批号质量结果医疗器械售后服务反馈登记表编号:反馈单位部门姓名职务详细地址电话品名规格生产批号票供货生产产品注册购货日期号单位厂家证号来人□来电□来函□走访□问卷调查□报刊□反馈方式电视□其它□在□内划√医疗器械效期产品管理记录序产品名称规格型生产批有效期产品状处理结库管员签日期生产厂家号数量态果字号号至用户访问联系记录表业务员:年度访问客户日期访问访问结果(客户意见)答复被访客户(时间及内容)时客户名称联系电话间项目WORD格式不合格医疗器械产品确认、报损、销毁记录产品名称规格型号数量注册证号生产批号合格证明生产企业供货单位确认不合格产品原因处理结果(报损、销毁时间、地点、人员、过程、结果)审核人经手人备注11专业资料整理医疗器械检测、维修和使用维护记录使用科室设备名注册证号称生产企型号规格业名称出厂时启用时间间检测维检测维修时间修单位检测维修项目检测维修结果检测维修负责人备注12医疗器质量管理及法规学习记录学习时间:学习地点:学习人员:学习题目:学习内容:。
医疗器械经营企业记录表格(质量记录表格)
文件发放/回收记录表No医疗器械质量信息反馈单编号:反馈部门:首营企业审批表审核表应附资料:1、医疗器械经营许可证或医疗器械生产许可证(复印件加盖红章)2、营业执照、税务登记证、组织机构代码证(复印件加盖红章)3、授权委托书原件。
首营品种审批表注:附医疗器械生产经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
医疗器械购进记录医疗器械退货记录表医疗器械入库验收单:医疗器械拒收单日期:年月日验收情况及存在的问题:验收员意见:质管部意见:医疗器械养护、检查表医疗器械养护处理记录近效期医疗器械预警表储运部经理: 保管员: 催销日期:医疗器械销售记录表医疗器械产品出库复核记录医疗器械售后服务记录质量问题追踪表医疗器械产品质量查询、投诉记录表医疗器械用户访问处理意见表访问时间:年月日质量事故报告单质量事故确认处理记录表质量管理部门意见:签章年月日可疑医疗器械不良事件报告表医疗器械销售退回申请单日期:页次:质检部:医疗器械退回验收记录医疗器械退回记录日期:页次:质检部:医疗器械召回事件报告表记录表编号:医疗器械召回计划实施情况报告中国境内负责单位、负责人及联系方式召回工作联系人和联系方式其他情况报告单位:(盖章)负责人:(签字)报告人:(签字)报告日期:不合格品医疗器械确认表不合格医疗器械报损审核表供货商名称品名规格进货日期不合格原因不合格医疗器械产品处理记录表不合格医疗器械销毁记录表不合格医疗器械销毁记录表医疗器械培训计划表____________ 年度培训记录表年度体检汇总表档案医疗器械设施设备一览表质量管理制度执行情况自查考试记录。
医疗器械记录表格(可打印修改)

A.患者资料 1.患者姓名: 4.预期治疗疾病:
2.年龄: 3.性别:□ 男 □ 女
5.并发疾病:
6.既往疾病:
B.不良事件情况
7.事件后果
□ 死亡
(时间) □ 危胁生命
□ 机体功能结构永久伤害 □ 需要治疗避免永久损伤 □ 其它
8.事件发生日期: 年 月 日 9.事件报告日期: 年 月 日
品名
规格
数量
生产批号
退货日期
退
货
原
因
质检员签字:
年月日
领 导 批 示
负责人签字:
年月日
处
理
结
果
经办人签字:
年月日
6
华晨宏业(天津)科技有限公司安装调试维修记录
使用 单位 供货 单位 生产 厂家 产品 名称
地址 地址 地址 规格 型号
电话 电话 电话 机器 编号
联系 人
联系 人
联系 人
生产 日期
生产、经营企业许可证 号
10.不良事件的发生地点:
□ 医院
□ 诊所 □ 家庭 □ 其它
9
1.事件的陈述:(至少包括器械使用地点、时间、使用目的、使用依据、使用情况、出现 的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)
报告人:
医师□
技师□
护士□
其他□
联系地址:
邮编:
联系电话:
编码:□□□□□□□□□□□
C.医疗器械情况 12.产品名称:
品名:
规格:
计量单位:
凭证号
摘
要
入库
数量
金额
发出
医疗器械生产记录(空白表格)
产生原因
处
理
措
施
顾
客
评
价
及
需
求
顾客签名
及盖章
年月日
客户培训记录
编号:JL-7.2-10
用户名称
地址
电话
购置设备名称
规格型号
培训对象
培训时间及内容:
培训方式和效果:
用户意见:
培训教师:
合同更改通知单
编号:JL-7.2-11
用户名称
地址
电话
联系人
通知方式
邮编
合同更改内容:
记录人:日期:
部门意见:
编号:JL-7.3-04
项目名称
设计人
设计开发输入内容:
项目负责人:
参加评审人员
评审结论:
评审组长:日期:
设计开发输出清单
编号:JL-7.3-05
项目名称
项目负责人
设计开发输出清单:
1、
2、
3、
4、
5、
6、
7、
8、
设计人:项目负责人:日期:
备注:
编号:JL-7.3-06
设计和开发评审记录表
评审类别
项目名称
受控文件清单(1.质量文件)
编号:JL–4.2.3-011
序
号
文件名称
文件编号
版本号
发放号
保管部门
使用部门
发布引入日期
受控状态
记录:
受控文件清单(2.管理文件)
编号:JL–4.2.3-01
序
号
文件名称
文件编号
版本号
发放号
保管部门
使用部门
发布引入日期
医疗器械记录表格(出库、销售、退货、验收、采购等记录表)

医疗器械记录表格(出库、销售、退货、
验收、采购等记录表)
XXX医疗器械出库复核记录表:
出库日期商品名称数量规格/型号生产企业注册证号批号有效期购货企业复核
医疗器械销售记录:
日期商品名称规格/型号生产企业注册证号数量单价有效期购货企业经营地址联系电话
医疗器械退货记录:
产品名称生产企业规格/型号注册证号批号有效期退货单位退货日期退货数量退货原因处理结果
医疗器械售后服务及质量跟踪记录表:
购买日期购货方产品名称生产厂家规格/型号批号产品质量处理购货方联系人联系方式员工签字结果
洛阳XX医疗器械有限公司库房养护检查记录:
日期商品名称规格/型号注册证号生产厂商供货企业批号有效期养护员养护数量结论签字备注
XXX医疗器械采购记录表:
购货日期供货单位产品名称生产厂商规格/型号注册证号产品批号数量单价金额经办人
医疗器械质量复检通知单:
序号到货日期复检产品名称生产企业规格/型号注册证号批号有效期验收员意见质管部复检意见
医疗器械质量查询、投诉、抽查情况记录:
日期客户名称投诉产品生产厂家注册证号批号有效期投诉内容处理结果
设施和设备安装、维修、调试及定期检查、保养记录:
序号日期设施、设备名称定期检查保养情况清洁记录维修记录设备状态记录人
XX医疗器械有限公司医疗器械购进验收记录:
商品数型号/规格验收合格数验收员日期生产厂商供货企业注册证号批号有效期验收结论备注。
医疗器械生产记录表格模板.doc

编号:JL–4.2.3-01
序
号
文 件 名 称
文件编号
版本号
发放号
保 管部 门
使 用部 门
发布引入日期
受控状态
记录:
受控文件清单(2.管理文件)
编号:JL–4.2.3-01
序
号
文 件 名 称
文件编号
版本号
发放号
保 管部 门
使 用部 门
发布引入日期
受控状态
记录:
受控文件清单(3.技术文件)
管理者代表意见:
签名: 日期:
文 件 留 用 申 请
编号:JL–4.2.3-06
文件名称
编号
版本
份数
留用原因:
申请人: 日期:
所在部门意见:
签名: 日期:
文件保管部门意见:
签名: 日期:
管理者代表意见:
签名: 日期:
文件更改、销毁、留用记录表
编号:JL–4.2.3-07
序号
文件名称
文件编号
操作人
文件
序号
文 件 名 称
编号
发放号
发 放 记 录
回 收 记 录
部门
数量
签收人
日期
回收原因
数量
日期
回收人
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
文件借阅、复制记录表
编号:JL–4.2.3-03
时间
文件名称
编号
版本
受控状态
借阅、复制份数
医疗器械生产记录表格

受控文件清单(1.质量文件)编号:JL–4.2.3-01文件编号序保管使用发布引受控文件名称发放号号部门部门入日期状态版本号记录:受控文件清单(2.管理文件)编号:JL–4.2.3-01文件编号发布序保管使用受控文件名称发放号引入号部门部门状态版本号日期记录:受控文件清单(3.技术文件)编号:JL–4.2.3-01文件编号发布序保管使用受控文件名称发放号引入号部门部门状态版本号日期记录:受控文件清单(4.外来文件)编号:JL–4.2.3-01序文件编号保管使用发布受控文件名称发放号号部门部门引入状态资料版本号日期记录:资料文件发放回收记录表编号:JL-4.2.3-02发发放记录回收记录序号文件名称编号放部门数量签收人日期回收原因数量日期回收人号12345678910111213141516专业资料整理分享.专业资料整理分享资料1718.专业资料整理分享资料文件借阅、复制记录表编号:JL–4.2.3-03借阅、复文件名称编号版本受控状态签名归还时间制份数资料文件更改申请单编号:JL–4.2.3-04 文件名称编号版本更改位置及原因:更改后的内容:资料受此影响引起的其它更改文件名称:申请人:日期:所在部门意见:签名:日期:审批部门意见:签名:日期:文件销毁申请单编号:JL–4.2.3-05文件名称编号版本份数销毁原因:申请人:日期:所在部门意见:签名:日期:文件保管部门意见:签名:日期:管理者代表意见:签名:日期:文件留用申请编号:JL–4.2.3-06文件名称编号版本份数留用原因:申请人:日期:所在部门意见:签名:日期:文件保管部门意见:签名:日期:管理者代表意见:签名:日期:文件更改、销毁、留用记录表编号:JL–4.2.3-07序文件文件名称文件编号操作人日期备注号管理人1234567891111资料1111记录人:文件归档清单编号:JL–4.2.3-08序文件编号/文件名称归档时间制定部门归档人号归档编号记录人:部门质量记录清单编号:JL–4.2.4-01 序号编号质量记录名称使用部门保存期限记录人:公司质量记录清单编号:JL–4.2.4-02 序号编号质量记录名称使用部门保存期限记录人:法律法规文件阅读记录编号:JL-4.2.4-03 文件名称收集部门文件时间来源领导批示:资料参阅人员签字:请参阅人员快速传阅,尽快返回办公室。
医疗器械记录簿表格
采购记录表
年 NO
验收记录表
年 NO:
销售记录表
年 NO:
出库记录表
入库记录表
温湿度记录表
(年月)
适应相对温度范围: - ℃适应相对湿度范围:
定期检查记录表
年 NO:
不合格医疗器械销毁记录
记录人:
不良事件停止经营和通知记录年
医疗器械召回记录年
设施设备登记表
设施设备校准记录(年)
质量管理培训记录
质量投诉记录
接到日期:年月日编号:
填表人:
事故调查和处理报告记录
编号:
各岗位培训记录
基础设施及相关设备检查清洁和维护记录
设备名称:设备编号:使用部门:保养人:年月
予以记录
温湿度计检定记录
标准文档
医疗器械查询记录
退货管理处理记录
文件发放记录记录编号:
文件回收记录
记录编号:
年
文件销毁记录记录编号:
首营企业审批表
标准文档
首营品种审批表。
医疗器械生产过程记录

使用设备及参数
设备名称:设备编号:使用参数:
操作人员
备注
生产过程记录表
编号:
产品名称:XXXXX
规格型号:XXXXX
成品编码:XXXXX
生产批号:XXXXX
生产批量:XXXXX
工序责任人:
工艺流程:①贴标签 ——②清洗烘干—— ③装硅胶塞 ——④入内包装 ——⑤封口——⑥入外包装、贴灭菌标签
生产过程异常记录
使用设备及参数
设备名称:设备编号:使用参数:
操作人员
备注
2、待清洗温度达到设定温度时将硅胶塞放入到清洗槽的滤网中清洗3分钟。
3、将清洗后的硅胶塞放在物料框中送入烘箱中进行干燥,干燥时间半小时。
4、待干燥完成后方可送入产线进行下一步操作。
生产过程异常记录
使用设备及参数
设备名称:设备编号:使用参数:
操作人员
备注
生产过程记录表
编号:
产品名称:XXXXX
规格型号:XXXXX
注意点:1、生产前,所有标签的打印和分发必须有记录,且标签信息由质量部核对过;
2、生产过程中,注意纸塑袋是否被污染和破损;
3、贴标签的过程中标签不得随意丢弃和损毁,必须做好领用和销毁记录。
生产过程异常记录
使用设备及参数
设备名称:设备编号:使用参数:
操作人员
备注
生产过程记录表
编号:
产品名称:XXXXX
生产过程记录表
编号:
产品名称:
规格型号:
成品编码:
生产批号:
生产批量:
工序责任人:
工艺流程:①贴标签 ——②清洗烘干—— ③装硅胶塞 ——④入内包装 ——⑤封口——⑥入外包装、贴灭菌标签
医疗器械各种记录表格
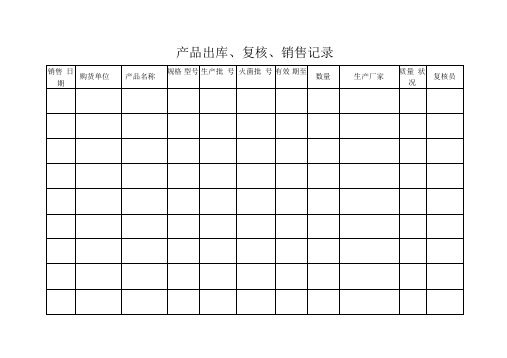
产品出库、复核、销售记录
产品购进记录
产品销售记录
产品验收记录
出库单
购货单位:日期:
保管员:复核员:
入库单
制单日期:
验收员签字:
商品投诉、质量查询报告单
医疗器械商品养护记录
医疗器械售后服务反馈登记表
编号:
医疗器械效期产品管理记录
用户访问联系记录表
业务员:年度
不合格医疗器械产品确认、报损、销毁记录
医疗器械检测、维修和使用维护记录
医疗器质量管理及法规学习记录学习时间:
学习地点:
学习人员:
学习题目:
学习内容:。
2017版医疗器械记录表格

2017版医疗器械记录表格1.前言2.质量管理体系文件3.设备清单及维护记录4.产品检验记录5.不合格品处理记录6.培训记录7.客户投诉处理记录8.内部审核记录9.管理评审记录前言:本表格为___医疗器械质量管理文件记录表格,用于记录公司医疗器械质量管理的各项文件和记录。
质量管理体系文件:公司建立了完善的医疗器械质量管理体系文件,包括质量手册、程序文件、工作指导书、记录表格等,所有文件均经过修订、审核和批准,并在实际工作中得到贯彻执行。
设备清单及维护记录:公司对医疗器械设备进行了清单管理,并制定了维护计划,定期对设备进行检查、维修和保养,并记录在设备维护记录表中,确保设备处于良好的工作状态。
产品检验记录:公司对生产的医疗器械进行全面的检验,包括原材料的检验、生产过程中的检验和最终产品的检验。
所有检验结果均记录在产品检验记录表中,以便追溯和管理。
不合格品处理记录:公司对不合格品进行了严格的管理和处理,制定了不合格品处理程序,并记录在不合格品处理记录表中,以确保不合格品得到及时处理和追溯,避免对产品质量和客户安全造成影响。
培训记录:公司对员工进行了全面的培训,包括医疗器械质量管理体系的培训、操作规程的培训和技能培训等。
所有培训记录均记录在培训记录表中,以确保培训工作得到有效的管理和跟踪。
客户投诉处理记录:公司对客户投诉进行了及时的处理和跟踪,制定了客户投诉处理程序,并记录在客户投诉处理记录表中,以确保客户投诉得到及时的处理和回复,提高客户满意度。
内部审核记录:公司定期进行内部审核,对医疗器械质量管理体系进行审核,发现问题及时进行纠正和改进,并记录在内部审核记录表中,以确保质量管理体系得到有效的管理和改进。
管理评审记录:公司定期进行管理评审,对医疗器械质量管理体系进行评审,确保质量管理体系的有效性和适应性,并记录在管理评审记录表中,以确保质量管理体系得到有效的管理和改进。
1.___的采购记录共有300项。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编号:JL-7.3-02
序号
设计开发计划阶段的内容
计划完
成时间
实际完成时间
人员分工
检查人
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
设计开发输入清单
编号:JL-7.3-03
项目名称
项目负责人
设计开发输入清单:
1、
2、
3、
4、
5、
6、
7、
8、
设计人:项目负责人:日期:
备注:
设计开发输入评审单
★表示符合要求 ▲ 表示需要改进
记录人:
顾客来电记录表
编号:JL-7.2-01
顾客名称
联系人
地址
电话
邮编
来电内容:
记录人:日期:
处理结果:
顾客来电记录表
JL-7.2-01
顾客名称
联系人
地址
电话
邮编
来电内容:
记录人:日期:
处理结果:
执行合同交付记录编号:JL-7.2-02
序号
合同号
产品名称
型号
机号
数量
紧急采购的原因:
拟制:年月日审核:年月日
检修人:日期:
验收记录:
验收人:日期:
备注:
设备报废单
编号:JL–6.3-07
设备使用部门:
设备名称
设备编号
起用时间
规格型号
原价格
报废申请
报废原因:
审批意见:
批准人:日期:
生产环境检查记录
编号:JL-6.4-01
单位
内容
时间
人员着装
温湿度
定置管理
实施责任人
年月日
环境综合
要求
人员着装符合要求,工作台面干净清洁,设备干净并处完好状态,产品器件工具摆放整齐,状态标识明确,环境温度应保持在10℃~30℃湿度≤80%
编号:JL-7.3-04
项目名称
设计人
设计开发输入内容:
项目负责人:
参加评审人员
评审结论:
评审组长:日期:
设计开发输出清单负责人
设计开发输出清单:
1、
2、
3、
4、
5、
6、
7、
8、
设计人:项目负责人:日期:
备注:
编号:JL-7.3-06
设计和开发评审记录表
评审类别
项目名称
合同的合法性、严密性违约条款
办公室
会议评审
结论
领导审批
备
注
备注:
1.没有现货的常规合同要求参加评审的部门为:生产、供应部、销售部、技术质量部,最终由总经理批准。
2.特殊合同要求评审部门:全体部门,最终由总经理签字批准。
3.现货合同或电话订货的单一合同可由销售部直接经手人评审,销售部经理批准即可实施。
机号
安装时间
联系人
联系电话
1
2
3
4
5
6
7
8
9
10
11
12
交付安装表
编号:JL-7.2-08
产品名称
型号
机号
安装地点
安装日期
安装人
安装验收
情况
服务质量
验收人:单位公章
顾客需求
签字:年月日
售后服务记录表
编号:JL-7.2-09
产品名称
型号
机号
安装日期
安装地点
安装人
技术培训
日期
培训内容
授课人
维修日期
维修人
设备台帐编号:JL-6.3-05
序号
设备名称
规格型号
设备编号
完好状态
所属部门
管理人员
购入日期
生产厂家
通讯地址
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
设备检修单
编号:JL–6.3-06
设备使用部门:
设备名称
设备编号
规格型号
检修申请人
故障发生时间和现象:
检修记录:
审的文
件资料
评审的主要内容(指方案的可行性,先进合理性,经济性文件资料的完整性,可生产性及改进建议)
评审结论
评审负责人:日期:
设计和开发评审意见表
编号:JL-7.3-05(3)
评审项目
产品代号
意见内容:
评审者单位
记录人
设计和开发评审记录表
编号:JL-7.3-06(4)
存在的问题及改进的措施
评审结论
评审组长
记录人:
特殊销售合同评审记录表
编号:JL-7.2-05
合同(协议)编号
评审日期
合同形式
()电传()投标()电话记录()其他
合同类型
产品名称型号
数量
单位名称
运输方式
合同评审内容
会议评审意见
评审部门
签名
价格及付款方式
销售部
交货地点
服务要求
生产供应部
交货期限
技术要求
技术质量部
包装要求
质量保证(检测手段、检测能力)
故障现象及
产生原因
处
理
措
施
顾
客
评
价
及
需
求
顾客签名
及盖章
年月日
客户培训记录
编号:JL-7.2-10
用户名称
地址
电话
购置设备名称
规格型号
培训对象
培训时间及内容:
培训方式和效果:
用户意见:
培训教师:
合同更改通知单
编号:JL-7.2-11
用户名称
地址
电话
联系人
通知方式
邮编
合同更改内容:
记录人:日期:
部门意见:
来电订货记录表
编号:JL-7.2-06
顾客单位名称
订货日期
负责人
邮编
电话
传真
地址
函
电
内
容
项目
顾客要求内容
产品名称型号
数量
交货期限
交货地点
运输方式
价格
付款方式
服务要求
技术要求
包装要求
质保要求
违约条款
通话人
供方接收人
市场部经理批准签字
顾客档案
编号:JL-7.2-07
序号
顾客名称及地址
所用产品名称及型号
数量(台)
日期
回收原因
数量
日期
回收人
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
文件借阅、复制记录表
编号:JL–4.2.3-03
时间
文件名称
编号
版本
受控状态
借阅、复制份数
签名
归还时间
文件更改申请单
编号:JL–4.2.3-04
文件名称
编号
版本
更改位置及原因:
更改后的内容:
受此影响引起的其它更改文件名称:
申请人:日期:
所在部门意见:
签名:日期:
审批部门意见:
签名:日期:
文件销毁申请单
编号:JL–4.2.3-05
文件名称
编号
版本
份数
销毁原因:
申请人:日期:
所在部门意见:
签名:日期:
文件保管部门意见:
签名:日期:
管理者代表意见:
签名:日期:
文件留用申请
编号:JL–4.2.3-06
文件名称
编号
版本
份数
留用原因:
年月日
设计存在问题及解决措施一览表
编号:JL-7.3-06
序号
问题内容
纠正措施及建议
负责人
要求完成日期
追踪结论
技术质量部签字:
年月日
采购合同台帐(档案)
编号:JL-
序号
合同编号
供方名称
签定日期
合同要求
供货名称
供方调查表
编号:JL-7.4-01
请贵公司认真如实填写,加盖公章后及早寄回本公司。谢谢!(选择项目请在□内打√,如贵公司不是生产企业可免填生产方面的内容)
项目负责人
YH有限公司
年月日
设计和开发评审记录表
编号:JL-7.3-05(1)
评审项目名称
型号或代号
项目负责人
参加设计
和开发人员
评审主办单位
会议地点
建议参加评审单位和同行专家
对参加评审
人员的要求
总工程师审核意见
签字
总经理批准意见
签字
预计评审
会议日期
编号:JL-7.3-05(2)
评审时间
评审地点
提供评
应参加
人数
实际参加人数
平均成绩
培训合格率
考核人
年度培训合格率情况:
记录人:
培训记录
编号:JL–6.2-04
培训时间
培训学时
培训教师
培训内容
培
训
人
员
名
单
参学人员签名
记录人:
员工培训档案
