材料科学与工程基础第三章答案
工程材料第三章作业参考答案

工程材料第三章作业参考答案1、解释下列名词:奥氏体化,过冷奥氏体,残余奥氏体;奥氏体的起始晶粒度、实际晶粒度、本质晶粒度。
答:奥氏体化:在临界点以上加热,目的是获得均匀的奥氏体组织,称为奥氏体化奥氏体化也是形核和长大的过程,分为四步:第一步奥氏体晶核形成、第二步奥氏体晶核长大、第三步残余Fe3C溶解、第四步奥氏体成分均匀化。
过冷奥氏体:处于临界点A1以下的奥氏体称过冷奥氏体。
过冷奥氏体是非稳定组织,迟早要发生转变。
随过冷度不同,过冷奥氏体将发生珠光体转变、贝氏体转变和马氏体转变三种类型转变。
残余奥氏体:即使冷却到Mf 点,也不可能获得100%的马氏体,总有部分奥氏体未能转变而残留下来,称残余奥氏体,用A’ 或γ’ 表示。
奥氏体的起始晶粒度:奥氏体化刚结束时的晶粒度称起始晶粒度,此时晶粒细小均匀。
实际晶粒度:在给定温度下奥氏体的晶粒度称实际晶粒度。
本质晶粒度:加热时奥氏体晶粒的长大倾向称本质晶粒度。
2、过冷奥氏体转变时所形成的珠光体类、贝氏体类、马氏体类组织有哪几种? 它们在形成条件、组织形态和性能方面有何特点?答:过冷奥氏体在A1~ 550℃间将转变为珠光体类组织,为铁素体与渗碳体片层相间的机械混合物。
根据片层厚薄不同,又细分为珠光体、索氏体和屈氏体。
⑴珠光体:形成温度为A1-650℃,片层较厚,500倍光镜下可辨,用符号P表示。
⑵索氏体:形成温度为650-600℃,片层较薄,800-1000倍光镜下可辨,用符号S 表示。
⑶屈氏体:形成温度为600-550℃,片层极薄,电镜下可辨,用符号T 表示。
珠光体、索氏体、屈氏体三种组织无本质区别,只是形态上的粗细之分,因此其界限也是相对的。
片间距越小,钢的强度、硬度越高,而塑性和韧性略有改善。
过冷奥氏体在550℃- 230℃(Ms)间将转变为贝氏体类型组织,贝氏体用符号B表示。
根据其组织形态不同,贝氏体又分为上贝氏体(B 上)和下贝氏体(B下)。
⑴上贝氏体形成温度为550-350℃。
材料科学与工程基础习题答案 (1)

第一章 原子排列与晶体结构1.[110], (111), ABCABC…, 0.74 , 12 , 4 , a r 42=; [111], (110) , 0.68 , 8 , 2 , a r 43= ;]0211[, (0001) , ABAB , 0.74 , 12 , 6 , 2a r =。
2. 0.01659nm 3 , 4 , 8 。
3. FCC , BCC ,减少 ,降低 ,膨胀 ,收缩 。
4. 解答:见图1-15.解答:设所决定的晶面为(hkl ),晶面指数与面上的直线[uvw]之间有hu+kv+lw=0,故有: h+k-l=0,2h-l=0。
可以求得(hkl )=(112)。
6 解答:Pb 为fcc 结构,原子半径R 与点阵常数a 的关系为ar 42=,故可求得a =0.4949×10-6mm 。
则(100)平面的面积S =a 2=0.244926011×0-12mm 2,每个(100)面上的原子个数为2。
所以1 mm 2上的原子个数s n 1==4.08×1012。
第二章合金相结构一、 填空1) 提高,降低,变差,变大。
2) (1)晶体结构;(2)元素之间电负性差;(3)电子浓度 ;(4)元素之间尺寸差别 3) 存在溶质原子偏聚 和短程有序 。
4) 置换固溶体 和间隙固溶体 。
5) 提高 ,降低 ,降低 。
6) 溶质原子溶入点阵原子溶入溶剂点阵间隙中形成的固溶体,非金属原子与金属原子半径的比值大于0.59时形成的复杂结构的化合物。
二、 问答1、 解答: α-Fe 为bcc 结构,致密度虽然较小,但是它的间隙数目多且分散,间隙半径很小,四面体间隙半径为0.291Ra ,即R =0.0361nm ,八面体间隙半径为0.154Ra ,即R =0.0191nm 。
氢,氮,碳,硼由于与α-Fe 的尺寸差别较大,在α-Fe 中形成间隙固溶体,固溶度很小。
材料工程基础周勇敏第三章习题答案

Q At
= Q =
85
=49.3W/(m2C)
A(tw -t f ) 3.14.014 0.8 (69-20)
【3-35】
【3-1】一根直径 d =50 mm , l =8 m 的钢管,被置于横断面为 0.2×0.2 m 的砖槽道内。若
钢 管 温 度 和 辐 射 率 分 别 为 t1 250 ℃ 、 1 0.79 , 砖 槽 壁 面 温 度 和 辐 射 率 分 别 为 t2 27 ℃、 2 0.93,试计算该钢管的辐射热损失。
=
1
1 0.002
1
60
800 320 50
=2822.7W /m2
q3-q0 100%= 2822.7-2810.3 100%=0.37%
q0
2810.3
【3【-431-1】】在换热器中,一种流体从 250℃被冷却到 150℃,另一种流体从 80℃被加热到
120℃。如果换热器被设计成顺流式、逆流式。试分别求出其对数平均温度差。
q
av
tw1
tw2
=0.103
300-100 0.1
=206(W
/m2
)
【3-【183】-1】 对置于气流中的一表面进行 对流换热试验,测得局部换热系数满足如下准则方程
Nux=0.04Rex0.9 Pr1/3。其中 x 为特性长度,是计算点离开平板前缘的距离。试计算当气流温 度 t∞=27℃、流速 u∞=50 m /s 时离开平板前缘 x=1.2 m 处的对流换热系数。设平壁温度 tw=73℃。
《材料科学基础》部分章节试题及答案(大学期末复习资料).docx

第三章作业答案1.说明面心立方结构的潜在滑移系有12个,体心立方结构的潜在滑移系有48个。
解:面心立方晶体的滑移系是{111} < 1-10> , (111}有四个,每个{111}面上有三个〈110〉方向,所以共有12个潜在滑移系。
体心立方晶体的滑移系是(110} <- 111 > , {211} <- 111 >以及{312} < -111 >o{110}面共有6个,每个{110}面上有两个<-111 >方向,这种滑移系共有12个潜在滑移系; {211}面有12个,每个“211”面上有1个〈111〉方向,这种滑移系共有12个潜在滑移系;{312}面共有24个,每个{312}面上有1个<-111 >方向,这种滑移系共有潜在滑移系24个, 这样,体心立方晶体的潜在滑移系共有48个。
2.一个位错环能否各部分都是螺位错?能否各部分都是刃位错?为什么?解:螺位错的柏氏矢量与位错线平行,而一个位错只有一个柏氏矢量,一个位错环不可能与一个方向处处平行,所以一个位错环不能各部分都是螺位错。
刃位错的柏氏矢量与位错线垂直,如果柏氏矢量垂直位错环所在的平面,则位错环处处都是刃位错。
这种位错的滑移面是位错环与柏氏矢量方向组成的棱柱面,这种位错又称棱柱位错。
3.纯铁的空位形成能为105kJ/mol.将纯铁加热到850°C后激冷至室温(20°C),假设高温下的空位能全部保留,试求过饱和空位浓度与室温平衡空位浓度的比值。
解:G,=4exp(-g)850 °C (1123K)后激穆室温可以认为全部空位保留下来Exp(31.87)4.写出距位错中心为R1范围内的位错弹性应变能。
如果弹性应变能为R1范围的一倍,则所涉及的距位错中心距离R2为多大?解:距位错中心为&范围内的位错弹性应变能为E = 竺瓦马。
4忒Ab如果弹性应变能为&范围的一倍,则所涉及的距位错中心距离R2为2 竺= 也4.K Ab A TT K Ab即R,=¥2 Ab5.简单立方晶体(100)面有一个b=[001]的螺位错。
材料科学基础课后习题答案

《材料科学基础》课后习题答案第一章材料结构的基本知识4. 简述一次键和二次键区别答:根据结合力的强弱可把结合键分成一次键和二次键两大类。
其中一次键的结合力较强,包括离子键、共价键和金属键。
一次键的三种结合方式都是依靠外壳层电子转移或共享以形成稳定的电子壳层,从而使原子间相互结合起来。
二次键的结合力较弱,包括范德瓦耳斯键和氢键。
二次键是一种在原子和分子之间,由诱导或永久电偶相互作用而产生的一种副键。
6. 为什么金属键结合的固体材料的密度比离子键或共价键固体为高?答:材料的密度与结合键类型有关。
一般金属键结合的固体材料的高密度有两个原因:(1)金属元素有较高的相对原子质量;(2)金属键的结合方式没有方向性,因此金属原子总是趋于密集排列。
相反,对于离子键或共价键结合的材料,原子排列不可能很致密。
共价键结合时,相邻原子的个数要受到共价键数目的限制;离子键结合时,则要满足正、负离子间电荷平衡的要求,它们的相邻原子数都不如金属多,因此离子键或共价键结合的材料密度较低。
9. 什么是单相组织?什么是两相组织?以它们为例说明显微组织的含义以及显微组织对性能的影响。
答:单相组织,顾名思义是具有单一相的组织。
即所有晶粒的化学组成相同,晶体结构也相同。
两相组织是指具有两相的组织。
单相组织特征的主要有晶粒尺寸及形状。
晶粒尺寸对材料性能有重要的影响,细化晶粒可以明显地提高材料的强度,改善材料的塑性和韧性。
单相组织中,根据各方向生长条件的不同,会生成等轴晶和柱状晶。
等轴晶的材料各方向上性能接近,而柱状晶则在各个方向上表现出性能的差异。
对于两相组织,如果两个相的晶粒尺度相当,两者均匀地交替分布,此时合金的力学性能取决于两个相或者两种相或两种组织组成物的相对量及各自的性能。
如果两个相的晶粒尺度相差甚远,其中尺寸较细的相以球状、点状、片状或针状等形态弥散地分布于另一相晶粒的基体内。
如果弥散相的硬度明显高于基体相,则将显著提高材料的强度,同时降低材料的塑韧性。
材料科学与工程基础第三章答案(供参考)

3.8 铁具有BCC晶体结构,原子半径为0.124 nm,原子量为55.85g/mol。
计算其密度并与实验值进行比较。
答:BCC结构,其原子半径与晶胞边长之间的关系为:a = 4R/3= 4⨯0.124/1.732 nm = 0.286 nmV = a3 = (0.286 nm)3 = 0.02334 nm3 = 2.334⨯10-23 cm3BCC结构的晶胞含有2个原子,∴其质量为:m = 2⨯55.85g/(6.023⨯1023) = 1.855⨯10-22 g密度为ρ= 1.855⨯10-22 g/(2.334⨯10-23 m3) =7.95g/cm33.9 计算铱原子的半径,已知Ir具有FCC晶体结构,密度为22.4g/cm3,原子量为192.2 g/mol。
答:先求出晶胞边长a,再根据FCC晶体结构中a与原子半径R的关系求R。
FCC晶体结构中一个晶胞中的原子数为4,ρ= 4⨯192.2g/(6.023⨯1023⨯a3cm3) = 22.4g/cm3,求得a = 0.3848 nm 由a = 22R求得R = 2a/4 = 1.414⨯0.3848 nm/4 = 0.136 nm 3.10 计算钒原子的半径,已知V 具有BCC晶体结构,密度为5.96g/cm3,原子量为50.9 g/mol。
答:先求出晶胞边长a,再根据BCC晶体结构中a与原子半径R的关系求R。
BCC晶体结构中一个晶胞中的原子数为2,ρ= 2⨯50.9g/(6.023⨯1023⨯a3cm3) = 5.96 g/cm3,求得a = 0.305 nm 由a = 4R/3求得R = 3a/4 = 1.732⨯0.305 nm/4 = 0.132 nm3.11 一些假想的金属具有图3.40给出的简单的立方晶体结构。
如果其原子量为70.4 g/mol,原子半径为0.126 nm,计算其密度。
答:根据所给出的晶体结构得知,a = 2R =2⨯0.126 nm = 0.252 nm 一个晶胞含有1个原子,∴密度为:ρ= 1⨯70.4g/(6.023⨯1023⨯0.2523⨯10-21cm3)= 7.304 g/cm33.12 Zr 具有HCP晶体结构,密度为6.51 g/cm3。
材料工程基础第三、四章习题答案

1、何为冷变形、热变形和温变形?冷变形:温度低于回复温度,变形过程只有加工硬化无回复和再结晶。
热变形:温度在再结晶温度以上,变形产生的加工硬化被再结晶抵消,变形后具有再结晶等轴晶粒组织,而无加工硬化痕迹。
温变形:金属材料在高于回复温度但低于再结晶开始温度的温度范围内进行的塑性变形过程。
2、简述金属的可锻性及其影响因素。
可锻性:指金属材料在压力加工时,能改变形状而不产生裂纹的性能。
它包括在热态或冷态下能够进行锤锻,轧制,拉伸,挤压等加工。
可锻性的好坏主要与金属材料的化学成分有关。
(1)内在因素(a)化学成分:不同化学成分的金属其可锻性不同;(b)合金组织:金属内部组织结构不同,其可锻性差别很大。
(2)外在因素(a)变形温度:系指金属从开始锻造到锻造终止的温度范围。
温度过高:过热、过烧、脱碳和严重氧化等缺陷。
温度过低:变形抗力↑-难锻,开裂(b)变形速度:变形速度即单位时间内的变形程度(c)应力状态:金属在经受不同方法进行变形时,所产生的应力大小和性质(压应力或拉应力)不同。
3、自由锻和模锻的定义及其特点是什么?自由锻造是利用冲击力或压力使金属在上下砧面间各个方向自由变形,不受任何限制而获得所需形状及尺寸和一定机械性能的锻件的一种加工方法,简称自由锻。
1、自由锻锻件的精度不高,形状简单,其形状和尺寸一般通过操作者使用通用工具来保证,主要用于单件、小批量生产。
2、对于大型机特大型锻件的制造,自由锻仍是唯一有效的方法。
3、自由锻对锻工的技术水平要求高,劳动条件差,生产效率低。
模锻是指在专用模锻设备上利用模具使毛坯成型而获得锻件的锻造方法。
模锻具有如下特点:(1)生产效率高。
劳动强度低。
(2)锻件成形靠模膛控制,可锻出形状复杂、尺寸准确,更接近于成品的锻件,且锻造流线比较完整,有利于提高零件的力学性能和使用寿命。
(3)锻件表面光洁,尺寸精度高,加工余量小,节约材料和切削加工工时。
(4)操作简便,质量易于控制,生产过程易实现机械化、自动化。
材料工程基础第三、五、六章的答案

材料的性能改善
1
合金化
通过混合不同金属,改变材料的结构和性能,提高硬度和耐腐蚀性。
2
热处理
通过控制材料的加热和冷却过程,改变其组织结构和性能。
3
表面涂层
在材料表面形成保护层,提高耐磨性、耐腐蚀性和外观质量。
未来的发展方向
纳米技术
纳米技术将材料的制造和应用推向 纳米级,具有广阔的应用前景。
生物材料
生物材料在医学和生物工程领域的 应用不断拓展,具有巨大的潜力。
可持续材料
可持续材料的研发将促进环境可持 续发展和资源利用的最大化。
材料工程基础第三、五、 六章的答案
准备好探索材料工程的世界了吗?本次演示将回答材料工程基础第三、五、 六章的问题,让我们一起开始吧!
材料的特性
金属
金属是一种重要的材料,其特性包 括强度,导电性和导热性。
聚合物
聚合物是可塑性材料,具有轻质、 高强度和化学稳定性等特点。
陶瓷
陶瓷具有优异的耐热性和绝缘性能, 适用于高温和电子器件等领域。
熔点
熔点是材料从固态到液态转变的温 度,不同材料具有不同的熔点。
材料的加工
锻造
锻造是通过对金属加热和加压,改变其形状和结构。
挤压
挤压是通过将材料挤压至模具孔中,制造出所需形 状的方法。
焊接
焊接是将材料加热至熔点并使其连接在一起的方法, 常用于金属结构的制造。
Байду номын сангаас
喷涂
喷涂是将涂料喷射到材料表面形成保护层或装饰层 的方法。
1
应力分析
通过应力分析确定所需的材料特性和性能。
2
材料筛选
根据应力分析的结果,筛选满足要求的材料,考虑成本和可用性。
顾宜《材料科学与工程基础》课后题答案

顾宜《材料科学与工程基础》课后题答案第一章:引言1.1 材料科学与工程基础的重要性材料科学与工程基础是现代工程领域不可或缺的一门基础课程。
它包括了材料科学与工程学科的基本原理和方法,为后续学习和研究提供了必要的基础知识。
材料是任何工程的基础,它在各个领域中都扮演着重要角色,如机械工程、电子工程、航空航天工程等。
因此,熟悉材料的结构、性质和应用对于工程师来说至关重要。
1.2 材料科学与工程基础的学习目标材料科学与工程基础的学习目标如下: - 理解材料的基本概念和分类方法; - 掌握材料制备、表征和性能分析的基本技术; - 理解不同材料的特性和应用; - 开发解决材料工程问题的能力。
第二章:晶体结构与晶体缺陷2.1 晶体的结构晶体是由原子、离子或分子按照一定的排列方式组成的长程有序固体结构。
晶体的结构可以通过晶体的晶胞来描述,晶胞是最小的重复单元。
2.2 晶体的缺陷晶体的缺陷指的是在晶体结构中存在的不完整或不规则的区域。
晶体的缺陷可以分为点缺陷、线缺陷和面缺陷三种类型。
点缺陷包括空位、插入原子和替代原子等。
线缺陷包括位错和脚位错。
面缺陷包括晶界和层错。
第三章:物理性能与力学性能3.1 物理性能物理性能是指材料的一些基本物理特性,如密度、热导率、电导率等。
物理性能的好坏对材料的应用和工程设计具有重要影响。
3.2 力学性能力学性能是指材料在力学作用下的表现。
常见的力学性能包括强度、硬度、韧性、可塑性等。
力学性能的好坏决定了材料在工程中的使用范围和耐久性。
第四章:金属材料4.1 金属的结构与特性金属是指电子云密度较大、以金属键连接的材料。
金属的结构特点是具有密堆结构和离域电子特性。
4.2 金属的物理性能与力学性能金属材料具有良好的导电性、导热性和延展性,对磨损和腐蚀有较好的抵抗能力。
金属材料的力学性能受材料的组织和处理方式的影响。
第五章:陶瓷材料与玻璃材料5.1 陶瓷材料的分类与特性陶瓷材料是以非金属元素为主要成分的材料,分为晶体陶瓷和非晶态陶瓷两大类。
材基第三章习题及答案

第三章 作业与习题的解答一、作业:2、纯铁的空位形成能为105 kJ/mol 。
将纯铁加热到850℃后激冷至室温(20℃),假设高温下的空位能全部保留,试求过饱和空位浓度与室温平衡空位浓度的比值。
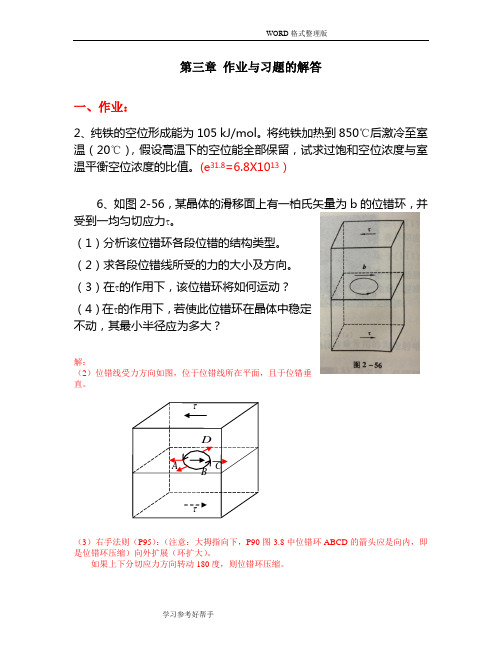
(e 31.8=6.8X1013)6、如图2-56,某晶体的滑移面上有一柏氏矢量为b 的位错环,并受到一均匀切应力τ。
(1)分析该位错环各段位错的结构类型。
(2)求各段位错线所受的力的大小及方向。
(3)在τ的作用下,该位错环将如何运动?(4)在τ的作用下,若使此位错环在晶体中稳定不动,其最小半径应为多大?解:(2)位错线受力方向如图,位于位错线所在平面,且于位错垂直。
(3)右手法则(P95):(注意:大拇指向下,P90图3.8中位错环ABCD 的箭头应是向内,即是位错环压缩)向外扩展(环扩大)。
如果上下分切应力方向转动180度,则位错环压缩。
A B CDττ(4) P103-104: 2sin 2d ϑτdT s b =θRd s =d ; 2/sin 2θϑd d= ∴ τττkGb b kGb b T R ===2 注:k 取0.5时,为P104中式3.19得出的结果。
7、在面心立方晶体中,把两个平行且同号的单位螺型位错从相距100nm 推进到3nm 时需要用多少功(已知晶体点阵常数a=0.3nm,G=7﹡1010Pa )? (3100210032ln 22ππGb dr w r Gb ==⎰; 1.8X10-9J )8、在简单立方晶体的(100)面上有一个b=a[001]的螺位错。
如果它(a)被(001)面上b=a[010]的刃位错交割。
(b)被(001)面上b=a[100]的螺位错交割,试问在这两种情形下每个位错上会形成割阶还是弯折?((a ):见P98图3.21, NN ′在(100)面内,为扭折,刃型位错;(b)图3.22,NN ′垂直(100)面,为割阶,刃型位错)9、一个]101[2-=a b 的螺位错在(111)面上运动。
材料科学与工程基础第三章答案

3.8 铁具有BCC晶体结构,原子半径为0.124 nm,原子量为55.85g/mol。
计算其密度并与实验值进行比较。
答:BCC结构,其原子半径与晶胞边长之间的关系为:a = 4R/3= 4⨯0.124/1.732 nm = 0.286 nmV = a3 = (0.286 nm)3 = 0.02334 nm3 = 2.334⨯10-23 cm3BCC结构的晶胞含有2个原子,∴其质量为:m = 2⨯55.85g/(6.023⨯1023) = 1.855⨯10-22 g密度为ρ= 1.855⨯10-22 g/(2.334⨯10-23 m3) =7.95g/cm33.9 计算铱原子的半径,已知Ir具有FCC晶体结构,密度为22.4g/cm3,原子量为192.2 g/mol。
答:先求出晶胞边长a,再根据FCC晶体结构中a与原子半径R的关系求R。
FCC晶体结构中一个晶胞中的原子数为4,ρ= 4⨯192.2g/(6.023⨯1023⨯a3cm3) = 22.4g/cm3,求得a = 0.3848 nm 由a = 22R求得R = 2a/4 = 1.414⨯0.3848 nm/4 = 0.136 nm 3.10 计算钒原子的半径,已知V 具有BCC晶体结构,密度为5.96g/cm3,原子量为50.9 g/mol。
答:先求出晶胞边长a,再根据BCC晶体结构中a与原子半径R的关系求R。
BCC晶体结构中一个晶胞中的原子数为2,ρ= 2⨯50.9g/(6.023⨯1023⨯a3cm3) = 5.96 g/cm3,求得a = 0.305 nm 由a = 4R/3求得R = 3a/4 = 1.732⨯0.305 nm/4 = 0.132 nm3.11 一些假想的金属具有图3.40给出的简单的立方晶体结构。
如果其原子量为70.4 g/mol,原子半径为0.126 nm,计算其密度。
答:根据所给出的晶体结构得知,a = 2R =2⨯0.126 nm = 0.252 nm 一个晶胞含有1个原子,∴密度为:ρ= 1⨯70.4g/(6.023⨯1023⨯0.2523⨯10-21cm3)= 7.304 g/cm33.12 Zr 具有HCP晶体结构,密度为6.51 g/cm3。
《材料科学与工程基础》顾宜 第三章 课后答案

3-1.解释以下名词:金属键、晶格、晶胞、合金、组元、相、机械混合物、铁素体、奥氏体、渗碳体、马氏体、黄铜、青铜、形变铝合金、非晶态金属键:是化学键的一种,主要在金属中存在。
由自由电子及排列成晶格状的金属离子之间的静电吸引力组合而成。
无方向性和饱和性.晶格:表示晶体结构周期重复规律的简单几何图形.晶胞:晶体内部的基本重复单元(最小重复单元).合金:是由两种或两种以上的金属与金属或非金属经一定方法所合成的具有金属特性的混合物。
一般通过熔合成均匀液体和凝固而得。
组元:组成合金的独立的、最基本的单元称为组元,组元可以是组成合金的元素或稳定的化合物。
相:指一个宏观物理系统所具有的一组状态,也通称为物态。
机械混合物:指由两种或以上的互不相溶晶体结构(纯金属、固溶体或化合物)机械地混合而形成的显微组织。
机械混合物的性能主要取决于组成它的各组成物的性能以及其数量、形状、大小和分布情况。
铁素体:是碳溶解在α-Fe中的间隙固溶体,常用符号F表示。
具有体心立方晶格,其溶碳能力很低.奥氏体:是钢铁的一种层片状的显微组织,通常是ɣ-Fe中固溶少量碳的无磁性固溶体,也称为沃斯田铁或ɣ-Fe。
一般由等轴状的多边形晶粒组成,晶粒内有孪晶。
渗碳体:铁与碳形成的稳定化合物,其化学式为Fe3C。
渗碳体的含碳量为ωc=6.69%,熔点为1227℃。
其晶格为复杂的正交晶格,硬度很高HBW=800,塑性、韧性几乎为零,脆性很大。
马氏体:是黑色金属材料的一种组织名称,是碳在α-Fe中的过饱和固溶体黄铜:由铜和锌所组成的合金,由铜、锌组成的黄铜就叫作普通黄铜,如果是由二种以上的元素组成的多种合金就称为特殊黄铜。
黄铜有较强的耐磨性能,黄铜常被用于制造阀门、水管、空调内外机连接管和散热器等。
青铜:是金属冶铸史上最早的合金,在纯铜(紫铜)中加入锡或铅的合金,有特殊重要性和历史意义,与纯铜(紫铜)相比,青铜强度高且熔点低(25%的锡冶炼青铜,熔点就会降低到800℃。
材料科学基础第三章答案

第三章1. 试述结晶相变的热力学条件、动力学条件、能量及结构条件。
2. 如果纯镍凝固时的最大过冷度与其熔点(tm=1453℃)的比值为0.18,试求其凝固驱动力。
(ΔH=-18075J/mol)3. 已知Cu的熔点tm=1083℃,熔化潜热Lm=1.88×103J/cm3,比表面能σ=1.44×105 J/cm3。
(1)试计算Cu在853℃均匀形核时的临界晶核半径。
(2)已知Cu的相对原子质量为63.5,密度为8.9g/cm3,求临界晶核中的原子数。
4. 试推导杰克逊(K.A.Jackson)方程5. 铸件组织有何特点?6. 液体金属凝固时都需要过冷,那么固态金属熔化时是否会出现过热,为什么?7. 已知完全结晶的聚乙烯(PE)其密度为1.01g/cm3,低密度乙烯(LDPE)为0.92 g/cm3,而高密度乙烯(HDPE)为0.96 g/cm3,试计算在LDPE及HDPE中“资自由空间”的大小。
8欲获得金属玻璃,为什么一般选用液相线很陡从而有较低共晶温度的二元系?9. 比较说明过冷度、临界过冷度、动态过冷度等概念的区别。
10. 分析纯金属生长形态与温度梯度的关系。
11. 什么叫临界晶核?它的物理意义及与过冷度的定量关系如何?12. 简述纯金属晶体长大的机制。
13. 试分析单晶体形成的基本条件。
14. 指出下列概念的错误之处,并改正。
(1) 所谓过冷度,是指结晶时,在冷却曲线上出现平台的温度与熔点之差;而动态过冷度是指结晶过程中,实际液相的温度与熔点之差。
(2) 金属结晶时,原子从液相无序排列到固相有序排列,使体系熵值减少,因此是一个自发过程。
(3) 在任何温度下,液体金属中出现的最大结构起伏都是晶胚。
(4) 在任何温度下,液相中出现的最大结构起伏都是核。
(5) 所谓临界晶核,就是体系自由能的减少完全补偿表面自由能的增加时的晶胚的大小。
(6) 在液态金属中,凡是涌现出小于临界晶核半径的晶胚都不能成核,但是只要有足够的能量起伏提供形核功,还是可以成核的。
《材料科学基础》习题及参考答案

形核功,还是可以成核的。
答案
(7)测定某纯金属铸件结晶时的最大过冷度,其实测
值与用公式ΔT=0.2Tm计算值基本一致。
答案
(8) 某些铸件结晶时,由于冷却较快,均匀形核率N1
提高,非均匀形核率N2也提高,故总的形核率为N=
N1 +N2。
答案
返回
53
(9) 若在过冷液体中,外加10 000颗形核剂,则结晶
❖ ②比较Cu-10% Sn合金铸件和Cu-30%合金铸件的铸造性能 及铸造组织,说明Cu-10% Sn合金铸件中有许多分散砂眼的 原因。
③ω(Sn}分别为2%,11%和15%的青铜合金,哪一种可进行 压力加工?哪种可利用铸造法来制造机件?
答案
返7回8
❖ 9.如下图所示,已知A,B,C三组元固态完全不互溶,质量 分数分别84%A,,10%B,10%C的O合金在冷却过程中将进 行二元共晶反应和三元共晶反应,在二元共晶反应开始时, 该合金液相成分(a点)为60%A,20%B,20%C,而三元共 晶反应开始时的液相成分(E点)为50%A,10%B,40%C。
答案
返回
6
❖ 6.位错受力后运动方向处处垂直于位错线,在运动
过程中是可变的,晶体作相对滑动的方向应是什么
方向?
答案
❖ 7.位错线上的割阶一般如何形成?
答案
❖ 8.界面能最低的界面是什么界面?
答案
❖ 9. “小角度晶界都是由刃型位错排成墙而构成的”这
种说法对吗?
答案
返回
7
三、综合题
❖ 1. 作图表示立方晶体的(123)(0 -1 -2) (421)晶面及[-102][-211][346]晶向。 答案
❖ 9. 在Fe中形成1mol 空位的能量为104. 67kJ,
材料科学基础第三章答案

解:影响形成置换型固溶体影响因素: (1)离子尺寸:15%规律:1.(R1-R2)/R1>15%不连续。2.<15%连续。3.>40%不能形成固熔体。(2)离子价:电价相同,形成连续固熔体。 ( 3)晶体结构因素:基质,杂质结构相同,形成连续固熔体。(4)场强因素。(5)电负性:差值小,形成固熔体。差值大形成化合物。
Ni2O3 2 + 3 +
y 2y y
Ni3+2yNi2+1-3yO Ni3+/Ni2+=2y/(1-3y)=10-x
则y=5×10-5, x=1-y=0.99995, Ni0.99995O
每m3中有多少载流子即为空位浓度:[ ]=y/(1+x)=2.5×10-5。
3-26在 MgO-Al2O3和 PbTiO3-PbZrO3中哪一对形成有限固溶体,哪一对形成无限固溶体,为什么?
解:MgO-AL2O3: ,即rMg、rAl半径相差大,MgO(NaCl型)、AL2O3(刚玉)结构类型差别大,形成有限固溶体;
PbTiO3-PbZrO3形成无限固溶体,因为尽管Ti4+、Zr4+半径相差较大(15. 28),但都是(ABO3)钙钛矿型结构,Ti4+、Zr4+都填充八面体空隙,该空隙体积较大,可填入的阳离子的半径r值可在一定范围内变化,而不至于使结构变化。
(2)围绕每个位错分别作伯氏回路,其结果又怎样?
图3-1
解:略。
3-15有两个相同符号的刃位错,在同一滑移面上相遇,它们将是排斥还是吸引?
解:排斥,张应力重叠,压应力重叠。
3-16晶界对位错的运动将发生怎么样的影响?能预计吗?
材基第三章习题集及标准答案

第三章 作业与习题的解答一、作业:2、纯铁的空位形成能为105 kJ/mol 。
将纯铁加热到850℃后激冷至室温(20℃),假设高温下的空位能全部保留,试求过饱和空位浓度与室温平衡空位浓度的比值。
(e 31.8=6.8X1013)6、如图2-56,某晶体的滑移面上有一柏氏矢量为b 的位错环,并受到一均匀切应力τ。
(1)分析该位错环各段位错的结构类型。
(2)求各段位错线所受的力的大小及方向。
(3)在τ的作用下,该位错环将如何运动?(4)在τ的作用下,若使此位错环在晶体中稳定不动,其最小半径应为多大?解:(2)位错线受力方向如图,位于位错线所在平面,且于位错垂直。
(3)右手法则(P95):(注意:大拇指向下,P90图3.8中位错环ABCD 的箭头应是向内,即是位错环压缩)向外扩展(环扩大)。
如果上下分切应力方向转动180度,则位错环压缩。
A B CDττ(4) P103-104: 2sin 2d ϑτdT s b =θRd s =d ; 2/sin 2θϑd d= ∴ τττkGb b kGb b T R ===2 注:k 取0.5时,为P104中式3.19得出的结果。
7、在面心立方晶体中,把两个平行且同号的单位螺型位错从相距100nm 推进到3nm 时需要用多少功(已知晶体点阵常数a=0.3nm,G=7﹡1010Pa )? (3100210032ln 22ππGb dr w r Gb ==⎰; 1.8X10-9J )8、在简单立方晶体的(100)面上有一个b=a[001]的螺位错。
如果它(a)被(001)面上b=a[010]的刃位错交割。
(b)被(001)面上b=a[100]的螺位错交割,试问在这两种情形下每个位错上会形成割阶还是弯折?((a ):见P98图3.21, NN ′在(100)面内,为扭折,刃型位错;(b)图3.22,NN ′垂直(100)面,为割阶,刃型位错)9、一个]101[2-=a b 的螺位错在(111)面上运动。
材料工程基础第三、五、六章的答案资料

Rk =
D t ln(d 2 / d1 ) = Q 2p kl
通过多层圆筒壁的导热 Q =
2p l (t1 - t4 ) ln(d2 / d1 ) / k1 + ln(d3 / d2 ) / k2 + ln(d4 / d3 ) / k3
7
3-4 一厚度为10 cm的无限大平壁,导热系数k为15W/(m· K)。平 壁两侧置于温度为20℃,表面传热系数h为50W/(m2· K)的流体中, 104W/m3。试确定平壁内的最高温 Q 平壁内有均匀的内热源 =4× 度及平壁表面温度。 解:由于对称性,仅研究壁厚的一半即可。 该问题的数学描写为:
已知:各层的厚度δ1、δ2、δ3,各层的导 热系数 k1 、k2和k3及多层壁两表面的温 度tw1和tw4。 求:各层间分界面上的温度。 ï tw1 - tw 2 d1 ü = ï 解: ï q k1 ï ï ï tw1 - tw 4 d1 d2 d3 ï tw 2 - tw3 d2 ï = + + = ï ý q k1 k2 k3 q k2 ï ï ï tw1 - tw 4 tw3 - tw 4 d3 ï ï q = = ï d1 d2 d3 ï q k3 ï + + ï þ
tw2 d = tw1 - q 1 k1
k1 k2 k3
q=
tw1 - tw( m+ 1)
å
n
i= 1
di ki
t w3 = q
d3 - tw4 k3
5
Rt =
d d1 d d + ( 2 + 3 )- 1 + 4 k1 k2 k3 k4
q=
tw1 - tw 4 d d1 d d + ( 2 + 3 )- 1 + 4 k1 k 2 k3 k4
材料科学与工程基础第三章标准答案

3.8 铁具有BCC晶体结构,原子半径为0.124 nm,原子量为55.85g/mol。
计算其密度并与实验值进行比较。
答:BCC结构,其原子半径与晶胞边长之间的关系为:a = 4R/3= 4⨯0.124/1.732 nm = 0.286 nmV = a3 = (0.286 nm)3 = 0.02334 nm3 = 2.334⨯10-23 cm3BCC结构的晶胞含有2个原子,∴其质量为:m = 2⨯55.85g/(6.023⨯1023) = 1.855⨯10-22 g密度为ρ= 1.855⨯10-22 g/(2.334⨯10-23 m3) =7.95g/cm33.9 计算铱原子的半径,已知Ir具有FCC晶体结构,密度为22.4g/cm3,原子量为192.2 g/mol。
答:先求出晶胞边长a,再根据FCC晶体结构中a与原子半径R的关系求R。
FCC晶体结构中一个晶胞中的原子数为4,ρ= 4⨯192.2g/(6.023⨯1023⨯a3cm3) = 22.4g/cm3,求得a = 0.3848 nm 由a = 22R求得R = 2a/4 = 1.414⨯0.3848 nm/4 = 0.136 nm 3.10 计算钒原子的半径,已知V 具有BCC晶体结构,密度为5.96g/cm3,原子量为50.9 g/mol。
答:先求出晶胞边长a,再根据BCC晶体结构中a与原子半径R的关系求R。
BCC晶体结构中一个晶胞中的原子数为2,ρ= 2⨯50.9g/(6.023⨯1023⨯a3cm3) = 5.96 g/cm3,求得a = 0.305 nm 由a = 4R/3求得R = 3a/4 = 1.732⨯0.305 nm/4 = 0.132 nm3.11 一些假想的金属具有图3.40给出的简单的立方晶体结构。
如果其原子量为70.4 g/mol,原子半径为0.126 nm,计算其密度。
答:根据所给出的晶体结构得知,a = 2R =2⨯0.126 nm = 0.252 nm 一个晶胞含有1个原子,∴密度为:ρ= 1⨯70.4g/(6.023⨯1023⨯0.2523⨯10-21cm3)= 7.304 g/cm33.12 Zr 具有HCP晶体结构,密度为6.51 g/cm3。
材基第三章习题和答案解析
第三章 作业与习题的解答一、作业:2、纯铁的空位形成能为105 kJ/mol 。
将纯铁加热到850℃后激冷至室温(20℃),假设高温下的空位能全部保留,试求过饱和空位浓度与室温平衡空位浓度的比值。
(e 31.8=6.8X1013)6、如图2-56,某晶体的滑移面上有一柏氏矢量为b 的位错环,并受到一均匀切应力τ。
(1)分析该位错环各段位错的结构类型。
(2)求各段位错线所受的力的大小及方向。
(3)在τ的作用下,该位错环将如何运动?(4)在τ的作用下,若使此位错环在晶体中稳定不动,其最小半径应为多大?解:(2)位错线受力方向如图,位于位错线所在平面,且于位错垂直。
(3)右手法则(P95):(注意:大拇指向下,P90图3.8中位错环ABCD 的箭头应是向内,即是位错环压缩)向外扩展(环扩大)。
如果上下分切应力方向转动180度,则位错环压缩。
(4) P103-104: 2sin 2d ϑτdT s b =θRd s =d ; 2/sin 2θϑd d= ∴ τττkGb b kGb b T R ===2 注:k 取0.5时,为P104中式3.19得出的结果。
7、在面心立方晶体中,把两个平行且同号的单位螺型位错从相距100nm 推进到3nm 时需要用多少功(已知晶体点阵常数a=0.3nm,G=7﹡1010Pa )? (3100210032ln 22ππGb dr w r Gb ==⎰; 1.8X10-9J )8、在简单立方晶体的(100)面上有一个b=a[001]的螺位错。
如果它(a)被(001)面上b=a[010]的刃位错交割。
(b)被(001)面上b=a[100]的螺位错交割,试问在这两种情形下每个位错上会形成割阶还是弯折?((a ):见P98图3.21, NN ′在(100)面内,为扭折,刃型位错;(b)图3.22,NN ′垂直(100)面,为割阶,刃型位错)9、一个]101[2-=a b 的螺位错在(111)面上运动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.8 铁具有BCC 晶体结构,原子半径为0.124 nm,原子量为55.85g/mol 。
计算其密度并与实验值进行比较。
a = 4R/J 3 = 4 0.124/1.732 nm 二 0.286 nmV = a 3= (0.286 nm)3= 0.02334 nm P = 2.334 10 23cm 3BCC 结构的晶胞含有2个原子,其质量为:m 二 2 55.85g/(6.023 1023) = 1.855 10 22g密度为 二 1.855 10 22g/(2.334 10 23m 3) =7.95g/cm 3计算铱原子的半径,已知Ir 具有FCC 晶体结构,密度为22.4 g/cm 3,原子量为 192.2 g/mol 。
先求出晶胞边长a ,再根据FCC 晶体结构中a 与原子半径R 的 关系求R 。
FCC 晶体结构中一个晶胞中的原子数为 4,=4 192.2g/(6.023 1023a 3cm 3) = 22.4g/cm 3,求得 a = 0.3848 nm由 a = 2^2 R 求得 R = v2 a/4 = 1.414 0.3848 nm/4 = 0.136 nm 3.10计算钒原子的半径,已知 V 具有BCC 晶体结构,密度为5.96g/cm 3,原子量为 50.9 g/mol 。
答:先求出晶胞边长a ,再根据BCC 晶体结构中a 与原子半径R 的关系求R 。
BCC 晶体结构中一个晶胞中的原子数为 2,=2 50.9g/(6.023 1023a 3cm 3) = 5.96 g/cm 3,求得 a = 0.305 nm 由 a = 4R/J 3 求得 R = 73 a/4 = 1.732 0.305 nm/4 = 0.132 nm 3.11 一些假想的金属具有图3.40给出的简单的立方晶体结构。
如果其原子量为70.4 g/mol ,原子半径为0.126 nm ,计算其密度。
答: BCC 结构,其原子半径与晶胞边长之间的关系为:3.9答:答:根据所给出的晶体结构得知, a = 2R =2 0.126 nm 二0.252 nm一个晶胞含有1个原子,密度为: 二 1 70.4g/(6.023 10230.252310 21cm 3)=7.304 g/cm 33.12 Zr 具有HCP 晶体结构,密度为6.51 g/cm 3。
晶胞的体积为多少?用m 3表示答:cN A对于HCP ,每个晶胞有6个原子,M zr = 91.2g/mol. 因此:V c = ------ 6 --------=1.396 X 128m 3/晶胞6.51 X 1X6.02 X 210(b) V c =3 Xa X sin60a >c=3 冶2X ”3X 1.593=4.1386a 3=4.1386a 3=1.396 X 惱,求得 a =3.231 10 10m = 0.323 nm, c =1.593a =0.515 nm3.13利用原子量,晶体结构,和书中给出的原子半径数据,计算 Pb, Cr, Cu 和Co 的理想密度,并与书中的实验数据做比较。
Co 的c/a之比为1.623。
3.14铑(Rh)的原子半径为0.1345 nm,密度为12.41 g/cm 3。
确定其晶 体结构是否为FCC 或BCC 晶体结构。
(b) 如果c/a 之比为1.593,计算c 和a 值。
6X 91.2答:根据所给出的晶体结构得知, a = 2R =2 0.126 nm二0.252 nm 3.15下面列出的表为3种假定合金的原子量,密度和原子半径。
判断每种合金,其晶体结构是否为FCC ,BCC , 或简单立方,并证明则: n/V C = 8.22 1021g/(1.2857 10 22 g nm 3) = 63.934 nm 32)单个原子质量: 107.6/(6.02 1023) = 1.787 10 22g则: n/V C =13.42 10 21g/(1.787 10 22g nm 3) = 75.098 nm 3若为简单立方: V C = a 3=(2R)3=(2 0.133)3= 0.01882 nm 3则:n = 1.41与简单立方晶胞存在1个原子不符,故不是简单立方结构 。
若为面心立方:V c = a 3=(2V2R)3=(2 1.414 0.133)3= 0.0532 nm 3则: n = 3.996 与面心立方晶胞存在 4个原子相符,因此是面心立方结构 。
3.16锡晶胞具有四方(tetragonal)对称,晶格常数a 和b 各为0.583 和0.318 nm 。
如果其密度,原子量和原子半径各为 7.30 g/cm 3,118.69 g/mol 和0.151 nm ,计算其原子致密度。
答:晶胞体积为: V C = a 2b =0.58320.318 = 0.1081 nm 3合原子量 密度 原子半径(g/mol)(g/cm 3) (nm) A 77.4 8.22 0.125 B 107.6 13.42 0.133 C127.39.230.142你的结论。
简单立方晶胞示在图 3.40 中。
金10 22g 答:(1)单个原子质量: 77.4/(6.02 1023) = 1.2857四方晶胞有几个独立原子:3.17碘具有正交晶胞,其晶格常数 a, b,和c 各为0.479, 0.725和 0.978 nm 。
(a )如果原子致密度和原子半径各为 0.547和0.177 nm, 确定晶胞中的原子数。
(b )碘的原子量为126.91 g/mol;计算其密度。
答:(a )单个原子体积:V= 3 R 3=4X3-14 XO-3=0.0232 nm 3晶胞体积:V C = abc = 0.479 0.725 0.978 = 0.3396im 3晶胞中的原子数为:APFXV C 0.547 X0.3396n=r(b )单个原子体积:献值进行比较。
3.19 Zn 具有HCP 晶体结构,c/a 之比为1.856,其密度为7.13 g/cm 3。
计算Zn 的原子半径。
3.20 Re 具有HCP 晶体结构,原子半径为0.137 nm, c/a 之比为1.615。
计算Re 晶胞的体积。
答: Re 具有 HCP 晶体结构,贝J a = 2R = 2 0.137 = 0.274nm六边形底面积 A: A = a sin60 a 3 = 0.27423 V3/2 = 0.195 nm 2 晶胞的体积:A c = 0.195 1.615 a =0.195 0.274 1.615=8原子/晶胞0.0232nXm V c0.33968X 126.91 X 10g/nm 3二 4.96g/cm 33.18 Ti 具有HCP 晶胞, 其晶格常数之比 c/a 为1.58。
如果Ti 原子的半径为0.1445 nm,⑻ 确定晶胞体积,(b )计算Ti 的密度,并与文=0.0863 nm33.21下面是一个假想金属的晶胞,(a)这一晶胞属于哪个晶系?(b)属于哪个晶体结构? (c)计算材料的密度,已知原子量为141g/mol。
亠卩答:属正方晶系,体心正方结构。
晶胞体积:0.4 0.3 0.3 = 0.036 (nm3)单个原子质量:141g/(6.02 1023) = 2.342 10 22 (g)密度:2.342 10 22/0.036 =3.22 金属间化合物AuCu3晶胞为:(1)边长为0.374 nm的立方晶胞(2)Au原子位于立方体的所有8个角上(3)Cu原子位于立方体6个面的中心。
3.23 金属间化合物AuCu晶胞为:(1)四方晶胞,边长 a = 0.289 nm; c = 0.367 nm(2)Au原子位于立方体的所有8个角上(3)Cu原子位于立方体中心。
3.24 画出体心和正交晶体结构的草图。
3.25对于陶瓷化合物,决定晶体结构的组元离子的两个特征是什么答:离子半径和电荷决定晶体结构3.26证明配位数为4时,阳离子与阴离子半径之比最小值为0.225。
BC = BD = r A + r c ;CBD =109 28BCD = BDC = (180 109 28)/2=35 16CD = 2r Asin 109.47 sin35.27~C D —= BD0.944 0.5772r A r A+r c1.154 r A = 0.944 m + 0.944r c等式两边用r A相除,并整理得:0.21 = 0.944(r c/r A)即有:r c/r A = 0.2233.27证明配位数为6时,阳离子与阴离子半径之比最小值为0.414。
提示:利用NaCI晶体结构,并假设阴离子和阳离子在立方体边和面对角线相切。
则有:如图所示:考虑GHF三角形,GH = r A + r c = HFGF =2r A ;GFsi n45 = GH,则有 2「A V2 = r A + r c等式两边用r A相除:V>1+ r c/r A,即有:r c/r A = 1.414 1 = 0.4140.732。
3.28证明配位数为8时,阳离子与阴离子半径之比最小值为答: 3.29根据离子电荷和离子半径预测下列材料的晶体结构:⑻ CsI (b) NiO (c) KI (d) NiS ,证明结果。
答:r(Cs+): 0.170; r(Ni2+): 0.069; r(K+): 0.138;r(I ): 0.220; r(O2 ): 0.140; r(S2 ): 0.184;(1) 0.732V空二勢=0.773< 1.0;根据阳离子与阴离子之比,每个「「0.22阳离子的配位数是8,预测的晶体结构是氯化铯型晶体结构。
(2) 0.414 < r(Ni+)/r(O2 ) = 0.069/0.14 = 0.493 < 0.732 根据阳离子与阴离子之比,每个阳离子的配位数是6,预测的晶体结构是氯化钠型晶体结构。
(3) 0.414 < r(K+)/r(I ) = 0.138/0.220 = 0.627 < 0.732;根据阳离子与阴离子之比,每个阳离子的配位数是6,预测的晶体结构是氯化钠型晶体结构。
(4)0.225 < r(Ni2+)/r(S2 ) = 0.069/0.184 = 0.375 < 0.414;根据阳离子与阴离子之比,每个阳离子的配位数是4,预测的晶体结构是闪锌矿型。
3.30表3.4中哪些阳离子能够形成氯化铯型晶体结构的碘化物。
1 able 3 4 luinc Riiclii Ibi al Ctitiuns UIK I A IIIUIIA i\ Co()nliii<)Uwi)Nmnber of 6)luttK Rmfins, (HE)Anioit ivttic Jnis伽讪IHErl Br-(» 19GEa-*0,136C10.1810 100F-0 133cv0.17(1[-nZ30F00.0T7O--0 HO0.009s^-0 184K*LH3H曲0.072Mr7NM0,1020.069IHMftTP+0.061氯化铯型晶体结构中,阳离子的配位数为 8,要求阳离子与阴离子的半径之比的范围在 0.732 vr A/r i < 1.0,则 0.732 0.220 vr A V 1.0 0.220,即有:0.161 <“< 0.22。
