材料科学基础第三章2PPT课件
合集下载
材料科学基础第三章.ppt

第三章材料的相结构与相图
同济大学材料科学与工程学院 无机非金属材料研究所
• 3.1 材料的相结构
基本概念:
(1)组元:组成材料的最基本的、独立的物质。
组元可以是纯元素:Cu、Ni、Fe等;
也可以是非金属元素:C、N、B、O等;
或者是化合物
:Al2O3、SiO2、ZrO2等
(2)材料可以是单组元构成:
关键词:聚集状态(冰+水:二相) 晶体结构(不同的相具有不同的晶
体结构)
存在相界面 (理论上各相之间是可以分离的)
• 材料的性能与各组成相的性质、形态、数量 有很大的关系:
• 实例1:
微晶玻璃—— 由玻璃相+微晶相组成
铁碳合金 ——随着铁中碳含量的变化源自通常在0.0218%-6.69%之间),可 以形成各种不同的结晶态物质,如铁素体、 渗碳体、奥氏体等,这些相的形态、数量对 钢材的性能有很大的影响。
各组元质点分布分别按照各自的布拉维点阵进 行排列,整个固溶体就是由各组元的分点阵组成 的复杂点阵,也称超点阵或超结构。
• 3.1.1.1置换型固溶体
• 在理论的指导下,通过对实践经验的积累 总结,针对置换型固溶体的情况,提出了 一些重要的影响因素:
• (1)晶体结构类型 • (2)质点尺寸因素 • (3)化学电负性(化学亲和力) • (4)电价因素
合金组元间的电负性差越大,则倾向于生 成化合物而不利于形成固溶体;生成的化 合物越稳定,则固溶体的溶解度就越小。
只有电负性相近的元素才可能具有较大的溶 解度,有利于形成固溶体。
(通常以以 0.4 作为边界条件)
• (4)电价因素(电子浓度)
定义:电子浓度是指合金中各组成元素的价 电子数总和与原子总数的比值:e/a
同济大学材料科学与工程学院 无机非金属材料研究所
• 3.1 材料的相结构
基本概念:
(1)组元:组成材料的最基本的、独立的物质。
组元可以是纯元素:Cu、Ni、Fe等;
也可以是非金属元素:C、N、B、O等;
或者是化合物
:Al2O3、SiO2、ZrO2等
(2)材料可以是单组元构成:
关键词:聚集状态(冰+水:二相) 晶体结构(不同的相具有不同的晶
体结构)
存在相界面 (理论上各相之间是可以分离的)
• 材料的性能与各组成相的性质、形态、数量 有很大的关系:
• 实例1:
微晶玻璃—— 由玻璃相+微晶相组成
铁碳合金 ——随着铁中碳含量的变化源自通常在0.0218%-6.69%之间),可 以形成各种不同的结晶态物质,如铁素体、 渗碳体、奥氏体等,这些相的形态、数量对 钢材的性能有很大的影响。
各组元质点分布分别按照各自的布拉维点阵进 行排列,整个固溶体就是由各组元的分点阵组成 的复杂点阵,也称超点阵或超结构。
• 3.1.1.1置换型固溶体
• 在理论的指导下,通过对实践经验的积累 总结,针对置换型固溶体的情况,提出了 一些重要的影响因素:
• (1)晶体结构类型 • (2)质点尺寸因素 • (3)化学电负性(化学亲和力) • (4)电价因素
合金组元间的电负性差越大,则倾向于生 成化合物而不利于形成固溶体;生成的化 合物越稳定,则固溶体的溶解度就越小。
只有电负性相近的元素才可能具有较大的溶 解度,有利于形成固溶体。
(通常以以 0.4 作为边界条件)
• (4)电价因素(电子浓度)
定义:电子浓度是指合金中各组成元素的价 电子数总和与原子总数的比值:e/a
材料科学基础第三章典型晶体结构(共71张PPT)

Zn离子的位置交叉错开。
表示方法:球体堆积法;坐标法;投影图;配位多面体连 接方式
与金刚石晶胞的比照 ,有什么不同?
同型结构的晶体β-SiC,GaAs,AlP 等
5、 -ZnS〔纤锌矿〕型结构 〔AB type〕
六方晶系,简单六方格子
配位数:
晶胞中正负离子个数
堆积及空隙情况
同型结构的晶体:BeO, ZnO, AlN等
笼外俘获其它原子或基团,形成类C60的衍生物,例如
C60F60。再如,把K、Cs、Ti等金属原子掺进C60分子 的笼内,就能使其具有超导性能。再有C60H60这些相 对分子质量很大地碳氢化合物热值极高,可做火箭的 燃料等等。
2〕碳纳米管
碳纳米管又称纳米碳管〔 Carbon nanotube,CNT〕,是 单质碳的一维结构形式。碳纳米 管按照石墨烯片的层数分类可分 为:单壁碳纳米管〔Singlewalled nanotubes, SWNTs〕和多 壁碳纳米管〔Multi-walled nanotubes, MWNTs〕。
4. -ZnS〔闪锌矿〕型结构 〔AB type〕 点群:
空间群:
配位数:
晶胞中正负离子个数Z:
堆积及间隙情况:
• 以体积较大的S2-作立方紧密堆积 • Zn2+如何填充? • 空隙如何分布?
等同点分布:
共有2套等同点。这种结构 可以看作是Zn离子处在由S离 子组成的面心立方点阵的4个
四面体间隙中,即有一半四面 体间隙被占据,上层和下层的
晶体结构的描述通常有三种方法:
1〕坐标法:给出单位晶胞中各质点的空间坐标,这种采用
数值化方式描述晶体结构是最标准化的。为了方便表示晶胞, 化学式可写为MO,其中M2+是二价金属离子,结构中M2+和O2-分别占据了NaCl中钠离子和氯离子的位置。 以由体正积 负还较离大子可的半径S以2比-作rN采立a方+/r用紧cl-密≈堆投0.积 影图,即所有的质点在某个晶面〔001〕上的投
表示方法:球体堆积法;坐标法;投影图;配位多面体连 接方式
与金刚石晶胞的比照 ,有什么不同?
同型结构的晶体β-SiC,GaAs,AlP 等
5、 -ZnS〔纤锌矿〕型结构 〔AB type〕
六方晶系,简单六方格子
配位数:
晶胞中正负离子个数
堆积及空隙情况
同型结构的晶体:BeO, ZnO, AlN等
笼外俘获其它原子或基团,形成类C60的衍生物,例如
C60F60。再如,把K、Cs、Ti等金属原子掺进C60分子 的笼内,就能使其具有超导性能。再有C60H60这些相 对分子质量很大地碳氢化合物热值极高,可做火箭的 燃料等等。
2〕碳纳米管
碳纳米管又称纳米碳管〔 Carbon nanotube,CNT〕,是 单质碳的一维结构形式。碳纳米 管按照石墨烯片的层数分类可分 为:单壁碳纳米管〔Singlewalled nanotubes, SWNTs〕和多 壁碳纳米管〔Multi-walled nanotubes, MWNTs〕。
4. -ZnS〔闪锌矿〕型结构 〔AB type〕 点群:
空间群:
配位数:
晶胞中正负离子个数Z:
堆积及间隙情况:
• 以体积较大的S2-作立方紧密堆积 • Zn2+如何填充? • 空隙如何分布?
等同点分布:
共有2套等同点。这种结构 可以看作是Zn离子处在由S离 子组成的面心立方点阵的4个
四面体间隙中,即有一半四面 体间隙被占据,上层和下层的
晶体结构的描述通常有三种方法:
1〕坐标法:给出单位晶胞中各质点的空间坐标,这种采用
数值化方式描述晶体结构是最标准化的。为了方便表示晶胞, 化学式可写为MO,其中M2+是二价金属离子,结构中M2+和O2-分别占据了NaCl中钠离子和氯离子的位置。 以由体正积 负还较离大子可的半径S以2比-作rN采立a方+/r用紧cl-密≈堆投0.积 影图,即所有的质点在某个晶面〔001〕上的投
材料科学基础ppt课件

11
• 这类聚合物是由缩聚反应或开环聚合而成的, 因主链带极性,易水解,醇解或酸解
• 优点:耐热性好,强度高 • 缺点:易水解
• 这类聚合物主要用作工程塑料
12
元素高分子
➢主链中不含碳原子,而是由Si 、B 、As等元素和O元 素组成,但在侧链上含有有机取代基团。这类高分 子兼具无机和有机高分子特性,如有机硅高分子。
• 支化高分子的形式:星形(Star)、 梳形 (Comb)、无规(Random)
23
网状(交联)大分子
• 缩聚反应中有三个或三个以上官能 度的单体存在时,高分子链之间通 过支链联结成一个三维空间网形大 分子时即成交联结构
• 交联与支化有本质区别 支化(可溶,可熔,有软化点) 交联(不溶,不熔,可膨胀)
2
•
3-1 材料组成和结构的基本内容
Principal Contents of Materials Composition and Structures
• 材料的组成: 构成材料的基本单元的成分及数目
• 材料的结构: 材料的组成单元(即原子或分子)之间相互吸引 和相互排斥作用达到平衡时在空间的几何排列。
(2)
结构单元 的键接方式 ( 几何构型 Geometric
Configuration) (链节)
16
加聚
缩聚
• 由以上知:
• 由于高分子是链状结构,所以把简单重复(结构)单元称为“链节”(chains) • 简单重复(结构)单元的个数称为聚合度DP(Degree of Polymerization1
28
无 规 共 聚 ( random)
• 两种高分子无规则地平行联结
ABAABABBAAABABBAAA
• 这类聚合物是由缩聚反应或开环聚合而成的, 因主链带极性,易水解,醇解或酸解
• 优点:耐热性好,强度高 • 缺点:易水解
• 这类聚合物主要用作工程塑料
12
元素高分子
➢主链中不含碳原子,而是由Si 、B 、As等元素和O元 素组成,但在侧链上含有有机取代基团。这类高分 子兼具无机和有机高分子特性,如有机硅高分子。
• 支化高分子的形式:星形(Star)、 梳形 (Comb)、无规(Random)
23
网状(交联)大分子
• 缩聚反应中有三个或三个以上官能 度的单体存在时,高分子链之间通 过支链联结成一个三维空间网形大 分子时即成交联结构
• 交联与支化有本质区别 支化(可溶,可熔,有软化点) 交联(不溶,不熔,可膨胀)
2
•
3-1 材料组成和结构的基本内容
Principal Contents of Materials Composition and Structures
• 材料的组成: 构成材料的基本单元的成分及数目
• 材料的结构: 材料的组成单元(即原子或分子)之间相互吸引 和相互排斥作用达到平衡时在空间的几何排列。
(2)
结构单元 的键接方式 ( 几何构型 Geometric
Configuration) (链节)
16
加聚
缩聚
• 由以上知:
• 由于高分子是链状结构,所以把简单重复(结构)单元称为“链节”(chains) • 简单重复(结构)单元的个数称为聚合度DP(Degree of Polymerization1
28
无 规 共 聚 ( random)
• 两种高分子无规则地平行联结
ABAABABBAAABABBAAA
厦门大学 材料科学基础(二) 第三章-2-b 三元系统相图
生成一个不一致熔融三元化合物的三元系统相图
有双升点的类型
有双降点的类型
具有一个高温分解低温稳定二元化合物的三元系统 相图
熔体M的析晶路程 :
具有一个高温稳定低温分解二元化合物的三元系统 相图
单组元有晶型转变的三元系统相图
只有一个二元连续固溶体的三元系统相图
M1的析晶 过程:
LC+SAB LC+SAB LC L : M1 L L Ln 结晶结束 1 2 沿CM1射线 沿E1E2线 沿E1E2线
S:C
CS 和L 2 M1 2 C F M1 的交点 沿CF 线 沿FM1线
具有液相分层的三元系统相图
p M
界线性质的判断
从界线上任意一点作该界线的切线与对
应的联线(或其延长线)相交,若交点在 相应的两个晶相组成点联线之间,则冷却 时在切点处进行的是低共熔过程;若交点 在联线之外,则在切点处进行的是转熔过 程,远离交点的那个晶相被转熔。
共熔界线用单S1=A+B (低共熔)
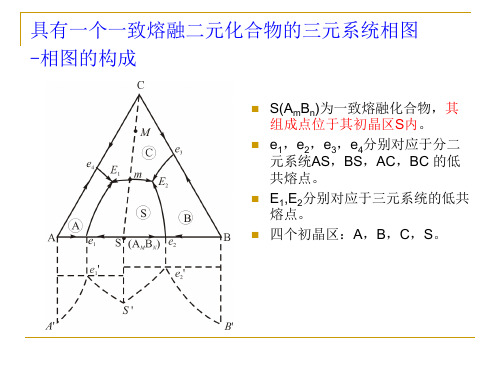
具有一个一致熔融二元化合物的三元系统相图 -相图的构成
S(AmBn)为一致熔融化合物,其 组成点位于其初晶区S内。 e1,e2,e3,e4分别对应于分二 元系统AS,BS,AC,BC 的低 共熔点。 E1,E2分别对应于三元系统的低共 熔点。 四个初晶区:A,B,C,S。
具有一个一致熔三元化合物的三元系统相图
S3:S3=B-A (转熔)
无变量点性质的判断
若无变量点处于相对应的副三角形内的 重心位置,该无变量点为低共熔点;若 无变量点处于相应的副三角形之外,则 是转熔点,而且在交叉位置的是单转熔 点(回吸一种晶相 ),在共扼位置的是 双转熔点(回吸两种晶相) 。 低共熔点:无变量点周围三条界线上的 温降箭头都指向它。 单转熔点(双升点 ):无变量点周围三 条界线的温降箭头有两个指向它,一个 箭头离开它。 双转熔点(双降点):无变量点周围三 条界线的温降箭头有一个指向它,另外 两个箭头离开它。
[课件]材料科学基础 第三章晶体缺陷PPT
![[课件]材料科学基础 第三章晶体缺陷PPT](https://img.taocdn.com/s3/m/6fa4603c10a6f524ccbf8577.png)
2018/12/13
《材料科学基础》CAI课件-李克
11
b. 螺型位错 screw dislocation
位错线bb’:已滑移区和未滑移区的边界线
特征:
1)无额外半原子面, 原子错排是轴对称的 2)分左螺旋位错,符合左手法则;右螺旋位错 ,符合右手法则 3)位错线与滑移矢量平行,且为直线,位错线的运动方向与滑移矢量垂直 4)凡是以螺型位错线为晶带轴的晶带 所有晶面都可以为滑移面。 5) 点阵畸变引起平行于位错线的切应变,无正应变。 6)螺型位错是包含几个原子宽度的线缺陷。
2018/12/13 《材料科学基础》CAI课件-李克 9
3.2.1 位错的基本类型和特征
根据几何结构特征: a. 刃型位错 edge dislocation
b. 螺型位错 screw dislocation
2018/12/13
《材料科学基础》CAI课件-李克
10
a. 刃型位错 edge dislocation
材料科学基础 第三章_晶体缺 陷
第三章 晶体缺陷
Imperfections (defects) in Crystals
It is the defects that makes materials so interesting, just like the human being.
Defects are at the heart of materials science.
1、点缺陷的形成 (production of point defects)
原因:热运动:热振动强度是温度的函数 能量起伏=〉原子脱离原来的平衡位置而迁移别处 Schottky 空位,-〉晶体表面 =〉空位(vacancy)
材料科学基础第三章

• 从纯金属冷却曲线可以看出:金属从液态 冷却到理论凝固温度(熔点)Tm时并不凝固, 而是再降至实际开始结晶温度Tn时才开始 结晶;随后温度回升到接近Tm时出现恒温 结晶(曲线平台),结晶终止后温度继续下降。
• 曲线出现“平台”,是金属液固转变所释 放的潜热与系统散热量相等的结果。
• 在“平台”温度下,液固相不平衡,所以 “平台”温度不是熔点但相差不大。
• 如果只有一粒晶核长大,则由这一粒晶核 长大的金属就是一块金属单晶体。
• 3.1.2 金属结晶的宏观现象
• 金属结晶伴随着一系列宏观特征的改变, 如结晶潜热的释放,融化熵的变化等。研 究这些宏观特征的变化是研究金属结晶过 程的重要手段。
• 3.1.2.1 冷却曲线与金属结晶温度:用热分 析装置将金属融化后缓慢降温,每隔一定 时间记录一次温度,绘制成温度-时间关系 曲线,称为冷却曲线。这种测定冷却曲线 的方法叫热分析法。
金属中,表面能可用表面张力表示。当晶 核稳定时,有:
• σLW=σSW+σSLcosθ
(3-15)
• 形成一个晶核时,总自由能的变化为:
ΔG’=-ΔGBV+ΣσAi
(3-16)
• 晶核体积(球冠体积)为:
• VS=πr3(2-3cosθ+cos3θ)/3
(3-17)
• (VS=πh2(r-h/3), h=r(1-cosθ))
核功越小。
• 在过冷液相中,均匀形核依靠结构起伏形 成大于临界晶核的晶胚;再从能量起伏中
获得形核功形成稳定的晶核。结构起伏和 能量起伏是均匀形核的必要条件。
• 临 但界 晶晶胚核的半最径大尺rk随寸过rm冷ax却度随ΔT过增冷加度而的减增小加;而 增加。如图所示:两条曲线的交点为均匀 形核的临界过冷度ΔT*。当系统过冷度 ΔT<ΔT*时,
材料科学基础第三章 62页PPT文档

• 当温度高于Tm时,GL<GS,固态自动熔化 为液态;当温度低于Tm时,GL>GS,液态 自动转化为固态。
• 单位体积自由能变量ΔGB与过冷度变量ΔT 的关系:
• ΔGB=GL-GS=(HL-HS)-T(SL-SS) • H因L此-H:S=SLLm-(S熔S=化Lm潜/T热m); T=Tm时, ΔGB=0。 • 当 为T常<数Tm,时则,:因为SL-SS的变化很小,可视
• 与均匀形核功ΔG(式3-9)相比,此式多一项 系数: (2-3cosθ+cos3θ)/4
• 讨论:
• 当θ=0时,ΔG’=0,此时固体杂质相当于现 成的核,结晶不需要形核功;
• 当θ=π时,ΔG’=ΔG,此时固体杂质不起促 进晶胚成核作用;
• 一般情况下,θ在0º~180º之间,ΔG’<ΔG。 即非均匀形核比均匀形核所需要的形核功 小,且随θ角的减小而减小。
• 3.3.1.2 临界成核:当r=rk时,晶胚可能消 失,也可能长大,称其为临界晶核。其半
径rk称为临界晶核半径。
• 临界晶核的自由能变化为0,由式(3-9)可得:
• rk=2σ/ΔGB
(3-10)
• 此式表明:临界晶核半径与晶胚的单位面
积自由能成正比;与晶胚的单位体积自由
能变化成反比。
• 因ΔGB=LmΔΤ/Tm
• 3.3.2 非均匀形核 • 金属实际凝固的过冷度一般不超过20ºC,
远远低于均匀形核的0.2Tm。这是由于非均 匀形核的结果。
• 3.3.2.1 非均匀形核 • 的形核功:液相在 • W相基底上形成球 • 冠状的S晶核,其 • 曲率半径为r,接触 • 角(湿润角)为θ。
• 以 晶σ胚LSW与,WσS和W和S与σS液L分相别L之表间示的液界体面与能基。底在W纯,
• 单位体积自由能变量ΔGB与过冷度变量ΔT 的关系:
• ΔGB=GL-GS=(HL-HS)-T(SL-SS) • H因L此-H:S=SLLm-(S熔S=化Lm潜/T热m); T=Tm时, ΔGB=0。 • 当 为T常<数Tm,时则,:因为SL-SS的变化很小,可视
• 与均匀形核功ΔG(式3-9)相比,此式多一项 系数: (2-3cosθ+cos3θ)/4
• 讨论:
• 当θ=0时,ΔG’=0,此时固体杂质相当于现 成的核,结晶不需要形核功;
• 当θ=π时,ΔG’=ΔG,此时固体杂质不起促 进晶胚成核作用;
• 一般情况下,θ在0º~180º之间,ΔG’<ΔG。 即非均匀形核比均匀形核所需要的形核功 小,且随θ角的减小而减小。
• 3.3.1.2 临界成核:当r=rk时,晶胚可能消 失,也可能长大,称其为临界晶核。其半
径rk称为临界晶核半径。
• 临界晶核的自由能变化为0,由式(3-9)可得:
• rk=2σ/ΔGB
(3-10)
• 此式表明:临界晶核半径与晶胚的单位面
积自由能成正比;与晶胚的单位体积自由
能变化成反比。
• 因ΔGB=LmΔΤ/Tm
• 3.3.2 非均匀形核 • 金属实际凝固的过冷度一般不超过20ºC,
远远低于均匀形核的0.2Tm。这是由于非均 匀形核的结果。
• 3.3.2.1 非均匀形核 • 的形核功:液相在 • W相基底上形成球 • 冠状的S晶核,其 • 曲率半径为r,接触 • 角(湿润角)为θ。
• 以 晶σ胚LSW与,WσS和W和S与σS液L分相别L之表间示的液界体面与能基。底在W纯,
材料科学基础 ppt课件

当这对矛盾达到统一时,系统就达到平衡。 因为系统都具有最小自由能的倾向,由此确定的 点缺陷浓度即为该温度下的平衡浓度。
(5)结合键与性能
材料结合键的类型及键能大小对某些性能 有重要影响,主要表现在以下两个方面:
1.物理性能: (1)熔点的高低代表了材料稳定性的程度。物 质加热时,当热振动能足以破坏相邻原子间的稳 定结合时,便会发生熔化,所以熔点与键能值有 较好的对应关系:共价键、离子键化合物的熔点 较高,其中纯共价键金刚石具有最高熔点,金属 的熔点相对较低,但过渡族金属有较高的熔点, 特别是难熔金属W、Mo、Ta等熔点都很高。而具 有二次键结合的材料的熔点一般很低,如聚合物
2.根据排列次序建立了元素周期表,各个周 期中的元素的性质呈现相同的周期变化规 律,元素在周期表上的位置不仅决定了单 个原子的行为,也决定了材料中原子的结 合方式以及材料的化学性能和物理性能。
第二节 原子结合键
一.原子结合键 1.存在状态:凝聚态(液态和固态) 分类 2.一次键:结合力较强,包括离子键、共 价键和金属键。 3.二次键:结合力较弱,包括范德瓦耳斯 键和氢键。
二. 一次键
1.离子键
(1)通过电子转移形成稳定结构,存在于大 多数盐类、碱类和金属氧化物,如NaCI、MgO 、CuO、Mg2Si、CrO2。
(2) 基本特点是以离子为基本结合单位。
(3)一般离子晶体中正负离子静电引力较强 ,结合牢固。因此。其熔点和硬度均较高。 另外,在离子晶体中很难产生自由运动的电 子,因此,它们都是良好的电绝缘体。但当
电子云
原子核
电子云
原子核 a)理论电子云的分布
b)原子偶极矩的产生
4.氢键
氢键是一种特殊的分子间作用力,本质上与
范德瓦耳斯键一样,它是由氢原子同时与两个电
(5)结合键与性能
材料结合键的类型及键能大小对某些性能 有重要影响,主要表现在以下两个方面:
1.物理性能: (1)熔点的高低代表了材料稳定性的程度。物 质加热时,当热振动能足以破坏相邻原子间的稳 定结合时,便会发生熔化,所以熔点与键能值有 较好的对应关系:共价键、离子键化合物的熔点 较高,其中纯共价键金刚石具有最高熔点,金属 的熔点相对较低,但过渡族金属有较高的熔点, 特别是难熔金属W、Mo、Ta等熔点都很高。而具 有二次键结合的材料的熔点一般很低,如聚合物
2.根据排列次序建立了元素周期表,各个周 期中的元素的性质呈现相同的周期变化规 律,元素在周期表上的位置不仅决定了单 个原子的行为,也决定了材料中原子的结 合方式以及材料的化学性能和物理性能。
第二节 原子结合键
一.原子结合键 1.存在状态:凝聚态(液态和固态) 分类 2.一次键:结合力较强,包括离子键、共 价键和金属键。 3.二次键:结合力较弱,包括范德瓦耳斯 键和氢键。
二. 一次键
1.离子键
(1)通过电子转移形成稳定结构,存在于大 多数盐类、碱类和金属氧化物,如NaCI、MgO 、CuO、Mg2Si、CrO2。
(2) 基本特点是以离子为基本结合单位。
(3)一般离子晶体中正负离子静电引力较强 ,结合牢固。因此。其熔点和硬度均较高。 另外,在离子晶体中很难产生自由运动的电 子,因此,它们都是良好的电绝缘体。但当
电子云
原子核
电子云
原子核 a)理论电子云的分布
b)原子偶极矩的产生
4.氢键
氢键是一种特殊的分子间作用力,本质上与
范德瓦耳斯键一样,它是由氢原子同时与两个电
[课件]材料科学基础第三章-2PPT
![[课件]材料科学基础第三章-2PPT](https://img.taocdn.com/s3/m/a2d4973214791711cc7917ef.png)
位错和向错
3.2.1 位错的基本类型和特征
位错的类型: 刃型位错(edge dislocation)(正应变) 螺型位错(screw dislocation) (切应变) 混合位错(mixed dislocation) 向错(复杂应变)
1. 刃型位错
(1)刃型位错(edge dislocation)的产生 完整晶体滑移的理论剪切强度要远高于实际晶体滑移的对应 强度,从而促进了位错理论的产生和发展。 (2) 刃型位错图示: 刃型位错线:多余半原子面与滑移面的交线。 (3)刃型位错特征: ① 刃型位错有一个额外的(多余)半原子面。正刃型位错用 “⊥”表示,负刃型位错用“┬”表示;其正负只是相对而言。 判断用右手定则:食指指向位错线方向,中指指向柏氏矢量 方向,拇指指向多余半原子面方向。 ② 刃型位错是直线、折线或曲线。它与滑移方向、柏氏矢量 垂直。
螺型位错示意图
晶体局部滑移造成的螺型位错
比较
• 刃型位错 • 位错线
– 形状? – 位错线的移动方向?
• 螺型位错 • 位错线
– 形状? – 位错线的移动方向?
• 滑移面
–?
• 滑移面
–?
• 正应变和切应变
• 只有切应变
3.混合位错
(1) 混合位错(mixed dislocation)的图示 (2) 混合位错特征:混合位错可分为刃型分量和螺型分量 , 它们分别具有刃位错和螺位错的特征。 刃:ξ ⊥b ; 螺: ξ ∥b ; 位错环(dislocation loop)是一种典型的混合位错。
3. 柏氏矢量的特性-B
(5) 位错的连续性:可以形成位错环、连接于其他位错、终止 于晶界或露头于表面,但不能中断于晶体内. (6) 可用柏氏矢量判断位错类型 刃型位错: ξ e⊥be,右手法则判断正负 螺型位错: ξ s∥bs,二者同向右旋,反向左旋 (7) 柏氏矢量表示晶体滑移方向和大小.大小|b|,方向为柏氏 矢量 方向。 (8) 刃型位错滑移面为ξ 与柏氏矢量所构成的平面,只有一个; 螺型位错滑移面不定,多个。 (9) 柏氏矢量可以定义为:位错为柏氏矢量不为0的晶体缺陷.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 结晶过程中固相和液相的成分在不断变化, 因此有原子的扩散
07.11.2020
28
二元相图的基本类型
• (2)共晶相图 在二元系统中,两个组元在液相可以无限
互熔,而在固相时,完成互不相熔或只 是有限互熔并发生共晶转变,形成共晶 组织的相图,称为二元共晶相图。
07.11.2020
29
典型的二元共晶相图
07.11.2020
16
二元相图的建立方法:
• 二元相图的测定或建立是根据各种成分材料的 临界点(critical point)绘制的。
• 临界点是表示物质结构状态发生本质变化的临 界相变点。测定材料临界点有两种方法类型: (1)动态法:热分析法(thermal analisis method)、膨胀法、电阻法 (2) 静态法: 金相法、X-ray衍射分析法 这些方法主要 是利用合金在相结构变化时,引起物理性能、 力学性能及金相组织变化的特点来测定。
• 一、相与相平衡 • 1. 相 (Phase) • 在一个系统中,成分、结构相同,性能一致
的均匀的组成部分叫做相,不同相之间有明显 的界面分开,该界面称为相界面。 • 注意: • 相在物理性能和化学性能上是均匀的。 • 相界面和晶界的区别。
07.11.2020
4
2. 相平衡
• 在某一温度下,系统中各个相经过很 长时间也不互相转变,处于平衡状态, 这种平衡称为相平衡。(反之称为非平衡相)
07.11.2020
22
均晶相图分析:
07.11.2020
23
07.11.2020
24
07.11.2020
25
07.11.2020
26
杠杆规则的应用
07.11.2020
27
均晶结晶的特点:
• 固溶体的结晶是在一个温度范围内完成的。
•
纯金属 F=0
•
固溶体 F=1
• 结晶出的固相与共存液相的成分不同
• 组元数 C=1 • 根据相律: F=1-P+2=3-P • ∵F≥0, ∴P≤3 • 若,P=1,则F=2
• ∴可以用温度和压力作坐标的平面图 (pT图) 来表示系统的相图。
若,F=0,则P=3,即最多有三相平衡。
07.11.2020
10
水的相图
07.11.2020
11
07.11.2020
12
• 当然,现在还有使用计算机,通过热力学数据 的计算结果来绘制相图的方法。
07.11.2020
17
热分析法画制Cu-Ni相图
07.11.2020
18
Cu-Pb合金相图
07.11.2020
19
杠杆规则
07.11.2020
20
上式也可写成: wL obC Co w ao Co CL
杠杆规则示意图
f+p=c+n
07.11.2020
7
• 只考虑温度和压力对系统平衡状态的影响:
•
F=C-P+2
• 凝聚系统:
•
F=C-P+1
• 式中的P称为相数,显然在f=0时,
P最大。
07.11.2020
8
几点说明:
• (1)相平衡是研究多相体系的平衡状态如何随 温度、压力和组分浓度等变数而改变的规律;
• (2)相图是根据多相平衡的实验结果而绘制的 几何图形;又称状态图;
07.11.2020
21
二元相图的基本类型
• (1)均晶相图
当两个组元化学性质相近,晶体结构相同,晶格 常数相差不大时,它们不仅可以在液态或熔融 态完全互溶,而且在固态也完全互溶,形成成 分连续可变的固溶体,称为无限固溶体或连续 固溶体,它们形成的相图即为均晶相图 (Isomorphous system)。
15
• 二元相图的表示法
• 如果合金系由A、B两组元组成,横坐标一端 为组元A,而另一端为组元B,那么体系中任 一成分合金都可以在横坐标上找到相应的点。
• 根据国标,二元合金成分可以有两种表示方法: 质量分数(W)和摩尔分数(x)。但通常多数用 质量百分数表示,在没有特别注明,合金成分 都是指质量百分数。若A、B为单质,质量百 分数和摩尔分数之间可以换算 。
07.11.2020
13
07.11.2020
14
二元系相图
• 二元凝聚系统有两个组元,根据相律: • F=C-P+1,二元系统最大的自由度数目
F=2,这两个自由度就是温度和成分。 • 故二元凝聚系统的相图,仍然可以采用
二维的平面图形来描述。即以温度和任 一组元浓度为坐标轴的温度-成分图表示。
07.11.2020
• (3)相图中的平衡状态的概念。只适用于热 力学平衡状态,各相温度相等(热量平衡)、 各相压力相等(机械平衡)、各相化学势相等 (化学平衡)。
• (4)相律只表示体系中组元和相的数目,不 能指明组元和相的类型和含量。
• (5)不能预告反应动力学(即反应速度问 题)。
07.11.2020
9
单元系统的相图
独立组分是指决定一个相平衡系统中多相组成所需 要的最少数目的化学纯物质,它的数目称为独立 组分数,用字母C表示。
按(独立)组元数目,将系统分为:一元系统、二 元系统、三元系统……
07.11.2020
6
• 4 自由度和吉布斯相律
自由度是指在平衡系统中那些独立可变因 素的最大数目,以符号f表示。
吉布斯相律是指处于热力学平衡状态的系 统中自由度与组元数和相数之间的关系 定律:
• 各组元在各相中的化学势相同。
A
AB
热力学动态平衡
07.11.2020
5
• 3.组元与独立组分
• 组元通常是指系统中每一个可以单独分离出来, 并能独立存在的化学纯物质,在一个给定的系统 中,组元就是构成系统的各种化学元素或化合物。
• 化学元素:Cu, Ni, Fe等
• 化合物:Al2O3, MgO, Na2O, SiO2等
07.11.2020
30
二元相图的基本类型
• (3)固溶型相图 特征: 高温时,两个组元在液态和固态都完全互
溶,而低温时,完全互溶的固溶体又分 成两个部分互溶的固溶体。
07.11.2020
31
• 固溶型体系的相图有两种类型: • 一种是包含有共溶型结构的二元系统(共溶型);
第三章材料的相结构及相图 (之二)
07.11.2020
1
本章主要内容
• 相与相平衡的基本概念,杠杆规则; • 二元系统各种类型相图的基本特点和阅
简单三元共晶相图。
07.11.2020
2
为什么要研究相图?
07.11.2020
3
3.2.1相图的基础知识
07.11.2020
28
二元相图的基本类型
• (2)共晶相图 在二元系统中,两个组元在液相可以无限
互熔,而在固相时,完成互不相熔或只 是有限互熔并发生共晶转变,形成共晶 组织的相图,称为二元共晶相图。
07.11.2020
29
典型的二元共晶相图
07.11.2020
16
二元相图的建立方法:
• 二元相图的测定或建立是根据各种成分材料的 临界点(critical point)绘制的。
• 临界点是表示物质结构状态发生本质变化的临 界相变点。测定材料临界点有两种方法类型: (1)动态法:热分析法(thermal analisis method)、膨胀法、电阻法 (2) 静态法: 金相法、X-ray衍射分析法 这些方法主要 是利用合金在相结构变化时,引起物理性能、 力学性能及金相组织变化的特点来测定。
• 一、相与相平衡 • 1. 相 (Phase) • 在一个系统中,成分、结构相同,性能一致
的均匀的组成部分叫做相,不同相之间有明显 的界面分开,该界面称为相界面。 • 注意: • 相在物理性能和化学性能上是均匀的。 • 相界面和晶界的区别。
07.11.2020
4
2. 相平衡
• 在某一温度下,系统中各个相经过很 长时间也不互相转变,处于平衡状态, 这种平衡称为相平衡。(反之称为非平衡相)
07.11.2020
22
均晶相图分析:
07.11.2020
23
07.11.2020
24
07.11.2020
25
07.11.2020
26
杠杆规则的应用
07.11.2020
27
均晶结晶的特点:
• 固溶体的结晶是在一个温度范围内完成的。
•
纯金属 F=0
•
固溶体 F=1
• 结晶出的固相与共存液相的成分不同
• 组元数 C=1 • 根据相律: F=1-P+2=3-P • ∵F≥0, ∴P≤3 • 若,P=1,则F=2
• ∴可以用温度和压力作坐标的平面图 (pT图) 来表示系统的相图。
若,F=0,则P=3,即最多有三相平衡。
07.11.2020
10
水的相图
07.11.2020
11
07.11.2020
12
• 当然,现在还有使用计算机,通过热力学数据 的计算结果来绘制相图的方法。
07.11.2020
17
热分析法画制Cu-Ni相图
07.11.2020
18
Cu-Pb合金相图
07.11.2020
19
杠杆规则
07.11.2020
20
上式也可写成: wL obC Co w ao Co CL
杠杆规则示意图
f+p=c+n
07.11.2020
7
• 只考虑温度和压力对系统平衡状态的影响:
•
F=C-P+2
• 凝聚系统:
•
F=C-P+1
• 式中的P称为相数,显然在f=0时,
P最大。
07.11.2020
8
几点说明:
• (1)相平衡是研究多相体系的平衡状态如何随 温度、压力和组分浓度等变数而改变的规律;
• (2)相图是根据多相平衡的实验结果而绘制的 几何图形;又称状态图;
07.11.2020
21
二元相图的基本类型
• (1)均晶相图
当两个组元化学性质相近,晶体结构相同,晶格 常数相差不大时,它们不仅可以在液态或熔融 态完全互溶,而且在固态也完全互溶,形成成 分连续可变的固溶体,称为无限固溶体或连续 固溶体,它们形成的相图即为均晶相图 (Isomorphous system)。
15
• 二元相图的表示法
• 如果合金系由A、B两组元组成,横坐标一端 为组元A,而另一端为组元B,那么体系中任 一成分合金都可以在横坐标上找到相应的点。
• 根据国标,二元合金成分可以有两种表示方法: 质量分数(W)和摩尔分数(x)。但通常多数用 质量百分数表示,在没有特别注明,合金成分 都是指质量百分数。若A、B为单质,质量百 分数和摩尔分数之间可以换算 。
07.11.2020
13
07.11.2020
14
二元系相图
• 二元凝聚系统有两个组元,根据相律: • F=C-P+1,二元系统最大的自由度数目
F=2,这两个自由度就是温度和成分。 • 故二元凝聚系统的相图,仍然可以采用
二维的平面图形来描述。即以温度和任 一组元浓度为坐标轴的温度-成分图表示。
07.11.2020
• (3)相图中的平衡状态的概念。只适用于热 力学平衡状态,各相温度相等(热量平衡)、 各相压力相等(机械平衡)、各相化学势相等 (化学平衡)。
• (4)相律只表示体系中组元和相的数目,不 能指明组元和相的类型和含量。
• (5)不能预告反应动力学(即反应速度问 题)。
07.11.2020
9
单元系统的相图
独立组分是指决定一个相平衡系统中多相组成所需 要的最少数目的化学纯物质,它的数目称为独立 组分数,用字母C表示。
按(独立)组元数目,将系统分为:一元系统、二 元系统、三元系统……
07.11.2020
6
• 4 自由度和吉布斯相律
自由度是指在平衡系统中那些独立可变因 素的最大数目,以符号f表示。
吉布斯相律是指处于热力学平衡状态的系 统中自由度与组元数和相数之间的关系 定律:
• 各组元在各相中的化学势相同。
A
AB
热力学动态平衡
07.11.2020
5
• 3.组元与独立组分
• 组元通常是指系统中每一个可以单独分离出来, 并能独立存在的化学纯物质,在一个给定的系统 中,组元就是构成系统的各种化学元素或化合物。
• 化学元素:Cu, Ni, Fe等
• 化合物:Al2O3, MgO, Na2O, SiO2等
07.11.2020
30
二元相图的基本类型
• (3)固溶型相图 特征: 高温时,两个组元在液态和固态都完全互
溶,而低温时,完全互溶的固溶体又分 成两个部分互溶的固溶体。
07.11.2020
31
• 固溶型体系的相图有两种类型: • 一种是包含有共溶型结构的二元系统(共溶型);
第三章材料的相结构及相图 (之二)
07.11.2020
1
本章主要内容
• 相与相平衡的基本概念,杠杆规则; • 二元系统各种类型相图的基本特点和阅
简单三元共晶相图。
07.11.2020
2
为什么要研究相图?
07.11.2020
3
3.2.1相图的基础知识
