蛋白质翻译-精
蛋白质翻译后修饰

细胞应激反应
在应激条件下,如氧化应激和DNA损伤, 蛋白质翻译后修饰可以调控应激反应相关蛋 白的活性和功能,从而影响细胞的生存和凋
亡。
THANK YOU
泛素化作用
泛素化可以影响靶蛋白的稳定性、定位、活性以及与其他蛋白质的相互作用,从 而调控细胞内的多种生物学过程,如细胞周期、信号转导和自噬等。
泛素化可以标记受损或不需要的蛋白质,引导其被蛋白酶体降解,从而维持细胞 内蛋白质的平衡。
泛素化调控
泛素化过程受到严格的调控,涉及多种酶的协同作用。这些酶包括E1(泛素活化酶)、 E2(泛素结合酶)和E3(泛素连接酶)。
E3酶在泛素化过程中起着关键作用,它能够识别并结合特定的靶蛋白,将泛素分子准 确地连接到靶蛋白上。
此外,去泛素化酶能够逆转泛素化过程,去除已经结合在靶蛋白上的泛素分子,从而对 泛素化进行动态调控。
05
其他翻译后修饰
乙酰化
总结词
乙酰化是一种常见的蛋白质翻译后修饰,通过将乙酰基团连接到蛋白质的特定氨基酸残基上,可以调节蛋白质的 活性和功能。
翻译后修饰可以影响蛋白质的稳定性 ,通过增加或减少蛋白质的降解速率 ,从而影响细胞内蛋白质的水平和功 能。
蛋白质降解
某些翻译后修饰,如泛素化,可以标 记蛋白质进行降解,通过蛋白酶体途 径降解蛋白质,维持细胞内蛋白质的 动态平衡。
蛋白质功能调控
酶活性调节
亚细胞定位
许多蛋白质在翻译后被修饰以改变其酶活性, 例如,磷酸化可以激活或抑制酶的活性,从 而调控代谢过程和信号转导。
03
疾病与磷酸化
许多人类疾病与蛋白质磷酸化的异常有关。例如,一些癌症和神经退行
性疾病的发生与特定蛋白质的异常磷酸化有关。因此,对蛋白质磷酸化
分子生物学--蛋白质的翻译课件

Initiation requires factors and free subunits
(2)细菌中有三种起始因子 IF-3:稳定30S亚基;辅助 30S亚基与mRNA上起始点特 异性结合; IF-1:与30S亚基结合在A位, 阻止氨酰-tRNA进入;阻止 30S与50S亚基结合。 IF-2:结合特定起始因子 tRNA,控制它进入核糖体; 有核糖体依赖GTP酶活性;
5.1.2 氨酰-tRNA合成酶引入的两种错误
◆蛋白质合成真实性主要决定于:
tRNA能否把正确的氨基酸放到新生多肽链的 正确位置。 ◆氨酰-tRNA合成酶会引入两种错误:
一种是将错误的氨基酸加在正确的tRNA上; 另一种是将正确的氨基酸加在错误的tRNA上。 前者现错的可能性更大。
Error rates differ at each stage of gene expression
Eplroontegiantibo5yn.2tRr.ai3bno蛋ssfoe白rmfer质omm合ovpee成spta的idloyn三l-gtR个mNRA阶NtAo段,aem简xitne介onadcinygl-tRNA
Termination Polypeptide chain is released from tRNA, and ribosome dissociates from mRNA
I: 次黄嘌呤
1.4.4 读码的连续性
生物合成过程中,mRNA的编码方向是 5`→3`,从N端向C端延伸肽链。一条肽链 合成起始后,密码子按3个一框读下去不重 叠也不跳格,直到终止。
2 蛋白质合成中使用的RNA
概述 2.1 mRNA 2.2 tRNA 2.3 rRNA
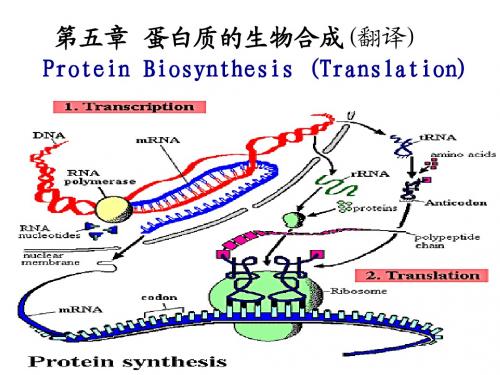
第四章蛋白质的翻译

色氨酸-tRNA的分离
用20种AA-tRNA做20组同样的实验, 每组都含20种AA-tRNA和各种三核苷 酸,但只有一种氨基酸用14C标记,看 哪一种AA-tRNA被留在滤膜上,进一 步分析这一组的模板是哪个三核苷酸, 从模板三核苷酸与氨基酸的关系可测 知该氨基酸的密码子。例如,模板是 UUU时,Phe-tRNA结合于核糖体上, 可知UUU是Phe的密码子。
摆动假说:
在密码子与反密码子的配对中,前两对严格遵守碱基配对原则,第三 对碱基有一定的自由度,可以“摆动”,因而使某些tRNA可以识别1个 以上的密码子;
如果有几个密码子同时编码一个氨基酸,凡是第一、二位碱基不同的 密码子都对应于各自独立的tRNA。原核有30-45种tRNA,真核有50种 tRNA。 I: Inosine is formed by deamination of adenosine after tRNA synthesis
4.2 tRNA
tRNA在蛋白质合成中处于关键地位,它不但为每个三 联密码子翻译成氨基酸提供了接合体,还为准确无误地将 所需氨基酸运送到核糖体上提供了运送载体,所以,它又 被称为第二遗传密码。
tRNA参与多种反应,并与多种蛋白质和核酸相互识 别 ,这就决定了它们在结构上存在大量的共性。
4.2.1 tRNA的结构 1、tRNA的二级结构
1954年科学家对破译密码首先提出了设想: A. 若一种碱基对应与一种氨基酸,那么只可能产生4种氨基酸; B. 若2个碱基编码一种氨基酸的话,4种碱基共有42=16种不同的排列
组合; C. 3个碱基编码一种氨基酸,经排列组合可产生43=64种不同形式; D. 若是四联密码,就会产生44=256种排列组合。
贮 存 在 DNA 上 的 遗 传 信 息 通 过 mRNA 传 递 到 蛋 白 质 上 , mRNA与蛋白质之间的联系是通过遗传密码的破译来实现的。 mRNA上每3个核苷酸翻译成蛋白质多肽链上的一个氨基酸, 这3个核苷酸就称为密码,也叫三联子密码。
9. 蛋白质翻译(1)

摇摆的原因(摇摆假说):
一般地,同义密码子的第1、2位是保守的,而第3位 则是可变的,意味着该可变位点的配对具有一定的灵活 性。
tRNA的反密码子在反密码环上呈弧状排列,与密码子 不能保持完全的平行排列;另外,反密码子的第1个核 苷酸位于非双链结构的松弛环内,摇摆的自由度较大, 从而导致密码子的第3位核苷酸和反密码子的第1位核苷 酸之间形成非标准的碱基配对。(反密码子的这个位点 称为摇摆位点) 如果tRNA的摇摆位点是被修饰的碱基,就可能出现更 多的选择配对关系。
上次讲解内容
一、顺式作用元件与反式作用因子(重点) 二、真核生物RNA的转录过程 三、真核生物RNA转录后加工(重点) 1. 5’加帽; 2. 3’加尾; 3. 选择性剪接; 4. RNA编辑 四、RNA编辑
碱基的突变
C变为U
ApoB 基因有 29 个外显子
CAA
第 2153 个密码子编码 Glu 编辑
T-loop(TψC环)
• 这个环中始终含有胸 腺嘧啶-假尿嘧啶-胞嘧 啶的序列。 • 它与核糖体大亚基的 5S rRNA结合,稳定 蛋白质的结构
D-loop (DHU环)
直接与氨基酰tRNA合成酶
结合,使氨基酸连接到 tRNA的受体位点上。
tRNA与氨基酰tRNA合成酶的结合
氨基酸连接到受体位点上的过程:
UAA
3’UTR
AAA
Open reading frame(开放阅读框), ORF (3’非翻译区)
Stop codon(终止密码) UAG UGA UAA
开放阅读框(open reading frame, ORF): mRNA中从起始密码子(AUG)到终止密 码子(UAA、UAG或UGA)的核酸序列, 它可以编码一条完整的多肽链。
5蛋白质的翻译

proteins,r-proteins)组成,rRNA 组成总分子量的 60%~65%。核糖体的相对大小常常用 沉降系数单位来表示。大肠杆菌的核糖体称为 70S 核糖体,其中的小亚基称为 30S 核糖体, 大亚基称为 50S 核糖体(图 5-8) 。小亚基包含 21 种不同的蛋白质(被称为 S1 一 S21)和 16SrRNA。大亚基由 33 种蛋白质(被命名为 L1~L33)和 23S 及 5SrRNAs 组成(图 5-9)。真核 核糖体称为 80S 核糖体,其中 40S 小亚基包含 33 种蛋白质和 18SrRNA,而 60S 大亚基包含 50 种蛋白质(图 5-9)和 3 种 rRNA (28S, 5.8S 和 5S) 。 真核 5.8SrRNA 与细菌 23SrRNA 的 5SrRNAs 部分同源(表 5.1) 。古细菌核糖体类似于细菌核糖体,但有些包含与真核相同的特别亚基。
组织上,原核生物与真核生物有重要的差别(图 5.1、图 5.2 和图 5.3) 。原核生物的 mRNA 的第一个密码子 AUG 上游的一个重要特征就是 Shine-Dalgarno 序列,而真核生物 mRNA 除
第一个密码子 AUG 的上游是核糖体小亚基扫描 AUG 的信号序列(CCACC)外, 5’端非翻译区 上游为帽子结构, 3’端非翻译区内有多聚腺苷化的信号 AAUAAA 以及其下游的多聚 A 尾巴。 mRNA 是由 DNA 的模板链转录而来, 其序列与编码链相同与模板链互补。 mRNA 的 5’ →3 ’ 三联体密码子序列与蛋白质 N 端到 C 端的氨基酸序列线形相关。原核生物 mRNA 的转录和翻 译发生在时间与空间上具有相对的同一性,其 mRNA 通常不稳定,在合成后的几分钟内翻译 成蛋白质。 真核 mRNA 的合成与成熟都在核内, 成熟的 mRNA 被运往胞质, 作为模板翻译蛋白 质 , 其 稳 定 性 相 对 较 高 , 达 几 小 时 。
分子生物学-蛋白质的翻译课件

详细描述
核糖体通过识别mRNA上的起始密码子与mRNA结合,形成 翻译起始复合物。这个过程需要消耗能量,以确保核糖体正 确地定位在起始密码子上。
起始复合物的形成
总结词
起始复合物的形成是翻译过程的重要步骤,它涉及到多个蛋白质和RNA分子的相互作 用。
详细描述
起始复合物的形成涉及多个步骤。首先,核糖体与mRNA结合后,需要招募翻译起始 因子,如IF3和IF2。这些因子帮助核糖体正确地定位在起始密码子上,并确保翻译的准 确性。随后,氨酰-tRNA结合到核糖体的A位点上,准备开始多肽链的合成。至此,起
肽链的延长
01
02
03
肽键的形成
氨基酸在加入到肽链中后, 通过肽键的形成相互连接, 形成多肽链。
转肽酶的作用
转肽酶在肽键形成过程中 起催化作用,促进氨基酸 之间的连接。
核糖体的移动
随着肽链的延长,核糖体 沿着mRNA移动,确保下 一个密码子被正确识别和 翻译。
终止密码子的识别
终止密码子的种类
终止密码子有UAA、UAG和UGA三种,它们作为翻译终止的信号 被核糖体识别。
翻译的起始
02
起始密码子
总结词
起始密码子是mRNA上的一个特定 序列,用于标记蛋白质合成的起始位 置。
详细描述
起始密码子是mRNA上的三个连续的 核苷酸,通常为AUG。它不仅标记了 翻译开始的位点,还决定了从这里开 始合成多肽链的方向。
核糖体与mRNA的结合
总结词
核糖体是负责蛋白质合成的细胞器,它通过与mRNA的结合 开始翻译过程。
无意义校正是指当mRNA上的终止密码子提前出现时,核 糖体会提前终止多肽链的合成。这种机制有助于减少多肽 链的错误合成。
蛋白质翻译后修饰——末端修饰(氨基末端、羧基末端)——加密版

蛋白质翻译后修饰——末端修饰(氨基末端、羧基末端)(~~by luckyboy)(微生物班、精简打印、元旦巨献版)在核糖体上翻译的时候,当氨基酸添加到新生多肽之后,在体内氨基酸残基会发生各种各样的共价修饰。
I、氨基端的修饰初生蛋白的第一个氨基酸的命运:在细菌中:在细菌中生物合成蛋白质的第一步一般是甲酰甲硫氨酰-tRNAfmet和第二个氨酰tRNA通过肽键合成,因此初生蛋白质存在一个甲酰甲硫氨酰位点。
在真核生物中:虽然N末端甲硫氨酰位点从第一个甲硫氨酸获取在成熟蛋白质中很常见,N末端的α-甲基一般很快会被移除,接着在大多数情况下甲硫氨酸残基会被断裂下来。
这个作用是依靠甲硫氨酸氨基肽酶的作用,并且这个裂解过程由第二个残基控制。
(1)在酵母中(啤酒酵母):如果倒数第二个氨基酸残基有一个0.129nm或更小的回转半径的时候,甲硫氨酸会被完完全全的裂解掉(这些氨基酸有:Gly, Ala, Ser, Cys, Thr, Pro, Val)(3)在真菌或哺乳动物的线粒体中:起始甲硫氨酸的不被去除,但在植物的线粒体中还是会发生的。
在工程菌中:在大肠杆菌中过量表达的蛋白质通过质粒技术会导致一种甲硫氨酸残基保留的不正常现象。
一、乙酰化1.N端a-乙酰基修饰(a-acetyl)在蛋白质中是很普遍的在Ehrlich ascite 细胞中:大概有80%的可溶蛋白是N端a-乙酰基修饰的。
在高等真核生物中:有证据表明在这些细胞中氨基酸末端乙酰化是非常普遍的,几乎可以作为高等真核生物蛋白质的一个典型标志。
在低等真核生物中:N端a-乙酰基的比例比较低,但还是存在的2. N端a-乙酰基化修饰通常是翻译中同时发生的,一般发生在新生肽链大约40个残基长的时候3.N端残基乙酰化修饰的频率(概率)是不同的:一般Ala,Ser > Met,Gly, Asp > Asn,lle,Thr,Val >其他氨基酸残基(1)在高等真核生物中的蛋白质比细菌或真菌中的蛋白质更可能发生乙酰基修饰(2)在大肠杆菌中表达的真核细胞蛋白部分发生乙酰化。
5蛋白质翻译
AAAAAAA-OH
mRNA上存在遗传密码 mRNA分子上从5至3方向,由AUG开始,
每3个核苷酸为一组,决定肽链上某一个氨 基酸或蛋白质合成的起始、终止信号,称 为三联体密码(triplet codon)。
从mRNA 5端起始密码子AUG到3端终止
密码子之间的核苷酸序列,各个三联体密码 连续排列编码一条多肽链,称为开放阅读框 架(open
5' 7 m Gppp
reading frame, ORF)。
编码区 ORF AUG UAA 3' AAA……An
5'非翻译区
3'非翻译区
2、遗传密码的破译
• 基因密码的破译是六十年代分子生物学最辉煌的成就; • 1954年,物理学家George Gamow的数学推理(43=64 ); • 1961年,Brenner和Crick首先肯定了三个核苷酸的推理 ;
U
One tRNA anticodon may pair with as many as three codons.
3、遗传密码的特点
(1)连续性(commaless) :两个密码子之间无 任何核苷酸加以隔开和重叠,如插入/删除 碱基,可发生移码突变或框移
5′…. UACGGACAUCUG….3′
酪 插入 甘 组 蛋
5′….UACCGGACAUCUG….3′
酪 精 苏 半胱
缺失
5′…. UACGACAUCUG….3′
核苷酸结合技术
Nirenberg和Leder,1964
核苷酸结合技术
蛋白质生物合成—翻译及翻译后过程

一、生物合成的模板—mRNA
5′
CAACUGCAGACAUAUAUGAUACAAUUUGAUCAGUAU
3′
-Gln-Leu-Gln-Thr-Tyr-Met-Ile-Gln-Phe-Asp-Gln-Tyr-
遗传密码(genetic code)——能编码蛋白质氨基酸序列的 基因中的核苷酸体系
密码子
(二)真核生物翻译起始复合物形成
1. 起始因子eIF3结合到核糖体(80S) 的小亚基(40S)上,使大亚基 (60S)与小亚基解离
2. 甲硫酰tRNA( Met-tRNAimet )结 合
3. mRNA结合(需帽结合蛋白CBP)
40S
elF-3
② met
Met Met-tRNAiMet-elF-2 -GTP
2. 诱导转肽酶改变为酯酶活性,催化肽酰基转移到-OH上,使 肽链从核蛋白体上释放。
四、核蛋白体循环— 多聚核蛋白体 (polysome)
1. 细胞内一条mRNA链上结合 着多个核糖体
2. 每个核糖体都独立完成一条 多肽链的合成
3. 蛋白质合成高速、高效进行
蛋白质生物合成的调节
1. 阅读框架的漂移、重叠和5’-AUG的作用 2. 翻译错误:氨基酰合成酶校正 3. RNA的结构:帽子、poly (A)尾、空间结构 4. 蛋白质生物合成阻断剂: ① 抗生素类—大环内酯类、氯霉素、氨基糖苷类、四环素 ②抗代谢药物—抗肿瘤药 ③其他生物活性物质—白喉毒素、干扰素
翻译后的加工修饰
新和成的多肽只有经过细胞内各种修饰处理后才 能成为有活性的成熟蛋白质——翻译后加工
1.蛋白质氨基酸侧链的微小改变 2.特定氨基酸残基上添加体积较大的基团 3.剪切 — 从新生肽链上去除不等的氨基酸残基
蛋白质翻译从mRNA到蛋白质的精密过程

蛋白质翻译从mRNA到蛋白质的精密过程蛋白质是构成生物体的基本组成部分,扮演着许多重要功能的角色。
蛋白质的合成过程被称为翻译,它从mRNA(信使RNA)到蛋白质的转换是一个极其精密的过程。
本文将详细介绍蛋白质翻译过程的各个步骤。
1. 信使RNA合成蛋白质翻译过程的第一步是合成mRNA。
在细胞核内,DNA的一个片段被转录成一条对应的mRNA分子。
这个过程称为转录。
mRNA由核糖核酸(RNA)构成,它的结构与DNA类似,但含有尿嘧啶(U)代替胸腺嘧啶(T)。
转录是由RNA聚合酶酶催化的。
2. 剪切和修饰新合成的mRNA分子并不是马上可以进行蛋白质翻译的,它还需要经过一系列的修饰。
这些修饰包括剪切和3'端聚腺苷酸(poly A)尾加工。
剪切是指将mRNA分子中一些无用的片段剪掉,只保留编码蛋白质所需的有效信息。
而3'端聚腺苷酸尾加工是在mRNA的末端附加一串腺苷酸,这个尾部结构有助于mRNA的稳定和翻译的开始。
3. 核外运输修饰完成的mRNA会离开细胞核,通过核孔进入到细胞质中。
这个过程是由核糖体蛋白复合物协助的。
核糖体蛋白复合物将mRNA的运输与mRNA袋装蛋白质的合成进行联系,确保mRNA在核内合成的蛋白质能够顺利地到达其目的地。
4. 蛋白质合成蛋白质的翻译是在细胞质中进行的。
这个过程需要依靠核糖体,核糖体是由核糖体RNA(rRNA)和蛋白质组成的。
核糖体通过识别mRNA上的起始密码子,导致tRNA(转运RNA)结合到起始密码子上。
tRNA上携带着相应的氨基酸,它们会根据密码子对tRNA的互补性配对进行连接。
蛋白质的合成是根据mRNA上的一系列密码子和相应的氨基酸序列进行的。
5. 翻译终止当核糖体到达mRNA上的终止密码子时,翻译会终止,并释放新合成的蛋白质。
终止密码子不编码任何氨基酸,而是指示核糖体停止翻译,并释放蛋白质。
通过这些精密的过程,细胞能够根据基因的指示合成特定的蛋白质。
蛋白质翻译

3、核糖体的活性位点
30S小亚基 头部 基底部 中间有一豁口 50S大亚基 三个突起
• 两者之间形成一个mRNA通道 (Prok.与 Euk.之间互有异同)
• 根据功能将核糖体上的活性部位分为两类 ♪ 翻译区域 7个活性位点 占2/3 ♪ 逐出位点 2个位点(多肽的逐出) 占1/3
tRNA
Ala (GGC)
tRNA
Ala (UGC)
具有G3 :U70 paracodon
--- paracodon 是为AARS(特定氨基酸)所识别的若干 碱基(并非均为一对核苷酸)
--- AARS 对paracodon 的识别与结合是通过氨基酸与 碱基之间的连接实现的。属于生物 II 型空间密码
实验证实—模板mRNA只能识别特异的tRNA而不是AA
[14C]-Cys-tRNACys
Ni
[14C]-Ala-tRNACys
(2) AA– tRNA合成酶(AARS)
★ 需要三种底物 AA tRNA ATP
★ 因此有三个位点 aa binding site tRNA binding site ATP site
多顺反子mRNA(polycistronic mRNA ):
mRNA 分子的组成: • 编码区 起始AUG到终止密码子 • 前导序列 AUG之前的 5’ 端非编码区(5’UTR)
• 尾巴 终止密码子之后,不翻译的 3’ 端
1、 原核生物mRNA的特征 (1) 大部分为多顺反子 spacer: 各顺反子之间(基因之间)的非编码区 长度变化很大 因此,多顺反子的mRNA翻译有两种情况: a、spacer较长时,下一个基因的产物合成起始是独立的 b、spacer长度较短时,两个顺反子使用相同的核糖体或小 亚基( 相当…………,有S-D 序列的特征) 所以-----Prok中多顺反子mRNA中各基因的产物数量不一 定相等
蛋白质翻译机制的精准性概述

蛋白质翻译机制的精准性概述李建永(潍坊科技学院/山东省高校设施园艺实验室寿光262700)摘要蛋白质是细胞和生物体功能的重要执行者,若蛋白质的翻译过程出现差错就会造成灾难性的后果。
生物机体的众多机制保障了翻译过程的精确无误,本文概述蛋白质翻译机制的精准性。
关键词蛋白质翻译mRNA模板精准性蛋白质种类繁多、结构复杂,参与生物体内众多的生化反应,是细胞和生物机体功能的重要执行者。
一旦翻译过程出现问题就会生成错误的蛋白质,进而会造成灾难性的后果。
那么,哪些机制保障了蛋白质翻译过程的精准性呢?1模板序列的准确性1.1mRNA序列的正确性mRNA是蛋白质翻译的模板,其携带信息的精确性是蛋白质准确翻译的基础’DNA转录生成的前体mRNA要经历一系列复杂的剪接、加工和修饰过程。
例如,真核生物的前体mRNA要经历5,端加帽、3,端加尾、内含子切除等加工过程后才成为成熟的mRNA*1〕。
这也保证DNA存储的遗传信息准确无误地传递到翻译的模板一RNA。
1.2校正基因的作用当编码蛋白质的结构基因发生变异时,通常会合成错误的蛋白质。
大量的研究结果表明,一种蛋白质的结构基因发生变异后,所产生的错误结果往往可以被第二次变异所校正,由此所产生的基因叫校正基因[2]o校正变异如果发生在结构基因内,称之为“基因内校正”;而校正变异发生在另外一个基因上,则称之为“基因间校正”。
基因内校正是通过第二次变异来修正基因本身产生的错误;而基因间校正则是通过校正tRNA来实现对目标基因的校正的。
2氨基酸与tRNA结合的专一性氨酰tRNA合成酶(aaRS)保证了氨基酸与tRNA 结合的专一性,体现在两个方面,即aaRS的识别和矫正功能。
2.1氨酰tRNA合成酶的识别功能在翻译过程中,»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»»主要参考文献[1]中华人民共和国教育部.普通高中生物学课程标准(2017年版)*M].北京:人民教育出版社,2018:2-5.[2]刘丹.试论高中生物学教材基于核心素养的情境创设——holt M c D ougal版bioiogk遗传部分的启示[J].中学生物教学,2018,12(3):4-7.[3]中华人民共和国教育部.普通高中通用技术课程标准(2017年版)*M].北京:人民教育出版社,2018: 4.0tRNA负责与特定氨基酸结合,并将它们运送到核糖体,此过程由氨酰tRNA合成酶介导。
蛋白质翻译生物化学

疾病发生与治疗
蛋白质翻译的异常与多种疾病的发生和发展密切 相关,如癌症、神经退行性疾病等。因此,对蛋 白质翻译的研究有助于深入理解疾病机制,为疾 病治疗提供新的思路和靶点。
激素调控
一些激素如生长激素和胰岛素可以影响氨基 酸的合成。
05
蛋白质合成的调控
蛋白质合成的调控机制
转录水平调控
通过调节基因的转录,控制蛋白质合成的数量。
转录后水平调控
通过控制mRNA的稳定性、翻译和降解,影响蛋白质的合成。
翻译后水平调控
通过蛋白质的磷酸化、乙酰化等修饰,影响蛋白质的功能。
蛋白质合成的抑制剂
蛋白质翻译的未来展望
1 2 3
新技术发展
随着新技术的发展和应用,蛋白质翻译的研究将 更加深入和精确,有望发现更多未知的蛋白质翻 译机制和功能。
跨学科融合
蛋白质翻译涉及到多个学科领域,未来将有更多 的跨学科融合,推动蛋白质翻译研究的发展和应 用。
个性化医疗
随着个性化医疗的兴起,蛋白质翻译的研究有望 为个体化诊断和治疗提供更精确和有效的方案。
02
遗传密码与tRNA
遗传密码的特性
简并性
遗传密码具有简并性,即一种密码子只能决定一种氨基酸,但一 种氨基酸可能由一种或多种密码子决定。
通用性
遗传密码在不同生物中具有通用性,即生物界中的绝大多数生物都 使用相同的遗传密码。
连续性
遗传密码的阅读具有连续性,即从左到右按照三联体密码的顺序逐 个读取。
蛋白质翻译在医学研究中的应用
疾病诊断与治疗
蛋白质翻译的异常与多种疾病的发生和发展密切相关,通 过对蛋白质翻译的研究可以为疾病诊断和治疗提供新的思 路和方法。
蛋白质翻译的过程与调控

蛋白质翻译的过程与调控蛋白质翻译是生物体内重要的生物化学过程之一,它在维持细胞功能和机体生命活动中起着重要的作用。
蛋白质翻译的过程涉及到多种生物分子的相互作用和调控,使得细胞能够根据需要合成适量的特定蛋白质。
在这篇文章中,我们将探讨蛋白质翻译的过程以及它的调控机制。
一、蛋白质翻译的过程蛋白质翻译是将基因信息转化为蛋白质的过程,它主要包括三个阶段:初始化、延伸和终止。
1. 初始化初始化是蛋白质翻译的第一个阶段,它涉及到启动子、核糖体和氨基酸tRNA的相互作用。
在这一阶段,启动子序列位于mRNA的开头部分与核糖体结合,通过识别mRNA上的起始密码子,选择适当的氨基酸tRNA进入翻译复合体。
2. 延伸延伸是蛋白质翻译的第二个阶段,它涉及到肽链的不断延伸。
在这一阶段,核糖体将位于mRNA上的三联密码子与适当的氨基酸tRNA 配对,通过肽键的形成将氨基酸连接成多肽链。
这一过程不断重复,直到遇到终止密码子终止翻译。
3. 终止终止是蛋白质翻译的最后一个阶段,它涉及到终止密码子与释放因子的结合,使翻译复合体解离。
当核糖体遇到终止密码子时,特定的释放因子(RF)结合到终止密码子上,导致蛋白质链从tRNA上释放出来,翻译过程结束。
二、蛋白质翻译的调控蛋白质翻译的调控是指细胞在不同生理和环境条件下对蛋白质合成速率和特定蛋白质合成的调节。
调控机制可以通过多个层面来实现,从转录水平的调控到翻译水平的调控。
1. 转录水平的调控转录水平的调控是指通过调控mRNA的合成和降解来调控蛋白质翻译的过程。
这可以通过调节转录因子的活性、调控RNA聚合酶的结合和启动子的可及性来实现。
例如,某些转录因子的结合可以促进启动子的转录,从而增加mRNA的合成量。
此外,miRNA和siRNA等小RNA分子也可以通过与mRNA结合,抑制其在翻译过程中的参与。
2. 翻译水平的调控翻译水平的调控是指通过调控翻译复合体的组装和运动来调控蛋白质翻译的过程。
蛋白质的翻译和翻译后修饰

蛋白质的翻译和翻译后修饰蛋白质是细胞中最基本的生物大分子,参与了生物体内几乎所有的生命活动。
蛋白质的合成涉及到翻译过程和翻译后修饰两个主要步骤。
一、蛋白质的翻译蛋白质的翻译是指将mRNA上的遗传信息转化为氨基酸序列的过程。
这一过程主要发生在细胞质中的核糖体上。
1. 启动子与小核仁RNA(rRNA)的结合:翻译开始前,mRNA的5'端结合到核糖体小亚基上的小核仁RNA,形成启动复合体。
这一步骤确保正确的起始点和适当的翻译框架。
2. 外显子剪接和核糖体扫描:mRNA经过剪接后,转录内含子被去除,形成成熟的mRNA转录本。
核糖体扫描该mRNA,寻找起始密码子(AUG),确定翻译开始位置。
3. 起始复合物形成:核糖体识别起始密码子并与亚单位Met-tRNAiMet结合,形成起始复合物。
这一复合物包含大、小核糖体亚基以及tRNAiMet。
4. 转移rna(tRNA)结合:核糖体在mRNA上滑动,直到识别到一个新的密码子。
合适的tRNA通过抗密码子与mRNA上的密码子配对,保证正确的氨基酸被加入到蛋白质链上。
5. 肽键形成和elongation:肽键的形成是翻译的关键步骤,它由蛋白合成酶催化,将新到达的氨基酸与蛋白质链上的上一氨基酸连接起来。
步骤重复进行,直到到达终止密码子。
6. 翻译终止:终止密码子标志着蛋白质链的结束。
在终止密码子到达时,核糖体与复合物解离,蛋白质链被释放,并经过后续的修饰和折叠。
二、蛋白质的翻译后修饰蛋白质翻译后经历一系列修饰过程,使其成为活性蛋白质并能够履行其功能。
1. 氨基酸修饰:氨基酸修饰包括磷酸化、甲基化和乙酰化等。
这些修饰可以改变蛋白质的稳定性、活性以及与其他分子的相互作用。
2. 糖基化修饰:糖基化修饰是将糖基添加到蛋白质上,形成糖蛋白。
糖蛋白在细胞识别、细胞黏附和信号传导等过程中起着重要作用。
3. 蛋白质折叠:翻译后的蛋白质链通常处于未折叠的状态,需要经过蛋白质折叠过程才能形成稳定的三维结构。
