药典分析方法验证和确认usp37 1225 1226
USP〈1226〉药典规程的确认

USP〈1226〉药典规程的确认<1226> VERIFICATION OF COMPENDIAL PROCEDURES药典规程的确认The intent of this chapter is to provide general information on the verification of compendial procedures that are being performed for the first time to yield acceptable results utilizing the personnel, equipment, and reagents available. This chapter is not intended for retroactive application to already successfully established laboratory procedures. The chapter Validation of Compendial Procedures<1225> provides general information on characteristics that should be considered for various test categories and on the documentation that should accompany analytical procedures submitted for inclusion in USP-NF. Verification consists of assessing selected analytical performance characteristics, such as those that are described in chapter <1225>, to generate appropriate, relevant data rather than repeating the validation process.本章节的目的是提供关于药典规程确认的信息,这些规程是第一次执行,使用可用的人员、设备、试剂,来生成可接受的结果。
药典分析方法确认与验证

通过分析含有高于和低于必需的检测水平的、已知待分析物浓度的样品,以显示检测限度足够低。例如,如果必需检测浓度在0.1%的杂质,则应当证明该分析规程将可靠地检测在这个水平的杂质。
药典分析方法确认与验证
D
精密度、线性等内容的验证,证明修订后的分析方法的合理可行。
当变更达到一定程度时,则需要完整的验证。如分析方法完全改变,则应按新方法进行完整的验证。
方法验证的一般原则:
通常情况下,分析方法需进行方法验证。对于仅需按照实验室日常测试操作步骤即可测定的检验项目不需要进行验证,如外观、崩解时限、密度、重量、pH值、灰分、装量等。
对于展示出背景噪音的仪器分析规程,ICH文件描述了一个通用方法,用来比较从以下样品测得的信号,这些样品分别为含已知低浓度被分析物的样品和空白样品。这样就确立了能够可靠检测的待分析物的最低浓度。可接受的典型信噪比是2:1或3:1。其他方法取决于校正曲线斜率的测定和响应值的标准差。
5QUANTITATION LIMIT定量限度
第一类:对成药中原料药或活性成分(包括防腐剂)的主要组分进行定量测定的分析规程。
第二类:对成药中原料药或降解物质中杂质进行测定的分析规程。这些规程包括定量测定和限度测定。
第三类:对工作特性(例如,溶出度、药物释放)进行测定的分析规程。
第四类:鉴别测试。
每一个类别均需要不同的分析信息。每个种类通常所需要的数据要素在表2中列出。
分析工作特性
第二类
第一类
定量测试
限度测试
第三类
第四类
准确度பைடு நூலகம்
USP40 1226 药典的确认中英文对照

1226 VERIFICATION OF COMPENDIAL PROCEDURES药典方法的确认The intent of this general information chapter is to provide general information on the verification of compendial procedures that are being performed for the first time to yield acceptable results utilizing the personnel, equipment, and reagents available.此章节的意图是对药典方法的确认提供基本资料,使用人员,设备和试剂使第一次进行运用药典方法以产生可接受的结果。
This chapter is not intended for retroactive application to already successfully established laboratory procedures. The chapter Validation of Compendial Procedures <1225>provides general information on characteristics that should be considered for various test categories and on the documentation that should accompany analytical procedures submitted for inclusion in USP–NF.Verification consists of assessing selected analytical performance characteristics, such as those that are described in chapter <1225>to generate appropriate, relevant data rather than repeating the validation process.此章节并不旨在对已经成功建立的实验室方法进行回顾性运用。
药典方法确认规程
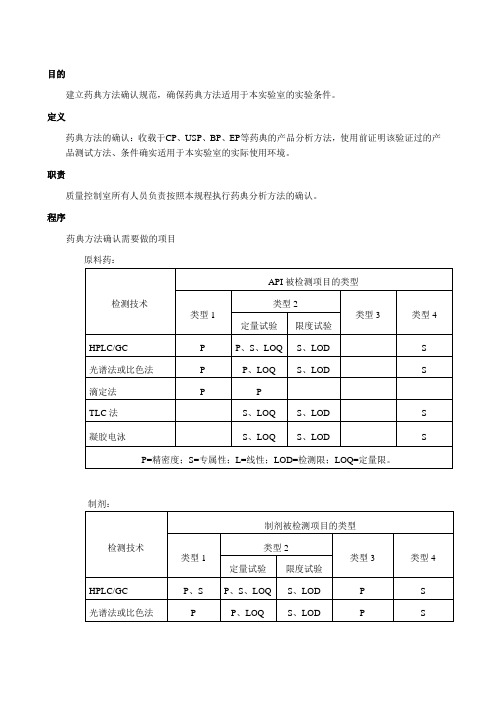
目的建立药典方法确认规范,确保药典方法适用于本实验室的实验条件。
定义药典方法的确认:收载于CP、USP、BP、EP等药典的产品分析方法,使用前证明该验证过的产品测试方法、条件确实适用于本实验室的实际使用环境。
职责质量控制室所有人员负责按照本规程执行药典分析方法的确认。
程序药典方法确认需要做的项目原料药:制剂:被检测项目类型的说明:系统适用性实验按药典正文要求的内容进行;正文没有要求的内容,如RSD%,按药典附录的要求进行。
专属性系指在其他成分(如杂质、降解物、辅料等)可能存在下,采用的分析方法能够正确鉴定、检出被分析物质的特性。
通常,鉴别、杂质检查、含量测定方法中均应考察其专属性。
如采用的方法不够专属,应采用多个方法予以补充。
鉴别反应专属性鉴别试验应确证被分析物符合其特征。
专属性试验要求证明能与可能共存的物质或结构相似化合物区分,需确证含被分析物的供试品呈正反应,而不含被测成分的阴性对照呈负反应,结构相似或组分中的有关化合物也应呈负反应。
杂质检测专属性在杂质可获得的情况下,可向供试品中加入一定量的杂质,证明杂质与共存物质能得到分离和检出,并具适当的准确度与精密度。
在杂质或降解产物不能获得的情况下,专属性可通过与另一种已证明合理但分离或检测原理不同、或具较强分辨能力的方法进行结果比较来确定。
或将供试品用强光照射,高温,高湿,酸、碱水解及氧化的方法进行破坏(制剂应考虑辅料的影响),比较破坏前后检出的杂质个数和量。
必要时可采用二极管阵列检测和质谱检测,进行色谱峰纯度检查。
含量检测专属性➢对于API主成分含量测定可在供试品中加入杂质,考察测定结果是否受干扰,并与未加杂质的供试品比较测定结果;在杂质或降解产物不能获得的情况下,可采用另一个经验证了的或药典方法进行比较,对比两种方法测定的结果。
也可采用破坏性试验(强光照射,高温,高湿,酸、碱水解及氧化),得到含有杂质或降解产物的试样,用两种方法进行含量测定,比较测定结果。
药品分析方法的验证和确认标准操作规程
目的:方法验证的目的是证明采用的方法适合相应检测要求;方法确认目的是为确认方法在本实验室条件下的适用性。
应用范围:适用于本公司产品的检验方法。
编订依据:《中国药典》2010年版二部附录194页。
内容:1 分析方法的验证及确认的适用范围及发起时机2 方法验证方法验证就是根据检验项目的要求,预先设置一定的验证内容和验证标准要求,并通过设计合理的实验来验证所采用的分析方法是否答合检验项目的要求。
建立质量标准时,应对分析方法中的各检验项目进行完整的验证;在药品生产工艺变更、制剂的组分变更、原分析方法进行修订时,可根据变更的内容决定对分析方法进行部分验证还是完整的验证;当原料药合成工艺发生变更时,可能引入新的杂质,杂质检查方法和含量测定方法的专属性就需要进行验证,以证明有关物质检查方法能够检测新引入的杂质,且新引入的杂质对主成分的含量测定应无干扰;当质量标准中某一项目分析方法发生部分改变时,如采用高效液相色谱法测定含量时,检测波长发生改变,则需要重新进行检测限、定量限、专属性、准确度、精密度、线内容的验证,证明修订后的分析方法的合理可靠;当变更达到一定程度时,则需要完整的验证。
如分析方法完全改奕,则应按新方法进行完整的验证。
2.1 方法验证的一般原则通常情况下,分析方法需进行方法验证。
对于仅需按照实验室日常测试操作步骤即可测定的检验项目不需要进行验证,如外观、崩解时限、密度、重量、pH值、灰分、装量等。
方法验证的内容应根据检验项目的要求,结合所采用分析方法的特点确定。
同一分析方法用于不同的检验项目会有不同的验证要求。
2.2 需要验证的检验项目检验项目是为控制药品的质量,保证药品安全有效而设定的测试项目。
根据检验项目的设定目的和验证内容的不同要求,一般需验证的检验项目分为四类:鉴别、杂质的限度检查、杂质的定量测定、含量测定包括原料药或制中有效成分的含量,制中其他成分的含量,溶出度与释放度等检查中的溶出量,以及含量均匀度。
药典分析方法验证和确认usp37--1225-1226

药典分析方法验证和确认usp37 1225 1226 <1225>药典分析方法验证用于评价药物质量的检验方法应符合一定要求。
根据联邦食品、药品、化妆品第501条的规定,在美国药典(USP)和国家处方集(NF)的正文检验方法和规定为法定标准。
按照现行药品生产管理规范有关条文[21 CFR 211.194(a)]要求,用于评价药品是否符合既定标准规定的分析方法应具有一定准确性和可靠性。
按照该要求[21 CFR 211.194(a)(2)],USP和NF分析方法使用者不必验证方法的准确性和可靠性,但要确认在实际使用条件下的适用性。
考虑到USP和NF标准法定地位这一基本情况,所以,药典品种新方法或修订方法得建议,应由充分实验室数据支持,以说明方法有效。
本指导通则内容尽可能与三方国际协调会(ICH)关于在欧盟、日本和美国注册申报资料要求中与分析方法部分有关的分析方法验证和方法学文本一致。
药典申报新的或修订的分析方法得药典申报,应报送充分的资料,以便美国药典委员会专家理事会及其专家委员会建议的方法是否清晰完整,需要建立该方法的结论,以及方法验证文本。
方法类型不同,申报要求可能不同,一般包括下列内容:理由写明需要本方法的理由、用途以及与其他方法比较的优点。
修订的方法应写明现行药典方法的局限性以及建议方法得优点。
建议的分析方法应完整详细地写明建议的分析方法,以便他人依法操作。
文字应包括全部重要的操作参数和有关事项以及明确的试验结果计算公式。
数据元素本部分要求提供详细、完整的分析方法验证文件,文件应包括实验数据及各适用的分析方法运行特性计算结果。
运行特性在下文中叙述。
验证分析方法验证是通过实验室研究证明该分析方法的运行特性符合其分析应用要求的过程。
表1中列出了本文分析方法验证需考虑的典型分析运行特性。
由于对术语有不同的理解和用法,本通则以下部分包括各运行特性的定义以及衡量特性的方法描述。
定义与“测定结果”有关。
分析方法验证与确认管理规程

分析方法验证与确认管理规程0 目录1 目的 (1)2 适用范围 (1)3 定义 (1)4 职责 (2)5 规程内容 (3)6 环境、健康和安全EHS............................................................................ 错误!未定义书签。
7 相关文件................................................................................................... 错误!未定义书签。
8 附件........................................................................................................... 错误!未定义书签。
9 变更历史记录........................................................................................... 错误!未定义书签。
1 目的为保证检测方法的适用性、重现性和可行性,特制订本规程。
本规程明确了检验方法验证的基本内容和测试方法,为检验方法验证、确认工作明确了基本原则。
2 适用范围2.1 对检验方法进行方法学验证时;2.2 对在研产品的检验方法进行复核确认时;2.3 对首次使用的药典、国标等检验方法进行确认时。
3 定义3.1 检验方法验证:证明采用的方法适用于相应检测要求。
3.2 检验方法确认:证明使用法定方法在目前实验室条件下是否能获得可靠结果,是否适用于相应的检测工作。
在本质上和验证一样,但不一定是验证项目的全部。
3.3 药典方法:经过国家药监部门批准的药典收载的质量标准和检验方法3.4 法定方法:法定方法包括药典方法、国标方法等。
USP 1225 - 药典规程的验证

1225药典规程的验证用于评价药品质量水平的检验规程受到多方面要求影响。
根据联邦食品、药品和化妆品法案501章,由美国药典和国家处方集各论中的含量测定和质量标准构成了法定标准。
现行GMP[21 CFR 211.194(a)]要求,用于评价药物与已建立标准符合性的检测方法,必须符合在准确度和可靠性方面的适当标准的要求。
根据这些法规[21 CFR 211.194(a)(2)],在美国药典-国家处方集中有描述的分析方法无需验证这些方法的准确度和可靠性,而仅需要核查在实际使用条件下的实用性。
认识到美国药典和国家处方集的法律地位,因此,建议采用新的或是修订的药典分析规程,以充分的实验室数据支持记录方法的有效性。
本信息章节的内容最大程度的与三方国际会议(ICH)的文件《分析规程验证》和《方法学》的延伸内容保持一致,涉及到的分析规程包括欧盟、日本和美国提交的注册申请的一部分。
药典意见书关于新的或修订的分析规程的药典意见书应该包括充足的信息,使美国药典专家理事会及其专家委员会的成员能评估拟议规程的相对优势。
大多数情况下,验证涉及到评估分析规程描述的清晰性和完整性,需要此规程的确定性,和已恰当验证过的文件。
信息可根据涉及到的方法类型而改变。
然而,大部分情况下,提交建议包括以下部分:基本原理—这部分内容应该确定规程的需要性,描述提出的此规程的性能和它优于其他类型的原因。
对于修订的规程,应提供相比之下现行药典规程的局限和拟定规程的优势。
拟定分析规程—这一部分应该充分对分析规程进行完整性描述,具体到能使业内人士重复它。
文章应包括所有重要的操作参数和具体指令,如:试剂制备、进行系统稳定性试验、所用空白的描述、预防措施、实验结果计算的明确公式。
数据要素—这一部分应提供完全的、完整的此分析规程验证的文件材料。
其应该包括对于证明每个实用分析性能特征的实验数据和计算的总结。
这些特性在下面的部分描述。
验证一个分析规程的验证是建立和实验室研究的过程,该程序的运行特性满足预定分析程序的要求。
检验分析方法的验证和确认

检验分析方法的验证和确认分析方法的验证和确认内容一、法规要求二、分析方法验证三、分析方法确认四、分析方法验证和确认总结一、法规要求:新版GMP(2010年修订)第二百二十三条物料和不同生产阶段产品的检验应当至少符合以下要求:(一)企业应当确保药品按照注册批准的方法进行全项检验。
(二)符合下列情形之一的,应当对检验方法进行验证。
1. 采用新的检验方法;2. 检验方法需变更的;3. 采用《中华人民共和国药典》及其他法定标准未收载的检验方法;4. 法规规定的其他需要验证的检验方法。
(三)对不需要进行验证的检验方法,企业应当对检验方法进行确认,以确保检验数据准确、可靠。
法规要求:中国药典(2010年版)凡例1. 检验方法和限度。
2. 二十三、本版药典正文收载的所有品种,均应按规定的方法进行检验。
如采用其他方法,应将该方法与规定的方法做比较试验,根据试验结果掌握使用,但在仲裁时仍以本版药典规定的方法为准。
法规要求:分析方法确认或验证相关指南二、分析方法验证1. 分析方法验证的定义2. 分析方法验证的目的3. 分析方法验证范围4. 分析方法验证的时机5. 需验证的分析方法类型6.分析方法验证的具体内容7. 验证检测项目小结8. 分析方法验证的方式和步骤9. 分析方法验证常见问题1. 分析方法验证的定义是根据检测项目的要求,预先设置一定的验证内容,并通过设计合理的试验来验证所采用的分析方法能否符合检测项目的要求。
2. 分析方法验证的目的(1)证明采用的分析方法是科学、合理。
(2)证明分析方法能有效控制药品的内在质量。
验证过程和结果均应记载在标准起草或修订说明中。
3. 分析方法验证范围(1)适用范围:化学药品的理化分析方法和仪器分析方法的验证与确认;清洁验证方法的验证。
(2)不适用:化学药品的微生物方法;生物制品分析方法验证。
4. 分析方法验证的时机(1)建立新的药品质量标准;(2)药品生产工艺变更;(3)制剂的组分变更;(4)对原分析方法进行修订时。
方法验证”和“方法确认”其实不一样

方法验证〞和"方法确认〞其实不一样!"方法验证和方法确认到现在还混淆不清?那简直弱爆了!本文小析姐教你几招,告诉你两者最大的区别是什么?国内外方法验证和确认的参数有何不同,分别有什么步骤?很多实验室认为方法确认或验证困难重重原因有?......方法验证和确认的定义方法验证〔Validation of method〕USP:方法验证是一个通过实验室研究来证明程序的性能参数符合期望的分析应用要求的过程.ICH:分析方法验证的目的是显示分析方法适用于它所期望的应用目的.FDA:方法验证是一个阐述分析方法适合于其使用目的的过程.方法确认〔Verification of method〕USP<1225>:USP-NF所收载方法的使用者不需要验证这些方法的准确性和可靠性,但需要确认这些方法在实际使用条件下的适应性.USP<1226>:确认包括所涉与方法的性能参数,如那些在<1225>中描述的,以建立恰当的、相应的数据,而不是重复验证的过程.FDA:出现在USP中的方法被认为已验证,对于法定方法,厂家必须阐明该方法在实际使用情况下的状态.总体来讲,方法验证是阐明方法适合于它使用目的的一个过程,方法确认是通过已验证的方法进行检测的条件确实适合于该已验证方法的过程.方法验证的步骤方法的确认的步骤〔1〕详细说明有关要求〔指的是我们得知道我们要满足的"特定要求〞是什么,其中包括客户要求〕〔2〕确定检测和/或校准方法的特性;〔3〕检查核实使用该方法能够满足有关要求;〔4〕声明有效性如果我们对于所使用新的非标准方法进行了如上的确认,则在适用X围内就不需要对后期使用再进行确认了.〔当然,如发现方法特性变差等可能方法不适用时,需要重新确认〕.标准方法也需做进一步的验证?ISO/IEC 17025 要求:"应优先使用以国际、区域或国家标准发布的方法.〞,这些标准方法被认为已经得到验证.因此,许多技术人员错误地认为标准方法不需要在实验室中做任何进一步的验证、证实或试验即可投入使用.ISO/IEC 17025 在5.4.2 中有类似的要求:"在引入检测或校准之前,实验室应证实能够正确地运用这些标准方法.如果标准方法发生了变化,应重新进行证实.〞这里明确了标准方法只要不发生变更,不需要进行验证,但实验室应确认其有能力成功运行该方法.当决定选择什么样的证实方式最好时,问题又来了.全部的验证试验都要重做?是否需要重做部分验证试验,还是全部的验证试验都要重做?或者仅仅系统适用性试验或质控样品结果满意是否足够,这些都不清楚.ISO/IEC 17025在中也给出相应的注解:用于确定某方法性能的技术应当是下列之一,或是其组合:1.使用参考标准或标准物质〔参考物质〕进行校准;2.与其他方法所得的结果进行比较;3.实验室间比对;4.对影响结果的因素作系统性评审;导致很多实验室认为方法确认或验证困难重重原因有?1〕法规标准的翻译问题,导致理解存在偏差,比如CNAS-CL01:2006中所描述的"证实〞即与"确认〞同义;2〕部分法规标准未作详细说明,比如《实验室资质认定评审准则》;3〕方法确认和方法验证定义不清,概念搞混;4〕国人缺乏研究心态,有点困难就逃避,懒惰之心严重." 标准方法的确认和评价〞也应该有作业指导书与内部制定方法的验证相同,标准方法的确认和评价也应该遵循文件化的程序,如确认计划或作业指导书.方法验证、确认和转移到底有啥联系?相对于方法验证来说,方法确认类似于方法验证的简化版,且方式更灵活.但是实验室最终该如何做好方法验证或确认,还需要各实验室对相关法规标准与参考文献进行深入的研究,制定适合自身的作业指导书并严格执行.将方法验证、确认和转移简单总结如下:任何分析检测的目的都是为了获得稳定、可靠和准确的数据,方法验证在其中起着极为重要的作用.方法验证的结果可以用于判断分析结果的质量、可靠性和一致性,这是所有质量管理体系不可分割的一部分.一般在下列情况下,要求对分析方法进行验证、确认〔或称证实〕或重新验证:1〕首次用于常规检测前;2〕转到另一个实验室时;3〕对于验证过的方法,其条件或方法参数发生变化时〔例如,仪器性能参数发生改变或样品基质不同时〕,并且这种变化超出了方法的原适用X围.实验室应对非标准方法确认国内第三方检测机构一般均非标准制修订机构,方法验证或确认的来源基本来自资质认定或实验室认可的要求,主要依据如下:CNAS-CL01:2006方法选择:实验室制定的或采用的方法如能满足预期用途并经过确认,也可使用.所选用的方法应通知客户.在引入检测或校准之前,实验室应证实能够正确地运用这些标准方法.如果标准方法发生了变化,应重新进行证实.l 5.4.5.2 实验室应对非标准方法、实验室设计〔制定〕的方法、超出其预定X围使用的标准方法、扩充和修改过的标准方法进行确认,以证实该方法适用于预期的用途.确认应尽可能全面,以满足预定用途或应用领域的需要.实验室应记录所获得的结果、使用的确认程序以与该方法是否适合预期用途的声明.CNAS-CL10:2012《检测和校准实验室能力认可准则在化学检测领域的应用说明》5.4.2 方法的选择:b> 实验室应对首次采用的检测方法进行技术能力的验证,如检出限、回收率、正确度和精密度等.如果在验证过程中发现标准方法中未能详述但影响检测结果的环节,应将详细操作步骤编制成作业指导书,作为标准方法的补充.当检测标准发生变更涉与到检测方法原理、仪器设施、操作方法时,需要通过技术验证重新证明正确运用新标准的能力.5.4.5 方法确认: a> 任何对标准方法的偏离,都必须进行实验室确认,即使所采用的替代技术可能具有更好的分析性能. b> 实验室应通过试验方法的检出限、精密度、回收率、适用的浓度X围和样品基体等特性来对检测方法进行确认.CNAS-CL09:2013要求:标准方法引入检测之前,实验室应证实能够正确地运用这些方法,并未清晰说明如何证实,而对非标方法的确认提供的参考资料.除化学领域明确规定应对标准方法进行确认或验证外,其他领域仅要求对非标方法进行确认或验证,或者未做规定,而且对确认和验证是否有区别也未作说明.但是CNAS-CL52:2014是与CNAS-CL01:2006同步应用的,具有等同效力,因此其他领域如未对标准方法确认或验证进行规定的,应参考CNAS-CL52执行.实验室为啥要进行方法验证!对于实验室而言,我们要应该非常的清楚我们是否有能力来满足客户的预期需求〔用途〕,这个是最基本的.因此,我们就会涉与到对方法的评审问题,即评审我们是否有能力完成客户提出的要求.客户没有指定所用方法当客户没有任何指定所用方法时,毫无疑问,我们也是要选择〞采用满足客户需求并适用于所进行的检测或校准活动的方法〞.1.这个时候我们会首当其冲采用国际、区域或国家、行业等标准〔由标准化组织发布的〕方法.但是当我们第一次拿到这个标准的时候,也就是说我们从来没有依照此方法开展过检测活动,那怎么办?我们是壮着胆、拍着胸脯告诉客户——没问题,我们可以做,还是直接拒绝客户呢?或许这样的结果都会出现,但是请记住无论实验室在做出哪个回答时,请你要认真的去证明下你的结论,要给出你的证明材料和论据来论证你是"有能力〞还是"没有能力〞完成这个检测任务,而这个过程——即针对标准方法,实验室在准备依照该方法实施检测或校准时,证明能够正确应用这些方法,就是叫做方法验证或证实.该如何证明我们能正确应用所选标准方法?这个问题倒是不难来证明,因为所谓的操作指南——标准都已经摆在你面前了,就看标准中所要求的条件〔环境条件,包括样品保存条件等〕、资源〔设备,材料,标准物质等〕我们是否可以满足,当然还有一个非常重要的因素,就是是否有"人〞能够有能力利用这些资源在该条件下做出满足标准中要求的指标内容,如检出限、测量X围等.通俗为"人、机、料、法、环、样〞等进行验证.如果在现行没有特别有效的标准方法时,我们也可能会选择知名机构或科学文献和期刊公布的方法、仪器设备厂商指定的方法找出合适的方法,又可使用实验室内部制定的方法,这些方法都可以称为非标准方法.当实验室在采用这些方法的时候,则需要依据实际情形采取不同的方式来"证明〞——实验室所采用〔选择〕的方法能够满足客户的预期用途.方法的验证<证实>和非标准方法的确认最大的区别?通俗的讲,标准方法的验证<证实>和非标准方法的确认最大的区别是,对于前者实验室可以依"葫芦画瓢〞,方法的特性指标、应用X围等有关权威组织都帮你完成了,而对于后者,你只能通过"自身〞努力来证实你所用的方法,不论自创还是"模仿〞,能够真正满足客户的要求.方法验证是否有时间要求,是否一次验证终身有保障?目前的确对方法验证没有时间的要求,一定要说多久做一次,有的人也说5年,那是基于认为中国的标准是5年一次审查,但实际上10年也许都不会变一次.因此没有对时间硬性固定.但绝对不会是终身保障.明白我们做验证的目的是要证明我们有能力完成测试认为,获得准确结果,可是当实验室因数据问题遭到投诉、控制图显示QC异常或能力验证离群,则我们要考虑我们的是否出问题呢?此时安排一次给出全面的检测——方法验证,来评估下我们的能力是否退步了,当然此时也针对其它资源的核查也是必要的,如环境条件等.是否每一次测试对象发生变化或偏离都要进行确认呢?显然是要进行确认了,只不过是确认的方式会有差异.但是不能笼统的统一规定都应该要怎么做,而是要依照实际情况,譬如偏离的内容是什么、对哪些资源带来挑战等.如有些测试中要求使用某个品牌的设备而实验室是另外一个品牌,且该检测员有过操作这两种类型设备的经历,则确认就非常的简单,或者标准是针对球面的外观检查,现要求对桌面的外观进行检查,则此次关注的是"人〞,如有此能力应当可以实施.以上是否要完成确认报告不尽然,用其他简便方式亦可.。
usp37---1224分析方法转移

u s p37---1224分析方法转移(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--<1224>分析方法转移程序前言对辅料、中间体和/或药物成分和产品进行检验确定是否符合质量标准,对确定制剂成品的质量非常重要。
分析方法转移程序(TAP),通常也称作方法转移,该程序就是记录一个实验室(接收方)能够使用由另一个实验室(转移方)所开发检验方法的过程,并确保接收实验室知道检验程序并有能力按规定进行检验。
该节内容的目的是总结可能存在的分析方法转移的类型,包括可能不需要进行任何核查,概述转移方案中需包含的内容。
该节不包括统计方法,也不包含对微生物和生物检验方法的转移。
分析方法转移类型进行分析方法转移有好几种方法。
其中最常用的方法是:对从生产批次取出的同批次样品或为检验专门制备的样品(例如:将相对准确的一定量的已知杂质添加到样品中),两个实验室同时检验并进行对比。
其他方法包括:实验室间一起进行验证;接收方进行完整或部分的分析方法验证;或有充分理由证明不需进行分析方法转移。
将要转移的方法,需考虑到转移工作的程度以及执行的方法,之前的经验,接收方的情况、产品的复杂性和规格标准以及相应的方法等内容根据风险分析来进行。
对比试验需要转出方和接收方同时对同一批次的样品进行检验(需要进行的检验批次数应预先规定)。
其他的方法也可能有效,例如:对于一个掺了杂质的产品,接收方测定的杂质回收率符合预先规定的标准。
所进行的分析应根据预先批准的转移方案来进行,方案中规定程序的具体细节,应使用的样品和预先规定的标准,包括可接受的变异性。
满足预定验收标准是必要的,以确保接收方能进行检验。
两个实验室或多个实验室间的共同验证进行分析方法验证的实验室要求可以使用检验方法。
生产企业可让接收方参与多个实验室的共同验证工作,包括让接收方在转移方中作为验证小组的成员,因此需进行重现性的评估并获得相关数据。
检验方法确认美国药典usp1225

验证: Validation 针对新方法(没有法定方法, 需要用户自己建立的) 按照ICH Q2 或USP<1225>的方式均可; 主要是需要满足使用目的.<1225>VALIDATION OF COMPENDIAL PROCEDURES药典规程的验证Test procedures for assessment of the quality levels of pharmaceutical articles are subject to various requirements. According to Section 501 of the Federal Food, Drug, and Cosmetic Act, assays and specifications in monographs of the United States Pharmacopeia and the National Formulary constitute legal standards. The Current Good Manufacturing Practice regulations [21 CFR 211.194(a)] require that test methods, which are used for assessing compliance of pharmaceutical articles with established specifications, must meet proper standards of accuracy and reliability. Also, according to these regulations [21 CFR 211.194(a)(2)], users of analytical methods described in USP-NF are not required to validate the accuracy and reliability of these methods, but merely verify their suitability under actual conditions of use. Recognizing the legal status of USP and NF standards, it is essential, therefore, that proposal for adoption of new or revised compendial analytical procedures be supported by sufficientlaboratory data to document their validity.评估药品质量水平的实验方法受到多种要求的影响。
药品生产验证指南有哪几个版本

药品生产验证指南有哪几个版本引言药品生产验证是确保药品质量和安全性的关键步骤之一。
各国药品监管机构和国际组织努力制定相应的指南和要求,以规范药品生产验证的过程。
本文将介绍药品生产验证指南的几个主要版本。
国际药典委员会(USP)验证指南国际药典委员会(USP)是负责制定和发布全球药典的国际组织。
USP的验证指南提供了一套严格的规则和标准,用于验证药品生产流程中的各个环节。
USP验证指南主要包括以下几个版本:P 1225 验证分析方法–该版本指导制药企业验证药品分析方法的准确性、可靠性和适用性。
它提供了一种结构化的方法,用于评估分析方法的各个方面。
P 1226 验证化学方法–该版本专门用于验证药品制剂中的化学方法,以确保其质量和一致性。
它涵盖了各种药品制剂的验证流程,包括原料药、中间体和最终制剂。
P 1210 验证计算机系统–该版本关注计算机化系统在药品生产验证中的应用。
它提供了验证计算机系统的方法和要求,以确保其功能和合规性。
P 1111 药品生产验证–该版本是药品生产验证的主要指南,提供了用于验证整个药品生产流程的方法和步骤。
它包含了质量控制、工艺验证、设备验证等方面的要求。
国际标准化组织(ISO)验证指南国际标准化组织(ISO)是一个制定国际标准的非政府组织。
ISO的验证指南对药品生产验证提供了国际通用的标准和指导。
以下是几个重要的ISO验证指南版本:1.ISO 14644 纯洁度等级–该版本规定了洁净室中颗粒物浓度的等级划分,以及验证和监测方法。
洁净室是药品生产过程中关键的环境控制区域,这个指南帮助制药企业确保洁净室符合要求。
2.ISO 13485 医疗器械质量管理体系–该版本是医疗器械行业的质量管理指南,也适用于药品生产中使用的医疗器械。
它提供了一个管理体系的框架,用于确保医疗器械的质量和安全性。
3.ISO 14971 风险管理–该版本关注药品生产过程中的风险管理。
它提供了一套方法和步骤,用于识别、评估和控制潜在的风险,以确保药品的质量和安全性。
USP1223-微生物替代方法的验证

USP1223-微⽣物替代⽅法的验证微⽣物替代⽅法的验证本章的⽬的是为官⽅法定微⽣物学⽅法的替代⽅法的验证提供指导。
由于如经济、产量、⽅便等各种原因,对于那些通论⾥的微⽣物回收率和鉴定,微⽣物检验实验室有时候会使⽤其他的检测⽅法。
对于这些⽅法的验证是必要的。
通⽤需知中的检测和分析部分提供了对这些替代⽅法的验证指导。
这部分内容中提到,如果发⽣争议,以法定⽅法的结果为准。
替代微⽣物学⽅法的验证研究应考虑到⼤量的变量,例如使⽤传统的平⽫计数法进⾏微⽣物检测时,其结果的RSD(15%~30%)经常会⽐常⽤的化学分析的RSD (1%~3%)⼤。
许多传统的微⽣物学⽅法都受制于取样误差、稀释误差、涂平⽫误差、培养误差和操作误差。
法定⽅法的验证定义了准确度、精密度、专属性、检测限、定量限、线性、限度、重现性和稳定性在分析⽅法中应⽤的特征。
这些定义不太适⽤于⾄少等价于法定⽅法的替代微⽣物学⽅法验证,此替代⽅法给出了相似性质的问题(参阅“通⽤的关系”中检测和分析的步骤部分)。
关键问题是替代⽅法得到的结果是否等价于,甚⾄好于传统⽅法得到的结果。
其他⾏业组织也提供了替代⽅法的验证指南*。
⼀个新的或改良的⽅法的适⽤性要经过该替代⽅法与美国药典法定⽅法的⽐较来证明。
本章定义的⼀些特性可能被⽤于建⽴这种⽐较。
微⽣物学检测的种类对检测中以替代⽅法命名的部分进⾏鉴别对验证来说很重要。
⽐如说,很多技术都可⽤来鉴定活细胞的存在。
这些技术可能应⽤于各种检测(如⽣物负载,⽆菌检测),但实际上他们不能完全代替检测中的重要部分。
⽐如说,⼀个⽤滤膜过滤的⽆菌检测可能⽤法定⽅法进⾏到把加⼯过的滤器和回收培养基放⼀起,然后活细胞的存在可能⽤⼀些可⽤的技术来证明。
这个应⽤的验证就要求验证所应⽤的回收系统⽽不是整个检测。
对于微⽣物学检测有三种特殊的测定,包括样品中是否有微⽣物的判定检测;微⽣物数量的定量检测(或样品中特殊亚群的计数)和⽤于鉴定微⽣物种类的检测。
药典分析方法确认与验证

药典分析方法确认与验证分析方法的验证和确认主要内容:分析方法的验证分析方法的确认分析方法的转移方法验证、方法确认和方法转移的文件管理【背景介绍】只有经过验证或确认的分析方法,才可以用于物料和产品的检验以及清洁验证。
检验方法必须经过验证或确认是物料和产品放行的前提之一。
因为只有经过验证或确认的分析方法才可以可靠有效地用于控制药品的内在质量。
分析方法:分析方法是为完成检验项目而设定和建立的测试方法,它详细描述了完成分析检验的每一步骤。
一般包括分析方法原理、仪器及仪器参数、试剂、供试品溶液与对照品溶液等的制备、测定、计算公式及限度要求等。
不同分析方法各有特点,同一分析方法可用于不同的检验项目,但验证内容会有不同。
例如,采用高效液相色谱法进行药品的鉴别和杂质定量检验,两检验项目在方法验证时要求不同。
前者重点要求验证专属性,而后者则需要重点验证专属性、准确度和定量限。
【适用范围】适用于:化学药品(包括物料和产品)的理化分析方法和仪器分析方法的验证与确认。
清洁验证方法的验证。
生物制品分析方法验证。
不适用于:化学药品的微生物方法,【方法验证】方法验证就是根据检验项目的要求,预先设置一定的验证内容和验证标准要求,并通过设计合理的实验来验证所采用的分析方法是否符合检验项目的要求。
建立质量标准时,应对分析方法中的各检验项目进行完整的验证。
当药品生产工艺变更、制剂的组分变更、原分析方法修订时,可根据变更的内容决定对分析方法进行部分验证还是完整的验证。
当原料药合成工艺发生变更时,可能引入新的杂质,杂质检查方法和含量测定方法的专属性就需要进行验证,以证明有关物质检查方法能够检测新引入的杂质,且新引入的杂质对主成分的含量测定应无干扰。
当质量标准中某一项目分析方法发生部分改变时,如采用高效液相色谱法测定含量时,检测波长发生改变,则需要重新进行检测限、定量限、专属性、准确认、精密度、线性等内容的验证,证明修订后的分析方法的合理可行。
美国药典新通则_1224_122_省略_中药痕量分析质量保证体系中的作用_左甜甜

美国药典新通则<1224><1225><1226>分析方法转移、验证和确认及其在中药痕量分析质量保证体系中的作用*左甜甜,金红宇**,许明哲,马双成**(中国食品药品检定研究院,北京100050)摘要:中药中有害物质痕量残留分析不同于常规的常量或微量分析,对于分析技术要求较高。
进一步规范该类分析工作,做好实验室质量控制,是保证分析结果的准确与可靠的重要前提。
本文以最新版美国药典(USP37-NF32)通则<1224><1225>和<1226>为基础,介绍了分析方法转移、验证和认证的内容,讨论了三者之前的联系与区别,重点探讨了对于中药痕量分析的参考意义及技术要求。
关键词:实验室质量控制;转移;验证;确认;中药;痕量分析;外源性有害残留检测中图分类号:R 917 文献标识码:A 文章编号:0254-1793(2016)05-0868-05doi:10.16155/j.0254-1793.2016.05.19Transfer,validation and verification of analytical procedures described in General chapter<1224><1225><1226> of U.S.Pharmacopoeia (USP37-NF 32)and their significances for trace analysis assurance system of traditional Chinese medicines* ZUO Tian-tian,JIN Hong-yu**,XU Ming-zhe,MA Shuang-cheng**(National Institutes for Food and Drug Control,Beijing 100050,China)Abstract:Traditional Chinese medicine trace analysis is different from either conventional constant or trace analysis,which requires much higher analysis technology,and the well quality control of laboratory are important prerequisties for the accuracy and reliability of analysis results,which isimportant prerequisites for the quality control of laboratory.This article focused on the General Chapter<1224><1225><1226> of the latest version of U.S.Pharmacopoeia 37/ National Formulary(USP37-NF32)and introduced the technical requirements of“transfer of analytical procedures”,“validation of compendial procedures”and“verification of compendial procedures”.In addition,the article further discussed the interconnections and differences among the three analytical methods,and mainly explored their reference significance and technical requirements on trace analysis of traditional Chinese medicines.Keywoods:laboratory quality control;transfer;validation;verification;trace analysis;traditional Chinese medicines;detection of extrinsic harmful residues * 国家十二五“重大新药创制”课题“中药质量安全检测和风险控制技术平台”(2014ZX09304307-002) ** 通信作者 金红宇 Tel:(010)67095994;E-mail:jhyu@马双成 Tel:(010)67095272;E-mail: masc@ 第一作者 Tel:(010)67095994;E-mail: zuotiantian2011@中药外源性有害残留物分析多属于痕量分析范畴,目前我国主要依赖于药典及相关标准的分析方法进行检测分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药典分析方法验证和确认usp37 1225 1226 <1225>药典分析方法验证用于评价药物质量的检验方法应符合一定要求。
根据联邦食品、药品、化妆品第501条的规定,在美国药典(USP)和国家处方集(NF)的正文检验方法和规定为法定标准。
按照现行药品生产管理规范有关条文[21 CFR 211.194(a)]要求,用于评价药品是否符合既定标准规定的分析方法应具有一定准确性和可靠性。
按照该要求[21 CFR 211.194(a)(2)],USP和NF分析方法使用者不必验证方法的准确性和可靠性,但要确认在实际使用条件下的适用性。
考虑到USP和NF标准法定地位这一基本情况,所以,药典品种新方法或修订方法得建议,应由充分实验室数据支持,以说明方法有效。
本指导通则内容尽可能与三方国际协调会(ICH)关于在欧盟、日本和美国注册申报资料要求中与分析方法部分有关的分析方法验证和方法学文本一致。
药典申报新的或修订的分析方法得药典申报,应报送充分的资料,以便美国药典委员会专家理事会及其专家委员会建议的方法是否清晰完整,需要建立该方法的结论,以及方法验证文本。
方法类型不同,申报要求可能不同,一般包括下列内容: 理由写明需要本方法的理由、用途以及与其他方法比较的优点。
修订的方法应写明现行药典方法的局限性以及建议方法得优点。
建议的分析方法应完整详细地写明建议的分析方法,以便他人依法操作。
文字应包括全部重要的操作参数和有关事项以及明确的试验结果计算公式。
数据元素本部分要求提供详细、完整的分析方法验证文件,文件应包括实验数据及各适用的分析方法运行特性计算结果。
运行特性在下文中叙述。
验证分析方法验证是通过实验室研究证明该分析方法的运行特性符合其分析应用要求的过程。
表1中列出了本文分析方法验证需考虑的典型分析运行特性。
由于对术语有不同的理解和用法,本通则以下部分包括各运行特性的定义以及衡量特性的方法描述。
定义与“测定结果”有关。
分析方法的叙述应写清该方法得测定结果是什么。
ISO5725-1和3534-1指出,“测定结果是用特定测定方法得到的特性值。
分析方法应规定进行一次还是数次单独测定,作为测定结果报告的平均值,或其他适宜函数(如,中位数或标准偏差)。
可能要求做标准校正,如气体体积校正到标准温度和压力时的体积。
所以测定结果可以是数个观察值的计算结果。
简单试验时,测定结果就是观察值本身”。
测定结果是用于与标准规定限度比较的最终报告值,但偶有例外。
物理性质测定方法验证可能包括化学计量模型。
方法验证中用到的典型分析特性可用于基于化学计量模型的方法。
表1 分析方法验证用典型分析特性准确度精密度专属性检测限定量限线性范围耐用性用代表性样品进行分析方法验证时,应考虑工艺条件和物料差异的影响。
下列情况下,药典分析方法应进行再验证:报送USP的修订分析方法;或将已有通用方法用于新产品或新物料制成的产品(见下文方法所需数据元素部分)。
国际协调会(ICH)有关文本建议下列情况下需在验证:原料药合成工艺改变;药物制剂组方改变;分析方法改变。
通则<1225>提供适于大多数药典分析方法得验证要求信息。
药典分析方法验证可按照表1中列出的部分或全部分析特性,以及表2中分析方法分类进行。
有的药典分析方法验证要求超出通则<1225>的特性。
则可按各有关方法通则规定的分析验证特性或特殊验证要求进行。
分析运行特性准确度定义分析方法得准确度系指该方法所得测试结果与真值的接近程度。
分析方法的准确度应在一定范围内测定。
[关于术语:通则<1225>和ICH Q2中准确度定义为不偏离程度(真实度)。
但在国际计量学词汇[International Vocabulary of Metrology(VIM)]和国际标准组织[the International Organization for Standardization(ISO)]的文件中,“准确度”有不同的意思。
ISO准确度的定义把不偏离程度(真实度)与精密度的概念合在一起]。
测定对于原料药含量测定,用分析方法测定已知纯度的供试品(如对照品),或用被验证方法测定结果与其他已知准确度的方法测定结果进行比较,测得准确度。
对于制剂中药物的含量测定,用分析方法测定制剂成分混合物中按照方法范围加入的已知量被测物,测得准确度。
如不能获得全部制剂成分,可向制剂中加入已知量被测物(加样法)进行测定,或用被验证方法测定结果与其他已知准确度的方法测定结果进行比较。
对于杂质定量分析,原料药或制剂中加入已知量杂质,测得准确度。
如不可能得到某些杂质或降解产物,可以将测定结果与另一方法测得结果进行比对。
如没有其他方法,可比较杂质和被测物质的响应值,即等量杂质和被测物响应值比值(相对响应因子),如果已知该比值,可用于计算杂质含量。
准确度为样品中被测物已知加入量含量测定的百分回收率,或平均值与可接受真值的偏差,同时报告置信区间。
ICH有关文件建议在规定范围至少3个浓度至少测定9次的结果确定准确度(即3个浓度,每个浓度重复测定3次)。
准确度的确定可以用不同方法,包括在含量测定范围内测定被测物回收率(百分回收率),或测定估计浓度与真实浓度的线性关系。
建议统计判断标准为斜率的置信区间应在约1.0区间内,或斜率应接近1.0。
在验证文件中均应规定区间或接近程度的定义。
判断标准取决于含量测定方法和变异以及结果。
不建议在斜率为1.0时用零假设检验没有统计意义地确定判断标准。
物理性质测定方法的准确度可通过标准物质分析确定,或根据具体情况对上述方法得适用性进行具体分析来确定。
精密度定义分析方法的精密度系指均匀样品多次取样用该分析方法测定各结果的一致程度。
分析方法的精密度常用一系列测定结果的标准偏差或相对标准偏差(变异系数)表示。
精密度衡量在正常操作条件下分析方法的重现性和重复性。
重复性系指不同实验室用该分析方法测定,如协同研究。
中间精密度(也称耐用性)为实验室内差异,即在同一实验室在不同日期,或用不同分析人员,或用不同设备用该分析方法进行测定。
重复性系指在一个实验室由一个分析人员用相同设备在短时间内用该分析方法进行测定。
测定分析方法的精密度是对足够份数的一个均匀样品进行测定,以便计算标准偏差或相对标准偏差(变异系数)统计有效的估计数。
本测定为各份样品从样品制备得到最终结果进行的全部分析过程。
ICH有关文件建议在规定范围至少3个浓度至少测定9次的结果确定准确度(即3个浓度,每个浓度重复测定3次),或用100%测试浓度至少6次测定结果。
专属性定义 ICH定义专属性在杂质、降解产物以及辅料存在下分析方法能准确确定被测物质存在的能力。
如果缺乏专属性,可用其他分析方法弥补。
[注:国际专业权威机构(IUPSC,AOAC-I)采用“选择性”这个术语,对选择性极高的分析方法保留“专属性”这个术语]。
对于下面讨论的分析方法,以上定义具有以下含义: 鉴别试验:鉴定被分析物特性纯度检查:采用的所有分析方法能给出被测物质中杂质的准确含量(如有关物质检查、重金属限度检查、有机挥发性杂质检查)。
含量测定:给出正确结果,样品中被分析物含量或效价的准确结果。
测定定性分析(鉴别试验)方法。
应能显示区分可能存在的结构十分相关的化合物的能力。
用含有被分析物质的阳性反应(与已知对照品对照)加上不含被测物质样品的阴性反应进行确证,并确证阳性反应不是与被分析物结构相似或十分相关的物质产生的。
杂质分析方法,向原料药或制剂中加入适量杂质,应能显示这些杂质的测定结果具有一定准确度和精密度。
含量测定分析方法,其专属性应能显示该分析方法不受杂质或辅料存在的影响。
实际做法可向原料药或制剂中加入适量杂质或辅料,确定测定结果不受这些外来物质的影响。
如果杂质或降解产物得不到,可将含有杂质或降解产物的样品测定结果与用另一确证了的方法测定结果比较(如药典方法,或其他经验证了的方法),以说明其专属性。
应包括对贮存在相应苛刻条件下的样品测定比较(如:光、热、湿度、酸或碱水解、以及氧化)。
含量测定分析方法,应比较这些结果;色潜纯度检査应比较杂质的检出情况.ICH有关文件说明,当使用色谱分析方法时,验证资料中应附代表性色谱图,以显示其选择性好坏,应标明每个色谱个峰。
峰纯度检査(如用二极管阵列或质谱法检测)可用于显示被测定物色谱峰仅为一个成分。
用波谱法的定性定量测定方法验证,应参考有关通法,如近红外光谱法、拉曼光谱法、X射线粉末衍射法等。
检测限定义检测限是限度检查的特性。
检测限系指在规定试验条件下样品中被分析物能被检出的最低量,不一定要求定量。
因此,限度检查只要说明被分析物的量髙于或低于一定限度。
检测限通常以样品中被分析物的浓度表示(如百分浓度,十亿分之几)。
测定非仪器分析方法,一般用已知浓度被分析物的样品进行分析,求得该被分析物能被可靠检出的最低浓度。
仪器分析方法,可用与非仪器分析方法相同方法求得检测限。
分析方法推荐作为药典方法时,不必要测定实际的检测限。
实际上,用含高于和低于规定检测浓度的已知浓度被分析物样品求得的检测限是非常低的。
例如,要求检査浓度为0.1%的杂质,应表明,用本法能可靠地检出该浓度的杂质。
具有基线噪音的仪器分析方法,ICH有关文件叙述了一个常用方法,即将含已知低浓度被分析物样品测得的信号与空白样品信号比较。
可以确定可靠检出被分析物的最低浓度。
一般可接受的信噪比为2:1或3:1。
其他方法如按照标准曲线的斜率和响应值的标准偏差计算检测限的。
无论用那种方法,必须用接近检测限或制备成检测限浓度的数个样品,对检测限进行最后验证。
定量限定义定量限是样品基质中低浓度化合物定量测定的特性,如原料药中的杂质和最终药物制剂中的降解产物。
定量限系指在规定试验条件下样品中被分析物能被测定的最低量,且具有可接受的精密度和准确度。
定量限通常以样品中被分析物的浓度表示(如百分浓度,十亿分之几)。
测定非仪器分析方法,一般用已知浓度被分析物的样品进行分析,求得该被分析物能被测定且具有可接受准确度和精密度的最低浓度。
仪器分析方法,可用与非仪器分析方法相同方法求得定量限。
分析方法推荐作为药典方法时,不必要测定实际的定量限。
实际上,用含高于和低于规定定量浓度的已知浓度被分析物样品求得的定量限是非常低的。
例如,要求测定被分析物的浓度为每片0.lmg,应表明,用本法能可靠地定量测定该浓度的被分析物。
具有基线噪音的仪器分析方法,ICH有关文件叙述了一个常用方法,即将含已知低浓度被分析物样品测得的信号与空白样品信号比较。
可以确定可靠测定被分析物的最低浓度。
一般可接受的信噪比为10:1。
其他方法如按照标准曲线的斜率和响应值的标准偏差计算定量限的。
无论用那种方法,必须用接近定量限或制备成定量限浓度的数个样品,对定量限进行最后验证。
