化学反应速率化学平衡图像题精选精练
一轮复习 化学反应速率-化学平衡图像专题

化学反应速率化学平衡图像知识目标:1、学会读图,弄清图像含义2、学会识图,进行信息提取3、学会用图,联想化学原理解答问题1、速率—时间图例1对达到平衡状态的可逆反应A(g)+3B(g) 2C(g)+D(g) △H<0画出t1时刻改变下列某一条件的V-t图像变化①增加A的浓度②减少B的浓度③增大C的浓度④减少D的浓度⑤加压⑥减压⑦降温⑧升温⑨加正催化剂专练1.对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为()A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体专练2:A(g)+3B(g) 2C(g)+Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是()A.升温 B.加压 C.增大c(A) D.降低c(C) E.降低c(A)2、浓度—时间图例2.图2表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为______.小结:3、含量—时间—温度(压强)图例3.同压、不同温度下的反应:A(g)+B(g)C(g);△HA的含量和温度的关系如图3所示,下列结论正确的是A.T1>T2,△H>0 B.T1<T2,△H>0 C.T1>T2,△H<0 D.T1<T2,△H<0小结:专练3.现有可逆反应A(g)+2B(g)nC(g);△H<0,在相同温度、不同压强时,A 的转化率跟反应时间(t )的关系如图4,其中结论正确的是A .p 1>p 2,n >3B .p 1<p 2,n >3C .p 1<p 2,n <3D .p 1>p 2,n=34、恒压(温)线例4.对于反应2A (g )+B (g )2C (g );△H<0,下列图象正确的是 ( )5.速率—温度(压强)图 例5.反应2X(气)+Y(气) 2Z(气)(正反应为放热反应),在不同温度(T 1和T 2)及压强(P 1和P 2)下,产物Z 的物质的量[n(z)]与反应时间(t)的关系如图所示。
化学反应速率和化学平衡--图像专题

2.浓度(C)-时间(t)图
想一想: 由下图可以得到什么信息?
C4
3 2 1 0
A
B
C
图像含义: (1)确定反应物和生成物。 (2)确定反应方程式各物质化学计量数。
化学计量数之比=物质的量的变化量之比 =物质的量浓度的变化量之比 =反应速率之比
t
由图可知: ①反应为可逆反应 ②方程式为: A + 3C
化学反应速率和化学平衡—图像专题
1.速率-时间图
例1、在一密闭体系中发生:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ· -1右图是某一时间段中反应速率与反应进 mol 程的曲线关系图,回答下列问题: (1)处于平衡状态的时间段 ν t0~t1,t2~t4,t5~t6 是_________________。 ν逆 ν逆 (2)t1、t3、t4时刻体系中分 ν正 ν正 别是什么条件发生了变化? t1:升温; t3:加催化剂; t0 t1 t2 t3 t4 t5 t 6 t t4:减压 (3)下列各时间段时,氨的 体积分数最高的是( A ) 解题注意: 外界条件对速 率及平衡移动的影响。 A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
2B
解题注意: 曲线的起点、终点及变化趋势。
3.含量-时间t-压强P(或温度T)图
例如:对反应aA(g)
的 浓 度
bB(g)
读图判断该图中P1与P2及;b
解题原则一:先拐先平数值大
t
t1 t2
小结: (1)判断非平衡态(斜线)和平衡态(水平线),且遵循 “先拐先平,数值大”的原则. (2)判断反应特征,如压强大小,反应前后体积变化等。
③看线:即线的走向和变化趋势
第二章 化学反应速率和化学平衡图像题专练

化学反应速率和化学平衡图像题专练题组一速率—时间图像1. 在密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然改变的条件可能是( )A.催化剂失效B.减小生成物的浓度C.降低体系温度D.增大容器的体积答案 C解析从图像可以看出:改变条件后,反应速率与原平衡速率出现断点且低于原平衡反应速率,说明改变的条件可能是降低温度或减压。
从改变条件后的v′正与v′逆的大小关系,可得出化学平衡正向移动。
降低温度,该平衡正向移动,必有v′正>v′逆,故选C。
2.向一容积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)2HI(g)ΔH<0,当达平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使平衡移动(如图所示),下列说法正确的是( )A.容器内气体颜色变深,平均相对分子质量不变B.平衡不移动,混合气体密度增大C.H2转化率增大,HI平衡浓度减小D.t0时改变的条件为减小体积或升高体系温度答案 A解析条件改变后,正、逆反应速率均增大,但是逆反应速率大于正反应速率,平衡逆向移动,改变的条件应为升高温度,A项正确。
题组二时间—浓度(物质的量)图像3.已知X(g)和Y(g)可以相互转化:2X(g)Y(g) ΔH<0。
现将一定量X(g)和Y(g)的混合气体通入一体积为1L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。
则下列说法不正确的是( )A.若混合气体的压强不变,则说明反应已达化学平衡状态B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点C.25~30min内用X表示的平均化学反应速率是0.08mol·L-1·min-1D.反应进行至25min时,曲线发生变化的原因是增加Y的浓度答案 D解析正反应是气体分子数减小的反应,所以当压强不再发生变化时,可以说明反应已经达到平衡状态,A项正确;根据图像可知,只有b 点表示的反应体系中,各物质的浓度不再发生变化,所以只有b点表示反应处于平衡状态,B项正确;25~30min内X的浓度变化量是0.4mol·L-1,所以用X表示的平均化学反应速率是0.4mol·L-15min=0.08mol·L-1·min-1,C项正确;反应进行至25min时,X物质的浓度增大,D项不正确。
选修4练习化学反应速率和化学平衡图像

课时跟踪检测(十)化学反应速率和化学平衡图像1.可逆反应:2AB3(g) A2(g)+3B2(g)ΔH>0,下列图像正确的是()解析:选D A项,升高温度,正、逆反应速率都增大,平衡向正反应方向移动,交叉点后,正反应速率大于逆反应速率,错误;B项,升高温度,平衡向正反应方向移动,B2%增大,错误;C项,当温度一定时,增大压强,AB3%降低,平衡应正向移动,而实际上增大压强,平衡逆向移动,错误;D项,当温度一定时,增大压强,平衡向逆反应方向移动,AB3%增大,符合题意;当压强一定时,升高温度,平衡向正反应方向移动,AB3%降低,符合题意,正确。
2.可逆反应a A(g)+b B(g) c C(g)+d D(g)ΔH=Q,同时符合下列两图中各曲线的规律的是()A.a+b>c+d T1>T2Q>0B.a+b<c+d T1>T2Q>0C.a+b<c+d T1<T2Q<0D.a+b>c+d T1<T2Q<0解析:选D对于左图,先拐先平衡,说明反应速率快,即T2>T1,随温度的升高,生成物的浓度减小,平衡向吸热反应方向移动,即正反应是放热反应,即Q<0;对于右图,v正和v逆相交后,随压强的增大,平衡向正反应方向移动,a+b>c+d,D选项正确。
3.对于可逆反应:m A(g)+n B(g) x C(g)ΔH=?在不同温度及压强(p1、p2)条件下,反应物A的转化率如图所示,下列判断正确的是()A.ΔH>0,m+n>x B.ΔH>0,m+n<xC.ΔH<0,m+n<x D.ΔH<0,m+n>x解析:选D根据图像(1),p1先拐说明p1>p2,增大压强A的转化率升高,说明增大压强平衡向正反应方向移动,m+n>x;根据图像(2),升高温度,A的转化率降低,说明升高温度,平衡向逆反应方向移动,即此反应的正反应ΔH<0,D正确。
4.如图为某化学反应的速率与时间的关系示意图。
在t1时刻升高温度或者增大压强,速率的变化都符合示意图的反应是()A.2SO2(g)+O2(g) 2SO3(g)ΔΗ<0B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔΗ<0C.H2(g)+I2(g) 2HI(g)ΔΗ>0D.N2(g)+3H2(g) 2NH3(g)ΔΗ<0解析:选B由图像知增大压强或升高温度后,v正、v逆都增大,由于v逆增大的多,平衡逆向移动。
化学平衡图像(习题精练含解析)
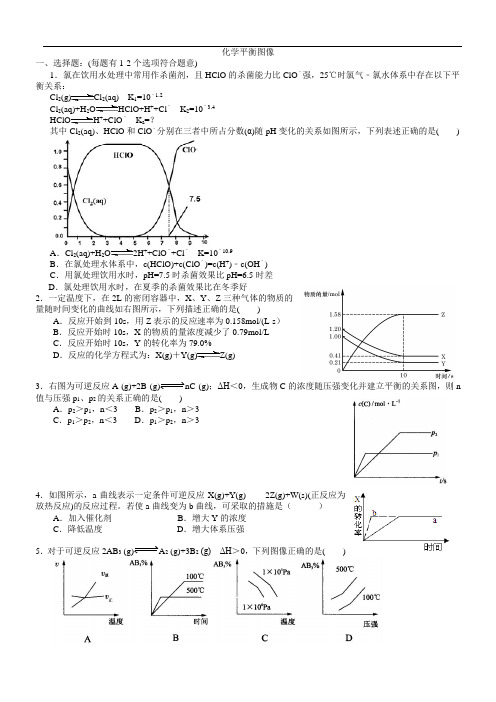
化学平衡图像一、选择题:(每题有1-2个选项符合题意)1.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO﹣强,25℃时氯气﹣氯水体系中存在以下平衡关系:Cl 2(g)Cl2(aq) K1=10﹣1.2Cl 2(aq)+H2O HClO+H++Cl﹣K2=10﹣3.4HClO H++ClO﹣K a=?其中Cl2(aq)、HClO和ClO﹣分别在三者中所占分数(α)随pH变化的关系如图所示,下列表述正确的是( ) A.Cl 2(aq)+H2O2H++ClO﹣+Cl﹣K=10﹣10.9B.在氯处理水体系中,c(HClO)+c(ClO﹣)=c(H+)﹣c(OH﹣)C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差D.氯处理饮用水时,在夏季的杀菌效果比在冬季好2.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)3.右图为可逆反应A (g)+2B (g)nC (g);ΔH<0,生成物C的浓度随压强变化并建立平衡的关系图,则n 值与压强p1、p2的关系正确的是( )A.p2>p1,n<3 B.p2>p1,n>3C.p1>p2,n<3 D.p1>p2,n>34.如图所示,a曲线表示一定条件可逆反应X(g)+Y(g)2Z(g)+W(s)(正反应为放热反应)的反应过程。
若使a曲线变为b曲线,可采取的措施是()A.加入催化剂B.增大Y的浓度C.降低温度D.增大体系压强5.对于可逆反应2AB3 (g)A2 (g)+3B2(g) ΔH>0,下列图像正确的是( )6.已知:4NH 3(g)+5O 2(g)4NO(g)+6H 2(g). △H = -1025kJ/mol 该反应是一个可逆反应。
化学反应速率和化学平衡练习题(含详细答案)

化教反应速率战化教仄稳概括训练之阳早格格创做一、采用题(包罗15个小题,每小题4分,共60分.每小题有只一个选项切合题意.)1. 设反应C+CO22CO(正反应吸热)反应速率为v1,N2+3H22NH3(正反应搁热),反应速率为v2.对付于上述反应,当温度降下时,v1、v2的变更情况为A. 共时删大B. 共时减小C. v1删大,v2减小D. v1减小,v2删大2. 正在一稀关容器内爆收氨领会反应:2NH3N2+3H2.已知NH3起初浓度是2.6mol·L-1,4s终为1.0 mol·L-1,若用NH3的浓度变更去表示此反应的速率,则v(NH3)应为mol·L-1·s-1 B. 0.4 mol·L-1 ·s-1C. 1.6 mol·L-1·s-1D. 0.8 mol·L-1·s-13. 正在温度没有变的条件下,稀关容器中爆收如下反应:2SO2+O22SO3,下列道述不妨证明反应已经达到仄稳状态的是A. 容器中SO2、O2、SO3共存B. SO2与SO3的浓度相等C. 容器中SO2、O2、SO3的物量的量之比为2∶1∶2D. 反应容器中压强没有随时间变更4. 反应2A(g)2B(g)+E(g)(正反应为吸热反应)达到仄稳时,要使正反应速率落矮,A的浓度删大,应采与的步伐是A. 加压B. 减压C. 缩小E的浓度D. 落温5. 一定温度下,浓度均为1mol·L-1的A2战B2二种气体,正在稀关容器内反应死成气体C,反应达仄稳后,测得:c(A2)=0.58 mol·L-1,c(B2)=0.16 mol·L-1,c(C)=0.84 mol·L-1,则该反应的精确表白式为A. 2A2+B22A2BB. A2+B22ABC. A2+B2A2B2D. A2+2B22AB26. 一定条件下的反应:PCl5(g)PCl3(g)+Cl2(g)(正反应吸热)达到仄稳后,下列情况使PCl5领会率落矮的是A. 温度、体积没有变,充进氩气B. 体积没有变,对付体系加热C. 温度、体积没有变,充进氯气D. 温度没有变,删大容器体积7. 正在一定温度下,把2. 0体积的N2战6. 0体积的H2通进一个戴活塞的体积可变的容器中,活塞的一端与大气相通,容器中爆收如下反应:N2+3H22NH3.已知仄稳时NH3的浓度是c mol·L-1,现按下列四种配比动做起初物量,分别充进上述容器,并脆持温度没有变,则达到仄稳后,NH3的浓度没有为c mol·L-1的是8. 将3 molO2加进到VL 的反应器中,正在下温下搁电,经t1s 修坐了仄稳体系:3O22O3,此时测知O2的转移率为30%,下列图象能精确表示气体的物量的量浓度(m)跟时间(t)的关系的是9. 下图为可顺反应A(g)+2B(g)nC(g)(正反应搁热)死成物C 的浓度随压强变更并修坐仄稳的关系图,则n 值与压强p1、p2的关系精确的是 A. p2>p1,n <3 >C. p1>p2,n <3D. p1>p2,n >310. 正在容积牢固的稀关容器中充进一定量的X 、Y 二种气体,一定条件下爆收可顺反应3X(g)+Y(g)2Z(g),并达到仄稳.已知正反应是搁热反应,测得X 的转移率为37. 5%,Y 的转移率为25%,下列有关道述精确的是A. 若X 的反应速率为0.2 mol·L -1·s -1,则Z 的反应速率为0.3 mol·L -1·s -1B. 若背容器中充进氦气,压强删大,Y 的转移率普及C. 降下温度,正反应速率减小,仄稳背顺反应目标移动D. 启初充进容器中的X 、Y 物量的量之比为2∶111. 正在373 K 时,把0.5 mol N2O4通进体积为5 L 的真空稀关容器中,坐时出现棕色.反应举止到2 s 时,NO2的浓度为0.02 mol·L -1.正在60 s 时,体系已达仄稳,此时容器内压强为启初的1.6倍.下列道法精确的是A. 前2 s ,以N2O4的浓度表示的仄稳反应速率为0. 01 mol·L -1·s -1B. 正在2 s 时体系内的压强为启初时的1. 1倍C. 正在仄稳时体系内含N2O40. 25molD. 仄稳时,如果压缩容器体积,则可普及N2O4的转移率12. 对付于反应2SO2+O22SO3,下列推断精确的是A. 2体积SO2战脚量O2反应,肯定死成2体积SO3B. 其余条件没有变,删大压强,仄稳肯定背左移动C. 仄稳时,SO2消耗速度肯定等于O2的死成速率D. 仄稳时,SO2浓度肯定等于O2浓度的二倍 13. 反应:L(s)+aG(g)bR(g)达到仄稳,温度战压强对付该反应的 做用如左图所示,图中:压强p1>p2,x 轴表示温度,y 轴表示仄 衡混同气体中G 的体积分数.据此可推断 A 2 3 mD 2 3 m t t 1 B2 3 m 1 C 2 3 m t 2t 1C 浓度/m ol L-1p p .12x yp p OA. 上述反应是搁热反应B. 上述反应是吸热反应C. a>bD. 无法决定a、b的大小14. 合成氨反应为N2+3H22NH3,今有A、B、C、D四个容器,每个容器中有二种支配,二种支配分别达到仄稳后,支配1中N2战支配2中NH3转移率之战一定没有为1的是(起初体积相等)A. 恒温恒容:支配1:加1 mol N2+3 mol H2,支配2:加2 mol NH3B. 恒温恒压:支配1:加1 mol N2+3 mol H2,支配2:加2 mol NH3C. 恒温恒容:支配1:加1 mol N2+3 mol H2,支配2:加3 mol NH3D. 恒温恒压:支配1:加1 mol N2+3 mol H2,支配2:加3 mol NH315. 某温度下,C战H2O(g)正在稀关容器里爆收下列反应:C(s)+H2O(g)CO(g)+H2(g),CO(g)+H2O(g)CO2(g)+H2(g)当反应达到仄稳时,c(H2)=1. 9 mol·L-1,c(CO)=0. 1 mol·L-1.则下列道述精确的有A. CO正在仄稳时转移率为10%B. 仄稳浓度c(CO2)=c(H2)C. 仄稳时气体仄稳相对付分子品量约为23. 3D. 其余条件没有变时,缩小体积,H2O(g)的转移率随之落矮第Ⅱ卷(非采用题共60分)16. (10分)正在稀关容器中爆收下列反应:I2(g)+H2(g)2HI(g)(正反应吸热)起初时,n(H2)=a mol,n(I2)=b mol.只改变表中列出的条件,其余条件没有变,试将化教反应速率的改变(“删大”“减小”或者“没有变”)挖进相映的表格.编号反应条件反应速率(1)降下温度(2)加进催化剂(3)再充进a mol H2(4)将容器容积夸大为本去2倍(5)通进b mol Ne(g)17. (8分)正在一个牢固体积的稀关容器中,加进2 mol A战1 mol B,爆收反应:2A(g)+B(g)3C(g)+D(g)达到仄稳时,C的浓度为W mol·L-1.若保护容器体积战温度没有变,用下列物量动做起初反应物时,经反应达到仄稳后C的浓度(用“大于”“小于”“等于”表示).(1)加进1 mol A战1 mol B时,C的仄稳浓度_________W mol·L-1.(2)加进2mol A、1mol B、3mol C、1mol D时,C的仄稳浓度_________W mol·L -1.(3)加进3 mol C 战1 mol D 时,C 的仄稳浓度_________W mol·L -1.(4)加进2 mol B 、3 mol C 、1 mol D 时,C 的仄稳浓度_________W mol·L -1.18. (12分)现有反应:mA(g)+nB(g)pC(g),达到仄稳后,当降下温度时,B 的转移率变大;当减小压强时,混同体系中C 的品量分数也减小,则:(1)该反应的顺反应为_________热反应,且m+n_________p(挖“>”“=”“<”).(2)减压时,A 的品量分数_________.(挖“删大”“减小”或者“没有变”,下共)(3)若加进B(体积没有变),则A 的转移率_________,B 的转移率_________.(4)若降下温度,则仄稳时B 、C 的浓度之比将_________.(5)若加进催化剂,仄稳时气体混同物的总物量的量_________.(6)若B 是有色物量,A 、C 均无色,则加进C(体积没有变)时混同物颜色_______,而保护容器内压强没有变,充进氖气时,混同物颜色_______(挖“变深”“变浅”或者“没有变”).19. (14分)将等物量的量的A 、B 、C 、D 四种物量混同,爆收如下反应:aA +bB cC(s)+dD ,当反应举止一定时间后,测得A 缩小了nmol ,B 缩小了2nmol ,C 减少了23n mol ,D 减少了nmol ,此时达到化教仄稳.(1)该化教圆程式中各物量的化教计量数为:a=_____________,b=_____________,c=_____________,d=____________.(2)若只改变压强,反应速率爆收变更,但是仄稳没有移动,该反应中各物量的汇集状态:A_____________,B_____________,C_____________,D_____________.(3)若只降下温度,反应一段时间后,测得四种物量的物量的量又达到相等,则该反应为_____________反应(挖“搁热”或者“吸热”).20. (16分)一定条件下,将SO2战O2充进一稀关容器中,爆收如下反应:2SO2(g)+O2(g)2SO3(g)(正反应搁热)反应历程中SO2、O2、SO3物量的量变更如图所示:回问下列问题:(1)落矮温度,SO2的转移率_________,化教反应速度_________.(挖“删大”“减小”或者“没有变”)(2)反应处于仄稳状态的时间是_________.(3)反应举止至20 min 时,直线爆收变更的本果是______________________(用笔墨表白).10 min 到15 min 的直线变更的本果大概是_________(挖写编号). a. 加了催化剂b. 缩小容器体积c. 落矮温度d. 减少SO3的物量的量化教仄稳概括训练问案1、剖析:偶像温度对付v的做用,降下温度,反应速率删大,故选A.问案:A2、剖析:v(NH3)=s4L mol)0.16.2(1-⋅-=0.4mol·L-1·s-1.问案:B3、问案:D4.剖析:为了落矮正反应速率,必须采与落矮反应物或者死成物的浓度、落矮温度、减小压强中的一种或者几种,而采与与此差异的步伐,没有管化教仄稳背何目标移动,皆市删大反应速率的;选项B、C、D切合上述央供.题中又央供使A的浓度删大,则减压(减小压强,真量上是删大容器的体积)后没有管仄稳背何反应目标移动,皆能减小反应物战死成物的浓度,所以选项B没有切合题意.减小E的浓度,仄稳背正反应目标移动,而落温使仄稳背顺反应目标(搁热反应目标)移动,A的浓度会删大,所以D切合题意.问案:D5、剖析:Δc(A2)=1 mol·L-1-0. 58mol·L-1=0. 42mol·L-1,Δc(B2)=1 mol·L-1-0. 16mol·L-1=0. 84mol·L-1,Δc©=0. 84 mol·L-1,果变更量之比等于化教计量数比,故选D.问案:D6、剖析:正反应为扩体吸热反应.A. 无做用;B. 加热,温度降下,仄稳左移,PCl5领会率删大;C. 充进Cl2,仄稳左移,PCl5领会率落矮;D. 温度没有变,体积删大,压强减小,仄稳左移,PCl5领会率删大.故选C.问案:C7.剖析:此题考查教死对付恒温恒压条件下等效仄稳的认识.恒温恒压修坐等效仄稳的条件是投料比相等.所以题设条件下,加进的N2战H2的体积比切合V(N2)∶V(H2)=2. 0∶6. 0=1∶3者皆可选.天然没有管加进几NH3,其转移为N2战H2的体积比皆为1∶3,即加进几NH3皆是符合的,或者曰对付等效仄稳无做用.可睹惟有C选项可选.问案:C8、剖析:3O22O3n(初):3 0n(变):0. 9 0. 6n(仄):2. 1 0. 6故C 切合变更.问案:C9、剖析:p 大,v 大,到达仄稳所需时间短,故p1>p2,若由p1形成p2,则p 减小,仄稳背扩体目标移动,而C 浓度删大,即仄稳背死成C 的目标移动,故1+2<n ,即n >3,故选D.问案:D10、剖析:A 项错,X 消耗速率为0. 3 mol·(L·s)-1,转移为X 战Y 的Z 的速率为0. 2 mol·(L·s)-1才是仄稳的标记.B 项错,正在容器容积没有变时加进氦气,仄稳没有移动.C 项错,降温时,正、顺反应速率均删大,但是删幅分歧.D 项精确,设启初时充进X 的物量的量为x,Y 的物量的量为y ,则x·37. 5%∶y·25%=3∶1得y x =21.问案:D11、剖析:c 初(N2O4)=L 5mol5.0=0. 1mol·L -1,果N2O42NO2,所以v(N2O4)=2s 2L mol 002.01⨯⋅-=0. 005 mol·L -1·s -1,A 没有精确;n(NO2)=0. 02mol·L -1×5 L =0. 1mol ,反应后n(总)=0. 5mol +0. 1 mol×21=0. 55mol ,故B 精确;设到达仄稳时,反应的N2O4物量的量为x ,由N2O42NO2n(初): 0. 5 mol 0n(仄): 0. 5 mol -x 2x则mol 5.0mol 5.0x+=1. 6 mol ,所以x=0. 3 mol ,C 没有精确;压缩容积,压强删大,仄稳背N2O4目标移动,故N2O4的转移率落矮,D 没有精确.问案:B12、剖析:选项A :死成2体积还表示2体积SO2局部反应,但是此反应是可顺反应,反应物没有成能局部转移为死成物.选项B :此反应的正反应是气体物量分子数目缩小的反应,果此删大压强时会使仄稳背正反应目标移动.选项C :达到仄稳时的标记是正、顺反应速率相等.SO2的消耗是正反应,O2的死成是顺反应.由于反应速率之比等于圆程式中各物量的化教计量数之比.所以消耗SO2的速率应为死成O2速率的二倍.选项D :仄稳时,SO2浓度与O2浓度的关系要瞅反应起初的投料量,如果SO2与O2的起初投料量的物量的量之比为2∶1时,由于反应消耗的SO2与O2的起初投料量的物量的量之比为2∶1,所以达仄稳时,SO2浓度肯定等于O2浓度的二倍,可则没有会是.问案:B13、剖析:由图给疑息可知,随着温度的降下,仄稳混同气中G 的体积分数减小,证明该反应为吸热反应;由图知,正在相共温度下,压强删大,仄稳混同气中G 的体积分数也删大,该反应是气体分子数删大的反应,即a <b.问案:B14、剖析:C. 从正、顺二个目标分别修坐等效仄稳,得反应物的转移率与死成物的转移率之战为1.问案:C15、剖析:正在其余条件没有变时,缩小体积,仄稳:C(s)+H2O(g)CO(g)+H2(g)背左移动,火的转移率落矮.问案:D16、剖析:(1)没有管正反应吸热,仍旧搁热,降下温度皆能使化教反应速率加快,v(正)也加快,v(顺)也加快,但是减少幅度没有相共.若正反应吸热,降下温度时,v(正)>v(顺);若正反应搁热,降下温度时,v(正)<v(顺).(2)若无特天声明,常常所道的催化剂即为“正催化剂”,加进催化剂,可共等程度天普及正、顺化教反应速率.(3)再充进a mol H2,c(H2)浓度删大,化教反应速率加快.(4)夸大容器的容积,容器内各物量浓度(或者压强)均减小,化教反应速率落矮.(5)通进Ne(g),并已改变反应物的浓度战压强,化教反应速率没有变.问案:(1)删大 (2)删大 (3)删大 (4)减小(5)没有变17、剖析:此题为等效仄稳问题,2 mol A 战1 mol B 反应达到仄稳时,与3 mol C 战1 mol D 反应达到仄稳时是等效的,即二者正在仄稳时C 的浓度为W mol·L -1,再根据仄稳移动本理加以推断即可.问案:(1)小于 (2)大于 (3)等于 (4)大于18、剖析:降下温度,B 的转移率变大,证明此反应的正反应为吸热反应;减小压强,混同体系中w©减小,证明减压仄稳背顺反应目标移动,即m+n >p.问案:(1)搁> (2)删大 (3)删大减小 (4)变小 (5)没有变 (6)变深变浅19、剖析:(1)果变更的物量的量之比等于化教计量数比,所以a ∶b ∶c ∶d =n ∶2n ∶23n ∶n =2∶1∶3∶2,故a=2,b=1,c=3,d=2.(2)果改变压强,速率爆收变更证明有气态物量介进反应,使仄稳没有移动,证明等号二边气态物量的化教计量数相等,据此可判知:A为气态,B为固态或者液态,C为固态,D为气态.(3)降温时,反应一段时间后,四种物量的量又达到相等,证明仄稳背顺反应目标移动,所以顺反应为吸热反应.问案:(1)2 1 3 2(2)气态固态或者液态固态气态(3)搁热20、剖析:(1)落温,仄稳背正反应目标移动,SO2的转移率删大,化教反应速率落矮.(2)反应举止15 min时,SO2、O2、SO3的物量的量均没有爆收变更,证明反应达到了仄稳状态.(3)反应举止至20 min,O2的物量的量爆收突变,证明此时减少了O2的量.问案:(1)删大减小(2)15~20 min,25~30 min(3)减少了O2的量 ab。
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
化学平衡图像专题(精选)

【达标检测16】----化学平衡图像问题一、选择题1、下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断(AB )A、正反应是放热反应B、若A、B是气体,则D是液体或固体C、逆反应是放热反应.D、A、B、C、D均为气体2、在密闭容器中充入A、B或G、H进行可逆反应:aA(气)+bB(气)gG(气)+hH (气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是( A )A、开始时充入G和H a+b<g+h Q<0B、开始时充入G和H a+b<g+h Q>0C、开始时充入G和H a+b>g+h Q>0D、开始时充入A和B a+b>g+h Q>03、可逆反应A(气)+2B(气)nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( C )A、P1>P2,n >3B、P1>P2,n <3C、P1<P2,n >3D、P1<P2,n <34、如下图所示a曲线表示一定条件下可逆反应X(g)+Y(g)2Z(g)+W(s)△H <0的反应过程。
若使a曲线变成b曲线,可采取的措施是(AD )A、加入催化剂B、增加Y的浓度C、降低温度D、增大体系压强5、反应A(g)+B(g)C(g)+D(g);△H>0分别在673K和373K时进行,得C 的体积分数和时间的关系曲线如下图所示,其中能正确表示此反应的图象是( C )6、在容器相同的五个容器中,分别充入同量的N2和H2,在不同温度下任其反应:N2+3H22NH3,分别在同时刻测得其中NH3的体积百分比,连成如下图所示曲线,不正确的叙述是( C )。
A、放热反应B、E、F二点尚未达到化学平衡状态C、H、I二点尚未达到化学平衡状态D、G、H、I三点已达到化学平衡状态7、反应:L(s)+ a G(g) b R(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强P1>P2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。
(完整版)化学速率平衡图像专题练习题

化学反应速率、化学平衡图像一、ν-t图像或c-t图像1. ν-t图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。
【练习1】对于反应2SO 2(g)+O2(g) 2SO3(g) △H<0,填写改变的条件及平衡移动的方向。
t1时,,平衡向移动。
t2时,,平衡向移动。
t3时,,平衡向移动。
t4时,,平衡向移动。
小结:改变条件,图像一点保持连续;改变,两点突变,_____________使正逆反应速率同等程度的增大而平衡不移动。
【练习2】对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为( )A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体【练习3】在密闭容器,一定条件下进行反应,mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )A.正反应是吸热反应B.逆反应是吸热反应C.m+n>p+q D.m+n<p+q【练习4】应N2(g)+3H2(g) 2NH3(g) △H<0 在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( ) ,氨的百分含量最高的时间段是( )A.t0-t1B.t2-t3C.t3-t4D. t5-t62. c-t图像:分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程式中各物质的化学计量数之比。
【练习5】今有X(g)+Y(g) 2Z(g) △H<0。
从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是( )A.增大X或Y的浓度B.增大压强C.增大Z的浓度D.升高温度【练习6】右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间。
化学反应速率和平衡的图像题分类.doc

化学反应速率与平衡的图像专题✧一、速率-时间图像:1、在密闭容器中充入SO2(g)和O2(g),发生可逆反应2SO2(g)+O2(g) 2 SO3(g) △H<0,当反应达到平衡后,只改变下列各条件时,填入相应速率随时间的变化图像的编号。
(1)加入催化剂(2)升温(3)增大体积(4)增大氧气浓度【应用】2、右图表示反应N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在时间t0~t6中反应速率与反应过程的曲线图,则各时间段的变化不正确的是( )A t1~t2升温B t2~t3加压C t3~t4加催化剂D t4~t5减压3、反应A(g)+B(g)2C (g)+D(s)达到平衡状态时,只改变某一条件时,正、逆反应速率随时间的变化如图2所示,则所改变的条件可能是A. 升高温度B. 增大D的用量C. 使用正催化剂D. 增大压强✧二、浓度(或物质的量或气体体积)-时间图像:4、在密闭容器中,充入一定量A气体和B气体,反应中各物质的浓度随时间的变化情况如图1:(1)根据图像,写出反应方程式(2)A的平衡转化率为____________【应用】5、[2012福建]一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如右图所示。
下列判断正确的是( ) A.在0-50min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20-25min之间,pH=10时R的平均降解速率为0.04 mol·L—1·min—1CABt/min图10.51.51.02.0c(mol/L)V正V逆V'正=V'逆V正V逆V正V逆V'逆V'正V'正V'逆V'逆V'正V正V逆V正V逆V'正=V'逆V图2三、反应物转化率(或百分含量或浓度)—时间—温度(或压强)图像:6.对于反应mA(g)+nB(g) pC(g)+qD(g)(1)T1___T2 正反应____热(2)P1___P2 m+n__p+q(3)T1___T2 正反应____热(4)P1___P2 m+n___p+q【解题方法】7、(双选)【2011新课标改编】在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是()A. 温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=n A/t A mol·L-1·min-1B. 该反应在T1时的平衡常数比T2时的小C. 该反应为放热反应D. 处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大四、反应物转化率(或百分含量或浓度)-温度-压强图像:8、对于反应mA(g)+nB(g) pC(g)+qD(g)(1)△H 0 m+n___p+q (2) m+n___p+q △H 0【解题方法】9、【2011年山东】CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。
化学平衡图像综合训练

化学反应速率与化学平衡图像综合分析典例训练:题组一速率—时间图像1.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段2.在一密闭容器中发生反应N2(g)+3H2(g)⇌2NH3(g)ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:(1)处于平衡状态的时间段是________(填字母,下同)。
A.t0~t1B.t1~t2C.t2~t3D.t3~t4E.t4~t5F.t5~t6(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强B.减小压强C.升高温度D.降低温度E.加催化剂F.充入氮气t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是________。
A.t0~t1B.t2~t3C.t3~t4D.t5~t6(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
题组二物质的量(或浓度)—时间图像1.100 ℃时,向某恒容密闭容器加入1.6 mol·L-1的Q后会发生如下反应:2Q(g)⇌M(g)。
其中M的物质的量浓度随时间的变化如图所示:下列说法错误的是()A.从反应开始到刚达到平衡的时间段内,v(Q)=0.02 mol·L-1·s-1B.a、b两时刻生成Q的速率:v(a)<v(b)C.用Q浓度变化值表示的ab、bc两个时间段内的反应速率:v(ab)>v(bc)=0D.其他条件相同,起始时将0.2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s2.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)⇌y C(g)ΔH<0。
高考化学小题精练系列专题34化学平衡图像(含解析)

专题34 化学平衡图像(满分42分时间20分钟)姓名:班级:得分:1.在密闭容器中,反应2X(g)+ Y 2(g) 2XY(g)△H<0,达到甲平衡。
在仅改变某一条件后,达到乙平衡,下列分析正确的是A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低C.图Ⅱ中,t时间是增大了压强D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲【答案】D考点:考查化学平衡图像分析。
2.如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是A .温度、压强不变,充入一些A 2(g)B .压强不变,降低温度C .压强、温度不变,充入一些与之不反应的惰性气体D .升高温度,同时加压 【答案】A【考点定位】考查化学反应速率与化学平衡【名师点晴】该题的难点是压强对平衡状态的影响,特别是“惰性气体”对化学平衡的影响:①恒温、恒容条件:原平衡体系−−−−→−充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系−−−−→−充入惰性气体容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3.在某容积一定的密闭容器中,有下列的可逆反应:A (g)+B (g)xC (g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A .P 3>P 4,y 轴表示B 的转化率 B .P 3<P 4,y 轴表示B 的体积分数C .P 3<P 4,y 轴表示混合气体的密度D .P 3<P 4,y 轴表示混合气体的平均摩尔质量 【答案】A【考点定位】考查化学平衡图象【名师点晴】本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义。
(完整版)化学平衡图像题_(含答案)

化学反应速率化学平衡之图像题一、选择题1.(2012·武汉模拟)如图为某化学反应的速率与时间的关系示意图。
在t1时刻升高温度或者增大压强。
速率的变化都符合的示意图的反应是()A.4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH<0B.2SO2(g)+O2(g)2SO3(g)ΔH<0C.H2(g)+I2(g)2HI(g)ΔH>0D.C(s)+H2O(g)CO(g)+H2(g)ΔH>02.可逆反应m A(g)n B(g)+p C(s)ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是()A.m>n,Q>0B.m>n+p,Q>0 C.m>n,Q<0 D.m<n+p,Q<03.在密闭容器中进行如下反应:H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是() A.T1>T2,ΔH>0 B.T1>T2,ΔH<0 C.T1<T2,ΔH>0 D.T1<T2,ΔH<04.(2011·陕西四校联考)在一密闭容器中有如下反应:L(s)+a G(g)b R(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断() A.正反应为放热反应B.化学方程式中的计量数a>bC.G的转化率随温度升高而减小D.增大压强,容器内气体质量不变第1题图第2题图第3题图第4题图X Y 5.下图是表示外界条件(温度和压强)变化对反应的影响,L (s )+G (g )2R (g ), △H >0,在图中y 轴是指 ( )A.平衡混合物中R 的质量分数B. 平衡混合物中G 的质量分数C.G 的转化率D. L 的转化率6.在一定条件下,固定容积的密闭容器中反应:2NO 2(g ) O 2(g )+ 2NO (g ); △H >0,达到平衡。
化学平衡图像练习题
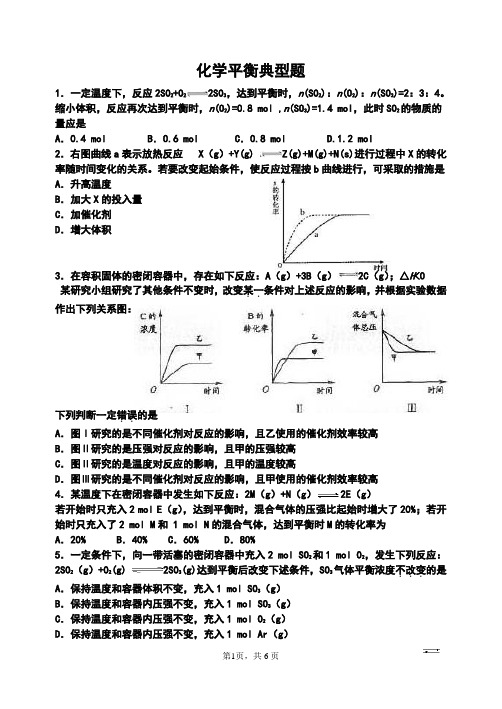
化学平衡典型题1.一定温度下,反应2SO 2+O22SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。
缩小体积,反应再次达到平衡时,n(O2)=0.8 mol ,n(SO3)=1.4 mol,此时SO2的物质的量应是A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol2.右图曲线a表示放热反应 X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。
若要改变起始条件,使反应过程按b曲线进行,可采取的措施是A.升高温度B.加大X的投入量C.加催化剂D.增大体积3.在容积固体的密闭容器中,存在如下反应:A(g)+3B(g)2C(g);△H<0某研究小组研究了其他条件不变时,改变某一..条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误..的是A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高4.某温度下在密闭容器中发生如下反应:2M(g)+N(g)2E(g)若开始时只充入2 mol E(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol M和 1 mol N的混合气体,达到平衡时M的转化率为A.20% B.40% C.60% D.80%5.一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO 2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变...的是A.保持温度和容器体积不变,充入1 mol SO3(g)B.保持温度和容器内压强不变,充入1 mol SO3(g)C.保持温度和容器内压强不变,充入1 mol O2(g)D.保持温度和容器内压强不变,充入1 mol Ar(g)6.在一固定体积的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g) xC(g) ,平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。
化学反应速率和化学平衡图像专题

化学反应速率、化学平衡图像专题练习一、ν-t图像或c-t图像1、ν—t图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率与平衡移动得影响。
【练习1】对于反应2SO2(g)+O2(g) 2SO3(g) △H〈0,填写改变得条件及平衡移动得方向。
t1时, ,平衡向移动、t2时, ,平衡向移动。
t3时, ,平衡向移动。
t4时, ,平衡向移动。
小结:改变条件,图像一点保持连续;改变,两点突变,_____________使正逆反应速率同等程度得增大而平衡不移动、【练习2】对达到平衡状态得可逆反应X+YZ+W,在其她条件不变得情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质得聚集状态为( )A.Z、W均为气体,X、Y中有一种就是气体ﻫB.Z、W中有一种就是气体,X、Y皆非气体C.X、Y、Z、W皆非气体ﻫD、X、Y均为气体,Z、W中有一种为气体【练习3】在密闭容器,一定条件下进行反应,mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确得就是()A.正反应就是吸热反应B、逆反应就是吸热反应C。
m+n>p+q D.m+n<p+q【练习4】应N2(g)+3H2(g) 2NH3(g) △H〈0 在某一时间段中反应速率与反应过程得曲线关系如图,则图中氨得百分含量最低得时间段就是( ) ,氨得百分含量最高得时间段就是( ) A。
t0-t1 ﻩ B.t2-t3C、t3—t4ﻩD。
t5—t62、c—t图像:分清反应物与生成物,浓度减小得为反应物,浓度增大得为生成物,分清消耗浓度与增加浓度,反应物得消耗浓度与生成物得增加浓度之比,等于化学方程式中各物质得化学计量数之比。
【练习5】今有X(g)+Y(g) 2Z(g) △H<0、从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化得原因就是()ﻩA、增大X或Y得浓度B、增大压强ﻩC.增大Z得浓度D。
化学的反应速率和化学的平衡图像练习题目

化学反响速率和化学平衡图像班别某某学号1、速率——时间图此类图像定性揭示了V正、V逆,对于条件的改变随时间变化的规律,表现了平衡移动的方向和平衡的特征.认识此类图像的关键:假如改变单一物质的浓度,图像是连续的,假如改变体系的温度和压强,如此图像不连续.对于反响:mA<气>+nB<气>pC<气>+qD<气> +Q,请根据提示完成以下的图像<→表示平衡向正反响方向移动,←表示平衡向逆反响方向移动>.〔〕〔〕〔〕〔1〕增大反响物浓度〔2〕减少生成物浓度〔3〕增大生成物浓度〔〕〔〕〔〕〔4〕减少反响物浓度〔5〕温度〔Q>0〕〔6〕降低温度〔Q>0〕〔〕〔〕〔〕〔7〕温度〔Q<0〕〔8〕降低温度〔Q<0〕〔9〕加压〔m+n=p+q〕〔〕〔〕〔〕〔10〕减压〔m+n=p+q〕〔11〕加压〔m+n>p+q〕〔12〕减压〔m+n>p+q〕〔〕〔〕〔〕〔13〕加压〔m+n<p+q〕〔14〕减压〔m+n<p+q〕〔15〕参加催化剂2、浓度〔物质的量〕—时间图此类图像能说明平衡体系中各组分的浓度<或物质的量>在反响过程中的变化情况,根据图像可看出反响物和生成物,以与浓度的改变推出各组分的计量数之间的关系,进而推写化学方程式.对于图〔16〕:〔16〕〔17〕〔1〕、该反响的化学方程式;〔2〕、反响开始至3min末,Y的反响速率为;〔3〕、该反响是由开始的〔正反响、逆反响、正逆么应同时〕3、全程速率—时间图此类图像的分析要抓住各个阶段的主要矛盾——影响速率的主要因素.如Zn 与足量的盐酸反响,反响速率随时间的变化情况如图〔17〕所示.其中A~B速率变化的原因是;B~C速率变化的原因是.4、含量<或转化率>—时间—温度<或压强>图此类图像的分析应注意3个方面的问题:〔1〕纵坐标表示的意义;即是反响物还是生成物的含量,还是反响物的转化率?〔2〕达平衡的时间:温度越高〔或压强越大〕,反响的速率越大,达到平衡的时间越短.〔3〕平衡线的上下:根据纵坐标的含义与反响方程式的特点<放热或吸热以与反响前后气体分子数的关系>来判断平衡线的上下.以反响mA<气>+nB<气>pC<气>+qD<气> +Q为例,图示如下:〔18〕当P一定,如此Q 〔19〕当T一定,如此m+np+q〔20〕当T一定,如此m+np+q 〔21〕当T一定,如此m+np+q〔22〕当P一定,如此Q 〔23〕当P一定,如此Q〔24〕当T一定,如此m+np+q 〔25〕当T一定,如此m+np+q5、恒温<或恒压>线此类图像的分析应注意以下3个方面:<1> 纵坐标所表示的意义:是百分含量还是转化率;<2> 根据横轴与反响方程式的特点判断曲线的走向;<3> 作纵轴的平行线,依据反响方程式的特点与坐标的含义来判断平衡线的相对位置.+nB<气>pC<气>+qD<气> +Q为例,图示如下:以反响mA<气>〔26〕当Q>0,如此m+np+q 〔27〕当Q<0,如此m+np+q〔28〕当m+n < p+q,如此Q0 〔29〕当m+n > p+q,如此Q0〔30〕当Q<0,如此m+np+q六、速率—温度<或压强>图此类图像的分析应注意条件的变化与正逆反响速率变化的关系,即温度〔增大压强〕正逆反响都增大,只是增大的程度应依据反响方程式的特点来确定.+nB<气>pC<气>+qD<气> +Q为例,图示如下:以反响mA<气>〔31〕Q0 〔32〕Q0化学平衡图形题练习:1、右图表示外界〔温度、压强〕的变化对如下反响的影响L<s>+3G<g>2R<g><正反响为热反响>,在图中,y轴是指A、平衡混合物中R的百分含量B、平衡混合物中G的百分含量C、G的转化率D、L的物质的量2、反响A<g>+B<g>C<g>在密闭容器中进展.假如存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线,情况②是曲线,情况③是曲线,3、右图是关于反响A2<g>+3B2<g>2C<g><正反响为放热反响>的平衡移动图形,影响平衡移动的原因是A、温度,同时加压B、降低温度,同时减压C、增大反响物浓度,同时使用催化剂D、增大反响物浓度,同时减小生成物浓度4、可逆反响A<g>+B<g>2C<g>在不同的温度下经过一时间,混合物中C的体积分数与温度的关系如以下图,那么:⑴反响在温度下达到平衡.⑵此反响的正反响为热反响;⑶由T1向T2变化时正反响速率逆反响速率〔填>、<、=〕;⑷由T3向T4变化时正反响速率逆反响速率5、有一化学平衡mA<g>+nB<g>PC<g>+qD<g>,右图表示的转化率与压强、温度的关系.由此得出的正确结论是A、正反响是吸热反响,〔m+n〕>〔p+q〕B、正反响是吸热反响,〔m+n〕<〔p+q〕C、正反响是放热反响,〔m+n〕>〔p+q〕D、正反响是放热反响,〔m+n〕<〔p+q〕6、对可逆反响A<g>+B<g>===C<g>〔正反响为吸热反响〕,如下图像正确的答案是7、对于2A<g>+B<g>2C<g>〔正反响为放热反响〕,符合该反响的如下图象:8、右图中a曲线表示一定条件下可逆反响X<g>+Y<g>2Z<g>+W<S>〔正反响为放热反响〕的反响过程.假如使a曲线变为b曲线,可采用的措施是A、参加催化剂B、增大Y的浓度C、降低温度D、增大体系压强9、如下图表示平衡混合物中X的体积分数在不同的压强下随温度变化的情况,在下述的平衡体系中,X可以代表横线标明的物质〔反响中各物质均为气态〕是〔〕A、N2+3H2 2NH3 正反响为放热反响B、H2+I2 2HI 正反响为放热反响C、2SO3 2SO2+O2 正反响为吸热反响D、4NH3+5O2 4NO+6H2O 正反响为吸热反响10、可逆反响L<S>+G<g>2R<g>由右图分析Y所表示的量反响的能量变化为< >A、R的体积分数,正反响为放热反响B、G的体积分数,正反响为吸热反响C、G的转化率,正反响为放热反响D、R的分解率,正反响为放热反响11、可逆反响2A+B 2C〔g〕正反响为放热反响,随温度变化气体平衡相对分子质量如以下图.如此如下表示正确的答案是A、A和B可能都是固体B、A和B一定都是固体C、假如B为固体如此A一定为气体D、A和B可能都是气体12、在密闭容器中进展如下反响:M<g>+N<g>R<g>+2L.此反响符合如下图象,R%为R在平衡混合物中的体积分数,该反响是〔〕A、正反响为吸热反响L是气体B、正反响为放热反响L是气体C、正反响为吸热反响L是固体D、正反响为放热反响L是固体或液体13、在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反响,达到平衡后,测得X,Y的转化率与起始时两物质的物质的量之比nx:ny的关系如以下图,如此X和Y的反响方程式可表示为〔〕A、3X+Y ZB、2X+Y ZC、X+3Y ZD、3X+Y 2Z14、今有X<g>+Y<g>2Z<g>正反响为放热反响,从反响开始经过t1S后达到平衡状态t2S时,由于条件改变,平衡受到破坏,在t3S时又到平衡.根据右图回答:从t2S到t3S间的曲线变化是由哪种条件引起的A、增大X或Y的浓度B、增在压强C、增大Z的浓度D、温度15、如下图表示反响:N2+3H2 2NH3建立平衡的过程,如果用纵坐标表示物质的量浓度,横坐标表示时间来绘制这一反响的图形,如此如下图形中一举正确的答案是16、在一密闭容器中进展如下反响:A<g>+B<g>2C<g>+2D,此反响符合右图〔其中C%是混合物中C的质量分数,t为反响时间〕对此反响的表示正确的答案是A、正反响为吸热反响,D是固体B、正反响为吸热反响,D是气体C、正反响为放热反响,D是固体或液体D、正反响为放热反响,D是气体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题:化学反应速率化学平衡图像题精选精练(64题)A组基础训练型1.右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。
图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是A A或EBC C BD D2.有如下的可逆反应:X(g)+2Y(g)2Z(g)现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是A 100℃B 200℃C 300℃D 不能确定3.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X,Y的转化率与起始时两物质的物质的量之比n x/n y的关系如图所示,则X,Y的反应方程式可表示为A 2X+Y3ZB 3X+2Y2ZC X+3Y ZD 3X+Y Z4.在A(g)+B(g)=C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则正反应是放热反应的图为A B C D5.可逆反应aX(g)+bY(g)cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图象如右图。
则下列说法中正确的是A 若a+b=c,则t0时只能是增大了容器的压强B 若a+b=c,则t0时只能是加入了催化剂C 若a+b≠c,则t0时只能是增大了容器的压强D 若a+b≠c,则t0时只能是加入了催化剂6.现有可逆反应A(g)+2B(g)n C(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如右图所示,其中结论正确的是A p1>p2,n>3B p1<p2,n>3C p1<p2,n<3D p1>p2,n=37.在容积不变的密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)=0.5N2(g)+CO2(g);ΔH=-373.2 kJ/mol。
右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。
若改变起始条件,使反应过程按照曲线b进行,可采取的措施是A 加催化剂B 向密闭容器中加入氩气C 降低温度D 增大反应物中NO的浓度8.下图表示反应A(气)+B(气)nC(气)(正反应放热)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。
下列有关叙述正确的是A 若其它条件相同,a 比b 的温度高B a 表示有催化剂,b 表示无催化剂C 若n =2,其它条件相同,a 比b 的压强大D 反应由逆反应开始9.对于如下的反应:mA (g )+nB (g )pC +qD 当其它条件不变,温度分别为T 1和T 2时,反应物B 的百分含量与反应时间(t )的关系分别可用图中曲线I 和曲线II 表示,据此下列判断正确的是A T 1>T 2B 正反应是吸热反应C T 2>T 1D 逆反应是吸热反应10.同压、不同温度下的反应:A(g)+B(g)C(g)A 的含量和温度的关系如右图所示,下列结论正确的是A T 1>T 2,正反应吸热B T 1<T 2,正反应吸热C T 1>T 2,正反应放热D T 1<T 2,正反应放热11.在一定温度不同压强(p 1<p 2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z 在反应混合物中的体积分数( )与反应时间(t )的关系有以下图示,正确的是A B C D12.今有反应X (g )+Y (g )2Z (g )(正反应放热),右图表示该反应在t 1时达到平衡,在t 2时因改变某个条件而发生变化的曲线。
则下图中的t 2时改变的条件是 A 升高温度或降低Y 的浓度B 加入催化剂或增大X 的浓度C 降低温度或增大Y 的浓度D 缩小体积或降低X 的浓度13.在一定条件下,可逆反应2X (g )2y (g )+z (g )(正反应放热),在t 1时达到平衡,然后在t 2时开始加热至一定温度后停止加热并保温,到t 3时又建立平衡,下图中能表示这一变化情况的是A B C D14.在一定温度下发生反应:I 2(g )+H 2(g )2HI (g );△H <0并达平衡。
HI 的体积分数V (HI )随时间变化如图曲线(II )所示。
若改变反应条件,在甲条件下V (HI )的变化如曲线(I )所示。
在乙条件下V (HI )的变化如曲线(III )所示。
则甲条件、乙条件分别是①恒容条件下,升高温度 ②恒容条件下,降低温度③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积⑤恒温恒容条件下,加入适当的催化剂A ①⑤,③B ②⑤,④C ③⑤,②D ③⑤,④15.密闭容器中,有反应:A 2+B 22AB ,产物AB 的生成情况如图所示,a 为500℃,b 为300℃时的情况,c 为300℃时从时间t 3开始向容器中加压的情况,下列叙述正确的是ZX浓度 O122A A2、B2、AB均为气体,正反应放热B AB为气体,A2、B2中最少有一种为非气体,正反应吸热C AB为气体,A2、B2中最少有一种为非气体,正反应放热D AB为固体,A2、B2中最少有一种为非气体,正反应吸热16.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是A 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大17.对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为A Z、W均为气体,X、Y中有一种是气体B Z、W中有一种是气体,X、Y皆非气体C X、Y、Z、W皆非气体D X、Y均为气体,Z、W中有一种为气体18.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是A 该反应在T1、T3温度时达到过化学平衡B 该反应在T2温度时达到过化学平衡C 该反应的逆反应是放热反应D 升高温度,平衡会向正反应方向移动19.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是A t0~t1B t2~t3C t3~t4D t5~t620.如图所示,反应2SO2(g)+O2(g)2SO3(g);△H<0,在不同温度、不同压强(P1>P2)下达到平衡时,混合气中SO3的体积φ(SO3)随温度变化的曲线应为A B C D21.可逆反应aA(g)+bB(g)cC(g)+dD(g);ΔH同时符合下列两图中各曲线的规律的是A a+b>c+d T1<T2ΔH<0B a+b>c+d T1<T2ΔH>0C a+b<c+d T1>T2ΔH<0D a+b>c+d T1>T2ΔH>022.在一定条件下,固定容积的密闭容器中反应:2NO2(g)2NO(g)+O2(g);△H>0,达到平衡。
当改变其中一个条件X,Y随X的变化符合图中曲线的是A 当X表示温度时,Y表示NO2的物质的量B 当X表示压强时,Y表示NO2的转化率C 当X表示反应时间时,Y表示混合气体的密度D 当X表示NO2的物质的量时,Y表示O2的物质的量23.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示:下列描述正确的是A 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B 反应开始时10s,X的物质的量浓度减少了0.79mol/LC 反应开始时10s,Y的转化率为79.0%D 反应的化学方程式为:X(g)+Y(g)Z(g)24.右图是温度和压强对X+Y2Z反应影响的示意图。
图中横坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是A 上述可逆反应的正反应为放热反应B X、Y、Z均为气态C X和Y中只有一种为气态,Z为气态D 上述反应的逆反应的ΔH>025.下图表示的平衡混和物中,产物X的百分含量在不同压力下随温度改变的情况,在下述哪一个可逆体系中X可代表用横线标明的物质A N2(g)+O2(g)2NO(g)(正反应吸热)B 2SO3(g)2SO2(g)+O2(g)(正反应吸热)C N2(g)+3H2(g)2NH3(g)(正反应放热)D 4NH3(g)+3O2(g)2N2(g)+6H2O(g)(正反应放热)26.在容积一定的密闭容器中发生可逆反应A(g)+2B(g)2C(g),△H>0;平衡移动关系如图所示。
下列说法正确的是A P1<P2,纵坐标指A的质量分数B P1>P2,纵坐标指C的质量分数C P1<P2,纵坐标指A的转化率D P1<P2,纵坐标指混合气体的平均摩尔质量27.对于反应A(s)+2B(g)3C(g)(正反应吸热),平衡混和物中C的百分含量C%与外界条件x、y的关系如下图所示,则下列结论中正确的是A x表示温度,y表示压强,且y1>y2>y3B x表示压强,y表示温度,且y3>y2>y1C x表示温度,y表示压强,且y3>y2>y1D x表示压强,y表示温度,且y1>y2>y328.在某恒温的容器中,可逆反应A(g)+B(g) xC(g),有如图所示的关系曲线,下列说法正确的是A 温度:T1>T2B 压强p1>p2C 该正反应是吸热反应D x的值是129.在下列反应中:A2(g)+B2(g)2AB(g)(正反应放热)当其达到平衡时,在下图的曲线中,符合勒沙特列原理的曲线是A ①②B ③④C ①D ①⑤30.对气体反应:mA+nB eC 温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是A 正反应是放热反应B m+n<eB 正反应是吸热反应 D m+n>e31.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)A P3>P4,y轴表示B的转化率B P3<P4,y轴表示B的体积分数C P3<P4,y轴表示混合气体的密度D P3>P4,y轴表示混合气体的平均mol质量32.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是A 10~15 min可能是加入了正催化剂B 10~15 min可能是降低了温度C 20 min时可能是缩小了容器体积D 20 min时可能是增加了B的量33.用来表示可逆反应:2A(g)+B(g)2C(g)(正反应放热)的正确图象是下图中的A B C D34.对于可逆反应:A2(g)+3B2(g)2AB3(g)(正反应放热),下列图象中正确的是A B C D35.下列图象能正确地表达可逆反应3A(g)+B(g)2C(g)(△H<0=的是36.密闭容器中mA(g)+nB(g)pC(g),反应达到平衡,经测定增大压强P时,A 的转化率随P 而变化的曲线如右图。
