仪器分析复习提纲(lastversion)
现代仪器分析技术复习纲要

现代仪器分析技术复习纲要第一章热分析方法1、热分析是测量物质的物理或化学参数对温度的依赖关系的一种分析技术。
2、所谓程序控制温度,就是把温度看著就是时间的函数。
3、热分析的定义是:在程序控温下测量物质的物性与温度关系一类技术统称为“热分析”4、热重法tg:在程序控制温度下,测量物质的质量与温度关系的一种技术。
5、微商热重法dtg:得出嶂厍线对时间或温度一级微商的方法。
6、热差分析法dta:在程序控制温度下,测量物质与参比物之间温度差与温度关系的一种技术。
7、差示扫描量热法dsc:在程序控制温度下,测量输给物质与参比物的功率差与温度关系的一种技术。
第一节tg及dtg1、tg及dtg的测试原理:通过用热天平测量冷却时物质的质量变化,凡是物质冷却或加热过程中存有重量变化的都可以用这两种方法展开测量。
2、两种测量方式:零位法、变位法3、各种因素对tg测重的影响:浮力的影响、对流的影响、还有试样盘的形状、试样量、气氛、升温速度以及被分析样品的挥发物的再凝缩、温度的测量等,甚至同样的样品在不同厂家不同型号的仪器所得到的结果也会有所不同。
为了得到最佳的可比性,应该尽可能稳定每次实验的条件,以便减少误差,使结果更能说明问题。
4、tg及dtg在高分子材料研究中的应用领域:(1)热稳定性的测评(2)添加剂的分析(3)共聚物和共混物的分析(4)挥发物的分析(5)水分的测量(6)水解诱导期的测量(7)切割过程分析(8)热分解动力学研究(差示法、多种冷却速率法)。
很多高分子材料在加热时有失重过程,这些过程包括各种物理反应和化学反应.所以应用tg及dtg方法来分析高分子材料时能得到多方面的信息.如配方的分析、热稳定性的研究、热裂解机理的研究、聚合物并用及共聚物的研究和某些化学反应动力学的研究等5、评价热稳定性:直观的相同条件比较法(相对热稳定性比较)、关键温度表示法(特征温度比较)、ipdt(分数程序水解温度)法(阴影面积太少稳定性高)、最小舱内速度法(即dtg曲线的峰顶温度就是最小舱内速度点温度)、iso法和astm法等测量增塑剂、水分的含量。
仪器分析复习提纲(lastversion)

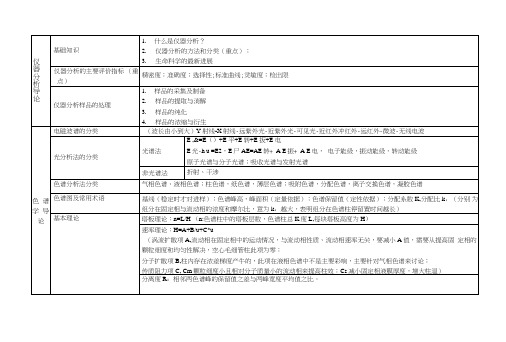
仪器分析复习提纲Chapter 1仪器分析定义 :仪器分析是以物质的物理和物理化学性质为基础建立起来的一种分析方法, 测定时常常需要使用比较复杂的仪器,它是分析化学的发展方向。
分类 :1、光学分析法(紫外 -可见光谱法、红外光谱法、分子荧光(磷光)光谱法、原子吸 收光谱法、原子发射光谱法) ;2、电化学分析(极谱与伏安分析法、库仑分析法、电解分析 法、电位分析法) ;3、色谱分析法(气相色谱法、液相色谱法) ; 4、其他方法(质谱法、流 动注射分析法、热分析法)特点 : 1、选择性好; 2、操作简便、分析速度快 、容易实现自动化; 3、灵敏度高; 4、相对 误差大(不宜用于大量分析)分析仪器的组成:Chapter 2 光分析的三个基本过程 :激发信号、信号转换、输出信号 (能源提供能量;能量与被测物之间的互相作用;产生信号) 光谱分析分类 :原子光谱(线状光谱) 、分子光谱(带状光谱) 吸收光谱、发射光谱电磁辐射的基本性质(波粒二象性) 电磁辐射的频率、波长、波数、速率的基本概念以及运算关系 λ=1/ 波数 E=hc/ λ=hν 波速 =νλ( 1eV=1.602J h=6.626 J s ) 光谱法仪器五个基本单元: 光源、单色器、样品、检测器、显示与数据处理 棱镜与光栅的分辨率与色散率的计算 1、 棱镜色散率 =偏向角对波长求导(角色散率) =谱线距离对波长求导(线色散率) 线色散率=角色散率×焦距 /sin 光轴夹角分辨率 =平均波长 /波长差 =棱镜总底边长×色散率2、 光栅色散率 =光谱级次 / (光栅常数× cos 衍射角)(角色散率) =角色散率×会聚透镜焦距分辨率 =光谱级次×光栅总刻痕数 各种光谱中样品池的选择 发射光谱——激发源 紫外光区——石英比色皿 可见光区——玻璃比色皿 红外光区—— NaCl 、KBr 、KRS-5、固体试样与 KBr 做成的盐窗(混合压片) 荧光分析——低荧光物质做成的比色皿常用检测器的检测原理1、 硒光电池(光敏半导体) ;2、光电管(光电效应) ;3、光电倍增管(光电效应) 光源: 原子发射——原子化器原子吸收——空心阴极灯(紫外 -可见区锐线光源) 紫外吸收——氢灯、氘灯(紫外区连续光源) 可见吸收——钨灯(可见区连续光源) 红外吸收—— Nernst 灯、硅碳棒(中红外区连续光源) 分子荧光(磷光)——高压汞灯(紫外 -可见区线光源)Chapter 3 紫外-可见分光光度法分子吸收光谱形成原因:价电子和分子轨道上的电子在电子能级间跃迁,并伴随有振动和 转动能级间的跃迁 Δ E=hν 电子跃迁类型 与有机化合物有关的价电子有σ、π和 n 电子,主要跃迁有: 1.N -V 跃迁:由基态跃迁至反键轨道:σ -σ *、π -π* 2.N -Q 跃迁:非键电子跃迁到反键轨道: n-σ* 、n-π* 3.N -R 跃迁:σ电子激发到更高能级或电离 能量大小顺序:σ -σ*<n -σ*<π-π*<n - π* 测量到的是π - π*和 n-π*两种跃迁 π -π*跃迁一般在 200nm 附近; n-π*跃迁一般在近紫外区,吸收强度弱。
[精品]仪器分析复习大纲.doc
![[精品]仪器分析复习大纲.doc](https://img.taocdn.com/s3/m/015690c1b9f67c1cfad6195f312b3169a451eab6.png)
[精品]仪器分析复习大纲.doc仪器分析实验复习大纲1、原子吸收光谱法的原理,原子吸收光谱仪由哪几部分组成以及每部分的作用。
原理:原子吸收光谱法是基于从光源辐射出具有待测元素特征波K 的光通过试样原子蒸汽时,被蒸汽屮被测元素的基态原子所吸收,我们利用光被吸收的程度来测定被测元素的含量。
组成及作用:光源(提供被测元素共振谱线的锐线光源)原子化器(将试液蒸发干燥并使待测元索转变成气态的基态原子,使待测试样中元索原子化)单色器(使光源发出的光在很窄的波长范围内)检测系统(将待测光信号转换成电信号,经检波放大后显示结果)2、原子吸收光谱法中常用的光源是什么?原子化器冇哪些?常用光源:能产生锐线光源的光源如空心阴极灯、蒸汽放电灯、高频无极放电灯等。
原子化器:火焰原子化器、石墨炉原子化器、氢化物发生原子化器。
3、原子吸收光谱法进行定量分析的依据是什么?常用的定量分析方法冇哪些?分析依据:A=KC 对于大部分元素,A—C曲线在一定的浓度分析范围内呈线性关系。
方法:校正曲线法(工作曲线法)、标准加入法。
4、电位分析法的原理、测量装置。
原理:电位分析法是利用指示电极电位和溶液中某种离子的活度(或浓度)之间的关系来测定物质含量的一种电分析化学方法。
在实际屮可以通过测量由指示电极、参比电极和待测溶液组成电池的电动势来求得待测物的含量。
测量装置:指示屯极、参比电极、辅助屯极、电化学工作站。
5、什么叫参比电极,工作电极,辅助电极?各类电极常用有哪些,各例举两种。
参比电极:在测量过程中,其电位基本不发生变化的电极称为参比电极。
工作电极:测量期间,如果冇较大的电流通过,主体浓度发生显著改变的体系,则相应的电极称为工作电极。
辅助屯极:辅助屯极仅提供电子传导场所,与工作电极组成电池,形成通路,但电极上进行的电化学反应并非实验屮所需研究或测试的。
6、在电位分析法中通常需要加入总离子强度调节剂,测饮用水中氟离子的时候,需要加入TISAB, TISAB 的组成是什么及各组成部分的作用?组成:氯化钠、柠檬酸钠、HAc—NaAc缓冲溶液。
仪器分析复习重点

▪ 7.固定液选择的原理是? ▪ 8.在色谱分析法中,为什么要测定定量校
正因子 ?
▪ 9.液相色谱中正相,反相色谱的定义及研 究对象
▪ 10.色谱定量分析公式-内标法 ▪ 11.色谱分离条件选择-如何提高柱效
第三节 HPLC的主要类型及分离原理
1. 液液分配色谱
亲水性固定液常采用疏水性流动相,即流动相的极 性小于固定相的极性,称为正相液液色谱法,极性柱 也称正相柱。主要应用于分离甾醇类、类脂化合物、 磷脂类化合物、脂肪酸以及其他有机物。
cM mMVS
VS
:相比
相对保留值 r21:指组分2和组分1的调整保留值之比。
r21
t 'R2 t 'R1
V 'R2 V 'R1
相对保留值的特点是只与温度和固定相的性质有关, 与色谱柱及其它色谱操作条件无关。
相对保留值反映了色谱柱对待测两组分1和2 的选 择性,是气相色谱法中最常使用的定性参数。
例:用电解法从组成为0.01 mol/L Ag+, 2mol/L Cu2+的混合液中分离Ag+ 和Cu2+,已知铜的标 准电极电位为0.345V,银的标准电极电位为 0.779V。
问:1)首先在阴极上析出的是铜还是银?
2)电解时两者能否完全分离?
3) 外加电压应控制在什么数值上,Ag+与Cu2+ 完全分离,阳极电位等于1.23v(vs.SCE,不考 虑超电位) ?
测待测液的pH值,写出该化学电池的符号表示式?(见书 P113) 5.离子选择性系数 的定义?(见书P118) 6.盐桥是什么组成的?作用是什么? 7.干扰电流及其消除方法(见书P162) 8.什么是残余电流,它产生的原因是什么?它对极谱分析有 什么影响? (见书P162)
苏州科技学院仪器分析复习简要提纲

仪器分析复习简要提纲(注:本提纲不覆盖全部考试内容;全面内容以课堂和书本为准)第一章:气相色谱分析(选择、填空、简答1-2、计算2,比例50-60%)1、气相色谱的组成以及作用(p5简答)(五个部分,每个部分的作用)2、有关色谱术语A)基线、基线漂移、基线噪声;B)保留值、死时间、保留时间、调整保留时间、相对保留值r21等的定义;通过相对保留值来判断样品分离效果;C)色谱流出曲线图以及区域宽度(Y、Y1/2、σ之间的关系Y1/2 = 2.35σ;Y= 4σ);3、色谱分析的基本原理A)分配系数、分配比的定义以及它们之间的关系(p9-10简答)K = C S/C M;k = m S/m M;K = k错误!未找到引用源。
;错误!未找到引用源。
= V M/V S(知道每个符号的含义)B)k = t R'/t M4、色谱分离的基本理论A)理解并掌握塔板理论的四个假设及其作用(p11-12简答)B)速率方程(p15-16简答、计算)H = A + B/u + Cu掌握公式,并且理解速率方程中每一项的含义,以及跟哪些因素有关。
5、色谱分离度(计算)A)分离度R的定义、公式(p17,公式2-27)B)根据分离度判断分离效果(R越大,分离效果越好)6、色谱分离基本方程(计算)(P18,公式2-29)A)根据色谱分离基本方程阐述影响色谱分离度的因素及其影响(简答)。
(柱校因子n、选择性系数α、容量因子k)B)一些计算公式:n = 16(t R/Y)27、分离条件的选择(计算)通过速率方程计算最佳流速和最小塔板高度(p21 公式2-34,2-35)8、气相色谱检测器类型(p34)浓度型(热导检测器、电子捕获检测器);质量型(氢火焰离子化检测器、火焰光度检测器)9、内标法计算组分含量(p53计算)10、毛细管柱的特点(p57简答)(速率方程中A项可忽略,可用长色谱柱,相比大,允许进样量少,柱效高等)例:p62,习题25、26、29第四章:电位分析法1、掌握电位分析法依据和基本原理(p111简答)Nernst方程(公式4-2),通过测定电极电位,确定离子的活度(直接电位分析法中,指示电极的电位与待测离子的活度符合能斯特方程)(电位分析法中,测量的化学电池的参数是电动势)2、以pH玻璃电极为例理解膜电位的形成(简答)3、离子选择性电极的选择性系数K ij的定义以及用途(p117)用途:估计共存离子的干扰程度= 0.01,说明电极对Na+比对K+敏感100倍)(例:K Na,K4、标准加入法,测定溶液中离子的浓度(p132-133,计算)公式4-25,4-29错误!未找到引用源。
《仪器分析》复习资料

《仪器分析》课程期末复习资料. 《仪器分析》课程讲稿章节目录:第一章绪论及课程导学第一节仪器分析概述第二节常见分析仪器概论第二章电化学分析法第一节电化学分析法概述第二节电位法的基本原理第三节直接电位法第四节电位滴定法第五节永停滴定法第三章光谱分析法概论第一节电磁辐射及其与物质的相互作用第二节光学分析法的分类第三节光谱分析仪器第四章紫外-可见分光光度法第一节紫外-可见分光光度法的基本原理和概念第二节紫外-可见分光光度计第三节紫外-可见分光光度分析方法第五章荧光分析法第一节荧光分析法的基本原理第二节荧光定量分析方法第三节荧光分光光度计和荧光分析技术第六章红外吸收光谱法第一节红外吸收光谱法的基本原理第二节有机化合物的典型光谱第三节红外吸收光谱仪第四节红外吸收光谱分析第七章原子吸收分光光度法第一节原子吸收分光光度法的基本原理第二节原子吸收分光光度计第三节原子吸收分光光度实验方法第八章核磁共振波谱法第一节核磁共振波谱法的基本原理第二节核磁共振仪第三节化学位移第四节偶合常数第五节核磁共振氢谱的解析第九章质谱法第一节质谱法的基本原理和质谱仪第二节质谱中的主要离子及其裂解类型第三节有机化合物的质谱解析第十章色谱分析法概论第一节色谱法的分类第二节色谱过程和色谱流出曲线第三节色谱参数第四节色谱法的基本原理第五节色谱法的基本理论第十一章平面色谱法第一节平面色谱法的分类和有关参数第二节薄层色谱法第三节纸色谱法第十二章气相色谱法第一节气相色谱法的分类和气相色谱仪第二节气相色谱法的固定相和载气第三节气相色谱检测器第四节气相色谱速率理论和分离条件选择第五节气相色谱法定性与定量分析方法第十三章高效液相色谱法第一节高效液相色谱法的主要类型第二节高效液相色谱法的固定相和流动相第三节高效液相色谱速率理论和分离方法选择第四节高效液相色谱仪第五节高效液相色谱定性与定量分析方法第十四章毛细管电泳法第一节毛细管电泳基础理论第二节毛细管电泳的主要分离模式第三节毛细管电泳仪第十五章色谱联用分析法第一节色谱-质谱联用分析法第二节色谱-色谱联用分析法客观部分:(单项选择、多项选择、判断)(一)、单项选择部分1. 分析化学的方法可分为化学分析和仪器分析,这是按照(D)分的。
仪器分析复习提要本.doc

1.总的要求:a.知识的掌握:掌握仪器分析的定义、仪器分析的特点(与化学分析相比);各种仪器分析方法的中英文和简称、基本原理、仪器组成、定量定性方法、各种仪器分析方法的应用范围。
包括哪些方法,定量定量方法,定性,分析的样品特点,可不可以多种组分的同时测定等,光谱分析法:电分析法:色谱分析法:B.技能的掌握:良好的实验习惯、简单样品的处理、实验条件的选择与优化、实验数据的记录与处理、实验结果的正确表示.C.能力的掌握:学习的能力:查阅文献的意识和能力;分析问题和解决问题的能力:运用分析化学中误差分析的知识对仪器实验中2.仪器分析方法的评价指标:线性范(相关系数)、灵敏出现的”异常,,现象进行合理分析。
度、精密度、准确度.检出限、选择性等IUPAC建议分析方法的主要评价指标:精密度、准确度、检出区域宽度,分配系数,分配比,保留指数,分离度,3・气相色谱法:气相色谱仪的组成(五部分);色谱术语(保量因子);理解分配系数和分配比的影响因素;分配系数与分配比的关系。
色谱理论(塔板理论,速率理论的表达式及各项的意义);常见气相色谱检测器类型(包括英文简写)及应用范围; 气相色谱定量计算方法及适用范围液相色谱法:HPLC 的主要类型及其选择;概念(反相 液相色谱/正相液相色谱);化合物在正相色谱和反相色谱的出 峰顺序。
高效液相色谱仪器组成部分;检测器类型。
色谱图,及从色谱图中可得到的信息。
电位分析法:电位测定法和电位滴定法的原理;用于测定 溶液pH 的指示电极是玻璃电极,参比电极是饱和甘汞电极;玻 璃电极的构造;酸差、碱差;利用氟离子电极测定氟离子时溶液 酸度太大或太小对测量的影响;总离子强度调节剂(TISAB )的 组成及作用。
电位滴定曲线上如何确定滴定终点。
测定离子浓度 或活度的方法。
选择性系数的意义;未知液pH 和未知离子浓度 的计算6. 伏安分析法:概念(半波电位,极限扩散电流),扩散电 流方程式,尤考维奇公式,残余电流的种类及消除方法,极谱定 量的方法及计算(标准加入法)7. 库仑分析法:库仑分析法的基本依据-法拉第电解定律, 库仑分析法必须满足的条件-两条,根据库仑分析法进行计算、8. 原子发射光谱法:原子光谱(原子光谱产生于原子外层电 子能级的跃迁)是根据待测物质的气态原子或离子受激发后所发 射的特征光谱的波长及其强度来测定物质中元素组成和含量的 分析方法。
仪器分析复习提纲(2).doc

《仪器分析》复习要点第二章气相色谱分析P4色谱分离的基本原理。
P5气相色谱仪器的丄作流程及各部分功能。
P6基木概念:基线;保留值;和对保留值。
P8色谱流出Illi线可以解决的问题。
P9分配系数概念及含义。
P15根据速率理论,式中各项的含义。
P17分离度的概念及分离标志。
P18根据色谱分离基木方程讨论各项的影响因素。
P21色谱分离操作条件该如何选择。
P27气相色谱中对单体的要求。
P27红色单体和白色单体各冇什么特点及适用范围。
P27硅藻土型单体可如何改性。
P28单体的选择原则。
P36热导池检测器的检测原理。
P38氢火焰离子化检测器的检测原理。
P40电子俘获检测器的检测原理。
P42基本概念:灵敏度;检出限;最小检出量。
P50定量校正因了的含义。
P52会利用归一化法进行计算。
P53会利用内标法进行计算。
笫三章高效液相色谱分析P66高效液相色谱法特点。
P69影响色谱峰扩展和色谱分离的因素。
P71正相、反相液液色谱。
P73离子交换色谱法分离原理。
P74离了色谱法分离原理。
P78化学键合固定相及特点。
P81对流动相要求。
第四章点位分析法P110电分析化学分类。
PU1会根据测定某离子,导岀原电池电动势与离子活度的关系式。
P112导出测定pH值的关系式,并说明该如何测定。
P118离子选择性系数的含义。
P118会根据离了选择性系数公式计算测定误差。
P119说明离子选择性电极具有选择性的原因。
P119离子选择性电极的分类。
P131测定离子浓度的方法(标准加入法)。
P132离了强度调节剂的含义。
P133会用标准加入法进行计算。
P135影响测定因素有哪些。
笫八章原子吸收光谱分析P228共振线;吸收线。
P231谱线变宽冇哪儿种,什么原因引起。
P234峰值吸收测定含义,导出的公式是什么。
P235原子吸收测定的是基态原子;在测定条件下所占比例。
P238灯电流该如何选择。
P240原子化方法有哪几种。
P24I三种空气■乙烘火焰特点是什么,各适合测什么元索。
仪器分析复习提纲

一、色谱分析法(气相色谱分析、高效液相色谱分析)1.气相色谱的一般组成载气系统(气源、气体净化器、供气控制阀门和仪器)进样系统(进样器、汽化室)分离系统(色谱柱、控温柱箱)检测系统(检测器、检测室)记录系统(放大器、记录仪、色谱工作站)2.了解色谱术语色谱流出曲线:试样中各组分经色谱柱分离后,按先后次序经过检测器时,检测器就将流动相中各组分浓度变化转变为相应的电信号,由记录仪记录下的信号-时间曲线或信号-流动相体积曲线。
基线:在操作条件下,仅有纯流动相进入检测器时的流动曲线。
峰高,h:色谱峰顶点与峰底之间的垂直距离。
峰面积,A:峰与峰底之间的面积。
峰底宽,Y:Y=4σ半峰宽,Y1/2=2.35σ标准偏差,σ:0.607倍峰高处色谱峰宽度的一半。
保留值:通常用时间或将组分带出色谱柱所需的载气体积来表示。
保留时间,t R:从进样至被测组分出现浓度最大值时所需时间。
保留体积,V R:从进样至被测组分出现最大浓度时流动相通过的体积。
死时间,t M:不被固定相滞留的组分从进样至出现浓度最大值时所需的时间。
死体积,V M:不被固定相滞留的组分从进样至出现浓度最大值时流动相通过的体积;V M=t M*F0,F0:柱尾载气体积流量。
调整保留时间,t R’:t R’=t R-t M调整保留体积,V R’:V R’=V R-V M相对保留值,R i,s:在相同的操作条件下,待测组分与参比组分的调整保留值之比;与柱长、柱径、填充情况、流动相流速等条件无关,仅与温度、固定相种类有关;为1时两组分不能分离。
3.色谱流出曲线可解决的问题依据色谱峰的位置(保留时间)可以进行定性分析;依据色谱峰的面积或峰高可以进行定量分析;根据色谱峰的位置及其宽度,可以对色谱柱分离情况进行评价。
4.分配系数与分离的关系,影响分配系数的主要因素分配系数,K:在一定温度压力下组分在固定相和流动相间达到分配平衡时的浓度比值。
分配系数是色谱分离的依据。
现代仪器分析复习提纲

1.1光谱分析法及其分类(1).发射光谱法①原子发射光谱法在正常状态下,原子外层价电子处于基态,在受到外部能量作用而被激发后,由能量较低的基态跃迁到能量较高的激发态。
处于激发态的电子十分不稳定,在极短时间内返回到基态或其他较低的能级时,特定元素的原子可发射出一系列不同波长的特征光谱线,这些谱线按一定的顺序排列,并保持一定强度比例,通过这些谱线的特征来识别元素,测量谱线的强度来进行定量,这就是原子发射光谱法。
②荧光或磷光光谱法气态金属原子和物质分子受电磁辐射(一次辐射)激发后,能以发射辐射的形式(二次辐射)释放能量返回基态,这种二次辐射称为荧光或磷光,测量由原子发射的荧光和分子发射的荧光或磷光强度和波长所建立的方法分别称为原子荧光光谱法、分子荧光光谱法和分子磷光光谱法。
同样作为发射光谱法,这三种方法与原子发射光谱法的不同之处是以辐射能(一次辐射)作为激发源,然后再以辐射跃迁(二次辐射)的形式返回基态。
分子荧光和分子磷光的发光机制不同,荧光是由单线态-单线态跃迁产生的。
由于激发三线态的寿命比单线态长,在分子三线态寿命时间内更容易发生分子间碰撞导致磷光猝灭,所以测定磷光光谱需要用特殊溶剂或刚性介质“固定”三线态分子,以减少无辐射跃迁,达到定量测定的目的。
(2).吸收光谱法①原子吸收光谱法原子中的电子总是处于某一种运动状态之中。
每一种状态具有一定的能量,属于一定的能级。
当原子蒸气吸收紫外-可见光区中一定能量光子时,其外层电子就从能级较低的基态跃迁到能级较高的激发态,从而产生所谓的原子吸收光谱。
通过测量处于气态的基态原子对辐射能的吸收程度来测量样品中待测元素含量的方法,称为原子吸收光谱法。
②分子吸收光谱法分子吸收光谱产生的机理与原子吸收光谱相似,也是在辐射能的作用下,由分子内的能级跃迁所引起。
但由于分子内部的运动所涉及的能级变化比较复杂,因此分子吸收光谱比原子吸收光谱要复杂得多。
根据照射辐射的波谱区域不同,分子吸收光谱法可分为紫外分光光度法、可见分光光度法和红外分光光度法等。
仪器分析复习内容(重点)

第二章气相色谱分析1.简要说明气相色谱分析的基本原理借在两相间分配原理而使混合物中各组分分离。
气相色谱就是根据组分与固定相与流动相的亲和力不同而实现分离。
组分在固定相与流动相之间不断进行溶解、挥发(气液色谱),或吸附、解吸过程而相互分离,然后进入检测器进行检测。
2.气相色谱仪的基本设备包括哪几部分?各有什么作用?气路系统.进样系统、分离系统、温控系统以及检测和记录系统.气相色谱仪具有一个让载气连续运行管路密闭的气路系统.进样系统包括进样装置和气化室.其作用是将液体或固体试样,在进入色谱柱前瞬间气化,然后快速定量地转入到色谱柱中.3.试以塔板高度H做指标,讨论气相色谱操作条件的选择.解:提示:主要从速率理论(van Deemer equation)来解释,同时考虑流速的影响,选择最佳载气流速.P13-24。
(1)选择流动相最佳流速。
(2)当流速较小时,可以选择相对分子质量较大的载气(如N2,Ar),而当流速较大时,应该选择相对分子质量较小的载气(如H2,He),同时还应该考虑载气对不同检测器的适应性。
(3)柱温不能高于固定液的最高使用温度,以免引起固定液的挥发流失。
在使最难分离组分能尽可能好的分离的前提下,尽可能采用较低的温度,但以保留时间适宜,峰形不拖尾为度。
(4)固定液用量:担体表面积越大,固定液用量可以越高,允许的进样量也越多,但为了改善液相传质,应使固定液膜薄一些。
(5)对担体的要求:担体表面积要大,表面和孔径均匀。
粒度要求均匀、细小(但不宜过小以免使传质阻力过大)(6)进样速度要快,进样量要少,一般液体试样0.1~5uL,气体试样0.1~10mL.(7)气化温度:气化温度要高于柱温30-70℃。
4.试述速率方程中A, B, C三项的物理意义. H-u曲线有何用途?曲线的形状主要受那些因素的影响? 解:参见教材P14-16A 称为涡流扩散项,B 为分子扩散项,C 为传质阻力项。
下面分别讨论各项的意义:(1) 涡流扩散项A 气体碰到填充物颗粒时,不断地改变流动方向,使试样组分在气相中形成类似“涡流”的流动,因而引起色谱的扩张。
《仪器分析》考试大纲

《仪器分析》考试大纲重点掌握常用仪器分析方法的基本原理、基本知识、基本技能。
了解仪器的结构及常用仪器的主要组成部分,学会使用一些仪器。
要求初步具有根据分析的目的、要求和各种仪器分析方法的特点、应用范围,选择适宜的分析方法以解决分析问题。
第一章绪论基本要求:本章要求了解仪器分析的任务、作用、特点及其仪器分析的方法、分类及发展概况,掌握定量分析方法的评价指标第一节仪器分析简介1、仪器分析和化学分析2、仪器分析方法——光学分析法,电化学分析法,色谱法,其它仪器分析方法3、仪器分析的发展概况第二节定量分析方法的评价指标1、标准曲线——标准曲线及其线性范围,标准曲线的绘制,相关系数2、灵敏度3、精密度4、准确度5、检出限第二章光谱分析法导论基本要求:了解光与物质相互作用引起原子、分子内部量子化能级之间的跃迁所产生的光谱,掌握原子光谱、分子光谱及光谱分析法的分类。
弄清原子光谱和分子光谱的概念。
第一节电磁辐射1、电磁辐射的性质2、电磁辐射第二节原子光谱和分子光谱1、原子光谱2、分子光谱第三章紫外-可见吸收光谱法基本要求:掌握紫外可见吸收光谱法的基本原理,用紫外可见吸收光谱进行定性分析、结构分析和定量分析的方法及具体应用,紫外可见吸收光谱的产生与影响因素;了解紫外可见分光光度计的基本构造及仪器类型。
第一节概述第二节紫外-可见吸收光谱1、有机化合物的紫外-可见吸收光谱2、无机化合物的吸收光谱第三节紫外可见分光光度计1、基本部件——光源,单色器,吸收池,检测器,信号显示器2、分光光度计构造原理第四节紫外-可见吸收光谱法的应用1、紫外吸收光谱法在有机定性分析中的应用(1)化合物的鉴定(2)结构分析2、定量分析——单组分、多组分物质分析第四章红外吸收光谱法基本要求:掌握红外吸收光谱法的基本原理和红外吸收光谱法的定性分析及未知物结构的确定,红外吸收光谱的振动形式、红外吸收光谱产生的条件和谱带强度;掌握基团频率与红外光谱区域及影响基团频率位移的因素;了解红外吸收光谱仪主要部件及类型;学会解析简单的红外光谱谱图——进行定性分析。
《仪器分析》考前复习提纲

《仪器分析》考前复习提纲第一篇:《仪器分析》考前复习提纲—1—仪器分析5.原子发射光谱特点优点:1.多元素同时检测能力强;2.分析速度快;3.选择性好;4.检测限比较低;5.耗品少;缺点:1.影响谱线强度因素多,参比样品要求高;2.浓度C误差大,不能做高浓度分析;3.只能用于元素分析,不能测结构;4.不适于有机物和大部分非金属元素:第八章原子吸收光谱法1.原子吸收光谱产生的原理:首先,测量前将样品用原子化器原子化,原子化温度在200K-300K,此时大多数化合物可解离为原子状态,其中包括被测元素的基态原子和激发态原子,在一定温度下,体系处于热力学平衡时,满足Nigi-Ei/kT,在300K一下,认为基态原子数等于吸收辐射的原子总数。
=eN0g02.理论上原子吸收光谱法的谱线是很尖锐的,但实际有一定的宽度,其影响谱线宽度因素:①多普勒展宽(热展宽):原子在空间中做无规则热运动;被测元素的原子量越小,温度越高,谱线的波长越长,多普勒展宽越大;②压力展宽(碰撞展宽):由于产生吸收的原子与蒸汽中原子或分子相互碰撞而引起的。
③自吸展宽:灯的电流越大,自吸展宽越严重。
3.光源(空心阴极灯)的作用:辐射待测元素的特征光谱,供测量使用。
4.原子化器的作用:使样品溶液中待测元素转化为基态原子蒸汽,并辐射光程产生共振吸收的装置。
5.原子吸收光谱的特点:优点:①灵敏度高;②检测限低;③选择性好;④重现性好:⑤速度快;缺点:①不能同时测几种元素;②难熔金属,易形成稳定化合物元素,原子化效率低;③非火焰原子化器,重现性差。
6.原子吸收光谱与原子发射光谱的异同点:相同点:①均为原子光谱,对应原子外层的电子跃迁;②均为线性光谱,共振辐射,且灵敏度高;Made by ZhangLun —2—不同点:①AAS:基态→激发态;AES:激发态→基态;AFS:核外电子受光能激发。
②AAS:测吸收强度;AES:测吸收光度;AFS:测荧光强度;③分析公式。
仪器分析复习纲要

态中各振动能级的分布情况。 因为基态中振动能级的分布和第一电子激发态中振动能级的 分布情况类似,因此荧光光谱的形状和吸收光谱极为相似。
1.样品前处理技术 萃取:超临界流体、加速溶剂、微波、超声波 净化:柱层析、固相萃取法、固相微萃取法
2.样品前处理的目的 消除基质的干扰、保护仪器、提高方法的准确度、精密度、 选择性和灵敏度。
食品样品的前处理,除了取样外,主要是指提取和净化步骤
3.样品置备的基本要求:代表性、有效性
4. 前处理方法的技术要求 所有监控组分的回收率要达到标准方法的要求; 尽量不使用价格昂贵的专用设备; 试剂和吸附剂纯度高,最好不需要再纯化处理,价格适中; 前处理所用的有机溶剂少或者不用; 前处理不强调将试样基质全部分离,但基质的剩余部分在色 谱图上的色谱峰不能影响主要成分定量,基质剩余部分尽量除。
11.样品制备 (一)红外光谱法对试样的要求
1. 试样纯度高,>98% 2. 试样应不含水,因为水会干扰测定,侵蚀盐窗 3. 试样浓度和压片的厚度应适当 (2) 不同状态样品的制备 1. 气体试样:在气体池中测定,气体池结构如下: 2. 液体试样 ①液膜法 沸点较高的试样,直接滴在两块盐片之间,形成液膜; 沸点较低,挥发性较大的试样,可注入封闭的液体池中,液 层厚度一般为0.01~1mm。 ②溶液法 对于红外吸收很强的液体,当调整厚度时仍不能得到满意的 谱图时,可配制成溶液以降低其浓度; 量少的液体试样,为了能灌满液体池,也需要加入溶剂; 某些固体和气体试样也可以用溶液的形式进行测定。 对所使用的溶剂必须仔细选择。溶解性好,无强烈红外吸 收,不侵蚀盐窗,无强烈溶剂化效应。 3. 固体试样 ①压片法 取试样0.5~2mg于玛瑙研钵中研细; 再加入100~200mg磨细干燥的KBr粉末,混合均匀; 将混合粉末加入压模内,在压力机中边抽气边加压,制成一 定直径及厚度的透明片; 将薄片放入仪器光束中测定。 ②薄膜法 对于熔点低,熔融时不分解、升华或发生化学反应的物质可 以 A 直接加热熔融后涂制或压制成膜; B 先将试样制成溶液,然后蒸干溶剂以形成薄膜。
《仪器分析》复习提纲.doc
基于测量待测元索 的基态原子对其特征谱线的 吸收程度而建立起来的分析 方法。
2.原子吸收光谱的产生:电 子基态・> 激发态
3.谱线变宽
1.组成:光源、原子化器、分 光系统,检测系统四部分
2.光源:锐线光源、空心阴极 灯(结构);
3.原子化器:将试样待测元素 转化为基态原子。火焰原子化器, 石墨炉原子化器
3.操作条件的选择:载气、 流速;柱温(程序升温); 载体和固定液的选择;进 样条件;
4.毛细管气相色谱:柱前分 流,柱后尾吹
仪器结构:气路系统.进样系统、 分离系统、检测系统、记录系统、 温控系统;
气相色谱检测器:热导检测器、 火焰离子化检测器、屯子捕获检 测器、火焰光度检测器。
高效液相色谱
1.HPLC的特点及其适用范 围;
传质阻力项C, Cm颗粒细度小且相对分子质量小的流动相来提高柱效;Cs减小固定相液膜厚度,增大柱温)
分离度R:相邻两色谱峰的保留值之差与两峰宽度平均值之比。
方法名称
理论
仪器
分析
方法
定性
定量
光谱
原了发射光谱
AES
1.定义:在一定条件下受激 后所发射的特征光谱来研究 物质化学组成及含量的方法。
2.原子发射光谱的产生:电 子激发态・> 基态
3.常见化合物的特征基团 频率
变换型;
2•压片法IR样品制备
谱进行比对
团的特征性的 红外吸收峰的 位置、强度和形 状
定律
分子发光法
1.定义:
2.分子荧光、磷光的产生原 理;
3.荧光激发光谱,荧光发射 光谱
4.荧光强度与荧光量了产率
5.荧光与分了结构的关系
6.化学发光,生物发光
仪器分析复习资料

仪器分析复习资料仪器分析的复习提纲第一章小结:仪器分析是以物质性质或物质化学性质及其在分析过程中所发生的分析结果与物质的内在关系为基础,进而对其进行定性、定量、进行形态和结构分析的一类测定方法。
精密度:指在相同条件下对同一样品进行多次平行测定,各平行测定结果之间的符合程度。
准确度:指多次测定的平均值与真值相符合的程度。
选择性:是指分析方法不受试样中共存物质干扰的程度。
选择性越好,干扰越小。
线性范围:指定量测定的最低浓度到遵循线性响应关系的最高浓度间的范围。
灵敏度:指分析信号随组分含量的变化率,与检测器的放大倍数有直接关系。
检出限:指能产生一个确证在试样中存在被测组分的分析信号所需要的该组分的最小含量或最小浓度。
D=3s0/b.仪器分析的主要优点:1.灵敏度极高;2.选择性好,适于复杂组分试样的分析;3.分析迅速,适于批量试样的分析;4.适于微量、超微量组分的测定;5.能进行无损分析;6.组合能力和适应性强,能进行在线分析;易于自动化和智能化。
第二章小结:光分析法:基于电磁辐射与待测物质相互作用后所产生的辐射信号与物质组成及结构关系所建立起来的分析方法。
光谱法——基于物质与辐射能作用时,分子发生能级跃迁而产生的发射、吸收或散射的波长或强度进行分析的方法。
激发能:原子外层电子由低能级跃迁到高能级所需要的能量。
电离能:原子外层电子获得足够大的能量,脱离原子,使原子电离所需要的最小能量。
光分析法仪器的基本单位:光谱仪器通常包括五个基本单位:1.光源;2.单色器3.试样装置4.检测器5.显示与数据处理第三章小结:原子发射光谱仪:用来观察和记录原子发射光谱并进行光谱分析的仪器称为原子发射光谱仪。
一般元素普线的强度会随浓度的下降而消失,其总数量也会同时减少,所以谱线中最后消失的谱线称“最后线”或最灵敏线。
原子发射光谱分析的特点:1.多元素同时检测的能力。
样品激发后,不同元素都发射特征光谱。
2.灵敏度高。
可进行痕量分析,检出限可达10—0.1ug.g-13.选择性好。
现代仪器分析复习大纲

现代仪器分析考点一、名词解释:色谱法的定义:色谱法又称色层法或层析法,是一种物理化学分析方法,它利用不同溶质(样品)与固定相和流动相之间的作用力(分配、吸附、离子交换等)的差别,当两相做相对移动时,各溶质在两相间进行多次“平衡”,使各溶质达到相互分离。
基线:无试样通过检测器时,检测到的信号即为基线。
保留时间(t R):组分从进样到柱后出现浓度极大值时所需的时间死时间(t M):不与固定相作用的气体(如空气)的保留时间。
调整保留时间:保留时间减去死时间(t R '):t R'= t R-t M分配系数K:在一定温度下,组分在两相间分配达到平衡时的浓度(单位:g / mL)比,称为分配系数,用K 表示,分配系数是色谱分离的依据。
分配比是指,在一定温度下,组分在两相间分配达到平衡时的质量比。
噪声N:无样品通过时,由仪器本身和工作条件等偶然因素引起基线的起伏称为噪声(以噪声带衡量).最低检测限:检测器响应值为3倍噪声水平时的试样浓度(或质量),被定义为最低检测限(或该物质的最小检测量)。
原子吸收光谱法(atomic absorption spectrometry, AAS):是以在蒸气状态被测元素原子对其共振辐射的吸收进行定量分析的方法。
锐线光源:光源发射线的中心频率与吸收线的中心频率一致,而且发射线的半宽度比吸收线的半宽度小得多时,则发射线光源叫做锐线光源。
线性范围:指进入检测器组分量与其响应值保持线性关系,或是灵敏度保持恒定所覆盖的区间,称线性范围。
二、简答题1、色谱法按照分离机制可以分为哪几种:(1)吸附色谱(adsorption chromatography )利用吸附剂表面对不同组分吸附性能的差异,达到分离鉴定的目的。
(2)分配色谱(partition chromatography)利用不同组分在流动相和固定相之间的分配系数(或溶解度)不同,而使之分离的方法。
(3)离子交换色谱(ion-exchange chromatography )利用不同组分对离子交换剂亲和力的不同,而进行分离的方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
仪器分析复习提纲 Chapter 1仪器分析定义:仪器分析是以物质的物理和物理化学性质为基础建立起来的一种分析方法, 测定时常常需要使用比较复杂的仪器,它是分析化学的发展方向。
分类:1、光学分析法(紫外-可见光谱法、红外光谱法、分子荧光(磷光)光谱法、原子吸 收光谱法、原子发射光谱法);2、电化学分析(极谱与伏安分析法、库仑分析法、电解分析 法、电位分析法);3、色谱分析法(气相色谱法、液相色谱法);4、其他方法(质谱法、流动注射分析法、热分析法)特点:1、选择性好;2、操作简便、分析速度快、容易实现自动化;3、灵敏度高;4、相对 误差大(不宜用于大量分析)分析仪器的组成:Chapter 2光分析的三个基本过程:激发信号、信号转换、输出信号(能源提供能量;能量与被测物之间的互相作用;产生信号) 光谱分析分类:原子光谱(线状光谱)、分子光谱(带状光谱)吸收光谱、发射光谱电磁辐射的基本性质(波粒二象性)电磁辐射的频率、波长、波数、速率的基本概念以及运算关系入=1/波数E=hc/入=h v 波速=»入 (1eV=1.602,10"J h=6.626 切)光谱法仪器五个基本单元:光源、单色器、样品、检测器、显示与数据处理棱镜与光栅的分辨率与色散率的计算1、棱镜色散率=偏向角对波长求导(角色散率)=谱线距离对波长求导(线色散率) 线色散率=角色散率X 焦距/sin光轴夹角分辨率=平均波长/波长差=棱镜总底边长X 色散率2、光栅色散率=光谱级次/ (光栅常数X cos 衍射角)(角色散率) =角色散率X 会聚透镜焦距分辨率=光谱级次X 光栅总刻痕数各种光谱中样品池的选择发射光谱一一激发源 紫外光区一一石英比色皿 可见光区——玻璃比色皿红外光区一一NaCI 、KBr 、KRS-5固体试样与 KBr 做成的盐窗(混合压片) 荧光分析一一低荧光物质做成的比色皿 常用检测器的检测原理1、硒光电池(光敏半导体);2、光电管(光电效应);3、光电倍增管(光电效应) 光源:原子发射一一原子化器原子吸收一一空心阴极灯(紫外-可见区锐线光源) 紫外吸收一一氢灯、氘灯(紫外区连续光源) 可见吸收一一钨灯(可见区连续光源)红外吸收 ----- N ernst 灯、硅碳棒(中红外区连续光源) 分子荧光(磷光)一一高压汞灯(紫外-可见区线光源)Chapter 3紫外-可见分光光度法分子吸收光谱形成原因:价电子和分子轨道上的电子在电子能级间跃迁,并伴随有振动和 转动能级间的跃迁△ E=h v梁颖 2012电子跃迁类型与有机化合物有关的价电子有c、n和n电子,主要跃迁有:1. N —V跃迁:由基态跃迁至反键轨道-b *、n - n *2. N—Q跃迁:非键电子跃迁到反键轨道:n- b *、n- n *3. N—R跃迁:b电子激发到更高能级或电离能量大小顺序:b - b *<n- b *< n - n *<n- n *测量到的是n - n*D n-冗俩种跃迁n -n*跃迁一般在200nm附近;n-n*跃迁一般在近紫外区,吸收强度弱。
常用术语:1. 生色基团:含有n键的不饱和基团(为C= C C= 0、N= N、一N= O等)能产生n -n * 跃迁,使得有机化合物分子在紫外-可见光区产生吸收的基团。
①非共轭生色团a、基团结构不同:独立吸收b、相同,仅一个吸收峰,但强度随生色团数目增加叠加。
②共轭:仅一个吸收峰(红移强度显著增大)。
2. 助色基团:含有非键电子(n电子)的基团(为一OH、一NH2、一SH—X等),其本身在紫外一可见光区无吸收,但能与生团中n电子发生n- n *共轭,使生色团吸收峰红移的基团。
3. 红移和蓝移使分子的吸收峰向长波方向移动的效应称红移。
使分子的吸收峰向短波方向移动的效应称蓝移。
吸收带K吸收带(共轭带):n - n *跃迁能量比R大,强度强,红移程度与共轭程度有关,是共轭分子的特征吸收带。
R吸收带(基团带):n-n *跃迁在270 —300nm围,能量小,强度弱。
苯在紫外区有三个吸收带,均由n -n *引起(有取代基时,三带分布就会变化且趋于光滑):E1 吸收带在185nm £ = 104 (60000)E2 吸收带在204nm £ = 103 (7900)B吸收带(苯环带)在254 —260nm (230 —270nm)& = 200,由于振动跃迁叠加在n -n *上引起。
影响紫外-可见光谱的因素:1、共轭效应(红移变强);2、空间效应;3、溶剂极性(蓝移);4、体系pH。
Lambert-Beer 定律透光率T= la/10 T f,吸收J吸光度A= lg1/T = Igl0/la A f,吸收f数学表达式:A=kcl= e cl比吸光系数:卩畑=10 e /M适用条件:只有当溶液浓度小于0.01mol* ---------------- 的稀溶液中Lambert-Beer定律才能成立Lambert-Beer定律只适用于单色光分析条件的选择:1、波长的选择选择:吸光物质的最大吸收波长作为分析波长,另外,当吸光度A=0.434时,吸光度相对误差最小;2、参比溶液的选择(原则:背景干扰最少)1、溶剂参比;2、试剂参比;3、试样参比;4、平行操作溶液参比。
紫外-可见分光光度计主要组成部件及作用1、光源作用:提供入射光要求:提供足够强度和稳定的连续辐射,强度基本不随波长变化而改变。
2、单色器作用:将复合光分解程度单色光或有一定宽度的谱带3、吸收池作用:盛待测试样要求:透光性好,无折射,反射,宽度精确种类:石英(only)=>紫外区玻璃、石英=>可见光区4、检测器作用:将光信号转换为检测信号5、信号指示系统作用:显示和记录测定结果最大吸收波长的计算基值:异环二烯(214)、同环二烯(253)、不饱和羰基化合物(215)共轭体系的延长:30环外双键:5烷基取代:不饱和羰基化合物(a -10; 3 -12;丫-18 )、其余5Chapter 4红外分光光度法产生红外吸收的条件:1、辐射光子具有的能量与发生振动跃迁所需的跃迁能量相等;2、辐射与物质之间有耦合作用。
吸收谱带划分:基团频率区(4000~1300虹」)、指纹区(1400~400也丄])影响基团频率的因素:1、诱导效应(v j); 2、共轭效应(v f); 3、氢键(v f); 3、费米共振(重峰);4、振动耦合(重峰);5、分子对称性;6、空间效应;7、中介效应(v f)红外光谱仪的组成:1、光源:能斯特灯(ZrO2、Y203 ThO2等烧结而成)、硅碳棒(SiC2、单色器:光栅3、吸收池:NaCI、KBr、KRS-5固体试样与KBr做成的盐窗(石英、玻璃对红外光均有吸收)4、检测器:真空热电偶、热释电检测器、碲镉汞检测器、测热辐射计5、记录系统制样方法:固体试样(压片法)不饱和度的计算:F _ ] +珥十红外谱图的解析Chapter 5分子发光分析法基本定义:1、振动弛豫:在液相或压力足够高的气相中分子间碰撞的概率很大,激发态分子可能将过剩的振动能量以热的形式传递给周围的分子,而自身从—的高振动能层失活到该电子能级的最低振动能层上。
2、荧光发射:当分子处于单重激发态的足底振动能层时,去活化过程的一种形式是以〜型」s左右的短时间发射光子返回基态。
3、转换:相同多重度等能态间的一种无辐射跃迁过程。
4、外转换:激发分子通过与溶剂或其他溶剂间的相互作用和能量转换而使荧光或磷光强度减弱甚至消失的过程。
5、系间跨越:不同多重度状态间的一种无辐射跃迁过程。
荧光与磷光的根本区别:荧光是由激发单重态最低振动能层至基态各振动能层的跃迁产生的;磷光是由激发三重态的最低振动能层至基态各振动能层间跃迁产生的;磷光寿命比荧光长。
产生荧光的必备条件:1合适的结构(跃迁类型、共轭效应、刚性平面结构、取代基效应)2、具有一定的荧光量子产率(0 f)荧光强度与溶液浓度的关系:荧光强度= 荧光量子产率丨-、I吸收光强度=Kc (正比)影响荧光强度的因素:溶剂极性和溶剂分子与荧光体间的特殊化学作用荧光(磷光)光谱仪的组成:1、光源:高压汞灯、氙弧灯2、样品池:熔融石英(四壁均光洁透明)3、单色器:两个光栅(一个用于选择激发光波长;另一个用于分离选择荧光发射波长)4、检测器:为了消除入射光和散射光的影响,荧光检测器与激发光方向呈直角。
5、磷光镜:禾I」用磷光比荧光寿命长的原理,时间分辨技术。
化学发光反应产生的条件:1、必须提供足够的激发能;2、有有利的化学反应历程;3、不以热的形式消耗能量。
Chapter 6原子光谱图原子发射光谱的产生:元素在受到热(火焰)或电(电火花)激发时,由基态跃迁到激发态,返回基态时,发射出特征光谱(线状光谱)基本定义:1、电离能:电离所需要的能量。
2、分析线:进行分析时所使用的谱线。
3、共振线:从激发态相基态跃迁所发射的谱线。
4、最后线:当样品中某元素含量逐渐减少时最后能观察到的几条谱线。
5、原子线:原子被激发后,其外层电子从激发态向基态跃迁所发射的光谱线。
6、离子线:离子被激发后,其外层电子从激发态向基态跃迁所发射的光谱线。
7、自吸:原子在高温发射某一波长的辐射,被处在边缘低温状态的同种原子所吸收的现象。
&自蚀:由于自吸严重,谱线中心强度都被吸收了,完全消失,好像两条谱线的现象。
9、等离子体:包含分子、原子、离子、电子等各种离子电中性的集合体。
光谱符号:卩吗n――主量子数S总自旋量子数L――总角量子数J――量子数原子发射光谱法仪器:一、激发光源(提供足够的能量使试样蒸发、原子化、激发、产生光谱)1、直流电弧用于少量的矿物定性分析2、交流电弧少量金属合金定量分析3、火花光源高含量的熔点较低的金属与合金分(炼钢厂的钢铁分析)4、ICP可同时做多组分定量分析光谱仪:摄谱法:摄谱法是用感光板记录光谱;光电法:光电法用光电倍增管检测谱线强度分析方法:1、定性:铁光谱比较法可同时进行多元素定性分析标准试样光谱比较法2、定量:标法被测元素I 标元素H 相对强度R=l£]=Ac先作出R-c图,再用ICP测出R求c发射光谱定量分析的基本关系式原子吸收光谱法:原理:气相中被测元素的基本原子对其原子共振辐射的吸收强度来测定试样中被测元素的含量。
原子吸收光谱位于光谱的紫外区和可见区。
原子吸收光谱的测量:1、积分吸收:在吸收线轮廓,吸收系数的积分;2、峰值吸收:吸收线中心波长处的吸收系数;3、锐线光源:发射线半宽度远小于线半宽度的光源。
定量分析计算:A=Kc原子吸收光谱仪组成及作用:1、光源:发射被测元素的共振辐射,提供锐线光源(空心阴极灯、无极放电灯)空心阴极灯的工作原理:两极间施加几百伏电压,便产生阴极溅射效应,并且放店。
