2017—2018学年浙教版八年级下册科学化学基础知识
浙教版初二科学下册知识点总结

初二科学(下)期末基础知识复习总结姓名第1章 符号与粒子 一、写出元素符号或元素的名称:氦- 锰- 金- 铝- 氯- 硅- 铁-H - C - N - O - Na - Mg - P -S - K - Ca - Cu - Zn - Hg - I -二、写出下列物质的化学式:水- 二氧化碳- 金刚石- 氧化铜- 硫-一氧化氮- 氧化铝- 五氧化二磷- 氯化氢- 氯气--硫化氢- 氧化钠- 氧化镁- 氖气- 氢氧化钠--过氧化氢- 二氧化硫- 氧化钙- 碳酸钙-- 硝酸根离子三、写出下列物质的名称:CH 4- Fe 2O 3- Na 2S - FeCl 3 - Fe 3O 4 - ZnO - NaCl - MgCl 2 - KCl - CaCl 2- CuSO 4- K 2MnO 4—四、根据化学式的计算 (瞧懂、理解)1、化合物中各元素的质量比:设化学式为A x B yA元素:B元素=A原子个数(x)×A的相对原子质量:B原子个数(y)×B的相对原子质量2、元素的质量分数=化合物的相对分子质量相对原子质量某元素原子个数 ×100%=物质的总质量某元素的质量×100%3、物质的质量分数=混合物的总质量纯物质的质量×100%=的质量分数根据化学式求得该元素分数实际测得某元素的质量×100%(也就是计算该物质的纯度或百分含量)4、元素的质量=物质的质量×元素的质量分数五:1、 分子就是构成物质,并保持物质 的一种..微粒;原子就是 最小微粒2、 核电荷数= (带 电)= (带 电),相对原子质量= +3、 第一个提出原子概念的人就是 ;第一个发现电子的人就是4、 H 2O 有那些意义(1)、 (物质);(2)、 (元素);(3)、 (分子);(4)、 (原子):(5)、 (相对质量)。
5、 把由同种元素组成的纯净物叫 ,如 ;由不同种元素组成的纯净物叫 ,如 ;由两种元素组成且其中一种就是氧元素的化合物叫 ,如 。
浙教版八年级下册,化学知识点归纳

浙教版八年级下册,化学知识点归纳第一章:物质的分类- 物质的分类:元素、混合物、化合物- 物质的分类特征:组成、性质、制备方法、分离方法第二章:空气中的氧气- 空气的组成:氮气78%、氧气21%、其他1%- 氧气的性质:无色无味、不易溶于水、能使物质燃烧- 氧气的应用:养氧器、制取氧气等第三章:金属- 金属的性质:导电性好、导热性好、延展性好、韧性好- 不同金属的性质差异:密度、熔点、延展性、硬度等- 金属的应用:构建工程、石油开采、冶金等第四章:金属氧化物- 金属氧化物的种类:氧化物、碱性氧化物、酸性氧化物、非金属氧化物- 金属氧化物的性质:易溶于水成碱、易与酸反应生成盐第五章:一氧化碳- 一氧化碳的性质:无色无味、易燃易爆、有毒- 一氧化碳的危害:影响氧气的输送、引发安全事故、危及人类健康- 预防一氧化碳中毒:通风、使用一氧化碳检测器第六章:理论量和计算量- 化学方程式的写法与解释- 理论量、计算量、实际量的计算方法- 化学实验中存在误差的原因和减小误差的方法第七章:化学实验室用具- 常用化学实验室器具:玻璃瓶、试管、量筒、三角漏斗等- 化学实验室器材的使用注意事项:存放、清洗、使用等- 化学实验室的安全知识:着实验服、佩戴护目镜、遵守实验室规定等第八章:化学反应- 化学反应的表征方式:物质的组成变化、物理性质变化、化学性质变化- 化学反应的类型:合成反应、分解反应、置换反应、还原与氧化反应- 化学反应实验:铁的活化实验、镁燃烧实验等第九章:中性溶液- 酸碱中和反应的原理- 中性溶液的判定方法和特征- 酸碱中和反应在日常生活中的应用第十章:通式和化学式- 元素符号和元素名的对应关系- 化学式的种类:分子式、离子式、结构式- 通式和化学式的关系。
八年级科学下册浙教版所有知识点

八年级科学下册浙教版知识点全面评估一、物质的微观结构1. 原子的结构八年级科学下册浙教版中,原子的结构是一个重要的知识点。
原子是构成一切物质的基本单位,由质子、中子和电子组成。
在此知识点中,我们深入了解了原子内部的构成和相互作用,从而更好地理解物质的微观结构。
2. 元素、化合物和混合物的区别了解了原子的结构之后,我们需要对元素、化合物和混合物有一个清晰的认识。
在浙教版中,通过丰富的例子和实验,深入探讨了这些物质的性质、组成和区别,使我们对物质的分类有了更深入的理解。
二、能量的转化3. 能量的储存和转化能量的转化是另一个重要的知识点。
在浙教版中,通过生动的案例和图表,我们了解了各种能量形式之间的相互转化,让我们对能量的储存和利用有了更清晰的认识。
4. 水资源的利用与保护在能量的转化中,水资源的利用与保护也是一个关键的话题。
通过对地球水资源的分布、利用和保护的深入探讨,我们对水资源问题有了更全面的认识,也更加意识到了水资源的宝贵性和保护的重要性。
三、生物的分类与发展5. 生物的分类在八年级科学下册中,生物的分类是一个重要的知识点。
通过对不同生物的形态、结构和生活习性的观察和归纳,我们深入了解了生物的多样性和分类规律,从而更好地认识了生物世界的奇妙和丰富。
6. 生物的进化生物的进化也是一个让人着迷的话题。
在浙教版中,我们通过丰富的化石、遗传和进化理论的案例,了解了生物进化的过程和机制,从而更加深入地理解了生物的多样性和生命的奇迹。
总结回顾通过对八年级科学下册浙教版中知识点的全面评估,我们对物质的微观结构、能量的转化以及生物的分类与发展有了更全面、深刻的理解。
这些知识不仅让我们更好地认识了世界,也让我们更加重视和珍惜我们周围的一切,保护并利用好我们的地球资源。
对于生物的进化,更让我们对生命的奇妙和生物多样性有了更深入的思考。
个人观点与理解在学习这些知识的过程中,我深深感受到了科学的魅力和深刻。
对于认识世界、探求未知,科学是无比重要的工具和武器。
(2017)新浙教版八年级下册科学第四章《植物与土壤》知识点归纳

(2017)新浙教版科学八年级(下)第四章《植物与土壤》知识点第一节:土壤的成分1.土壤的组成① 土壤生物:动物、植物、微生物(细菌、真菌)② 非生命物质:空气、水、无机盐和有机物(生物的排泄物和死亡的生物体)2.腐殖质:土壤中的有机物在土壤生物的作用下形成的,可以为土壤生物提供食物,也可以为绿色植物提供养分。
3.土壤的成分和作用① 固体: 矿物质颗粒(占固体95%):为植物生长提供无机盐 腐殖质(有机物):为土壤生物提供食物,为植物提供养分② 液体:水分:是植物生长的必要条件③ 气体:空气:是植物的根和微生物生命活动所需氧气的来源4.土壤的形成:岩石就是在长期的风吹雨打、冷热交替和生物的作用下,逐渐风化变成了石砾和砂粒等矿物质颗粒(岩石从大变小),最后经各种生物和气候的长期作用(有机物积累)才形成了土壤。
(土壤的形成非常缓慢,但毁灭土壤却是瞬间的)5.引起岩石风化的因素:①物理因素:风力、流水、温度剧变、海浪等②化学因素:化学物质的溶蚀作用③生物因素:植物的根、地衣和蕨类分泌的物质第二节:各种各样的土壤1.影响土壤结构的因素:矿物质颗粒的大小和比例2.土壤的类型和性状:第三节:植物的根与物质吸收1.植物的根系①直根系:有主根、侧根之分(常见植物:大多数的双子叶植物)②须根系:没有主侧根,只有不定根(常见植物:大多数的单子叶植物)2.影响植物根在土壤中分布的因素:土壤的结构、肥力、通气状况和水分状况3.根的功能:①固定②吸收水分和无机盐4.根吸水失水的部位:根尖——根毛区——根毛细胞5.根尖结构的细胞特点和作用6.根毛细胞吸水条件:细胞液浓度>土壤溶液浓度根毛细胞失水条件:细胞液浓度<土壤溶液浓度7.水分进入根部的途径:水分→根毛细胞→皮层细胞→导管→植物体各结构8.植物生长需要无机盐(无机盐溶解在水中被吸收)①构建植物体:N、Mg是合成叶绿素的原料;N、S是合成蛋白质的原料②调节植物生命活动:K能使茎秆粗壮、促进淀粉的合成和运输P能促进幼苗的生长发育和开花9.三大营养素作用及缺乏时症状第四节:植物的茎与物质运输1.茎的分类①按形态分:直立茎、匍匐茎、攀缘茎、缠绕茎②按组成分:木质茎、草质茎2.茎的结构注:单子叶植物茎中一般没有形成层结构,茎长成后一般不会加粗。
浙教版科学八年级下知识点

第一章热能的转化
一、热能的定义
热能(thermal energy)是由物质中的分子运动产生的、具有可能转化为机械能或其他形式能量的一种能量形式。
二、热能的转化
1.热能转化为机械能或其他形式能量:热能可转化为机械能或其他形式的能量,如汽车的发动机就是一个应用热能转化为机械能的机器,汽车发动机将燃烧燃料产生的热能转化为机械能,使汽车按照操纵者的要求运动。
2.热能转化为电能:热能可以转化为电能,在火力发电厂中,利用燃烧燃料的热能来汽化水,使蒸汽的温度和压强上升,用汽车发动机原理使汽车发动机的热能转化为电能,输入我们的家中,使用电器,实现用热能转化为电能。
3.热能转化为其他形式能量:热能还可以转化为其他形式的能量,如热量转化为化学能,在火药、煤气、氢弹等产品中,都是利用热量转化为化学能,来实现大量的能量的源泉。
三、热能的应用
1.在水力发电中,利用蒸发的热量使水蒸发,然后利用蒸汽进行相应的动力,将其转化为电能,最终输入家庭使用;
2.火力发电:在火力发电厂中,利用燃料燃烧把热能转化成机械能,驱动汽车发动机,把机械能转化为电能,然后输入家庭使用;
3.在化工工业中。
浙教版初中科学知识点总结(八年级下)

浙教版科学八下八年级下第一章物质与微观粒子模型1、分子与原子的区别:在化学变化中,分子可分,原子不可再分。
2、化学变化的实质:分子分割成原子,原子重新组合成新的原子。
3、化学变化与物理变化的本质区别:在变化中,物质的分子变成了其它物质的分子,就就是化学变化。
在变化中,物质的分子还就是原来的分子,只就是分子间的距离发生了变化,就就是物理变化。
4、分就是由原子构成的。
一些气体、液体主要由分子构成5、原子直接构成的物质:金属与固体非金属及稀有气体原子结构的模型质子(带正电) 夸克一、原子的结构:1、原子: 原子核: (带正电) 中子(不带电) 夸克(不显电性) 核外电子:(带负电)(1)核电荷数=质子数=核外电子数。
(2)质子不同,原子种类一定不同。
原子的质量主要集中在原子核上。
五、带电的原子或原子团--离子【实验】钠在氯气中燃烧的实验实验现象:钠原子失去电子--形成正电荷的钠离子(阳离子)氯原子得到电子--形成负电荷的氯离子(阴离子)离子就就是带电的原子或原子团(离子的组成元素不止一种)。
离子与分子、原子一样也就是构成物质的基本粒子。
组成物质的元素1、由多种物质组成叫混合物。
由一种物质组成叫纯净物。
纯净物分为单质与化合物:单质:由同种元素组成的纯净物。
化合物:由不同种元素组成的纯净物。
3、元素在地壳的分布就是不均匀的,地壳主要由氧、硅、铝、铁、钙、钠、钾、镁、氢等元素组成。
其中含量最高的就是氧,其次就是硅。
金属元素中含量最高的就是铝,其次就是铁。
4、在人体中含量最高的就是氧元素,其次就是碳、氢;海水中含量多到少:氧、氢、氯、钠。
有机物主要由碳、氢、氧组成表示元素的符号1、元素符号一般表示:⑴一种元素⑵这种元素的1个原子(3)表物质(由原子直接构成的) 表示物质的符号1、化学式的确定依据:由实验测定组成,不能凭空想象,一种物质只有一种化学式。
2、化学式表示的意义:⑴表示某种物质(纯净物) ⑵表示物质的元素组成⑶表示某种物质的一个分子由什么原子构成⑷表示物质分子的构成⑸该物质的相对分子质量就是多少6、离子符号就是在形成该离子的原子的元素符号右上角标出该离子所带的电荷数。
浙教版 初二化学知识点

浙教版初二化学知识点总结一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O2 点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O442. 铜在空气中受热:2Cu + O2 加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HC l == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaC O3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl一、物质的学名、俗名及化学式⑴金刚石、石墨:C⑵水银、汞:Hg (3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2 (5)盐酸、氢氯酸:HCl(6)亚硫酸:H2SO3 (7)氢硫酸:H2S (8)熟石灰、消石灰:Ca(OH)2 (9)苛性钠、火碱、烧碱:NaOH (10)纯碱:Na2CO3 碳酸钠晶体、纯碱晶体:Na2CO3•10H2O (11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4•5H2O (13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡(15)酒精、乙醇:C2H5OH (16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(17)氨气:NH3 (碱性气体)(18)氨水、一水合氨:NH3•H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(19)亚硝酸钠:NaNO2 (工业用盐、有毒)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
浙教版八年级下科学知识点总结
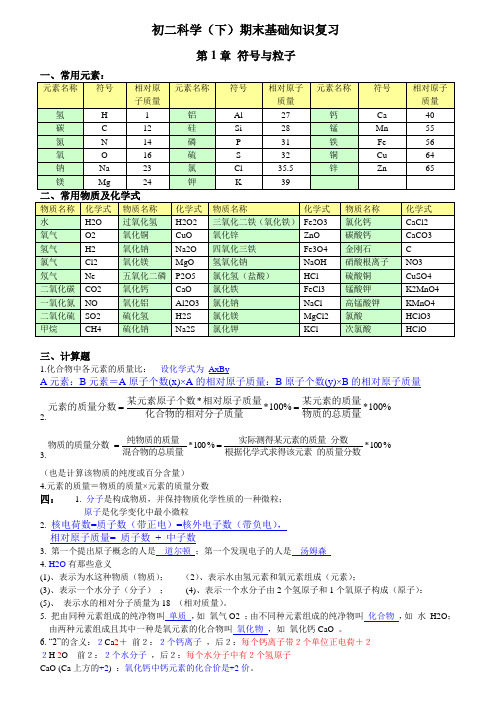
初二科学(下)期末基础知识复习第1章符号与粒子三、计算题1.化合物中各元素的质量比:设化学式为AxByA元素:B元素=A原子个数(x)×A的相对原子质量:B原子个数(y)×B的相对原子质量2.%100*%100**物质的总质量某元素的质量化合物的相对分子质量相对原子质量某元素原子个数元素的质量分数==3.%100*%100*的质量分数根据化学式求得该元素分数实际测得某元素的质量混合物的总质量纯物质的质量物质的质量分数==(也是计算该物质的纯度或百分含量)4.元素的质量=物质的质量×元素的质量分数四: 1. 分子是构成物质,并保持物质化学性质的一种微粒;原子是化学变化中最小微粒2. 核电荷数=质子数(带正电)=核外电子数(带负电),相对原子质量= 质子数+ 中子数3. 第一个提出原子概念的人是道尔顿;第一个发现电子的人是汤姆森4. H2O有那些意义(1)、表示为水这种物质(物质);(2)、表示水由氢元素和氧元素组成(元素);(3)、表示一个水分子(分子);(4)、表示一个水分子由2个氢原子和1个氧原子构成(原子):(5)、表示水的相对分子质量为18 (相对质量)。
5. 把由同种元素组成的纯净物叫单质,如氧气O2 ;由不同种元素组成的纯净物叫化合物,如水H2O;由两种元素组成且其中一种是氧元素的化合物叫氧化物,如氧化钙CaO 。
6. “2”的含义:2Ca2+前2:2个钙离子,后2:每个钙离子带2个单位正电荷+22H 2O 前2:2个水分子,后2:每个水分子中有2个氢原子CaO (Ca上方的+2) :氧化钙中钙元素的化合价是+2价。
7. 地壳中元素含量:氧 > 硅 > 铝 > 铁 。
8. 在元素周期表中“行”称为 周期 ,“列”称为 族 ;从左到右,元素原子的质子数逐渐 增大 。
在同一族内,各元素的 化学性质 都很相似。
第2章 空气与生命1.按体积计算:空气中氮气约占 78% ;氧气约占 21% ;二氧化碳约占 0.03% 。
浙教版八年级科学下册化学变化总结

浙教版八年级科学下册化学变化总结化学变化是物质发生转化过程的总称,它在日常生活和工业生产中起着重要的作用。
本文将对浙教版八年级科学下册化学变化的相关知识进行总结。
一、化学变化的概念化学变化是指物质在化学反应中发生的物理性质、化学性质以及组成的变化。
化学变化是由于原子间的结构改变引起的,通常伴随着能量的释放或吸收。
二、化学反应的表示方法化学反应可以用化学方程式来表示。
化学方程式由反应物和生成物组成,中间用箭头分隔。
反应物在箭头的左侧,生成物在箭头的右侧。
化学方程式还包括化学式、反应条件等信息。
三、化学变化的类型化学变化主要分为以下几种类型:1. 氧化还原反应:指物质与氧气之间的反应,其中含氧负离子的物质成为氧化剂,含氧正离子的物质成为还原剂。
2. 酸碱反应:指酸和碱之间的反应,其产物为盐和水。
3. 燃烧反应:指物质与氧气之间的高温反应,产生大量的热和光。
4. 合成反应:指两种或更多物质反应生成一种新物质。
5. 分解反应:指一种物质分解成两种或更多的物质。
四、化学变化的影响因素化学变化受到多种因素的影响,主要包括温度、催化剂和浓度等。
温度的升高可以加快反应速率,催化剂可以提高反应速率,浓度的增加也能增加反应速率。
五、化学变化的应用化学变化在生活和工业生产中有广泛的应用。
例如,化学变化可以用于制造肥料、药品、塑料等。
在日常生活中,我们还可以利用化学变化来烹饪、发酵食品、清洁等。
总结本文对浙教版八年级科学下册化学变化的相关知识进行了总结。
化学变化的概念、表示方法、类型、影响因素以及应用都在文中有所介绍。
化学变化是化学反应的过程,对于理解物质的性质和变化具有重要意义。
希望本文能对读者有所帮助。
八下科学浙教版知识点

八下科学浙教版知识点八下科学浙教版知识点:一、物质的组成与分类物质是构成宇宙的基本要素,可以分为纯物质和混合物两大类。
纯物质又分为元素和化合物,元素是由相同类型的原子组成的物质,而化合物是由不同类型的原子组成的物质。
混合物又分为均质混合物和非均质混合物,均质混合物是由两种或两种以上的纯物质按一定比例混合而成的,非均质混合物是由不同组成的物质混合在一起而形成的。
二、物质的性质与变化物质的性质包括物理性质和化学性质。
物理性质是物质固有的、不改变物质组成的性质,如颜色、形状、硬度等。
化学性质是物质与其他物质发生化学反应时表现出来的性质,如燃烧、氧化等。
物质的变化包括物理变化和化学变化。
物理变化是指物质在不改变其组成的情况下发生的变化,如溶解、熔化等;化学变化是指物质在与其他物质反应时发生的变化,如燃烧、腐蚀等。
三、常见物质的性质与应用常见物质的性质与应用是指我们日常生活中常见的物质的特点及其在各个领域中的应用。
例如,金属具有导电性和导热性,所以广泛应用于电器、建筑等领域;非金属具有绝缘性和耐腐蚀性,所以广泛应用于绝缘材料、化妆品等领域;塑料具有轻质、耐磨等特点,所以广泛应用于包装材料、家具等领域。
四、能量的转化与运用能量是物质运动和变化的基础,包括机械能、热能、化学能、光能等形式。
能量的转化是指能量从一种形式转化为另一种形式的过程,如机械能转化为热能、化学能转化为电能等。
能量的运用是指人类利用能量满足各种需求的过程,如利用水能发电、利用太阳能取暖等。
五、地球与地图地球是我们生活的家园,它是一个具有大气、水、陆地等要素的系统。
地球的形状是近似于一个椭球体,有南北两极和赤道。
地球上有七大洲和五大洋,它们分布在地球的不同位置。
地图是地球的缩影,通过地图我们可以了解地球上的地理信息和分布情况。
六、天体运动与地球天体运动是指太阳、月亮、地球等天体在宇宙中的运动。
太阳是地球的主要能源供应者,它的光与热对地球上的生物和环境产生了重要影响。
浙教版初二化学知识点

浙教版初二化学知识点第一单元走进化学世界1、物质的变化及性质(1)物理变化和化学变化的概念及区别物理变化:没有生成其他物质的变化,叫物理变化,如冰的融化、水的蒸发、汽油的挥发、蔗糖的溶解、金属的延展等;化学变化:变化时生成了其他物质的变化,叫化学变化,又叫化学反应,如铁生锈、木材燃烧、食物腐败、呼吸、发酵等。
(2)物理性质和化学性质物理性质:物质不需要发生化学变化就表现出来的性质,如颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性等;化学性质:物质在化学反应中表现出来的性质,如可燃性、助燃性、氧化性、还原性、酸碱性等。
2、化学是一门以实验为基础的科学(1)化学实验的作用有助于化学概念的形成和巩固;有助于化学原理和定律的论证;有助于化学用语的掌握;能激发学生的学习兴趣,调动学生主动学习的积极性。
(2)学习化学实验的基本方法科学探究的基本环节:提出问题→猜想与假设→制定计划→进行实验→收集证据→解释结论→反思评价→表达交流;化学实验的基本操作。
(3)运用化学实验学习化学的具体方法实验—质疑法;实验—探究法。
3、具备基本的化学实验技能是学习化学和进行化学探究活动的基础和保证。
只有掌握化学实验的基本技能,才能安全、准确地进行化学实验。
初二上册数学知识点归纳浙教版标题:初二上册数学知识点归纳——浙教版一、基础概念1、定义:数学是研究数量、结构、变化、空间以及信息等概念的一门学科。
2、变量:在数学中,变量是一个可以取不同值的量。
3、方程:含有未知数的等式称为方程。
4、函数:如果对于每一个自变量x,都有唯一的y与之对应,那么称y是x的函数。
二、运算规则1、加法交换律:a+b=b+a2、加法结合律:(a+b)+c=a+(b+c)3、乘法交换律:ab=ba4、乘法结合律:(ab)c=a(bc)5、分配律:a(b+c)=ab+ac三、公式定理1、勾股定理:直角三角形两直角边的平方和等于斜边的平方。
2、完全平方公式:(a+b)^2=a^2+2ab+b^23、平方差公式:(a-b)^2=a^2-2ab+b^24、平行线分线段成比例定理:两条平行线被第三条直线所截,截得的线段对应成比例。
浙教版 初二化学知识点

浙教版初二化学知识点总结一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O2 点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O442. 铜在空气中受热:2Cu + O2 加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HC l == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaC O3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl一、物质的学名、俗名及化学式⑴金刚石、石墨:C⑵水银、汞:Hg (3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2 (5)盐酸、氢氯酸:HCl(6)亚硫酸:H2SO3 (7)氢硫酸:H2S (8)熟石灰、消石灰:Ca(OH)2 (9)苛性钠、火碱、烧碱:NaOH (10)纯碱:Na2CO3 碳酸钠晶体、纯碱晶体:Na2CO3•10H2O (11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4•5H2O (13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡(15)酒精、乙醇:C2H5OH (16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(17)氨气:NH3 (碱性气体)(18)氨水、一水合氨:NH3•H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(19)亚硝酸钠:NaNO2 (工业用盐、有毒)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
浙教版八年级下知识点总结

浙教版科学八下八年级下第一章1、分子和原子的区别:在化学变化中,分子可分,原子不可再分。
2、化学变化的实质:分子分割成原子,原子重新组合成新的原子。
3、化学变化和物理变化的本质区别:在变化中,物质的分子变成了其它物质的分子,就是化学变化。
在变化中,物质的分子还是原来的分子,只是分子间的距离发生了变化,就是物理变化。
4、刚石和石墨物理性质不同是由于原子排列不同。
5.分子是构成物质,并保持物质化学性质的一种..微粒,构成物质有三种微粒:分子、原子、离子,保持化学性质的粒有子原子、离子,分子等1、由原子直接构成的物质有:金属单质(如:铁Fe、钠Na等)、稀有气体单质(:如氦气He、氖气Ne、氩气Ar等),部分固态非金属单质(如:碳C、磷P、硫S、硅Si等)2、由离子直接构成的物质有:食盐(氯化钠NaCl)、硫酸铜CuSO4等3、由分子直接构成的物质有:水H2O、二氧化碳CO2、氮气N2、氢气H2、二氧化硫SO2五氧化二磷P2O5、一氧化碳CO、甲烷CH4、氧气O2、蔗糖、酒精等6.原子是化学反应中的最小微粒7.第3节原子结构的模型一、原子结构模型的建立与修正1、道尔顿--实心球原子结构--发现原子2、汤姆森--“汤姆森模型”:原子是一个平均分布着正电荷的球体,带负电荷的电子嵌在中间。
--发现电子3、卢瑟福--“卢瑟福模型”:电子绕原子核运行4、波尔--“分层模型”:电子在固定的轨道上运动 5、“电子云模型质子(带正电) 夸克二、原子的结构:1、原子:原子核: (带正电) 中子(不带电) 夸克(不显电性)核外电子:(带负电)(1)核电荷数=质子数=核外电子数。
相对原子质量=质子数+中子数(2)中子数不一定等于质子数。
(3)原子内可以没有中子。
(4)质子不同,原子种类一定不同。
电子质量很小,在整个原子的质量中所占的比例极小,可忽略不计。
原子的质量主要集中在原子核上。
四、原子的“孪生兄弟”---同位素1、元素:具有相同核电荷数(即质子数)的同一类原子的总称。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
符号
元素名称
符号
元素名称
符号
元素名称
符号
氧
O
氢
H
氮
N
氯
Cl
碳
C
磷
P
硫
S
硅
Si
金属:
元素名称
符号
元素名称
符号
元素名称
符号
元素名称
符号
钾
K
钙
Ca
钠
Na
镁
Mg
铝
Al
锌
Zn
铁
Fe
铜
Cu
汞
Hg
银
Ag
锰
Mn
钡
Ba
三:常见原子团的名称和符号
名称
符号
名称
符号
名称
符号
名称
符号
氢氧根
OH-
硝酸根
NO3-
碳酸根
CO32-
硫酸根
SO42-
磷酸根
PO43-
铵根
NH4+
碳酸氢根
HCO3-
亚硫酸根
SO32-
四:书p62
八年级科学化学基础知识
班级姓名
一:1-20号元素的名称和符号
原子序数
名称
符号
原子序数
名称
1
氢
H
2
氦
He
3
锂
Li
4
铍
Be
5
硼
B
6
碳
C
7
氮
N
8
氧
O
9
氟
F
10
氖
Ne
11
钠
Na
12
镁
Mg
13
铝
Al
14
硅
Si
15
磷
P
16
硫
S
17
氯
Cl
18
氩
Ar
19
钾
K
20
钙
Ca
二:常见元素的名称和符号
非金属:
