人教版高中选修四化学 原电池ppt【优秀课件】
合集下载
人教版高二化学选修4教学课件:第四章4.1 原电池(共12张PPT)

达标练习
教材 P73 习题
课后作业
学法 P105-106
不习惯读书进修的人,常会自满于现状,觉得再没有什么事情需要学习,于是他们不进则退。经验丰富的人读书用两只眼睛,一只眼睛看到纸面上的话,另 一眼睛看到纸的背面。2022年4月3日星期日2022/4/32022/4/32022/4/3 书籍是屹立在时间的汪洋大海中的灯塔。2022年4月2022/4/32022/4/32022/4/34/3/2022 正确的略读可使人用很少的时间接触大量的文献,并挑选出有意义的部分。2022/4/32022/4/3April 3, 2022 书籍是屹立在时间的汪洋大海中的灯塔。
2. 工作原理
电极反应式的书写
(1)遵循离子方程式书写规则。 注意:生成难溶物沉积在电极上,不标“↓”。
(2)方法步骤 标变价→列物质→注得失→配守恒
负极:氧化反应,还原剂 − ne- ══ 氧化产物 正极:还原反应,氧化剂 + ne- ══ 还原产物 电池反应 = 负极反应式 + 正极反应式
注意:同时书写正负极反应式,以得失电子数 相等配平;书写单个电极反应式,化为最简整数比 。
谢谢观赏
You made my day!
我们,还在路上……
例:写出下列装置的电极反应式
二、设计原电池
设计思路
1. 写出电极反应式 将Βιβλιοθήκη 知的氧化还原反应拆分为氧化反应和还原
反应两个半反应。 2. 确定电极材料
以两极反应原理为依据,确定电极材料。 如,发生氧化反应的物质为金属单质,可用该 金属直接作负极;用较不活泼的金属(或能导电的惰 性材料)作正极。 3. 确定电解质溶液 一般选用总反应式中的电解质溶液;若有盐桥 ,阳离子与电极相对应,电极不与电解质溶液反应
人教版高中化学选修四4.1《原电池》课件 (共19张PPT)

第一节 原电池
下列装置中能构成原电池的是:
A
没有两个活泼性不同的导体作电极
B
C
没有电解质溶液
D
没有形成闭合回路
原电池的构成条件:
• 1.能自发进行氧化还原反应 • 2.两个活泼性不同的导体作电极 • 3.有电解质溶液 • 4.形成闭合回路
实验探究㈠
请根据反应:Zn + CuSO4 = ZnSO4 + Cu
本堂小结
⒈原电池的功能: ⒉原电池的工作原理:
⒊原电池输出电能的能力:
本堂小结
⒈原电池的功能:将化学能转化为电能 ⒉原电池的工作原理: ①用还原性较强的物质作为负极,负极向外电路提 供电子;用氧化性较强的物质作为正极,正极从外 电路得到电子。 ②在原电池的内部,通过阴阳离子的定向移动而形 成内电路。 ⒊原电池输出电能的能力,取决于 ①装置设计的合理性; ②组成原电池的反应物的氧化还原能力。
练习
根据反应:Cu+2AgNO3=Cu(NO3)2+2Ag 设计一个带盐桥的原电池。 ⑴画出此原电池的装置简图; ⑵注明原电池的正负极; ⑶注明外电路中电子的流向; ⑷写出两个电极上的电极反应式。
实验方案
实验探究㈡
请根据反应:
Zn + CuSO4 = ZnSO4 + Cu
设计一个能产生持续、稳定电流 的原电池,并进行实验。
实验装置构成及实验现象
正极
电极材料 电解质溶液
负极
装置图
连通两烧杯 溶液的材料
电流表读数 是否稳定
原电池的工作原理
e- → e- → 1.外电路中电子从
←ClK +→
设计一个原电池。
正极 电解质溶液 电极材料 负极 装置图
下列装置中能构成原电池的是:
A
没有两个活泼性不同的导体作电极
B
C
没有电解质溶液
D
没有形成闭合回路
原电池的构成条件:
• 1.能自发进行氧化还原反应 • 2.两个活泼性不同的导体作电极 • 3.有电解质溶液 • 4.形成闭合回路
实验探究㈠
请根据反应:Zn + CuSO4 = ZnSO4 + Cu
本堂小结
⒈原电池的功能: ⒉原电池的工作原理:
⒊原电池输出电能的能力:
本堂小结
⒈原电池的功能:将化学能转化为电能 ⒉原电池的工作原理: ①用还原性较强的物质作为负极,负极向外电路提 供电子;用氧化性较强的物质作为正极,正极从外 电路得到电子。 ②在原电池的内部,通过阴阳离子的定向移动而形 成内电路。 ⒊原电池输出电能的能力,取决于 ①装置设计的合理性; ②组成原电池的反应物的氧化还原能力。
练习
根据反应:Cu+2AgNO3=Cu(NO3)2+2Ag 设计一个带盐桥的原电池。 ⑴画出此原电池的装置简图; ⑵注明原电池的正负极; ⑶注明外电路中电子的流向; ⑷写出两个电极上的电极反应式。
实验方案
实验探究㈡
请根据反应:
Zn + CuSO4 = ZnSO4 + Cu
设计一个能产生持续、稳定电流 的原电池,并进行实验。
实验装置构成及实验现象
正极
电极材料 电解质溶液
负极
装置图
连通两烧杯 溶液的材料
电流表读数 是否稳定
原电池的工作原理
e- → e- → 1.外电路中电子从
←ClK +→
设计一个原电池。
正极 电解质溶液 电极材料 负极 装置图
高中化学人教版选修四 4-1 原电池 课件(37张)
负极
Zn-2e=Zn2+
铜锌原电池 正极
Cu2++2e- =Cu
阴离子
电解质 溶液
盐桥
阳离子
内电路
2019/2/15
原电池
原电池的组成——两个半电池
盐桥
锌 半 电 池
铜 半 电 池
利用同样的原理,可以把其它氧化还原反应设计成 各种原电池。
2019/2/15
原电池
1、Cu、Fe作两极,稀硫酸作电解质溶液的原电池中: 负 极 ①Cu作____ 正 极, ②Fe作____ 电极反应式是:负极____________ Fe-2e-=Fe2+ 2H++2e-=H2↑ 正极_____________ Fe+H2SO4=FeSO4+H2↑ 总反应式是___________________________ 如将稀硫酸改为浓硝酸则: 负 极, ②Fe作____ 正 极 ①Cu作____ Cu-2e-=Cu2+ 电极反应式是:负极____________ 2NO3-+4H++2e-==2NO2 ↑ +2H2O 正极_____________________ Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2O 总反应式是_______________________________
2019/2/15
原电池
请写出图片中原电池的电极反应式和 电池反应方程式。
负极: (锌片)
Zn - 2e- = Zn2+
氧化反应
(铜片) 2H+ + 2e- = H2↑ 正极:
还原反应
稀H2SO4
高中化学人教选修四课件:第4章 第1节 原电池(共80张PPT)

4.下图是锌、 铜和稀硫酸组成的原电池,某实验兴趣小组同 学做完实验后,在读书卡片上记录如下: 卡片:No.28 时间:2015.03.20 实验后的记录: ①Zn 为正极,Cu 为负极 ②H+向负极移动 ③电子流动方向为 Zn ④Cu 极有 H2 产生 ⑤若有 1 mol 电子流过导线,则产生的 H2 为 0.5 mol ⑥正极反应式:Zn-2eZn2+ Cu
【解析】 在该原电池中负极为 Zn,电极反应式为 Zn-2e正极为铜,电极反应式为 Cu2++2e移电子数(由 a 到 b)为
0.64 g
-1
Zn2+,
Cu,当铜电极增加 0.64 g 时,转
64 g · mo l
×6.02×1023 mol-1×2=1.204×1022。盐
桥中 K+向正极区(右侧烧杯)移动,Cl-向负极区(左侧烧杯)移动。 【答案】(1)由 a 到 b(或 a→b) (2)Zn-2eZn2+
1.原电池的概念 原电池是利用①氧化还原反应原理将②化学能转化为③电能的 装置。 2.原电池工作原理(以锌铜原电池为例)
装置
Байду номын сангаас
电极材料 电极名称 得失电子 电子流向 反应类型 电极反应式 总反应式
Zn 电极 ④负极 ⑥失电子 流⑧出 ⑩氧化反应 Zn-2e- Zn2+
Cu 电极 ⑤正极 ⑦得电子 流⑨入 还原反应 Cu2++2e- Cu Cu2++2e- Cu
(3)1.204×1022 (4)B
活动探究 2:原电池原理的应用
1.若用纯锌与粗锌(含 Fe、C 等)分别与同浓度的稀 H2SO4 反应 制取 H2,哪种方法产生 H2 的速率快?
人教化学选修4第四章第一节 原 电 池(共19张PPT)

离子方程式Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
思考讨论:利用该反应设计原电池
化合价升高失2e-
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
化合价降低得2e-
电极反应式:
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag
电极:负极是Cu,正极可以是Ag或C等。
根据电子流动方向或电流方向或电解质溶液内离子的定向移动方向判断负极电子流出极电流流入极或阴离子定向移向极正极电子流入极电流流出极或阳离子定向移向极3
第四章 电化学基础
第一节 原 电 池
一、原电池的工作原理 1.构成条件 (1)具有两个 活泼性 不同的电极。 (2)合适的 电解质 溶液。 (3)形成 闭合 回路(外电路用导线相连或互相接触并 将两电极插入电解质溶液中)。 (4)能自发地发生 氧化还原 反应。
负极——电子流出极,电流流入极或阴离子定向 移向极
正极——电子流入极,电流流出极或阳离子定向 移向极
3.根据两极发生的变化判断
负极——失去电子,化合价升高,发生氧化反应 正极——得到电子,化合价降低,发生还原反应
4.根据反应现象判断 负极——会逐渐溶解,质量减小 正极——有气泡逸出或质量增加
♨特别提示:原电池正负极判断的基础是氧化 还原反应。如果给出一个方程式让判断正、负极,可 以直接根据化合价的升降变化来判断,发生氧化反应 的一极为负极,发生还原反应的一极为正极。
电解液: AgNO3 或者: Cu(NO3)2 、AgNO3
总结
❖ 1、复习回忆了原电池的形成。 ❖ 2、进一步了解原电池的反应原理,
思考讨论:利用该反应设计原电池
化合价升高失2e-
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
化合价降低得2e-
电极反应式:
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag
电极:负极是Cu,正极可以是Ag或C等。
根据电子流动方向或电流方向或电解质溶液内离子的定向移动方向判断负极电子流出极电流流入极或阴离子定向移向极正极电子流入极电流流出极或阳离子定向移向极3
第四章 电化学基础
第一节 原 电 池
一、原电池的工作原理 1.构成条件 (1)具有两个 活泼性 不同的电极。 (2)合适的 电解质 溶液。 (3)形成 闭合 回路(外电路用导线相连或互相接触并 将两电极插入电解质溶液中)。 (4)能自发地发生 氧化还原 反应。
负极——电子流出极,电流流入极或阴离子定向 移向极
正极——电子流入极,电流流出极或阳离子定向 移向极
3.根据两极发生的变化判断
负极——失去电子,化合价升高,发生氧化反应 正极——得到电子,化合价降低,发生还原反应
4.根据反应现象判断 负极——会逐渐溶解,质量减小 正极——有气泡逸出或质量增加
♨特别提示:原电池正负极判断的基础是氧化 还原反应。如果给出一个方程式让判断正、负极,可 以直接根据化合价的升降变化来判断,发生氧化反应 的一极为负极,发生还原反应的一极为正极。
电解液: AgNO3 或者: Cu(NO3)2 、AgNO3
总结
❖ 1、复习回忆了原电池的形成。 ❖ 2、进一步了解原电池的反应原理,
人教版高中化学选修4第四章第一节 原电池 课件(共34张PPT)

(∨)
总反应:Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
2、如图所示,在铁圈和银圈的焊接处, 用一根棉线将其悬在盛水的烧杯中,使之 平衡;小心的向烧杯中央滴入CuSO4溶液, 片刻后可观察到的现象是
A. 铁圈和银圈左右摇摆不定
B. 保持平衡状态
C. 铁圈向下倾斜,银圈向上倾斜
D. 银圈向下倾斜,铁圈向上倾斜 D
[探究回顾]
请根据反应:
Zn + CuSO4 = ZnSO4 + Cu
设计一个单液原电池,并进行实 验。
CuSO4 溶液
电流表指针发生 偏转,但不稳定。
两个电极上都有 红色物质生成
分析:由于锌片与硫酸铜溶液直接接 触,锌片失去的电子一部分经导线传 递到铜片表面,另一部分电子直接传 递给硫酸铜溶液中的Cu2+,铜在锌片表 面析出,锌片表面也构成了原电池, 进一步加速铜在锌表面析出,致使向 外输出的电流强度减弱。当锌片表面 完全被铜覆盖后,不再构成原电池, 也就没有电流产生。
Zn + H2SO4 == ZnSO4 + H2↑ 指出发生氧化反应和还原反应的物质 以及电子转移的情况 氧化反应: Zn → Zn2+
还原反应:H+ → H2
要产生电流,必须的条件是什么? 有电子的转移 氧化还原反应
2.原电池的构成条件
1.有两种活泼性不同的金属(或非金属)作电极 2.电极材料均插入电解质溶液中 3.能自发地发生氧化还原反应 4.两极相连形成闭合回路
2、 实验室氢气选用纯锌粒好还是选用粗锌好?为什么?
选用粗锌好,形成原电池可加快反应。一般先把锌用硫酸 铜溶液浸泡一下。
人教版 高中化学(选修四) 第四章 第一节《原电池》 (共25张PPT)
⑵、 将Cu片插入H2SO4溶 液中有什么现象?为什么?
⑶、将一Zn片,Cu片平行插入 稀象H?2为SO什4溶么液?中,有什么现
(4)、若将Zn片,Cu片用一 导线连接,导线间接一电流 计,再浸在稀H2SO4溶液中, 有什么现象?为什么?
原 电 池 的 工 作 原 理
定向移动方向:电子、离子
原电池
盐电池
反应:
Cu2++Zn=Zn2++Cu
根据检流计指针偏转方向 知电流方向: Cu→Zn
盐桥:在U型管中装 满用饱和KCl溶液 和琼胶作成的冻 胶。
盐桥的作用:
使Cl-向锌盐方向移动, K+向铜盐方向移动,使 Zn盐和Cu盐溶液一直保 持电中性,从而使电子 不断从Zn极流向Cu极。
正、负两极分别发 生的反应,称为电 极反应。
小心的向烧杯中央滴入CuSO4溶液,片刻后
可观察到的现象是
A. 铁圈和银圈左右摇
(D )
摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
4、我国发射的神州五号载人飞 船是采用先进的甲烷电池为电能 的,该电池以KOH溶液为电解 质,其总反应的化学方程式为: CH4+2O2+2OH-=CO32-+3H2O
正极(铜电极): Cu2+ + 2e- = Cu 负极(锌电极): Zn = Zn2+ + 2e-
Cu2++Zn=Zn2++Cu
2、原电池形成的条件: 1.两个活泼性不同的电极
2. 电解质溶液 3.能自发地发生氧化还原反应 4.形成闭合回路
3、电极判断:
负极:电子流出的一极,发生氧化反应
⑶、将一Zn片,Cu片平行插入 稀象H?2为SO什4溶么液?中,有什么现
(4)、若将Zn片,Cu片用一 导线连接,导线间接一电流 计,再浸在稀H2SO4溶液中, 有什么现象?为什么?
原 电 池 的 工 作 原 理
定向移动方向:电子、离子
原电池
盐电池
反应:
Cu2++Zn=Zn2++Cu
根据检流计指针偏转方向 知电流方向: Cu→Zn
盐桥:在U型管中装 满用饱和KCl溶液 和琼胶作成的冻 胶。
盐桥的作用:
使Cl-向锌盐方向移动, K+向铜盐方向移动,使 Zn盐和Cu盐溶液一直保 持电中性,从而使电子 不断从Zn极流向Cu极。
正、负两极分别发 生的反应,称为电 极反应。
小心的向烧杯中央滴入CuSO4溶液,片刻后
可观察到的现象是
A. 铁圈和银圈左右摇
(D )
摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
4、我国发射的神州五号载人飞 船是采用先进的甲烷电池为电能 的,该电池以KOH溶液为电解 质,其总反应的化学方程式为: CH4+2O2+2OH-=CO32-+3H2O
正极(铜电极): Cu2+ + 2e- = Cu 负极(锌电极): Zn = Zn2+ + 2e-
Cu2++Zn=Zn2++Cu
2、原电池形成的条件: 1.两个活泼性不同的电极
2. 电解质溶液 3.能自发地发生氧化还原反应 4.形成闭合回路
3、电极判断:
负极:电子流出的一极,发生氧化反应
人教版化学选修四第四章第一节 原电池PPT(共24页)

F
√
C
D
√
G Zn C
√
稀硫酸
人教版化学选修四第四章第一节 原电池(共24张PPT)
简单原电池的设计
(1)将反应:2FeCl3+Fe=3FeCl2设计成原电池。 (2)判断正负极并写出电极反应。
Fe
石墨
人教版化学选修四第四章第一节 原电池(共24张PPT)
FeCl3溶液
负极(铁): Fe-2e-=Fe2+ 正极(石墨): 2Fe3+ + 2e-=2Fe2+
阴离子 溶液中 负极
思考: 原电池正负极判断方法?
电极材料,电极现象,电子流向,离子流向
人教版化学选修四第四章第一节 原电池(共24张PPT)
人教版化学选修四第四章第一节 原电池(共24张PPT)
二 原电池的电极判断
负极
正极
电极材料 较活泼金属 较不活泼金属或非金属
电极反应 氧化反应 还原反应
电子流向 电子流出 电子流入
选修4 《化学反应原理》
第一节 原 电 池
电能是一种清洁重要的能源,什么能可转 化为电能?
第一课时
我们的生活中离不开各种电池
干
锂
电
离 子
池
电
池
纽
蓄
扣
电
电
池
池
利用化学反应将化学能转化为电能---原电池
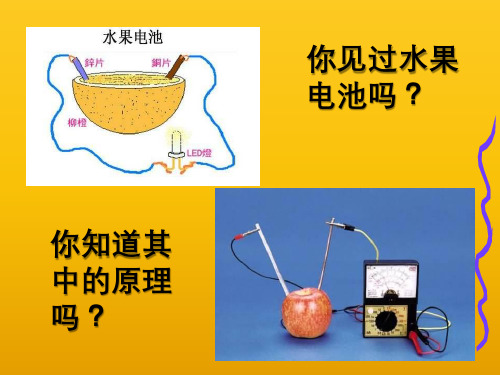
【实验一】将锌片、铜片插入稀硫酸,现象?
Zn + 2H+ = Zn2+ + H2↑
Zn
Cu
稀硫酸
锌片上有气泡产生,锌片渐渐溶解
人教版化学选修四第四章第一节 原电池(共24张PPT)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人教版高中选修四化学 原电池ppt【优秀课件】
2、工作原理
外电路:Zn失去电子沿导线通过电流表进入 铜片
内电路: Zn原子失去电子成为Zn2+进入溶液,使
ZnSO4溶液因Zn2+增加而带正电,盐桥中 的Cl—会移向ZnSO4溶液;同时Cu2+获得电 子成为金属沉淀在铜片上,使CuSO4溶液 因SO42—相对增加而带负电,盐桥中的K+ 移向CuSO4溶液,从而形成闭合回路。
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
当堂检测
(A级)1.锌铜原电池产生电流时,阳离子 ( B) A、移向Zn 极,阴离子移向Cu 极 B、移向Cu 极,阴离子移向Zn 极 C、和阴离子都移向Zn极 D、和阴离子都移向Cu 极
人教版高中选修四化学 原电池ppt【优秀课件】
回顾旧知
1、原电池 将化学能转变为电能 的装置。 原电池反应的本质是发生____氧_ 化_还__原_____反应。 2、原电池的构成条件:
①有两种活泼性不同的金属(或其中一种为非金属导体) ②电解质溶液 ③构成闭合回路 ④能自发地发生氧化还原反应
3、原电池正、负极规律 ①负极——电子 流出 的极。通常是活泼性 较强 的
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
CuSO4 溶液
分析:
由于锌片与硫酸铜溶液直接 接触,铜在锌片表面析出,锌表面 也构成了原电池,进一步加速铜在 锌表面析出,致使向外输出的电流 强度减弱。当锌片表面完全被铜覆 盖后,不再构成原电池,也就没有 电流产生。
(C级)2.、如图所示,在铁圈和银圈的焊接处, 人教版高中选修四化学原电池ppt【优秀课件】 用一根棉线将其悬在盛水的烧杯中,使之平衡; 小心的向烧杯中央滴入CuSO4溶液,片刻后可 观察到的现象是( ) D
A. 铁圈和银圈左右摇摆不定 B. 保持平衡状态 C. 铁圈向下倾斜,银圈向上倾斜 D. 银圈向下倾斜,铁圈向上倾斜
3、利用原电池的反应原理: Cu+2AgNO3=2Ag+Cu(NO3)2设计一个能持续 产生电流的原电池装置。
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
五、【课后作业】:把a、b、c、d四块金属
片浸入稀硫酸中,用导线两两相连组成原电池。
若a、b相连时,a为负极;c、d相连时,电流由d
金属,发生 氧化 反应 ②正极——电子 流入 的极。通常是活泼性 较弱 的金属 或非金属导体,发生 还原 反应
练习:下列哪些装置能构成原电池? ( abcd )
普通干电池
手机电池
钮扣电池
笔记本电脑 专用电池
摄像机 专用电池
“神七”用 太阳能电池
选修4 《化学反应原理》
原电池
实验探究
请根据反应:
小结:将原电池反应中的氧化反 应与还原反应分开在两个不同 区域内进行,再以适当的方式 连接起来,从而获得了稳定持 续的电流。
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
课堂总结
一、定义: 二、形成条件: 三、原电池正负极判断 四、工作原理 五、半电池和盐桥
CuSO4 溶液
电流表指针发生偏转,但 不稳定。两个电极上都有红 色物质生成
人教版高中选修四化学 原电池ppt【优秀课件】
补充实验1
问题:该装置是否构成原电池?电流表指针 发生偏转吗?铜电极上有什么现象?
现象:铜片表面明显有铜 析出,锌片逐渐溶解,电 流表指示无电流通过。
判断、假设:有原电池中电 极反应的特点;电流表指针 不动的原因可能与锌片与铜 片直接接触有关。
到c;a、c相连时,c极上产生大量气泡,b、d相
连时,b上有大量气泡产生,则四种金属的活动性
顺序由强到弱的为 ( )
A.a > b > c > d
B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
六、【课后反思】 1.查漏知识点: 2.主要错题:
人教版高中选修四化学 原电池ppt【优秀课件】
Zn + CuSO4 = ZnSO4 + Cu
设计一个原电池,并进行实验。
Hale Waihona Puke 实验探究1CuSO4 溶液
实验探究2
电流表指针发生偏转吗?指 针稳定吗?两个电极上都有什 么现象?
该装置是否构成原电池?电流 表指针发生偏转吗?铜电极上 有什么现象?
电流表指针发生偏转吗? 指针稳定吗?两个电极上都 有什么现象?
思考:如何才能得到 持续稳定的电流?
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
实验探究
在原有实验基础上进行改进,设计成一个能 产生持续稳定电流的原电池。
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
铜锌原电池
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
一、原电池
3、电极反应 Zn——负极 Zn - 2e- = Zn2+
Cu——正极 Cu2 2e Cu
总反应方程式:Zn+Cu2+=Zn2++Cu
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
一、原电池
将化学能转变为电能的装置
1.组成——两个半电池、盐桥
盐桥:饱和 KCl 溶液(以琼 胶制作成冻胶)
盐桥的作用
①让溶液始终保持电中性使电极反应得以继续进行 ②使两个烧杯中的溶液连成一个通路
人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】 人教版高中选修四化学 原电池ppt【优秀课件】
人教版高中选修四化学 原电池ppt【优秀课件】
•
1.加强职工主人翁责任感,组织落实 各项技 术组织 措施, 认清贯 彻劳动 定额的 重要意 义和目 的,增 强完成 定额和 超额完 成定额 的信心 。
•
2.帮助本单位职能部门做好劳动定额 制订和 修订工 作,并 组织班 组职工 讨论, 使劳动 定额保 持先进 合理的 水平。
