常见人名反应及机理
基础有机化学人名反应

引言概述:基础有机化学是研究有机化合物的物理性质、化学性质、结构和合成方法的科学。
在有机化学领域,人名反应是一种重要的化学反应类别。
人名反应是以其发现者或主要贡献者的名字来命名的有机化学反应。
本文将介绍几个常见的基础有机化学人名反应,包括居里尔莫梅托反应、格里尼亚反应、梅林反应、勒纳-约翰逊反应和沃尔弗-克希尔反应。
正文内容:一、居里尔莫梅托反应1.居里尔莫梅托反应的概述和历史背景2.反应机理和关键步骤的详细解释3.应用和实例:居里尔莫梅托反应在有机合成中的应用领域和反应条件4.优势和局限性:居里尔莫梅托反应的优势以及在特定情况下的局限性5.进一步发展和改进:对居里尔莫梅托反应的未来发展和改进的前景进行讨论二、格里尼亚反应1.格里尼亚反应的基本原理和应用2.反应机理和关键步骤的详细解释3.不同类型的格里尼亚试剂的制备方法和特点4.格里尼亚反应在有机合成中的应用实例5.格里尼亚反应的改进和未来发展方向三、梅林反应1.梅林反应的概述和历史背景2.反应机理和关键步骤的详细解释3.梅林反应在合成有机化合物和天然产物中的应用4.梅林反应与其他反应的比较和优势5.对梅林反应未来研究和改进的展望四、勒纳-约翰逊反应1.勒纳-约翰逊反应的基本原理和历史背景2.反应机理和关键步骤的详细解释3.不同类型的勒纳-约翰逊试剂的制备方法和特点4.勒纳-约翰逊反应在有机合成中的应用实例5.对勒纳-约翰逊反应的改进和发展方向的讨论五、沃尔弗-克希尔反应1.沃尔弗-克希尔反应的概述和历史背景2.反应机理和关键步骤的详细解释3.沃尔弗-克希尔反应在药物合成中的应用4.不同类型的沃尔弗-克希尔试剂的制备方法和特点5.对沃尔弗-克希尔反应的改进和未来发展前景的展望总结:基础有机化学的人名反应是有机化学领域中的重要组成部分,各个人名反应都有其独特的反应机理和应用领域。
本文详细介绍了居里尔莫梅托反应、格里尼亚反应、梅林反应、勒纳-约翰逊反应和沃尔弗-克希尔反应的概述、反应机理、应用和改进方向。
大学有机化学人名反应总结
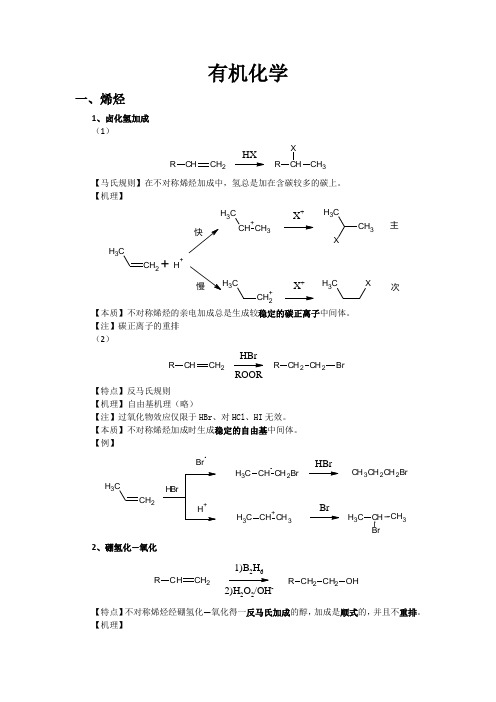
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCHCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH 2CH 33H 323H 32CH CH 2CH 32CH CH=CH (CH 3CH 2CH 2)3-H 3CH 2CH 2C22CH 3CH 2B OCH2CH 2CH 3H 3CH 2CH 2C2CH 2CH 3+OH -OHB-OC H 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2BOC H 2CH 2CH 3CH 2CH 2CH 3H 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOC H 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH -CH 3HH OH3、X 2加成C CBr /CClCC Br【机理】CCCC Br BrCBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
大学有机化学人名反应机理汇总

3.Baeyer----Villiger 反应拜耳-维立格氧化重排反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
7.Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
9.Claisen 酯缩合反应含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
有机化学人名反应机理全解

人名反应1.Arbuzov反应(Michaelis-Arbuzov重排)2.Arndt-Eistert反应3.Baeyer-Villiger氧化重排4.Beckmann重排5.Birch还原6.Bischler-Napieralski合成法7.Bouveault-Blanc还原8.Bucherer反应9.Cannizzaro反应10.Chichibabin反应11.Chugaev反应12.Claisen重排13.Claisen缩合反应14.Claisen-Schmidt反应15.Clemmensen还原bes合成法17.Cope重排18.Cope消除19.Corey-House合成法20.Cristol反应21.Curtius重排22.Darzen反应23.Demjanov重排24.Dieckmann反应25.Diels-Alder反应26.Döebner-Miller合成法27.Edman降解法28.Eschweiler-Clarke反应29.Favorski重排30.Fischer吲哚合成法31.Friedel-Crafts烷基化反应32.Friedel-Crafts酰基化反应33.Fries重排34.Gabriel合成法35.Gatterman反应(1)36.Gatterman反应(2)37.Gatterman-Koch反应38.Gomberg-Bachmann反应39.Hantzsch吡啶合成法40.Hantzsch吡咯合成法41.Haworth反应42.Hell-Volhard-Zelinsky反应43.Hell-Volhard-Zelinskyα-溴化法44.Henry反应45.Hinsberg反应46.Hofmann重排(Hofmann降解)47.Hofmann烷基化48.Hofmann消除反应49.Houben-Hoesch反应50.Hunsdiecker反应51.Knoevenagel反应52.Knorr合成法53.Kochi反应54.Kolbe反应55.Kolbe-Schmidt反应56.Kucherov反应57.Leuckart反应58.Lossen重排59.Mannich反应60.McMurry反应61.Meerwein-Ponndorf-Verley还原62.Michael加成反应tkin重排64.Nazarov反应65.Oppenauer氧化66.Paal-Knorr合成法67.Perkin反应68.Pschorr反应69.Reformatsky反应70.Reimer-Tiemann反应71.Ritter反应72.Robinson增环反应73.Rosenmund还原74.Sandmeyer反应75.Schiemann反应76.Schmidt重排77.Shapiro反应78.Simmons-Smith反应79.Skraup合成法80.Smiles重排81.Stephen还原82.Stevens重排83.Strecker氨基酸合成法84.Tiffeneau-Demjanov重排85.Ullmann反应86.Vilsmeier反应87.von Richter重排88.Wacker氧化反应89.Wagner-Meerwein重排90.Williamson合成法91.1,2-Wittig重排92.Wittig反应93.Wittig-Horner反应(Emmons反应、Horner-Emmons反应、Wadsworth-Emmons反应)94.Wolff重排95.Wolff-Kisher-黄鸣龙还原96.Wurtz反应97.Wurtz-Fittig反应Arbuzov反应亚磷酸三烷基酯与卤代烷或其衍生物反应生成烷基膦酸酯和一个新的卤代烷的反应称为Arbuzov反应,也称Michaelis-Arbuzov重排。
有机合成常用人名反应

有机合成常用人名反应有机合成是化学领域中的一个重要分支,它研究有机化合物的合成方法和反应过程。
在有机合成中,常常会使用一些常用的人名反应,这些反应以人名命名,代表了该反应的发现者或者重要贡献者。
本文将介绍一些常用的人名反应,并对其原理和应用进行阐述。
一、格氏反应(Gattermann Reaction)格氏反应是一种用于合成醛的重要反应。
它是由德国化学家格氏(Gattermann)于1898年发现的。
格氏反应通过在芳香化合物上引入氰基,然后将其加氢还原,得到相应的醛。
格氏反应是一种重要的合成醛的方法,广泛应用于有机合成领域。
二、斯特雷克反应(Strecker Reaction)斯特雷克反应是一种合成α-氨基酸的方法,由德国化学家斯特雷克(Strecker)于1850年发现。
该反应通过使用醛、氰化物和胺,经过缩合和水解反应,合成出具有氨基酸结构的化合物。
斯特雷克反应是合成氨基酸的重要方法之一,广泛应用于生物化学和药物化学领域。
三、沃尔夫-克尼希反应(Wolf-Kishner Reduction)沃尔夫-克尼希反应是一种将醛或酮转化为对应的烷烃的方法。
该反应由德国化学家沃尔夫(Wolf)和克尼希(Kishner)于1912年发现。
沃尔夫-克尼希反应通过使用氨水和氢醇钠,将醛或酮转化为相应的烷烃。
这种还原反应在有机合成中具有重要的应用价值。
四、格里格纳德试剂(Grignard Reagent)格里格纳德试剂是一类由法国化学家格里格纳德(Grignard)于1900年发现的有机金属试剂。
格里格纳德试剂可以与卤代烃反应,生成烷基镁试剂。
这些烷基镁试剂可以与酮、醛、酸等化合物发生加成反应,合成出复杂的有机分子。
格里格纳德试剂是一种重要的有机合成试剂,在有机合成中具有广泛的应用。
五、费舍尔试剂(Fisher Reagent)费舍尔试剂是一种用于合成酮的试剂,由德国化学家费舍尔(Fisher)于1895年发现。
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯与一个新得卤代烷:卤代烷反应时,其活性次序为:R′I >R′Br 〉R′Cl.除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a—或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总就是先脱除含碳原子数最少得基团。
本反应就是由醇制备卤代烷得很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用得卤代烷R’X得烷基与亚磷酸三烷基酯(RO)3P得烷基相同(即R'=R),则Arbuzov反应如下:这就是制备烷基膦酸酯得常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2与次亚膦酸酯R2POR'也能发生该类反应,例如:反应机理一般认为就是按SN2 进行得分子内重排反应:反应实例二、Arndt—Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer——--Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上得一个烃基带着一对电子迁移到—O-O-基团中与羰基碳原子直接相连得氧原子上,同时发生O-O键异裂.因此,这就是一个重排反应具有光学活性得3-—-苯基丁酮与过酸反应,重排产物手性碳原子得枸型保持不变,说明反应属于分子内重排:不对称得酮氧化时,在重排步骤中,两个基团均可迁移,但就是还就是有一定得选择性,按迁移能力其顺序为:醛氧化得机理与此相似,但迁移得就是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应得酯,其中三氟过氧乙酸就是最好得氧化剂。
这类氧化剂得特点就是反应速率快,反应温度一般在10~40℃之间,产率高。
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I >R′Br >R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理2 进行的分子内重排反应:一般认为是按 SN反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
有机合成人名反应及机理

有机合成人名反应及机理
有机合成中有很多重要的反应,这些反应的机理大多数都是经过
详细论证的。
下面具体介绍几个重要的反应及其机理。
1. 化学家霍夫曼发明了非常有用的反应,叫做“霍夫曼降解反应”。
这个反应可以用来从胺中制备出烷基卤化物。
具体反应步骤是:首先将胺和次氯酸钠混合,然后将水加入混合液中,这样就可以生成
亚氯酰胺。
接下来,将氢氧化钠加入混合液中,反应会生成氯化胺和
氢氧化钠。
最后,烷基化剂加入反应混合物中,生成的产物就是烷基
化合物。
2. 另一个非常重要的有机反应称为“Suzuki–Miyaura偶联反应”,这个反应可以用来将芳香化合物和烯丙基铜或锂互相连接。
这
个反应的机理是:首先,碘化物和芳基卤化物混合,这样就可以形成
碘化芳基化合物。
然后,在其上添加烯丙基铜或锂,这样就可以连接
两种芳香化合物。
最后,加入铜催化剂来促进反应的进行。
3. 最后一个重要的反应是“Diazo反应”,这个反应可以用来制
备罕见的化合物,并且这个反应的机理也比较简单。
首先,从亚硝酸
和苯甲酸中制备出叠氮化物。
接下来,将目标化合物与叠氮化物混合,这样就可以生成新的化合物。
这个反应的一个很好的例子是,将间苯
二酚转化成二苯基二烯。
以上三个反应是有机合成中非常常见的反应,掌握这些反应及其
机理可以为有机合成研究提供非常有用的指导。
有机化学人名反应总结

有机化学人名反应总结是研究碳及其化合物的科学,其中许多反应被命名以纪念其首位发现者或发展者。
这些人名反应不仅对于的发展起到了巨大的推动作用,也源自于对科学家们的敬意和对他们贡献的赞扬。
在本文中,将总结几个人名反应,了解它们的原理和应用。
一、丁基锂合成反应(BuLi 生成反应)丁基锂是一种有机锂化合物,它的生成反应是通过将溶于正丁脱氢剂(n-BuLi)加入至正丁锂反应(floats-buLi)中得到的。
正丁锂反应是以但钾为催化剂,会使其在高压下进行。
该反应的关键是高温和高压条件下n-BuLi和粉末锂(floats-Li)之间的快速反应。
这个反应的应用十分广泛,可以用来合成各种有机锂试剂,如烃基锂、脂基锂,进而合成复杂的有机化合物。
二、格氏试剂合成反应 (Grignard 试剂生成反应)格氏试剂是有机锂试剂的后继者,由法国化学家弗朗索瓦·格里尼亚(francois auguste)发明并得名。
该反应以季碳基物质镁为催化剂,与卤化烃或卤化芳烃发生取代反应得到格氏试剂。
格氏试剂常用于合成范围广泛的有机化合物,主要反应机制类似于亲核取代反应,并使其非常重要的有机合成试剂之一。
三、斯托茨勒合成(Storz reaction)斯托茨勒合成反应是醛、酮与硫酸钠或硫酸食盐反应,生成酯的方法。
该反应是由俄罗斯化学家弗拉基米尔·利奥诺维奇·斯托茨(Vladimir Leontievich Stotsky)发现并命名的。
通过控制反应条件和底物的选择,可以合成具有多种不同结构的酯。
四、诺贝尔-加斯基诺反应 (Nobel-Gassman 试剂生成反应)诺贝尔-加斯基诺反应是一种用于合成β-哌啶酮的方法,是由德国化学家赫尔曼·斯图尔特·诺贝尔(Herman Staudinger)和法国化学家约瑟夫·加斯奥诺(Joseph Köck)合作发现的。
这个反应的关键是氰甲酸酯的转化,通过底物的选择,可以合成出不同结构的β-哌啶酮,具有广泛的应用前景。
常见人名反应及机理

1. Aldol Condensation:羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
反应第一步为羟醛反应,第二部反应为脱水反应。
酸催化碱催化图例使用OCH3 做碱2.Baeyer –Villiger Oxidation酮在过氧化物如过氧化氢、过氧化羧酸等氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
2.Baylis –Hillman Reactionαβ-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。
催化剂一般采用DABCO(14-二氮双环222辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇1。
贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael 加成反应启动的加成-消除反应历程4. Beckmann Rearrangement是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
α-二酮、α-酮酸、α-叔烃基酮反式、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易,又斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为―异常贝克曼重排‖称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
5. Benzoin Condensation 安息香缩合反应,又称苯偶姻缩合,是一个有机反应,是氰离子催化下两分子芳香醛进行缩合生成一个偶姻分子的反应。
由于生成物是安息香(Ph-CO-CHOH-Ph)的衍生物,故名??. Birch Reduction钠和醇在液氨中将芳香环还原成14-环己二烯的有机还原反应。
Birch 还原的重要性在于:尽管剩下的双键(非芳香性)更为活泼,该反应却能停留在环己双烯上,而不继续还原。
反应中的钠也可以用锂或钾取代,使用的醇通常是甲醇或叔丁醇。
有机化学人名反应

有机化学人名反应取代反应:1,加特曼反应:加特曼(Gattermann L)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成?-氨基吡啶,如果?位已被占据,则得?-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯―巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)―巴赫曼(Bachmann)反应。
7,柯尔伯―施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯―施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(Williamson A W)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(Sandmeyer T)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(Pschorr R)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔―悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔―悌曼(Reimer ―Tiemann)反应。
有机化学人名反应

引言概述:有机化学人名反应是有机化学领域中的重要反应,以发现或命名人物命名,旨在纪念对有机化学做出重大贡献的科学家。
本文将介绍五个涉及有机化学人名反应的重要反应,包括Sn2反应、Friedel-Crafts反应、Hofmann降解反应、Diels-Alder反应和Hofmann重排反应。
正文内容:1. Sn2反应1.1 概述:Sn2反应是一种亲核取代反应,其中一个亲核试剂攻击官能团上的消极部分,然后将其替换为新的官能团。
1.2 人名来源:Sn2反应是以科学家在有机化学领域做出开创性贡献的Edwin S. Gould命名。
1.3 反应特点:Sn2反应的反应速率与亲核试剂浓度成正比,但与底物浓度无关。
1.4 影响因素:影响Sn2反应速率的因素包括底物结构、溶剂选择和温度等。
1.5 应用领域:Sn2反应在合成有机化学中广泛应用于底物的碳-氮键或碳-氧键的形成。
2. Friedel-Crafts反应2.1 概述:Friedel-Crafts反应是一种芳香族碳-碳键形成的反应,在芳香族化合物上引入新的取代基团。
2.2 人名来源:Friedel和Crafts是两位法国化学家,他们共同发现并开发了这一重要反应。
2.3 反应类型:Friedel-Crafts反应可以分为两种类型,即芳香烃的烷基化和芳香烃的酰基化。
2.4 反应机理:Friedel-Crafts反应的机理通常涉及亲电取代和负离子取代两种机制。
2.5 应用领域:Friedel-Crafts反应在药物合成和农药合成等领域具有重要的应用价值。
3. Hofmann降解反应3.1 概述:Hofmann降解反应是一种将主要氨基酸转化为次级氨基酸的反应。
3.2 人名来源:Hofmann是德国化学家Hermann Emil Fischer 的学生,他发现并研究了这个反应。
3.3 反应过程:Hofmann降解反应涉及以次氨基酸为中间体进行进一步反应,最终生成次级氨基酸。
邢其毅第三版至23章常见有机人名反应及其机理

邢其毅第三版至23章常见有机人名反应及其机理1.苯芳香烃芳香亲电取代伯奇还原(Birchreduction)【苯及苯同系物得到环己二烯系,独到之处在于可将苯环部分还原为环二烯】不与苯环共轭的双键不能在该条件下发生还原,与苯环共轭的C=C双键能在该条件下发生还原。
而且反应首先在双键处发生。
机理:傅-克(Friedel-Craft)烷基化反应【苯环上引入烷基】机理:特点一:烷基化反应易发生重排,不适合制备长的直链烷基苯。
特点二:反应不易控制在一元取代阶段,常常得到一元、二元、多元取代产物的混合物。
特点三:反应是可逆的,所以经常发生烷基移位、移环。
傅-克(Friedel-Craft)酰基化反应【苯环上引入酰基,可用于制备芳酮,配合Clemmenen还原制备直链烷烃】特点一:酰基是一个钝化的间位定位基,所以反应能控制在一元取代阶段,产率很好。
特点二:反应是不可逆的,不会发生取代基的转移反应哈武斯(Harworth)合成法【制备稠环化合物】加特曼-科赫(Gattermann-Koch)反应【在酸性条件下,在苯和甲苯上引入甲酰基】2.醛、酮亲核加成共轭加成贝克曼(Beckmann)重排【酸性条件下,酮肟转变为酰胺,可用于由酮制备酰胺、羧酸、胺】(1)重排反应是在酸催化下完成的。
(2)只有处于羟基反位的烃基才能迁移。
(3)基团的迁移和羟基离去是同步的。
(4)迁移基团在迁移过程中构型保持不变。
某麦克尔(Michael)共轭加成反应【在碱性催化剂作用下,能提供亲核碳负离子的化合物(给体)与能提供亲电共轭体系(受体)的化合物发生亲核1,4-共轭加成得到1,5-二羰基化合物】不对称酮进行麦克尔加成时,反应总是在多取代的α-C上发生。
克莱门森(Clemmenen)还原【酸性条件下将羰基还原成亚甲基】乌尔夫-凯惜纳-黄鸣龙(Wolffl-Kihner-HuangMinlon)还原【碱性条件下将羰基还原成亚甲基】机理:麦尔外因-彭杜尔夫(Meerwein-Ponndorf)还原魏悌息(Wittig)亲核加成反应【醛酮形成烯烃】①反应速度醛最快,酮次之。
15个有机人名反应

有机人名反班级:化学一班学号:41207046 姓名:袁雪薇1.Pschorr反应重氮盐在碱性条件下发生分子内偶联反应。
反应机理:一般认为,本反应是通过自由基进行的,在反应时,两个苯环必须在双键的同一侧,并且在同一个平面上。
2.Dkin反应邻位或对位有羟基(或氨基)的芳醛或芳酮在碱溶液中用过氧化氢或其他氧化物氧化,得到相应的多元酚。
化学方程式:反应机理:3.Baeyer-Viliger 氧化酮类化合物用过酸如或氧乙酸等氧化,可在羰基旁边插一个氧原子,生成相应的酯。
反应机理4.Vilsmeier 反应芳烃、活化烯烃化合物用二取代甲酰胺及三氯氧磷处理得到醛类。
是在芳环上引入甲酰基的常用方法。
化学方程式:反应机理:5. Hantzsch反应原料:羰基酸酯,醛,氨,氧化剂反应方程式:反应机理:R /ORO O R //+R /O ONH 3NR //CO 2R /RRR /O 2C主要应用:用于合成吡啶的同系物,在生物、医药等 6. Birch 反应原料:芳香化合物、碱金属(钠、钾或锂)、液氨、醇(乙醇、异丙醇或仲丁醇) 反应方程式:反应机理:主要应用:Birch 还原时连接芳香族和脂肪族化合物的桥梁,它使许多芳香族衍生物成为合成脂肪族化合物。
Birch 还原早期集中于烷基苯和芳香醚类化合物的合成,现在已扩展到芳香族酸、酯和酮等化合物,在天然有机产物合成中得到广泛应用。
例如手性环己烷衍生物的合成。
Na3Na +NH3Na +e+HHeEtOHHHeHH EtOHHH7. Fries重排原料:酚、酯、lewis酸也可以是硝基苯、硝基甲烷溶剂反应方程式:酚酯在lewis酸存在下加热发生酰基重排,生成邻羟基和对羟基芳酮的混合物。
邻对位比例取决于酚酯的结构、反应条件和催化剂等。
温度对产物比例影响较大,一般来说,较低温度下重排有利于形成对位异构产物,较高温度下有利于形成邻位异构产物。
反应机理:O CORAlCl3OHCOR+OHCO R3O CCH3OCH33165℃OHCH3H3CCO80~85%95%COCH3O COCH3AlCl3AlCl3+H3CCO+OH3CCOH+-AlCl3OHH3CCO主要应用:主要在药物合成中应用广泛,丙酸苯酯的Fries重排可以合成抗早产药利托君的中间体,还可以合成肾上腺素,是一种强心剂。
常见人名反应及其机理

常见人名反应及其机理1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer-Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault-Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
经典有机人名反应

有机化学人名反应1.拜耳维利格Baeyer----Villiger 反应(p317)反应机理(不要求)过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例2.康尼查罗Cannizzaro 反应(p321)凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
具有α-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α-活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到季戊四醇:反应机理醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
反应实例3.克莱森许密特Claisen—Schmidt 反应(交叉羟醛缩合)(p314)一个无氢原子的醛与一个带有氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到不饱和醛或酮:反应机理反应实例3.Claisen 重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
常见人名反应及机理

常见人名反应及机理 Document number:NOCG-YUNOO-BUYTT-UU986-1986UTBeckmann重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:Birch还原反应机理Cannizzaro反应反应机理Claisen酯缩合含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见反应机理乙酸乙酯的α-氢酸性很弱(,而乙醇钠又是一个相对较弱的碱(乙醇的pKa~),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
Claisen_Schmidt反应一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮:反应机理Clemmensen还原醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用还原。
Cope重排1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应()反应称为Cope 重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B e c k m a n n重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:Birch还原反应机理Cannizzaro反应反应机理Claisen酯缩合含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见反应机理乙酸乙酯的α-氢酸性很弱(pKa-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pKa~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
Claisen_Schmidt反应一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮:反应机理Clemmensen还原醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用还原。
Cope重排1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应()反应称为Cope 重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。
例如:内消旋-3,4-二甲基-1,5-己二烯重排后,得到的产物几乎全部是(Z,E)-2,6辛二烯:反应机理Cope重排是[3,3] -迁移反应,反应过程是经过一个环状过渡态进行的协同反应:在立体化学上,表现为经过椅式环状过渡态:Cope消除反应叔胺的N-氧化物(氧化叔胺)热解时生成烯烃和N,N-二取代羟胺,产率很高。
实际上只需将叔胺与氧化剂放在一起,不需分离出氧化叔胺即可继续进行反应,例如在干燥的二甲亚砜或四氢呋喃中这个反应可在室温进行。
此反应条件温和、副反应少,反应过程中不发生重排,可用来制备许多烯烃。
当氧化叔胺的一个烃基上二个β位有氢原子存在时,消除得到的烯烃是混合物,但是Hofmann产物为主;如得到的烯烃有顺反异构时,一般以E-型为主。
例如:反应机理这个反应是E2顺式消除反应,反应过程中形成一个平面的五员环过度态,氧化叔胺的氧作为进攻的碱:要产生这样的环状结构,氨基和β-氢原子必须处于同一侧,并且在形成五员环过度态时,α,β-碳原子上的原子基团呈重叠型,这样的过度态需要较高的活化能,形成后也很不稳定,易于进行消除反应Darzens反应反应机理Dieckmann缩合反应反应机理Diels_Alder反应含有一个活泼的双键或叁键的化合物(亲双烯体)与共轭二烯类化合物(双烯体)发生1,4-加成,生成六员环状化合物:这个反应极易进行并且反应速度快,应用范围极广泛,是合成环状化合物的一个非常重要的方法。
带有吸电子取代基的亲双烯体和带有给电子取代基的双烯体对反应有利。
常用的亲双烯体有:下列基团也能作为亲双烯体发生反应:常用的双烯体有:Elbs反应羰基的邻位有甲基或亚甲基的二芳基酮,加热时发生环化脱氢作用,生成蒽的衍生物:由于这个反应通常是在回流温度或高达400-450°C的温度范围内进行,不用催化剂和溶剂,直到反应物没有水放出为止,在这样的高温条件下,一部分原料和产物发生碳化,部分原料酮被释放出的水所裂解,烃基发生消除或降解以及分子重排等副反应,致使产率不高。
Favorski反应炔烃与羰基化合物在强碱性催化剂如无水氢氧化钾或氨基钠存在下于乙醚中发生加成反应,得到炔醇:液氨、乙二醇醚类、四氢呋喃、二甲亚砜、二甲苯等均能作为反应的溶剂。
反应机理Favorskii重排α-卤代酮在氢氧化钠水溶液中加热重排生成含相同碳原子数的羧酸;如为环状α-卤代酮,则导致环缩小。
如用醇钠的醇溶液,则得羧酸酯:此法可用于合成张力较大的四员环。
反应机理Friedel-Crafts反应芳烃与卤代烃、醇类或烯类化合物在Lewis催化剂(如AlCl3,FeCl3,H2SO4,H3PO4,BF3,HF等)存在下,发生芳环的烷基化反应。
卤代烃反应的活泼性顺序为:RF>RCl>RBr>RI;当烃基超过3个碳原子时,反应过程中易发生重排。
反应机理首先是卤代烃、醇或烯烃与催化剂如三氯化铝作用形成碳正离子:所形成的碳正离子可能发生重排,得到较稳定的碳正离子:碳正离子作为亲电试剂进攻芳环形成中间体σ-络合物,然后失去一个质子得到发生亲电取代产物:Friedel-Crafts酰基化反应芳烃与酰基化试剂如酰卤、酸酐、羧酸、烯酮等在Lewis酸(通常用无水三氯化铝)催化下发生酰基化反应,得到芳香酮:这是制备芳香酮类最重要的方法之一,在酰基化中不发生烃基的重排。
反应机理Fries重排酚酯在Lewis酸存在下加热,可发生酰基重排反应,生成邻羟基和对羟基芳酮的混合物。
重排可以在硝基苯、硝基甲烷等溶剂中进行,也可以不用溶剂直接加热进行。
邻、对位产物的比例取决于酚酯的结构、反应条件和催化剂等。
例如,用多聚磷酸催化时主要生成对位重排产物,而用四氯化钛催化时则主要生成邻位重排产物。
反应温度对邻、对位产物比例的影响比较大,一般来讲,较低温度(如室温)下重排有利于形成对位异构产物(动力学控制),较高温度下重排有利于形成邻位异构产物(热力学控制)。
反应机理Gabriel合成法邻苯二甲酰亚胺与氢氧化钾的乙醇溶液作用转变为邻苯二甲酰亚胺盐,此盐和卤代烷反应生成N-烷基邻苯二甲酰亚胺,然后在酸性或碱性条件下水解得到一级胺和邻苯二甲酸,这是制备纯净的一级胺的一种方法。
有些情况下水解很困难,可以用肼解来代替:反应机理邻苯二甲酰亚胺盐和卤代烷的反应是亲核取代反应,取代反应产物的水解过程与酰胺的水解相似。
Gattermann反应重氮盐用新制的铜粉代替亚铜盐(见)作催化剂,与浓盐酸或氢溴酸发生置换反应得到氯代或溴代芳烃:本法优点是操作比较简单,反应可在较低温度下进行,缺点是其产率一般较低。
反应机理见Hinsberg反应伯胺、仲胺分别与对甲苯磺酰氯作用生成相应的对甲苯磺酰胺沉淀,其中伯胺生成的沉淀能溶于碱(如氢氧化钠)溶液,仲胺生成的沉淀则不溶,叔胺与对甲苯磺酰氯不反应。
此反应可用于伯仲叔胺的分离与鉴定。
Hofmann烷基化卤代烷与氨或胺发生烷基化反应,生成脂肪族胺类:由于生成的伯胺亲核性通常比氨强,能继续与卤代烃反应,因此本反应不可避免地产生仲胺、叔胺和季铵盐,最后得到的往往是多种产物的混合物。
用大过量的氨可避免多取代反应的发生,从而可得到良好产率的伯胺。
反应机理反应为典型的亲核取代反应(S N1或S N2)Hofmann消除反应季铵碱在加热条件下(100--200°C)发生热分解,当季铵碱的四个烃基都是甲基时,热分解得到甲醇和三甲胺:如果季铵碱的四个烃基不同,则热分解时总是得到含取代基最少的烯烃和叔胺:Hofmann重排酰胺用溴(或氯)在碱性条件下处理转变为少一个碳原子的伯胺:反应机理Mannich反应含有α-活泼氢的醛、酮与甲醛及胺(伯胺、仲胺或氨)反应,结果一个α-活泼氢被胺甲基取代,此反应又称为胺甲基化反应,所得产物称为Mannich碱。
反应机理Koble_Schmitt反应酚钠和二氧化碳在加压下于125-150oC反应,生成邻羟基苯甲酸,同时有少量对羟基苯甲酸生成:反应产物与酚盐的种类及反应温度有关,一般来讲,使用钠盐及在较低的温度下反应主要得到邻位产物,而用钾盐及在较高温度下反应则主要得对位产物:邻位异构体在钾盐及较高温度下加热也能转变为对位异构体:Michael加成反应一个亲电的共轭体系和一个亲核的碳负离子进行共轭加成,称为Micheal加成:反应机理Knoevenagel反应含活泼亚甲基的化合物与醛或酮在弱碱性催化剂(氨、伯胺、仲胺、吡啶等有机碱)存在下缩合得到α,β-不饱和化合物。
反应机理Oppenauer氧化仲醇在叔丁醇铝或异丙醇铝和丙酮作用下,氧化成为相应的酮,而丙酮则还原为异丙醇。
这个反应相当于的逆向反应。
反应机理Reformatsky反应醛或酮与α-卤代酸酯和锌在惰性溶剂中反应,经水解后得到β-羟基酸酯。
反应机理首先是α-卤代酸酯和锌反应生成中间体有机锌试剂,然后有机锌试剂与醛酮的羰基进行加成,再水解:Reimer-Tiemann反应反应机理Rosenmund还原酰氯用受过硫-喹啉毒化的钯催化剂进行催化还原,生成相应的醛:反应物分子中存在硝基、卤素、酯基等基团时,不受影响。
Sandmeyer反应重氮盐用氯化亚铜或溴化亚铜处理,得到氯代或溴代芳烃:这个反应也可以用新制的铜粉和HCl或HBr来实现(反应)。
反应机理Schiemann反应芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸重氮盐,后者加热分解生成氟代芳烃:此反应与类似。
反应机理本反应属于单分子芳香亲核取代反应,氟硼酸重氮盐先是分解成苯基正离子,受到氟硼酸根负离子进攻后得到氟代苯。
Gomberg_Bachmann反应芳香重氮盐在碱性条件下与其它芳香族化合物偶联生成联苯或联苯衍生物:反应机理Schmidt反应羧酸、醛或酮分别与等摩尔的叠氮酸(HN3)在强酸(硫酸、聚磷酸、三氯乙酸等)存在下发生分子内重排分别得到胺、腈及酰胺:其中以羧酸和叠氮酸作用直接得到胺的反应最为重要。
羧酸可以是直链脂肪族的一元或二元羧酸、脂环酸、芳香酸等;与、和相比,本反应胺的收率较高。
反应机理本反应的机理与、和机理相似,也是形成异氰酸酯中间体:当R为手性碳原子时,重排后手性碳原子的构型不变:Skraup合成法反应机理Ullmann反应卤代芳烃在铜粉存在下加热发生偶联反应生成联苯类化合物。
如碘代苯与铜粉共热得到联苯:这个反应的应用范围广泛,可用来合成许多对称和不对称的联苯类化合物。
芳环上有吸电子取代基存在时能促进反应的进行,尤其以硝基、烷氧羰基在卤素的邻位时影响最大,邻硝基碘苯是参与Ullmann反应中最活泼的试剂之一。
反应机理本反应的机理还不肯定,可能的机理如下:另一种观点认为反应的第二步是有机铜化合物之间发生偶联:Williamson合成法卤代烃与醇钠在无水条件下反应生成醚:如果使用酚类反应,则可以在氢氧化钠水溶液中进行:卤代烃一般选用较为活泼的伯卤代烃(一级卤代烃)、仲卤代烃(二级卤代烃)以及烯丙型、苄基型卤代烃,也可用硫酸酯或磺酸酯。
