有机化学人名反应机理
大学有机化学人名反应机理汇总

3.Baeyer----Villiger 反应拜耳-维立格氧化重排反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
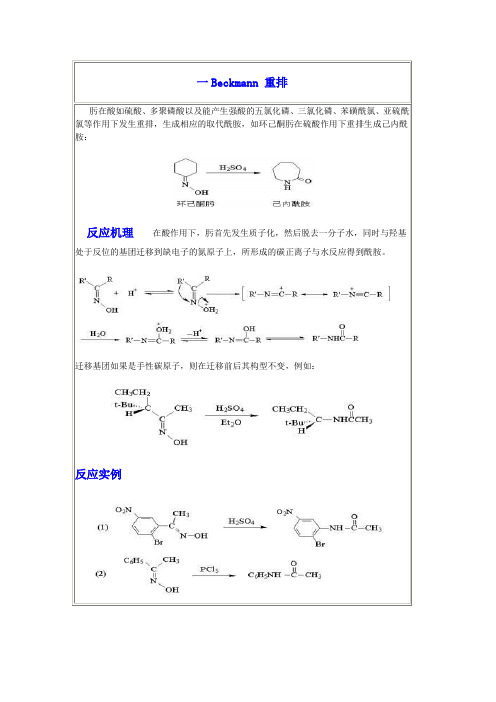
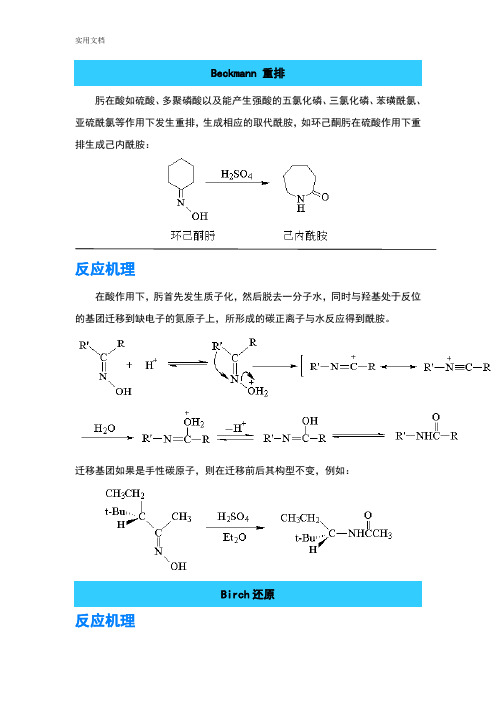
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排%肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
7.Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:!脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
9.Claisen 酯缩合反应含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
乙酸乙酯的α-氢酸性很弱(,而乙醇钠又是一个相对较弱的碱(乙醇的pK a~),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
有机化学人名反应机理

液氨、乙二醇醚类、四氢呋喃、二甲亚砜、二甲苯等均能作为反应的溶剂。 反应机理
• 反应实例
Favorskii 重排 • α-卤代酮在氢氧化钠水溶液中加热重排生成含相同碳原子数的羧酸;如为环状α-卤代酮,则导致环缩小。
如用醇钠的醇溶液,则得羧酸酯: 此法可用于合成张力较大的四员环。
• 反应机理
有机化学人名反应
Arbuzov反应(艾伯佐夫反应) • 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:
a
卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、α-卤代醚、α-或 β-卤代 酸酯、对甲苯磺酸酯等也可以进行反应。当亚磷酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的 基团。
• 反应机理 反应实例
Gabriel 合成法(盖布瑞尔) • 邻苯二甲酰亚胺与氢氧化钾的乙醇溶液作用转变为邻苯二甲酰亚胺盐,此盐和卤代烷反应生成N-烷基邻苯
二甲酰亚胺,然后在酸性或碱性条件下水解得到一级胺和邻苯二甲酸,这是制备纯净的一级胺的一种方法。
有些情况下水解很困难,可以用肼解来代替:
反应机理 邻苯二甲酰亚胺盐和卤代烷的反应是亲核取代反应,取代反应产物的水解过程与酰胺的水解相似。
交叉反应实验证明:Claisen重排是分子内的重排。采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳 原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯 环相连。
• 反应机理 Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
由于这个反应通常是在回流温度或高达400-450 °C的温度范围内进行,不用催化剂和溶剂,直到反应物没有 水放出为止,在这样的高温条件下,一部分原料和产物发生碳化,部分原料酮被释放出的水所裂解,烃基发生 消除或降解以及分子重排等副反应,致使产率不高。
有机人名反应——机理及合成应用

有机人名反应——机理及合成应用有机化学里,有一个有趣的领域叫做“人名反应”,听到这个名字是不是觉得有点像是某种神秘的仪式?其实,人名反应是指那些以某个人名命名的经典化学反应。
就像有人给你起个外号,化学家们也给这些反应起了名字,以纪念那些对化学有重大贡献的前辈。
今天我们就来聊聊这些反应的机理以及它们在合成中的应用,让大家对这个领域有个直观的了解。
1. 有机人名反应的机理1.1 什么是机理?简单来说,机理就是解释化学反应为什么会这样发生的故事。
就像你在看一部悬疑剧时,想知道凶手怎么作案一样,化学家们也想弄清楚反应的“幕后黑手”是什么。
机理告诉我们每一步反应过程中的分子怎么舞动,反应怎么一步步进行,就像揭开了化学反应的神秘面纱。
1.2 经典人名反应的机理我们先从最著名的几个反应说起吧,比如费林反应(FriedelCrafts反应)和迈克尔加成反应。
费林反应是由化学家费林(Friedel)和克拉夫茨(Crafts)一起开发的,它主要用来生成芳香族化合物的衍生物。
简单来说,就是把一个芳香环(比如苯)跟一个其他的基团结合起来,形成新化合物。
这就好比把你喜欢的几个菜肴混合在一起,变成一道新的美味。
迈克尔加成反应就像是个“组合拳”,它把两个分子合并,形成一个新的结构。
具体来说,它是一种加成反应,其中一个分子上的亲电中心(可以理解成化学反应中的“吸引力中心”)和另一个分子的亲核中心(“发射点”)发生反应。
这个过程有点像一个化学版的“双簧”——需要两个分子之间的默契配合,才能奏效。
2. 有机人名反应的合成应用2.1 药物合成中的应用说到应用,那可真是五花八门。
药物合成中,有机人名反应简直就是神兵利器。
比如说,某些复杂的药物分子可以通过这些反应合成出来,像阿莫西林这样的抗生素就是通过特定的反应步骤制作的。
想象一下,你要制作一款超级复杂的料理,怎么做呢?得有可靠的食谱和技巧对吧?化学家们也是如此,他们用这些反应作为合成的“食谱”,让复杂的药物分子得以顺利生成。
大学有机化学人名反应机理汇总

3.Baeyer----Villiger 反应拜耳-维立格氧化重排反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
7.Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
9.Claisen 酯缩合反应含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
常见人名反应及其机理

常见人名反应及其机理1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer-Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault-Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
有机人名反应——机理及合成应用

有机人名反应——机理及合成应用1. 引言:有机反应的魅力大家好,今天我们聊聊有机化学中的一个特别的玩意儿——有机人名反应。
听名字就有点儿高大上对吧?其实说白了,就是那些化学反应背后,有一群化学大咖的名字在闪闪发光。
别急着打哈欠,这些反应可是有着很酷的故事和广泛的应用哦!这些反应背后的机理复杂得像迷宫,但如果你愿意跟我走一遭,我们就能一起揭开这些化学秘密的面纱,了解它们如何在实验室里翻云覆雨,甚至在我们的生活中大显神威。
2. 有机人名反应的基本概念2.1 反应的定义和背景有机人名反应,其实就是那些以化学家的名字命名的反应。
这些反应都是有着超高应用价值的,有的能帮我们合成药物,有的能让我们制造新材料。
每一个反应背后都有一个动人的故事,像是你听过的那些传奇人物一样。
比如,有个叫做“DielsAlder反应”的家伙,就是由两位化学大神的名字组合而成的。
他们发明的这个反应,可以帮助我们把两种化合物“合二为一”,就像魔法一样。
2.2 机理的揭秘接下来,我们来聊聊这些反应是怎么工作的。
简单来说,机理就是反应的“操作指南”,告诉我们每一步怎么做。
比如在DielsAlder反应中,我们有两个重要的角色:一个是“内烯”,另一个是“二烯”。
这两个角色就像是一对搭档,在化学的舞台上跳起了华尔兹,它们的结合过程就像是一场精心编排的舞蹈,每一步都需要精准把握。
3. 人名反应的实际应用3.1 合成药物的魔法我们说了这么多,这些反应到底能干啥呢?让我们看看药物的合成。
药物合成中的许多步骤都离不开这些反应,比如抗生素的制造。
如果没有这些反应,我们可能还在为感冒发愁。
DielsAlder反应不但能合成药物,还能用于制造天然产物,让我们在生活中得到更多的好东西。
比如,维生素K的合成过程就涉及到这个反应,没有它,骨头可能会变得脆弱得像干枯的树枝。
3.2 新材料的创新除了药物,这些反应在新材料的制造上也大展身手。
比如,用来制造高科技的塑料、合成纤维、甚至是液晶显示屏的材料。
有机化学人名反映机理比较完整

1.Arbuzov 反映一般以为是按SN2 进行的分子内重排反映:2.Arndt-Eister 反映酰氯与重氮甲烷反映,然后在氧化银催化下与水共热取得酸。
重氮甲烷与酰氯反映第一形成重氮酮(1),(1)在氧化银催化下与水共热,取得酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反映生成酸,若与醇或氨(胺)反映,则得酯或酰胺。
3.Baeyer----Villiger 反映过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反映具有光学活性的3---苯基丁酮和过酸反映,重排产物手性碳原子的枸型维持不变,说明反映属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团都可迁移,可是仍是有必然的选择性,按迁移能力其顺序为:4.Beckmann 重排在酸作用下,肟第一发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反映取得酰胺。
迁移基团若是是手性碳原子,则在迁移前后其构型不变。
5.Bouveault---Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
6.Bucherer 反映萘酚及其衍生物在亚硫酸或亚硫酸氢盐存在下和氨进行高温反映,可得萘胺衍生物,反映是可逆的。
7.Cannizzaro 反映凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作历时,不发生醇醛缩合而起歧化反映生成与醛相当的酸(成盐)及醇的混合物。
此反映的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反映,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
醛第一和氢氧根负离子进行亲核加成取得负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
有机合成人名反应及机理

有机合成人名反应及机理
有机合成中有很多重要的反应,这些反应的机理大多数都是经过
详细论证的。
下面具体介绍几个重要的反应及其机理。
1. 化学家霍夫曼发明了非常有用的反应,叫做“霍夫曼降解反应”。
这个反应可以用来从胺中制备出烷基卤化物。
具体反应步骤是:首先将胺和次氯酸钠混合,然后将水加入混合液中,这样就可以生成
亚氯酰胺。
接下来,将氢氧化钠加入混合液中,反应会生成氯化胺和
氢氧化钠。
最后,烷基化剂加入反应混合物中,生成的产物就是烷基
化合物。
2. 另一个非常重要的有机反应称为“Suzuki–Miyaura偶联反应”,这个反应可以用来将芳香化合物和烯丙基铜或锂互相连接。
这
个反应的机理是:首先,碘化物和芳基卤化物混合,这样就可以形成
碘化芳基化合物。
然后,在其上添加烯丙基铜或锂,这样就可以连接
两种芳香化合物。
最后,加入铜催化剂来促进反应的进行。
3. 最后一个重要的反应是“Diazo反应”,这个反应可以用来制
备罕见的化合物,并且这个反应的机理也比较简单。
首先,从亚硝酸
和苯甲酸中制备出叠氮化物。
接下来,将目标化合物与叠氮化物混合,这样就可以生成新的化合物。
这个反应的一个很好的例子是,将间苯
二酚转化成二苯基二烯。
以上三个反应是有机合成中非常常见的反应,掌握这些反应及其
机理可以为有机合成研究提供非常有用的指导。
各种人名反应及其机理

1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按 S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer----Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault---Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
常见人名反应及机理

1. Aldol Condensation:羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
反应第一步为羟醛反应,第二部反应为脱水反应。
酸催化碱催化图例使用OCH3 做碱2.Baeyer –Villiger Oxidation酮在过氧化物如过氧化氢、过氧化羧酸等氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
2.Baylis –Hillman Reactionαβ-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。
催化剂一般采用DABCO(14-二氮双环222辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇1。
贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael 加成反应启动的加成-消除反应历程4. Beckmann Rearrangement是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
α-二酮、α-酮酸、α-叔烃基酮反式、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易,又斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为―异常贝克曼重排‖称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
5. Benzoin Condensation 安息香缩合反应,又称苯偶姻缩合,是一个有机反应,是氰离子催化下两分子芳香醛进行缩合生成一个偶姻分子的反应。
由于生成物是安息香(Ph-CO-CHOH-Ph)的衍生物,故名??. Birch Reduction钠和醇在液氨中将芳香环还原成14-环己二烯的有机还原反应。
Birch 还原的重要性在于:尽管剩下的双键(非芳香性)更为活泼,该反应却能停留在环己双烯上,而不继续还原。
反应中的钠也可以用锂或钾取代,使用的醇通常是甲醇或叔丁醇。
有机化学人名反应
肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例反应机理反应实例反应机理反应实例反应机理反应实例吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难。
本反应是在杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶和菲啶类化合物均能发生本反应。
二元羧酸酯的分子内酯缩合见Dieckmann 缩合反应。
反应机理反应实例烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 -碳 14C 标记的烯丙基醚进行重排,重排后 -碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是 碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3] 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3] 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3] 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
有机化学人名反应

引言概述:有机化学人名反应是有机化学领域中的重要反应,以发现或命名人物命名,旨在纪念对有机化学做出重大贡献的科学家。
本文将介绍五个涉及有机化学人名反应的重要反应,包括Sn2反应、Friedel-Crafts反应、Hofmann降解反应、Diels-Alder反应和Hofmann重排反应。
正文内容:1. Sn2反应1.1 概述:Sn2反应是一种亲核取代反应,其中一个亲核试剂攻击官能团上的消极部分,然后将其替换为新的官能团。
1.2 人名来源:Sn2反应是以科学家在有机化学领域做出开创性贡献的Edwin S. Gould命名。
1.3 反应特点:Sn2反应的反应速率与亲核试剂浓度成正比,但与底物浓度无关。
1.4 影响因素:影响Sn2反应速率的因素包括底物结构、溶剂选择和温度等。
1.5 应用领域:Sn2反应在合成有机化学中广泛应用于底物的碳-氮键或碳-氧键的形成。
2. Friedel-Crafts反应2.1 概述:Friedel-Crafts反应是一种芳香族碳-碳键形成的反应,在芳香族化合物上引入新的取代基团。
2.2 人名来源:Friedel和Crafts是两位法国化学家,他们共同发现并开发了这一重要反应。
2.3 反应类型:Friedel-Crafts反应可以分为两种类型,即芳香烃的烷基化和芳香烃的酰基化。
2.4 反应机理:Friedel-Crafts反应的机理通常涉及亲电取代和负离子取代两种机制。
2.5 应用领域:Friedel-Crafts反应在药物合成和农药合成等领域具有重要的应用价值。
3. Hofmann降解反应3.1 概述:Hofmann降解反应是一种将主要氨基酸转化为次级氨基酸的反应。
3.2 人名来源:Hofmann是德国化学家Hermann Emil Fischer 的学生,他发现并研究了这个反应。
3.3 反应过程:Hofmann降解反应涉及以次氨基酸为中间体进行进一步反应,最终生成次级氨基酸。
有机化学人名反应机理全解

人名反应1.Arbuzov反应(Michaelis-Arbuzov重排)2.Arndt-Eistert反应3.Baeyer-Villiger氧化重排4.Beckmann重排5.Birch还原6.Bischler-Napieralski合成法7.Bouveault-Blanc还原8.Bucherer反应9.Cannizzaro反应10.Chichibabin反应11.Chugaev反应12.Claisen重排13.Claisen缩合反应14.Claisen-Schmidt反应15.Clemmensen还原bes合成法17.Cope重排18.Cope消除19.Corey-House合成法20.Cristol反应21.Curtius重排22.Darzen反应23.Demjanov重排24.Dieckmann反应25.Diels-Alder反应26.Döebner-Miller合成法27.Edman降解法28.Eschweiler-Clarke反应29.Favorski重排30.Fischer吲哚合成法31.Friedel-Crafts烷基化反应32.Friedel-Crafts酰基化反应33.Fries重排34.Gabriel合成法35.Gatterman反应(1)36.Gatterman反应(2)37.Gatterman-Koch反应38.Gomberg-Bachmann反应39.Hantzsch吡啶合成法40.Hantzsch吡咯合成法41.Haworth反应42.Hell-Volhard-Zelinsky反应43.Hell-Volhard-Zelinskyα-溴化法44.Henry反应45.Hinsberg反应46.Hofmann重排(Hofmann降解)47.Hofmann烷基化48.Hofmann消除反应49.Houben-Hoesch反应50.Hunsdiecker反应51.Knoevenagel反应52.Knorr合成法53.Kochi反应54.Kolbe反应55.Kolbe-Schmidt反应56.Kucherov反应57.Leuckart反应58.Lossen重排59.Mannich反应60.McMurry反应61.Meerwein-Ponndorf-Verley还原62.Michael加成反应tkin重排64.Nazarov反应65.Oppenauer氧化66.Paal-Knorr合成法67.Perkin反应68.Pschorr反应69.Reformatsky反应70.Reimer-Tiemann反应71.Ritter反应72.Robinson增环反应73.Rosenmund还原74.Sandmeyer反应75.Schiemann反应76.Schmidt重排77.Shapiro反应78.Simmons-Smith反应79.Skraup合成法80.Smiles重排81.Stephen还原82.Stevens重排83.Strecker氨基酸合成法84.Tiffeneau-Demjanov重排85.Ullmann反应86.Vilsmeier反应87.von Richter重排88.Wacker氧化反应89.Wagner-Meerwein重排90.Williamson合成法91.1,2-Wittig重排92.Wittig反应93.Wittig-Horner反应(Emmons反应、Horner-Emmons反应、Wadsworth-Emmons反应)94.Wolff重排95.Wolff-Kisher-黄鸣龙还原96.Wurtz反应97.Wurtz-Fittig反应Arbuzov反应亚磷酸三烷基酯与卤代烷或其衍生物反应生成烷基膦酸酯和一个新的卤代烷的反应称为Arbuzov反应,也称Michaelis-Arbuzov重排。
常见人名反应及其机理

常见人名反应及其机理1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1,(1在氧化银催化下与水共热,得到酰基卡宾(2,(2发生重排得烯酮(3,(3与水反应生成酸,若与醇或氨(胺反应,则得酯或酰胺。
3.Baeyer-Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault-Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
有机化学人名反应机理

1. Beckma nn 重排* * 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:2.Birch 还原芳香化合物用碱金属〔钠"钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇:)的混合液中旺原,苯坏可被as原成非共純的匕4-坏己二烯化合反应实例取代的苯也能发生还原*并且通常得到单一的还原产物9例如;NaCH3 HaNH3(liq,XEtOH3.Ca nn izzaro 反应4•反应实例4.Chichibab in 反应杂坏碱类,与碱金属的氨基物一起加热时发生胺化反应.得到相应的氨基衍生牺如毗喘与氨基钠反应生成2-氨基毗碇,如果世位已被占据,则得片氨基毗噪,但产率很低*本法是在樂环上引入氨基的简便有敢的方法’广泛适用于各种氮杂芳环,如苯并咪毗异劇t叮喘和菲喘类化合枷均能发生本反应。
哇咻、毗嗪、曙咗、囈醴类化合物反应较为困难。
氨基化试剂除氨基钠、氨基钾外J还可以用取代的碱金属氯优物:f J + Nmc冋--------------- rl反应实例吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难本反应是在杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶和菲啶类化合物均能发生本反应5.Claise n酯缩合反应含有幻氢的酯在醇讷等碱性缩合剂作用下发生縮合作用,失去f子醇得到酸酯。
如2分子乙酸乙酯左金属钠和少量乙醇作用下发生缩含得到乙酰乙酸乙酯。
C a H5ONa2也岁0角论-------- 一GHgCOCH云0心眄75%二元羧酸酯的分子内酯缩合见Dieckma nn 缩合反应。
常见人名反应及其机理

常见人名反应及其机理1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer-Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault-Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
(完整版)经典有机人名反应

有机化学人名反应1.拜耳维利格Baeyer----Villiger 反应(p317)反应机理(不要求)过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例2.康尼查罗Cannizzaro 反应(p321)凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
具有α-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α-活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到季戊四醇:反应机理醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
反应实例3.克莱森许密特Claisen—Schmidt 反应(交叉羟醛缩合)(p314)一个无氢原子的醛与一个带有氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到不饱和醛或酮:反应机理反应实例3.Claisen 重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
有机化学人名反应机理

Friedel-Crafts烷基化反应
• 芳烃与卤代烃、醇类或烯类化合物在Lewis催 化剂(如AlCl3,FeCl3, H2SO4, H3PO4, BF3, HF 等)存在下,发生芳环的烷基化反应。
卤代烃反应的活泼性顺序为:RF > RCl > RBr > RI ; 当烃基超过3个碳原子时,反应过程中易发生 重排。
• 反应实例
Cope 重排( 科普)
• 1,5-二烯类化合物受热时发生 类似于 O-烯丙基重排为 C-烯 丙基的重排反应(Claisen 重排) 反应称为Cope重排。这个反应 30多年来引起人们的广泛注意。 1,5-二烯在150—200℃单独加 热短时间就容易发生重排,并 且产率非常好。
• Cope重排属于周环反应,它和其它周环反应的特点一样, 具有高度的立体选择性。例如:内消旋-3,4-二甲基-1,5己二烯重排后,得到的产物几乎全部是(Z, E)-2,6辛二烯:
这是一个重排反应,在合成上意义不大,但可以了解环 发生的一些重排反应。
• 反应机理
反应实例
1-氨甲基环烷醇也能发生类似的重排反应,详 见Tiffeneau-Demjanov重排。
Dieckmann 缩合反应(狄克曼)
• 反应机理:见 Claisen 酯缩合反应。
• 反应实例
Diels-Alder 反应
• 含有一个活泼的双键或叁键的化合物(亲双烯体) 与共轭二烯类化合物(双烯体)发生1,4-加成,生 成六员环状化合物:
这个反应极易进行并且反应速度快,应用范围极广泛, 是合成环状化合物的一个非常重要的方法。 带有吸电子取代基的亲双烯体和带有给电子取代基的双烯 体对反应有利。常用的亲双烯体有:
下列基团也能作为亲双烯体发生反 应:
常见人名反应及机理
Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:Birch还原反应机理Cannizzaro 反应反应机理Claisen 酯缩合含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见 Dieckmann 缩合反应。
反应机理乙酸乙酯的α-氢酸性很弱(pKa-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pKa~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
Claisen_Schmidt反应一个无a-氢原子的醛与一个带有a-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到a,b-不饱和醛或酮:反应机理Clemmensen还原醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用Wolff-Kishner-黄鸣龙反应还原。
Cope 重排1,5-二烯类化合物受热时发生类似于 O-烯丙基重排为 C-烯丙基的重排反应(Claisen重排)反应称为Cope重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 反应实例
Cope 重排( 科普)
• 1,5-二烯类化合物受热时发生 类似于 O-烯丙基重排为 C-烯 丙基的重排反应(Claisen 重排) 反应称为Cope重排。这个反应 30多年来引起人们的广泛注意。 1,5-二烯在150—200℃单独加 热短时间就容易发生重排,并 且产率非常好。
• Cope重排属于周环反应,它和其它周环反应的特点一样, 具有高度的立体选择性。例如:内消旋-3,4-二甲基-1,5己二烯重排后,得到的产物几乎全部是(Z, E)-2,6辛二烯:
交叉反应实验证明:Claisen重排是分子内的重 排。采用 g-碳 14C 标记的烯丙基醚进行重排,重 排后 g-碳原子与苯环相连,碳碳双键发生位移。 两个邻位都被取代的芳基烯丙基酚,重排后则仍 是a-碳原子与苯环相连。
• 反应机理
Claisen 重排是个协同反应,中间经过一个环状过 渡态,所以芳环上取代基的电子效应对重排无影响。
• 反应机理 • 首先是卤代烃、醇或烯烃与催化剂如三氯化铝作
用形成碳正离子:
所形成的碳正离子可能发生重排,得到较稳定的碳 正离子:
• 碳正离子作为亲电试剂进攻芳环形成中间体σ-络 合物,然后失去一个质子得到发生亲电取代产物:
反应实例
Friedel-Crafts酰基化反应
• 芳烃与酰基化试剂如酰卤、酸酐、羧酸、烯酮等 在Lewis酸(通常用无水三氯化铝)催化下发生酰基 化反应,得到芳香酮:
• 从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3] 迁移和 一次由酮式到烯醇式的互变异构;两个邻位都被取代基占 据的烯丙基芳基酚重排时先经过一次[3,3] 迁移到邻位 (Claisen 重排),由于邻位已被取代基占据,无法发生互变 异构,接着又发生一次[3,3] 迁移(Cope 重排)到对位,然 后经互变异构得到对位烯丙基酚。
• 醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为 亚甲基:
此法只适用于对酸稳定的化合物。对酸不稳定而对碱稳定 的化合物可用Wolff-Kishner-黄鸣龙反应还原。 反应机理 本反应的反应机理较复杂,目前尚不很清楚。
• 反应实例
Combes 合成法(库姆斯喹啉合成法)
在氨基的间位有强的邻、对位定位基团存在时,关环反应 容易发生;但当强邻、对位定位基团存在于氨基的对位时, 则不易发生关环反应。
• 反应机理 反应实例
Dakin 反应(达金)
• 反应机理 反应实例
Darzens 反应(达尔森)
• 反应机理
• 反应实例
Demjanov 重排(蒂芬欧–捷姆扬诺夫)
• 环烷基甲胺或环烷基胺与亚硝酸反应,生成环扩大与 环缩小的产物。如环丁基甲胺或环丁胺与亚硝酸反应, 除得到相应的醇外,还有其它包括重排的反应产物:
反应机理 Cope重排是[3,3]s-迁移反应,反应过程是经过一个环状过 渡态进行的协同反应:
• 在立体化学上,表现为经过椅式环状过渡态:
反应实例
Cope 消除反应
• 反应机理
• 反应实例
Curtius 反应(库尔提斯)
• 酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯:
异氰酸酯水解则得到胺:
本法优点是操作比较简单,反应可在较低温度下进 行,缺点是其产率一般较Sandmeyer反应低。 反应机理 见Sandmeyer反应
• 反应实例
Gattermann-Koch 反应(盖德曼科 赫)
• 芳香烃与等分子的一氧化碳及氯化氢气体在加压 和催化剂(三氯化铝及氯化亚铜)存在下反应,生 成芳香醛:
• 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如 下:
这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2 和次亚膦 酸酯 R2POR' 也能发生该类反应,例如:
• 反应机理 • 一般认为是按 SN2 进行的分子内重排反应:
• 反应实例
本反应具有很强的区域选择性,当双烯体与亲双烯体 上均有取代基时,主要生成两个取代基处于邻位或对 位的产物:
当双烯体上有给电子取代基、亲双烯体上有不饱 和基团如:
• 与烯键(或炔键)共轭时,优先生成内型(endo)加 成产物:
Elbs 反应( 埃尔布斯)
• 羰基的邻位有甲基或亚甲基的二芳基酮,加热时 发生环化脱氢作用,生成蒽的衍生物:
反应实例
Arndt-Eister反应
反应机理
• 反应实例:
Baeyer-Villiger 氧化(拜耶尔维利格)
• 反应机理
• 反应实例
Beckmann 重排(贝克曼)
• 肟在酸如硫酸、多聚磷酸 以及能产生强酸的五氯化 磷、三氯化磷、苯磺酰氯、 亚硫酰氯等作用下发生重 排,生成相应的取代酰胺, 如环己酮肟在硫酸作用下 重排生成己内酰胺:
反应机理: 在酸作用下,肟首先发生质子化,然后脱去一分子水, 同时与羟基处于反位的基团迁移到缺电子的氮原子上, 所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如
• 反应实例
Birch 还原(伯奇)
反应实例
反应机理
Birch 还原
Bischler-Napieralski 合成法(比施勒-纳皮 耶拉尔斯基)
吡啶类化合物不易进行硝化,用硝基还原法制备氨基 吡啶甚为困难。本反应是在杂环上引入氨基的简便有效 的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹 啉、吖
• 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙
基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重 排主要得到邻位产物,两个邻位均被取代基占据时, 重排得到对位产物。对位、邻位均被占满时不发生此 类重排反应。
液氨、乙二醇醚类、四氢呋喃、二甲亚砜、二甲苯等均能 作为反应的溶剂。 反应机理
• 反应实例
Favorskii 重排
• α-卤代酮在氢氧化钠水溶液中加热重排生成含相同 碳原子数的羧酸;如为环状α-卤代酮,则导致环缩 小。
如用醇钠的醇溶液,则得羧酸酯:
此法可用于合成张力较大的四员环。
• 反应机理
• 反应实例
• 反应机理 反应实例
Bouveault-Blanc还原( 鲍维特-勃朗克还 原反应)
反应实例
• 反应机理
Bucherer 反应(布赫尔反应)
反应实例
反应机理
Cannizzaro 反应(坎尼扎罗)
反应机理
• 反应实例
Chichibabin 反应(齐齐巴宾)
• 反应机理
• 反应实例
Claisen 酯缩合反应
• 反应机理
• 反应实例
Claisen-Schmidt 反(克莱森-斯密特)
一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮 在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失 水得到α,β不饱和醛或酮:
• 反应机理
反应实例
Clemmensen 还原(克莱门森)
Friedel-Crafts烷基化反应
• 芳烃与卤代烃、醇类或烯类化合物在Lewis催 化剂(如AlCl3,FeCl3, H2SO4, H3PO4, BF3, HF 等)存在下,发生芳环的烷基化反应。
卤代烃反应的活泼性顺序为:RF > RCl > RBr > RI ; 当烃基超过3个碳原子时,反应过程中易发生 重排。
由于这个反应通常是在回流温度或高达400-450 °C的温度范围内进行,不用催化剂和溶剂,直到 反应物没有水放出为止,在这样的高温条件下,一 部分原料和产物发生碳化,部分原料酮被释放出的 水所裂解,烃基发生消除或降解以及分子重排等副 反应,致使产率不高。
• 反应机理 本反应的机理尚不清楚。 • 反应实例
• 取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是 Z-构型还是E-构型,重排后的新双键的构型都是E-型,
这是因为重排反应所经过的六员环状过渡态具有稳定椅 式构象的缘故。
• 反应实例
• Claisen 重排具有普遍性,在醚类化合物中,如 果存在烯丙氧基与碳碳相连的结构,就有可能发 生Claisen 重排。
• 含有一个活泼的双键或叁键的化合物(亲双烯体) 与共轭二烯类化合物(双烯体)发生1,4-加成,生 成六员环状化合物:
这个反应极易进行并且反应速度快,应用范围极广泛, 是合成环状化合物的一个非常重要的方法。 带有吸电子取代基的亲双烯体和带有给电子取代基的双烯 体对反应有利。常用的亲双烯体有:
下列基团也能作为亲双烯体发生反 应:
• 常用的双烯体有
反应机理 这是一个协同反应,反应时,双烯体和亲双烯体彼 此靠近,互相作用,形成一个环状过渡态,然后逐 渐转化为产物分子:
• 反应是按顺式加成方式进行的,反应物原来的构型关 系仍保留在环加成产物中。例如:
正常的Diels-Alder反应主要是由双烯体的HOMO(最高已占轨 道)与亲双烯体的LUMO(最低未占轨道)发生作用。反应过程 中,电子从双烯体的HOMO“流入”亲双烯体的LUMO。也 有由双烯体的LUMO与亲双烯体的HOMO作用发生反应的。
这是制备芳香酮类最重要的方法之一,在酰基 化中不发生烃基的重排。
• 反应机理 反应实例
Fries 重排
• 酚酯在Lewis酸存在下加热,可发生酰基重排反应,生成邻羟 基和对羟基芳酮的混合物。重排可以在硝基苯、硝基甲烷 等溶剂中进行,也可以不用溶剂直接加热进行。
• 邻、对位产物的比例取决于酚酯的结构、反应条 件和催化剂等。例如,用多聚磷酸催化时主要生
有机化学人名反应机理
Arbuzov反应(艾伯佐夫反应)
• 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成 烷基膦酸二烷基酯和一个新的卤代烷:
a
卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷 外,烯丙型或炔丙型卤化物、α-卤代醚、α-或 β-卤代酸酯、对 甲苯磺酸酯等也可以进行反应。当亚磷酸三烷基酯中三个烷基 各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯 可以由醇与三氯化磷反应制得:
