手性药物的制备技术
手性制药技术

不对称合成
手性辅助剂法
特点: 与第一代方法类似 ,手性控制仍是通过底 物中的手性基团在分子内实现的。但需预先 连接手性辅助剂,反应完成后还要脱去,麻 烦。 例:降血压药 甲基多巴的合成。
不对称合成
手性辅助剂法
不对称合成
手性辅助剂法
特点: 1)与第一代及第二代方法不同 ,立体化学 的控制是通过分子间的作用进行的。 2)没有手性试剂与底物的连接,避免了 手性辅助剂与底物的连接与脱离的麻烦,而 且手性试剂能部分被回收。
诱导结晶法
优点:不需拆分剂,工艺简单,母液可套用多 次,成本低,是比较理想的大规模拆分法; 缺点:预先需要有纯的单一异构体晶体作为晶 种,而且拆分过程是间歇操作,生产周期较长。 另外得到的异构体纯度不够高。
化学拆分法
用手性试剂(拆解剂)通过化学反应的方法将 外消旋体中的两种对映体转变成非对映异构体, 然后利用非对映异构体之间的物理和化学性质的 差异将它们分开,得到单一的非对映异构体后再 转化成原来的手性化合物。 通常也叫做:非对映异构体拆分法 适用于对外消旋化合物的拆分。
诱导结晶法
将外消旋混合物加热形成热饱和溶液,向其中加 入一种纯对映体的晶种,然后冷却,此时与晶种 相同的对映体将附在晶体上不断析使 之达到饱和,然后加入另一种对映体的晶种,冷却 使另一对映体析出。交替进行,可得到大量纯对映 体的结晶。
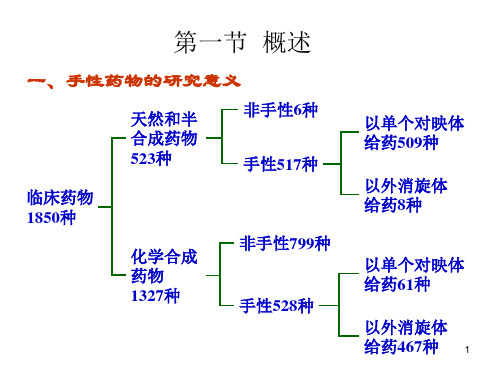
基本概念
手性化合物的标记
R,S型,苏 赤式,D,L 型 将连接手性碳的四个基团按从大到小排序,并将 最小基团放在距观察者最远的位置 (纸面后方 ), 然后观察其它三个基团的排列,如果按由大到小 顺时针方向排列则该手性碳为R 构型, 若按逆时针方向排列则为S 构型。 常用透视式和费歇尔 投影式表示。
4制药工艺学_手性药物的制备技术
pKa=3.83(25oC)
pKa=3.86(25oC)
29
特
点
结构:镜影与实物关系 内能:内能相同。 物理性质和化学性质在非手性环境中相同,在手性 环境中有区别。 旋光能力相同,旋光方向相反。 对映体的生理性质不同。
30
外消旋体
一对对映体等量混合,得到外消旋体。
外消旋体与纯对映体的物理性质 不同,旋光必然为零。
T D
cl
D-钠光源,波长为589nm T-测定温度,单位为℃ -实测的旋光度 l-样品池的长度,单位为dm c-为样品的浓度,单位为g· -1 ml
10
对映体和手性
Louis Pasteur (1822-1895.9.25)法 国微生物学家、化 学家,近代微生物 学的奠基人。1848 年得到的酒石酸盐 晶体
13
不对称碳原子
不对称碳原子: (asymmetric carbon atom) 与四个互不相同的基 团相连的碳原子叫不 对称碳原子﹡.
C*
不对称碳原子是一种手性中心, 但手性中心不一定是不对称碳原子. 有不对称碳的分子不一定是手性分子.
14
• 饱和碳原子具有四面体结构. (sp3杂化) 例: 乳酸(2-羟基丙酸CH3-CHOH-酒石酸的情况分析 HOCH2CHCHCH2OH
HO OH
COOH
(R) (S)
H H
OH OH COOH
O N O
(S)
O O NH O O N COOH COOH
惨痛的教训使人们意识到,药物必须注意它们的 构型。从此,手性药物的开发引起了人们越来越多 5 的关注。
旋光性和手性
1 旋光性 (optical activity)
手性药物制备技术

大自然给我们提供的主要手性原料包括: 碳水化合物类:D-葡萄糖、D-果糖、L-山梨酸
等 氨基酸类:L-谷氨酸、L-天冬氨酸、L-赖氨
酸等 化合物:(+)-樟脑、(+)-胡薄荷酮等 生物碱类:(-)-番木鳖碱、(-)-马钱子
碱、(-)-辛可宁碱等 有机酸类:(+)-酒石酸、(+)-乳酸等 维生素类
中国的中药虽然历史悠久,但许多化合物 都未能分离鉴定,只限于混合物,这在一 定程度上限制了我国中药的发展。中药要 发展,就要使我国古老的中药现代化,使 各种有效成分(绝大多数为手性化合物) 得到分离鉴定,否则中国的中药就会被外 国人变成了他们的西药。
二、外消旋体的拆分
(一)外消旋体的有关性质 外消旋体:等量异构体的混合物 对映体之间存在着相互作用的影响,根据这
从国产萝芙木提取利血平
将萝芙木根粉以少量水湿润,用苯回流提取, 苯提取液减压回收苯,将苯提取物按1克加8毫 升甲醇、1.5毫升醋酸及6毫升水的比例进行混 合,搅拌溶液使利血平溶解,过滤,滤液加入 硫酸氰钾于常温放置2至3天,析出利血平硫氰 酸盐结晶;滤取后以少量甲醇洗涤,干燥后按 1克加20毫升甲醇,7.5毫升5%氨水的比例于 73~75℃加热搅拌,使利血平游离,放冷后析 出粗品结晶,以少量水洗并用丙酮-甲醇混合 液重结晶精制。
02
02 11.2 服务器端生成 JSON 数据
11.2.2 jsonserver 工程主要代码
JsonServlet 的 doGet 方法调用了 doPost 方法,在 doPost 方法中,根据 HTTP 请求参数 action_flag 的不同,而调用 JsonTool 的不同实参的 createJsonString 方法,以在返回页面输出 JSON。
种影响把外消旋体分为: 外消旋体混合物 外消旋体化合物 外消旋固体溶液
手性药物的制备技术PPT课件

阿替洛尔 (ER:12)
普萘洛尔 (ER:130)
美托洛尔 (ER:270)
(二)两个异构体有完全相反的药理作用
N
HO
新型苯哌啶类镇痛药-哌西那朵 右旋异构体:阿片受体的激动剂; 左旋异构体:阿片受体的拮抗剂。
(三)一个异构体有毒或有严重的副作用
N
.HCl
NS
盐酸四咪唑:驱虫药,主要用于驱蛔虫及勾虫。 副作用:呕吐,由其右旋体产生
这时可实现连续生产,与普通的色谱操作 相比:产品质量稳定,流动相消耗小,产 品浓度高,产率提高。
但要移动固定相颗粒,操作困难,固定相 亦易破碎。
模拟移动床色谱(Simulated moving bed chromatography)
色谱柱不动,原料液入口、洗脱液入口、萃取液(含强吸附组分)和萃 余液(含弱吸附组分)出口等四个进出口位置周期性沿流动相方向依次 同时前移至下一根柱子出口,以四个进出口位置为参照物,则相当于色 谱柱(即固定相)相对于流动相后移,达到与移动床相同的效果:操作 连续,同时也克服了固定相真正移动的缺点。 街头的霓虹灯看上去是灯在移动,但实际上只是灯的颜色在变化,灯并 未移动。
手性流动相添加剂法 手性固定相法
P118~119
手性固定相(chiral stationary phase)法
Pulse Feed
Chiral Stationary Phase Mobile Phase
两对映体与手性固定相的作用强 度不同,据此得以分离两对映体。
目前已开发和应用的CSPs
1.蛋白质类键合相; 2.多糖衍生化手性固定相; 3.Pirkle刷型手性固定相; 4.环糊精手性固定相; 5.配位基交换型手性固定相; 6.手性分子烙印固定相; 手性溶质在手性固定相提供的不对称环境中,由于空间构 型不同,其与固定相的活性吸附点之间的相互作用强度存在差 异,据此实现手性溶质的分离。
第四章手性药物的制备技术

第三节利用前手性原料制备手性药物-、不对称合成的定义和发展(一)不对称合成Morrison和Mosher的将不对称合成定义为“一个反应, 底物分子中的非手性单元在反应剂作用下以不等量地生成立体异构产物的途径转化为手性单元。
也就是说不对称合成是这样一个过程,它将潜手性单元转化为手性单元,并产生不等量的立体异构产物。
”不对称合成分为对映体选择合成和非对映异构体选择合成两类。
对映体选择合成指潜手性底物在反应中有选择的生成一种对映体;非对映异构体选择性合成指手性底物在生成一个新的不对称中心时,选择性生成一种非对映异构体。
R -CH -CH 2+ R 1COOH例如潜手性烯桂和手性烯炷的环氧化反应: 由此可见:在不对称合成反应中,底物和反应剂结合 形成非对映过渡态,两个反应物中至少有一个手性中 心以便在反应位点上诱导不对称性。
通常不对称性是 在官能团点位上由三面体碳转化为四面体碳时产生的, 这些官能团包括拨基、烯胺、烯醇、亚胺或碳■碳不饱 和双键。
手蛙傕化剂■R'COjll+ RTOOH不对称合成的目标不仅是得到光学活性化合物,而且要达到高度的非对映选择性。
因此,一个成功的不对称合成反应的标准是:(1)具有高的对映体过量;;;;;;(2)手性试剂易于制备并能循环使用;:!(3)可以制备R和S两种构型的目标产物;(4)最好是催化型的合成反应。
(二)不对称合成的发展20世纪60年代以前,手性非均相催化反应是不对称合成研究的主流。
60年代后期发现了均相催化剂三苯麟氯化错(Rh(PPh3)3Cl) ,1971 年,Kagan和Dang发明了含有手性二麟DIOP的不对称催化氢化催化剂, DIOP-Rh⑴配合物催化a-(酰胺)丙烯酸及其酯的不对称催化氢化反应,生成相应的氨基酸衍生物,对映体过量高达80%,由此带来了不对称催化领域的突破性进展。
30年来,许多研究结果表明含有手性取代基的二麟类化合物在有机过渡金属催化的反应中是最有效的多功能配体,已在氢化、环氧化、环丙烷化、烯桂异构化、氢氧化和双烯加成等几十种反应中取得成功,其中DIOP、BINAP等手性二麟配体催化某些反应, 立体选择性达到或接近100%oPPh2PP%("-DKJPH3C ctiy/_\ph2p PPh? Ph* pPh2 (R) - PROPHOS ⑴ 5>CHIRAPHOSH3e{RRASKEWPHOS (凡&-CH1RAPH0S(RR)-NORPHOS(R&卜PYRPHOS(55)-8PPM水溶性手性麟配体的过渡金属配合物解决了均相催化剂不易貞原与回q攵的问题。
手性药物制备技术
-分子和-(-)-分子, 分别地形成存在稳定性差别的、 具有非对映立体异构关系的两种吸附物,其中之一被吸附 得比较牢固,而另一个比较松弛,因此在洗提得过程中, 后者比较容易通过吸附剂柱而先被洗脱,于是可以达到拆 分外消旋体的目的。
外消旋体混合物
外消旋体固体溶液
外消旋化合物
15
2.外消旋体拆分 外消旋体的拆分,又叫拆解。就是将一个外消旋体所包
含的两个对映体用适当的方法彼此分开,使成为纯净的左、 右旋体。
(1)直接结晶法 利用外消旋体具有形成聚集体的性质,直接从溶液中结晶
析出 A.自发结晶拆分:外消旋体在结晶过程中,自发形成各自的对 映体,再采用人工的方法将两个对映体分开; B.优先结晶拆分:在过饱和的外消旋体溶液中加入其中一种对 映体的晶种,使与该对映体相同的对映体从溶液中结晶出来; C.逆向结晶拆分:优先结晶法中,加入不溶物即晶种形成晶核, 加快或促进与之晶型或立体构型相同的对映异构体结晶的生长
14
(3)外消旋固体溶液 在某些情况下,当一个外消旋体中两种分子的三种结合
力相差很小时,则两种分子混合在一起成晶,形成固体溶液, 这种固体溶液叫做外消旋固体溶液。这种情况相当于溶液或熔 化状态的分布,其分子的排列是混乱的 。这种晶体与其纯态的
对映体在很多方面的性质都是相同的。例如,熔点及熔解度是 相同或相差甚微。
13
(2)外消旋化合物 当右旋体分子与左旋体分子之间比相同种类分子间具有
较大的亲合力时,构型相反的两个分子结合成对地出现在晶格 中每个位置上,只有一种晶体。这种晶态的分子化合物称为 “外消旋化合物”。外消旋化合物的大部分物理性质都不同于 其纯态的对映体,例如其熔点曲线有两种情况,高熔点分子化 合物有酒石酸,低熔点分子化合物有乳酸等。
第四章 手性药物的制备技术

39
三、 对映异构体的动力学拆分
动力学拆分的特点 过程简单,生产效率高
可以通过调整转化程度提高剩余底物的对映体 过量
40
40
三、 对映异构体的动力学拆分
4. 动态动力学拆分(dynamic kinetic resolution) 利用手性底物或手性中间体的消旋化的动态平 衡,使其中一种手性底物或手性中间体转化成另 外一种立体异构体,达到最大限度得到单一手性 化合物的目的。
28
二、 结晶法拆分非对映异构体
(4)拆分剂的手性碳原子离成盐的官能团越近越 好。 (5)合成拆分剂的优点是两种对映体都能得到。 (6)拆分剂可回收,且回收方法简单易行。 (7)同等条件下应优先考虑低分子量的拆分剂, 这是因为低分子量拆分剂的生产效率高。
29
29
S = K×t =
二、 结晶法拆分非对映异构体
手性配合物催化 Sharpless不对称环氧化法
36
36
三、 对映异构体的动力学拆分
3. 对映异构体比E与动力学拆分效率 对映异构体比E 两种对映异构体假一级反应速度 常数的比值,常用于比较和衡量动力学拆分的效 率
37
37
三、 对映异构体的动力学拆分
38
对映体过量(e.e.)与转化率的关系曲线
镜像重合
手性优择( chiral preference):天然存在的手
性化合物以对映体中的一种存在的现象
手性药物(chiral drug) :以单一异构体注册为
药物
4
4
表4-1 手性药物与外消旋药物所占市场比例
药物总数 手性药物 数量 前10种最畅销药物 前30种最畅销药物 前60种最畅销药物 8 22 39 混旋体药物 非手性药物
手性药物制备技术—化学制药工艺学36
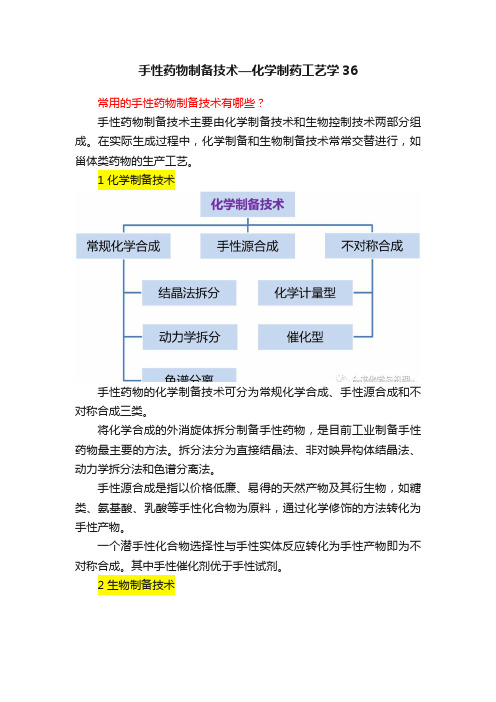
手性药物制备技术—化学制药工艺学36常用的手性药物制备技术有哪些?手性药物制备技术主要由化学制备技术和生物控制技术两部分组成。
在实际生成过程中,化学制备和生物制备技术常常交替进行,如甾体类药物的生产工艺。
1 化学制备技术手性药物的化学制备技术可分为常规化学合成、手性源合成和不对称合成三类。
将化学合成的外消旋体拆分制备手性药物,是目前工业制备手性药物最主要的方法。
拆分法分为直接结晶法、非对映异构体结晶法、动力学拆分法和色谱分离法。
手性源合成是指以价格低廉、易得的天然产物及其衍生物,如糖类、氨基酸、乳酸等手性化合物为原料,通过化学修饰的方法转化为手性产物。
一个潜手性化合物选择性与手性实体反应转化为手性产物即为不对称合成。
其中手性催化剂优于手性试剂。
2 生物制备技术天然产物提取:在动植物中存在大量手性化合物,如糖类、生物碱、氨基酸等,用分离提取方式可以直接获得手性化合物。
控制酶代谢技术:利用生物催化剂将待定底物转化为目标产物的过程,即生物催化。
固定化酶具有稳定性好、可连续操作、易于控制、易于提纯和收率高等特点,是生物催化的主要发展方向。
3 影响手性药物生产成本的主要因素影响手性药物生产成本的因素有哪些?(1)起始原料成本。
(2)拆分剂、化学或生物催化剂的成本。
(3)化学收率和产物的光学纯度。
(4)反应步骤数。
(5)拆分或不对称合成在多步合成中的位置。
在多步合成中,拆分或不对称合成要尽早进行。
为什么?越后面的中间体价格越贵、结构越复杂,越难以进行手性拆分或不对称合成。
(6)非目标立体异构体的转化利用。
非目标立体异构体的转化利用途径有哪些?构型翻转和消旋化。
手性药物制备技术PPT课件

总之,制备和生产手性化合物的工业化 方法很多,有酶催化的动力学拆分、不对称 合成、结晶技术和手性源合成等。在为某一 具体品种选择和确定合成路线时,要考虑合 成路线的可行性和经济性。由于影响手性药 物或手性化合物生产成本的因素很多,众多 影响因素中孰主孰次,没有一个普遍适用的 衡量标准;在工艺路线评价与选择时,要具 体问题具体分析,但总的原则是尽可能早地 进行拆分。
(一)、手性药物 1、手性和手性药物 手性:物体与镜像不能重叠的特征。 构型标记法:R/S标记和D/L标记 手性药物:以单一立用剂量低和疗效以 上高等特点,颇受市场欢迎,销量迅速增长。研究 与开发手性药物是当今药物化学的发展趋势,随着 合理药物设计思想的日益深入,化合物结构趋于复 杂,手性药物出现的可能性越来越大;另一方面用 单一异构体代替临床应用的混旋体药物,实现手性 转换,也是开发新药的途径之一。
17
第二节 外消旋体拆分
拆分可分为结晶法拆分、动力学拆分和色谱分 离三类。结晶拆分又分为直接结晶拆分 (direct crystallization resolution)和非对映异 构 体 拆 分 ( diastereomer crystallization resolution ) , 分 别 适 用 于 外 消 旋 混 合 物 ( conglomerate ) 和 外 消 旋 化 合 物 的 拆 分 (racemic compound)的拆分。 目前很多重 要的手性药物或它们的手性中间体是利用传统 的结晶法拆分外消旋体制得的,可以说结晶法 拆分在手性药物生产中仍将发挥重要的作用。
7
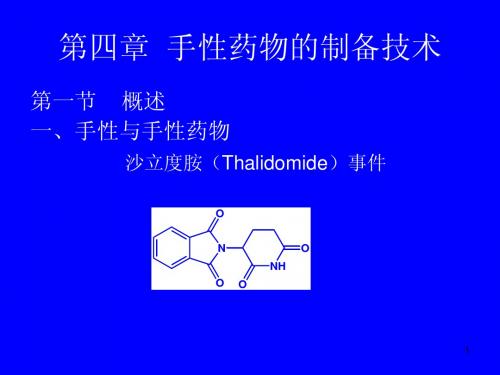
沙利度胺(反应停,Thalidomide,4-5)
8
2.手性药物的地位与发展趋势
美国食品和药品管理局(FDA)在1992 年发布手性药物指导原则,要求所有在美国 申请上市的外消旋体新药,生产商均需提供 报告说明药物中所含对映体各自的药理作用、 毒性和临床效果。如果申请上市的混旋体药 物的化学结构中含有一个手性中心,开发者 就得做三组(左旋体、右旋体和外消旋体) 药效学、毒理学和临床等试验。
《手性药物制备技术》课件

如何控制反应过程中的温度、pH值、反应时间等因素?
3 手性分离
如何有效分离左旋和右旋异构体,制备旋光性纯的手性药物?
手性分离技术
化学手性分离
利用手性反应、手性识别等方 法区分左旋和右旋异构体,分 离手性药物。
物理手性分离
利用晶态、液液萃取等方法区 分左旋和右旋异构体,分离手 性药物。
机理介绍
手性药物制备技术
手性药物是医学领域研究的热门话题,本课程将带你深入了解手性药物制备 技术。
手性药物概述
概念
手性药物是由手性分子组成 的药物,左旋和右旋异构体 在人体内的性质和作用不同。
特点
手性药物的两个异构体具有 不同的药效和副作用,需要 认真研究并纯化。
应用领域
手性药物广泛应用于治疗抑 郁症、心血管疾病等疾病, 也用于肿瘤治疗等领域。
化学手性分离和物理手性分离 的区别和原理是什么?
手性药物合成案例
手性莫西沙星制备
莫西沙星是一种广谱抗生素,制备时需纯化左旋异 构体。
手性阿莫西林制备
阿莫西林是一种常用的抗生素,制备时需纯化右旋 异构体。
未来发展趋势
新型手性合成方法
利用新型催化剂、反应条件和反应机制,发展高效、环保的手性药物制备方法。
手性药物制备方法
1
化学合成法
通过选择不同的试剂、催化剂、反应条件等,在反应过程中控制反应环境,制备 手性药物。
2
生物法
利用生物学技术,如酶工程、发酵等方法,制备手性药物。
3
分离法
通过手性分离技术,将左旋和右旋异构体分离,制备手性药物。
手性药物制备过程中的技术问题
1 反应选择性
如何实现特定的手性选择性,增大有用产物的比例?
第四章手性药物制备技术

(三)结晶法拆分非对映异构体的新技术 1、特制的拆分剂——一个发展方向 2、相互拆分—— 拆分剂的两个对映异构体均可以得到, 那么可以运用Marckwald原理,向第一次拆分后的母液 中加入拆分剂的另一个对映异构体,即可得到另一个异 构体产物。 3、用少于1当量的拆分剂进行拆分——理论上,利用形 成非对映异构体进行外消旋体的拆分时,只有其中的一 个立体异构体的结晶从溶液中析出。因此有可能利用 1/2当量的拆分剂来完成经典拆分,这种改进称为半量 方法。
第四章手性药物制备技术
由于手性药物具有副作用少、使用剂量低和疗效以 上高等特点,颇受市场欢迎,销量迅速增长。研究 与开发手性药物是当今药物化学的发展趋势,随着 合理药物设计思想的日益深入,化合物结构趋于复 杂,手性药物出现的可能性越来越大;另一方面用 单一异构体代替临床应用的混旋体药物,实现手性 转换,也是开发新药的途径之一。
第四章手性药物制备技术
3、拆分参数 一个拆分剂的拆分能力可以用拆分参数S表示,S
等于产物的化学收率K(收率50%时,K=1) 和光学纯 度t(光学纯度100%时,t=1)的乘积。因为拆分的化 学收率最大为50%,得到拆分的手性化合物光学纯度最 大为100% ,所以S最大为1。根据式4-2,S与p和n盐的 溶解度差别有关。
第四章手性药物制备技术
当最低共熔点混合物的组成接近其中一个纯组 分时,收率可达到最大理论量 (如图4-6所示)。 从 1:1混合物得到的纯P盐的最大理论收率可由式4-1计算:
第四章手性药物制备技术
就工业化的实际情况而言,通过一次结晶处理 得到光学纯度大于95%的产物,若化学收率大于 40% ,通常被认为是经济可行的拆分方法。目前存 在的主要问题是理论上尚不能预测两个非对映异构 体盐的溶解度之差,选择拆分剂的有效方法只能是 经验指导下的实践与尝试。
手性药物制备技术 05

降低血清胆固醇 作用于肝脏内源性胆 固醇,抑制调控胆固 醇生物合成的酶。 胆固醇吸收抑制剂, 抑制饮食胆固醇自小 肠的吸收。
12
辛伐他汀( Simvastatin )
HO
2002年销售额 53.25亿美元,全 球第二。
Astra公司,抗溃疡药奥美拉唑(Omeprazole) 的开发
1995年消旋体上市,商品名Losec,专利2002年到期;
销售额:美国,1999年,59亿美元;2000年, 70亿美 元; 2001年,80亿美元;2002年 ~30 亿美元;
H N MeO N O S OMe N
Astra公司开发S-异构体,通用名为esomeprazole,于
O H3C
Sepracor
公司发现药理活性只存在其S-对映体中,在 1998年1月将该异构体申请专利,并进行临床试验。
11
上市药物组合物(marketing drug combination)
将一种老药与一种较新取得专利的治疗同样疾病的、 但有着不同作用机制的药物组成复方。
Merck 公司的组合物
W C Y 不对称中心
23
X
X C Z Z
W
Y
手性中心的种类
中心手性原子除了碳之外,还有氮、磷、硫等。
O C N P +S S
常见的中心手性原子的几种形式
以氮为中心手性原子的化合物,由于氮中心上的快速 内翻转,对映体无法直接被分离,只有通过形成季铵盐、 叔胺N-氧化物等形式使孤对电子被固定,然后才能分离。
心血管类药物:阿伐他汀( Pfizer); Brist-Myers Squibb公司,新型手性药物omapatrilat (Vanlev);
手性药物的制备与分离技术研究

手性药物的制备与分离技术研究手性药物是一种药物分子中存在对映异构体的分子结构,在它们的制备和分离上,存在独特的技术难点和挑战。
手性药物不同对映异构体的药效和细胞毒性差异较大,因此在临床上应用时要对不同的对映体进行鉴定和纯化。
手性分离技术的发展至关重要,涉及着从药物开发到化学制品生产的广范围应用。
本文将主要讨论手性药物的制备和分离技术的研究进展,以期能够更好地掌握这些技术的基本原理和实际应用。
一、手性药物制备技术手性药物的制备技术主要有基于对映体分离的方法和对映体识别反应的方法两种。
其中基于对映体分离的方法包括手性合成和分子印迹技术。
手性合成是一种基于已知对映体的建模和合成目标对映体的化学合成方法,对映体分离的难点在于具有相同分子式、相同化学性质,但分子结构不同的对映异构体间的分离。
而手性合成则是根据对映异构体的物理和化学性质的差异性来进行不同对映异构体的合成,从而达到对不同对映异构体分离纯化的目的。
这种方法的优点在于可以实现对目标对映体的纯度和产量高,同时也可以通过不同反应路径来优化药效和安全性。
分子印迹技术是一种根据药物分子和其靶标分子间的亲和性来获取目标对映体的方法。
它通过合成分子印迹聚合物来选择性绑定目标对映体,并在循环流动的系统中帮助对缺失对映体进行识别和追踪。
但是,这种方法使用场景相对较少,需要进行很多前期实验和参数的调整,其精确度和分离效率仍有待提高。
二、手性药物分离技术手性药物的分离技术是一种基于物理性质的分离方法。
其中最常用的是液相色谱法和毛细管电泳法。
液相色谱法是一种基于物质在不同的化学性质下通过不同吸附剂和固定相间的分离方法,可以对手性药物进行不同程度的分离,可以获得较高纯度的对映异构体。
毛细管电泳法是一种利用毛细管对带电药物分子的分离和聚积,也可以用于对手性药物进分离。
这种方法的优点在于对样品的耗费和多种离子传输的选择性,同时又具有扩展性和优化性。
但毛细管电泳法需要一些特别的样品制备和流量控制技术来获得最好的结果,并且也不适用于大规模药物生产的情况下。
手性药物的制备和分离技术

手性药物的制备和分离技术手性药物是指由手性分子构成的药物。
手性分子是指在空间构型上存在镜像对称的分子,即左旋和右旋异构体。
由于手性异构体之间的药物作用差异较大,因此,研究手性药物的制备和分离技术对于药物研发和生产至关重要。
一、手性药物的制备手性药物的制备分为对映选择性合成和手性分离两种方式。
对映选择性合成是指在化学反应过程中,通过调节反应条件,控制反应产物的手性形态,从而选取特定的对映异构体。
手性分离是指将手性混合物中的对映异构体分离出来。
对映选择性合成方法包括:1. 手性诱导剂合成法该方法是利用手性诱导剂将非手性反应物的手性信息“传递”到产物中,控制产物的手性。
目前广泛应用的手性诱导剂有葡萄糖、天然蛋白质等。
2. 催化剂合成法该方法是利用手性催化剂,使催化反应产生手性产物。
手性催化剂包括非对称合成、核磁共振催化等。
手性分离方法包括:1. 液相色谱法液相色谱法是通过改变手性固定相的化学性质或物理性质,控制手性药物在柱子中的分配行为。
常用的手性固定相有环糊精、聚乙烯亚胺等。
2. 粉末衍射分析法粉末衍射分析法是利用衍射图案分辨出手性分子的对映异构体,对于具有晶体结构的手性分子比较有效。
二、手性药物的分离和纯化手性药物的分离和纯化主要涉及手性液体-液体萃取、手性气相色谱和手性无机杂化材料等技术。
这些技术的实现原理基本上是通过利用手性相互作用,将手性分子与其它化合物区分开来。
手性液体-液体萃取法:手性药物在酸性或碱性条件下会形成盐,通过萃取可以实现手性药物的分离。
手性气相色谱法:利用手性固定相的化学性质实现手性药物分离纯化。
手性无机杂化材料:无机杂化材料具有良好的表面静电相互作用,可以用于分离手性药物。
总之,手性药物的制备和分离技术对于药物研发和生产具有重要的意义。
随着手性药物市场前景的不断扩大,手性药物的制备和分离技术也逐渐得到了广泛的应用。
手性药物的制备技术

手性药物的制备技术
第25页
手性药物的制备技术
第26页
手性药物的制备技术
第27页
六、手性药品与生物活性之间关系 1、手性药品与受体
手性药物的制备技术
第28页
2、手性药品与生物活性之间关系
手性药物的制备技术
第29页
β受体拮抗剂
均以外消旋体给药
阿替洛尔 (ER:12)
普萘洛尔 (ER:130)
,结晶分离出两个非对映体盐后,分别水解回收再利用樟脑磺酸,
与此同时分别得到苯甘氨酸两个对映体,其中(L)-苯甘氨酸外消旋化
后再行拆分。
手性药物的制备技术
p第1541页 1
手性药物的制备技术
第55页
手性药物的制备技术
第56页
三、色谱拆分法
手性药物的制备技术
第57页
色谱拆分法
气相色谱法 液相色谱法
龟兔赛跑思想应用于色谱分离即为移动床 :吸附剂(或称固定相)从上往下移动, 而流动相从下向上移动。从而强保留组分 随固定相逐步下移,而弱保留组分则随流 动相逐步上移。
这时可实现连续生产,与普通色谱操作相 比:产品质量稳定,流动相消耗小,产品 浓度高,产率提升。
但要移动固定相颗粒,操作困难,固定相 亦易破碎。
手性药物的制备技术
第4页
❖ 我国药品管理法也已经明确要求,对手性药品必须 研究光学活性纯净异构体药代、药效和毒理学性质 ,择优进行临床研究和同意上市。只停留在消旋体 药品研究与开发水平上,已不符合国际与国内药品 法规要求。
❖ 近数十年来发觉了许多特异性催化剂,使不对称有 机合成蓬勃发展,能选择性地导向一个对映体产生 ;另外,伴随当代分析技术进步,手性分离方法也 不停涌现,技术上使供给单一手性药品成为可能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
长率20%以上 。全球最畅销的500种药物,手性药物
占一半以上,占销售总额的52%.
P96~98
2500
2000 单一对映体药物的制备技术迅
2000
速发展,已成为药物开发中的
1500
一个热点!
1472 1330
亿美元
1000 500
964 730 830 200 300 400 480
0 1991 1992 1993 1994 1996 1997 1998 2000 2001 2008
P106
具有一定光学纯度的立体异构体的纯化
分离精制其它方法得到的具有一定ee值的混合物。即两种对 映体的含量不等。
T
T
S M M’
R
外消旋化合物
SM
R
外消旋混合物
对外消旋混合物,总是可以结晶得到两个对映体。
对外消旋化合物,则对起始组成有要求。当两个对映体组成在深红 色线区域内时,无法纯化,因为在当组成处于该区域时,不同构型 的分子间作用力将大于同种构型分子间的作用力,结晶只能得到等 量共存的外消旋体。而在蓝色线区域时,因同种构型的分子间作用
(R)-Enantiomer (Crystal)
只对具有最低熔点和最大的溶解度的外消旋混合物有效。 有两种操作方法。
同时结晶法
有择结晶法
P106
同时结晶法(Simulataneous Crystallization)
Solution of racemate
(R)-Enantiomer (Crystal)
(S)-Enantiomer (Crystal)
(R)-Enantiomer (Crystal)
(S)-Enantiomer (Crystal)
将外消旋混合物的过饱和溶液依次通入含有不同对映体晶种 的两个结晶室,同时得到两种对映体结晶。剩余溶液再与新 进入系统的外消旋混合物混合,加热形成过饱和溶液。
n盐
p盐
溶解度差异变大
结晶
(d)-A-(l)-B (l)-A-(l)B 离解
(l)-B (d)-A (l)-B (l)-A
P108~112
苯甘氨酸 (+)-樟脑磺酸
(D,L)-PG
+
(+)-CAS
(D)-PG-(+)-CAS 非对映体盐 (L)-PG-(+)-CAS
OH-
OH-
(+)-CAS
(D)-PG
影响手性药物Me生O 产成本的主Me要O 因素 NCHO
5. 拆分或不1对00%称合成在多步合71%成中位置
两条路线的
NCHO
NMe 反应步骤和
MeO 拆分或不对称合成尽可能早地进行。以提高 收率均相同。
Rout原e A料、92%溶剂和反应溶剂的利用率。4此4%外,随 但路线B更合
着反应进行,中间体结构逐Me渐O 复杂,非目标 适,生产效
(+)/阿片受体激动剂,镇痛剂 (-)/阿片受体拮抗作用
(R)/5-HT3受体拮抗剂,抗精神病 (S)/L-钙通道阻滞剂 (-)/利尿 (R)/β-受体激动作用
(S)/5-HT3受体激动剂 (R)/L-钙通道活化剂 (+)/抗利尿 (S)/β-受体拮抗作用
手性药物的生物活性类型
3.一种对映体具有药理活性,另一种弱或无活性
因为不同构型的分子间作用力小于同种构型分子间的作用力, 外消旋混合物的外消旋体的熔点最低,溶解度最大。
熔点增加,意味着分子间作用力增加,溶解度降低,容易结 晶析出。故只有外消旋混合物才能直接利用结晶法拆分。
直接结晶法拆分外消旋体混合物
Solution of (RS,oSlu)-teinonanotfiomer(75g) (CS)r-yesntaanl otifo(mRe)r-(50g) (eRn)a-nentiaonmtieorm(2e5rg()50g)
碳四面体学说
COOH H OH
CH3
..
C
N
COOH HO H
CH3
..
..
P
S
O
与手性相关的术语:
D/L:参照D-或L-甘油醛的绝对构型确定的分子的绝对构型
d/l:右旋或左旋,根据化合物将平面偏振光的平面旋转的方向 确定
R/S: 左或右,根据三个取代基的CIP优先顺序和取代基的排列 顺序确定
对映体(Enantiomers):分子互相为不可重叠的实物和镜像关系 的立体异构体
H
Me
H
+
HN H
H
OH
O X
OH OH
V
(R)-(-)-肾上腺素与受体作用 1)静电引力; 2)氢键作用; 3)螯合作用。
H
Me
OH
+
HNH
H
H
O
OH OH
V
X
(S)-(-)-肾上腺素与受体作用
可能因为氢键作用强度降 低,表现出弱的生物活性。
L-多巴的作用机理
HO
HO
H2N H 多巴脱羧酶
HO
药物
治疗作用的对映O体
毒副作用的对映体
羟基哌嗪 氯胺酮 乙胺丁醇
(S)-体,镇咳
N*
(S)-体,安眠镇痛
(S,S)-体,抗结核O O
(RO)-体,嗜睡
N H
(R)-体,术后幻觉
(R,R)-体,可导致失明
沙利度胺
米安色林 (S)-体,抗抑郁
(R)-体,细胞毒性
又称反应停,曾作为有效的镇痛药和止吐药为许多孕妇
对映体* 的NH外.HB消r 旋化反应随着困难。
率比路线A提
右美沙芬
高一倍:生 NMe.HBr 产相同质量
MeO
H
的产品所需
Route B 44%
71%
的原料、溶
MeO
剂和反应器
NH.HBr
NCHO
尺寸均比路
H 92%
H 100%
NCHO H
线A少一半。
MeO
MeO
影响手性药物生产成本的主要因素
(6) 非目标对映体的转化利用(p104)
1) 拆分剂化学性质稳定,不发生外消旋化; 2) 氢键作用有利于拆分; 3) 强碱或强酸型拆分剂更有利; 4) 拆分剂的手性碳原子离成盐的官能团越近越好; 5) 拆分剂回收利用方便 6)小分子量的拆分剂生产效率更高
(L)-PG
(+)-CAS
racemization
(D,L)-苯甘氨酸两个对映体分别与(+)-樟脑磺酸形成两个非对映体盐,
结晶分离出两个非对映体盐后,分别水解回收再利用樟脑磺酸,与
此同时分别得到苯甘氨酸的两个对映体,其中(L)-苯甘氨酸外消旋化
后再行拆分。
p111
拆分剂
天然拆分剂 合成拆分剂:光学纯的中间体
(S)- / (R)- 38
手性药物的生物活性类型
4. 两种对映体具有不同的药理活性 药物可作用于不同的靶器官、组织而呈现不同的作用模式。 在临床用于不同目的。
Me
(2R, 3S)-丙氧芬
N
镇痛药 Me
Me
*
O
*
O
(2S, 3R)-丙氧芬
Me
镇咳药
手性药物的生物活性类型
5. 一种对映体具有药理活性,另一种对映体具有毒性作用
对映体过量(enantiomeric excess,e.e):光学纯度的一种表征
外消旋(racemic)
e.e.
外消旋体(racemate)
S S
enantiomer enantiomer
R R
enantiomer enantiomer
100
%
外消旋化(racemization)
外消旋化合物
不同构型分子间作用力大于同种构型分 子间作用力。结晶时,一个晶核内两种 异构体等量共存。
SR
外消旋混合物
不同构型分子间作用力小于同种构型分
子间作用力。结晶时,一个晶核内只含
有一种异构体。
S
R
P105
T
T
R/S 外消旋化合物
R/S 外消旋混合物
因为不同构型的分子间作用力大于同种构型分子间的作用力, 外消旋化合物的外消旋体的熔点最高,溶解度最小。
4.反应步骤的数量尽可能少
Kinetic resolution
(R,S)-RX +H2O
(S)-RX + (R)-ROH
外消旋的
racemization
Байду номын сангаас
手性醇
卤代烃
Kinetic resolution
(R,S)-RX +H2O
(R)-ROH + (S)-RX
racemization
(R)-RX (S)-ROH
COOH
HO
NH2
帕金森氏病药物L-多巴经过多巴脱酸酶催化形成无手性因 素的活性成分--多巴胺,多巴胺可透过血脑屏障进入作用 部位。而D-多巴不能被多巴脱酸酶催化,无法发挥治疗 效用,不能被人体代谢。
手性药物的生物活性类型
1.两种对映体的作用相同 药物作用为手性中心,但不涉及活性中心,属于静态手性类药物。
力大于不同构型的分子间作用力,故结晶可得到某种纯的对映体。 P107
非对映体结晶法
(dl)-A + (l)-B
(d)-A-(l)-B +
(l)-A-(l)-B
外消旋酸与光学纯的碱; 外消旋碱与光学纯的酸
形成非对映体盐,物理 化学性质差异增大,可 方便分离得到两种盐, 然后解离脱掉拆分剂 (即光学纯的碱或酸)。
内消旋体没有对映异构体,拆分主要针对外消旋体。所 谓拆分是指将两个对映异构体的混合物分离开来。因对 映异构体除旋光性不同外,其它物理性质很接近。难以 用常规方法分离,分离难度很大。
