银 铜对玻璃的着色
钸对玻璃的藕色在含钸的玻璃中

钸对玻璃的藕色在含钸的玻璃中,Ce。
+的含量要比Ce:+离子的数量高2一d倍。
Ce 七+的存在会使玻璃在可见区着色,因为Ce“在光谱的紫色区产生吸收。
在强氧化条件卞熔炼的玻璃中和碱含量较低或铅含量较高的玻璃中,当铈的含量高时,吸收带能够靠近于波长550nm的区段。
在此以下的可见光谱区内,铈的数量不影响光的透过率。
通过还原可降低Ce”的含量,而含有396左右氧化铈的玻璃几乎是无色的。
图2—'0组成为6SiOaPbO.Nato(56.8弗(重量)SiOa,34.6笫PbO,9.8笫NaaO)加2弗CeOz在氧化条件下熔炼的玻璃(1)和组成为6Si02·CaO.NaaO(75.3笫(重量)SiOz,11.7笫CaO,13笫Na,O)加2苏CeOa和2弗As:㈠。
电在氧化条件下熔炼的玻璃(2)的光谱透过率。
试样厚度为2mm。
铈的特性是在光谱的紫外区有强烈的吸收。
而对于波长在红外区的吸收,即使当着色剂的浓度很高时也是微乎其微的。
铈对玻璃的着色在可见光谱区比较弱。
对于钙—钠—硅罐6璃玻说来,只有当炉料中CeO,的含量达5—10%时,才皇现黄色或浅黄褐色着色。
如果熔炼过程在强氧化条件下进行,那么即使CeO2的含量相当低也要出现可见的着色.例如铅玻璃,CeO,的含量低于1%都要着色。
含少量铈的玻璃通常是无色的或者被着成较弱的浅黄色,当在垂直入射光(含有紫外线)之下进行观察时,会发现浅蓝色的暗淡的色调,这是由Cea+离子的强化荧光而引起的。
同时含有铈和少量砷的玻璃在阳光作用下具有明显的褐色色调.这种现象叫做辐照变暗,在有关玻璃脱色的章节中将要叙述它。
无其它加入物时,CeO,很少作为着色剂使用,例如制造吸收紫外线的玻璃就是如此。
常常是把它与其它着色剂(首先是TiO。
)结合起来使用.二氧化铈是比较弱的着色剂,但是添加两倍量的TiOt可大大加强黄色色泽。
铈对玻璃中铁的化合物能产生强氧化作用,因此常用它来脱色,但首要条件是玻璃中不含砷。
光致变色玻璃

Mn、W、Mo等的氧化物,制成的玻璃经过热处理或用
紫外线辐照后,玻璃就会具有光色性能。
17
因为热处理(或紫外线辐照)后,在玻璃中形成了着色中
心。 着色中心在77K温度下均为稳定的,而在>60℃时则全部 是非稳定的。 着色中心形成之后,使得玻璃在可见光波段的光敏性增 加,产生了附加吸收。 例如,用一价铜离子作为添加剂加入玻璃配合料中,得 到卤化铜光色玻璃。 这种玻璃未经热处理时,在紫外、可见光波段均为透明的; 热处理后,透明度显著下降,并出现乳光,且吸收限向长
激活辐射去除,色心破坏即褪色,激活-破坏(变暗-复 明)往复循环而不疲劳。
3
光色玻璃的分类
光色玻璃变色的特性是由其含有的亚稳态色心而产生的。在一定 波长的激活辐射作用下,玻璃生成色心即产生着色;当激活辐射 去除后,色心破坏又使玻璃褪色,主要包括同相(均相)型光色 玻璃和异相型光色玻璃。 同相(均相)型光色玻璃:色心与基质玻璃是同相的。主要是掺 加可变价的Ce、Eu等元素,这些元素在紫外光照射下产生4f~5d 的电子跃迁,形成能吸收蓝紫色光波的亚稳态色心,在强光照射 下,玻璃由浅黄色变深黄褐色,在弱光照射时,Ce3+、Eu3+色心 恢复到原来的电子态,玻璃恢复到高透明状态。 异相型光色玻璃:色心是与基质玻璃不同的光敏晶相物质,其中 最适宜的光敏材料是卤化银、卤化铜、卤化镉晶体,其中卤化银 光色玻璃的光致变色效果最好。
透过率/%
57℃ 48℃ 38℃ 30℃ 22℃ 褪色过程
暗化在光照后微秒间就开 始,随着照射光亮的增加
而变深。
褪色反应与扩散有关,温
0 5 10 15 0
度越高褪色越快。
5 10 15 20 25 30 时间/min
光色玻璃的暗化褪色过程
玻璃 青铜着色 工艺

玻璃青铜着色工艺
玻璃青铜着色工艺是一种在玻璃制品上添加青铜色的工艺。
这种工艺可以通过不同的方法实现,包括在玻璃制品表面涂覆青铜色的材料或者在玻璃制品的制作过程中直接将青铜材料融入玻璃中。
以下是从多个角度对这种工艺的回答:
1. 工艺原理,玻璃青铜着色工艺的原理是利用特定的化学物质或金属元素使玻璃呈现出青铜色。
这些化学物质或金属元素可以通过涂覆、喷涂或者熔入玻璃中的方式实现。
2. 工艺应用,玻璃青铜着色工艺广泛应用于玻璃制品的装饰和艺术制作中,例如玻璃花瓶、灯具、餐具等。
这种工艺赋予玻璃制品独特的艺术效果,增加了其观赏价值。
3. 工艺方法,实现玻璃青铜着色的方法包括化学着色和金属着色两种主要方式。
化学着色是通过在玻璃表面涂覆特定化学物质并在高温下烧结使其呈现青铜色,而金属着色则是在玻璃熔化的过程中将含有青铜成分的金属氧化物加入,使玻璃获得青铜色。
4. 工艺特点,玻璃青铜着色工艺赋予玻璃制品独特的古典、高
雅的外观,增加了其装饰性和艺术性。
青铜色的玻璃制品在光线的照射下呈现出迷人的色泽,具有一定的透光性和质感。
总的来说,玻璃青铜着色工艺是一种在玻璃制品上赋予青铜色的工艺,通过特定的化学物质或金属元素使玻璃呈现出独特的艺术效果,广泛应用于玻璃制品的装饰和艺术制作中。
着色玻璃——精选推荐

着色玻璃2001年第1期中国玻璃善色玻璃玻璃着色剂的种类很多,太部分是过渡元素离子.许多着色剂产生与盐和溶液颜色相同的色彩,其它颜色可以通过胶体形成得到,其中有一,二种被视为克分子溶液.在所有场合,重要的是要了解玻璃的组成及诸如氧化还原状态等其它一些因素或其它着色剂对由一种着色剂产生的颜色会有多大的影响.氧化铁着色铁对玻璃的着色格外引入注目,一是其使用广泛,二是它为化学氧化还原现象及玻璃组成的影响提供了一个范例.氧化铁(FeO)和三氧化二铁(Fe~O3)各自通过位于被4,5或6个氧离子环绕的部位中的Fe和Fe”隔离离子进行着色的.Fe’会产生一个约为lOOOnm的固定吸收带,它不仅吸收红外线,而且吸收红色光和黄色光.含有呈亚铁态铁的玻璃具蓝色.可以说,这样的玻璃是一种”还原玻璃”,因为制诹这样的玻璃要使用一种象焦炭或有机物质这样的还原剂(电子给予体).F3’在约为38Ohm的渡带中吸收很少,从而导致产生一种淡黄色.在无特殊添加荆制备的玻璃中有’/一/,的铁呈亚铁态,由此产生淡绿色,根据原料的纯度,这种颜色会有深浅变化.我们的先辈,根据经验发现某些组分如山毛榉能大大缓解着色性.这是一种氧化锰载体,Mn(h通过下述氧化还原”反应将二价铁转变为三价铁: M++4Fe+甘Mn’+4F这种方向明显向右的平衡反应表明:M离子没有Fe”离子稳定,换言之,其电子亲和力更强.这种”化学脱色”技术在过去广为使用.有时在古老的窗户上可以看到谈紫色的窗玻璃,这是因在原始玻璃中使用锰, 随后玻璃长年累月地暴露在太阳的紫外辐射下(暴晒现象),Mn’氧化为Mn”态造成的.长期以来,使用氧化砷,氧化锑或氧化铈各自的”氧化还原偶”As”/AP,Sb”/Sb3或Ce”/Ce”进行化学脱色来制取”特白”的杯和瓶.在所有场合,出现的少量的铁几乎全部呈Fe”态,它可能使特厚玻璃产生一种黄色.为使之避免,少量加进两种经合适计量的着色剂氧化钴(蓝色)和氧化硒(玫红色)],从而在总体上形成一种互补色.这种颜色的补偿叫做”物理脱色”.变价离子着色还有其它一些离子着色剂,其化合价和吸收带髓玻璃的氧化还原状态变化.表1中, 用于着色和脱色的氧化还原偶以对氧化类电子亲和力的降序排列,换言之,按还原类电子稳定性的降序排列,或按氧化类电子稳定性的升序排列.氧化态§还原态(2550,370nm)黄色cr6§Cr3绿色中国玻璃2001年第1期(6.4,450am和5.9,950rma)(4,490nm)紫色MnMn淡黄色(0.04,430nm)(700,240rim)(紫外)Ce”Ce(紫外)(100.314rma)黄一粟色V”,r3绿色(3,780nm)蓝色Cu2§Cu无色无色As”As”无色无色Ssb”无色(1.3,380nm)黄色Fe”Fe蓝色(9.1,1050rim)无色Sn”Sn”无色括号内数据表示在吸收带最大值下(Bamford数据)由1%(重量)氧化物导致的lem厚玻璃的光密度和波长.光密度:一logl0(传递能量的分数).该谱系具有重要的实用结果6首先,它是脱色本身的基础:高偶的存在促进了低偶的氧化态.该原理同样适用于着色.例如,经验表明,加人微量的铬和MnO:较易从Mn”中获得一种紫色.同样,低偶的存在有助于高偶的还原态.例如,要获得cI’,就需使用氧化铁含量较低的原料.该谱系的第二个结果是,不能将由一种氧化类导致的颜色和一种由低序列的还原类导致的颜色混合.因此.不能期待用产生的蓝色来增强Cu产生的蓝色.不变价离子着色有两种大家熟悉的其作用与氧化状态无关的离子着色剂:钴和镍.在所有由简单离子在可见光谱中产生的吸收带中,co2产生的吸收带最为强烈(47.7,59Ohm).因此,通常用其来制造蓝玻.N在钠钙玻璃中产生的茶色同样较强(14.8,45Ohm).其特点是对碱离子的类型特别敏感.用钾代替钠,可转换为紫色,而用锂代替则产生黄色.这些颜色的变换与Ni离子的配位数变化有关:环绕有6个氧离子,K则环绕有4个氧离子.在co场合,要产生相同的配位数变化,需用无碱硼酸盐玻璃来代替钠钙玻璃,这时Cd的配位数将为6,颜色则呈玫红色.稀土金属着色至此为止,所有着色都产生自跃迁的金属离子.然而,同样还存在能对玻璃着色的稀土金属离子.钕(Nd”),镨(P一)和铒(E)分别产生蓝一紫色,绿色和玫红色.所有吸收带具有三个特征:窄带,很少受玻璃组成影响,强度较低(Nd导致的光密度仅为c0光密度的l/50).使用稀土金属作为着色剂的主要缺点是其吸收率低,成本高.化合物或离子配位化合物着色在窗玻璃,甚至在浇注玻璃,包装玻璃中,最古老的一种着色是琥珀色.无疑,在经过一段很长的时阃才明白琥珀色必须在硫和铁同时存在的情况下才能形成.因为这两种元素作为添加荆或杂质总是在玻璃中存在. 因此.只要简单地向玻璃混合料中引人任何还原剂(煤,金属,有机物质)就能获得这种颜色.一旦关联性建立,就可对硫化物(硫的还原形式)的主要作用作出评估.令人惊异的是实验表明,铁的活性类是Fe(在还原性玻璃中仅呈很小的浓度)而不是F.从而推出了一个由3个氧离子和1个s离子进行四面体配位的Fe”组成的生色团.颜色有可能产生于含有这两种离子的配位化合物,但同样有可能Fe的作用是氧化s2一和形成可能是生色团的”过硫化物”s2离子:2S2一+3Fe~oS2+3Fe在所有场台.琥珀色是由通过平衡反应2001年第1期中国玻璃41生成的化合物造成的概念与大家熟悉的其特征之一完全吻合:即:快速冷却(钢化)的琥珀色玻璃比相同的退火玻璃颜色要浅.因此可以认为,温度降低时,平衡右移,而这是在同样降低的速度下进行的.与缓慢冷却相比,快速冷却将平衡”冻结”在更靠左侧.在建筑平板玻璃和某些汽车玻璃中看到的茶色是添加硒获得的,其色彩同样取决于含铁量,与氧化还原状态也少有关系.因此可以认为茶色是用硒代替硫的相似琥珀色.但Schreiber提出,这种场合的生色团是一种聚硒化物Se.z一,是用Fe还原se产生的:2Fb+xSe苗Sex一+2Fx是聚硒化物链中的原子数.此外,还存在另一种”硫一三价铁”相似琥珀色.这种琥珀色稍星桔黄色,是用钼代替铁获得的.鉴于其成本高昂,收益性也就不明显了.还有一些组合有两种不同阳离子的离子着色配位化合物.例如用铈和钛化合物可制取非常有效的抗紫外玻璃.但这种玻璃带有轻微的黄色.用铁和钛可以获得与传统琥珀色相似的强烈着色.此外,还有产生青绿色的铈一铜配位化合物和产生粟色的铈一铅配位化台物.克分子和胶体溶液着色前面涉及的物理脱色中,提到用硒进行玫红着色.事实上,往低铁含量但非还原性的玻璃(特白玻璃的情况)中加人元素硒可在钠钙玻璃中获得一种玫红色.确切地讲玫红一桔黄色.这种颜色用于制杯业,以及用于制镜的浮法玻璃上.前面谈到了玫红色,淡紫色,紫红色,没有谈到红色和宝石红.所有可见光谱(红色端除外)中的吸收类型是由一种金属或一种半导体微粒子的胶态悬浮产生的.被吸收的能的极限值,亦即颜色,根据目前业已成熟的理论,取决于粒子的尺寸和传导率.幸好我们的祖先没有等待,他们首先发现了铜红(罗马彩绘玻璃时代).金红的发现则是更近的事了,它是1680年左右,两个炼金术士工作的成果.一个叫Cassius,他从氯化金和氯化锡中获得一种紫红色,提出将其混合在玻璃中.第二个叫KunckeI,他通过加人两种金属的化舍物获得了宝石红,同时又术得不加人还原物质保证锡以Sn:态存在.这两种红宝石玻璃的一个特性是在600~C左右时开始显色,也就是说,成形后在使用金的场合,还原和沉淀反应可写成下式:Au¨+Sn¨—fAu.)n+SIl4这样在不使用锔的情况下就能获得一种铜红,但有sn存在更为有益,因此通常都采用(其作用可通过下述事实表示:只要将浮法玻璃的锡面与铜盐甚至气态铜盐接触,就能看到宝石红显色).不过,对导致铜红的粒子是否是金属铜还不能确定,它可能是一种低氧化物cu扣.通过半导体(硒化镉)粒子的胶质沉淀可获得一种发亮的无色彩差异的红色.同祥,采用硫化镉会产生一种黄色.这两种颜色是借助于金属锌形成的.金属锌在这里起着保证硫或硒以s2一或Se一形式出现的还原剂,可以写为:nCd+nSe+nZn-*(CdSe)n+nZn在红宝石玻璃中,显色更为容易.看来,zl1”对离子s一和Sen的活性度同样起着缓冲作用c事实上,已经知道zn2对s’有亲合性,下述事实也揭示了这一点,即传统的琥珀色比古有百分之几ZnO的玻璃中的颜色要浅得多).黑色玻璃黑色玻璃是一种简单通过着色剂组合的不透明玻璃,其吸收带位于整个可见光谱范42中国玻璃2001年第1期围p壬例如使用铬—锰或钴—镍—铬系着色剂.同样可以制取完全不透明的Fe_.s”琥珀色玻璃.乳白色玻璃在某些杯,瓶甚至有时在平板玻璃中看到的乳色通常是氧化钙和氧化钠微晶体沉淀而成的.为使玻璃中引人大约5%的氟化物. 往钠钙玻璃混合料中加入萤石,一旦组成改变,在成形冷却过程中就会产生沉淀.过滤功能玻璃不改变玻璃的透射光谱只是为了获得同样具有功能目的的颜色,上面提到了在镜片中加入钕和在车灯中加入硫化辐(其防眩作用仍值得怀疑).通常,追求的是对紫外或近红外辐射进行或多或少的吸收.长期以来,镜片和包装玻璃业已开发出用不吸收可见光的ce4和Ce3来对紫外光线进行强劲的吸收现在问题是要将其用于汽车玻璃中,至少在专年I】上已经谈及.通常,一种可以采纳的广泛用作肪紫外保护工具的着色是由Fe—s琥珀生色团提供的着色.实际上只有Fe2才能吸收红外辐射,此类离子在lO00nm左右吸收非常有效.但超出红外,对可见光谱的吸收导致产生一种蓝色.问题的关键是要最大限度地吸收太阳辐射的能量并保证有”足够.的可见光透射.就建筑玻璃而言,建筑师可对这种自然光的级别进行选择.但对汽车玻璃则需要调整.在这两种场合,一旦玻璃的透明度得以确定. “选择性”则取决于Fe”/Fe”的比.就这一观点讲,向玻璃混合料中引入一种还原剂来提高该比,制取蓝色而不是绿色的玻璃是有益的.然而,不能使这种还原过度,其理由是:第一,超过约为0.5%的FeO/(Fe20,4- FeO)比,玻璃渡中存在的硫酸盐将还原为硫态,在玻璃中产生我们所看到的琥珀色;第二,硫酸盐的损耗减慢了氧化硅的溶解,并使传统浮法熔窑的熔化制度紊乱.在滤热功能方面,如在放映机里为保护膜片免受灯热的影响.使用磷酸盐玻璃来解决这个问题.实际上,这种环境的变换使吸收光谱向低频移动,遗憾的是这种方法不能搬迁到汽车和建筑玻璃上来.陈金生译自法国(j瘦璃)2000年第3期(上接34页)产,需要更换的调节闸板则可从容地换下,而不需要闸下安全闸板截断玻璃液.从而避免了严重影响浮法玻璃生产厂的产量而造成较大的经济损失.5.主要技术参数调节闸板的调节范围:以流槽底平面为设计基准,调节闸板可上调600ram,下调50mm.升降速度分为两档:快速:1.2mm/s,慢速0.6ram/s6.结束语本设备通过针对性的改进设计以后.取得了良好的使用效果.已成功用于洛阳一线和浙玻二线.。
玻璃的成分

各种“玻璃”的成分(1)普通玻璃(Na2SiO3、CaSiO3、SiO2或Na2O•CaO•6SiO2)(2)石英玻璃(以纯净的石英为主要原料制成的玻璃,成分仅为SiO2)(3)钢化玻璃(与普通玻璃成分相同)(4)钾玻璃(K2O、CaO、SiO2)(5)硼酸盐玻璃(SiO2、B2O3)(6)有色玻璃在(普通玻璃制造过程中加入一些金属氧化物。
Cu2O——红色;CuO——蓝绿色;CdO——浅黄色;CO2O3——蓝色;Ni2O3——墨绿色;MnO2——紫色;胶体A u——红色;胶体Ag——黄色)(7)变色玻璃(用稀土元素的氧化物作为着色剂的高级有色玻璃)(8)光学玻璃(在普通的硼硅酸盐玻璃原料中加入少量对光敏感的物质,如AgCl、AgBr 等,再加入极少量的敏化剂,如CuO等,使玻璃对光线变得更加敏感)(9)彩虹玻璃(在普通玻璃原料中加入大量氟化物、少量的敏化剂和溴化物制成)(10)防护玻璃(在普通玻璃制造过程加入适当辅助料,使其具有防止强光、强热或辐射线透过而保护人身安全的功能。
如灰色——重铬酸盐,氧化铁吸收紫外线和部分可见光;蓝绿色——氧化镍、氧化亚铁吸收红外线和部分可见光;铅玻璃——氧化铅吸收X射线和r射线;暗蓝色——重铬酸盐、氧化亚铁、氧化铁吸收紫外线、红外线和大部分可见光;加入氧化镉和氧化硼吸收中子流。
(11)微晶玻璃(又叫结晶玻璃或玻璃陶瓷,是在普通玻璃中加入金、银、铜等晶核制成,代替不锈钢和宝石,作雷达罩和导弹头等)。
(12)玻璃纤维(由熔融玻璃拉成或吹成的直径为几微米至几千微米的纤维,成分与玻璃相同)(13)玻璃丝(即长玻璃纤维)(14)玻璃钢(由环氧树脂与玻璃纤维复合而得到的强度类似钢材的增强塑料。
)(15)玻璃纸(用粘胶溶液制成的透明的纤维素薄膜)(16)水玻璃(Na2SiO3)的水溶液,因与普通玻璃中部分成分相同而得名)(17)金属玻璃(玻璃态金属,一般由熔融的金属迅速冷却而制得)(18)萤石(氟石)(无色透明的CaF2,用作光学仪器中的棱镜和透光镜)(19)有机玻璃(聚甲基丙烯酸甲酯)注:(14)——(19)为类玻璃。
银镜反应和铜镜反应

化教论学生实验报告册课题:《银镜反应和铜镜反应》姓名:王思氩学号:10111550105日期:2013年11月29日《银镜反应和铜镜反应》一、实验的三维目标二、课程及实验分析:三、银镜反应过程:1 .在洁净的试管中加入2ml硝酸银溶液现象:硝酸银装在棕色试剂瓶中,为无色液体2. 向试管中滴加1-2滴氢氧化钠溶液现象:滴入后立即产生棕灰色沉淀。
3. 在不断振荡下滴加稀氨水至沉淀刚好溶解为止现象:沉淀量增多并且变为灰色,继续滴加沉淀逐渐消失,约加入5mL后,溶液完全澄清透明,无沉淀4. 向澄清溶液中加入1-2mL葡萄糖溶液现象:葡萄糖溶液为无色,加入后溶液无明显变化5.将试管置于70摄氏度的水中水浴现象:加热后立即产生在上部液面管壁处产生银白色、有金属光泽的附着物。
试管中下部先由澄清液变为黑色,持续加热至1min20s时,试管壁上完全附着光亮平滑的银白色物质:银镜。
取出试管,试管内部的液体变为灰黑色浑浊液。
四、铜镜反应过程:1 .用肥皂洗净手,涌去污粉将培养皿擦洗干净,再把洗涤剂放在小烧杯中加水溶剂,加热至80摄氏度,将它倒入培养皿中,静置冷至室温,倾去后分别用水和蒸馏水全面淋洗,备用现象:无明显现象。
2.将20mL氯化亚锡溶液倒入培养皿中,静置5分钟后倾去,用蒸馏水小心淋洗,现象:氯化亚锡溶液为无色透明溶液,整个静置过程无明显现象。
3. 在50mL烧杯中加入2滴5%的硝酸银和1滴氢氧化钠溶液,加入15mL蒸馏水,现象:硝酸银溶液为无色,加入氢氧化钠后立即产生棕色颗粒式沉淀,逐滴加入0.5mol/L的氨水至沉淀刚好溶解,现象:棕色颗粒逐渐溶解,最后溶液变为无色澄清加入15毫升蒸馏水,搅拌后再加入3mL3%的葡萄糖溶液,现象:加入葡萄糖后,溶液的颜色略显微黄色。
混合后立即倒入培养皿,静置5min,用蒸馏水小心淋洗再甩干。
现象:倒入后立即产生棕色细颗粒装漂浮物,静止后,棕色加深。
甩干后,蒸发皿内壁上有一层淡淡的浅黄色。
镜框与镜架材质的介绍

镜框与镜架材质的介绍镜架结构:由镜圈,鼻梁,鼻托,桩头和镜脚等主要部分构成.镜圈:以沟槽及螺丝固定镜片鼻梁:连接左右镜圈或直接与镜片固定连接..鼻托:接触鼻部的衬垫,支持并稳定镜架,使之不滑动.包括托叶,托叶梗和托叶箱.桩头:镜圈与镜脚的连接处.镜脚:通过桩头连接于两镜圈或镜片的颞侧.一、镜架材质的介绍:特点:制作镜框的材质要求易加工但不易变形,重量轻,有一定的坚韧度,坚固耐用,对皮肤无刺激,不易对皮肤等酸性分泌物所侵蚀等。
主要包括塑料材质、金属材质、龟壳材质。
(一)塑料与合成材料(非金属材料):1、热塑性塑料(热软化),此材料可发复加热、再成形,镜架需用此材料,以便调整镜架及镜腿,以适合配戴,者的脸型。
A、硝酸纤维素:特点:易燃、易褪色、质硬、不易弯曲、不刺激皮肤、不受皮肤分泌物侵蚀。
现已基本不采用.B、醋酸纤维素:特点:易加工、易抛光、可燃性较硝酸纤维素低,易受酮高浓度酸碱侵蚀。
2、热固性塑料(热硬化),此材料一旦成形便不能再成形,故不宜单独制作眼镜。
如丙烯树脂(俗称有机玻璃)特点:质硬而脆、透明、质量轻、性质稳定、不易老化、不易变形。
3、混合塑料:因其具有热固性材料的稳定性,又具有热塑性材料的可塑性,所以也可以作为制作眼镜的材料,如环氧树脂。
(二)金属材料:1、金:因其太软及价格昂贵,现在多不用纯金制作镜架。
在镜架中使用的金包括合金、包金、镀金三种类型:A、合金(也称开金):指纯金与其它金属制成的合金,开金是合金中纯金对其它金属的比例,以开数表示(即以黄金的1/24的倍数表示)如12K、18K。
B、包金(又称加金、滚金):指在金属外面包一层金,厚约10~50 m,包金的品质是所用开金的比例及该开金的开数两项数字表示,如1/10、12K表示镜架所用开金是12K,所用开金占镜架重量的1/10。
包金和开金的镜架坚固耐用、美观,具有金材料的所有特点,如耐腐蚀,对皮肤无刺激、价格低廉等。
小于0.3微米为镀金,大于0.3微米为包金.C 镀金:指在其它金属材料制成的镜架上镀金,以改善外观,并具有金耐腐蚀的特点。
会变色的玻璃——卤化银光致变色玻璃

会变色的玻璃——卤化银光致变色玻璃作者:苏同王明召来源:《中国教育技术装备》2010年第33期摘要本文为高中化学阅读材料,介绍卤化银光致变色玻璃的变色原理以及制作流程,供一线教师选用。
关键词卤化银;光致变色玻璃;变色原理中图分类号:G633.8 文献标识码:B 文章编号:1671-489X(2010)33-0032-02Color Changeable Glasses: Photochromic Glasses Sensitized by Silver Halides//Su Tong, Wang MingzhaoAbstract The photochromic mechanism in reversibility of the color change and producing process of photochromic silicate glasses sensitized by silver halides,is introduced for high school teachers.Key words silver halides; photochromic glasses; photochromic mechanismAuthor’s address Institute of Chemistry,Beijing Normal University,Beijing, China 100875玻璃大家都很熟悉。
现在有一种能够自动“识别”光线强弱进而改变颜色的墨镜,它的镜片颜色在阳光下会自动变深,而当进到室内或阳光不是那么刺眼的时候,镜片又会褪为接近无色。
这种墨镜的镜片用到一种特殊的玻璃——卤化银光致变色玻璃,简称卤化银光色玻璃。
1 光色玻璃为什么能变色其实,早在1962年W. H. Armistead和S. D. Stookey[1]在美国就制出第一块光色玻璃,所用光敏材料是卤化银。
铜-银-金在釉料及微晶玻璃(包括玻璃)中的作用与影响

铜\银\金在釉料及微晶玻璃(包括玻璃)中的作用与影响摘要:本文主要阐述了铜、银、金的基本物理、化学性质,以及主要的存在形式,如氧化铜、硝酸银、氯化金。
并研究了氧化铜、硝酸银、氯化金在釉料及微晶玻璃中的呈色作用以及氧化铜对釉料及微晶玻璃主要性能的影响。
结果表明:氧化铜具有降低熔化温度和降低粘度的双重作用,可被用作釉料的呈色剂;同时会增大釉料及微晶玻璃的热膨胀系数;降低釉料及微晶玻璃的机械强度;但对釉料及微晶玻璃耐化学腐蚀性的影响不具备大的正面意义;玻璃表面结构中的铜离子具有抗菌功能,这种抗菌作用仅次于ag+离子。
关键词:氧化铜;硝酸银;氯化金;釉料;微晶玻璃1 基本物理、化学性质铜、银、金同属于铜分族的过渡元素。
它们的核最外电子构型分别为:3d104s1、4d105s1、5d106s1。
由于d电子层的屏蔽效应较弱,致使它们的有效核电荷大于同周期的碱金属元素和碱土金属元素,最终也使铜分族元素的电离能大于同周期的碱金属和碱土金属元素。
因此,铜分族元素的化学性质远不如碱金属、碱土金属活泼,是属于化学性质比较惰性的元素。
然而,受d电子轨道的影响,铜分族形成络合物的能力较强。
铜分族元素具有突出的导电热和导热性,也具有较高的熔点和优异的延展性。
因此,铜分族元素是很重要的工业材料,特别是铜。
一般来说,铜不仅容易失去4s1电子,而且3d电子轨道中的一个电子也可参与化学键。
因此,cu2+离子的稳定性高于cu+离子。
cu+离子的配位数优先选择4,cu2+离子的配位数优先选择6。
由铜分族各元素的电极电位和电离势可知,以铜的化学活泼性较高,银其次,金最次。
铜在常温下和在干燥的空气中较稳定,而在潮湿的空气中会缓慢地锈蚀成铜绿(即碱式碳酸铜),如:铜在常温下可与卤素元素直接化合,加热时则反应加快。
在加热条件下,铜与氧、硫也可以发生反应。
但是,与碳、氮即使在高温下也不会发生反应。
铜溶于硝酸将放出no2或no,溶于浓硫酸将放出so2。
6-玻璃的着色与脱色
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
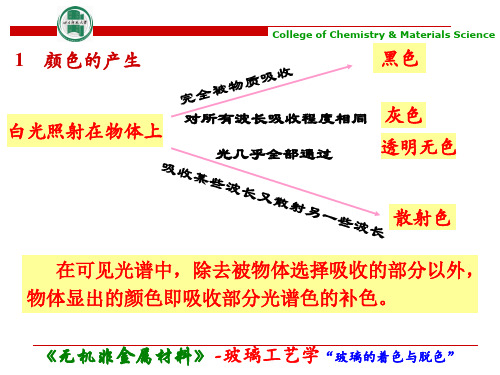
3 原因 玻璃对光的吸收是由于原子中的电子在接受光照 射后由较低的能级(E1)跃迁到较高的能级(E2)。 当E2-E1=可见光的能量时,就呈颜色。能量差 愈小、吸收光的波长愈长,呈现的颜色愈深。 颜色还同时采用亮度(透射或反射光的强度),是 颜色在“量”方面的特征。色调(是色玻璃透过的透 光中最显著的波长),是颜色质方面的特征。饱和度 (主波长在与白光混合中所占的百分数)。色调和饱 和度称为“色品” 。
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
配位数间的平衡
即与周围氧离子的配位数有关
[Fe3+O6] (淡红色) [Fe3+O4] (黄褐色) [Co2+O6] (粉红色) 着色离子浓度 [Co2+O4] (青色]
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
6.4.3 硫碳着色
1 硫碳在玻璃中的着色(掌握) “硫碳”着色玻璃,颜色棕而透红,色 似琥珀,广泛用于瓶罐玻璃和器皿玻璃。 碳的作用:还原剂作用,并不参加着色
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
09 玻璃的着色和脱色

稀土金属(或镧系)是属于内过渡元素。由于它们的4 f 轨道的电子是部分填充的, 容易产生 f - f 跃迁而引起光吸收,使玻璃着色。其中La 和Lu 分别具有0和14个4 f 电
3+ 3+
子( f 0, f
14
),是无色的。具有4 f 轨道为7个电子的Gd ( f 7),由于半充满,特别
3+
稳定,难以激发,也是无色的。此外,具有 f
波长/μm 图 9-6 含Fe2+玻璃的透光曲线
透过率/%
透过率/%
波长/μm 波长/μm 图 9-7 含Fe2+玻璃的透光曲线 图 9-9 含Cu2+玻璃的透光曲线
透过率/%
透过率/%
波长/μm 图 9-8 含Fe2+玻璃的透光曲线
波长/μm 图 9-10 含Cu2+玻璃的透光曲线
153
ห้องสมุดไป่ตู้
9.2.3 稀土金属离子着色
2
6
154
颜色玻璃的光谱特性不仅随离子的种类而异, 而且在很大程度上决定于离子的价态。 同 3+ 2+ 6+ 3+ 3+ 2+ 种元素的离子,其价态不同时光谱特性也不同。例如,Fe 与Fe ,Cr 与Cr ,Mn 与Mn 等,虽分别属于同一元素,但由于价态不同,它们的光谱特性各异。 过渡金属离子都是可变价的,在玻璃中也是如此。离子的变价实质上是氧化还原问题。 对某一变价离子来说, 一定的氧化还原状态必定存在着不同价态之间的平衡关系。 影响离子 对玻璃来说主要有: 玻璃的基础成分、 不同离子间的相互作用、 的氧化还原状态的因素很多, 熔制工艺以及热处理和光照等。 (1)玻璃的基础成分 玻璃的基础成分直接影响离子的价态。 玻璃的酸碱性对离子的氧化还原状态有重要的作 用。实践证明,一般在酸性玻璃中(即含 SiO 2 、B 2 O 3 或P 2 O 5 高的玻璃)离子有利于向低 价和高配位转变, 而在碱性玻璃中, 则有利于转向高价和低配位。 因为碱性玻璃游离氧较多, 酸性玻璃游离氧较少,故前者易使玻璃保持高价,而后者则有利于低价。例如,锰离子在铅 3+ 3+ 玻璃(高碱玻璃 )中以Mn 存在,使玻璃呈紫色,而在硼硅酸盐玻璃中Mn 离子比例相应 减少,玻璃的紫色大为减弱。又如钴和镍在磷酸盐玻璃中以 [NiO 6 ] 和 [CoO 6 ] 存在,而 在铅玻璃中则以[NiO 4 ] 及[CoO 4 ]形态存在。含钴的钠硅酸盐玻璃中含有[CoO 4 ]基团,玻 璃呈蓝色;而在B 2 O 3 玻璃中存在[CoO 6 ]基团,玻璃呈玫瑰色。硼硅酸盐玻璃中两者同时存 在,因而呈紫红色。 玻璃中 R 2 O(或RO)含量越大,游离氧越多,越有利于着色离子保持高价状态。当碱 含量(摩尔百分数)相同,随着碱金属(或碱土金属)离子半径的增大, R—O 键力减弱, 3+ 给出游离氧的能力增强,有利于着色离子保持高价状态。因此钾玻璃比钠玻璃更有利于Mn 的存在。 必须指出,玻璃的酸碱性,只是相对而言,一般是根据玻璃中酸性氧化物和碱性氧化 物含量的多少,大致估计哪些玻璃偏于酸性,哪些玻璃偏于碱性,其间并无严格的界线。 (2)不同变价离子间的影响 氧化还原是相对的, 因此在不同的变价离子相互间也有氧化还原作用。 由于不同离子的 氧化还原能力不同, 彼此间必然发生氧化还原反应。 根据它们氧化能力的大小可按下列顺序 排列: Cr6+>Mn3+>Ce4+>V5+>Cu2+>As5+>Sb5+>Fe3+>Sn4+ 氧化能力大的氧化物能氧化氧化能力小的氧化物,同时它本身被还原。例如Sb 2 O 5 对于 FeO 来说是氧化剂,但对于 CrO 3 来说却是还原剂,其余类推。因此,在玻璃的实际熔制过 程中,由于受温度和变价氧化物浓度等因素的影响,情况要复杂得多。 (3)熔制工艺因素的影响 玻璃在熔制过程中,变价离子的高低价态之间存在着动态平衡关系,如: Cr6+ (黄绿色)+3 e Mn3+(紫色)+ e Cu2+(蓝色)+ e Cr3+(绿色) Mn2+ (无色或弱黄色) Cu+(无色)
玻璃着色方法

熔制玻璃时加入少量玻璃着色剂,可制得各种有色玻璃。
氧化铜(Ⅱ)或氧化铬(Ⅲ)产生绿色;氧化钴(Ⅱ)产生蓝色;二氧化锰产生紫色;二氧化锡或氟化钙产生乳白色;铀化合物产生黄绿荧光;胶态硒产生红玉色;胶态金产生红、红紫或蓝色;氧化亚铜产生红、绿或蓝色;亚铁化合物产生绿色,量多时为黑色;铁(Ⅲ)化合物产生黄色。
制玻璃时,由于原料中含有亚铁的杂质,常使玻璃带绿色,可加入少量二氧化锰或硒,使之变成无色玻璃。
玻璃的丝网印刷玻璃丝网印刷,就是利用丝网印版,使用玻璃釉料,在玻璃制品上进行装饰性印刷。
玻璃釉料也称玻璃油墨、玻璃印料,它是由着色料、连结料混合搅拌而成的糊状印料。
着色料由无机颜料、低熔点助熔剂(铅玻璃粉)组成;连结料在玻璃丝印行业中俗称为利板油。
印刷后的玻璃制品,要放火炉中,以520~600℃的温度进行烧制,印刷到玻璃表面上的釉料才能固结在玻璃上,形成绚丽多彩的装饰图案。
如果将丝印与其它加工方法并用的话,会得到更理想的效果。
例如利用抛光、雕刻、腐蚀等方法在印刷前或印刷后对玻璃表面进行加工处理,能够加倍地提高印刷效果。
1.玻璃制品蚀刻丝印长期以来,玻璃制品的蚀刻装饰,是在玻璃表层热涂蜡层及其它增固材料,作为抗蚀层,然后再在涂层上用针、小刀等刻出图案纹样,露出玻璃表面,然后在此部位上着氟氢酸进行腐蚀。
此工艺延续至今还有厂家应用,但其加工方法费时、费力、效率低下。
丝印蚀刻工艺,使玻璃制品的蚀刻装饰变得简便、省时、省力。
玻璃的蚀刻丝印,有热印及冷印两种方法。
热塑性蚀刻丝印,是将石蜡、沥青、硬脂酸等所配制的粘合剂,加入少量的抗蚀粉调制成抗蚀印料,通过热印丝网版,按设计图样,把印料刮印至玻璃表面,形成抗蚀膜的。
抗蚀膜上露出玻璃的部分,即是需要蚀刻的图案。
蚀刻采用氯氟酸进行,蚀刻后要用开水冲洗掉印在玻璃上的抗蚀层。
玻璃丝印蚀刻,也可以采用冷印方法进行。
抗蚀印料可使用特制的沥青漆加抗蚀粉,也可购买市售的抗依油墨。
印刷完成后,待抗蚀膜完全干燥,便可进行氢氟酸腐蚀了。
银镜反应和铜镜反应

银镜反应和铜镜反应一、实验目的:1.生成光亮银(铜)镜的实验条件。
2.掌握相关的实验操作方法。
二、实验原理:银镜:银氨溶液具有弱氧化性,含有醛基的物质具有还原性,在碱性条件下水浴加热可以发生反应:RCHO+2Ag(NH3)2OH→RCOONH4+2Ag↓+3NH3+H2O,还原生成的银镜附在试管壁上,形成银镜。
铜镜:由硫酸铜与氢氧化钠反应,生成氢氧化铜,再加入酒石酸钾钠,配制成“斐林试剂”。
这时,再加入甲醛,即有红色单质铜沉淀产生(甲醛具有还原性),就会在培养皿上形成光亮的铜镜。
三、实验用品:试管、试管夹、酒精灯、培养皿、石棉网、10%氢氧化钠溶液、0.5M氨水、浓氨水、5%硝酸银溶液、6M盐酸、3%葡萄糖溶液、37%甲醛溶液、甲酸钠溶液、酒石酸钾钠溶液、银氨溶液(现配)、10%氯化亚锡溶液。
四、实验内容:五、实验注意事项:1.试管要洁净。
否则,只得到黑色疏松的银沉淀,没有银镜产生或产生的银镜不光亮。
2.溶液混合后,振荡要充分。
加入最后一种溶液时,振荡要快,否则会出现黑斑或产生银镜不均匀。
3.加入的氨水要适量。
氨水的浓度不能太大,滴加氨水的速度一定要缓慢,否则氨水容易过量。
氨水过量会降低试剂的灵敏度,且容易生成爆炸性物质。
4.加碱可使甲醛与银氨溶液在常温下发生反应,但如果滴加氢氧化钠过量,反应速率太快,产生的银镜会发黑。
5.银氨溶液只能临时配制,不能久置。
如果久置会析出氮化银、亚氨基化银等爆炸性沉淀物。
这些沉淀物即使用玻璃棒摩擦也会分解而发生猛烈爆炸。
所以,实验完毕应立即将试管内的废液倾去,用稀硝酸溶解管壁上的银镜,然后用水将试管冲洗干净。
6.氨水的浓度不宜过大,否则容易过量,致使实验失败。
7.制作铜镜时,培养皿一定要洗干净,不能留有杂质,否则造出的铜镜质量不好。
六、实验探究:在课堂教学中,用传统方法做银镜反应实验由于该反应需要水浴装置并控温,装置复杂,占用空间较大,所用时间长,实验成功率较低,不宜达到便捷的课堂演示实验目的。
铜银金在釉料及微晶玻璃(包括玻璃)中的作用与影响

铜\银\金在釉料及微晶玻璃(包括玻璃)中的作用与影响作者:戴长禄杨勇杨明来源:《佛山陶瓷》2011年第10期摘要:本文主要阐述了铜、银、金的基本物理、化学性质,以及主要的存在形式,如氧化铜、硝酸银、氯化金。
并研究了氧化铜、硝酸银、氯化金在釉料及微晶玻璃中的呈色作用以及氧化铜对釉料及微晶玻璃主要性能的影响。
结果表明:氧化铜具有降低熔化温度和降低粘度的双重作用,可被用作釉料的呈色剂;同时会增大釉料及微晶玻璃的热膨胀系数;降低釉料及微晶玻璃的机械强度;但对釉料及微晶玻璃耐化学腐蚀性的影响不具备大的正面意义;玻璃表面结构中的铜离子具有抗菌功能,这种抗菌作用仅次于Ag+离子。
关键词:氧化铜;硝酸银;氯化金;釉料;微晶玻璃1 基本物理、化学性质铜、银、金同属于铜分族的过渡元素。
它们的核最外电子构型分别为:3d104s1、4d105s1、5d106s1。
由于d电子层的屏蔽效应较弱,致使它们的有效核电荷大于同周期的碱金属元素和碱土金属元素,最终也使铜分族元素的电离能大于同周期的碱金属和碱土金属元素。
因此,铜分族元素的化学性质远不如碱金属、碱土金属活泼,是属于化学性质比较惰性的元素。
然而,受d电子轨道的影响,铜分族形成络合物的能力较强。
铜分族元素具有突出的导电热和导热性,也具有较高的熔点和优异的延展性。
因此,铜分族元素是很重要的工业材料,特别是铜。
一般来说,铜不仅容易失去4s1电子,而且3d电子轨道中的一个电子也可参与化学键。
因此,Cu2+离子的稳定性高于Cu+离子。
Cu+离子的配位数优先选择4,Cu2+离子的配位数优先选择6。
由铜分族各元素的电极电位和电离势可知,以铜的化学活泼性较高,银其次,金最次。
铜在常温下和在干燥的空气中较稳定,而在潮湿的空气中会缓慢地锈蚀成铜绿(即碱式碳酸铜),如:铜在常温下可与卤素元素直接化合,加热时则反应加快。
在加热条件下,铜与氧、硫也可以发生反应。
但是,与碳、氮即使在高温下也不会发生反应。
银 铜对玻的着色

银对玻璃的着色(图2—22。
1)在玻璃工业中,可用银来获得各种颜色效果。
方法如下,1)在适当大小的Ag粒子分散相的作用下,对玻璃质体着色,2)表面着色,即所谓银的媒染剂,这一迩程的基础是,银离子在玻璃表面内渗透(扩散),因而与碱离子进行交换,然后银离子还原成原子,银原子又聚集成胶体粒子。
3)由于炽热的还原气体对含Ag玻璃的作用,或者由于预先涂在玻璃表面上的松酯酸银被还原性焙烧,因而在玻璃表面上能生成虹彩的银釉药。
玻璃中银的胶体粒子对光的吸收,主要由粒子的大小和数量来决定,该情况指的是类似于琥珀色或铈黄色的黄色着色,在这种条件下,尺寸在30nm以下的细小Ag粒子会引起浅绿色调(浅柠檬黄色),随着银粒子的生长将过渡到橙色色调的区域。
胶体银在430和450nm之间有一透过极小值,而且与玻璃其它黄色的区别是在紫外区有相当高的光透过率。
图2—22(1)添加0.2形AgN08着色的钙—钠—硅酸盐玻璃和(2)添加1.2笫CuIO熔炼的铜红宝石的光谱透过率。
试样厚度为2皿血。
银是强着色剂,每100公斤砂子添加20—100克AgNO。
(溶液)能得到黄色色调。
它在玻璃中的溶解度取决于玻璃的成分,溶解度相当低正是溶液在高温下能够长时间保持的条件。
在玻璃中添加0.5%的SnO:可加速溶解过程。
每100公斤砂子大约使用1公斤AgNO。
时,可熔制出发乳光的玻璃,其中银粒子起了乳浊剂的作用。
熔炼含银的玻璃时,银在熔体中或者以一价离子存在,或者以原子的形式存在,后一种情况在紫外线照射下玻璃中会出现强烈的荧光。
采用还原熔炼条件和提高温度的结果,将使平衡向银原子的方向移动,这对于未来的颜色具有重大的意义。
基质玻璃成分对银的溶解也有影响。
用这种化学元素着色时,最适宜的玻璃是铅玻璃,而且引入S。
就能达到还原的目的。
当然,也可以使用在适度还原条件下熔炼的无铅玻璃,然而,使用钠玻璃时会得到较黄的色调,而使用钾玻璃时则得到橙黄色调。
通常,熔炼出的玻璃是无色的,由银粒子生长所决定的橙黄色,将由于附加热处理(显色)而发展。
玻璃的着色和脱色

80 60 40 20
0.44
0.68 1.0 2.0
波长/µm
含Fe2+玻璃的透光曲线
较稳定,跃迁需较高能量,通常不产生选择性吸收, 故无色、不吸收紫外线。
第九章 玻璃的着色和脱色
(2)18及18+2电子构型
极化率大,易变形,有变价,吸收紫外线。本身无色,易被 还原为金属态。与阴离子结合可有色。 Cu+、Zn2+、Ga3+、Ge4+、As5+、 As3+、Ag+、Cd2+、In3+、 Sn4+、Sb5+、Au+、Hg2+、Tl3+、Pb4+、 Pb2+、Bi5+、Bi3+
(4)色饱和度(纯度P) 主波长在消色混合中所占的比例。
(2)(3)(4)是用于区别彩色的。
2. X-Y颜色图
第九章 玻璃的着色和脱色
3. 着色玻璃的分类 (1)光吸收型着色玻璃
离子着色 高能辐射着色
(2)光散射型着色玻璃 金属胶体粒子着色
(3)半导体着色玻璃 硫化物、硒化物着色
第九章 玻璃的着色和脱色
1. 单质着色
硒在中性条件下成淡紫红色,氧化条件紫色更美,氧 化过分无色(硒酸盐)。还原条件会生成无色碱硒化物和 棕色硒化铁。
硫只在硼很高的玻璃中存在(蓝色),不实用。
第九章 玻璃的着色和脱色
2. 硫-碳着色
(1) 着色机理 Fe3+为中心原子,被三个氧离子(O2-)和一个硫离子(S2-)包围, 成四面体结构。
80 60 40 20
400 500
700 波长/nm
含Cu2+玻璃的透光曲线
银镜反应和铜镜反应

银镜反应和铜镜反应2012年12月6号银镜反应和铜镜反应一、实验目的1.研究生成金属银镜和铜镜的条件。
2.掌握相关的实验操作。
二、实验原理(1) 银氨溶液的配制:AgNO3+NaOH =AgOH↓+NH4NO3AgOH+ 2NH3?H2O= [Ag(NH3)2]OH+2H2O(2)银镜反应:银氨溶液具有弱氧化性,含有醛基的物质具有还原性,在碱性条件下加热可发生反应R C HO+2Ag(NH3)2]++2OH-→CO32-+2Ag↓+NH4++3NH3↑+H2O.还原生成的银镜附在试管壁上,形成光亮的银镜。
甲酸钠溶液与银氨溶液反应:HCOO-+2[Ag(NH3)2]++2OH-→CO32-+2Ag↓+NH4++3NH3↑+H2O.甲醛溶液与银氨溶液反应:HCHO + 4[Ag(NH3)2]OH ---> 4Ag↓ + 6NH3↑ + (NH4)2CO3 + 2H2O葡萄糖溶液与银氨溶液反应:CH2OH(CHOH)4CHO+2Ag(NH3)2OH→H2O+2Ag↓+3NH3↑+CH2OH(CHOH)4COONH4(3)铜镜反应:由硫酸铜与氢氧化钠反应,生成氢氧化铜,再加入酒石酸钾钠。
配置成“斐林试剂”这时,加入甲醛,既有红色单质铜沉淀产生(甲醛具有还原性),在培养皿表面形成光亮的铜镜。
CH2OH(CHOH)4CHO +Cu(OH)2→C H2OH(CHOH)4COOH+ Cu↓+H2O其中加入酒石酸钾钠,可与铜离子络合,起到了稳定铜离子的作用。
三、实验用品试管、试管夹、酒精灯、培养皿、石棉网、烧杯、铁架台10%氢氧化钠溶液、5%硝酸银溶液、0.5M氨水、浓氨水、7%硫酸铜溶液、6M盐酸、3%葡萄糖溶液、37%甲醛溶液、甲酸钠溶液、酒石酸钾钠溶液、银氨溶液、10%氯化亚锡溶液洗涤剂、蒸馏水四、实验步骤四、结果及讨论1、银镜反应:①酒石酸钾钠溶液和甲酸钠溶液②甲醛溶液③甲酸钠溶液④葡萄糖溶液进行的银镜反应中1. 结论:葡萄糖溶液的效果最佳,生成了十分光亮的银镜,镀层均一,现象明显。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
银对玻璃的着色(图2—22。
1)在玻璃工业中,可用银来获得各种颜色效果。
方法如下,1)在适当大小的Ag粒子分散相的作用下,对玻璃质体着色,2)表面着色,即所谓银的媒染剂,这一迩程的基础是,银离子在玻璃表面内渗透(扩散),因而与碱离子进行交换,然后银离子还原成原子,银原子又聚集成胶体粒子。
3)由于炽热的还原气体对含Ag玻璃的作用,或者由于预先涂在玻璃表面上的松酯酸银被还原性焙烧,因而在玻璃表面上能生成虹彩的银釉药。
玻璃中银的胶体粒子对光的吸收,主要由粒子的大小和数量来决定,该情况指的是类似于琥珀色或铈黄色的黄色着色,在这种条件下,尺寸在30nm以下的细小Ag粒子会引起浅绿色调(浅柠檬黄色),随着银粒子的生长将过渡到橙色色调的区域。
胶体银在430和450nm之间有一透过极小值,而且与玻璃其它黄色的区别是在紫外区有相当高的光透过率。
图2—22(1)添加0.2形AgN08着色的钙—钠—硅酸盐玻璃和(2)添加1.2笫CuIO熔炼的铜红宝石的光谱透过率。
试样厚度为2皿血。
银是强着色剂,每100公斤砂子添加20—100克AgNO。
(溶液)能得到黄色色调。
它在玻璃中的溶解度取决于玻璃的成分,溶解度相当低正是溶液在高温下能够长时间保持的条件。
在玻璃中添加0.5%的SnO:可加速溶解过程。
每100公斤砂子大约使用1公斤AgNO。
时,可熔制出发乳光的玻璃,其中银粒子起了乳浊剂的作用。
熔炼含银的玻璃时,银在熔体中或者以一价离子存在,或者以原子的形式存在,后一种情况在紫外线照射下玻璃中会出现强烈的荧光。
采用还原熔炼条件和提高温度的结果,将使平衡向银原子的方向移动,这对于未来的颜色具有重大的意义。
基质玻璃成分对银的溶解也有影响。
用这种化学元素着色时,最适宜的玻璃是铅玻璃,而且引入S。
就能达到还原的目的。
当然,也可以使用在适度还原条件下熔炼的无铅玻璃,然而,使用钠玻璃时会得到较黄的色调,而使用钾玻璃时则得到橙黄色调。
通常,熔炼出的玻璃是无色的,由银粒子生长所决定的橙黄色,将由于附加热处理(显色)而发展。
如果此时采用强还原气氛,那么同时可得到表面虹彩。
用银着色时要使用硝酸银(AgNO真),它是无色片状的晶体,含有63%的银。
AgNO,试剂在光的作用!F表面上要变黑,因此要保存在褐色的玻璃容器中。
该试剂易溶于水,故用其水溶液进行着色铜对玻璃的着色铜属于最早为人们所知的着色剂,在5000多年前就巳被使用。
按照金属铜粒子的大小,可把玻璃分为以下四类,”铜红宝石(暗红色玻璃),它的亮度较小(灰色调成分较多),这是它与金红宝石和硒红宝石的区别所在,其原因是含有氧化铜离子,它们在光谱的红色区域能产生吸收。
铜红宝石的载色体是胶体粒子大小的铜晶体,2)正铁血红素(乳浊的褐—红色玻璃)。
玻璃中的铜粒子达到相当于光波长的大小,因而造成了乳浊。
3)铜金星玻璃(具有不同乳浊程度的玻璃),其中一定数量的铜晶体达到了相当大的尺寸,即由十分之几mm到1mm。
这些片状的晶体呈现出特征性的金属光泽和反射,在把玻璃加工成制品时,常常能看到铜的鳞片与制品表面平行地分布,4)铜的媒染剂(玻璃表面的暗红色着色)。
如同银的着色一样,铜的媒染剂是因为铜离子的还原而产生的,由于同碱金属离子的交换,它们扩散到了玻璃的表面层内。
除了属于玻璃表面装饰范围内的彩色媒染剂外,在生产方面最重要的就是铜红宝石。
考虑到它具有相当大的着色强度,可用来给晶质玻璃涂层(套色),其厚度为十分之几毫米。
铜在玻璃中的溶解度比金和银高得多。
熔炼时(在炉料中引入Cu。
O)会出现铜原子的高温溶液与一价和二价离子的平衡。
还原条件和适宜的玻璃成分(特别是有锡存在时),能使平衡向金属铜的方向移动。
在补允加热(显色)时,铜粒子能聚集并生长到着色的胶体尺寸。
显色温度范围取决于玻璃的成分,通常在580℃一700℃的区间内。
玻璃粘度也是一个重要的因素:软性的低粘度玻璃易于显色,但由于乳浊会产生。
猪旰”色调。
所以,在玻璃的熔炼实践中,认为粘度较高的玻璃(硬性玻璃)比较好。
使用乳浊玻璃时容易显色,当然,最终的色调为不纯的褐色。
由铜的胶体晶体所决定的铜红宝石的透过率曲线在波长550nm处有吸收极大值,而光透过率的极大值在690nm的红色区。
此外,在520nm的区域还有一个透过率不超过5:6的次极大值。
至于基质玻璃,熔炼铜红宝石通常要使用钠玻璃,因为使用较贵重的KlO时未发现有什么优越性。
选择基质玻璃时,认为SiO。
含量高的玻璃比较好,也希望含有B:O¨因为它能像Ba卿样促进铜在玻璃中的溶解。
ZnO则产生相反的作用,而玻璃中较高含量的PbO可以在还原条件下熔炼时使用。
为了消除这些不良现象,可采用两阶段熔炼法,在实际玻璃生产中经常采用它。
该方法首先是在正常条件下(即氧化的条件下)熔炼铅晶质玻璃,然后将其粉碎和球磨。
第二步熔炼以如下方式进行,即把磨细的晶质玻璃与添加的Cu:O、SnO,和还原剂混合后,聋还原条件下再次熔炼,这火材料的侵蚀程度也比冰晶右大。
在实际玻璃熔炼中很少使用一种Na,SiF。
进行乳浊,而是经常与其它氟化物的乳浊剂(与冰晶石或萤石)纵合使用。
在使用萤石时,一般要以长石的形式(重量大致与萤石相同)把A1:O。
引入玻璃中。
(二)冈氧化砷乳浊6Lp酸铅L,L,(AsU真/:的晶体是乳浊载体。
采用氧化砷As:O。
作为乳浊剂,可将它引入含Pb达40%(或>40%)的铅玻璃炉料中。
玻璃液中As:O。
的含量在3—8%的范围内。
在某些情况下,其它乳浊剂杂质(例如磷酸钙或二氧化锡)的引入会增大乳浊的强度,并在冷却时变成珐琅。
三,难溶子玻璃液的乳浊剂可把在玻璃液中熔化能力低和溶解度小的高折射率氧化物,加入炉料作为乳浊剂。
如今,这种乳浊方法在玻璃工业中巳层次要地位,而且常常是在熔制釉和珐琅时才被采用。
由于二氧化铈(CeU:)和难溶于玻璃的二氧化锡(SnO:)具有高折射串,因而是特别强的乳浊剂,二氧化锆(ZrO:)和二氧化钛(TjO。
)是较弱的乳浊剂。
在某几种上述乳浊剂的抑制下,氟乳浊玻璃的乳浊度会明显加深,这种玻璃屏蔽光的能力巳接近于不透明的珐琅。
( 一)滴状轧浊剂。
用磷酸盐和硫酸盐化合物进行乳浊均属于此类,由于它们的溶解度有限,冷却时将分出乳浊液状的滴状相。
由于进一步的冷却,在用硫酸盐乳浊的场合中,滴状相会全部晶化,而在用磷酸盐乳浊的情况下,样做不需补充显色就可以熔制出棒状的锕红宝右。
玻璃中有锡存在是熔御1铜红宝石的重要前提。
锡以氧化锡SnO的形式或锡粉的形式引入炉料。
为了还原起见,可使用氧化锑,酒石等。
补充显色是由还原熔炼条件所决定的。
表2—7玻璃中的铜含量用铜着色的玻璃类型f玻璃中的铜含量,弗(重量)应当指出,对于铜红宝石的载色体目前还没有统一的看法。
在印度加尔各答的玻璃与陶瓷中央科学研究所对铜红宝石玻璃的实质性问题进行了长期的研究。
印度学者力图有根据地证明载色体是氧化亚铜(Cu,O)胶体粒子的观点,而Cu20在自然界中会生成红色的赤铜矿晶体。
按照他们的理论,在适度还原的熔炼条件下,玻璃中能生成姜Si—O—Cu硅酸盐团,显色时将从中产生Cu。
O,即---Si—O—Cu+Cu—O—Si罟=Co:O+营Si—O—Si营。
他们认为,聚集的金属铜把玻璃替成浅灰黄色或浅黄褐色。
在工艺方面,要考虑到玻璃中存在的Cu'+离子能转变为Cu+离子,因此必须在适度的氧化条件下进行熔炼。
印度学者把实现Cu真+离子还原成Gu+离子并开始Cu’-bCu,过渡这个阶段视为。
熔炼的临界状态。
在这个阶段,由Cu'+离子使玻璃产生的浅天蓝色调会变为浅黄色,而制品在热处理时具有均匀的鲜红色。
在熔炼持续的条件下,玻璃液中将逐渐产生其它的铜粒子,它们会导致形成难看的浅灰红色调。
玻璃液适于制做优质红宝石的。
熔炼的临界状态'总共只有几分钟的时间.有锡存在时,这一时间间隔可增长到数小时。
根据印度学者的理论,在显色过程中铜红宝石内的锡,并不起还原作用(Sn”+2Cu中--.~2Cu。
+SⅡ”),但能迅速地提高玻璃液中Cu+离子的稳定性,在这段时间里,玻璃液用来制作优质红宝石是合适的。
当使用过高的显色温度(超过600℃)时,玻璃将出现不良的浅褐红或浅灰红色色调,这是因为在此温度下产生的Cu,0会立即被再分解为金属铜粒子(Cu。
)。
在短时间显表2—8胶体大小的金属晶体对玻璃着色的实例金Au:2~4,以A,ICl锵液)形式引入玫瑰色或紫红色红宝石氧化加1笫SnOs的钾铅硅玻璃最为适宜。
建议高温熔期银[AgNOs藩谖谚式引入柠檬色或橙黄色适度还原加Sbzoo和SnO:(Sn)的铅玻璃最为适宜铜Cu.O:200+、,2000红色的红宝石还原使用加SnO,(Sn)的钠嘲·硅玻璃Cuso2000内妒5000呈乳浊状的浅褐红色(正铁血红素)还原BsOo,BaO产生有利的作用CutO4000,、,8000金星玻璃(金属光泽的鳞片)还原色的玻璃中,用x哺线结构分析能够发现有Cu‘和Cu,O共剐存。
在成型过程中,当一批玻璃二次加热时,Cu:O也会出现类似的分解。
’加尔各答科学研究所的上述研究成果,在认识铜红宝石的自然载色体方面是一个重大的贡献,但目前尚不能认为这是唯一被证实了的成果。
如果这一观点正确,那么玻璃应该叫做铜玻璃,而不该叫做铜红宝石。
胶体大小的金属晶体,对玻璃着色的概况列于表2—8中,。
