辉石角闪石三价铁及晶体化学式计算材料.
角砾岩矿物成分

角砾岩矿物成分角砾岩是一种由火山岩直接或间接变质而成的岩石,其矿物成分主要包括斜长石、辉石和磷灰石。
下面将分别介绍这三种主要矿物成分的特点和性质。
斜长石是角砾岩中最常见的矿物成分之一。
它是一种硅酸盐矿物,化学式为(Na,K)AlSi3O8。
斜长石的晶体结构属于三斜晶系,晶体形态多为柱状或板状,颜色多样,常见的有白色、灰色、黄色和粉红色等。
斜长石的硬度较大,一般在6-6.5之间。
它的比重约为2.6-2.8。
斜长石在地壳中广泛存在,是地壳中最常见的矿物之一。
辉石是角砾岩中另一个重要的矿物成分。
辉石是一类含有镁、铁、钙等元素的硅酸盐矿物,化学式为(Mg,Fe,Ca)2Si2O6。
辉石的晶体结构属于单斜晶系,晶体形态多为柱状或片状,颜色多样,常见的有绿色、黑色和棕色等。
辉石的硬度一般在5-6之间,比重约为3.2-3.6。
辉石在地壳中分布广泛,常见于火成岩和变质岩中。
磷灰石是角砾岩中含磷的重要矿物成分。
磷灰石是一种磷酸盐矿物,化学式为Ca5(PO4)3(F,Cl,OH)。
磷灰石的晶体结构属于六方晶系,晶体形态多为柱状或板状,颜色多样,常见的有白色、灰色和黄色等。
磷灰石的硬度较小,一般在5之下。
它的比重约为3.1-3.2。
磷灰石在地壳中分布广泛,是一种重要的磷肥矿石。
除了上述主要矿物成分外,角砾岩中还可能含有少量的其他矿物,如黑云母、绿帘石等。
黑云母是一种含铝的硅酸盐矿物,化学式为KAl2(AlSi3O10)(OH)2。
它的晶体结构属于单斜晶系,晶体形态多为片状,颜色为黑色或暗褐色。
黑云母的硬度较小,一般在2.5-3之间,比重约为2.7-3.1。
绿帘石是一种含铁的硅酸盐矿物,化学式为Fe7Si8O22(OH)2。
它的晶体结构属于单斜晶系,晶体形态多为柱状或片状,颜色为绿色或黑绿色。
绿帘石的硬度较小,一般在2.5-3之间,比重约为3.1-3.5。
角砾岩的矿物成分主要包括斜长石、辉石和磷灰石。
斜长石是最常见的矿物成分,辉石和磷灰石是次要的矿物成分。
矿物晶体化学式计算方法汇总

------------------------------------------------------------精品文档-------------------------------------------------------- 成岩成矿矿物学––矿物晶体化学式计算方法矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1.化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSiO或KO?AlO?6SiO,而其晶体化学式则282332必须表示为K[AlSiO];83(2)磁铁矿的化学式可以写为:FeO,但其晶体化学式为:FeO?FeO。
3432(3)具AlSiO化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶52体化学式:2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
吸附水:吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。
吸附水不参加矿物晶格,可以是薄膜水、毛细管水、胶体水等。
当温度高于110?C 时则逸散,它可以呈气态、液态和固态存在于矿物中。
吸附水不写入矿物分子式。
结晶水:结晶是成中性水分子参加矿物晶格并占据一定构造位置。
常作为配位体围绕某一离子形成络阴离子。
结晶水的数量与矿物的其它组份呈简单比例。
如石膏:Ca[SO] ?2HO。
24++-+等离子形式参加H、OHH(或称化合水):常以OO表示,结构水呈H、结构水32-+离子少见,O最常见。
H矿物晶格。
占据一定构造位置,具有一定比例。
通常以OH3+++与HO + HO。
结构水如沸石水、层间水等。
矿物晶体化学式计算方法汇总

------------------------------------------------------------精品文档-------------------------------------------------------- 成岩成矿矿物学––矿物晶体化学式计算方法矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1.化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSiO或KO?AlO?6SiO,而其晶体化学式则282332必须表示为K[AlSiO];83(2)磁铁矿的化学式可以写为:FeO,但其晶体化学式为:FeO?FeO。
3432(3)具AlSiO化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶52体化学式:2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
吸附水:吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。
吸附水不参加矿物晶格,可以是薄膜水、毛细管水、胶体水等。
当温度高于110?C 时则逸散,它可以呈气态、液态和固态存在于矿物中。
吸附水不写入矿物分子式。
结晶水:结晶是成中性水分子参加矿物晶格并占据一定构造位置。
常作为配位体围绕某一离子形成络阴离子。
结晶水的数量与矿物的其它组份呈简单比例。
如石膏:Ca[SO] ?2HO。
24++-+等离子形式参加H、OHH(或称化合水):常以OO表示,结构水呈H、结构水32-+离子少见,O最常见。
H矿物晶格。
占据一定构造位置,具有一定比例。
通常以OH3+++与HO + HO。
结构水如沸石水、层间水等。
角闪石

矿物特性
普通角闪石为角闪石群(Amphibole group)矿物中最常见之矿物,化学成分主要为(Ca,Na)2-3[Mg, Fe(II),Fe(III),Al]5[(Al,Si)8O22] (OH)2,属单斜晶系的双链状结构,长柱状近乎不透明之晶体,其横 断面为菱形的六边体,集合体常呈粒状、针状或纤维状。外观为绿黑至黑色,但条痕则为浅灰绿色,具玻璃光泽, 且两组柱面解理完全,交角为124°和56°,此点可用来与辉石两组几乎呈现直交的解理面作为区分。摩氏硬度 5-6,比重3.0-3.4。角闪石于变质岩及火成岩中极普遍存在,多由富含铁镁矿物的岩石变质而成,在作用发生时, 常有硅铁镁等物质加入。
结构对称特点:单斜晶系,点群2/m;空间群C2/m。
成因
地壳下面的岩浆熔体在上升过程中温度不断降低,当温度低于某种矿物的熔点时就会形成该矿物结晶。随着 温度的持续下降,岩浆中所有的成份会形成一系列的矿物,例如形成橄榄石、辉石、角闪石与云母等多种矿物。 当火山爆发产生的岩浆与熔岩流遭遇空气后冷却。如果冷却过于迅速,来不及形成结晶态的矿物,则会固结成非 晶质的火山玻璃。火山作用除岩浆外,也会喷出硫气,硫气因温度骤降可直接升华成自然硫,例如台北大屯火山 群与基隆外海龟山岛的自然硫。
台湾玉属上述之闪玉,主要产于东部接触变质之蛇纹岩中,是从1965年起,正式于花莲县寿丰乡的丰田开采, 颜色为墨绿、翠绿、黄绿或淡黄灰色,半透明或不透明,因为其中亦有少量之铬铁矿,因此常有黑色斑点或条纹。 而台湾玉内因含呈平行之石绵,若经过适当之切磨工作,会呈现猫眼光(cat’s eye)现象。
晶体结构
成因产状
普通角闪石是分布很广的造岩矿物之一。在火成岩中,尤以中性岩中最为常见,是其中的最主要暗色矿物。 在酸性火成岩和正长岩中普通角闪石常为黄绿色;中性岩中以黄绿色为主,但也有褐色角闪石;镁铁质和超镁铁 质岩石中多为褐色角闪石。在区域变质作用中,普通角闪石也有大量产出。变质岩中角闪石的颜色与变质作用的 强度有关,一般情况下,较低级变质岩石中多蓝绿色角闪石,而中高级变质岩石多褐色角闪石,黄绿色角闪石分 布较广,在不同变质程度的岩石中均有产出。在区域变质作用中,普通角闪石也有大量产出。
辉石化学式

辉石化学式辉石是一类重要的岩石矿物,化学式通常表示为(Mg, Fe)2Si2O6,其中Mg和Fe分别代表镁和铁。
辉石是地壳中最常见的矿物之一,广泛存在于火山岩和变质岩中。
它具有许多重要的地质和工业应用,对于我们认识地球内部构造和矿物资源富集有着重要的意义。
辉石的化学式中的Mg和Fe是代表镁和铁的元素,它们在地壳中非常常见。
辉石的晶体结构中,镁和铁离子可以相互替代。
这种替代会影响辉石的物理和化学性质,如硬度、颜色和熔点。
辉石的颜色通常是黑色或绿色,但也可以是灰色、棕色或红色,这取决于其中镁和铁的含量。
辉石是一种硬度较高的矿物,常用于制作耐磨材料和建筑材料。
它的晶体结构稳定,具有良好的机械强度和抗压性能,因此常被用于制作建筑材料和耐火材料。
辉石的硬度也使它成为一种重要的磨料,用于磨削和抛光金属和石材。
辉石还具有良好的热稳定性和绝缘性能。
它的熔点较高,可以耐受高温环境。
因此,在冶金和玻璃工业中,辉石常被用作耐火材料和隔热材料。
辉石的绝缘性能也使它成为电子工业中的重要材料,用于制造电子元件和电路板。
除了工业应用,辉石还在地质学和地球科学研究中发挥着重要作用。
它是一种非常常见的岩石矿物,存在于地壳的各个部分。
通过研究辉石的分布和组成,科学家可以了解地球内部的构造和演化过程。
辉石的组成和矿物特征还可以用于研究岩浆的形成和变质岩的变质过程,对于理解地球的地质历史和资源富集有着重要的意义。
辉石化学式(Mg, Fe)2Si2O6代表了这一重要的岩石矿物的化学组成。
辉石具有广泛的地质和工业应用,对于地球科学研究和工业生产都具有重要的意义。
通过研究辉石的性质和分布,我们可以更好地了解地球的内部构造和地质演化过程,促进科学的发展和资源的利用。
让我们一起深入探索辉石的奥秘,揭示地球的神秘面纱。
多种矿物化学式及中英文名称
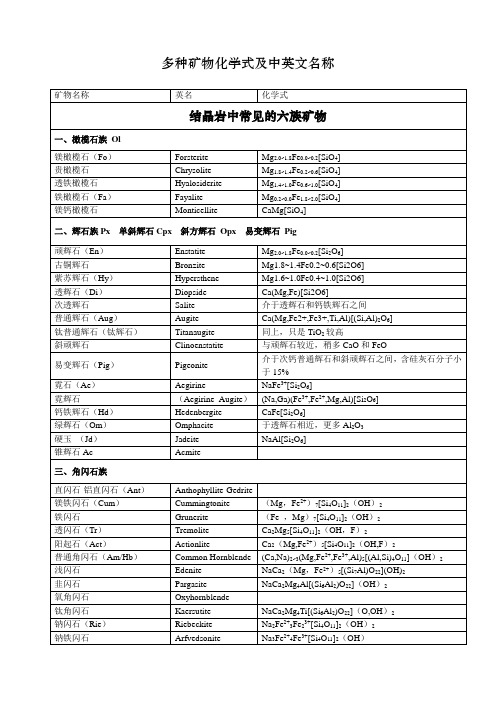
矿物名称
英名
化学式
结晶岩中常见的六族矿物
一、橄榄石族Ol
镁橄榄石(Fo)
Forsterite
Mg2.0~1.8Fe0.0~0.2[SiO4]
贵橄榄石
Chrysolite
Mg1.8~1.4Fe0.2~0.6[SiO4]
透铁橄榄石
Hyalosiderite
Mg1.4~1.0Fe0.6~1.0[SiO4]
沉积岩中的造岩矿物
十、均质体
蛋白石()
Opal
SiO2·nH2O
胶磷矿()
Collophane
3Ca3[PO4]2·nCa(CO3,F,O)·xH2O
胶铝矿()
Cliachite
Al2O3·nH2O
十二、一轴晶矿物
玉髓
Chalcedony
SiO2
自生石英
Authigenic Quartz
SiO2
方解石(Cc)
钙铁辉石(Hd)
Hedenbergite
CaFe[Si2O6]
绿辉石(Om)
Omphacite
于透辉石相近,更多Al2O3
硬玉(Jd)
Jadeite
NaAl[Si2O6]
锥辉石Ac
Acmite
三、角闪石族
直闪石-铝直闪石(Ant)
Anthophyllite-Gedrite
镁铁闪石(Cum)
Cummingtonite
ZnS
八、一轴晶矿物
钙霞石
Cancrinite
Na6Ca2[AlSiO4](CO3,SO4)(OH)2
霞石(Ne)
Nepheline
Na[AlSiO4]含少量钙、钾
普通角闪石的成分

普通角闪石的成分普通角闪石是一种常见的矿物,其成分主要由镁铁硅酸盐组成。
以下将从普通角闪石的化学成分、物理性质和地质意义等方面进行介绍。
一、化学成分普通角闪石的化学成分主要由镁铁硅酸盐组成,化学式为(Mg,Fe)7(Si8O22)(OH)2。
其中,镁和铁的比例会有一定的变化,从而导致普通角闪石的颜色也会有所不同。
普通角闪石的晶体结构属于单斜晶系,晶格中的硅酸根和氢氧根以及镁、铁等金属离子相互交错排列。
二、物理性质普通角闪石的颜色多为黑色或深绿色,有时也会呈现棕色、红色等。
它的硬度在5至6之间,密度约为3.2至3.6g/cm³。
普通角闪石的断口呈贝壳状,有较强的解理性。
在薄片下观察,普通角闪石呈现出明显的蓝色或绿色的双折射现象。
此外,普通角闪石还具有电性、磁性和热稳定性等特点。
三、地质意义普通角闪石广泛分布于地球上的各种岩石中,尤其是变质岩和火山岩中。
普通角闪石的存在可以指示该岩石在形成时的变质或火山作用环境。
普通角闪石在岩石中的含量和形态也与岩石的成因和演化过程密切相关。
通过研究普通角闪石的化学成分和分布特征,可以揭示岩石的形成历史、岩浆演化过程以及地壳的动力学变化等信息。
在实际应用中,普通角闪石具有一定的经济价值。
由于其丰富的铁和镁元素,普通角闪石可以作为重要的铁矿石和镁矿石资源。
此外,普通角闪石还被广泛应用于建筑材料、耐火材料、化肥和玻璃等工业领域。
总结起来,普通角闪石是一种由镁铁硅酸盐组成的矿物。
它具有特殊的物理性质和地质意义,广泛存在于各种岩石中。
通过研究普通角闪石的分布特征和化学成分,可以揭示岩石的成因及演化过程,为地质学和矿产资源开发提供重要的参考依据。
此外,普通角闪石还具有一定的经济价值,可以作为重要的矿石资源以及工业原料。
浅析辉石与角闪石的鉴定特征及其岩石定名依据

浅析辉石与角闪石的鉴定特征及其岩石定名依据辉石与角闪石是颗粒组合型岩石,在地质学上属于长石系,是高压变质岩形成的成岩岩石。
辉石与角闪石多在断层滑脱变形区域出现,拥有较高的熔融程度及变形特征,由于组成矿物过量、相互交织密集,让其独有的特点成为岩石的特殊标志之一。
辉石的鉴定特征1、组成矿物辉石的矿物组成以长石和闪长岩石为主,还含有有其它如辉长石、花岗岩石、云母等矿物。
2、外观形态辉石有颗粒多种形状,由细到粗可见各种颗粒,也有锯齿形、楔形、横纹形及块状物等,确定物样时注意外观形貌及质地十分重要。
3、分子结构辉石的分子结构呈连续分布态,矿物内部因相互作用形成矿物层析构造,矿物的具体构造能反映出其形成环境及演化历史。
4、萤光特性辉石的矿物萤光表现为荧光及弗离子荧光,比如长石、辉长石等具有弱荧光性,能反映出岩石中矿物构造、浓度及施加外力程度等信息,在岩石鉴定中有重要价值。
角闪石的鉴定特征1、组成矿物角闪石由长石、闪长石、辉长石、角闪石、石英、云母等组成。
2、外观形态角闪石的外观形态通常为多晶形、疏松细腻的细粒岩,单块重量较轻,表面不具有光泽。
3、光学性质角闪石的光学性质有顶反射、折射、绝热等,通过顶反射可观察到矿物内包裹体,而折射可以显示出物样内部结构及矿物特征。
4、化学成分角闪石的化学成分主要由碳酸盐、硅酸盐、硫酸盐和氧化物组成,从而可判断出物样的成因及演化史。
辉石与角闪石的岩石定名依据1、结构特征:辉石与角闪石具有较强的熔融性、变形特征和构造紧密,通过观察得出其具有颗粒结构,可确定为长石系岩石。
2、重量特征:辉石与角闪石多采用小粒细粉状矿物组成,单块重量较小。
3、岩石物理性质:辉石与角闪石具有致密结构,硬度较软,质地坚韧,有一定的触摸滑腻感,只有少数物质能水蚀,具有较强的耐酸性。
4、岩石组成矿物:辉石与角闪石由长石、闪长石、辉长石、角闪石、石英、云母等组成,可从矿物的成分以及结构特征判定物样属于辉石或角闪石。
选矿学思考题参考答案

教学模块一第一章概述1.名词解释:矿物加工选矿选煤品位产率回收率有用矿物粗选精选扫选选矿比富集比答:矿物加工:是利用矿物的物理化学性质的差异,借助各种分离、加工的手段和方法将矿石中有用矿物和脉石分离,达到有用矿物相对富集并进行其加工和利用的方法。
选矿:把矿石加以破碎,使之彼此分离(解离),然后将有用矿物加以富集提纯,无用的脉石被抛弃,这样的工艺过程叫选矿选煤:对煤炭而言,将煤与矸石分离,从而获得质量不同的产品过程,称为选煤。
品位:指产品中有用成分的质量与该产品质量之比,常用百分数表示。
产率:产品质量与原矿质量之比,叫该产品的产率,通常以γ表示。
回收率:指精矿中有用成分的质量与原矿中该有用成分质量之比。
有用矿物:能够为人类所利用的矿物、矿石、岩石。
粗选:矿浆经调合后进入浮选的第一个工序,选出部分高于原矿品位,但一般达不到精矿质量要求的粗精矿作业。
精选:将粗选所得到的粗精矿再选,并得到合格精矿的作业。
扫选:把粗选之后还不能做为最终尾矿丢弃的矿浆进行再选的作业。
为提高回收率,需降低尾矿品位,扫选也常进行多次。
选矿比:指原矿质量与精矿质量之比。
用K表示。
富集比:精矿品位与原矿品位之比。
2.分离过程一般包括哪几部分?分离剂主要指什么?答:一般包括原料(混合物)、分离剂(能量或物质)及产品三部分分离剂为加到分离装置中使过程得以实现的能量或物质3.常用的矿物加工方法主要有哪些?答:答:常用的矿物加工方法主要有:重选法、磁选法、电选法、浮选法化学分选、生物分选、特殊分选法其中,重选和浮选法应用最广。
各种矿物加工方法可以单独使用,也可以几种方法联合使用。
4.矿物加工的三个基本工艺过程指什么?答:①矿物选前的准备作业②分选作业③选后产品的处理作业5.什么叫流程?答:流程:是选矿厂为生产某种质量标准的产品所安排的作业顺序。
6.什么叫物料平衡?在矿物加工中有何意义?答:物料平衡:设计流程时,必须分析和了解矿流分支或汇合时物料是如何分布的。
晶体化学式作业计算-辉石角闪石
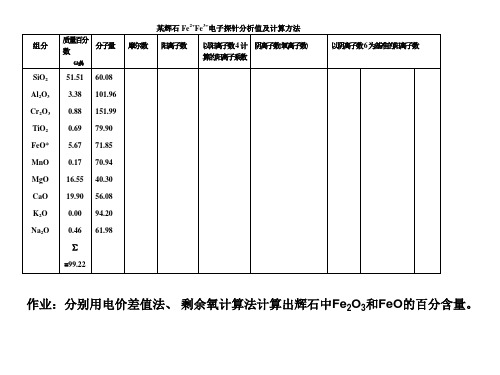
IV
9
10
SiO2 Al2O3 TiO2 Cr2O3 FeO* MnO MgO CaO Na2O K2O
42.12 13.83 1.57 0.00 8.76 0.09 14.27 11.47 2.34 0.85
60.08 101.96 79.9 151.99 71.85 70.94 40.3 56.08 61.98 94.2
Mn Ca Na sumX= Na K A= sum 95.6 ∑4 Fe2+=Fe- Fe3+= 23.0000 ∑6 β =15/∑6= Fe3+=(23-∑9)×2=
பைடு நூலகம்
Si Al Al SumT=8.000
VI
AlIV SumT=8.000 AlVI Fe3+ Cr Mg Fe2+ Mn sumY=5.000 Mg Fe2+ Mn Ca Na sumX=2.000 Na K A=0.000 ∑9
Fe3+ Cr Mg Fe
2+
Mn sumY=5.000 Mg Fe
2+
SiO2 Al2O3 Cr2O3 TiO2 FeO* MnO MgO CaO K2O Na2O
[常识]各类矿物的晶体形状
![[常识]各类矿物的晶体形状](https://img.taocdn.com/s3/m/9921342430126edb6f1aff00bed5b9f3f90f726e.png)
各种矿物的晶体形态1、黄铁矿(pyrite) FeS2点群 m3晶形:常见立方体、五角十二面体及其聚形。
晶面上常见平行{100}和{210}的聚形纹。
浅铜黄色,条痕绿黑色,金属光泽,无解理,硬度较大:6-6.5它是制造硫酸和硫磺的主要原料。
是NaCl型结构的衍生结构总之:黄铁矿:结构(了解,并解释硬度和解理)雄黄(realgar) As4S4形态:柱状、短柱状或针状,柱面有纵纹。
常以粒状、土状产出。
环状分子型结构:2/m橘红色,金刚光泽,透明-半透明。
平行{010}完全解理。
硬度1.5-2。
总之:雄黄:结构(了解,并解释物性)化学式:As4S4颜色雌黄(Orpiment) As2S3柠檬黄色,油脂-金刚光泽,解理面珍珠光泽,平行{010}极完全解理,硬度1.5-2。
形态:板状、短柱状,晶面常弯曲,柱面有纵纹。
集合体呈片状、梳状、放射状和土状等。
层状结构:2/m雌黄:结构(了解,并解释物性)化学式:As2S3颜色、方铅矿( Galena) PbSNaCl型结构,典型的立方面心格子,化学键为离子键-金属键过渡型。
形态:高温呈立方体,低温呈八面体,集合体呈粒状。
结构:m3m铅灰色,条痕黑色,金属光泽。
{100}三组完全解理。
硬度2-3。
相对密度7.4-7.6。
总之:方铅矿:结构(掌握,并解释物性)化学式:PbS解理(组数、方向、产生原因)5、闪锌矿( sphalerite) ZnS结构:4 3mZnS型结构多为粒状集合体。
单晶体高温为四面体,中低温为菱形十二面体。
四面体晶面上常见三角形蚀象,常呈正、负四面体的聚形及聚形纹。
颜色由无色到浅黄、棕褐至黑色,随成分中含Fe量的增加而变深。
松脂光泽至半金属光泽;透明至半透明。
具平行{110}的六组完全解理。
硬度3.5-4。
相对密度3.9-4.2,不导电总之:闪锌矿:晶形化学式:ZnS解理(组数、方向、产生原因)辰砂( cinnabar) HgS结构:三方晶系,点群:32链状结构(变形的NaCl型结构形态:单晶常呈菱面体{1011}、平行{0001}厚板状或平行c轴延伸的柱状。
辉石

辉石辉石(pyroxene )是一种重要的硅酸盐矿物,是辉石类矿物的总称,常在火成岩和变质岩中被发现。
辉石类矿物的共同特点是其晶体中含有硅氧四面体形成的单链结构。
辉石的化学式可表示为XY(Si,Al)2O 6,其中X 代表钙、钠、镁和2价铁的离子,偶尔也可为锌、锰和锂等元素的离子。
Y 既可代表与X 相同的离子,也可以代表一些半径较小的阳离子如铬、铝、3价铁、钒、钪等。
与长石和角闪石不同,铝在辉石中几乎不能替代硅氧四面体链中的硅原子。
不含铁的辉石颜色较浅,含铁的辉石颜色较深,从深绿,棕色到黑色不等。
辉石的莫氏硬度在5~7之间,比重在3.1~3.5左右。
晶体多为短柱状(霓石例外,呈长柱状或针状),横切面为假八边形或假四边形。
集合体为粒状块体或交织状致密块体。
解理平行菱方柱{110}中等,两组解理相交成87o ~88 o 或92 o ~93 o 。
一般为玻璃光泽。
透明-不透明。
颜色因品种和所含杂质而异,大多偏深。
光性也随品种变化而略有差异,是区分品种的主要标志。
辉石族矿物是重要的造岩矿物之一,集中分布于超基性、基性、中基性以及碱性火成岩中,也见于一些深变质岩中。
而透辉石、钙铁辉石等则是一种重要的蚀变成因矿物。
按国际矿物学会的《辉石命名法》(1987),辉石族矿物共包括20个矿物种,按成分可分为4个化学组:Ca-Mg-Fe 辉石组、Na-Ca 辉石组、Na 辉石组和其他辉石组。
各组内部和相互间绝大多数都存在着广泛的类质同象替代现象。
但任一辉石中,X 阳离子的半径总是大于或至少是等于Y 阳离子半径。
Ca-Mg-Fe 辉石组中斜方辉石的顽辉石和铁辉石,含Ca 2Si 2O 6(Wo)分子很少,基本上是由Mg 2Si 2O 6(En)分子和Fe 2Si 2O 6(Fs)分子组成的完全类质同象系列。
此系列早先按 En 由多到少共分为顽辉石、古铜辉石、紫苏辉石、铁紫苏辉石、尤莱辉石和铁辉石6个矿物种;但现只以En50Fs50为界而划分为顽辉石和铁辉石两个矿物种。
辉长岩主要矿物结晶顺序

辉长岩主要矿物结晶顺序
辉长岩(diorite)是一种中等-高等温深岩石,其主要矿物包括辉石、斜长石和角闪石。
这些矿物的结晶顺序取决于岩浆的化学成分、温度和压力等因素。
以下是一般情况下辉长岩中主要矿物的结晶顺序:
1.辉石(Pyroxene):一般来说,辉石是在岩浆冷却的早期阶段
结晶的。
辉石是辉长岩中的主要黑色矿物,有助于赋予岩石其
特征的颜色。
2.斜长石(Plagioclase Feldspar):斜长石是岩石中的主要灰色
矿物,通常在辉石结晶之后开始结晶。
斜长石是辉长岩中的主
要酸性矿物,其含钠和钙的含量可能影响其颜色。
3.角闪石(Hornblende):角闪石是辉石和斜长石之后结晶的矿
物,通常在岩浆冷却的晚期阶段形成。
它是一种含铁的矿物,
可以为岩石赋予绿色或黑色的颜色。
辉长岩中的这些矿物结晶顺序可以因具体的地质条件而有所变化,而且岩浆的混合和再结晶等过程也可能对结晶顺序产生影响。
因此,结晶顺序只是一种一般性的描述,具体的岩石样本可能显示出不同的特征。
辉石

辉石英文名称pyroxene在晶体结构上硅氧四面体呈单链状排列的钠、钙、镁、铁、铝的硅酸盐矿物的一个族类,以具[si4o6)4-的偏硅酸根为特征。
根据其所属晶系的不同分为两个亚族:斜方辉石和单斜辉石。
前者如顽火辉石、古铜辉石、紫苏辉石等;后者有普通辉石、透辉石、钙铁辉石、霓石(aegirine)、钠铝辉石、锂辉石等。
它们虽然化学成分和晶系不尽相同,但具有许多相似的性质。
晶体多为短柱状(霓石例外,呈长柱状或针状),横切面为假八边形或假四边形。
集合体为粒状块体或交织状致密块体。
硬度5—7。
解理平行菱方柱{110}中等,两组解理相交成87o~88 o或92 o~93 o。
相对密度大多介于3.1~3.5之间。
一般为玻璃光泽。
透明-不透明。
颜色因品种和所含杂质而异,大多偏深。
光性也随品种变化而略有差异,是区分品种的主要标志。
辉石族矿物是重要的造岩矿物之一,集中分布于超基性、基性、中基性以及碱性火成岩中,也见于一些深变质岩中。
而透辉石、钙铁辉石等则是一种重要的蚀变成因矿物。
在众多的辉石族矿物中,有多种可用作宝石,如古铜辉石、紫苏辉石、顽火辉石、透辉石、锰钙辉石等等。
但最重要的还是钠铝辉石和锂辉石,前者是翡翠的主要组成矿物,后者也是著名的宝石矿物之一。
在工业上,除锂辉石可用作提炼锂的原料外,其他无重要用途。
透辉石英文名称diopside 辉石族矿物。
化学式:camg[si2o6],常与钙铁辉石(cafe[si2o6])形成类质同像。
处于二者之间的中间成员,被称为“次透辉石”和“铁次透辉石”;此外也、常混入少量的锰,三价铁、铝、铬、钒、钛等。
单斜晶系。
晶体短柱状。
淡绿色,一般随铁含量增加而加深至暗绿色和黑色;此外也有白、黄、褐、灰、红褐、紫、蓝等色。
透明-微透明。
玻璃光泽。
二轴正晶,+2v=50o~63 o。
折射率ng=1.695~1.728,nm=1.672~1.702,np=1.664~1.699;重折射率0.024~0.031。
火山角砾岩矿物成分

火山角砾岩矿物成分火山角砾岩是一种由火山喷发产生的角砾流组成的岩石,其主要成分和特征是由熔岩经过快速冷却和凝固形成的。
以下是关于火山角砾岩的矿物成分的参考内容:火山角砾岩的主要矿物成分包括:1. 辉石:辉石是一种具有较高硅酸盐含量的矿物,主要由双辉石、斜辉石和角闪石等组成。
这些辉石通常呈现出黑色或绿色,并具有晶体形状和亮度。
2. 斜长石:斜长石是一种主要由钠和钾组成的矿物。
它通常呈现出灰白色或粉红色,并具有块状或片状的晶体形状。
3. 石英:石英是一种硅酸盐矿物,常见于火山岩中。
它通常呈现出白色、透明或半透明,以块状或晶体形式存在。
4. 长石:长石是一种主要由钾、钠或钙组成的矿物。
在火山角砾岩中,常见的长石有斜长石和正长石,其颜色通常为白色或粉红色。
5. 磷灰石:磷灰石是一种磷酸盐矿物,通常呈现出柠檬黄色或绿色。
它在火山角砾岩中的含量较少,但有时可以发现其微小晶体。
6. 磁铁矿:磁铁矿是一种黑色或灰色的氧化铁矿物,经常出现在火山岩中。
它具有磁性,并且通常以粒状或块状形式存在。
除了上述主要矿物成分外,火山角砾岩中还可能包含一些次要或微量的矿物,如斜方辉石、铁镁铝榴石、赤铁矿等。
关于火山角砾岩的矿物成分的参考内容还可以包括以下方面:1. 矿物成分的特征描述:如颜色、晶体形态、硬度、光泽等;2. 矿物成分的化学成分:例如主要含有的元素,如硅、铝、钙等;3. 矿物成分的有机质含量:火山角砾岩中可能还存在一些有机质,如木质残骸或植物炭化物;4. 矿物成分对火山角砾岩岩石学性质的影响:例如影响岩石的颜色、强度、抗风化性等;5. 矿物成分的起源和形成过程:火山角砾岩的主要矿物成分是在火山活动中由熔岩快速冷却凝固形成的,可以进一步描述这一过程。
总之,火山角砾岩的矿物成分是研究该岩石的重要内容之一,详细描述这些矿物的性质和特征有助于了解火山角砾岩的形成和演化过程。
辉石中的cu含量

辉石中的cu含量
辉石是一种常见的矿物,它通常含有一定量的铜(Cu)。
铜是一种重要的金属,在工业、电子、建筑等领域都有广泛的应用。
因此,对于辉石中的铜含量进行研究具有重要的实际意义。
辉石的化学式为(Mg,Fe)2SiO4,其中Mg和Fe可以相互替代。
由于铜的原子半径与Mg和Fe的原子半径相近,因此铜可以与Mg和Fe相互替代,成为辉石中的杂质。
辉石中的Cu含量通常在几百ppm至几千ppm之间。
其含量与辉石的成因、地质环境等因素有关。
例如,在岩浆岩中辉石中的Cu含量通常较高,而在变质岩中辉石中的Cu含量通常较低。
对于辉石中的Cu含量进行研究可以为矿床勘探、资源评价等提供重要参考。
同时,也可以为铜的提取、利用等方面的研究提供理论基础。
因此,辉石中的Cu含量研究具有重要的意义和价值。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、辉石等矿物的电子探针分析值中Fe3+含量的估算及晶体化学式
计算
①电价差值法
由于矿物中阳离子正电价总数与阴离子负电价总数应平衡,而电子探针得出的FeO*值把Fe3+也当成了Fe2+,因此分子式中的阳离子总电价必然低于理论电价。
据此差值则可求出Fe3+含量,即:
Fe3+ =理论电价-计算电价
Fe2+=FeO*-Fe3+
计算步骤:
A、按阳离子法计算出矿物各阳离子系数;
B、算出阳离子总电价,该电价与理论电价之差即为的Fe3+阳离子系数;
C、据分子式由Fe3+求出Fe2O3含量(重量%)
D、由Fe2+=FeO*-Fe3+求出Fe2+的阳离子系数并求出FeO含量。
下面以辉石为例,计算电子探针数据中的Fe2+和Fe3+:
2+3+
Fe3+=理论电价-计算电价=12-11.7858=0.2142
Fe2+=Fe总-Fe3+=0.3880-0.2142=0.1738
Fe2O3=0.2142÷(4/1.7941)÷2×159.7=7.67% FeO=0.1738 ÷(4/1.7941)×71.85=5.60%
②剩余氧计算法:
对于含变价Fe的矿物,电子探针分析值以FeO*形式给出全铁含量。
把Fe2O3换算成FeO的关系式为:Fe2O3=2FeO+Ox(Ox表示剩余氧)
可见由于Fe3+和Fe2+的价态差异,在换算过程中损失了部分氧(剩余氧,用Ox表示),即FeO*中未包含剩余氧Ox。
对于阳阴离子总数有固定比值的矿物,如辉石为4:6,石榴石为8:12,钛铁矿为2:3等,可由电子探针分子值分别算出阳、阴离子总数,又可据其理论比值算出理论阴离子总数。
理论阴离子总数与计算阴离子总数之差则为剩余氧Ox。
由于Fe2O3=2FeO+Ox,所以Fe2O3的分子数与Ox原子数相同,将其乘以Fe2O3的分子量就得出的Fe2O3百含分量。
2+3+
计算阳离子总数=1.7941≈理论阳离子总数计算阴离子总数=2.6432
理论比值:理论阳离子总数/理论阴离子总数=4/6 理论阴离子总数=6/4×1.7941=2.6912 剩余氧Ox =理论阴离子总数-计算阴离子总数=2.6912-2.6432=0.048
因为Fe2O3的分子数与Ox原子数相同,所以Fe2O3=0.048×159.70(Fe2O3的分子量)=7.67%
因为2Fe/(Fe2O3):(Fe/FeO)=0.8998(Fe2O3与中FeO含Fe量之比)
即FeO=0.8998×Fe2O3(等量Fe由Fe2O3形式换算成FeO形式)
所以FeO=FeO*-0.9 Fe2O3 =12.5-0.9×7.67%=5.60%
③通用公式计算法(Droop,1987)
原理:如果Fe是矿物中唯一的变价元素,则单位分子式中Fe3+的系数可以依据如下原理计算出来(1)若氧是唯一的阴离子,则阳离子正电价之和是氧原子数的2倍;(2)单位分子式中阳离子的总数符合理论化学计量系数;按照晶体化学原理,Fe3+与其他元素的含量具有确定的函数关系。
Droop(1987)根据上述原理,推导出计算铁镁硅酸盐和氧化物Fe3+的通用公式为:F=2X(1-T/S);其中X为分子式中的氧原子数;T为阳离子的理论数目;S为将Fe均作为Fe2+时的阳离子数;F为分子式中Fe3+的系数。
该式适用的矿物包括:铝榴石、钙榴石、铝酸盐尖晶石、磁铁矿、辉石、硬绿泥石和钛铁矿。
部分矿物的X和T值
计算步骤:
(1)由电子探针结果(wt%),计算以X个O为基准,全Fe作为Fe2+的离子系数。
(2)计算S值(将Fe均作为Fe2+时的阳离子数(各阳离子系数之和));如果S>T,
进入下一步计算,否则所有的Fe均应为Fe2+。
(3)由F=2X(1-T/S)计算的Fe3+系数(X为分子式中的氧原子数,T为分子式中阳
离子的理论数目)。
(4)各阳离子系数×T/S,将离子系数标定为T个阳离子的分子式单位。
(5)如果F< 经标定的全Fe离子数,则按Fe3+=F,剩余的Fe作为Fe2+,写出分
子式。
否则,所有的Fe均应为Fe3+。
(6)计算wt(FeO)(%)=wt(FeO*)×Fe2+/(Fe2++Fe3+)
O3)(%)= 1.1111×wt(FeO*)×Fe3+/(Fe2++Fe3+)
wt(Fe
F=2X(1-T/S)=2×6×(1-4/4.072)=2.122
若F小于标定的全Fe离子数,按Fe3+=F,剩余的Fe作为Fe2+,写出分子式。
否则,所有的Fe均应为Fe3+。
Fe3+=0.2122;
Fe2+=0.388-0.2122 =0.1756
wt(FeO)(%)=wt(FeO*)×Fe2+/(Fe2++Fe3+)=12.5×0.1756/0.388=5.66%
Wt(Fe2O3)(%)= 1.1113×wt(FeO*)×Fe3+/(Fe2++Fe3+)=7.6%
2、角闪石族矿物的Fe 3+的估算和晶体化学式计算
角闪石的化学通式:
A 0-1(A)X 2(M 4)Y 5(M 1M 2M 3)[T 4O 11]2(OH)2 A:Na K
X:Na Ca Mn 2+ Fe 2+ Mg 2+
Y:Al 3+ Fe 3+ Ti 4+ Mn 2+ Mg 2+ Fe 2+
T: Si 4+ Al 3+
由于角闪石没有固定的阳离子数,因此用于计算辉石族Fe 3+含量的电价差值法、剩余氧计算法都不适用。
目前常按照理想配比,分别计算Fe 3+最大值和最小值, Fe 3+的真实值被限定在此范围内。
A =1(即A 位被K Na 充满)时,反映处于最强还原状态, Fe 3+为最小值。
即迫使K Na 进入A 位,则Ca 以上的阳离子总数应等于15,此时计算的Fe 3+为最小值。
A =0时,反映处于最强氧化状态, Fe 3+为最大值。
即A 位空缺,K Na 进入M4位,则全部阳离子总数应该为15,据此计算的Fe 3+为最大值。
角闪石Fe3+的计算步骤:
如果所有Fe3+最小值计算的标准化因子(8Si,16CAT,全部Fe2+,15eNK)都大于Fe3+最大值计算的标准化因子(8SiAl ,15eK,10∑Fe3+,13eCNK)的话,那么Fe3+的最小值和最大值可以计算出来,否则,不能进行Fe3+的最小值、最大值的计算。
2、计算角闪石Fe3+最小值时的标定系数α
在四个标准化因子(8Si,16CAT,全部Fe2+,15eNK)中选最小值进行Fe3+最小值的计算。
如果这四个参数都大于1.0000,那么下限为Fe3+=0.0000。
在本例中,15eNK值最小,用于Fe3+最小值的计算。
3、计算角闪石Fe3+最大值时的标定系数β
四个标准化因子(8SiAl ,15eK,10∑Fe3+,13eCNK)中的最大值被用于计算Fe3+最大值。
如果8SiAl、15eK、13eCNK都小于全部Fe3+的值,那么全部Fe3+则用于计算Fe3+最大值。
在本例中,15eK为四个参数中的最大值,被用于计算Fe3+最大值。
4、在估算角闪石电子探针分析值中的三价铁含量时,通常取中间值,中间值的估算方法是:
取估算最大值和最小值时的标定系数的平均值((α+β)/ 2 ),重新计算表中第8-9列的值。
该例中为(0.99714+0.98621)/2=0.99167,用该值重新计算表中第8-10列的值。
3+
α=15/15.043=0.99714 Fe=(23-22.9337)×2=0.1326(0.133, 电价差值法求)Fe=Fe-0.1326=0.8854-0.1326=0.7528 (0.753)
角闪石Fe3+最大值的计算。
