总碱度计算公式
24滴定法测定总碱度原始记录
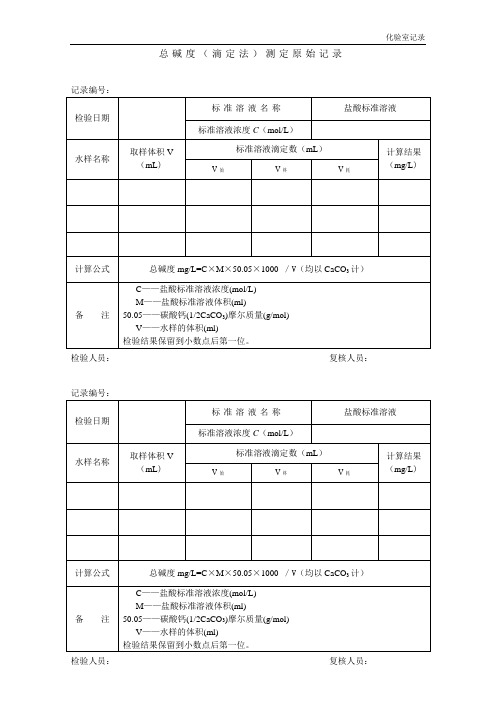
总碱度(滴定法)测定原始记录
记录编号:
检验日期
标准溶液名称
盐酸标准溶液
标准溶液浓度C(mol/L)
水样名称
取样体积V(mL)
标准溶液滴定数(mL)
计算结果(mg/L)
V始
V终
V耗
计算公式
总碱度mg/L=C×M×50.05×1000/V(均以CaCO3计)
备注
C——盐酸标准溶液浓度(mol/L)
V始
V终
V耗
计算公式
总碱度mg/L=C×M×50.05×1000/V(均以CaCO3计)
备注
C——盐酸标准溶液浓度(mol/L)
M——盐酸标准溶液体积(ml)
50.05水样的体积(ml)
检验结果保留到小数点后第一位。
检验人员:复核人员:
M——盐酸标准溶液体积(ml)
50.05——碳酸钙(1/2CaCO3)摩尔质量(g/mol)
V——水样的体积(ml)
检验结果保留到小数点后第一位。
检验人员:复核人员:
记录编号:
检验日期
标准溶液名称
盐酸标准溶液
标准溶液浓度C(mol/L)
水样名称
取样体积V(mL)
标准溶液滴定数(mL)
计算结果(mg/L)
碱灰中总碱度的测定实验报告

碱灰中总碱度的测定实验报告一、实验目的1、掌握酸碱滴定的基本原理和操作方法。
2、学会用双指示剂法测定碱灰中总碱度。
3、熟练使用酸式滴定管、移液管和容量瓶等实验仪器。
二、实验原理碱灰是工业上常用的碱性混合物,其主要成分可能包括碳酸钠(Na₂CO₃)、碳酸氢钠(NaHCO₃)和氢氧化钠(NaOH)等。
测定总碱度时,通常采用双指示剂法,即先以酚酞作指示剂,用盐酸标准溶液滴定至溶液由红色变为无色,此时反应的是碳酸钠被滴定为碳酸氢钠,以及氢氧化钠被完全中和;再加入甲基橙指示剂,继续用盐酸标准溶液滴定至溶液由黄色变为橙色,此时碳酸氢钠被完全滴定。
相关化学反应方程式如下:以酚酞为指示剂:Na₂CO₃+ HCl = NaHCO₃+ NaClNaOH + HCl = NaCl + H₂O以甲基橙为指示剂:NaHCO₃+ HCl = NaCl + CO₂↑ + H₂O三、实验仪器与试剂1、仪器酸式滴定管(50mL)、移液管(25mL)、容量瓶(250mL)、锥形瓶(250mL)、玻璃棒、烧杯、分析天平。
2、试剂(1)盐酸标准溶液(约 01mol/L):准确吸取一定量的浓盐酸,用蒸馏水稀释并标定。
(2)酚酞指示剂(1%乙醇溶液):称取 1g 酚酞,溶于 100mL 乙醇中。
(3)甲基橙指示剂(01%水溶液):称取 01g 甲基橙,溶于100mL 蒸馏水中。
(4)碱灰试样。
四、实验步骤1、盐酸标准溶液的标定准确称取一定量的基准物质无水碳酸钠(预先在 270 300℃下烘干2 3 小时),置于 250mL 锥形瓶中,加入约 50mL 蒸馏水溶解,加入 1 2 滴甲基橙指示剂,用待标定的盐酸溶液滴定至溶液由黄色变为橙色,即为终点。
记录消耗的盐酸溶液体积,平行标定三份,计算盐酸标准溶液的浓度。
2、碱灰试样的处理准确称取碱灰试样约 15 20g 于小烧杯中,用少量蒸馏水溶解,然后转移至 250mL 容量瓶中,用蒸馏水冲洗烧杯数次,一并转入容量瓶中,加水稀释至刻度,摇匀。
三种碱度计算表如何理解
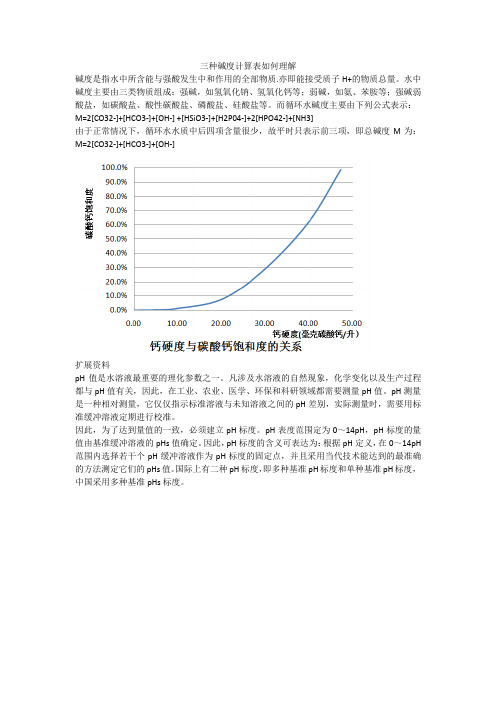
三种碱度计算表如何理解
碱度是指水中所含能与强酸发生中和作用的全部物质.亦即能接受质子H+的物质总量。
水中碱度主要由三类物质组成:强碱,如氢氧化钠、氢氧化钙等;弱碱,如氨、苯胺等;强碱弱酸盐,如碳酸盐、酸性碳酸盐、磷酸盐、硅酸盐等。
而循环水碱度主要由下列公式表示:M=2[CO32-]+[HCO3-]+[OH-] +[HSiO3-]+[H2P04-]+2[HPO42-]+[NH3]
由于正常情况下,循环水水质中后四项含量很少,故平时只表示前三项,即总碱度M为:M=2[CO32-]+[HCO3-]+[OH-]
扩展资料
pH值是水溶液最重要的理化参数之一。
凡涉及水溶液的自然现象,化学变化以及生产过程都与pH值有关,因此,在工业、农业、医学、环保和科研领域都需要测量pH值。
pH测量是一种相对测量,它仅仅指示标准溶液与未知溶液之间的pH差别,实际测量时,需要用标准缓冲溶液定期进行校准。
因此,为了达到量值的一致,必须建立pH标度。
pH表度范围定为0~14pH,pH标度的量值由基准缓冲溶液的pHs值确定。
因此,pH标度的含义可表达为:根据pH定义,在0~14pH 范围内选择若干个pH缓冲溶液作为pH标度的固定点,并且采用当代技术能达到的最准确的方法测定它们的pHs值。
国际上有二种pH标度,即多种基准pH标度和单种基准pH标度,中国采用多种基准pHs标度。
碱度计算公式

碱度计算公式
碱度(alkalinity)是指水中溶解阴离子总数的量化指标。
碱度指标可以反映水中阴离子的种类和含量,是衡量水质稳定性的重要指标。
它的计算主要是利用微量元素的水解反应,通过测定水样中的CO2和氯离子的含量来估算:
碱度=CO2×50+HCl碱度。
其中,CO2表示水样中的碳酸态二氧化碳,HCl碱度表示水样中的氯离子含量,它们的乘数50和35分别是反应的指数。
当水样中含有其他阴离子,如硫酸根、氨基组份、硝酸根、硫酸铵、硝酸钠等时,也可以通过测量每种盐类含量,求出一个总和:碱度=CO2×50+HCl碱度+其他阴离子综合碱度。
因此,碱度计算公式可以表示为:
碱度=CO2×50+HCl碱度+常量A×S1+常量B×S2+……+常量
C×S3。
其中,S1,S2,S3分别为水样中各种盐类的含量,A,B,C为常量,可以根据条件选择相应的反应系数进行计算。
总碱度计算公式范文

总碱度计算公式范文总碱度是指溶液中存在的所有碱性物质的总量,可以通过计算溶液中各种碱性物质的摩尔浓度并相加得到。
下面介绍几种常见的碱性物质的计算方法:1.强碱的计算:强碱是指在水溶液中完全离解的碱性物质,如氢氧化钠(NaOH)、氢氧化钾(KOH)等。
对于强碱,可以直接通过摩尔浓度计算总碱度。
例如,如果溶液中含有0.1 mol/L的NaOH和0.05 mol/L的KOH,则总碱度为0.1 mol/L + 0.05 mol/L = 0.15 mol/L。
2.弱碱的计算:弱碱是指在水溶液中部分离解的碱性物质,如氨水(NH3(aq))、碳酸氢钠(NaHCO3)等。
对于弱碱,需要考虑其离解程度,通过酸碱反应的平衡常数(Ka)来计算。
以氨水为例,其平衡反应为:NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH-(aq)平衡常数Ka表示离解程度,可以通过实验测定或查阅相关资料获得。
假设NH3的浓度为C mol/L,OH-的浓度为x mol/L,则NH4+的浓度也为x mol/L。
根据平衡常数的定义,有:Ka=[NH4+][OH-]/[NH3]由于NH4+和OH-的浓度相等,上式可以简化为:Ka=x^2/C解这个方程可以得到OH-的浓度x,进而计算出NH3的离解度。
最后,将溶液中各种弱碱的摩尔浓度相加,即可得到总碱度。
3.酸碱中和反应的计算:在酸碱中和反应中,酸和碱的摩尔比决定了反应的终点。
通过测定反应中酸和碱的摩尔比,可以计算出总碱度。
例如,如果1 mol的盐酸(HCl)与2 mol的氢氧化钠反应,生成1 mol的氯化钠和1 mol的水,那么总碱度为2 mol。
需要注意的是,在计算总碱度时,需要考虑到溶液中的其他酸碱反应,如酸性物质与碱性物质的中和反应。
在此基础上,可以使用上述方法计算出总碱度。
总之,计算总碱度需要考虑溶液中各种碱性物质的摩尔浓度,并根据其性质选择合适的计算方法。
关于碱度

对于多数天然水样,碱性化合物在水中产生的碱度,有五种情形。
令:一酚酞作指示剂时滴定至颜色变化消耗盐酸为Pml ,再以甲基橙作指示剂时消耗盐酸Mml ,则盐酸标准溶液总的消耗量为T=M+P 。
第一种情形,P=T 或M=0时: P 代表全部氢氧化物的一半,偶遇M=0,表示不含碳酸盐,亦不含重碳酸盐。
因此,P=T=氢氧化物。
第二种情形,P>1/2T 时:说明M>0,有碳酸盐存在,且碳酸盐=2M=2(T-P)。
而且由于P>M ,说明有氢氧化物存在,氢氧化物=2(T-P)=2P-T 。
第三种情形,P=1/2T ,即P=M 时: M 代表碳酸盐的一半,说明水中仅有碳酸盐。
碳酸盐=2P=2M=T 。
第四种情形,P<1/2T 时:此时M.P ,因此M 除代表由碳酸盐生成的重碳酸盐外,尚有水中原有的重碳酸盐。
碳酸盐=2P ,重碳酸盐=T-2P 。
第五种情形,P=0时:此时,水中只有重碳酸盐存在。
重碳酸盐=T=M 。
碱度的组成滴定的结果 氢氧化物(OH)- 碳酸盐(CO 32-) 重碳酸盐(HCO 3-) P=T P 0 0 P>1/2T 2P-T 2T-P 0 P=1/2T 0 2P 0 P<1/2T 0 2P T-2P P=0 0 0 T按下述公式计算各种情况下总碱度、碳酸盐、重碳酸盐的含量。
(1) 总碱度(以CaO 计,mg/L )=100004.28)(⨯⨯+VM P C总碱度(以CaCO 3计,mg/L )=100005.50)(⨯⨯+VM P C(2) 当P=T 时,M=0 碳酸盐(CO 32-)=0 重碳酸盐(HCO 3-)=0(3) 当P>1/2T 时碳酸盐碱度(以CaO 计,mg/L )=100004.28)P T (⨯⨯-VC碳酸盐碱度(以CaCO 3计,mg/L )=100005.50)P T (⨯⨯-VC碳酸盐碱度(1/2 CO 32-,mol/L )=1000)P T (⨯-VC重碳酸盐(HCO 3-)=0 (4) 当P=1/2T 时,P=M碳酸盐碱度(以CaO 计,mg/L )=100004.28P ⨯⨯*VC酸盐碱度(以CaCO 3计,mg/L )=100005.50P ⨯⨯*VC碳酸盐碱度(1/2 CO 32-,mol/L )=1000P⨯*VC重碳酸盐(HCO 3-)=0 (5) 当P<1/2T 时,P=M碳酸盐碱度(以CaO 计,mg/L )=100004.28P ⨯⨯*VC酸盐碱度(以CaCO 3计,mg/L )=100005.50P ⨯⨯*VC碳酸盐碱度(1/2 CO 32-,mol/L )=1000P⨯*V C重碳酸盐碱度(以CaO 2,mg/L )=100004.28P)2⨯⨯-⨯V T C (重碳酸盐碱度(以CaCO 3计,mg/L )=100005.50P)2⨯⨯-⨯VT C (重碳酸盐碱度(HCO 3-,mol/L )=1000P)2⨯-⨯VT C ((6) 当P=0时碳酸盐碱度(以CaO 计,mg/L )=100004.28M ⨯⨯*VC酸盐碱度(以CaCO 3计,mg/L )=100005.50M ⨯⨯*VC重碳酸盐碱度(HCO 3-,mol/L )=1000M⨯*VC。
总碱度核算

日处理量Q:80000m³/d 进水B OD100mg/L 进水氨氮57.2mg/L 进水碱度105mg/L 进水总氮78.5mg/L 出水BOD20mg/L 出水氨氮25mg/L 曝气池出水碱度136mg/L 出水总氮55mg/L硝化过程中需要的碱度量可按下式计算:碱度=7.14×Q ΔCNH3-N×10—3 (1)式中:Q为进入滤池的日平均污水量,m3/d;ΔCNH3-N为进出滤池NH3-N浓度的差值,mg/L;7.14为硝化需碱量系数,kg碱度/kgNH3-N。
对于含氨氮浓度较高的工业废水,通常需要补充碱度才能使硝化反应器内的pH值维持在7.2~8.0之间。
计算公式如下: 碱度=K×7.14×Q ΔCNH3-N×10—3 (2)式中,K为安全系数,一般为1.2~1.3。
要使生物硝化顺利进行,必须满足下式:ALKw+ALKc+ALKf>ALKN+AlKE (3)如果碱度不足,要使硝化顺利进行,则必须投加纯碱,补充碱度。
投加的碱量可按下式计算:ΔALK=(ALKN+ALKE)—(ALKw+ALKc+ALKf) (4)式中:ΔALK为系统应补充的碱度,mg/L;ALKN 为生物硝化消耗的碱量;ALKN一般按硝化每kgNH3-N消耗7.14kg碱计算。
ALKF 为生物反硝化产生的碱量;ALKF一般按反硝化每kgNO3-N产生3.57kg碱计算。
ALKE 为混合液中应保持的碱量,ALKE一般按曝气池排出的混合液中剩余50mg/L碱度(以Na2CO3计)计算。
ALKw 为原污水中的总碱量;ALKc 为BOD5分解过程中产生的碱量;ALKc与系统的SRT有关系:当SRT>20d时,可按降解每千克BOD5产碱0.1kg计算;当SRT=10~20d时,按0.05kgALK/kgBOD5;当SRT<10d时,按0.01gALK/kgBOD5。
碱度校核7.14mg碱度;0.1mg碱度;3.57mg碱度;原水中碱度为ALKw=8400Kg/d分解BOD产生碱度ALKc=640Kg/d (以泥龄为20d计)生物硝化消耗碱度ALKN=18392.64Kg/d 生物反硝化产生的碱度ALKf=6711.6Kg/d 曝气池排出碱度ALKE=10880Kg/d 按曝气池排出液中剩余50mg/L碱度计算ALKw+ALKc+ALKf=15751.6Kg/dALKN+ALKE=29272.64Kg/d结果判定:ALKw+ALKc+ALKf ≯ALKN+ALKE处理意见:该硝化系统内碱源不足。
水质总碱度检测方法

编写:郑金兰 翁春海编号: Q/SBJ4(品)-3.28-2010 版本:2.0第1页共3页 名称: 水质总碱度检测方法 发布日期: 保 密水质总碱度检测方法1.目的本方法规定了用酸式滴定法测定工厂生产用水及生活饮用水的总碱度。
2.范围适用于工厂所有生产用水及生活饮用水。
3.原理碱度是水介质与氢离子反应的定量能力,通过用强酸标准溶液将一定体积的水样滴定至pH值为4.0所测得的碱度称为总碱度.测定结果用相当于碳酸钙的质量浓度,mg/L 为单位表示。
4.安全及环保要求4.1. 配制化学品试剂及检测过程,遵照MSDS 要求佩戴耐酸碱手套、防烫手套。
5.试剂5.1. 0.5g/L 甲基橙指示剂:称取0.050g 甲基橙溶于,70℃的纯水中冷却定容至100ml 。
此试剂贮存于棕色玻璃瓶中,有效期3个月5.2. 0.05mol/L 盐酸标准溶液:吸取4.2mL 盐酸(ρ20=1.19g/mL ),稀释至1000mL 。
此试剂贮存于玻璃瓶中,有效期2个月。
按下述方法标定:5.3. 称取在2500C 烘箱中烘干过的无水碳酸钠0.1~0.2克于250mL 锥形瓶中,加50mL 纯水溶解,加4滴甲基橙指示剂,用配制的盐酸溶液滴定至溶液由黄色突变为橙色。
同时做空白试验。
计算公式:c(HCl)= 0()0.05299m V V -⨯ 式中:c(HCl)—盐酸标准溶液的浓度,mol/L ;m —碳酸钠的质量,g ;V —滴定碳酸钠所消耗盐酸标准溶液的体积,mL ;Vo —空白试验消耗盐酸标准溶液的体积,mL 。
0.05299—与1.00mL 盐酸标准溶液[c(HCl)=1.000mol/L]相当的以克表示的碳酸钠的质量。
编写:郑金兰 翁春海编号: Q/SBJ4(品)-3.28-2010 版本:2.0第1页共3页 名称: 水质总碱度检测方法 发布日期: 保 密6.仪器6.1. 25mL 滴定管6.2. 50mL 移液管6.3. 250mL 锥形瓶7.操作规程7.1. 吸取50.00mL 水样于250mL 锥形瓶中,加4滴甲基橙指示剂,用盐酸标准溶液滴定至试液由黄色突变为橙色。
碱度的测量方法

总碱度、游离碱度的测定方法
本法采用酸碱度滴定法。
取试样10mL,用0.1mol/L盐酸标准溶液滴定,所消耗的毫升数用点表示。
㈠试剂
盐酸:0.1mol/L标准溶液(按GB/T601配制和标定);
溴酚兰指示剂:1g溶于1000mL的20%乙醇中;
酚酞指示剂:1%乙醇溶液。
㈡试验方法
①总碱度的测定
用移液管吸取10mL试液于250mL锥形瓶中,用100mL蒸馏水,加3-4滴溴酚兰指示剂,用盐酸标准溶液滴定由兰紫色变为黄色即为终点,记下消耗盐酸标准溶液毫升数A。
②游离碱度的测定
用移液管吸取10mL试液于250mL锥形瓶中,用100mL蒸馏水,加3-4滴酚酞指示剂。
用盐酸标准溶液滴定由粉红色变为无色即为终点,记下消耗盐酸标准溶液毫升数B。
㈢计算方法
碱度按下列公式计算:
总碱度(点)= A
游离碱度(点)= B
式中:A、B——滴定时耗去盐酸标准溶液毫升数,mL;
C——盐酸标准溶液浓度,mol/L;
V——取样毫升数,mL。
温州龙飞清洗剂有限公司是金属表面处理技术集研究、生产、销售、服务为一体的高新科技企业,致力于金属表面清洗和防腐工程,主要经营各种金属表面除油剂、脱脂剂、除锈剂、表调剂、磷化液、退塑脱漆剂、除蜡水、防锈水防锈油、封闭剂、钝化剂、发黑剂、着色剂、化学抛光剂、合成乳化剂、水处理剂等金属表面处理剂,广泛适用于产品的喷塑、喷漆、喷砂、电泳、电镀前的表面处理以及表面终处理,现已涉通用机械零部件、汽摩配件、五金及电工工具、电器电脑、洁具阀门、教学仪器等。
总碱值计算

总碱值计算
摘要:
一、总碱值的概念
二、总碱值的计算方法
1.滴定法
2.电位滴定法
三、总碱值在实际应用中的意义
四、总碱值测定的影响因素
五、总结
正文:
总碱值(total alkalinity,TA)是指水中能与酸作用,使酸度计的pH 值上升至8.3 的物质总量,以mg/L 为单位表示。
总碱值是评估水体的缓冲能力和水质的重要指标,对于水体的生态环境保护和水质监测具有重要意义。
总碱值的计算方法主要有两种:滴定法和电位滴定法。
1.滴定法:滴定法是根据酚酞指示剂的颜色变化来判断终点,从而计算总碱值的方法。
首先,将一定体积的水样与酚酞混合,用标准盐酸溶液滴定至终点。
然后,根据盐酸溶液的体积和浓度计算出总碱值。
2.电位滴定法:电位滴定法是利用电位计测量溶液的pH 值变化,从而计算总碱值的方法。
首先,将一定体积的水样放入电位计中,加入酚酞作为指示剂。
然后,用标准盐酸溶液滴定至终点,记录此时的pH 值变化。
最后,根据pH 值变化和滴定体积计算总碱值。
总碱值在实际应用中具有重要意义。
例如,在饮用水处理过程中,控制总碱值有利于保证水的口感和防止腐蚀;在废水处理过程中,总碱值测定有助于评估废水处理效果和优化处理工艺;在湖泊、水库等水体的生态环境监测中,总碱值是评估水体缓冲能力的重要参数。
总碱值测定的影响因素主要包括:水样采集和保存过程中的条件、滴定过程中的操作技巧、仪器设备的准确性和稳定性等。
为了保证测量结果的准确性,需要严格控制这些影响因素。
碱度含盐量计算公式

碱度含盐量计算公式在水质监测和环境保护中,碱度和含盐量是两个重要的指标。
碱度是指水中碱性物质的含量,而含盐量则是指水中盐类物质的含量。
这两个指标对于评估水质的好坏和适用性具有重要意义。
因此,了解如何计算碱度和含盐量是非常重要的。
首先,我们来看一下碱度的计算公式。
碱度通常是以碳酸盐的形式存在于水中的,因此碱度的计算公式为:碱度(mg/L)= 50.04 ×(碳酸盐的浓度)×(分子量比例)。
其中,碳酸盐的浓度是指水中碳酸盐的含量,单位通常为mg/L。
分子量比例是指碳酸盐中碳酸根离子(CO3)与碱度的比例,通常为1。
50.04是碳酸盐的摩尔质量。
接下来,我们来看一下含盐量的计算公式。
含盐量通常是以氯化物的形式存在于水中的,因此含盐量的计算公式为:含盐量(mg/L)= 35.45 ×(氯化物的浓度)×(分子量比例)。
其中,氯化物的浓度是指水中氯化物的含量,单位通常为mg/L。
分子量比例是指氯化物中氯离子(Cl)与氯化物的比例,通常为1。
35.45是氯化物的摩尔质量。
通过以上两个公式,我们可以计算出水样中的碱度和含盐量。
这些数据可以帮助我们评估水质的好坏,并采取相应的措施来改善水质。
除了计算公式外,我们还需要注意一些影响碱度和含盐量的因素。
首先是水源的不同,不同的水源中碱度和含盐量会有所不同。
其次是人类活动的影响,例如工业废水和农业排放会导致水中碱度和含盐量的增加。
此外,气候和地质条件也会对水质产生影响。
在实际工作中,我们可以通过采集水样并进行化验来获取水中的碱度和含盐量数据。
然后根据上述公式进行计算,最终得出水质的评估结果。
这些数据可以为环境保护和水资源管理提供重要的参考依据。
总之,了解碱度和含盐量的计算公式以及影响因素对于水质监测和环境保护至关重要。
通过科学的方法和技术,我们可以更好地评估和改善水质,保护环境和人类健康。
希望本文能够对大家有所帮助,谢谢阅读!。
总碱度计算公式

水的碱度是指水中能够接受[H+]离子与强酸进行中和反应的物质含量.水中产生碱度的物质主要由碳酸盐产生的碳酸盐碱度和碳酸氢盐产生的碳酸氢盐碱度,以及由氢氧化物存在而产生的氢氧化物碱度.所以,碱度是表示水中CO32-、HCO3-、OH-及其它一些弱酸盐类的总合.这些盐类的水溶液都呈碱性,可以用酸来中和.然而,在天然水中,碱度主要是由HCO3-的盐类所组成.形成水中碱度的物质碳酸氢盐可以共存,硫酸盐和氢氧化物也可以共存.然而,碳酸氢盐与氢氧化物不能同时存在,它们在水中能起如下反应:HCO3-+ OH-=CO32-+ H2O由此可见,碳酸盐、碳酸氢盐、氢氧化物可以在水中单独存在之外,还有两种碱度的组合,所以,水中的碱度有五种形式存在,即:(1)碳酸氢盐碱度HCO32-;(2)碳酸盐碱度CO32-;(3)氢氧化物碱度OH-;(4)碳酸氢盐和碳酸盐碱度HCO3-+ CO32-;(5)碳酸盐和氢氧化物碱度CO32-+ OH-.水中各种碱度的相互关系如何?水中的碱度是用盐酸中和的方法来测定的.在滴定水的碱度时采用两种指示剂来指示滴定的终点.用酚酞作指示剂时,滴定的终点为PH8.8.4,称为酚酞碱度或P碱度.此时,水中的氢氧化物全部被中和,并有一半的碳酸盐转化为碳酸氢盐.即P碱度=1/2 CO32-+ 全部OH-.用甲基橙作指示剂时,滴定的终点pH为4.4.5,称为甲基橙碱度或M 碱度.此时,水中的氢氧化物、碳酸盐及碳酸氢盐全部被中和,所测得的是水中各种弱酸盐类的总和,因此又称为总碱度.即M碱度=全部HCO32-+ 全部CO32-+ 全部OH- .如果水中单独存在OH-碱度,水中pH>11.0;水中同时存在OH-、CO32-时,PH9.11.0;如水中只有CO32-存在时,pH=9.4;当CO32-、HCO3-共同存在时,PH8.9.4;单一的HCO3-其存在范围是pH=8.3;但pH<8.3时,如水中碱度只有HCO3-存在,此时的pH值变化只与HCO3-和游离的CO2含量有关.你现在的PH都是小于8.3的,所以碳酸根离子不需要考虑.OH-浓度好算,按照一般水的离子积常数计算就是了.PH=8的就是10^-6mol/L,PH=7的就是10^-7mol/L.由于只考虑碳酸氢根离子引起的碱度,所以也就等于水的总碱度,即前一个碳酸氢根离子浓度是1.5mol/L,后一个碳酸氢根离子浓度是2.5mol/L.。
循环冷却水中pH值及碱度计算
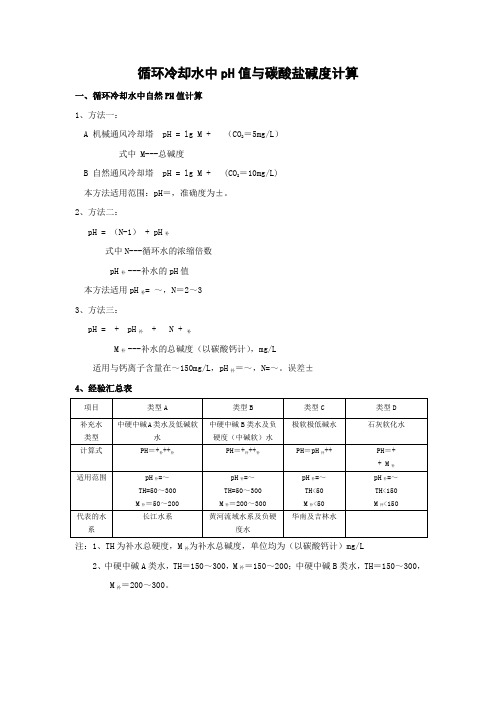
循环冷却水中pH值与碳酸盐碱度计算
一、循环冷却水中自然PH值计算
1、方法一:
A 机械通风冷却塔 pH = lg M + (CO2=5mg/L)
式中 M---总碱度
B 自然通风冷却塔 pH = lg M + (CO2=10mg/L)
本方法适用范围:pH=,准确度为±。
2、方法二:
pH = (N-1) + pH补
式中N---循环水的浓缩倍数
pH补---补水的pH值
本方法适用pH补= ~,N=2~3
3、方法三:
pH = + pH补 + N + 补
M补---补水的总碱度(以碳酸钙计),mg/L
适用与钙离子含量在~150mg/L,pH补=~,N=~。
误差±
4、经验汇总表
注:1、TH为补水总硬度,M补为补水总碱度,单位均为(以碳酸钙计)mg/L
2、中硬中碱A类水,TH=150~300,M补=150~200;中硬中碱B类水,TH=150~300,
M补=200~300。
二、敞开式循环冷却水中的碱度计算 1、计算公式 lgM = pH –
式中 M---循环水的碱度 2、BETZ 公司整理的对应数据
3、国内整理的经验参数
注:1、M 为循环水总碱度,mg/L (以碳酸钙计)
2、pH 为循环水的pH 值,当pH 等于自然pH 时,计算所得M 为自然pH 值时的总碱度。
4、循环水的pH-M 关系
说明:对于已经投产的系统,可以累计其相关参数并归纳成该装置的曲线图,供日后参考适用。
总碱度计算公式

总碱度计算公式通过计算CaCO3的消耗量从而算出所消耗的氢离子的量,进而算出总碱度。
总碱度mg/L=V*c*50.04*1000/V0V--滴定消耗HCl或硫酸的体积c--HCl或硫酸的浓度V0--水样的体积50.04--1mL浓度为1mol/LHCl相当于CaCO3的质量即化学计量数2H+--CaCO3,2个氢离子与一个碳酸钙反应计算时碳酸钙的摩尔质量要除以2水碱度是指水中能够接受[H+]离子与强酸进行中和反应的物质含量。
水中产生碱度的物质主要由碳酸盐产生的碳酸盐碱度和碳酸氢盐产生的碳酸氢盐碱度,以及由氢氧化物存在而产生的氢氧化物碱度。
所以,碱度是表示水中CO32-、HCO3-、OH-及其它一些弱酸盐类的总合。
这些盐类的水溶液都呈碱性,可以用酸来中和。
然而,在天然水中,碱度主要是由HCO3-的盐类所组成。
酚酞碱度[1] (phenolphthalein end一Point alkalinity)该碱度是由水中全部的氢氧根离子和一半碳酸盐含量引起的。
用酚酞为指示剂滴定终点(pH8.3)测定碱度。
通常与甲基红终点碱度结合使用。
酚酞碱度=[CO32-]+[OH-]-[H2CO3*] -[H+] 根据测定碱度时所用的指示剂,碱度可分为酚酞碱度(P)和甲基橙碱度(M),用酚酞作指示剂测定的碱度称为酚酞碱度,此时滴定终点的PH=8.3,所参加反应的离子为:OH -+H+=H2O;CO32-+H+=HCO3-;即CO32-仅反应生成HCO3-;当用甲基橙作指示剂时测定的碱度称为甲基橙碱度,其反应终点的PH=4.3—4.5,此时不仅有上述反应外,同时HCO3-也参加反应:HCO3-+H+=H2O+CO2;因此,甲基橙碱度也即为全碱度。
总碱度

总碱度;水中所有能接受氢离子的阴离子浓度的总和。
比如氢氧根、碳酸根、重碳酸根、磷酸根、硅酸根等。
按照产生碱度的物质种类,可把碱度分为三类:1)氢氧化物碱度,即OH-含量;2)碳酸盐碱度,即CO32-含量;3)重碳酸盐碱度(碳酸氢盐碱度),即HCO3-含量。
总碱度就是上述三种成分的总和。
一、碱度的测定:碱度的测定采用酸碱滴定法。
其原理是在水样中加入适当的指示剂,用标准酸溶液滴定,当达到一定的pH值时,指示剂就发生变色作用,表示某一化学计量点的到达,以此分别测出水样中所含的各种碱度。
各种碱度的反应为:OH-+H+ H2OCO32-+H+ HCO3-HCO3-+H+ H2CO3我们一般采用的标准酸溶液是盐酸,根据滴定时所选用的指示剂不同,可以分为连续滴定法和分别滴定法两种。
1.连续滴定法用酚酞和甲基橙作为指示剂。
取一定容积的水样,以酚酞为指示剂,用盐酸溶液滴定到红色→无色为终点,盐酸用量(mL)以P表示;接着再加入甲基橙指示剂,继续滴定到溶液由黄→橙色为终点,此时的盐酸用量以M表示。
根据P、M的相对大小,可以判断碱度的组成并计算其含量。
1)单独的氢氧化物碱度(OH-)化学计量点时pH=7.0,P>0 M=0。
由此判断水样中没有碳酸盐和重碳酸盐存在,只有氢氧化物碱度,故:氢氧化物碱度消耗盐酸量=P2)氢氧化物与碳酸盐碱度(OH-+CO32-)OH-+H+ H2O 化学计量点时pH=7.0CO32-+H+ HCO3-化学计量点时pH=8.3HCO3-+H+ H2CO3 化学计量点时pH=3.9用盐酸滴定到溶液由红色变为无色时,水样中氢氧化物碱度完全被中和,而碳酸盐碱度被中和了一半,此时盐酸用量为P;继续用盐酸滴定到水样由黄色变为橙色,碳酸盐的第2步反应进行完毕,这时消耗盐酸量为M。
P=OH-+CO32-M=CO32-P>M,所以:氢氧化物碱度消耗盐酸量=P-M碳酸盐碱度消耗盐酸量=2M3)单独的碳酸盐碱度(CO32-)P=CO32-M=CO32-P=M,所以:碳酸盐碱度消耗盐酸量=P+M4)碳酸盐与重碳酸盐碱度(CO32-+HCO3-)P=CO32-M=CO32-+HCO3-M>P,故:碳酸盐碱度消耗盐酸量=2P重碳酸盐碱度消耗盐酸量=M-P5)单独的重碳酸盐碱度(HCO3-)P=0 M=HCO3->0重碳酸盐碱度消耗盐酸量=MP+M称为总碱度,如不要求具体区分水中哪一种碱度的含量多少,只要求测出各种情况下水的总碱度,那么就可以只加甲基橙指示剂,用盐酸滴定到化学计量点(溶液的PH=3.9)。
工业纯碱总碱度计算公式

工业纯碱总碱度计算公式工业纯碱,这玩意儿在化工领域可是有着重要地位的。
咱今儿就来好好聊聊工业纯碱总碱度的计算公式。
先来说说啥是总碱度。
总碱度啊,简单说就是工业纯碱中能与酸发生中和反应的物质的总量。
这可关系到纯碱的质量和用途呢!那这总碱度咋算呢?一般来说,常用的计算公式是:总碱度(以碳酸钠计)% = (消耗盐酸标准溶液的体积 ×盐酸标准溶液的浓度 ×0.05299)÷试样质量 × 100 。
这里面的“0.05299”可是个关键系数,别小瞧它,作用大着呢!给您举个例子啊。
有一次,我在实验室里检测一批工业纯碱的总碱度。
那纯碱就摆在我面前,白白的,颗粒大小还不太均匀。
我小心翼翼地称取了一定量的试样,放入锥形瓶中,然后加入适量的蒸馏水溶解。
接着,就该滴加盐酸标准溶液啦。
我紧紧盯着滴定管,一滴一滴地加,心里那个紧张啊,就怕滴多了或者滴少了。
眼睛都不敢眨一下,手也稳稳地控制着滴定速度。
等到溶液颜色发生变化,达到终点的时候,我赶紧记录下消耗盐酸标准溶液的体积。
最后按照公式一算,嘿,得出了这批工业纯碱的总碱度。
在实际的工业生产中,准确计算工业纯碱的总碱度那是相当重要的。
如果总碱度不达标,生产出来的产品质量可能就不过关,会影响到后续一系列的使用效果。
比如说,在玻璃制造中,如果纯碱的总碱度不够,那玻璃的强度和透明度可能就达不到要求;在洗涤剂生产中,总碱度不合适,清洁效果可能就大打折扣。
所以啊,这看似简单的计算公式,背后可关系着工业生产的方方面面。
咱们可得认真对待,不能有丝毫马虎。
总之,工业纯碱总碱度的计算公式虽然看起来有点复杂,但只要咱多实践、多琢磨,就能熟练掌握,为工业生产把好质量关!。
水质总碱度检测方法

编写:郑金兰 翁春海编号: Q/SBJ4(品)-3.28-2010 版本:2.0第1页共3页 名称: 水质总碱度检测方法 发布日期: 保 密水质总碱度检测方法1.目的本方法规定了用酸式滴定法测定工厂生产用水及生活饮用水的总碱度。
2.范围适用于工厂所有生产用水及生活饮用水。
3.原理碱度是水介质与氢离子反应的定量能力,通过用强酸标准溶液将一定体积的水样滴定至pH值为4.0所测得的碱度称为总碱度.测定结果用相当于碳酸钙的质量浓度,mg/L 为单位表示。
4.安全及环保要求4.1. 配制化学品试剂及检测过程,遵照MSDS 要求佩戴耐酸碱手套、防烫手套。
5.试剂5.1. 0.5g/L 甲基橙指示剂:称取0.050g 甲基橙溶于,70℃的纯水中冷却定容至100ml 。
此试剂贮存于棕色玻璃瓶中,有效期3个月5.2. 0.05mol/L 盐酸标准溶液:吸取4.2mL 盐酸(ρ20=1.19g/mL ),稀释至1000mL 。
此试剂贮存于玻璃瓶中,有效期2个月。
按下述方法标定:5.3. 称取在2500C 烘箱中烘干过的无水碳酸钠0.1~0.2克于250mL 锥形瓶中,加50mL 纯水溶解,加4滴甲基橙指示剂,用配制的盐酸溶液滴定至溶液由黄色突变为橙色。
同时做空白试验。
计算公式:c(HCl)= 0()0.05299m V V -⨯ 式中:c(HCl)—盐酸标准溶液的浓度,mol/L ;m —碳酸钠的质量,g ;V —滴定碳酸钠所消耗盐酸标准溶液的体积,mL ;Vo —空白试验消耗盐酸标准溶液的体积,mL 。
0.05299—与1.00mL 盐酸标准溶液[c(HCl)=1.000mol/L]相当的以克表示的碳酸钠的质量。
编写:郑金兰 翁春海编号: Q/SBJ4(品)-3.28-2010 版本:2.0第1页共3页 名称: 水质总碱度检测方法 发布日期: 保 密6.仪器6.1. 25mL 滴定管6.2. 50mL 移液管6.3. 250mL 锥形瓶7.操作规程7.1. 吸取50.00mL 水样于250mL 锥形瓶中,加4滴甲基橙指示剂,用盐酸标准溶液滴定至试液由黄色突变为橙色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碱度:
碱度是表示水吸收质子的能力的参数,通常用水中所含能与强酸定量作用的物质总量来标定。
这类物质包括强碱、弱碱、强碱弱酸盐等。
天然水中的碱度主要是由重碳酸盐、碳酸盐和氢氧化物引起的,其中重碳酸盐是水中碱度的主要形式。
引起碱度的污染源主要是造纸、印染、化工、电镀等行业排放的废水及洗涤剂、化肥和农药在使用过程中的流失。
碱度和酸度是判断水质和废水处理控制的重要指标。
碱度也常用于评价水体的缓冲能力及金属在其中的溶解性和毒性等。
工程中用得更多的是总碱度这个定义,一般表征为相当于碳酸钙的浓度值。
因此,从定义不难看出测量的方法--酸滴定法。
总碱度计算公式:
总碱度mg/L=V*c*50.04*1000/V0
V--滴定消耗baiHCl或硫酸du的体积zhi
c--HCl或硫酸的浓度dao
V0--水样的体积
50.04--1mL1mol/LHCl相当于CaCO3的质量
计算公式:
计算公式是人们在研究自然界物与物之间时发现的一些联系,并通过一定的方式表达出来的一种表达方法。
是表征自然界不同事物之数量之间的或等或不等的联系,它确切的反映了事物内部和外部的关系,是我们从一种事物到达另一种事物的依据,使我们更好的理解事物的本质和内涵。
