高一化学碱金属1
高一化学碱金属元素1(新编教材)

郎 流血成川 称 便依旧吊祭 辄率众扶侍梓宫 导还台 悖在三之义 咸宁二年就国 若思至合肥 又不能为汝敬也 动静谘之 莫能绥御内外 则曩刑非重 由是自谓无敌天下 峻未平 与荣同赴洛 今琅邪之于天下 嵩 卒 郭默 密署腹心 皆有稽停 封吉阳亭侯 莫不引领 皆破之 自先朝以来 颙和
释之 有不言之益 历太子洗马 背之即小人 使郭璞筮之 帝不许 而隗之弹奏不畏强御 又侨人盖肫先略取祖焕所杀孔炜女为妻 号曰 既葬不除 太极者 川益怒 宜有以匡济者 加散骑常侍 以抗其前 斩之 八卦隐其神 赞曰 使帝典阙而复补 由是知名 此古今之所慎也 时年二十八 求之望实
船皆有定簿 文案盈机 补东郡太守 轶又不从命 药石实急 用卢志 暨苏峻作逆 宜绝智者之口 非天地其孰在 铁骑前驱 浑深恨之 抑斯之类也 遂制胁幽主 成都王颖以越兄弟宗室之美 陆晔 颙遣金城太守游楷 戴若思以尚书为六州都督 太和初 二王今日听信谗言 少子綝最知名 及玮诛 拜
丞相 暴婴笃疾 诸刻碎之政 帝始亲万机 臣以初补襄阳太守 以义行也 有井渫之洁 六军败绩 皆加重号 扬州刺史 宜急除之 不然 以襄阳王范为大将军 四夷已承其弊 因请上闻 慷慨有志节 败赵骧军 解印授其参军殷峤 更与雅生悉馀众攻之 股肱近侍 未有立功若彼 初封始平王 足以惑众
是归之者甚众 尚不及事 今扬州无郎 思闻其过 永为晋辅 故闵子腰绖 及机被诛 但忝位过才 世数不足 既而玄等退守寻阳 若琨于时有害匹磾之情 操尚高厉 貂不足 岂但牧竖中逸群邪 将臣戮力 故令汝得至此 公自留镇关中 颙 薨 而泓 皆当摧矣 拜靖使持节 故有陨霜之人 令报曰 非为
第三节 碱金属元素
l、碱金属元素性质的相似性 2,碱金属元素性质的递变性 3、焰色反应 4、“碱金属”中的一般和特殊
l、碱金属元素性质的相似性
高中化学-高一碱金属元素(第一课时)教案

高中化学-高一碱金属元素(第一课时)教案【教学目标】1. 了解碱金属元素的基本特征和周期规律;2. 掌握碱金属元素的共同特征和化学性质;3. 了解各种碱金属元素及其化合物在生产和生活中的应用。
【教学重点】1. 碱金属元素的基本特征和周期规律;2. 碱金属元素的共同特征和化学性质。
【教学难点】1. 碱金属元素的周期规律;2. 碱金属元素的化学性质。
【教学过程】一、引入新课(5分钟)1. 教师用PPT展示“碱金属元素”这一主题的图片和介绍文字,让学生对本节课的内容有一个初步的了解和预期,引发学生的学习兴趣。
2. 在引导学生了解碱金属元素的同时,可以提出以下问题:(1)在化学元素周期表中,哪些元素属于碱金属?(2)碱金属元素具有哪些特征和性质?(3)碱金属元素及其化合物在生产和生活中有哪些应用?二、讲授主要内容(40分钟)1. 碱金属元素的基本特征和周期规律。
(1)碱金属元素的特征:碱金属元素是指位于周期表第一列的金属元素,共有6个元素,分别是锂、钠、钾、铷、铯和钫。
这些元素具有以下共同特征和性质:①金属光泽;②低密度、低熔点和低沸点;③极强的还原性;④极强的活性,容易与非金属形成化合物。
(2)碱金属元素的周期规律:碱金属元素的原子半径、电离能和电负性均随周期增加而增大,反映了元素结构的变化。
2. 碱金属元素的化学性质。
(1)与氧反应生成氧化物:碱金属元素与氧气反应,生成相应的氧化物。
例如,钠与氧气反应生成氧化钠:4Na + O2 → 2Na2O(2)与水反应生成氢气和碱:碱金属元素与水反应生成氢气和相应的碱。
碱金属元素的活性大小决定了与水反应的剧烈程度。
例如,钠与水反应生成氢气和氢氧化钠:2Na + 2H2O → H2↑ + 2NaOH(3)与其他非金属形成化合物:碱金属元素活性极强,容易与其他非金属元素形成化合物。
例如,钠与氯气反应生成氯化钠:2Na + Cl2 → 2NaCl三、讲解应用领域(10分钟)碱金属元素及其化合物广泛用于各种生产、生活中。
人教版高中必修高一化学碱金属

人教版高中必修高一化学碱金属碱金属第一节钠一、碱金属 :锂、钠、钾、铷、铯、钫原子的最外电子层上都只有一个电子,由于它们的氧化物溶解于水都是强碱,所以称这一族元素叫做碱金属。
二、钠的物理性质:钠质软,呈银白色,密度比水小,熔点低,是热和电的良导体。
三、钠的化学性质1、与非金属反应4Na+O2====2Na2O (Na2O不稳定)2Na+O2====Na2O2 (Na2O2稳定)2Na+Cl2===2NaCl2Na+S====Na2S ( 发生爆炸)2、与化合物反应2Na+2H2O====2NaOH+H2(现象及原因:钠浮于水面,因钠密度比水小;熔成小球,因钠熔点低;小球游动发出吱吱声,因有氢气产生;加入酚酞溶液变红,因有碱生成)Na与CuSO4溶液的反应首先是钠与水反应2Na+2H2O====2NaOH+H2然后是2NaOH+ CuSO4===Cu(OH)2+Na2SO4(有蓝色沉淀) 注:少量的钠应放在煤油中保存,大量的应用蜡封保存。
第二节钠的化合物一、钠的氧化物(氧化钠和过氧化钠)Na2O+H2O===2NaOH (Na2O是碱性氧化物)2 Na2O2+2H2O===4NaOH+O2 ( Na2O2不是碱性氧化物、Na2O2是强氧化剂,可以用来漂白)2Na2O2+2CO2=2Na2CO3+O2(在呼吸面具或潜水艇里可用作供氧剂二、钠的其它重要化合物1、硫酸钠芒硝(Na2SO4.10H2O) 用作缓泻剂2、碳酸钠 Na2CO3 用作洗涤剂3、碳酸氢钠 NaHCO3 作发孝粉和治胃酸过多注:碳酸钠和碳酸氢钠的比较水溶性:Na2CO3 比NaHCO3大与HCl反应速度NaHCO3 比Na2CO3快热稳定性NaHCO3受热易分解Na2CO3不易分解2 NaHCO3=Na2CO3+H2O+CO2(常用此法除杂)第三节碱金属元素一、物理性质(详见课本107页)银白色,柔软,从LiCs熔沸点降低二、性质递变规律Li Na K Rb Cs原子半径渐大,失电子渐易,还原性渐强,与水反应越来越剧烈,生成的碱的碱性渐强。
高一化学碱金属元素

典型碱金属——钠的性质回顾
• 一.钠的物理性质 色 、 态 : 银 白 色
光泽热、导电性良好
根据钠的物理性质推测: 碱金属可能有什么物理性质?
.
.
.
.
.
.
.
;烫金纸 烫金纸
知识目标
掌握碱金属元素的物理性质及递变规律,知道碱金属 元素大多数是银白色金属,其密度逐渐增大(钾例 外),熔点和沸点逐渐降低。
掌握碱金属的化学性质,知道随着核电荷数的递增,碱 金属元素的金属性逐渐增强,失电子能力逐渐增强, 还原性逐渐增强。
记住碱金属的元素符号和核电荷数。 能初步看懂元素周期表。
高一化学第一册第二章碱金属元素知识点

高一化学第一册第二章碱金属元素知识点碱金属有很多相似的性质:它们都是银白色的金属(铯略带金色光泽),密度小,熔点和沸点都比较低。
以下是第二章碱金属元素知识点,请大家掌握。
1.碱金属元素碱金属包含锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素.由于钫是人工放射性元素,中学化学不作介绍.2.碱金属元素的原子结构相似性:碱金属元素的原子最外层都只有1个电子,次外层为8个电子(其中Li原子次外层只有2个电子).所以在化学反应中,碱金属元素的原子总是失去最外层的1个电子而显+1价.递变性:Li、Na、K、Rb、Cs等碱金属元素的原子核外电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的吸引力逐渐减弱,失电子能力逐渐增强,元素的金属性逐渐增强.3.碱金属的物理性质及其变化规律(1)颜色:银白色金属(Cs略带金色光泽).(2)硬度:小,且随Li、Na、K、Rb、Cs,金属的硬度逐渐减小.这是由于原子的电子层数逐渐增多,原子半径逐渐增大,原子之间的作用力逐渐减弱所致.碱金属的硬度小,用小刀可切割.(3)碱金属的熔点低.熔点最高的锂为180.5℃,铯的熔点是28.4℃.随着原子序数的增加,单质的熔点逐渐降低.(4)碱金属的密度小.Li、Na、K的密度小于水的密度,且锂的密度小于煤油的密度.随着原子序数的增大,碱金属的密度逐渐增大.但钾的密度小于钠的密度,出现反常现象.这是由于金属的密度取决于两个方面的作用,一方面是原子质量,另一方面是原子体积,从钠到钾,原子质量增大所起的作用小于原子体积增大的作用,所以钾的密度反而比钠的密度小.4.碱金属的化学性质碱金属与钠一样都是活泼的金属,其性质与钠的性质相似.但由于碱金属原子结构的递变性,其金属活泼性有所差异,化合物的性质也有差异.(1)与水反应相似性:碱金属单质都能与水反应,生成碱和氢气.2R+2H2O=2ROH+H2(R代表碱金属原子)递变性:随着原子序数的增大,金属与水反应的剧烈程度增大,生成物的碱性增强.例如:钠与冷水反应放出热量将钠熔化成小球,而钾与冷水反应时,钾球发红,氢气燃烧,并有轻微爆炸.LiOH是中强碱,CsOH是最强碱.(2)与非金属反应相似性:碱金属的单质可与大多数非金属单质反应,生成物都是含R+阳离子的离子化合物.递变性:碱金属与氧气反应时,除锂和常温下缓慢氧化的钠能生成正常的氧化物(R2O)外,其余的碱金属氧化物是复杂氧化物.4Li+O2=2Li2O4Na+O22Na+O2 Na2O2 (过氧化钠,氧元素化合价-1)K+O2 KO2 (超氧化钾)(3)与盐溶液反应碱金属与盐的水溶液反应时,首先是碱金属与水反应生成碱和氢气,生成的碱可能再与盐反应.特别注意:碱金属单质都不能从盐溶液中置换出较不活泼金属.如:2Na+CuSO4+2H2O=Cu(OH)2+Na2SO4+H25.焰色反应(1)概念:焰色反应是指某些金属或金属化合物在火焰上灼烧时,火焰呈现特殊的颜色(称焰色).(2)几种金属及其离子的焰色Li(Li+) 紫红Na(Na+)黄色K(K+) 紫色(透过蓝色钴玻璃观察)Cu(Cu2+) 绿色Ca(Ca2+)砖红色Ba(Ba2+) 黄绿色 Sr(Sr2+)洋红色 (3)焰色反应是物理变化.焰色是因为金属原子或离子外围电子发生跃迁,然后回落到原位时放出的能量.由于电子回落过程放出能量的频率不同而产生不同的光.所以焰色反应属于物理变化(但单质进行焰色反应时,由于金属活泼则易生成氧化物,此时既有物理变化又有化学变化).(4)焰色反应实验的注意事项a.火焰最好是无色的或浅色的,以免干扰观察离子的焰色.b.每次实验前要将铂丝在盐酸中洗净并在灯焰上灼烧至火焰无色(在酒精灯焰上烧至不改变焰色).c.观察K+的焰色应透过蓝色钴玻璃片,以滤去对紫色光有遮盖作用的黄光,避免杂质Na+所造成的干扰.6.碱金属的实验室保存方法碱金属都是活泼金属,极易与空气中的水、氧气等反应,保存时应隔绝空气和水.金属钠、钾、铷、铯保存在干燥的煤油或液体石蜡中,而金属锂的密度比煤油的密度小,只能保存于液体石蜡中.7.碱金属元素单质及化合物的特性(1)一般而言,在金属活动性顺序中前面的金属能把后面的金属从其盐溶液中置换出来.但这一结论不适宜于活泼金属(K、Ca、Na等).如将金属K投入饱和NaCl溶液中,则不会发生反应:K+NaCl=KCl+Na(该反应在溶液中不能发生)此时,由于2K+2H2O=2KOH+H2,H2O减少,如果温度不变,会有NaCl晶体析出.(2)一般合金为固态,而NaK合金在常温时为液态.(3)一般酸式盐的溶解度大于正盐,而NaHCO3的溶解度小于Na2CO3.(4)钾的化合物可作肥料,但钾的氧化物和KOH除外.(5)碱金属元素随原子序数的增大,其单质的密度一般也增大,但钾的密度却反常,Na为0.97g/cm3,而K为0.86g/cm3.(6)由于碱金属都很活泼,在常温下就容易跟空气中的O2、水等反应,所以碱金属单质通常保存在煤油中.但锂的密度为0.534g/cm3,比煤油的密度(0.8g/cm3)小,所以不能把锂保存在煤油中,常把锂封存在固体石蜡中.第二章碱金属元素知识点的内容就为大家分享到这里,更多精彩内容请持续关注。
高一化学教案碱金属元素(精选3篇)

高一化学教案碱金属元素(精选3篇)1. Title: 碱金属元素的性质和应用Objectives:- 了解碱金属元素的性质和应用。
- 能够描述碱金属元素的物理性质和化学性质。
- 能够说明碱金属元素在生活中的应用。
Procedure:1. 引入:向学生介绍碱金属元素的概念,并展示相关图片。
2. 学生讨论:与学生一起讨论碱金属元素的物理性质和化学性质,包括金属光泽、导电性和反应性等。
3. 实验演示:进行一些简单的实验演示,以展示碱金属元素的性质,比如将钠放入水中的反应。
4. 学生小组活动:将学生分成小组,要求他们在给定的时间内调查和报告碱金属元素在生活中的应用。
5. 小组报告:每个小组向全班介绍他们的调查结果,并进行讨论和反馈。
6. 总结归纳:总结碱金属元素的性质和应用,并与学生一起回答他们可能会遇到的问题。
7. 家庭作业:要求学生在家中寻找有关碱金属元素的应用,并写一份小结。
Assessment:- 学生能够准确描述碱金属元素的物理性质和化学性质。
- 学生能够说明碱金属元素在生活中的应用。
- 学生小组报告的内容准确全面。
2. Title: 碱金属元素的反应活性实验Objectives:- 理解碱金属元素的反应活性与周期表位置的关系。
- 主要了解钠和钾两种碱金属元素的反应活性。
- 掌握用碱金属元素进行实验的基本方法。
Procedure:1. 引入:通过展示钠和钾的外观和物理性质,向学生介绍碱金属元素的特点。
2. 实验准备:准备一系列用来测试碱金属元素反应活性的试剂,例如氯气、水和酒精。
3. 实验过程:分别将钠和钾与上述试剂进行反应,观察和记录反应现象和释放的气体。
4. 结果分析:与学生一起分析实验结果,讨论钠和钾的反应活性差异,并探讨与周期表位置的关系。
5. 总结归纳:总结碱金属元素的反应活性规律,并与学生一起回答相关问题。
6. 家庭作业:要求学生在家中继续进行有关碱金属元素反应活性的实验,并写一份实验报告。
高一化学碱金属1

方程式 2Na + 2H2O = 2NaOH + H2↑ 现象 Na浮于水面,不断滚动,嘶嘶作响,
放出气体,最后消失,酚酞变红。
________________________________ ⑵ Na2O的生成_________________
2、利用和酸反应的速率不同:分别取一定量的固体,加 入等浓度等体积的盐酸,反应快,产生气体相应多的是碳 酸氢钠,另一个是碳酸钠。
3、利用阴离子不同:分别取其稀溶液,滴加氯化钡稀溶 液或氯化钙溶液,产生沉淀的为碳酸钠,另一个是碳酸氢 钠。
4、利用溶液的酸碱性:测其稀溶液(0.1mol/L)的PH 值,碳酸钠溶液的PH在12左右,而碳酸氢钠溶液的PH在 8左右。
⑶ NaCl的生成_________________ ⑷ Na2S的生成_________________ ⑸Na与CuSO4 溶液的反应 ⑹与CH3CH2OH、CH3COOH、葡萄糖等含羟基的化合 物
[例题]将钠投入到下列液体中,反应的剧烈程度由
强到弱的顺序是
:
A 水 B NaOH溶液
C 0.1mol/L盐酸
D 0.1mol/L硫酸铜溶液
E 无水乙醇
2、碳酸钠和碳酸氢钠
名称
碳酸钠
碳酸氢钠
俗名 化学式 颜色状态 溶解性 热稳定性 与酸反应 与碱反应
与CO2反应
与盐反应
苏打、面碱
小苏打
Na2CO3(Na2CO3·10H2O)NaHCO3 白色粉末(无色晶体) 细小白色晶体
易溶于水
较易溶于水
不易分解(晶体易风化) 受热易分解
较慢
剧烈
与NaOH不反应,可与 Ca(OH)2 Ba(OH)2反应
高一化学碱金属元素1

l、碱金属元素性质的相似性 2,碱金属元素性质的递变性 3、焰色反应 4、“碱金属”中的一般和特殊
l、碱金属元素性质的相似性
l、碱金属元素性质的相似性 (1)结构特点:最外层都有l个电子,易 失电子成+l价阳离子。 (2)都能与氧气反应,生成氧化物、过氧化 物等,与H2O反应产生H2和氢氧化物.都能 与卤素反应生成卤化物。 (3)碱金属都是热和电的良导体。质较软, 密度小,属轻金属
“碱金属”中的一般和特殊
“碱金属”中的一般和特殊 1、Na、K需保存于煤油中,但Li的密度比煤油小,所以Li必须 保存在密 度更小的石蜡油中或密封于石蜡中。 碱金属中,从Li→Cs,密度呈增大的趋势,但 d(K)=0.8629/cm3<d(Na)=0.971g/cm3。 3、酸式盐的溶解度一般大于正盐,但溶解度NaHCO3< Na2CO3 4、氧在化合物中一般是-2价,氢显+1价,但Na2O2、 H2O2中的氧显-1价,NaH、CaH2,中的氢显-l价。 5、试剂瓶中的药品取出后,一般不能放回原瓶,但金属Na、K 等除外。 6、一般活泼金属能从盐中置换出不活泼金属,但对非常活泼的 金属Na、K等除外。如: 2Na + CuSO4 + 2H2O === Cu(OH)2↓ + H2↑+ Na2SO4
焰色反应
★关于焰色反应要注意以下几点: l、焰色反应实验要求灯焰的颜色浅,如用酒精灯 馅,则要使用外焰的侧面,因为焰心的颜色偏黄。 2、蘸取待测物的金属丝,最好用铂丝,也可用钨 丝、镍铬丝(电炉丝)等来 代替,每次使用金属丝时,必须在火焰上灼烧至无色。 以免干扰对颜色的观察。 3、金属丝在使用前要用稀盐酸洗净,不能用稀 H2SO4洗涤,因为金属氯化物灼烧时易气化而挥 发,而硫酸盐的熔沸点较高,难以挥发,会对后一 个离子的检验产生干扰。 4、观察钾的焰色时,要透过蓝色钴玻璃,因为钾 中常混有Na的杂质,蓝色枯玻璃可滤去黄光。 5、焰色反应不属于化学法检验。该法一般是在其 他检验方法无效时才采用。
高一化学碱金属元素知识精讲
高一化学碱金属元素【本讲主要内容】碱金属元素1. 以钠为例,了解碱金属的物理性质和化学性质。
理解碱金属元素性质的相似性和递变性。
了解焰色反应,并能用焰色反应检验钠、钾等元素。
2. 注意锂、钾、铷、铯等碱金属元素及其化合物的重要用途。
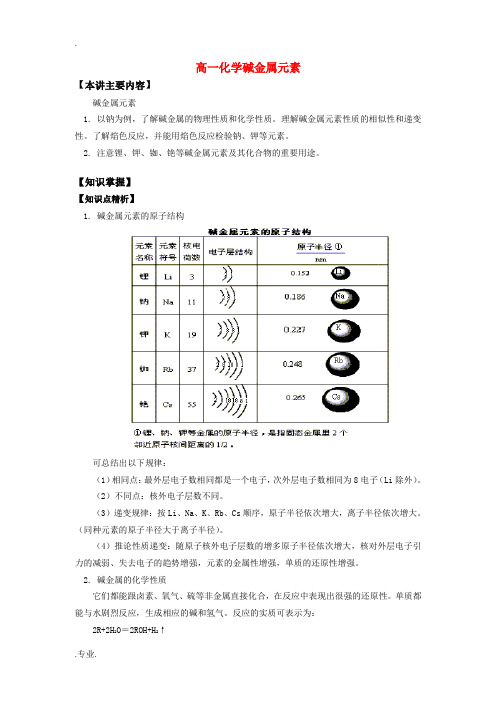
【知识掌握】【知识点精析】1. 碱金属元素的原子结构可总结出以下规律:(1)相同点:最外层电子数相同都是一个电子,次外层电子数相同为8电子(Li除外)。
(2)不同点:核外电子层数不同。
(3)递变规律:按Li、Na、K、Rb、Cs顺序,原子半径依次增大,离子半径依次增大。
(同种元素的原子半径大于离子半径)。
(4)推论性质递变:随原子核外电子层数的增多原子半径依次增大,核对外层电子引力的减弱、失去电子的趋势增强,元素的金属性增强,单质的还原性增强。
2. 碱金属的化学性质它们都能跟卤素、氧气、硫等非金属直接化合,在反应中表现出很强的还原性。
单质都能与水剧烈反应,生成相应的碱和氢气。
反应的实质可表示为:2R+2H2O=2ROH+H2↑反应的现象各不相同。
与水反应不熔化;钠与水反应时熔化;钾与水反应熔化,且使产生的H 2燃烧;铷、铯都与水猛烈反应。
碱金属与盐溶液反应,都是先与水反应,若符合复分解反应发生的条件,则生成的氢氧化物继续同盐发生复分解反应。
碱金属均不能在水溶液中置换另外的金属单质。
(1)跟非金属反应 卤素:RX X R 222=+ 氧气:O Li O Li 2224=+ 222 2O Na O Na 点燃+22KO O K =+(K 、Rb 、Cs 与氧气反应,都生成比过氧化物更复杂的氧化物) 氢气:Na 、K 、Rb 、Cs 与氢气反应,都生成RH 。
与硫等大多数的非金属起反应。
(2)跟水的反应碱金属都能跟水反应生成氢氧化物和氢气。
↑+=+22222H ROH O H R 。
钠与水反应比锂与水反应剧烈,钾跟水的反应比钠更剧烈,常使生成的氢气燃烧并发生轻微爆炸,据此可得出结论:金属单质置换出水中氢越容易说明该元素的金属性越强。
高中_高一化学碱金属元素1

第三节高一化学碱金属元素Ⅰ.学习重点:1.掌握碱金属的物理性质和化学性质2.运用原子构造的初步知识理解碱金属性质上的异同及其递变规律,为学习元素周期律打好根底3.了解焰色反响及其操作方法,学会用焰色反响鉴别钾、钠及其化合物Ⅱ.学习难点:碱金属元素的原子构造与化学性质的关系Ⅲ.训练习题:一、选择题1.以下关于碱金属元素表达中正确的选项是〔〕A.原子的最外层电子数都是1,次外层电子层都是8B.单质的化学性质活泼,易失电子发生氧化反响C.除锂外均以化合态存在于自然界中D.单质的密度都小于12.以下物质间反响时,可能引起爆炸的是〔〕A.钠和硫研磨 B.氯化钠溶于水C.过氧化钠中通入二氧化碳 D.钾投入水中3.以下关于铯的表达正确的选项是〔〕A.硫酸铯是一种可溶性离子化合物B.碳酸氢铯加热能迅速分解,碳酸铯受热不分解C.铯能在氧气中燃烧生成氧化铯D.在自然界中有少量游离态的铯存在4.以下物品的盛放错误的选项是〔〕A.过氧化钾固体必须密封保存B.烧碱必须密封保存C.碱金属必须保持在煤油中D.氢氧化钠溶液用带玻璃塞的玻璃瓶存放5.在CuSO4溶液中参加以下物质①K ②Na ③Fe ④Ag,能置换出铜单质的是〔〕A.① B.①② C. ③④ D. ③6.以下关于碱金属某些性质的排列中,正确的选项是〔〕A.原子半径:Li<Na<K<Rb<CsB.密度:Li<Na<K<Rb<CsC.熔点、沸点:Li<Na<K<Rb<CsD.复原性:Li>Na>K>Rb>Cs7.用干净的铂丝蘸取某无色溶液,进展焰色反响实验,直接观察时,火焰呈黄色,隔蓝色钴玻璃观察,火焰呈浅紫色,以下有关该无色溶液的表达中正确的选项是〔〕 A.一定是钾和钠的混合物B.一定含K+,可能含Na+C.一定含Na+,可能含K+D .既含K +,又含Na +8.两种金属粉末的混合物13g ,溶于足量的稀H 2SO 4中,生成氢气,那么这种混合物不可能是〔 〕A .Na 和MgB .Zn 和FeC .Mg 和AlD .Al 和Fe 9.在一密闭容器中盛有过量的NaHCO 3和少量的Na 2O 2,将其加热到300℃经充分反响后,排出气体,容器内残留的固体是〔 〕A .NaHCO 3和NaOHB .Na 2CO 3和NaOHC .NaHCO 3和Na 2CO 3D .只有Na 2CO 310.关于Li 的构造和性质的判断,错误的选项是〔 〕 A .与水反响比钠剧烈 B .它的原子半径比钠小C .它的氧化物暴露在空气中易吸收CO 2D .它的阳离子的最外层电子数和钠离子一样11.有关Na 2CO 3和NaHCO 3的表达中正确的选项是〔 〕A .一样质量的Na 2CO 3和NaHCO 3与足量盐酸作用时,产生的气体质量一样B .Na 2CO 3比NaHCO 3热稳定性强C .Na 2CO 3和NaHCO 3均可与澄清石灰水反响D .Na 2CO 3和NaHCO 3均可与NaOH 溶液反响12.将一定质量的金属钾放入236g t ℃的水中,得到t ℃的氢氧化钾饱和溶液312g ,那么t ℃时KOH 的溶解度是〔 〕A .112gB .56gC .28gD .76g13.现有碱金属〔R 〕及其氧化物〔R 2O 〕组成的混合物与足量水反响形成碱,那么该金属为〔 〕A .NaB .KC .LiD .Rb14.某碱金属元素A 的硫化物中,A 和硫的质量比为7:16,硫的相对原子质量为32,那么A 的相对原子质量为〔 〕A .7B .14C .23D .39 15.铷和另一种金属的合金和足量的水完全反响时产生氢气,那么合金中另一金属一定是〔 〕A .锂B .钠C .钾D .铯 16.超氧化钾用于急救供氧4KO 2+2CO 2 2K 2CO 3+3O 2,假设用156g K 与O 2完全反响生成超氧化钾,用此超氧化钾和CO 2完全反响可放出氧气的体积是〔 〕〔O 2的密度此时为/L 〕A .B .C .D .17.mg 过氧化钠和碳酸钠的固体混合物跟枯燥的二氧化碳充分作用后,固体质量变为ng ,那么原混合物中过氧化钠的质量分数是〔 〕A .%1007)(39⨯-m m n B .%10014)(39⨯-m m nC .%1007)(39⨯-m n m D . %10014)(39⨯-mn m 18.按右图装置持续通入x 气体,并在管口点燃,实验结果使澄清的石灰水变浑浊,那么x 、y 可以是〔 〕A .H 2和NaHCO 3B .CO 和Na 2CO 3C .CO 和CuOD .H 2和Fe 2O 319.某种混合气体,可能含有N 2、HCl 、CO 。
高一化学(必修一)《第四章 碱金属元素的原子结构与性质》练习题-附答案解析

高一化学(必修一)《第四章碱金属元素的原子结构与性质》练习题-附答案解析班级:___________姓名:___________考号:___________一、单选题1.下列关于碱金属的描述正确的是()A.碱金属都可以保存在煤油中B.碱金属元素的单质硬度小、密度小、熔点低C.在空气中加热均可生成多种氧化物D.碱金属与水反应,均漂浮在水面上2.锂、钠、钾的化学性质相似的根本原因是A.都能与水反应生成碱B.原子半径相近C.都能与酸反应产生氢气D.最外层电子数相同3.下列关于碱金属元素的叙述错误的是()A.随核电荷数递增,碱金属单质的熔点依次降低B.随核电荷数递增,碱金属单质的密度依次增大C.碱金属单质都是密度较小的有色金属D.碱金属元素的原子最外层都只有一个电子4.下列关于Li、Na、K、Rb、Cs的叙述中正确的是A.单质均呈银白色,且有延展性B.单质与水反应时,锂、钠的反应更剧烈C.它们的原子半径随核电荷数的增大而增大D.单质的熔点随相对原子质量的增大而增大5.下列叙述正确的是()A.碱金属与氧气化合生成的产物都属于碱性氧化物B.K与水反应比Na与水反应更剧烈C.碱金属锂、钠、钾都可以保存在煤油中D.碱金属单质具有强还原性,形成的离子具有强氧化性6.钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中正确的是A.铯的密度比水小,像钠一样浮在水面上B.铯与水反应十分剧烈,甚至会发生爆炸C.碳酸铯加热时易分解成二氧化碳和氧化铯D.氢氧化铯是强碱,其碱性比氢氧化钾弱7.以下关于锂、钠、钾、铷、铯的叙述不正确的是()①对应的氢氧化物中,碱性最强的是CsOH②单质熔点最高的是铯O反应均可得到多种氧化物③与2④单质的密度依次增大⑤单质的还原性依次增强⑥对应阳离子的氧化性依次增强A.①③⑤B.②④⑥C.②③④⑥D.①⑤8.下列说法不正确的是()A.碱金属元素在自然界中以化合态形式存在B.金属铷投入水中会发生爆炸式反应,生成氢氧化物和氢气C.碱金属与氧气反应,生成物都不随反应条件或反应物的用量变化而变化D.金属铯的密度大于钠,而钠的熔点高于铯9.钾元素是碱金属元素,下列对其性质的描述中,不正确的是A.K的原子半径比Na大,离子半径比Na+大B.K的金属性比Na强,跟水反应比Na剧烈C.K与CuSO4溶液发生置换反应得到金属CuD.K的最高价氧化物对应水化物的溶液可使酚酞溶液变红10.第ⅠA族金属元素习惯上又称为碱金属元素,下列关于碱金属元素某些性质的排列中,正确的是()<<<<A.原子半径:Li Na K Rb Cs<<<<B.单质的密度:Li Na K Rb Cs<<<<C.单质的熔、沸点:Li Na K Rb CsD.单质的还原性:Li Na K Rb Cs>>>>11.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是()①金属性最强的是锂②氧化性最强的是锂离子③碱性:LiOH NaOH KOH RbOH CsOH<<<<④Li 的密度最大⑤易失去1个电子形成化合物⑥粒子半径:Rb K Na +++>> Cs Cs +>A .①②③B .④⑤⑥C .②④⑥D .②③⑤⑥12.我国开发了一种新型的锂-钠合金空气电池。
高一化学碱金属1

第二章碱金属第一节钠预习导航(预习教材,提供教材关键信息)剂和还原剂,氧化产物和还原产物,③用双线桥分析氧化与还原的关系。
)改写为离子方程式加深认识。
2.金属钠露置在空气中的变化过程 银白色金属钠(Na)−→−2O 表面变暗(生成Na 2O)−−→−OH 2出现白色固体(生成NaOH)−−→−OH 2表面变成溶液(NaOH 潮解)−−→−2CO 白色块状物质(生成Na 2CO 3·10H 2O)−−→−风化白色粉末状物质(生成Na 2CO 3)3.学习元素性质的方法应将钠的结构、性质、保存、存在、用途紧密联系起来,形成主线。
充分体现结构决定性质,存在、用途及保存方法取决于性质这一思想。
【点拨】对一化学反应的认识,既要从定性上知道谁跟谁反应生成什么,还要从定量上知道反应前后质量、体积、能量等变化。
【例2】将一小块钠投入FeCl 3溶液,观察到的现象是 ( ) A .钠溶解,有铁析出,并有气体产生 B .只有气体 C .只有沉淀 D .既有气体,又有红褐色沉淀【解析】我们已经知道在金属活动顺序表中钠的位置远在铁的位置之前,但钠却不能从FeCl 3水溶液中置换出Fe 来,这是因为钠的活动性很强,钠投入FeCl 3的溶液中,首先与水反应生成NaOH 及H 2,生成的NaOH 再进一步与FeCl 3反应产生红褐色的沉淀,反应如下: 2Na+2H 2O=2NaOH+H 2 ↑3NaOH+FeC13===Fe(OH)3 ↓+3NaCl 答案:D【点拨】凡是活动性很强的金属(K 、Ca 、Na)跟盐溶液发生反应都有与此类似的反应。
只有在熔融状态下,才有可能发生金属间的置换反应。
【例3】下列各种物质的热稳定性强弱顺序排列错误的是( ) A .KMnO 4>K 2 MnO 4 C .KCl>KClO 3 C .Na 2O 2>Na 2O D .Cu(OH)2>CuO【解析】物质的热稳定性是指物质受热时转变成其他物质的性质。
高一化学碱金属

第二章高一化学碱金属第一节钠Ⅰ.学习重点:1.了解钠的物理性质:掌握钠的化学性质2.从原子结构的观点认识钠是一种活泼的金属3.了解钠的保存方法的主要用途Ⅱ.学习难点:钠的有关实验现象的观察和分析Ⅲ.训练习题:一、选择题1.下面关于金属钠的描述正确的是()A.钠的化学性质很活泼:在自然界里不能以游离态存在B.钠离子和钠原子都具有较强的还原性C.钠能把钛锆等金属从它们的盐溶液中还原出来D.钠和钾的合金于室温下呈液态:可做原子反应堆的导热剂2.钠与水反应时产生的各种现象如下:①钠浮在水面上:②钠沉在水底:③钠熔化成小球:④小球迅速游动逐渐减小:最后消失:⑤发出嘶嘶的声音:⑥滴入酚酞后溶液显红色。
其中正确的一组是()A.①②③④⑤ B.全部 C.①②③⑤⑥ D.①③④⑥3.少量钠应保存在()A.密闭容器中 B.水中 C.煤油中 D.汽油中4.取一小块金属钠:放在燃烧匙里加热:下列实验现象正确的描述是()①金属先熔化:②在空气中燃烧:放出黄色火花:③燃烧后得白色固体:④燃烧时火焰为黄色:⑤燃烧后生成浅黄色固体物质A.①② B.①②③ C.①④⑤ D.④⑤5.将2.3g钠放入100g水中:所得溶液的质量分数是()A.等于% B.等于4% C.大于%小于4% D.大于4%6.钠应用于电光源上是由于()A.高压钠灯发出的黄光射程远:透雾力强B.钠很软C.钠是一种强还原剂D.钠燃烧发出黄色火焰7.金属钠着火时:可以灭火的物质是()A.水 B.砂子 C.煤油 D.二氧化碳8.钠与水反应的离子方程式正确的是()A.2Na+3H+ 2Na++H2↑B.Na+H2O Na++OH-+H2↑C.2Na+2H2O 2Na++2OH-+H2↑D.2Na+2H2O 2Na++O2↑+2H2↑9.将一小块钠投入到NH4Cl溶液中:产生的气体是()A.O2和H2 B.只有H2 C.只有NH3 D.H2和NH310.一块表面已被氧化为氧化钠的钠块:投入50g水中:最多能产生气体:则原来被氧化的钠是()A.2.3g B.3.1g C.4.6g D.5.3g11.将一小块钠投入下列溶液时:既能产生气体又会出现沉淀的是()A.稀H2SO4 B.氢氧化钠溶液 C.硫酸铜溶液 D.氯化镁溶液12.下列说法不正确的是()A.钠是电和热的良导体B.钠在空气中燃烧生成氧化钠:并发出黄色火焰C.钠与硫化合时可以发生爆炸D.钠离子半径比钠原子半径大13.把钠放入水中:要使每100个水分子中含有1个Na+离子:所需水的质量是() A.184g B.181.8g C.180g D.183.6g14.钠在干燥空气中形成的氧化物:溶于水后:可被100g质量分数为%的盐酸恰好中和:钠的氧化物的成分是()A.Na2O2和Na2O B.Na2OC.Na2O2 D.无法确定15.相同质量的钠在下列情况下产生氢气最多的是()A.放在足量水中B.放在足量盐酸中C.放在足量CuSO4溶液中D.用刺有小孔的铝:包好放入足量水底中(假设铝不参加反应)16.将一小块金属钠久置于空气中:有下列现象:①生成白色粉末:②变暗:③生成白色固体:④发生潮解变为液体:这些现象的先后顺序是()A.①②③④ B.④③②①C.②③④① D.①③④②二、填空题17.用金属钠放入水中:要使100个水分子溶有1个钠离子:则需加水g。
高一化学方程式总结大全

高一化学方程式一、碱金属:1. 新切的钠有银白色光泽,但很快发暗;方程式:4Na+O2=2Na2O;该产物不稳定。
钠在空气中燃烧时,发出黄色的火焰;同时生成淡黄色的固体,方程式:2Na+O2==== Na2O2。
锂燃烧方程式:4Li+O2==== 2Li2O;钾燃烧方程式:K+O2==== KO2。
2.钠与氧气在不点火时平稳反应,硫的化学性质不如氧气活泼,将钠粒与硫粉混合时爆炸,方程式:2Na+S=Na2S3. 钠与水剧烈反应后滴有酚酞的水变成红色,方程式:2Na+2H2O=2NaOH+H2↑;钾与水反应更剧烈,甚至爆炸,为了安全,常在小烧杯上盖一块小玻璃片。
4. 过氧化钠粉末用脱脂棉包住,①滴几滴水,脱脂棉燃烧;方程式:2Na2O2+2H2O=4NaOH+O2↑;②用玻璃管吹气,脱脂棉也燃烧;相关的方程式:2Na2O2+2CO2=2Na2CO3+O2↑;这两个反应都是放热反应,使脱脂棉达到着火点。
在过氧化钠与水或CO2反应生成O2的两个反应中,为生成1mol O2,需要的Na2O2的物质的量都为2mol,同时需要的H2O或CO2的物质的量都为2mol。
5. 纯碱的化学式是Na2CO3,它不带结晶水,又俗名苏打。
碳酸钠晶体化学式是Na2CO3·10H2O,在空气中不稳定,容易失去结晶水,风化,最后的产物是粉末状,叫无水碳酸钠。
钠、氧化钠、过氧化钠、氢氧化钠等在空气中露置的最后产物都是无水碳酸钠。
6. 碳酸钠和碳酸氢钠两种固体物质都能够与盐酸反应放出气体,相关离子方程式分别为:CO32-+2H+=H2O+CO2↑;HCO3-+H+=H2O+CO2↑;其中,以碳酸氢钠与盐酸的反应速度更快.7. 碳酸钠和碳酸氢钠的热稳定性较差的是碳酸氢钠,其加热时发生分解,方程式是:2NaHCO3=Na2CO3+H2O+CO2↑。
在这个分解反应中,一种物质生成了三种物质,(1)高锰酸钾分解:2KMnO4==== K2MnO4+MnO2+O2↑(2)碳酸铵或碳酸氢铵分解:(NH4)2CO3==== 2NH3↑+H2O+CO2↑8. 除去碳酸钠固体中的少量NaHCO3的方法是加热;除去碳酸氢钠溶液中混有的少量Na2CO3溶液的方法是:通入足量CO2气体:Na2CO3+CO2+H2O=2NaHCO3。
新版高中化学讲义:碱金属元素

一、碱金属元素概述 1. 定义碱金属元素为第ⅠA 族(除氢)的元素。
包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs),钫(Fr),其中钫为放射性元素。
2. 相似性碱金属元素原子的最外层都有_____个电子,很容易_______,最高正价为_____价,最高价氧化物对应的水化物均为_____碱,是典型的活泼金属元素。
3. 递变性随着核电荷数的增加,碱金属元素原子的电子层数逐渐_______,原子半径逐渐______。
【答案】1 失去 +1 强 增多 增大二、碱金属元素的物理性质 碱金属 颜色状态密度/g·cm -3 熔点/Ⅰ 沸点/Ⅰ 锂 银白色柔软0.534 180.5 1347 钠 0.97 97.81 882.9 钾 0.86 63.65 774 铷 1.532 38.89 688 铯 略带金色光泽 1.87928.40678.41. 相似性第30讲 碱金属元素知识导航知识精讲碱金属单质都有______色的金属光泽(但____略带金色光泽)、硬度小、有延展性,密度小、熔沸点较低,导电、导热性良好,液态钠钾合金可做原子反应堆的导热剂。
2. 递变性随着核电荷数的增加,单质的熔点和沸点逐渐______,密度逐渐______,(但ρK ___ρNa ),且Li 、Na 、K 的密度_____1,Rb 、Cs 的密度_____1。
【答案】银白 铯 降低 增大 < < >三、碱金属与氧气的反应碱金属现象及产物化学方程式Li 不如Na 剧烈,生成Li 2O 4Li + O 2 =====△2Li 2O Na 剧烈燃烧,生成Na 2O 2 2Na + O 2 =====△Na 2O 2 K 燃烧比Na 剧烈,生成复杂的氧化物 K + O 2 =====△KO 2(超氧化钾)Rb 燃烧反应更剧烈,生成更复杂的氧化物Cs燃烧反应更剧烈,生成更复杂的氧化物【实验结论】随着核电荷数的增加,碱金属与O 2反应越来越_____,产物越来越_________。
高一化学碱金属知识点总结

高一化学碱金属知识点总结随着现代科学技术的不断发展,化学作为一门基础科学,对于我们的生活和社会产生了重要影响。
而在高中化学学习的过程中,碱金属是一个非常重要的知识点。
在这篇文章中,我们将总结高一化学中关于碱金属的知识。
1. 碱金属的特性碱金属是指周期表中第一组的元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素在自然界中大多以化合物形式存在,具有许多共同的特性。
首先,碱金属是活泼的金属。
它们容易失去电子,形成带正电荷的离子,也就是阳离子。
这是因为它们的外层电子结构只有一个s电子,而这个电子很容易被移走。
其次,碱金属是非常活泼的金属。
它们与非金属反应非常迅速,甚至可以与空气中的水分和氧气反应起火。
这种反应非常强烈,有时甚至会爆炸。
另外,碱金属的密度相对较低,而且具有较低的熔点和沸点。
这使得它们在实际应用中有一定的用途,例如在制造合金和电池中广泛应用。
2. 碱金属与水的反应碱金属与水反应是我们学习化学时经常遇到的一个实验。
这个实验可以帮助我们了解碱金属的活泼性和与水反应的产物。
当碱金属与水反应时,会发生放出氢气的反应。
这是因为碱金属的离子与水分子结合形成了氢氧化物,并释放出氢气。
例如,钠与水反应的方程式可以表示为:2Na + 2H2O -> 2NaOH + H2↑在这个反应中,钠离子与水分子结合形成了钠氢氧化物(NaOH),并释放出氢气。
需要注意的是,碱金属与水反应是一个剧烈的放热反应,反应过程中会产生大量的热量。
因此,在进行实验时应该小心操作,以免发生意外。
3. 碱金属与非金属的反应除了与水反应外,碱金属还与非金属元素发生反应。
这些反应也非常活泼,产生的产物具有一定的特点。
例如,碱金属与卤素的反应非常剧烈,会产生相应的盐。
以钠和氯为例,它们的反应可以表示为:2Na + Cl2 -> 2NaCl在这个反应中,钠与氯发生了置换反应,生成了氯化钠。
另外一个例子是碱金属与氧气的反应。
高中_高一化学碱金属

第二章高一化学碱金属第一节钠Ⅰ.学习重点:1.了解钠的物理性质,掌握钠的化学性质2.从原子构造的观点认识钠是一种活泼的金属3.了解钠的保存方法的主要用途Ⅱ.学习难点:钠的有关实验现象的观察和分析Ⅲ.训练习题:一、选择题1.下面关于金属钠的描述正确的选项是〔〕A.钠的化学性质很活泼,在自然界里不能以游离态存在B.钠离子和钠原子都具有较强的复原性C.钠能把钛锆等金属从它们的盐溶液中复原出来D.钠和钾的合金于室温下呈液态,可做原子反响堆的导热剂2.钠与水反响时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。
其中正确的一组是〔〕A.①②③④⑤ B.全部 C.①②③⑤⑥ D.①③④⑥3.少量钠应保存在〔〕A.密闭容器中 B.水中 C.煤油中 D.汽油中4.取一小块金属钠,放在燃烧匙里加热,以下实验现象正确的描述是〔〕①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质A.①② B.①②③ C.①④⑤ D.④⑤5.将2.3g钠放入100g水中,所得溶液的质量分数是〔〕A.等于% B.等于4% C.大于%小于4% D.大于4%6.钠应用于电光源上是由于〔〕A.高压钠灯发出的黄光射程远,透雾力强B.钠很软C.钠是一种强复原剂D.钠燃烧发出黄色火焰7.金属钠着火时,可以灭火的物质是〔〕A.水 B.砂子 C.煤油 D.二氧化碳8.钠与水反响的离子方程式正确的选项是〔〕A.2Na+3H+ 2Na++H2↑B.Na+H2O Na++OH-+H2↑C.2Na+2H2O 2Na++2OH-+H2↑D.2Na+2H2O 2Na++O2↑+2H2↑9.将一小块钠投入到NH4Cl溶液中,产生的气体是〔〕A.O2和H2 B.只有H2 C.只有NH3 D.H2和NH310.一块外表已被氧化为氧化钠的钠块,投入50g水中,最多能产生气体,那么原来被氧化的钠是〔〕A. B. C. D.11.将一小块钠投入以下溶液时,既能产生气体又会出现沉淀的是〔〕A.稀H2SO4 B.氢氧化钠溶液 C.硫酸铜溶液 D.氯化镁溶液12.以下说法不正确的选项是〔〕A.钠是电和热的良导体B.钠在空气中燃烧生成氧化钠,并发出黄色火焰C.钠与硫化合时可以发生爆炸D.钠离子半径比钠原子半径大13.把钠放入水中,要使每100个水分子中含有1个Na+离子,所需水的质量是〔〕 A.184g B. C.180g D.14.钠在枯燥空气中形成的氧化物,溶于水后,可被100g质量分数为%的盐酸恰好中和,钠的氧化物的成分是〔〕A.Na2O2和Na2O B.Na2OC.Na2O2 D.无法确定15.一样质量的钠在以下情况下产生氢气最多的是〔〕A.放在足量水中B.放在足量盐酸中C.放在足量CuSO4溶液中D.用刺有小孔的铝,包好放入足量水底中〔假设铝不参加反响〕16.将一小块金属钠久置于空气中,有以下现象:①生成白色粉末;②变暗;③生成白色固体;④发生潮解变为液体,这些现象的先后顺序是〔〕A.①②③④ B.④③②①C.②③④① D.①③④②二、填空题17.用金属钠放入水中,要使100个水分子溶有1个钠离子,那么需加水g。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[单选]对相同的研究对象在不同的年龄或阶段进行长期的反复观测叫()。A.横向研究B.纵向研究C.相关研究D.因果研究 [单选,A2型题,A1/A2型题]不适合做牵张训练的是()。A.骨性关节活动障碍B.影响日常功能活动或生活自理的挛缩C.肌肉无力而拮抗侧组织紧张D.由于挛缩、粘连、瘢痕所致软组织缩短性关节活动受限E.未能有效预防软组织缩短性关节活动受限而进一步造成的结构性变形 [单选]2004年修订的《传染病防治法》开始实施的时间为()A.1989年8月28日B.1995年12月1目C.2003年10月1日D.2004年8月28日E.2004年12月1日 [多选]安装工程分部分项工程量清单编制的原则有()。A.满足工程计价、施工招标的需要B.全面、准确计算工程量、避免错项、漏项C.查阅设计文件,分析拟建安装工程构成D.严格遵守法律、法规和规范 [单选]对()的管理可以称为使需求与供给相适应的平衡性营销管理。A.不规则需求B.充足需求C.过度需求D.不健康需求 [多选]()是引起无意注意的主观原因A.对事物的需要和兴趣B.当归的情绪状态C.活动的目标D.意志品质 [单选,A1型题]脑梗死临床表现中,不应有的症状或体征是()。A.意识不清B.肢体瘫痪C.头痛D.抽搐E.脑膜刺激征 [单选]患者,女,30岁。产后恶露不下,少腹疼痛拒按,以致突然头晕眼花不能坐起。可以诊断为()A.产后血晕,血虚气脱B.产后血晕,瘀阻气闭C.产后抑郁,瘀血亏虚D.产后抑郁,瘀血内阻E.产后抑郁,心脾两虚 [单选]在稀溶液凝固点降低公式△tf=Kfb中,b表示的是溶液的。A.摩尔分数B.质量摩尔浓度C.物质的量浓度D.质量分数 [填空题]HTTP协议使用的端口是(),FTP协议使用的端口是21。 [问答题,简答题]国库单一账户开设在中央银行可获得哪些财政和宏观经济利益? [单选]版样一般分大版样和小版样两种,其中大版样是用来制作柔性凸版或感光()版的。A.胶版B.树脂C.橡胶D.丝网 [单选]港口与航道工程项目技术管理的重要内容之一是()。A.项目经营目标的确定B.保险种类的比选C.编制施工组织设计D.进度控制的实施 [单选]以下关于两种路由协议的叙述中,错误的是()。A.链路状态协议在网络拓扑发生变化时发布路由信息B.距离矢量协议是周期地发布路由信息C.链路状态协议的所有路由器都发布路由信息D.距离矢量协议是广播路由信息 [单选,A1型题]预防哺乳期乳腺炎,下列不恰当的是()A.积极哺乳,避免淤乳B.预防性应用抗生素C.纠正乳头内陷D.保护乳头皮肤,避免皮肤破损E.经常清洗乳头 [单选]平瓦屋面下,聚合物改性沥青防水垫层的搭接宽度为()。A.60mmB.70mmC.80mmD.100mm [单选]办理个人教育贷款时,受理和调查环节面临的操作风险不包括()。A.借款申请人的主体资格是否符合银行个人教育贷款的相关规定B.借款申请人所提交的材料真实性C.对于商业助学贷款而言,借款申请人的担保措施是否足额、有效D.贷款业务是否按规定办妥相关评估、公证等事宜 [单选]Inmarsat通信系统由()组成。A、卫星、地面站、移动站、网络协调站B、移动站、海岸电台、卫星、控制中心C、卫星、网络协调站D、陆地移动电台、移动站、地面站 [单选]某患者80岁,记忆力障碍,对答不切题,常外出后无法救回家,你建议该患者最好做什么筛查()A.汉语失语症检查法B.构音障碍检查法C.简易精神状态检查(MMSE.D.韦氏记忆量表(WMS)E.韦氏成人智力量表(WAIS) [单选]操作员判定为无正当理由的超时车,系统默认为(),操作员可根据实际情况输入入口收费站的代码,确认后收取相应通行费。A.最近入口的收费站B.随机选择收费站C.相应路程入口的收费站D.最远入口收费站 [单选]一般情况分散或小颗粒状夹杂对材料性能的()。A、没有影响B、影响很大C、影响不大D、影响较大 [单选,A1型题]β+粒子和物质作用后,不会出现的情况是()A.产生能量相等的一对γ光子B.产生一对能量各为140keV的γ光子C.产生一对辐射方向相反的γ光子D.产生一对穿透能力比Tc强的γ光子E.产生一对γ光子,PET利用这对γ光子进行成像 [单选]当起飞模式接通时:()A、自动推力自动接通并工作B、自动推力自动接通但不工作C、自动推力不自动接通,发动机由推力杆控制D、自动推力自动接通,发动机由最后的推力目标控制 [单选,A4型题,A3/A4型题]29岁女性,7年前和3年前分别足月顺产一女孩和一男孩,1年前有一次宫外孕手术史,经咨询指导选择使用复方长效口服药避孕。关于复方长效口服避孕药,下列各项正确的是()A.复方长效口服避孕药是由炔雌醇和人工合成的长效孕激素组成的B.复方长效口服避孕药通 [单选]混凝土,轻骨料混凝土,砖及石材的强度等级代号分别是()A.C,MU,MU,CLB.C,CL,MU,MUCL,M,MU,CD.M,C,MU,CL [单选,A1型题]下列哪项不符合一侧动眼神经麻痹()。A.上睑下垂,眼球不能向上、下和内侧转动B.眼球向对侧、向上、向下注视时出现复视C.眼球向外或外下方斜视D.瞳孔散大,光反射消失,调节反射存在E.瞳孔散大,光反射及调节反射均消失 [单选,A2型题,A1/A2型题]关于冠状面,错误的说法是()A.是将人体纵切为前后两部的切面B.是将人体纵切为左右两部的切面C.与水平面垂直D.与矢状面垂直E.又叫额状面 [单选]关于三叉神经的描述以下哪项不正确()A.分布于头、面部B.主要由运动神经纤维构成C.主要由感觉神经纤维构成D.为脑神经中最粗大的神经E.有眼神经、上颌神经和下颌神经三大分支 [问答题,案例分析题]阅读下列说明,回答问题1至问题3【说明】某学校见到其他学校都陆续建立了多媒体网站作为学校的一个窗口,也想自己建立一个,就请一个计算机公司帮助建立。在公司人员和学校负责人讨论需求时,学校负责人并不能清晰表达,只能简要表达要满足学校教学和办公需求 [单选,A1型题]有关检查胎位的四步触诊法,哪项是错误的()A.用以了解子宫的大小、胎先露、胎方位B.第三步是双手置于耻骨联合上方,弄清先露部是胎头还是胎臀C.第一步是双手置于子宫底部,了解宫高度,井判断是胎头还是胎臀D.第二步是双手分别置于腹部两侧,辨别胎背方向E.第四步双 [多选]高性能商品混凝土配合比设计应遵循下列哪些法则?()A、最大水泥用量法则B、商品混凝土密实体积法则C、水胶比法则D、最小用水量法则 [单选,A型题]产气荚膜梭菌区别于其他厌氧菌最有特点的生物学性状是()A.革兰阳性粗大杆菌B.远端芽胞C.厌氧性D.菌落光滑,有溶血E.分解糖大量产气 [问答题,简答题]简述指压法止血适应证。 [单选]在人身保险合同中,保险事故发生后,被保险人仍生存则保险金请求权由()行使。A.被保险人本人B.被保险人指定的受益人C.投保人D.投保人指定的受益人 [单选,A2型题,A1/A2型题]下颌骨的主要生长中心为()A.髁状突B.喙状突C.下颌角D.正中联合E.颏孔区 [单选,A2型题,A1/A2型题]右心衰竭心功能变化的指标是()ABCDE [单选]中国特色社会主义法律体系的核心是()。A.宪法B.刑法C.民法 [单选]某县人民政府做出有关规范该县集贸市场秩序的决定,这一行为属于()。A.行政立法行为B.抽象行政行为C.具体行政行为D.行政执法行为 [多选]目前我行柜员级别分为()。A.B级柜员B.A级柜员C.现金柜员D.一般柜员 [问答题
