09级研究生《配位化学》试题(参考答案)
2009年全国普通高等学校招生统一考试上海化学试卷及答案-推荐下载

B. CuSO4 溶液吸收 H2S 气体: Cu2+ +H2S CuS +2H+
C. AlCl3 溶液中加入过量的浓氨水:
Al3+
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电通,力1根保过据护管生高线产中0不工资仅艺料可高试以中卷解资配决料置吊试技顶卷术层要是配求指置,机不对组规电在范气进高设行中备继资进电料行保试空护卷载高问与中题带资2负料2,荷试而下卷且高总可中体保资配障料置各试时类卷,管调需路控要习试在题验最到;大位对限。设度在备内管进来路行确敷调保设整机过使组程其高1在中正资,常料要工试加况卷强下安看与全22过,22度并22工且22作尽22下可护都能1关可地于以缩管正小路常故高工障中作高资;中料对资试于料卷继试连电卷接保破管护坏口进范处行围理整,高核或中对者资定对料值某试,些卷审异弯核常扁与高度校中固对资定图料盒纸试位,卷置编工.写况保复进护杂行层设自防备动腐与处跨装理接置,地高尤线中其弯资要曲料避半试免径卷错标调误高试高等方中,案资要,料求编试技5写、卷术重电保交要气护底设设装。备备置管4高调、动线中试电作敷资高气,设料中课并技3试资件且、术卷料中拒管试试调绝路包验卷试动敷含方技作设线案术,技槽以来术、及避管系免架统不等启必多动要项方高方案中式;资,对料为整试解套卷决启突高动然中过停语程机文中。电高因气中此课资,件料电中试力管卷高壁电中薄气资、设料接备试口进卷不行保严调护等试装问工置题作调,并试合且技理进术利行,用过要管关求线运电敷行力设高保技中护术资装。料置线试做缆卷到敷技准设术确原指灵则导活:。。在对对分于于线调差盒试动处过保,程护当中装不高置同中高电资中压料资回试料路卷试交技卷叉术调时问试,题技应,术采作是用为指金调发属试电隔人机板员一进,变行需压隔要器开在组处事在理前发;掌生同握内一图部线纸故槽资障内料时,、,强设需电备要回制进路造行须厂外同家部时出电切具源断高高习中中题资资电料料源试试,卷卷线试切缆验除敷报从设告而完与采毕相用,关高要技中进术资行资料检料试查,卷和并主检且要测了保处解护理现装。场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
配位化学复习题及答案

配位化学复习题及答案配位化学是无机化学的一个重要分支,它研究金属离子与配体形成配位化合物的过程和性质。
以下是一些配位化学的复习题及答案,供参考:一、选择题1. 什么是配位化合物?A. 含有金属离子的化合物B. 含有配体的化合物C. 金属离子与配体通过配位键结合形成的化合物D. 只含有金属元素的化合物答案:C2. 配位化合物中的配位键是由什么构成的?A. 金属离子和非金属离子之间的离子键B. 金属离子和配体之间的共价键C. 金属离子提供的空轨道和配体提供的孤对电子D. 配体之间的共价键答案:C3. 下列哪个不是常见的配体?A. 水分子B. 氨分子C. 二氧化碳分子D. 硫氰酸根离子答案:C4. 配位数是指什么?A. 配体的数量B. 配位化合物中的金属离子数量C. 与中心金属离子直接相连的配体数量D. 配位化合物中的总原子数量答案:C5. 什么是内界和外界?A. 内界是配体,外界是金属离子B. 内界是金属离子,外界是配体C. 内界是配位化合物的中心,外界是配位化合物的外围D. 内界和外界都是配体答案:B二、填空题6. 配位化合物的化学式通常表示为[M(L)_n]^z+,其中M代表______,L代表______,n代表______,z代表______。
答案:中心金属离子;配体;配位数;电荷数7. 配位化合物的几何构型取决于配位数,例如,四面体、平面正方形、八面体等。
当配位数为4时,常见的几何构型是______。
答案:四面体8. 配位化合物的稳定性可以通过______来衡量,它与配体的电子供体能力有关。
答案:配位常数9. 配位化合物的光学活性是由于分子的______性造成的。
答案:手性10. 在配位化学中,硬酸和硬碱倾向于形成______,而软酸和软碱倾向于形成______。
答案:硬配位键;软配位键三、简答题11. 简述什么是配位化学中的“软硬酸碱理论”?答案:软硬酸碱理论是由R. P. Pearson提出的,它根据中心金属离子和配体的相对电负性差异,将它们分为硬酸、软酸、硬碱和软碱。
研究生《配位化学》试题

化学系09级研究生《配位化学》试题姓名学号成绩一、填空题(每空1分共15分)1.命名上面左图的配合物:右图的中心原子的电荷数 ,配位数。
2.Mn(acac)3的磁矩为4.90 B.M.,试指出:(1) 中心原子氧化态, (2) 中心原子的配位数,(3) 中心原子未成对电子数, (4) 配合物的空间构型,注: acac-为乙酰丙酮根CH3C CH C CH3 O O-3.配位共价键形成的时候,中心原子提供 ,配位原子提供4.磁矩的测量证明,〔Co(NH3)6〕2+有3个未成对电子,而[Co(CN)6〕3-离子已没有未成对电子,由此说明,其中属内轨型配合物,其空间构型为;这也说明,两者比较其中更稳定。
12.实验测得Fe(H2O)63+和Fe(CN)63-的磁矩差别极大,其中CN-为强场配体,它们的空间构型为,其杂化轨道类型为,。
二.解释、区别下列名词(5*7=35分)1.单齿配体与多齿配体2.d2sp3杂化和sp3d2杂化3.简单配合物与螯合物4.低自旋配合物和高自旋配合物5.金属酶与金属蛋白6.强场配体和弱场配体7.晶体场理论与分子轨道理论三、选择题(每题3分共15分)1下列配位化合物高自旋的是 ------------------------------------ ()A、[]+363)(NHCo B、[]+263)(NHCoC、[]-362)(NOCo D、[]-46)(CNCo2、下列配合物磁矩最大的是 ------------------------------------ ()A、[]-36FeF B、[]-36)(CNMnC、[]+262)(OHNi D、[]+363)(NHCo3、Ni与CO可形成羰基配合物Ni(Co)n,其中n是 -------------------()A、6B、3C、4D、54、Cr与CO形成羰基配合物所属的点群是 ---------------------------()A、D3h B、TdC、 OhD、D6h5、下列配合物中几何构型偏离正八面体最大的是 --------------------()A、[]+262)(OHCu B、[]+262)(OHCoC、[]-36)(CNFe D、[]-46)(CNNi四.分子的点群填空题(3*5=15分)1.H3BO3分子是群,由于B与O原子都以Sp2杂化与其它原子成键,所以整个分子在一个平面上。
配位化学习题答案

配位化学习题答案【篇一:配位化学及答案】ss=txt>配位化学一.(12分)配位化合物a是单核配合物分子,由11个原子组成;微热后失重11.35%得到b;b进一步加热又失重26.66%(相对b)得到金属c;b极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。
a有2种异构体a1、a2,其中a2能与草酸盐反应得到一种式量比a略大的配合物分子d(a1无相似反应)1.写出a、b、c的化学式;2.写出b溶于盐酸后产物的名称;3.试画出a1、a2、d的结构,并比较a1、a2在水中溶解性的大小。
4.a还有若干种实验式相同的离子化合物。
它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。
(1)符合上述条件的离子化合物的精确的分子式有多少种。
(2)其中1种与agno3反应(摩尔比1︰2)得到两种组成不同的配合物,写出反应的化学方程式。
二.(7分)某Ⅷ族不活泼金属a溶于足量的王水生成b的溶液(a的含量为47.60%);将so2通入b的溶液中,得到c的溶液(a的含量为57.56%)。
已知b、c的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定a的元素符号;2.写出所涉及反应的化学方程式。
3.画出b、c阴离子的空间构型。
三.(11分)太阳能发电和阳光分解水制氮,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面。
下图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带(未充填电子的分子轨道构成的能级最低的能带)与价带(已充填价电子的分子轨道构成的能级最高的能带)+子、h为空穴。
瑞士科学家最近发明了一种基于上图所示原理的廉价光电化学电池装置,其半导体电极由2个光系统串联而成。
系统一由吸收蓝色光的wo3纳米晶薄膜构成;系统二吸收绿色和红色光,由染料敏化的tio2纳米晶薄膜构成。
在光照-下,系统一的电子(e)由价带跃迁到导带后,转移到系统二的价带,再跃迁到系统二的导带,然后流向对电极。
高中化学竞赛,强基计划,大学化学自招,配位化学-2009-2019全国初赛真题

高中化学竞赛,强基计划,大学化学自招,配位化学-2009-2019全国初赛真题高中化学奥林匹克竞赛辅导配位化学-2009-2019年全国初赛真题2019第5题将某镧系元素的无水氯化物和异丙基醇钠在异丙醇中回流,得淡蓝色溶液。
该溶液经过蒸发浓缩、真空干燥,所得固体在甲苯中低温重结晶,析出淡蓝色针状晶体A,A为稀土离子的配合物,加热至300℃也不分解。
进一步分析表征结果如下:(1)溶液电导测定显示:A为1:1电离类型,只有一种外界离子。
称取6.354g晶体A,溶解后加入足量硝酸银溶液,得到0..4778g乳白色沉淀B。
(2)A的元素分析结果为:C,32.02%;H,6.17%;O,14.35%;均为质量分数。
(3)单晶X射线衍射分析显示,A的结构中,氯仅有一种环境;稀土离子所处环境完全相同,它与配体结合成多聚团簇,每个离子周围有5个氧原子;氧原子均参与配位且有3种类型(端基、边桥基和面桥基)。
5-1.计算A的摩尔质量。
5-2.通过计算,推出A的化学式。
5-3.写出配合物结构中端基氧、边桥基氧和面桥基氧的数目。
解:5-1、M(A)=1906 g/mol5-2、Nd6(C3H7O)17Cl5-3、6个端基、9个边桥基、2个面桥基【解析】5-1、乳白色沉淀B为AgCl,n(AgCl)=0.4778 g/143.4 g/mol=0.003332 mol因A为1︰1电离类型即含1个Cl-,则M r (A)=6.354 g/0.003332 mol=1907 g/mol5-2、A分子中含:N(C)= 1907×32.02%/12=51N(H)=1907×6.17%/1=119N(O)=1907×14.35%/16=17设A的化学式为Nd x(C3H7O)17Cl,144.2x=1907—17×59—34.45=869.6 x=65-3、根据题意,6个Nd各与1个C3H7O-中端基氧配位,共6个端基氧;虚线组成上、下2个正三角形,6个交点是6个Nd。
配位化学的应用考研题库及答案

配位化学的应用考研题库及答案配位化学是无机化学的重要分支之一,研究金属离子与配体之间的相互作用和配位化合物的性质。
在化学考研中,配位化学的应用题是必考的一部分。
本文将从配位化学的基本概念、应用题的类型以及解题技巧等方面,为考生提供一些有益的信息。
一、配位化学的基本概念配位化学研究的是金属离子与配体之间的配位作用。
在配位化合物中,金属离子通过配体的配位作用形成配位键,形成稳定的配位化合物。
配位化合物的性质与金属离子和配体的性质有关,如配体的配位能力、配位数等。
二、应用题的类型在考研中,配位化学的应用题主要分为以下几种类型:1. 配位数的确定:题目给出一个配位化合物的结构和化学式,要求确定其中金属离子的配位数。
解答此类题目时,可以根据配位化合物的结构和化学式,利用已知的配位数规律进行判断。
例如,八面体结构的配合物一般配位数为6,四面体结构的配合物一般配位数为4。
2. 配位键的类型:题目给出一个配位化合物的结构和化学式,要求确定其中配位键的类型。
解答此类题目时,可以根据配位键的形成原理进行判断。
例如,当配体通过一个或多个氧原子与金属离子形成配位键时,配位键的类型为配位键。
3. 配位反应的类型:题目给出一个配位反应的化学方程式,要求确定配位反应的类型。
解答此类题目时,可以根据配位反应的特点进行判断。
例如,当配位化合物中的一个或多个配体被替换为其他配体时,配位反应的类型为置换反应。
三、解题技巧在解答配位化学的应用题时,可以采取以下一些解题技巧:1. 理清思路:在解答题目之前,先理清思路,明确题目要求和所给信息。
可以先画出配位化合物的结构,标明其中的金属离子和配体,有助于更好地理解题目。
2. 利用已知规律:配位化学有一些已知的规律,如不同配位数对应的配位几何形状、不同配位键的类型等。
在解答题目时,可以利用这些已知规律进行判断和推理。
3. 注意反应类型:在解答配位反应类型的题目时,要注意配位反应的特点。
例如,置换反应中,配体的离去和进入是同时进行的;配体的离去和进入速率不一定相等。
2009年中科院有机化学真题及答案 (1)
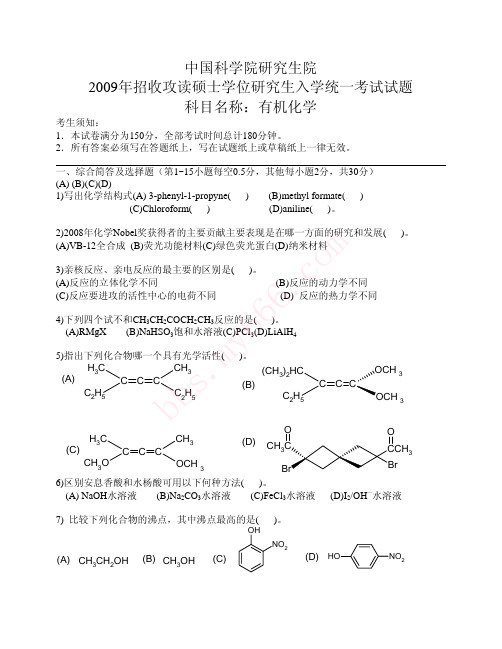
m 峰为 1740 cm-1,1.0 (3H,三重峰),1.3 (6H,双重峰),2.1 (2H,多重峰), co 4.2 (1H,三重峰),4.0 (4H,多重峰),推断该化合物的结构式,并指定谱图 . 各峰的归属。 666 3)(6 分)非环状某化合物A分子式为C7H12O2,其IR谱图在3000-170 y 0 cm-1处有吸收峰,UV于λ为200nm以上无吸收峰,在H2SO4存在下 m 加热得B和C,B和C互为异构体,分子式为C7H12O,B为主要产物,在 s. λ﹥258nm处有紫外吸收,而C在220nm处有紫外吸收,试推出A、B、 bb C的结构式。
1. A 的不饱和度=3,吸收 1mol 氢表明含一个双键、一个环和一个羰基
(1745); B 的氘交换表明有三个α氢;甲基在 A 中为单峰表明它连在双
键上,氢化后有一个相邻氢,所以 C 中为双峰;Baeyer-Villiger 氧化发生在
取代较多的一侧。各化合物的结构如下:
1745 CsH3
A
(A) CHO ( ) (B) CH=CH ( ) (C) OCH 3 ( ) (D) 苯上H ( )
二、写出下列反应的主要有机产物,或所需反应条件及原料或试剂(如有立体化学请注明) (每空2分,共30分)
1)
CH2 N
TsCl
CH2OH
Br
H
2)
Br Li
CuBr (
H3C
CH3
)
(
)
3)
O3
CH3SCH3
配位化学(09B)标准

复习题参考答案一、 命名或写出结构式(10分)1.Ni(CO)4 2. [Co(NH 3)3Cl 3] 四羰基合镍 三氯▪三氨合钴(Ⅲ) 3. trans -[Pd(NH 3)2Br 2] 4. [(NH 3)4Co(NH 2)2Co(NH 3)4]4+ 反-二溴▪二氨合钯(Ⅱ) 二(μ-氨基)八氨合二钴(Ⅲ) 5. K 3[Mn(CN)6] 6. [Cr(en)3]Cl 3六氰合锰(Ⅲ)酸钾 氯化三(乙二氨)合铬(Ⅲ) 7.顺—二氯·四氨合Co (Ⅱ) 8. [Pt(NCS)2(NH 3)2]Cl 3NH 3NH 3ClCoNH 二氨·四异硫氰合铂(Ⅱ)9.面-三硝基•三氨合钴(Ⅲ) 10. 二(μ—羟)·四氯合二铝(Ⅲ)3NH 3CoNO 2NO 2O N 2H N 3AlClAl Cl ClClHO HO二、 填空题(15分)1. 配离子[Mn(H 2O)6]2+中,Mn 2+价电子层d 电子数为: 5 ,配位结构为: 八面体 ,分子磁距为: 5.92 。
2.[Co(en)2(Br) (Cl)]NO 2与[Co(en)2(Br)(NO 2)]]Cl 互为 电离 异构体,[Pd(NH 3)3(NO 2)]与[Pd(NH 3)3(ONO)]Cl 互为 键合 异构体,而[Zn(NH 3)4][PtCl 4] 与[ZnCl 4][Pt(NH 3)4]互为 配位 异构体.3. 配合物按S N 1历程进行取代反应时,随着中心原子正电荷增加,速率 减小 ;离去配体负电荷增加,速率减小 ;共存配体体积增大,速率 增大 。
4.配合物[Fe(phen)3]3+为 低 自旋配合物,晶体场稳定化能值为 20Dq-2P ,分 子构型为 八面体 ,中心离子Fe 3+采用 d 2sp 3 杂化。
5.[Cr (H 2O)6] 2+ 是 活 性配合物,[Cr(H 2O)6]3+ 是 惰 性配合物。
配位化学课程考试题
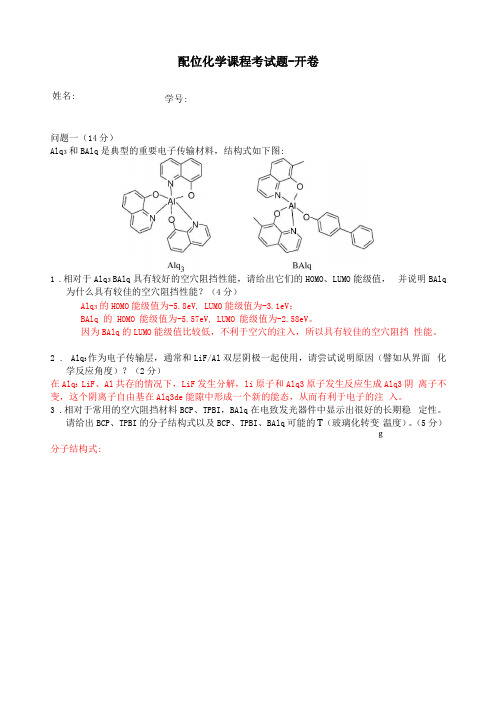
配位化学课程考试题-开卷姓名:学号:问题一(14分)Alq3和BAlq是典型的重要电子传输材料,结构式如下图:1.相对于Alq3 BAlq具有较好的空穴阻挡性能,请给出它们的HOMO、LUMO能级值,并说明BAlq为什么具有较佳的空穴阻挡性能?(4分)Alq3的HOMO能级值为-5.8eV, LUMO能级值为-3.1eV;BAlq 的HOMO 能级值为-5.57eV, LUMO 能级值为-2.58eV。
因为BAlq的LUMO能级值比较低,不利于空穴的注入,所以具有较佳的空穴阻挡性能。
2. Alq3作为电子传输层,通常和LiF/Al双层阴极一起使用,请尝试说明原因(譬如从界面化学反应角度)?(2分)在Alq3 LiF、Al共存的情况下,LiF发生分解,li原子和Alq3原子发生反应生成Alq3阴离子不变,这个阴离子自由基在Alq3de能隙中形成一个新的能态,从而有利于电子的注入。
3.相对于常用的空穴阻挡材料BCP、TPBI,BAlq在电致发光器件中显示出很好的长期稳定性。
请给出BCP、TPBI的分子结构式以及BCP、TPBI、BAlq可能的T (玻璃化转变温度)。
(5分)g分子结构式:BCP 、TPBI 、BAlq 可能的 T g 分别为:80℃、100℃、200℃ 4 .给出BCP 、TPBI 、Alq 3电子迁移率大小顺序。
(3分)问题二(34分)有机磷光金属配合物及电致磷光器件是当前有机电致发光研究领域的热点之一:1 说明基于磷光材料的电致发光器件的内量子效率,理论上,能够达到100%。
(4分) 再临光器件的发光层,主发光体的单重激发态与三重激发态的能量都可以分别由Foster 能 量转移和Dexter 能量转移到磷光发光体的单重激发态和三重激发态中,再经由磷光发 光体内部快速的系间窜越将单重激发态的能量转换到三重激发态,进而放出磷光,因 而内部量子效率可接近100%。
2 假定电致磷光器件的外量子为100%,通常情况下,外量子效率为多少?为什么? (4分)?试分析提高外量子效率的途径?(4分)p3151发光层具有较高的光致发光的效率2磷光材料(磷光材料可以通过采用重原子效应、降低体系温度和向体系内引入顺磁分子的 方法提高量子产率)3在发光层内,实现电荷以及激子限制4提高发射光耦合出射效率3 以非离子、分子型电致磷光铱配合物为例,当前,蓝、天蓝、绿、黄、红、近红外发光材料都已报道。
(完整版)应用化学09级分析化学第一次课堂练习参考答案

华 侨 大 学 分析化学第一次课堂练习 参考试卷 系别 应用化学2009级 考试日期 2010 年 11 月 日 姓名 学 号一、选择题 ( 共10题 30分 )1. 3 分 (4281)对于下列四种表述,不正确的是----------------------------------------------( A )(1) 为了减小测量误差,称样量越大越好(2) 仪器分析方法因使用仪器,因此准确度高(3) 增加平行测定次数不能消除系统误差(4) 做空白试验可消除系统误差(A)1,2 (B)1,2,4 (C)1,3,4 (D)1,2,32. 3 分 (4252)关于准确度与精密度关系的四种表述中正确的是----------------------------( A )(1) 精密度是保证准确度的必要条件(2) 高的精密度一定能保证高的准确度(3) 精密度差,所测结果不可靠,再衡量准确度没有意义(4) 只要准确度高,不必考虑精密度(A )1,3 (B)2,4 (C)1,4 (D)2,33. 3 分 (0220) 可用下列何种方法减免分析测试中的系统误差---------------------( A )(A) 进行仪器校正 (B) 增加测定次数(C) 认真细心操作 (D) 测定时保持环境的温度一致4. 3 分 (4264)下面四个数据中含有非有效数字的是-----------------------------------------( A )(1) 0.2081 (2) 0.02418 (3) 25.00 (4)1.000(A)1,2 (B)3,4 (C)1,3 (D)2,45. 3 分 (2301)某电解质MA(M 2+,A 2-)溶液,其浓度c (MA) = 0.10mol/L,则该溶液的离子强度为---( C )(A) 0.10mol/L (B) 0.30mol/L(C) 0.40mol/L (D) 0.60mol/L6. 3 分 (0402) 用NaOH 滴定某一元酸HA,在化学计量点时,[H +]的计算式是------( D )(A) )(a H A ⋅c K (B) )()(a -A H A ⋅c c K (C) )(a W -A ⋅c K K (D) )(W a -A ⋅c K K 7. 3 分 (0616) 欲用酸碱滴定法在水溶液中测定NaAc 试剂的纯度,采用指示剂确定终点,达到0.2%准确度,以下何种方法可行---------------------------------------------------( D )[p K a (HAc) = 4.74](A) 提高反应物浓度直接滴定 (B) 采用返滴定法测定(C) 选好指示剂,使变色点恰与化学计量点一致 (D) 以上方法均达不到8. 3 分 (0307)浓度相同的下列物质水溶液的pH 最高的是----------------------------------------------( D )(A) NaCl (B) NaHCO 3(C) NH 4Cl (D) Na 2CO 39. 3 分 (0501)将浓度相同的下列溶液等体积混合后,能使酚酞指示剂显红色的溶液是-----------( B )(A) 氨水+醋酸 (B) 氢氧化钠+醋酸(C) 氢氧化钠+盐酸 (D) 六次甲基四胺+盐酸10. 3 分 (0421) 欲配制pH=9的缓冲溶液,应选用---------------------------------------( B )(A) NH 2OH(羟氨) (K b = 9.1×10-9) (B) NH 3·H 2O (K b = 1.8×10-5)(C) CH 3COOH (K a = 1.8×10-5) (D) HCOOH (K a = 1.8×10-4)二、填空题 ( 共10题 30分 )11. 3 分 (4320) 写出下列溶液的质子平衡方程式:(1) NH 4H 2PO 4 _[][][][][][]3342443NH PO 2HPO OH PO H H +++=+---+___。
未完待续研友提供的09化工真题答案

未完待续]2009年华南理工大学-化工原理-试卷答案注:这是我自己做的答案,有什么问题或疑问请跟贴提出。
如问其他年份的答案,也欢迎,但由于知识能力局限不保证所有答案正确)2009 年攻读硕士学位研究生入学考试试卷参考答案一、填空、选择题(50分)1、某设备内真空表的读数为375mmHg,其绝压等于0.0513MPa,(设当地的大气压为1.013×105Pa)。
2、流体在圆管内作层流流动时,其流体阻力损失与管内流速u一次方成正比。
3、边长为0.5m的正方形通风管,该管道的当量直径为0.5m。
4. 离心泵在管路系统中工作时,其工作点是由离心泵的特性曲线和管路的_特性曲线_共同确定。
5. 其他条件不变,被输送流体的温度提高,离心泵的允许安装高度_下降;提高上游容器的操作压强,离心泵允许安装高度__降低_。
6. 球形颗粒在20ºC空气中沉降(设沉降过程符合stocks定律),其他条件不变,空气温度上升时,沉降速度将_降低_; 若该颗粒在水中沉降,当水温升高,其沉降速度将_增加_。
7. 用压滤机分离悬浮物,忽略过滤介质阻力,滤饼不可压缩。
过滤时间增加一倍,滤液量增加到原来的_根号2倍___;过滤面积增加一倍,滤液量增加至_2倍_。
8. 有一套管换热器。
环隙中1200C饱和水蒸气冷凝加热小管内空气,空气呈湍流流动状态,其对流传热系数为70 W⋅m-2⋅℃-1,若将上述套管中空气流量增大一倍,其他条件和物性基本保持不变,此时,套管的总传热系数约等于_70的0.8次方__ W⋅m-2⋅℃-1。
上述套管换热器内管壁温度接近于____70__ oC。
9.为了减少高温物体热辐射损失,往往在高温物体周围设置热屏障,热屏障材料的黑度减小,则热辐射损失增加10、当管子由水平放置改为垂直放置,其他条件不变,其能量损失C。
A. 增大B. 减小C. 不变D. 不确定11、并联管路的阻力损失等于C。
A. 各并联支管损失之和B. 各并联支管阻力损失的平均值C. 任一并联支管的阻力损失D. 不确定12.传热速率方程中的传热面积与热流方向B;A.相互平行; B. 相互垂直; C. 斜交 ; D.相对位置不确定13.一台换热器,管内、管外的对流传热系数分别为60 W⋅m-2⋅℃-1和10000 W⋅m-2⋅℃-1,换热管为φ25×1.5mm的紫铜管,若污垢热阻不计,则该换热器的控制热阻约为D m2.0C.W-1。
2009年九年级化学学业水平调研考试试题及答案【湛江市】2009年九年级化学学业水平调研考试试题及答

化学试卷温馨提示:1.测试时间60分钟,满分120分。
2.可能用到的相对原子质量:H—1 B—11 C—12 N—14O—16 Na—23 Mg—24 S—32选择题(共48分)一.单项选择题(以下第1-12小题,每小题只有一个选项符合题意,每小题3分,共36分。
)1.“做年例”是湛江一些乡村所特有的民间民俗活动。
下列各项活动主要涉及化学变化的是()A.逛花桥,赏心悦目B.游飘色,惊奇逼真C.舞醒狮,虎虎生威D.燃烟花,喜庆洋溢2.不用其他试剂,可以鉴别石蕊、盐酸、氢氧化钙、氢氧化钠、碳酸钠五种溶液,第二个被鉴别出来的物质是( )A.盐酸B.氢氧化钙 C.氢氧化钠 D.碳酸钠3.为测定空气中一氧化碳的污染程度,可采用五氧化二碘(化学式为I2O5)与一氧化碳反应。
其中五氧化二碘中碘元素的化合价为( )A.—5 B.+2 C.+3 D.+54.下列各组离子在溶液中一定能大量共存的是( )A.H+、C1—、OH—B.H+、SO42—、HCO3—;C.Ba2+、H+、SO42—D.Cu2+、C1—、N03—5.荔枝种植是廉江农业的“亮点”之一。
某果农种植的荔枝因欠缺磷肥和氮肥而出现生长较慢,叶色泛黄,且产量较低的现象。
下列化肥最适合他使用的是()A.尿素〔CO(NH2)2〕B.磷酸二氢铵(NH4H2PO4)C.磷酸二氢钙〔Ca(H2PO4)2〕D.硝酸钾(KNO3)6.2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest),有一类物质也好似鸟巢,如化学式是B5H9的五硼烷。
下列有关五硼烷的说法错误的是( )A.五硼烷属于化合物B.五硼烷的相对分子质量是64C.五硼烷中硼元素和氢元素的质量比为5∶9D.1个五硼烷分子由5个硼原子和9个氢原子构成7.使用手机长时间通话会受电磁辐射,可引起人头昏、头痛、失眠等症。
科学家发现富含北京奥运会主维生素的食物具有较强的防辐射功能。
下列食物中富含维生素C的是( ) A.豆腐B.牛奶C.油菜D.米饭8.下列物质的俗名与化学式一致的是( )A.水银Ag B.纯碱NaHCO3C.酒精CH4O D.烧碱NaOH9.为提高染发剂染色效果,一般先用碱剂等对头发预处理。
配位化学试题

《配位化学》试卷学号 姓名 班级一、命名下列配合物(12分)1、232)(P Ph PtCl2、Cl NO OH NH NH Py Pt )])()()(([2233、)])(()([2223NH NO NH Pt二、选择题(30分)1、.配位化学的奠基人是( )A 、阿仑尼乌斯B 、路易斯C 、鲍林D 、维尔纳2、.维生素B12的中心金属离子是( )A 、Fe 2+B 、Fe 3+C 、Co 2+D 、Co 3+3、关于[Cu(CN)4]3-的空间构型及中心离子的杂化类型叙述正确的是( )A 、平面正方形,d 2sp 3杂化B 、变形四边形,sp 3d 杂化C 、正四面体,sp 3杂化D 、平面正方形,sp 3d 2杂化4、乙二胺能与金属离子形成下列中的那种物质( )A 、复合物B 、沉淀物C 、螯合物D 、聚合物5、下列说法中错误的是( )A 、配合物的形成体通常是过渡金属元素B 、配键是稳定的化学键C 、配键的强度可以和氢键相比较D 、四面体配合物中,不存在顺反几何异构现象6、内轨型配离子[Cu(CN)4]2-的磁距等于2.0B.M.判断其空间构型和中心离子的杂化轨道分别为( )A 、四面体形和sp 3B 、正方形和dsp 2C、八面体形和sp3d2D、八面体形和d2sp37、下列说法中错误的是()A、对于Ni2+来说,当配位数为6时,无论是强声或弱声配体本位,只能采用sp3d2杂化B、对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或sp3杂化C、无论中心离子杂化轨道是d2sp2或sp3d2,其构型均为八面体形D、配合物中,由于存在配键,所以配合物都是弱电解质8、下列配离子都具有相同的强场配体(CN-)其中属于外轨型配合物的是()A、[Zn(CN)4]2-B、[Cu(CN)4]2-C、[Ni(CN)4]2-D、[Co(CN)6]3-9、[Co(NO2)6]3-显黄色(吸收紫光),而[Co(NH3)6]3-显橙色(吸收蓝光),根据它们颜色(或所吸收光的波长)判断出Co3+在这两种配离子中分裂能(△)的大小为()A、相等B、不能判断C、△[Co(NO2)6]3->△[Co(NH3)6]3+D、△[Co(NO2)6]3-<△[Co(NH3)6]3+10、已知[Ag(NH3)2]+的K稳=1.12*107,在1升的0.1mol.L-1的Ag+溶液中,欲使Ag+的浓度降低到2.0*10-7mol.L-1,需要加入的NH3的物质的量为()(摩尔)A、0.1 B、0.2 C、0.3 D、0.4三、填空题(14分)1、Mn(CN)6]-4和[Fe(CN)6]3-都是自旋配合物,其中Mn2+和Fe3+均以____杂化轨道与CN_ 成键;[MnCl6]4-和[FeCl6]3-都是自旋配合物,其中Mn2+和Fe3+均以杂化轨道与Cl-成键。
配位化学答案

(四)配位化学答案一.(12分)配位化合物A 是单核配合物分子,由11个原子组成;微热后失重11.35%得到B ;B 进一步加热又失重26.66%(相对B )得到金属C ;B 极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。
A 有2种异构体A 1、A 2,其中A 2能与草酸盐反应得到一种式量比A 略大的配合物分子D (A 1无相似反应)1.写出A 、B 、C 的化学式;2.写出B 溶于盐酸后产物的名称;3.试画出A 1、A 2、D 的结构,并比较A 1、A 2在水中溶解性的大小。
4.A 还有若干种实验式相同的离子化合物。
它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。
(1)符合上述条件的离子化合物的精确的分子式有多少种。
(2)其中1种与AgNO 3反应(摩尔比1︰2)得到两种组成不同的配合物,写出反应的化学方程式。
答案:1.A :Pt(NH 3)2Cl 2(1.5分) B :PtCl 2(1分) C :Pt (1分)2.四氯合铂(Ⅱ)酸(1分)3.A 1:PtNH 3H 3N Cl(1分) B :Pt Cl H 3N H 3N(1分) D :Pt O H 3N H 3N O O O (1.5分) 在水中溶解度较大的是A 2(1分)4.(1)4种([Pt(NH 3)4]重+、[Pt(NH 3)3Cl]+与[Pt(NH 3)Cl 3]-、[PtCl 4]2-组合)(1分)(2)[Pt(NH 3)4][PtCl 4]+2AgNO 3=Ag 2[PtCl 4]+[Pt(NH 3)4](NO 3)2(2分二.(7分)某Ⅷ族不活泼金属A 溶于足量的王水生成B 的溶液(A 的含量为47.60%);将SO 2通入B 的溶液中,得到C 的溶液(A 的含量为57.56%)。
已知B 、C 的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定A 的元素符号;2.写出所涉及反应的化学方程式。
配位化学—研究生版

下列表述正确的是晶体场活化能=反应物的晶体场稳定化能-过渡态的晶体场稳定化能。
一个化学体系吸收了光子之后,将引起下列哪种过程产生荧光指出下列说法中哪个有错误?磷光光谱与最低激发三重态的吸收带之间存在着镜像关系。
ziegler _natta 催化属于配位催化在循环伏安法的研究中一般使用的电极系统是三电极系统电喷雾质谱的离子化方式是哪种?强电场用实验方法测定某金属配合物的摩尔吸收系数e,测定值得大小决定于配合物的性质哪位化学家提出了超分子化学的概念?j.m.lehn紫外-可见吸收光谱主要决定于分子的电子结构下列表述正确的是外界机理中电子转移的速度非常快在o2,oh-,f-,cl-,br-,l-等离子与co3+所形成的配合物中,I-的配合物吸收波长最短哪种元素是含量最多的微量金属元素?fe下列表述正确的是?配合物配体取代反应的速度与金属离子的d电子构型有关已知[nicl4]2-是顺磁性分子,则它的几何形状为四面体形大部分配合物催化剂是过渡金属,主要因为它们有着d电子结构荧光分析法和磷光分析法的灵敏度比吸收光度法的灵敏度高下列配合物中,在水溶液中解离度最小的是[pt(nh3)2cl2]下列各组配位体中,二者均可作为螯合剂的是en、c2o42-下列不是还原剂的是seo2分子荧光过程是光致发光影响中心原子配位数的因素有其余三条都是粉末x射线衍射进形晶体结构确定的困难在于?衍射峰重叠x射线最早是哪位科学家发现的?伦琴拉曼散射发生的原因是,分子振动改变了分子的极化率cro42-具有较深的颜色,其中心离子为cr(vi),氧化能力强,该离子的电子跃迁是lmct欲测某有色物的吸光光谱,下列方法中可以采用的是分光光度法正八面体场中d轨道能级分裂为两组,其中能量较低的一组称为t2g,不包括下列哪种轨道dx2-y2电喷雾质谱峰一般用哪种方法归属?同位素分布下列选项中正确的是?中心离子半径和电荷增加,缔合机理反应更易进行。
红外光谱法,试样状态可以是气,液,固态都可以以下配体中不能够作为异性双基配体(两可配体)的是nh3用于治疗癌症的第一代含铂药物是trans-[ptcl2(nh3)2]已知某反应的级数为一级,则可确定该反应一定是其他都有可能配位催化中,离去配体底下位阻大小对催化速率额的影响越大速率越快在醇类化合物中,o-h伸缩振动频率额随溶液浓度的增加,向低波数方向位移的原因是形成氢键随之加强循环伏安法中可逆电极过程的阳极和阴极的峰电压的差值随扫描速率增大而不变下列哪项不是影响晶体场分裂能的主要原因未配位的溶剂分子由于羰基既是б电子对给予体,又是π电子对(接受体),因而羰基是π酸配体。
配位化学习题及答案

配位化学习题及答案
配位化学学习题及答案
配位化学是化学中一个重要的分支,涉及到配合物的结构、性质和反应等方面。
以下是一些配位化学的学习题及答案,希望能帮助大家更好地理解这一领域的
知识。
1. 什么是配合物?
答案:配合物是由中心金属离子和周围的配体组成的化合物。
配体通常是能够
提供一个或多个孤对电子给中心金属离子的分子或离子。
2. 什么是配位数?
答案:配位数是指一个中心金属离子周围配体的数量。
例如,对于[Fe(CN)6]4-
这个配合物来说,铁离子的配位数为6。
3. 什么是配位键?
答案:配位键是指中心金属离子和配体之间的化学键。
这种键通常是由配体中
的孤对电子和中心金属离子形成的。
4. 什么是配位化合物的立体化学?
答案:配位化合物的立体化学涉及到配体和中心金属离子之间的空间排布。
这
种排布对于配合物的性质和反应有很大的影响。
5. 什么是配合物的分子结构?
答案:配合物的分子结构是指配体和中心金属离子之间的空间排布。
这种排布
可以通过X射线衍射等方法来确定。
通过以上学习题及答案,我们可以更好地理解配位化学这一领域的知识。
希木
大家能够通过学习不断提高自己的化学水平,为将来的科研和工作打下坚实的
基础。
配位化学习题答案
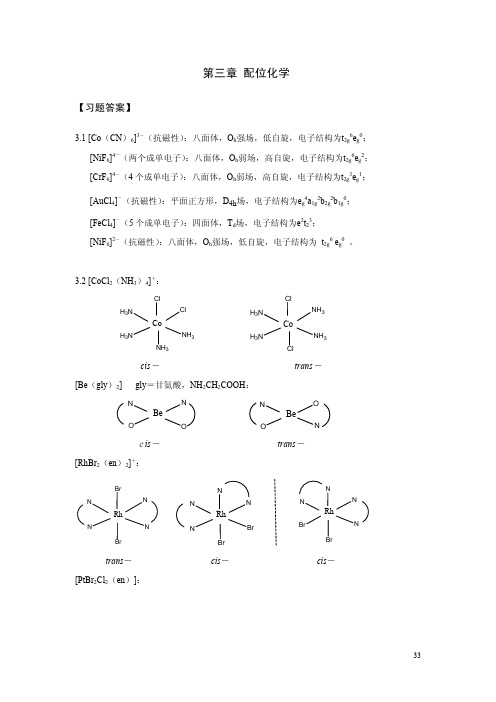
第三章 配位化学【习题答案】3.1 [Co (CN )6]3-(抗磁性):八面体,O h 强场,低自旋,电子结构为t 2g 6e g 0;[NiF 6]4-(两个成单电子):八面体,O h 弱场,高自旋,电子结构为t 2g 6e g 2; [CrF 6]4-(4个成单电子):八面体,O h 弱场,高自旋,电子结构为t 2g 3e g 1; [AuCl 4]-(抗磁性):平面正方形,D 4h 场,电子结构为e g 4a 1g 2b 2g 2b 1g 0;[FeCl 4]-(5个成单电子):四面体,T d 场,电子结构为e 2t 23;[NiF 6]2-(抗磁性):八面体,O h 强场,低自旋,电子结构为 t 2g 6 e g 0 。
3.2 [CoCl 2(NH 3)4]+:ClNH 3H 3NH 3NCoClNH 3NH 3NH 3H 3NH 3NCoClClcis - trans -[Be (gly )2] gly =甘氨酸,NH 2CH 2COOH :NONOBeONN O Becis - trans - [RhBr 2(en )2]+:NNNNRhBrBrNBrNNRhNNNNBrRhNBrtrans - cis - cis - [PtBr 2Cl 2(en )]:BrBrNNPtClClClNNPtBrBrBrClNNPtBrClBrClNNPtBr[Ir (C 2O 4)2Cl 2]3-:OOOOIrClOClOOIrOClOClOOIrOCltrans - cis - cis - [Cr (gly )3]:NOONCrNONOONCrNON ON OCrN ON ON OCrNOmer - mer - fac - fac - [Pt (gly )2]:NONOPtONNO Ptcis - trans -3.3 [M (A -B )2]为旋光活性的,说明它的结构为四面体:ABBA M A BBA M[M (A -B )2X 2]为旋光活性的,说明它的结构为cis -八面体A BB XM A XA BB XM A X3.4 Ti 3+为d 1组态,在O h 弱场中的跃迁为2T 2g → 2E g ,对应谱图中的吸收峰。
配位化学答案

配位化学答案【篇一:配位化学补充习题及答案】1. 画出下列配合物和配合离子的几何结构: (a) [pt(en)2]2+;(b) 顺-二水二草酸合铁(iii)离子; (c) 反-二氯二联吡啶;(d) 四碘合汞(ii)离子;(e) [mo(en)3]3+;(f) 五氨一氯合钒(ii)离子;(g) 顺-二氨二硫氰酸根合钯(ii)。
2. co(nh3)5(so4)br有两种异构体,一种为红色,另一种为紫色。
两种异构体都可溶于水形成两种离子。
红色异构体的水溶液在加入agno3后生成agbr沉淀,但在加入bacl2后没有baso4沉淀。
而紫色异构体具有相反的性质。
根据上述信息,写出两种异构体的结构表达式。
3. 某一锰的配合物是从溴化钾和草酸阴离子的水溶液中获得的。
经纯化并分析,发现其中含有(质量比)0.0% 锰,28.6% 钾,8.8% 碳和29.2% 溴。
配合物的其它成分是氧。
该配合物水溶液的电导性与等摩尔浓度的k4[fe(cn)6]相同。
写出该配合物的化学式,用方括号表示配位内界。
4. 下列化合物中,中心金属原子的配位数是多少?中心原子(或离子)以什么杂化态成键?分子或离子的空间构型是什么? ni(en)2cl2 ,fe(co)5 , [co(nh3)6]so4, na[co(edta)].5. 硫酸亚硝酸根五氨合钴(iii)的化学式是(1)___________;(nh4)3[crcl2(scn)4]的学名是(2)____________;6 判断题:( (1)配位键都是由金属离子接受电子对形成的;(2)多数配离子能存在于水溶液中;(3)含两个配位原子的配体称螯合体;(4)通常情况下外轨型配合物的配位原子比内轨型配合物的配位原子的电负性大。
7. 选择题:(1)下列说法正确的是()。
(a)只有金属离子才能作为配合物的形成体; (b)配位体的数目就是形成体的配位数; (c)配离子的电荷数等于中心离子的电荷数;(d)配离子的几何构型取决于中心离子所采用的杂化轨道类型。
智慧树知到《配位化学研究生版》章节测试答案

智慧树知到《配位化学研究生版》章节测试答案第一章1、配位化学发展史上最早见于记录的配合物是()A:普鲁士蓝KCN.Fe(CN)2.Fe(CN)3B:二茂铁C:蔡氏盐D:大环配合物答案: 普鲁士蓝KCN.Fe(CN)2.Fe(CN)32、配位化学发展史上标志着配位化学研究的开始的配合物是()A:CoCl3.6NH3B:二茂铁C:蔡氏盐D:大环配合物答案: CoCl3.6NH33、提出超分子化学概念的是()A:维尔纳B:鲍林C:道尔顿D:莱恩答案: 莱恩4、配位化学是无机化学的一个重要分支学科。
它研究的对象是配合物。
A:对答案: 对5、分子间弱相互作用与分子组装的化学称为超分子化学,它的基础是分子识别。
A:对B:错答案: 对第二章1、C6H6是σ配体、π配体、还是π酸配体?A:σ配体B:π配体C:π酸配体D:都不是答案: π配体2、根据配体的成键方式,判断下列配合物中有几类配体?章测试2-2.pngA:1B:2C:3D:4答案: 33、[Pt(NH3)2BrCl]有几种几何异构体?A:1C:3D:4答案: 24、氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH3)2]+,使铜溶解。
A:对B:错答案: 对5、外轨型配离子磁矩大,内轨型配合物磁矩小。
A:对B:错答案: 对第三章1、在六氨合钴配离子[Co(NH3)6]3+中,中心离子的t2g轨道是 ( )A:非键分子轨道B:成键分子轨道C:反键分子轨道D:不存在答案:A2、某金属离子在八面体强场中的磁矩为2.83BM,在八面体弱场中为4.90BM,则该金属离子可能为()A:Fe3+B:Co2+C:Ni2+D:Mn3+答案:D3、DFT使用什么来描述和确定体系性质()A:密度泛函B:体系波函数C:电负性答案:A4、中心原子的dxy、dyz、dzx轨道可以与配体的下列哪种群轨道对应组合()A:t1g、t1uB:t2uC:t2g答案:C5、对于晶体场引起的轨道能级分裂,只用群论就能确定()A:晶体场分裂能的大小B:能级相对高低C:分裂形式和简并度答案:C第四章1、原位合成时所加入的配体发生变化生成了新的配体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学系09级研究生《配位化学》试题(参考答案)
一、填空题(每空1分共15分)
1、硝基五氨合钴离子 2 6
2、⑴﹢2 ⑵6 ⑶4 ⑷八面体
3、空轨道孤对电子
4、[Co(CN)
6]3-八面体 [Co(CN)
6
]3-
5、八面体 SP3d2 d2SP3
二.解释、区别下列名词(5*7=35分)
1.单齿配体与多齿配体
单齿配体:指一个配体且只含有一个配位原子的配体
多齿配体:指含有两个以上的配位原子的配体
2.d2sp3杂化和sp3d2杂化
d2SP3杂化:指两个(n-1)d轨道,一个ns轨道和三个np轨道混合时就会产生6个d2SP3杂化轨道
SP3d2 杂化:指一个ns轨道,三个np轨道和两个nd轨道混合时就会产生6个SP3d2 杂化轨道
3.简单配合物与螯合物
简单配合物:单齿的分子或离子配体与中心原子作用形成的配合物
熬合物:由双齿或多齿配体与同一中心离子作用形成的环称为熬合环,所形成的具有熬合环的配合物
4.低自旋配合物和高自旋配合物
低自旋配合物:当P成对能小于△分裂能的配合物
高自旋配合物:当P成对能大于△分裂能的配合物
5.金属酶与金属蛋白
金属酶:必须有金属离子参与才有活性的酶,简单地说是结合有金属离子的酶是一种生物催化剂。
金属蛋白:金属离子与蛋白形成配合物,其主要作用不是催化某个生化过程,而是完成生物体内如电子传递之类特定的生物功能的活性物质。
6.强场配体:在光谱学中,△分裂能较大的为强场配体,如:NO
2
- CN- 弱场配体:在光谱学中,△分裂能较小的为强场配体,如:I- Cl-
7.晶体场理论:金属离子与配体间的相互作用为静电作用,同时考虑到配位体对中心离子d
轨道的影响。
分子轨道理论:着重于分子的整体性,它把分子看作是一个整体来处理,比较全面反映分子内部电子的各种运动状态,它不仅能解决分子中存在的电子对键、单电子键、三电子键的形成,而且对多原子分子的结构也能比较好的说明。
三、选择题(每题3分共15分)
1、B
2、A
3、C
4、C
5、A
四.分子的点群填空题(3*5=15分)
1. C3h
2. C3v
3. D3d 对称元素系中含有Cn ,n个C2 ,n个σd ,i和In,
4.面: 8 个正三角形,顶点: 6 个,棱: 12 条
5.该分子属 Td 对称性。
对称操作为{E,3C2,8C3,6S4,6σd}共有24阶。
五、计算讨论题(每题10分共10分)
1. 根据实测磁矩,推断下列螯合物的空间构型并指出是内轨还是外轨型配合物;并说明在晶体场中的高低自旋状态。
[Co(CN)
6] 3-(μ=1.8) 和[Co(en)
3
] 2+(μ=3.82)
解:[Co(CN)
6
]3- u=n(n+2)0.5=1.8 n=1
[Co(CN)
6
]3-为内轨型配合物,低自旋状态,八面体
[Co(en)
3
]2+u=n(n+2)0.5=3.82 n=3
[Co(en)
3
]2+为外轨型配合物,高自旋状态,八面体
六、问答题(10分)
简述你所了解的配合物的应用与研究。
1.应用:
⑴金属配合物药物
⑵抗癌金属配合物的研究
⑶在分析化学中的应用
⑷在离子交换树脂分离法中的应用
⑸配位催化
⑹配合物在化妆品中的应用
⑺在医疗中的应用
⑻
2.新材料研究:
⑴新型环保材料
⑵发光材料
⑶荧光材料
⑷光电功能材料
⑸金属超分子配合物型非线性光学材料
⑹配合物型纳米材料
⑺二茂铁功能材料
⑻新型稀土配合物
⑼金属有机配合物电致磷光材料
⑽Fullerene(富勒烯)功能材料
⑾稀土聚合物发光材料
⑿有机配合物发光材料及电致发光器件的研究。
