Hieff TransTM脂质体核酸转染试剂说明书
脂质体介导转染方法

脂质介导的短暂表达
实验材料
哺乳动物细胞
试剂、试剂
质粒DNA完全培养基氯化铯DMEM
盒
仪器、耗材
培养皿培养箱聚苯乙烯管
实验步骤
1. 按5×105细胞/孔的量在六孔板中接种指数期生长的细胞,在37℃ 5%CO2培养箱中
培养过夜,直至细胞80%汇片。
(如果用100 mm 培养皿代替六孔扳,则培养细胞至80%
汇片,将所有数量扩大8倍)
2. 在聚苯乙烯管中配制DNA/脂质体复合物如下:稀释质粒DNA至1 ml DMEM-SF中,
在旋涡混合器上振荡1 s 然后加入脂质体悬液、再次旋起混匀。
在室温下温育5~ 10 min,
使DNA与阳离子脂质体结合。
3. 吸去DMEM-SF培养液,用1 ml 的完全DMEM-SF洗1次,吸去DMEM-SF。
对毎
个35 mm 孔中,直接在细胞上加1 ml DNA/脂质体复合物。
在37℃培养箱中温育3~5 h。
4. 往每孔细抱中加入1 ml 的DMEM-20完全培养液,在37℃培养箱中继续温育24~48
h。
5. 吸去完全DMEM/DNA/脂质体复合物,毎孔加入2 ml 新的DMEM-10完全培养液,
继续搵育24~48 h。
6. 收集细胞:用细胞刮于刮下细胞,或胰蛋白酶消化或冻融裂解细胞。
进行适当的表
达分析。
脂质体进行稳定表达。
脂质体转染原理及操作步骤

脂质体转染原理及操作步骤脂质体转染是一种常用的基因传递技术,用于将外源的核酸(例如DNA、RNA)转入细胞内。
脂质体是由人工合成的类似于细胞膜的双层脂质膜组成,具有较好的生物相容性和可降解性,因此可以用来包裹并传递外源核酸进入目标细胞内。
本文将详细介绍脂质体转染的原理和操作步骤。
脂质体由两个疏水性脂质尾部和一个亲水性脂质头部组成,形成类似生物细胞膜的双层结构。
这种双层结构使得脂质体可以包裹水溶性的外源核酸,并形成脂质体-核酸复合物。
当复合物与细胞膜接触时,由于脂质体的类似性,这些复合物可以与细胞膜融合,并释放外源核酸进入细胞。
然而,简单地将脂质体-核酸复合物添加到细胞培养基中并不能有效地将外源核酸转入细胞内。
为了提高转染效率,常常需要使用电穿孔或钙磷共沉淀等方法,以增加细胞膜的通透性。
操作步骤:1.准备工作:-完整的脂质体转染试剂盒。
-DNA或RNA溶液。
-靶细胞。
-无菌操作条件下的实验室。
2.重组脂质体的合成:-按照试剂盒说明将脂质体复合物合成。
-使用无菌的工具和试剂。
3.核酸引物的制备:-将外源DNA或RNA与引物混合,使其形成核酸复合物。
4.细胞处理:-将培养皿中的细胞进行冲洗,去除培养基。
-将适量的细胞培养基添加到培养皿中,以保证细胞的正常生长。
5.导入核酸:-将所制备的核酸复合物滴加到细胞培养基中。
-将细胞培养皿置于无菌环境中,以便细胞吸收和利用核酸。
6.细胞培养:-按照细胞类型和所使用的培养基,将细胞置于恰当的培养条件下,并进行培养。
-根据需求添加所需要的生长因子和抗生素。
7.观察和分析:-在一定的培养时间后,观察细胞是否发生了显著的变化。
- 使用适当的实验方法(如PCR、Western blot等)检测外源基因的表达。
-观察并记录实验结果。
以上是脂质体转染的原理和操作步骤。
脂质体转染是目前常用的基因传递技术之一,可以用于研究基因功能、疾病治疗等领域。
随着技术的不断发展,转染效率和特异性将逐渐提高,为研究和治疗带来更多的机会和挑战。
转染试剂使用说明书

210102
1ml
1. 2. 3. 4. 5. 6.
适用范围及特点: 适应于众多原代培养细胞和转化细胞株的基因转染 适用于瞬时转染和稳定转染 适应于贴壁细胞和悬浮细胞转染 转染效率高且稳定,在有无血清存在的细胞培养基中均能获得高效率转染 细胞毒性低 转染程序简单,转染实验可以在半小时内完成
产品储存: GenFectinTM (1.0mg/ml) 在室温下运输,试剂到时请即存放于 4℃,在 4℃可存放
2. 3).
配制转染工作液: ( 6 孔板或 35 mm 平皿, 2 ml 培养液) 取 5~8μ g DNA (起始用量 5μ g) ,加入稀释液中至总体积为 100μ l,轻轻混匀,室 温放置。
4).
先将 GenFectin TM 涡旋振荡混匀。取 GenFectinTM 1~4μ0μl,轻轻混匀,室温放置 5 分钟。
8).
稳定转染时,于转染后 24~48 小时消化细胞分至 3~5 个培养皿中,加适当浓度的 相应抗生素(如 G418)筛选。
建议的起始转染条件 : 培养容器
96 孔板 24 孔板 6 孔板 35mm 培养皿 60mm 培养皿
转染前一天 接种细胞数
1-1.510 个 0.5-1 10 个 2-4 10 个 2-4 10 个 4-6 105 个
3.
GenFectinTM 在转染中不受血清影响,所以 GenFectinTM / DNA 复合物能直接加到 含血清的培养基中,但稀释 GenFectinTM 和 DNA 的缓冲液不能混有血清,因为 GenFectinTM 在制备 GenFectinTM / DNA 复合物之前可能会与血清中的蛋白质反 应,影响转染效率。
-5-
英格恩entranster转染试剂说明书

英格恩entranster转染试剂说明书一、产品概述英格恩 Entanster 转染试剂是一种用于转染外源 DNA/RNA 到细胞内的试剂。
它是经过优化的化学试剂组合,可以将外源 DNA/RNA 高效地传递到各种细胞中,并促进其定向表达。
本试剂适用于体外转染实验和基因工程研究,具有高转染效率、低细胞毒性、简单易用等优点。
二、试剂成分英格恩 Entanster 转染试剂主要成分包括转染缓冲液和转染增强剂。
转染缓冲液中包含有机溶剂、非离子表面活性剂等,用于稳定 DNA/RNA与转染剂的结合。
转染增强剂含有具有阴离子表面活性剂、脂质、蛋白质等物质,可以提高细胞膜通透性和转染效率。
三、使用说明1.储存和稀释:试剂应储存于-20℃的冰箱中,保持干燥和避光。
使用前需要将试剂溶解在适当体积的转染缓冲液中,最佳稀释比例为1:9、溶液需充分混匀,离心并去除任何沉淀物。
2.样品准备:在转染前,将目标DNA/RNA溶解在适当的缓冲液中,浓度通常在0.1-1μg/μL最佳。
确保样品充分溶解并无明显沉淀。
3.转染操作:对于已经培养至适当倍数的细胞,将细胞用预先暖和的转染缓冲液洗涤一次,并去除缓冲液。
将转染缓冲液和溶解好的目标DNA/RNA混合,稍微搅拌均匀。
与此同时,将适量的转染增强剂加入到混合物中,充分混合。
然后将混合物直接滴加到细胞上,并轻轻摇晃培养板以确保混合物均匀分布。
4.培养和检测:将含有转染混合物的培养板放回恒温培养箱中,保持恒定的温度和CO2浓度。
培养时间和温度根据需要进行调整,通常在24-48小时后可以进行下一步实验或观察。
四、注意事项1.试剂需保存在干燥、阴凉、避光的环境中,避免结冰或暴露在高温环境中。
2.操作中需佩戴手套并遵循生物安全实验操作规范。
3.使用前需充分摇匀试剂瓶,确保所有试剂成分充分混合均匀。
4.转染缓冲液中的有机溶剂可能对一些细胞有毒性,因此在选择试剂时应参考相关文献或尝试不同的浓度和时间,以确定最佳条件。
TransLipidHLTran...

TransLipid®HL Transfection Reagent目录号:FT111保存:2-8℃保存一年(避免冷冻)。
产品说明TransLipid® HL Transfection Reagent是一种新型的阳离子脂质体转染试剂,适用于将核酸(DNA和RNA)转染入真核细胞,在保证高转染效率的同时具有极低的细胞毒性。
本产品适用细胞类型广,转染时血清和抗生素的存在不影响转染效率,并且转染后无需更换培养基。
适用范围:贴壁细胞和悬浮细胞(哺乳动物细胞系)的转染。
特点·转染效率高·细胞毒性极低(细胞存活率>90%)·操作简便,转染后无需更换培养基质粒DNA的转染:以24孔板为例,步骤如下细胞接种:每孔接种0.5-2×105个细胞,使转染时细胞达到70-90%汇合度细胞培养12-24小时质粒稀释:将0.8 μg质粒稀释于50 μl Opti-MEM培养基TransLipid® HL稀释:将2 μl TransLipid® HL稀释于50 μlOpti-MEM培养基室温静置5分钟将质粒和TransLipid® HL轻柔混合室温静置20分钟将质粒-TransLipid® HL混合物加入细胞,于37℃ CO2培养箱培养转染4-6小时后更换培养基(可选),继续培养18-72小时本产品仅供研究,不用于临床诊断。
siRNA 的转染以24孔板为例,转染时细胞汇合度为30-50%,转染所需的siRNA 和TransLipid ® HL 的量分别为20 pmol 和1 μl ,步骤同DNA 转染。
质粒DNA 和siRNA 转染的优化为达到高转染效率和低细胞毒性的最佳结合,可以对DNA 或siRNA 和 TransLipid ® HL 的比例及转染初始细胞密度进行优化,DNA 转染可以在1: 2-1: 5的范围内优化比例,siRNA 转染可以试用10-50 pmol siRNA 和0.5-1.5 μl TransLipid ® HL 的用量。
脂质体转染实验步骤脂质体(LR)试剂是阳离子脂质体DOTMA和DOPE

脂质体转染实验步骤脂质体(LR)试剂是阳离子脂质体DOTMA和DOPE脂质体转染实验步骤脂质体(LR)试剂是阳离子脂质体DOTMA和DOPE的混合物(1:1)。
它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方面的转染方法之一。
转染率高,优于磷酸钙法,比它高5-100倍,能把DNA和RNA转染到各种细胞。
用LR进行转染时,首先需要优化转染条件,应找出该批LR对转染某一特定细胞适合的用量、作用时间等,对每批LR都要做。
先要固定一个DNA的量和DNA/LR混合物与细胞相互作用的时间,DNA可从1-5ug和孵育时间6h,开始,按这两个参数绘出相应LR需用量的曲线,再选用LR和DNA两者最佳的剂量,确定出转染时间。
因LR对细胞有一定的毒性,转染时间以不超过24h为宜。
细胞种类:COS-7、BHK、NIH-3T3、Hela和Jurkat等任何一种细胞均可作为受体细胞。
1、操作步骤(方法一):(1):取6孔培养板,向每孔中加入2ml含(1-2)x 10^5个细胞的培养基,37℃、18% CO2培养基40%-60%汇合时。
(2)转染液制备:在聚苯乙烯管中制备以下两液(为转染1个空细胞所用的量)。
A液:用不含血清培养基稀释DNA使浓度为1-10ug,终量100ul。
B液:用不含血清培养基稀释LR,使终浓度为2-50ug,终量100ul。
轻轻混合A液、B液,室温中置10-15min,稍后会出现微浊现象,但并不妨碍转染。
(3)转染准备:用2ml不含血清培养基漂洗2次,再加入1ml 不含血清培养基。
(4)转染:把A/B复合物缓缓加入培养基中,摇匀,置37℃温箱中6-24h,吸除无血清转染液,换入正常培养基继续培养。
(5)其余处理:如观察、筛选、检测等与其他转染法相同。
(6)注意:转染时切勿加血清,血清对转染效率有很大影响。
2、快速脂质体转染法操作步骤(方法二):● 将细胞以5 x 10^5个/孔接种于6孔板中培养24h,使其达到50%-60%板底面积。
HighGene plus Transfection reagent 说明书

HighGene plus Transfection reagent说明书货号:RM09014P规格:1mL,10mL◆产品描述HighGene plus Transfection reagent细胞转染试剂是一种新型的混合型高分子聚合物转染试剂。
它可以与核酸(包括质粒、siRNA、寡聚核苷酸)相互作用形成一种复合物将核酸转运到真核细胞内,适用于大部分真核细胞的细胞转染。
◆产品特点1、适用于多种细胞类型和培养板。
2、高转染效率、批次稳定重复性好、操作简单。
3、转染过程不受血清和抗生素的影响。
◆保存条件-20℃保存,24个月有效。
◆操作说明1、贴壁细胞转染(以293T细胞为例)(1)第一天,将293T细胞接种到6孔板中,细胞密度控制在70%-90%为宜;注:根据实验需求,可以选择不同的细胞培养装置,细胞接种数量和所需培养液体积详见附表1(2)第二天,先取4μg质粒加入到200μL无血清DMEM基础培养基离心管中,吹打混合均匀,然后加入8μL HighGene plus转染试剂,吹打混合;注:MEM、1640、F12等基础培养基均可用于HighGene plus转染试剂的溶剂,不同的细胞培养装置所需质粒的量和HighGene plus转染试剂剂量详见附表2(3)将200μL质粒/HighGene plus转染试剂复合物均匀滴加到6孔细胞培养板孔中,轻轻晃动细胞培养板使其均匀分布;注:6孔板中为完全培养基,轻轻晃动细胞培养板即可,切勿剧烈摇动细胞培养板,以免细胞脱落漂浮!(4)细胞转染4-6h后,半量更换新鲜完全培养基;注:半量换液时,吸弃一半原有完全培养基,补加一半新鲜完全培养基(5)细胞转染24-48h后,即可使用适当方式进行检测,如RT-PCR、Western、ELISA、报告基因等,或加入相应筛选药物(G418或Puromycin)可获得稳定细胞株。
2、悬浮细胞转染(以HEK293F细胞为例)(1)第一天,在125mL摇瓶中接种30mL密度为1×106个/mL HEK293F悬浮细胞;(2)第二天,先取30μg质粒加入到3mL无血清DMEM基础培养基离心管中,吹打混合均匀,然后加入60μL HighGene plus转染试剂,吹打混合均匀;(3)将3mL质粒/HighGene plus转染试剂复合物均匀滴加到30mL体积HEK293F悬浮细胞的125mL摇瓶中,轻轻摇动摇瓶使其混合均匀;(4)细胞转染3-5天后,根据蛋白表达的情况(胞内表达或分泌表达),收集细胞或细胞培养上清,进行后续蛋白纯化操作。
脂质体转染试剂 生产

脂质体转染试剂生产脂质体转染试剂是一种常用的生物技术试剂,广泛应用于基因转染和基因治疗研究中。
本文将介绍脂质体转染试剂的生产过程和其在基因转染中的应用。
脂质体转染试剂的生产主要包括脂质体的制备和试剂的包装两个步骤。
首先,制备脂质体需要选择适当的脂质体组分,常见的有磷脂、胆固醇和表面活性剂等。
这些组分能够在适当的条件下形成脂质体结构,提供载体功能。
其次,将脂质体组分按照一定比例混合,并在适当的温度和pH值下进行混悬和超声处理,最终得到脂质体悬浮液。
制备好的脂质体悬浮液需要经过一系列的质量控制检测,确保其质量符合要求。
脂质体转染试剂的包装主要是将制备好的脂质体悬浮液进行浓缩和冻干处理。
首先,利用超滤膜或离心浓缩等方法将脂质体悬浮液进行浓缩,以提高试剂的浓度。
然后,将浓缩后的脂质体悬浮液进行冻干处理,即将其在低温下进行干燥,使其转变为固态。
冻干后的脂质体转染试剂具有较长的保存期限和良好的稳定性,方便运输和使用。
脂质体转染试剂在基因转染中起着重要的作用。
基因转染是将外源基因导入到细胞中的过程,脂质体转染试剂作为一种常用的基因转染载体,可以有效地将外源基因转染到靶细胞中。
脂质体转染试剂通过与外源基因形成复合体,利用脂质体的包裹功能将其导入细胞内。
这种方法具有操作简单、转染效率高和适用于多种细胞类型等优点。
脂质体转染试剂在基因治疗研究中也有重要应用。
基因治疗是指通过导入外源基因来修复或治疗遗传性疾病的方法。
脂质体转染试剂可以作为基因载体,将治疗基因转染到患者的细胞中,以实现基因治疗的目的。
脂质体转染试剂具有较好的生物相容性和生物安全性,可以保护基因免受降解和免疫系统的攻击,提高基因转染效率和基因治疗的疗效。
总结来说,脂质体转染试剂是一种常用的生物技术试剂,能够有效地将外源基因转染到细胞中,并在基因转染和基因治疗研究中发挥重要作用。
脂质体转染试剂的生产过程包括脂质体的制备和试剂的包装,通过严格的质量控制确保试剂的质量符合要求。
L_(IPOFECT)AMINE^(TM)试剂:一种新的高效多聚阳离子脂质体转染试剂

L_(IPOFECT)AMINE^(TM)试剂:一种新的高效多聚阳离子
脂质体转染试剂
李克深
【期刊名称】《国外医学:遗传学分册》
【年(卷),期】1995(18)4
【摘要】阳离子脂质简化了核酸序列转入真核细胞的过程,最初用于转染的脂质包括L_(IPOFECTIN)及L_(IPOFECT) ACE^(TM)、DOTAP,它们都是单价阳离子。
L_(IPOFECT) AMINE,一种新的脂质体配方包含一种带有精胺头部的多聚阳离子脂质,可以在大多数类型的细胞中提高转染效率,比单价阳离子脂质体试剂的活性高出30倍。
本报道通过转染和人原代成纤维细胞将L_(IPOFECT) AMINE与其它几种可购买到的单阳离子脂质试剂进行了比较。
同时对转染条件的确定和优化进行了阐述。
【总页数】3页(P210-212)
【关键词】转染试剂;阳离子脂质;多聚阳离子脂质
【作者】李克深
【作者单位】哈尔滨医科大学遗传学教研室
【正文语种】中文
【中图分类】Q785
【相关文献】
1.三种脂质体法转染试剂转染原代大鼠气道平滑肌细胞效果的比较 [J], 徐玉东;王宇;魏颖;尹磊淼;杨永清
2.三种阳离子转染试剂对小鼠血管瘤内皮细胞转染效率及细胞毒性的影响 [J], 周晓彤;沈振亚;于曙东;余云生;叶文学;黄浩岳;焦鹏;滕小梅
3.SA脂质体—高效介导DNA转染的新试剂 [J], 杨静平;孔玉英
4.一种可降解的阳离子聚合物基因转染试剂 [J], 季守平;杜福胜;王颖丽;章扬培
5.LIPOFECT AMINETM试剂:一种新的高效多聚阳离子脂质体转… [J], 李克深;傅松滨
因版权原因,仅展示原文概要,查看原文内容请购买。
LipoHigh脂质体高效转染试剂
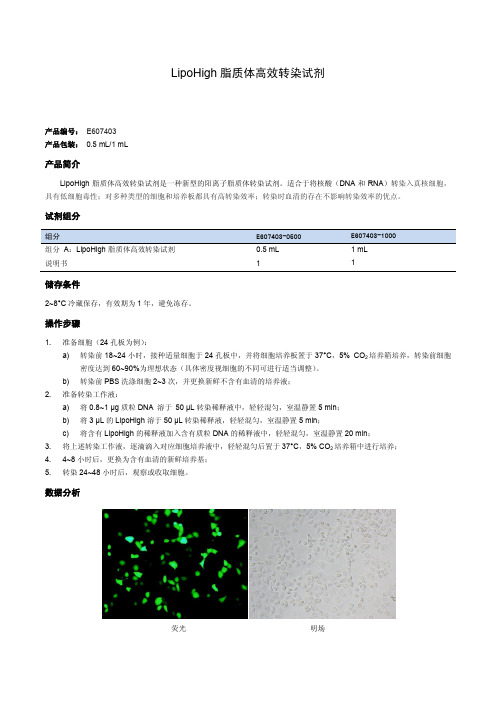
试剂组分
组分 组分 A:LipoHigh 脂质体高效转染试剂 说明书
E607403-0500 0.5 mL 1
E607403-1000 1 mL 1
储存条件
2~8°C 冷藏保存,有效期为 1 年,避免冻存。
ቤተ መጻሕፍቲ ባይዱ
操作步骤
1. 准备细胞(24 孔板为例): a) 转染前 18~24 小时,接种适量细胞于 24 孔板中,并将细胞培养板置于 37°C,5% CO2 培养箱培养,转染前细胞 密度达到 60~90%为理想状态(具体密度视细胞的不同可进行适当调整)。 b) 转染前 PBS 洗涤细胞 2~3 次,并更换新鲜不含有血清的培养液;
24 µg
60 µl
siRNA
5 pmol 20 pmol 40 pmol 100 pmol 200 pmol 600 pmol
0.25 µl 1.0 µl 2.0 µl 5 µl 10 µl 30 µl
注意事项
1. 影响转染效率的因素有很多,如细胞类型、细胞状态及密度、DNA 转染量、转染试剂与 DNA 比例等,应该在具体实践 中优化来确定最佳转染条件。
LipoHigh 脂质体高效转染试剂
产品编号: E607403 产品包装: 0.5 mL/1 mL
产品简介
LipoHigh 脂质体高效转染试剂是一种新型的阳离子脂质体转染试剂。适合于将核酸(DNA 和 RNA)转染入真核细胞, 具有低细胞毒性;对多种类型的细胞和培养板都具有高转染效率;转染时血清的存在不影响转染效率的优点。
DNA 转染
100 µl
2 × 25 µl
0.2 µg
0.5 µl
500 µl
2 × 50 µl
0.8 µg
Hieff TransTM脂质体核酸转染试剂(亲手整理

Hieff TransTM 脂质体核酸转染试剂产品描述Hieff Trans TM 脂质体核酸转染试剂是一种多用途的脂质体转染试剂,适用于DNA 、RNA 和寡核苷酸的转染,对大多数真核细胞具有很高的转染效率。
其独特的配方使其可直接加入培养基中,血清的存在不会影响转染效率,这样可以减少去除血清对细胞的损伤。
转染后不需要除去核酸-Hieff Trans TM 复合物或更换新鲜培养基,也可在4~6小时后除去。
Hieff Trans TM 以无菌的液体形式提供。
通常情况下对于 24 孔板转染,每次用1.5μl 左右,则1ml Hieff Trans TM 约可做660次转染;对于6孔板,每次用6μl 左右,则1ml Hieff Trans TM 约可做160 次转染; 运输与保存方法冰袋(wet ice )运输。
产品4ºC 保存,一年有效。
不可冷冻! 注意事项1)Hieff Trans TM 脂质体核酸转染试剂要求细胞铺板密度较高,以90%-95%为佳,这有助于减少阳离子脂质体细胞毒性造成的影响;如果你研究的基因要求比较长的表达时间,比如细胞周期相关基因,或者细胞表面蛋白,最好选择细胞铺板密度要求较低的转染试剂,不适合用脂质体核酸转染试剂。
2)Hieff Trans TM 脂质体核酸转染试剂可用于有血清培养基的转染,并且转染前后不需要换培养基。
但是,制备转染复合物时要求用无血清培养基稀释DNA 和转染试剂,因为血清会影响复合物的形成。
另外,要检测所用的无血清培养基与脂质体核酸转染试剂的相容性,已知CD293, SFMII, VP-SFM 就不相容。
3)转染的时候培养基中不能添加抗生素。
4)使用高纯度的DNA 或RNA 有助于获得较高的转染效率,质粒中的内毒素是转染的大敌。
5)阳离子脂质体应该在4度保存,要注意避免多次反复长时间开盖,因为可能会导致脂质体氧化而影响转染效率。
6)初次使用应优化DNA 浓度和阳离子脂质体试剂量以得到最大的转染效率。
Lipofect脂质体转染试剂

Lipofect 脂质体转染试剂简介:外源基因导入真核细胞的方法有很多种,如磷酸钙转染法、DEAE-葡聚糖转染法、脂质体法、电穿孔法、显微注射法等。
Leagene Lipofect 脂质体转染试剂(Lipofect Transfection Reagent)是一种新型的阳离子脂质体转染试剂,适用于把质粒、siRNA 或其它形式的核酸包括DNA 、RNA 、寡核苷酸以及核酸蛋白复合物或带负电荷的蛋白转染到真核细胞中。
Leagene Lipofect 脂质体转染试剂对于常见的哺乳动物细胞具有较高的转染效率,较好的重复性,且操作简以及单细胞毒性较小,可用于贴壁细胞和悬浮细胞。
Lipofect 脂质体转染试剂使用方法与Lipofectamine ® 2000 Reagent 极为相似。
该转染试剂转染细胞时, 基本不受细胞培养液中的血清和抗生素的影响,即可以在血清和抗生素存在的情况下进行细胞转染。
但为了取得最佳的转染效果,推荐转染时使用不含抗生素的含血清的细胞培养液。
组成:自备材料:1、 胰蛋白酶消化液2、 完全培养液和不完全培养液3、 PBS操作步骤(仅供参考):(一)DNA 转染:1、 (以12孔板为例)在转染前18~24h 用胰蛋白酶消化培养细胞,取适量对数期细胞转移至12孔板中,并将细胞培养板置于CO 2 培养箱培养,待细胞密度达到即可进行转染。
后续操作步骤均按12孔板计算,如果转染器皿不同,请按比例自行调节用量。
2、 在加入待转染的DNA 之前2~4h ,加入不含抗生素的完全培养液,置于CO 2培养箱培养。
也可使用含有血清并含有抗生素的新鲜培养液,但抗生素使某些细胞转染后出现一定的细胞毒性。
3、 配制转染工作液:取两个无菌离心管,分别加入不含抗生素和血清的培养液,取其中一编号 名称CZ0002 CZ0002 CZ0002 StorageLipofect 脂质体转染试剂 0.5ml 1ml 5×1 ml 4℃使用说明书 1份离心管加入DNA,轻轻混匀;取另一离心管加入Lipofect脂质体转染试剂,轻轻混匀。
DNAFect Transfection Reagent

DNAFect转染试剂DNAFect Transfection Reagent产品内容网站订购: 微信订购:扫一扫右侧二维码服务热线:4006-222-360版本号:12/2015目录号:CW0860S (500 μl )保存条件:2-8℃,避光保存ComponentCW0860S 500 μl DNAFect Transfection Reagent500 μl产品简介 DNAFect Transfection Reagent是一种高效的阳离子脂质体转染试剂,适用于多种细胞的DNA转染。
对于大多数细胞系包括原代细胞都有较高的转染效率,并且对细胞毒性极低。
本转染试剂可应用于瞬时转染、稳定转染、共转染、高通量DNA转染,基因表达和基因功能研究。
注意事项1.DNAFect Transfection Reagent使用前应先震荡摇匀。
2.转染效率与细胞密度有很大关系,不同实验间应保持一个基本的传代步骤,确保转染时细胞没有长满或处于静止期。
一般贴壁细胞转染的最佳细胞密度是80%-90%,悬浮细胞的最佳细胞密度为3-5×105细胞/ml,用于转染的最佳细胞度应根据不同的细胞类型或用途而异。
3.转染时不要在培养基中加入抗生素,否则会导致细胞死亡。
1操作步骤1.对于大部分的细胞系, DNA与DNAFect Transfection Reagent的比例在1:2至1:3时转染效率较高。
为了提高转化效率、表达水平并且减少细胞毒性,实验应在细胞密度较大时进行转染。
以下操作以24孔板每孔细胞的DNA转染操作为例。
贴壁细胞:转化前一天,在24孔板的每孔中加入500 μl无抗生素的生长培养基,并于每孔中接种0.5-2×105个细胞,待细胞长至80%-90%满时进行转染。
悬浮细胞:在细胞转染之前,在24孔板的每孔中加入500 μl无抗生素的生长培养基,并于每孔中接种3-5×105个细胞。
2.转染当天,首先准备转染复合物,对于每孔细胞按照以下用量配制:a. 取适量DNA,加入25 μl无血清培养基,并轻轻的混合均匀。
LipoFiter转染试剂中文说明书

类型 (培养皿/培养板)
96-well 48-well 24-well 12-well 6-well 60mm 100mm
表面积 /cm2
0.3cm2 0.8cm2 2cm2 4cm2 10cm2 20cm2 60cm2
对应细胞培养 液体积 100µl 350µl 500µl 1ml 2ml 4ml 12ml
7
LipoFiterTM 脂质体转染试剂
注意事项 1. 使用高纯度的 DNA(A260/A280 比值越近 1.8 越好)有助于获得 较高的转染效率。对于质粒,推荐使用 Qiagen 公司生产的质粒大量 抽提试剂盒进行高质量无内毒素抽提。 2. 转染前细胞必须处于良好的生长状态。 3. 需自备 DMEM 培养基,其他培养基如 1640、MEM、alpha-MEM, F12,DMEM/F12、M199 也均可以用于转染实验。 4. LipoFiterTM 不能 vortex 或离心,宜缓慢晃动混匀。 5. LipoFiterTM 使用后请立即盖好盖子,避免长时间暴露在空气中,影 响转染效率。 6. 经测试,LipoFiterTM 细胞毒性不明显,非常适用于病毒包装(腺 病毒,慢病毒,逆转录病毒等);请在进行病毒包装时严格按照病毒 安全操作进行。
关于病毒安全操作可参考《汉恒生物-病毒载体操作安全手册》或来电来信和我 们的病毒技术工程师沟通,您还可以扫描 加微信和我们技术工程师就技术上进 一步沟通。
7. 为了您的安全和健康,请在符合洁净度要求的细胞培养室中进行 转染操作,操作时请穿实验服并戴一次性手套、口罩和无菌帽。
8
LipoFiterTM 脂质体转染试剂 汉恒生物 进入汉恒官网观看 LipoFiterTM 转染实验操作视频
5
LipoFiterTM 脂质体转染试剂
HiPerFect转染试剂的使用

HiPerFect转染试剂的使⽤在做miRNA的相关实验中,在验证靶基因⽅⾯,通常是向靶细胞转染miRNA mimics,或者是构建稳定过表达的miRNA的细胞株,然后做WB即可。
我的靶细胞是RAW264.7,但向这种细胞株转染miRNA mimics时,使⽤lipo2000或lipo3000的效率没那么⾼,不太容易做出结果(⽂献中有⼈使⽤的,效果很好,但我实验中总是做不出来)。
后来在QIAGEN官⽹上搜到了⼀个转染试剂,HiPerFect,看介绍这个转染试剂是专门⽤于转染miRNA的。
以下是实验流程,具体实验我还没做,只是翻译了说明书中的内容。
1. 将2.5x10e5个RAW264.7细胞铺在6孔板中,培养基体积为2.3mL,含FBS与双抗。
2. 转染时,将150ng的miRNA稀释到100uL的不含⾎清的培养基中(通常使⽤OPTI-MEN培养基),如果是miRNAinhibitor,剂量增加10倍,使miRNA的终浓度为5nM,这个浓度根据实验⽽定,⽂献中使⽤lipo2000或3000转染miRNA mimcs时的终浓度是20nM-100nM,但QIAGEN的说明书中提到,这个转染试剂的优点在于能在低浓度⽔平上进⾏miRNA的转染。
加⼊12uL的HiPerFect到OPTI-MEM中,混匀。
说明书中还提到,在正式实验前,最好根据⾃⼰实验室的条件与靶细胞,优化⼀下剂量。
miRNA mimics的储备浓度通常是20uM,如果要使终浓度为100nM,那么就要加10uL的储备液。
3. 在常温下孵育5到10minj。
4. 将上述的转染复合物逐滴加到6孔板中,轻轻混匀。
5. 将细胞培养板放到孵箱中,在24到72⼩时后检测基因表达量(我觉得等细胞长到80%密度的时候就⾏),如果细胞数⽬过少,中间记得更换新培养基。
以下是说明书中提供的参考数据(6孔板的⼀个孔):。
neofect转染试剂说明书中文

NeoFect是一种用于将DNA或RNA转染到真核细胞中的转染试剂。
以下是一个简化的、假设性的NeoFect转染试剂说明书的中文翻译,请注意,这不是官方翻译,仅供参考。
实际使用时,请参考随产品附带的正式说明书和安全数据表(SDS)。
---NeoFect转染试剂说明书【产品名称】通用名:转染试剂商品名:NeoFect【成分】主要成分为阳离子脂质体,用于促进核酸分子与细胞膜的融合。
【性状】本品为透明至微浑浊的液体,通常以小瓶或多孔板包装。
【适应症】用于科研实验中,将DNA或RNA高效转染到哺乳动物细胞中,以进行基因表达、基因沉默、基因编辑等研究。
【使用方法】1. 准备待转染的细胞和核酸溶液(DNA或RNA)。
2. 根据实验设计,将适量的NeoFect转染试剂加入无血清培养基中,轻轻混匀。
3. 将核酸溶液加入含有NeoFect的培养基中,轻轻混匀,室温孵育15-30分钟。
4. 将混合物加入到细胞培养皿中,轻轻摇晃使混合均匀。
5. 根据细胞类型和实验目的,孵育一定时间后更换为完全培养基继续培养。
【不良反应】本品仅供实验室使用,不适用于临床治疗。
【禁忌】对本品成分过敏者禁用。
【注意事项】1. 使用前请检查试剂是否清澈,如有沉淀或颜色变化请勿使用。
2. 避免反复冻融,分装后请立即使用。
3. 使用过程中请遵守实验室安全操作规程,佩戴适当的个人防护装备。
4. 请在无RNA酶和DNA酶的环境中操作RNA转染实验。
5. 转染效率受多种因素影响,如细胞状态、核酸浓度、孵育时间等,建议优化实验条件。
【贮藏】存放于4°C冰箱中,避免冷冻。
【有效期】请参考包装标签上的说明。
【生产批号】见包装标签。
【生产企业】(请填写生产企业名称和联系方式)---以上信息仅供参考,实际使用时请遵循产品附带的正式说明书和安全数据表(SDS)的内容。
在操作前,务必了解所有相关的安全和健康信息。
vivo(动物体内转染试剂)使用手册

vivo(动物体内转染试剂)使用手册Entranster TM-in vivo(动物体内转染试剂)使用手册Cat. No. 18668-11 Size:1ml常温运输,储存于4℃。
一产品介绍英格恩生物公司(Engreen Biosystem Co, Ltd.)是专业的转染试剂研发生产厂商。
Entranster TM是英格恩生物公司研发合成的纳米聚合物转染试剂,该试剂采用纳米技术合成,是最新一代非病毒转染试剂。
由于纳米技术的应用,Entranster TM-in vivo在细胞转染过程中,表现了卓越的低毒、高效的性能。
本品可用于转染DNA,也可以转染RNA(如siRNA、miRNA、mimic和inhibitor),可用于如下研究:●基因治疗研究●RNA干扰研究●蛋白功能研究本品显著的特点是方法简单、快捷,价格低廉,对动物没有明显的炎性反应,对操作者安全。
二使用前注意一般情况下,核酸(ug)和Entranster TM-in vivo (ul)按照1:2的比例使用。
也可调整比例从1:1.5到1:4自行优化使用。
核酸的具体用量和注射用量须根据靶器官大小、动物大小、给药途径决定,具体可参考下表(核酸的用量换算成μg计算)。
表1 给药途径与核酸用量给药途径建议的核酸用量最大给药体积尾静脉50μg 200μl-400μl脑室 2.5-1μg 5μl成年小鼠腹膜100μg 0.6ml-1ml皮下肿瘤 10-50μg 100μl脑室 2-5μg 20μl成年大鼠静脉 150-300μg 1-1.5ml 一些器官比如皮下肿瘤的用量,也可以通过先确定最终的注射量,然后根据表2推算出核酸的用量和转染试剂的用量。
比如最终的注射量是100ul,那么核酸用量一般为12.5ug,Entranster TM-in vivo的用量为25ul。
表2 100ul 转染复合物的组成25μl 纯水25μl 核酸溶液12.5μg 核酸核酸稀释液25μl 的10%葡萄糖溶液25μl 转染试剂100μl 转染复合物转染试剂稀释液25μl 的10%葡萄糖溶液三操作步骤下面以50μg 的核酸与100μl 转染试剂,总注射体积400ul ,成年小鼠尾静脉注射为例说明。
脂质体转染操作步骤

脂质体转染操作步骤
(一)准备材料
1.质粒:一般是由受体细胞胞浆抽提的质粒,其中含有DNA操纵因子、胞质蛋白等;
2.抗体:主要由混合物或单一蛋白质组成,用于鉴定质粒抗原性以及
抑制免疫反应;
3.细胞培养液:一般为包含细胞培养基和生长因子的混合物;
4.转染试剂:也称转染缓冲液,主要由多种物质,如阿拉伯胞浆清酯、卡夫培糖、酚红、多数体核酸等组成,用于载体细胞的传感和质粒的迁移。
(二)脂质体转染操作
1.取出细胞培养液,将受体细胞倒入培养管中,用浓度为0.25%(体
积比)的牛血清添加至8-10%,以细胞膜生长抗性抑制剂(如抗生素或吲
哚美辛)等抑制细胞膜的分裂,加以培养;
2.将培养液中的受体细胞的数量控制在2×105/ml以上,用酚酞红法
检测,检测结果达到要求后,把受体细胞从培养管中放入6 ml的离心管中,进行6000 g的离心;
3.将离心液放入新的容器中,把细胞抽出,再加入细胞稀释缓冲液
(以PBS或缓冲液为主,加入百维素或多数体核酸)至1×106/ml,离心5000 g;
4.将离心液抽出,用转染试剂缓冲液把细胞洗涤,再分别加入DNase I, 抗体和质粒,放入摇床中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Hieff Trans TM脂质体核酸转染试剂说明书
产品描述
Hieff Trans TM脂质体核酸转染试剂是一种多用途的脂质体转染试剂,适用于DNA、RNA 和寡核苷酸的转染,对大多数真核细胞具有很高的转染效率。
其独特的配方使其可直接加入培养基中,血清的存在不会影响转染效率,这样可以减少去除血清对细胞的损伤。
转染后不需要除去核酸-Hieff Trans TM复合物或更换新鲜培养基,也可在4~6小时后除去。
Hieff Trans TM以无菌的液体形式提供。
通常情况下对于 24 孔板转染,每次用1.5μl左右,则1ml Hieff Trans TM约可做660次转染;对于6孔板,每次用6μl左右,则1ml Hieff Trans TM约可做160 次转染;
运输与保存方法
冰袋(wet ice)运输。
产品4ºC保存,一年有效。
不可冷冻!
注意事项
1)Hieff Trans TM脂质体核酸转染试剂要求细胞铺板密度较高,以90%-95%为佳,这有助于减少阳离子脂质体细胞毒性造成的影响;如果你研究的基因要求比较长的表达时间,比如细胞周期相关基因,或者细胞表面蛋白,最好选择细胞铺板密度要求较低的转染试剂,不适合用脂质体核酸转染试剂。
2)Hieff Trans TM脂质体核酸转染试剂可用于有血清培养基的转染,并且转染前后不需要换培养基。
但是,制备转染复合物时要求用无血清培养基稀释DNA和转染试剂,因为血清会影响复合物的形成。
另外,要检测所用的无血清培养基与脂质体核酸转染试剂的相容性,已知CD293, SFMII, VP-SFM 就不相容。
3)转染的时候培养基中不能添加抗生素。
4)使用高纯度的DNA或RNA有助于获得较高的转染效率,质粒中的内毒素是转染的大敌。
5)阳离子脂质体应该在4度保存,要注意避免多次反复长时间开盖,因为可能会导致脂质体氧化而影响转染效率。
6)初次使用应优化DNA浓度和阳离子脂质体试剂量以得到最大的转染效率。
DNA 和转染试剂的比例,通常推荐是1:2-1:3,比如24孔板内接种0.5-2×105个细胞,使用0.5 µg DNA 和1-1.5 µl 转染试剂。
通过调整DNA/Hieff Trans TM脂质体核酸转染试剂比例优化转染效率,保证细胞密度大于90%,DNA(μg): Hieff Trans TM(μl)比值在1:0.5-1:5。
操作流程(以24孔板为例,其他培养板加样体积请参考表一)
【注】:转染试剂使用量受细胞类型及其他实验条件影响,建议初次使用时设置梯度进行优化最佳使用量。
贴壁细胞:转染前一天(20-24小时),胰酶消化细胞并计数,细胞铺板(不含抗生素),使其在转染时密度为90-95%(0.5-2 × 105 cells/well for a 24-well plate)。
悬浮细胞:转染当天,配制DNA复合物之前,24孔板中细胞铺板,每500µl生长培养基(不含抗生素)中加入4-8×105 cells。
1. 按照以下体系配制DNA-Hieff Trans TM脂质体核酸转染试剂复合物:
1)对于每孔细胞,使用50μl无血清培养基(如OPTI-MEMⅠ培养基)稀释0.5μg DNA。
混匀。
2)对于每孔细胞,使用50μl无血清培养基(如OPTI-MEMⅠ培养基)稀释0.6-2.5 μl Hieff Trans TM脂质体核酸转染试剂。
Hieff Trans TM脂质体核酸转染试剂稀释后室温孵育5min(在30min内同稀释的DNA 混合,保温时间过长会降低活性)。
【注意】:即使脂质体核酸转染试剂使用OPTI-MEM稀释,细胞也可以使用DMEM 培养。
如果DMEM 作为脂质体核酸转染试剂的稀释液,必须在5min内同稀释的DNA混合。
2. 混合稀释的DNA和稀释的脂质体核酸转染试剂(总体积100µl),轻轻混匀,并在室温(15-25℃)孵育20min,使得DNA-脂质体复合物形成。
此时溶液可能会混浊,但不会影响转染。
【注意】:DNA-脂质体复合物室温至少稳定保存5h。
3. 直接将100µl DNA-Hieff Trans TM复合物加入到细胞培养板每个孔中,摇动培养板,轻轻混匀。
【注意】:如果在无血清条件下转染,使用含血清的正常生长培养基进行细胞铺板。
在加入复合物前移去生长培养基,替换为500µl无血清培养基。
4. 37℃,5% CO2培养箱培养24-48h,直至进行转基因表达分析,无需去掉复合物或更换培养基。
然而,可能有必要在4-6h后更换生长培养基,不会降低转染活性。
稳转细胞株:转染24h后,按照1:10或更高比例在细胞中加入新鲜生长培养基,转染48h 后加入筛选培养基。
悬浮细胞株:在细胞中加入DNA-Hieff Trans TM复合物后,如果需要可以4h后加入PMA
和/或PHA。
对于Jurkat细胞,PHA和PMA的终浓度分别为1µg/ml和50ng/ml,可以提高CMV启动子活性和基因表达。
对于K562细胞,只加入PMA足以提高启动子活性。
转染体系的调整
对于不同的细胞培养板,Hieff Trans TM脂质体核酸转染试剂、DNA、细胞和培养基的使用量会有所不同,具体请参考下表(表一)。
对于96 孔板培养,不需要提前一天进行细胞铺板,可以直接在平板中制备复合物,然后将细胞悬浮液加入到复合物就可以了,这样进一步减少了转染时间。
这种改进步骤已经过293-H,293-F,COS-7L和CHO细胞的试验,同传统方法相比活性稍低。
快捷的步骤和蛋白表达细胞系的高效转染使得脂质体核酸转染试剂非常适用于96 孔板的高通量转染,比如cDNA文库的筛选和蛋白瞬时表达。
1 不同厂商提供的细胞培养板表面积可能有所不同;
2 稀释DNA或RNAi所用的培养基体积。
【注】:该表使用量仅供参考,具体使用量还需根据细胞类型及其他实验条件进行优化。
使用时DNA(μg): Hieff Trans TM(μl)比值保持在1:0.5-1:5。
