河南省荥阳三中高中化学走进化学工业(第1课时)《生产硫酸的基本流程》三案一课学案新人教版选修2
高一化学下册《工业制硫酸》教案、教学设计

5.能够运用所学知识,分析实际工业生产过程中可能存在的问题,并提出合理的解决方案。
(二)过程与方法
在本章节的教学过程中,教师应采用以下方法引导学生学习:
1.通过案例分析,让学生了解硫酸工业的历史、现状及发展趋势,培养学生关注化学与生活、生产的联系。
讲授新知后,组织学生进行小组讨论,具体安排如下:
1.分组:将学生分成若干小组,每组4-6人,确保组内成员在知识、能力等方面具有一定的互补性。
2.讨论主题:围绕工业制硫酸的反应原理、设备与工艺流程、环保问题等方面展开讨论。
3.讨论要求:每个小组针对讨论主题,总结出关键点,并准备好向全班同学分享。
4.分享与交流:每组选派一名代表进行分享,其他小组成员可进行补充。在此过程中,鼓励学生提问、发表见解,培养学生的批判性思维。
2.化学方程式:指导学生书写工业制硫酸过程中的化学方程式,并解释反应条件对反应速率和平衡的影响。
3.设备与工艺流程:介绍工业制硫酸的主要设备、工艺流程及其操作注意事项,让学生了解实际生产过程。
4.环保与绿色化学:强调硫酸工业生产过程中的环保问题,引导学生关注绿色化学,将环保理念融入实际生产。
(三)学生小组讨论
高一化学下册《工业制硫酸》教案、教学设计
一、学目标
(一)知识与技能
1.了解硫酸在工业、农业、日常生活等领域的重要应用,认识到硫酸工业的重要性。
2.掌握工业制硫酸的反应原理,包括硫铁矿的氧化、二氧化硫的生成、二氧化硫转化为三氧化硫的过程以及三氧化硫与水反应生成硫酸的步骤。
3.学会使用化学方程式表示硫酸的制备过程,并能解释反应条件对反应速率和平衡的影响。
2.教学过程:
硫酸生产工艺流程知识分享
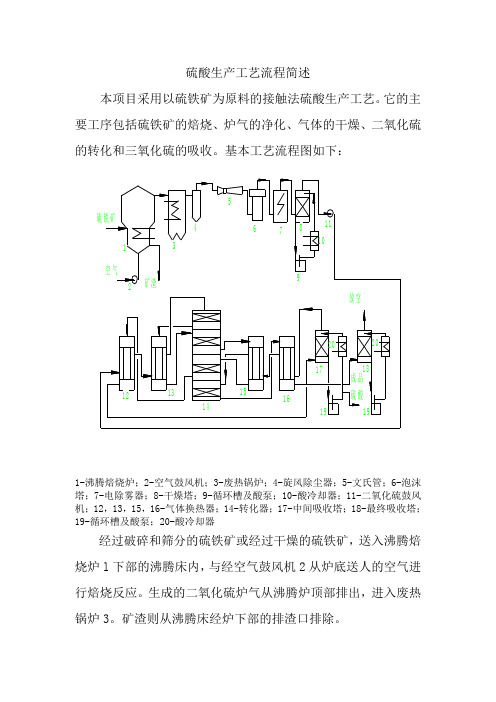
硫酸生产工艺流程简述本项目采用以硫铁矿为原料的接触法硫酸生产工艺。
它的主要工序包括硫铁矿的焙烧、炉气的净化、气体的干燥、二氧化硫的转化和三氧化硫的吸收。
基本工艺流程图如下:1-沸腾焙烧炉;2-空气鼓风机;3-废热锅炉;4-旋风除尘器;5-文氏管;6-泡沫塔;7-电除雾器;8-干燥塔;9-循环槽及酸泵;10-酸冷却器;11-二氧化硫鼓风机;12,13,15,16-气体换热器;14-转化器;17-中间吸收塔;18-最终吸收塔;19-循环槽及酸泵;20-酸冷却器经过破碎和筛分的硫铁矿或经过干燥的硫铁矿,送入沸腾焙烧炉l下部的沸腾床内,与经空气鼓风机2从炉底送人的空气进行焙烧反应。
生成的二氧化硫炉气从沸腾炉顶部排出,进入废热锅炉3。
矿渣则从沸腾床经炉下部的排渣口排除。
炉气在废热锅炉内冷却到约3500C,用以生产3.82Mpa、450摄氏度的过热蒸汽。
主要的蒸汽蒸发管束设在废热锅炉内。
装设在焙烧炉沸腾床内的冷却管也作为废热锅炉热力系统的一部分,与锅炉的汽包连接,用以回收部分焙烧反应热。
从废热锅炉出来的炉气,还含有相当数量的矿尘,经旋风除尘器4初步除尘后,进入净化系统。
废热锅炉、旋风除尘器除下的矿尘,与沸腾焙烧炉排出的矿渣一起送往堆渣场,等待进一步处理或出售。
净化系统包括文氏管5、泡沫塔6和电除雾器7。
文氏管对炉气进行除尘和降温,炉气经文氏管后,其中绝大部分矿尘被除去。
泡沫塔对炉气进一步除尘、降温。
在文氏管和泡沫塔中,炉气中所含的微量三氧化硫,从硫酸蒸汽形态转变成酸雾;砷、硒和其他一些金属的氧化物则成为固态粒子,从气相中分离出来;它们一部分与炉气中残存的微量矿尘一起被洗涤除去,另一部分随气体进入电除雾器,在高压静电作用下被清除干净。
通常,控制出净化系统的炉气温度在400C以下,以保证干燥-吸收系统的水平衡。
净化系统中排出的高含尘的稀酸送入污水处理系统,经CN 过滤器处理后抽回系统循环使用。
经过净化的气体,在干燥塔8中被循环淋洒的浓硫酸干燥。
河南省荥阳三中高中化学 化学与技术的发展《化肥》三案一课学案 新人教版选修2

第21课时 化肥学案【学习目标】1.了解常见化肥的组成、性质、作用。
2.了解几种常见化肥的制法。
【重点难点】常见化肥的制法、性质、作用课前预习【情景材料】化肥和农药为提高农作物的产量和质量、解决人类的粮食问题做出了不可磨灭的贡贡献,两者都是体现化学在农业生产中广泛应用的典型实例。
化学肥料为农作物生长提供所需的某种(或几种)元素,目前,人为地向土壤添加有所需元素的化学物质仍然是解决地力贫瘠的主要途径,农业生产的需要促进了肥料工业业的发展。
【预习内容】根据教材有关内容填写下列空白:一、化肥为农作物补充必要的营养元素农业生产中,大量使用的化肥主要是 、 和 。
1.磷肥:目前广泛使用的磷肥是 ,主要成分是 和 ,简称 ,其生产原料是 。
(填化学式)2.钾肥:农业上常用的钾肥主要有 、 和 。
3.氮肥:农业上使用最多的是氮肥,如 、 和 。
①写出工业制尿素的主要反应式: ; 。
②用方程式表示硝酸铵的生产原理: ; ; ; 。
4.复合肥料:复合肥料对植物的肥效 单一肥料,常用的复合肥有 、 等。
钙镁磷肥的主要成分是 和 ,它是一种缓效的 。
预习内容答案一、氮肥 磷肥 钾肥1.过磷酸钙 Ca( H 2PO 4)2 ·H 2O CaSO 4 普钙 Ca 5(PO 4)3F2.氯化钾 硫酸钾 硝酸钾3.尿素 硝酸铵 碳酸氢铵2NH 3+CO 2=====加压、加热H 2NCOONH 4 H 2NCOONH 4=====加热H 2NCONH 2+H 2O4NH 3+5O 2=====Pt ~Rh高温4NO +6H 2O 2NO +O 2===2NO 23NO 2+H 2O===2HNO 3+NO NH 3+HNO 3=NH 4NO 34.优于 铵磷复合肥 硝酸复合肥 Ca 3(PO 4)2 Mg 3(PO 4)2 多元复合肥堂中互动【问题探究1】常见化肥大致分为哪几类?大多数氮肥是如何生产制备的?【教师点拨】参考教材P84的内容。
硫酸生产流程

硫酸生产流程硫酸是一种重要的化工原料,广泛应用于冶金、化工、电镀、造纸等行业。
硫酸的生产流程通常包括硫磺燃烧、气体净化、氧化和吸收、结晶和浓缩等环节。
首先,硫磺燃烧是硫酸生产的第一步。
硫磺经过燃烧反应生成二氧化硫气体,反应方程式为S + O2 → SO2。
这一步骤通常在燃烧炉中完成,产生的二氧化硫气体会被送入后续的气体净化环节。
其次,气体净化是为了去除二氧化硫气体中的杂质。
二氧化硫气体中通常含有少量的氧气、水蒸气和尘埃等杂质,这些杂质会影响后续氧化和吸收的效果。
因此,气体净化设备通常采用洗涤塔或吸收塔,通过喷淋水或吸收剂将杂质吸收或洗涤掉,使二氧化硫气体变得纯净。
接下来是氧化和吸收环节。
经过气体净化的二氧化硫气体进入氧化器,与空气中的氧气发生氧化反应,生成二氧化硫气体。
反应方程式为2SO2 + O2 → 2SO3。
生成的二氧化硫气体会通过吸收器,与吸收剂(通常是浓硫酸)反应生成硫酸。
反应方程式为SO3 +H2SO4 → H2S2O7,H2S2O7 + H2O → 2H2SO4。
这一步骤是硫酸生产的关键环节,需要控制好反应温度、压力和反应时间,以确保产物纯度和产量。
最后是结晶和浓缩环节。
通过结晶器将生成的硫酸溶液进行结晶分离,得到硫酸结晶体。
然后将硫酸结晶体进行脱水浓缩,得到浓硫酸成品。
浓硫酸成品可以直接包装销售,也可以作为其他化工生产的原料使用。
总的来说,硫酸生产流程包括硫磺燃烧、气体净化、氧化和吸收、结晶和浓缩等环节。
这些环节相互关联,需要严格控制各个环节的工艺参数,以确保硫酸生产的安全、稳定和高效。
同时,随着科技的发展,硫酸生产技术也在不断创新和改进,以适应不同行业对硫酸品质和产量的需求。
部编人教版高二化学选修2《第1单元走进化学工业课题1化工生产过程中的基本问题》课堂教学精品ppt课件

两位小数)
工具
第一单元 走进化学工业
栏目导引
【解析】 (1)黄铁矿的主要成分为FeS2,同时根据质量守 恒也可推出。
(2)接触室实现了SO2氧化为SO3的目的。
(3)a相当于增大接触面积,正确;b中增加O2的量可使平衡 向生成SO3的方向移动,提高SO2的转化率,正确;c中催化剂只 对反应速率有影响,对平衡无影响,错误;d中矿渣含大量
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业 制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是 ______________________________________。
工具
第一单元 走进化学工业
栏目导引
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐 分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气 体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸 收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同; 铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为 40.00 g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是________%;若铵盐
质量为15.00 g,浓硫酸增加的质量为________。(计算结果保留
400~500 ℃
。
工具
第一单元 走进化学工业
栏目导引
四、硫酸工业废气和废渣的处理
1.尾气吸收 生产硫酸的尾气中含有少量 SO2 ,可用石灰水 吸收,
然后再用硫酸处理,生成的SO2可返回用作生产硫酸的原料,其 化学反应方程式为: SO2+Ca(OH)2===CaSO3+H2O 、 CaSO3+H2SO4===CaSO4+SO2↑+H2O 。
河南省荥阳高中化学走进化学工业(第1课时)《生产硫酸的基本流程》三案一课学案新人教版选修2
第1课时生产硫酸的基本流程学案【学习目标】1.依据化学反应原理知识,了解生产硫酸的基本流程。
2.了解硫酸工业生产中原料、厂址和规模的选择。
3.了解硫酸生产过程中反应条件的控制。
4.了解化学科学实验与化工生产的区别。
【重点难点】1.化工生产过程中的基本问题。
2.工业制硫酸的生产原理。
课前预习【情景材料】化工生产过程比较复杂,但一些最基本的问题是相似的,例如,任何化工生产都涉及到传质(物料的流动)、传热(能员的传导)、传动(动力的传输)和化学反应器等。
根据课程标准的要求,将化学反应原理、反应发生的条件、原料的选择、三废的处理和能量的利用等作为化工生产过程中的基本问题,结合一些典型产品的生产过程,使学生对化工生产的基本过程有一个初步的认识。
【预习内容】根据教材有关内容填写下列空白:一、依据化学反应原理确定生产过程1.工业制备硫酸,要从以下几个方面考虑(1)采用的原料应该是自然界中的含物质,如、。
(2)生产过程中,要先使硫元素转化成,再把转化成,再与水反应制得。
2.工业制硫酸主要分、、个阶段(1)以S为原料制备SO2化学反应方程式,(属反应)(2)利用催化氧化反庇将SO2氧化成SO3化学反应方程式,(属反应)(3)三氧化硫转化成硫酸化学反应方程式,(属反应)3.工业制硫酸主要生产流程二、生产中原料的选择工业生产某种化工产品,选择原料时,要从多方面虑,如、、原料、能源、工业用水的供应能力、储存、运输、预处理成本及环境保护等。
(1)从基建投资、加工费用及环保方面考虑,用制硫酸优于用制硫酸。
(2)我国天然硫资源,而且开采条件。
(3)我国黄铁矿储量比天然硫要。
(4)硫黄制硫酸比黄铁矿制硫酸生产流程、设备、三废少,劳动生产率,易于设备。
(5)由于原料多需进口,硫黄制硫酸成本比黄铁矿制硫酸。
三、生产中反应条件的控制1.硫酸工业生产的三个主要设备是、、。
2.温度较时,越有利于SO2转化为SO3,通常选择作为操作的温度,因为在这个温度范围内,和都比较理想。
硫酸的工业制法制备流程

硫酸的工业制法制备流程硫酸在工业上那可是相当重要的呢,就像个超级明星在化学工业的舞台上闪耀。
那它是咋被制造出来的呢?咱先来说说原料。
制造硫酸的主要原料有硫磺或者含硫矿石啥的。
硫磺呢,就像是个小金库,里面藏着能变成硫酸的宝藏。
要是用含硫矿石的话,就有点像从一个大杂烩里把有用的东西挑出来,不过这个过程也是充满乐趣的呢。
然后就是把硫磺或者含硫矿石变成二氧化硫啦。
这一步就像是给原料来个魔法变身。
如果是硫磺的话,把它点燃就好啦,硫磺就会欢快地变成二氧化硫气体,就像一个小火球在跳跃着释放出自己的魔力。
要是含硫矿石呢,那就得通过焙烧这个手段啦,就像在一个大烤箱里把矿石烤一烤,让里面的硫变成二氧化硫跑出来。
接下来呀,二氧化硫要变成三氧化硫。
这可不容易呢,就像让一个调皮的孩子变成一个听话的乖宝宝。
这个过程需要催化剂的帮忙,一般用的是五氧化二钒。
二氧化硫和氧气在这个催化剂的魔法下,在一定的温度和压力条件下,就会慢慢地结合在一起变成三氧化硫啦。
这个反应就像是一场精心编排的舞蹈,每个分子都在按照规则跳着自己的舞步,在催化剂这个指挥家的带领下,完美地结合在一起。
再之后呢,三氧化硫要变成硫酸。
这一步就像是给三氧化硫洗个澡,让它和水结合。
不过这个洗澡可不能直接用水冲哦,因为三氧化硫和水直接反应会特别剧烈,就像两个大力士在打架一样,容易出乱子。
所以呢,会用浓硫酸来吸收三氧化硫,然后再把得到的发烟硫酸稀释,这样就得到咱们想要的硫酸啦。
咱再说说这个过程中的一些小细节哈。
在整个制备流程中,温度、压力还有各种原料的比例都是很重要的。
就像做菜的时候盐放多少、火候多大一样重要。
如果温度不对,可能反应就不能很好地进行,就像蛋糕没烤熟一样尴尬。
压力也是,如果不合适,分子们就不能很好地聚集在一起反应。
原料比例也得刚刚好,多了少了都不行,就像穿衣服,太大太小都不合身呢。
还有哦,在这个工业制法里,环保也是个大问题呢。
因为在生产过程中可能会产生一些污染物,比如二氧化硫如果跑出去了就会污染空气,那可不行。
高一化学上学期硫酸工业流程--新人教版

化学教案-第五单元 硫酸工业 第一节 接触法制硫酸

化学教案-第五单元硫酸工业第一节接触法制硫酸一、教学目标1.了解接触法制硫酸的原理及生产过程。
2.掌握接触法制硫酸的工艺流程及操作条件。
3.培养学生的观察能力、实验能力和分析问题的能力。
二、教学重点与难点1.教学重点:接触法制硫酸的原理、工艺流程及操作条件。
2.教学难点:接触法制硫酸的化学反应原理及平衡移动。
三、教学过程1.导入新课通过提问方式引导学生回顾已学的硫酸制备知识,如硫酸的制备方法、原料等,为新课学习做好铺垫。
2.理论讲解(1)接触法制硫酸的原理:介绍接触法制硫酸的基本原理,包括二氧化硫的氧化、三氧化硫的吸收等。
(2)接触法制硫酸的工艺流程:详细讲解接触法制硫酸的工艺流程,包括沸腾炉、转化器、吸收塔等设备的作用及操作条件。
(3)接触法制硫酸的操作条件:分析接触法制硫酸的操作条件,如温度、压力、空速等,以及这些条件对生产的影响。
3.实验演示通过实验演示接触法制硫酸的模拟过程,让学生直观地了解生产过程中涉及的化学反应和设备。
4.小组讨论(1)接触法制硫酸的优缺点是什么?(2)如何改进接触法制硫酸的工艺,提高产量和降低成本?(3)在实际生产中,如何控制操作条件以保证产品质量和安全生产?(2)学生分享小组讨论的成果,提出自己的观点和疑问。
(3)教师针对学生的疑问进行解答,引导学生深入理解接触法制硫酸的相关知识。
四、作业布置1.复习接触法制硫酸的原理、工艺流程和操作条件。
2.列举接触法制硫酸的优缺点,并提出改进意见。
3.调查了解我国硫酸工业的现状及发展趋势。
五、教学反思本节课通过理论讲解、实验演示和小组讨论等多种教学手段,使学生掌握了接触法制硫酸的原理、工艺流程和操作条件。
在教学过程中,要注意引导学生主动参与,培养学生的实验能力和分析问题的能力。
同时,要关注学生的学习反馈,及时调整教学策略,提高教学效果。
重难点补充:1.教学重点补充接触法制硫酸的原理:通过动画或图示,详细解释二氧化硫氧化为三氧化硫的催化反应过程,以及三氧化硫与水反应硫酸的化学方程式。
高中化学 第一单元 走进化学工业 课题1 化工生产过程中的基本问题教案高二化学教案

【第一单元走进化学工业】之小船创作课题1化工生产过程中的基本问题教学目标分析课标解读1.依据化学反应原理,掌握生产硫酸的基本流程。
2.了解硫酸工业生产中原料、厂址和规模的选择。
3.了解硫酸生产过程中反应条件的控制及能量的综合利用。
4.了解化学科学实验与化工生产的区别。
5.了解工业生产中三废处理的方法,防止环境污染。
重点难点1.掌握硫酸工业生产中的“三原料、三阶段、三设备、三反应”。
(重点)2.能运用化学平衡原理分析二氧化硫催化氧化反应的适宜条件,了解硫酸生产过程中反应条件的控制。
(重难点)教学方案设计新课导入硫酸是一种重要的基本化工原料,也是一个国家化学工业生产能力的重要标志。
生产硫酸最古老的方法是用绿矾(FeSO4·7H2O)为原料,放在蒸馏釜中煅烧而制得硫酸,所以古代称硫酸为“绿矾油”。
你了解现代工业生产硫酸的流程吗?你了解工业生产中怎样处理“三废”防止环境污染吗?让我们共同学习本课题知识掌握化工生产过程中的基本问题。
课前自主导学依据化学反应原理确定生产过程1.化工生产与化学反应的关系化工生产依据化学反应原理符合化学反应规律基础实验室研究2.确定化工生产反应原理与过程的一般方法对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。
3.确定化工生产反应原理与过程的案例研究——生产硫酸(1)原料:从H2SO4的组成看,原料应该是自然界存在的含硫的物质,如硫黄、黄铁矿(主要成分是FeS2)等。
(2)步骤:生产硫酸的主要化学过程可以分成SO2的生成、SO2转化为SO3和SO3转化为硫酸三个阶段。
(3)原理:工业制硫酸的“三阶段”与“三反应”造气以S为原料S+O2=====点燃SO2以黄铁矿为原料4FeS2+11O2=====高温2Fe2O3+8SO2催化氧化2SO2+O2催化剂Δ2SO3吸收SO3+H2O===H2SO4生产中反应条件的控制1.生产中反应条件的选择在化工生产中要通过反应条件的控制使化学反应速率和反应物的转化率都比较理想,还要同时考虑控制某些反应条件的成本和实际可能性。
高中化学第一单元走进化学工业课题化学生产过程中的基本问题时教案新人教选修

第一单元走进化学工业课题1 化工生产过程中的基本问题【教学目标】1.了解生产硫酸的基本流程2.了解生产中原料的选择3. 了解化学科学实验与化工生产的区别。
4.注意生产中的三废处理,防止环境污染【学习过程】一、依据化学反应原理确定生产过程1.工业制备硫酸,要从以下的几个方面考虑(1)采用的原料应该是自然界中的含物质,如、。
(2)生产过程中,要先使硫元素转化成,再把转化成,再与水反应制得。
2.思考与交流:工业生产上制备硫酸的基本原理(1)以S为原料制备SO2化学反应方程式,(属反应)(2)利用催化氧化反应将SO2氧化成SO3化学反应方程式,(属反应)(3)三氧化硫转化成硫酸化学反应方程式,(属反应)3.工业制硫酸主要生产流程见课本P5二、生产中原料的选择1.思考与交流:我国生产硫酸需考虑的问题(1)从基建投资、加工费用及环保方面考虑,用制硫酸优于用制硫酸。
(2)我国天然硫资源,而且开采条件。
(3)我国黄铁矿储量比天然硫要。
(4)硫黄制硫酸比黄铁矿制硫酸生产流程、设备、三废少,劳动生产率,易于设备。
(5)由于原料多需进口,硫黄制硫酸成本比黄铁矿制硫酸,三、生产中反应条件的控制1. 硫酸工业生产的三个主要设备是 、 、 。
2.阅读P6表1-1,思考温度较____时,越有利于SO 2转化为SO 3二氧化硫催化氧化的反应方程式 ,属 _____________反应。
思考:是否温度越低越有利于SO 2 转化为SO 3 ? 2、提示:应选择温度:(1)低温(400~5000C)注意:工业生产中反应温度的选择往往还要考虑该温度下催化剂的活性3.阅读P6表1-2,思考压强的增大,SO 2的转化率_____思考:是否压强越高越好 ?3、提示:应选择压强:常压 注意:工业生产中压强的选择:往往还要考虑成本和能量消耗等问题。
四、生产中三废处理 1.如何处理尾气中的SO 2? 工业:SO22Ca(OH)Ca SO32 (重新利用)主要反应式 、。
高一化学上学期硫酸工业流程--新人教版

善叔不止嘴上功夫厉害,他还很能干。别看他眼瞎手残,可日常事务他基本都能自理,还能帮家里干些力所能及的农活。比方说,吃饭时,他会将长柄汤匙夹在两臂间,然后一口一口挖着吃,速度 并不比健全的人慢。穿衣洗漱什么的也不需人帮忙,这难免让人纳闷,他究竟是怎么做到的。至于喂猪提水晒谷子这类家务农活也难不倒他,路过之人每每看到,都会吃惊,而我们则早已习以为常,见 怪不怪了。千人斩
记忆中,善叔身体一向很好,几乎没听说他病过,在我看来,以他那壮硕身体,估计活个八九十不成问题。但让人想不到的是,后来呢,善叔家里不知撞上什么鬼,先是老母亲毫无征兆去世,后是 妹夫因庸医误诊,导致头晕,意外失足离世,再后便是善叔猝死,前后不过七八年功夫。那位厉害的妹妹呢,陆续送走三位至亲,又相继安置好几个儿女,等最后一个孩子也娶了老婆,竟然也猝然而逝。 听姐姐说,一刻还打着牌呢,后一刻说没就没了,和她母亲,哥哥,几乎一样的死法。
高中化学第一单元走进化学工业课题1化学生产过程中的基本问题教案新人教选修2

第一单元课题1 化工生产过程中的基本问题教学目标:1.了解生产硫酸的基本流程2.了解生产中原料的选择3. 了解化学科学实验与化工生产的区别。
4.注意生产中的三废处理,防止环境污染教学过程:[共同复习硫酸的用途.引入第一个大问题。
]一、依据化学反应原理确定生产过程【师】硫酸是化学工业中的重要产品之一。
首先硫酸大量用于化肥和农药的生产;在有机合成工业中,硫酸用于各种磺化反应和硝化反应,生产醚、酯、有机酸、也要消耗硫酸;在无机化学工业中,HF、H3PO4等的生产及K、Fe、Cu、Zn、Al的硫酸盐的生产等,都要消耗硫酸;在冶金工业及国防工业中,如生产炸药;石油工业、染料、人造纤维、食品、电池、搪瓷、医药、机械加工工业等许多部门,都要用到硫酸。
既然需要这么多硫酸,那么怎样制取呢?【师、生】1、应结合硫酸的组成和性质,来确定原料和生产路线。
经分析可知,生产硫酸主要化学过程可分为二氧化硫的生成和二氧化硫转化为三氧化硫两个主要阶段。
2、其具体生产原理为造气:4FeS2(S) +11 O2(g) 高温 2Fe2O3(s)+ 8SO2(g) 或S(S)+O2(g)高温SO2(g)二氧化硫的催化氧化:2SO2(g) + O2 (g) 催化剂2SO3(g)三氧化硫的吸收:SO3 (g) + H2O(l) = H2SO4(l)注意:工业上是用98.3%的浓硫酸来吸收SO3的,而不是直接用水或稀硫酸作吸收剂,原因是用后者吸收时容易形成酸雾,吸收速率慢。
3、工业制硫酸主要生产流程参看P5图1-2 ,造气→净化、干燥→催化反应室→吸收塔→稀释室→贮存室另外,还需要考虑原料的净化、适宜反应条件及设备的选择、废热的利用等。
二、生产中原料的选择1、我国生产硫酸需考虑的问题(1)从基建投资、加工费用及环保方面考虑,用硫磺制硫酸优于用黄铁矿制硫酸。
(2)我国天然硫资源缺乏,而且开采条件比较复杂。
(3)我国黄铁矿储量比天然硫要大。
(4)硫黄制硫酸比黄铁矿制硫酸生产流程短、设备简单、三废治理量小,劳动生产率高,易于设备大型化。
高三政治走进化学工业教案人教新课标版

走进化学工业【知识网络】【重点聚焦】化工生产虽多种多样,但大多遵循的思路是:反应原理→反应条件及原料的选择→“三废”处理及能量利用。
硫酸生产、工业合成氨及纯碱的生产都体现出该思路。
一、工业生产硫酸1、生产原理(1)生产原理分析H2SO4中的S元素可由自然界中含硫的物质(硫磺、硫铁矿等)来提供。
S或FeS2生成H2SO4,从化合价角度分析,需要被氧化;从元素角度分析,需O元素、H元素。
根据物质的化学性质可知,应是S或FeS2被氧化为SO2,SO2再氧化为SO3,SO3被H2O吸收生成H2SO4。
(2)有关反应由原理分析知,工业制H2SO4分造气、氧化、吸收三个阶段。
i:造气阶段主要是硫磺燃烧或硫铁矿煅烧生成SO2,反应分别为:S(s)+O2(g)SO2(g); ΔH=-297kJ/molFeS2(s)+O2(g)Fe2O3(s)+2SO2(g);ΔH=-853kJ/mol ii:SO2的催化氧化S或FeS2与O2只能生成SO2,SO2只有在催化剂作用下才生成大量的SO3。
SO2(g)+O2(g)SO3(g);ΔH=-98.3kJ/moliii:H2SO4的生成SO3溶于H2O生成H2SO4,同时放出大量热,反应为:SO3(g)+H2O(l)=H2SO4(l);ΔH=-130.3kJ/mol该阶段能放出大量热量,易形成酸雾,不利于SO3的吸收。
为了尽可能提高吸收效率,工业上用H2SO4质量分数为98.3%的浓H2SO4作吸收剂。
2、生产原料根据化学反应原理可选择原料,但工业生产要考虑成本和综合经济效益,必须多种角度考虑,如厂址选择、能源、工业用水的供应能力、贮存、运输、预处理成本及环境保护等。
目前,我国主要有硫磺制H2SO4和硫铁矿制H2SO4两种方法。
(1)、硫磺制硫酸和硫铁矿制硫酸的比较:①硫磺制硫酸比硫铁矿的优点:A、从基建投资,加工费用及环境保护等方面考虑,用硫磺制硫酸的装置简单。
B、硫磺制硫酸的生产流程短、劳动产率高。
选修二化学走进化学工业文稿演示

N2 + O2 ==== 2NO 2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO
雷雨发庄稼
氮的固定
将游离态氮转化为化合态氮的方法叫氮的固定.
(一)合成氨的反应原理
• 由氮气与氢气直接合成氨的化学原 理为:
高温高压
N2(g)+3H2(g) 催化剂 2NH3 (g)
(放热)
(二)工业合成氨的原料选择
思考: 工业合成氨时N2取自于什么物质?H2又来 源于哪里?
N2主要来源于空__气__ (从空气中分离出N2有哪些方法?) 氢气主要来源于碳__、__碳的氢化物和水反应
选修二化学走进化学工业文稿演示
(优选)选修二化学走进化学 工业
教学目标
1、以硫酸工业为例,了解化工生产中的一些基本问题。 2、知道生产硫酸的主要原理、原料、流程和意义。 3、能用勒夏特列原理选择二氧化硫催化氧化的合适条件。 4、了解合成氨的主要原理、原料、重要设备、流程和意义。 5、认识合成氨反应的特点,学会选择合成氨的适宜条件。 6、认识催化剂的研制对促进化学工业发展的重要意义。 7、 掌握氨碱法制取纯碱的原料、原理及工艺流程。 8、了解联合制碱法的原理。
题)
小结:(本节课重点)
• 1,工业上接触法制硫酸概括为“五个三” : • 三种原料: ❖硫磺(或黄铁矿),空气,和水 • 三个反应: • 三个生产过程: 造气,催化氧化,吸收 • 三个主要设备: 沸 腾 炉,接 触 室,吸收塔 • 硫酸工业生产的三个适宜条件:
(1)低温(400~5000C) (2)常压 (3)适当过量的空气
(三)硫酸工业生产的三个主要设 备
98.3%H2SO4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1课时生产硫酸的基本流程学案【学习目标】1.依据化学反应原理知识,了解生产硫酸的基本流程。
2.了解硫酸工业生产中原料、厂址和规模的选择。
3.了解硫酸生产过程中反应条件的控制。
4.了解化学科学实验与化工生产的区别。
【重点难点】1.化工生产过程中的基本问题。
2.工业制硫酸的生产原理。
课前预习【情景材料】化工生产过程比较复杂,但一些最基本的问题是相似的,例如,任何化工生产都涉及到传质(物料的流动)、传热(能员的传导)、传动(动力的传输)和化学反应器等。
根据课程标准的要求,将化学反应原理、反应发生的条件、原料的选择、三废的处理和能量的利用等作为化工生产过程中的基本问题,结合一些典型产品的生产过程,使学生对化工生产的基本过程有一个初步的认识。
【预习内容】根据教材有关内容填写下列空白:一、依据化学反应原理确定生产过程1.工业制备硫酸,要从以下几个方面考虑(1)采用的原料应该是自然界中的含物质,如、。
(2)生产过程中,要先使硫元素转化成,再把转化成,再与水反应制得。
2.工业制硫酸主要分、、个阶段(1)以S为原料制备SO2化学反应方程式,(属反应)(2)利用催化氧化反庇将SO2氧化成SO3化学反应方程式,(属反应)(3)三氧化硫转化成硫酸化学反应方程式,(属反应)3.工业制硫酸主要生产流程二、生产中原料的选择工业生产某种化工产品,选择原料时,要从多方面虑,如、、原料、能源、工业用水的供应能力、储存、运输、预处理成本及环境保护等。
(1)从基建投资、加工费用及环保方面考虑,用制硫酸优于用制硫酸。
(2)我国天然硫资源,而且开采条件。
(3)我国黄铁矿储量比天然硫要。
(4)硫黄制硫酸比黄铁矿制硫酸生产流程、设备、三废少,劳动生产率,易于设备。
(5)由于原料多需进口,硫黄制硫酸成本比黄铁矿制硫酸。
三、生产中反应条件的控制1.硫酸工业生产的三个主要设备是、、。
2.温度较时,越有利于SO2转化为SO3,通常选择作为操作的温度,因为在这个温度范围内,和都比较理想。
3.压强的增大,SO2的转化率。
通常采用操作。
4.催化剂:催化剂对化学平衡,但能改变到达平衡所需的时间,即增大。
预习内容答案一、1.(1)硫硫黄黄铁矿(主要成分FeS2)(2)SO2 SO2 SO3 H2SO42.造气催化氧化吸收(1)S(s)+O2 (g)=SO2 (g) 放热(2)2SO2 (g)+ O2 (g) 2SO3(g) 放热(3)SO3(g)+H2O(l)=H2SO4(1) 放热3.空气制SO2 400~500℃ 常压、催化剂 SO3发烟硫酸水 98%硫酸 98%硫酸二、化学反应原理厂址选择(1)硫黄黄铁矿(2)缺乏比较复杂(3)大(4)短简单治理量高大型化(5)高三、1.沸腾炉接触室吸收塔2.低 400~500℃ 反应速率二氧化硫的转化率3.变化不大常压4.没有影响化学反应速率堂中互动【问题探究1】对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。
请结合课本写出关于工业制硫酸的反应原理和过程?【教师点拨】掌握七个“三”,即“三阶段”、“三原料”、“三反应”、“三设备”、“三杂质”、“三净化”、“三原理”。
分析解答:化工生产是以化学反应原理为依据,以实验室研究为基础的。
任何生产的完成都要符合化学反应规律。
【即学即练1】在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应1.B【解析】本题考查化工生产中的技术处理问题。
可从化学反应速率、化学平衡移动及实际生产三个方面考虑各种操作条件的原因。
矿石粉碎是为了提高反应速率,并不是因为大块的硫铁矿不能燃烧;用浓硫酸吸收SO3是为了防止水与其形成酸雾;使用催化剂可以提高反应速率,但不能提高SO2的转化率;从沸腾炉出来的炉气需净化,因为炉气中杂质会使催化剂中毒。
【问题探究2】阅读P6表1-1,结合二氧化硫催化氧化的反应特点:是否温度越低越有利于SO2转化为SO3?阅读P6表1-2,分析随压强的增大,SO2的转化率怎么改变?是否压强越高越好? 【教师点拨】反应方程式2SO2(g)+O2(g)2SO3(g),属放热的可逆反应,气体体积减少的反应,从化学平衡的角度解释。
工业生产中压强的选择,往往还要考虑成本和能量消耗等问题。
分析解答:根据外界条件对化学反应速率和化学平衡影响的规律,选择化工生产的适宜条件时,既要注意外界条件对二者影响的一致性,又要注意对二者影响的矛盾性;既要注意温度、催化剂对化学反应速率影响的一致性,又要注意催化剂的活性对温度的限制;既要注意理论生产,又要注意实际可能性。
【即学即练2】已知,在硫酸工业中,①SO2转化为SO3的反应为:2SO2 + O22SO3 △H<0。
②经测定,在常压下上述反应的平衡混合气体中,SO2的体积分数为91%。
③催化剂V2O5的催化效率f与温度T有如图所示的关系。
④经除尘除杂后的SO2气体的温度约为200℃,反应后SO3气体温度约为600℃。
请根据以上信息,选择SO2催化氧化的适宜条件。
2.SO2氧化过程的适宜条件为:①氧气或空气适当过量;②常压;③450℃~500℃;④使用热交换器。
【解析】由①及化学平衡原理,加压有利于SO2的转化,但由②知,常压下SO2的转化率已很高,因转化率的上升空间较小,故不必再来取加压措施,以省掉加压泵的开支和降低接触室的造价。
观察催化剂的催化效率与温度关系图知,450℃以后催化效率基本不变,升温有利于提高反应速率,但不利于SO2转化,故反应温度控制在450℃~500℃为宜。
除尘后SO2温度低,不利于SO2氧化反应的进行,生成的SO3温度高,不利于SO3的吸收,解决这一问题的方法是使用热交换器。
【问题探究3】二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)1.请用平衡移动原理来解释:为什么降低温度和增大压强有利于提高转化率?2.如果其他条件不变,分别改变下列条件,将对化学平衡有什么影响?(1)增大O2的浓度;(2)减小SO3的浓度。
【教师点拨】如果改变影响平衡的一个条件(如浓度、温度、压强等),平衡就向能减弱这种改变的方向移动。
催化剂能同等程度地增加正反应速率和逆反应速率,因此对化学平衡没有影响,但能改变到达平衡所需的时间。
分析解答:①浓度对化学平衡的影响,增大生成物的浓度或减小反应物的浓度时,平衡向逆反应方向移动。
②在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。
(2)压强对化学平衡的影响,一般规律:对于有气体参加且反应前后气体体积不相等的可逆反应,在其他条件不变的情况下,若增大压强(即相当于缩小容器的体积),则平衡向气体总体积减小的方向移动,若减小压强(即增大容器的体积),则平衡向气体总体积增大的方向移动。
【即学即练3】有关接触法制硫酸的叙述不正确...的是( )。
A.硫黄和硫铁矿均可作为生产原料B.将矿石粉碎,是为了提高反应速率C.反应中通入过量的空气是为了提高FeS2和和SO2的转化率D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸3.D【解析】A项,理论上,可转化成SO2的任何含硫物质均可作为硫酸的生产原料,(如S、FeS、FeS2、H2S等),但在生产实践中,应选取那些储量大、矿质品位高、资源丰富、便于开采和加工的矿物作为化工原料,综合分析,A正确。
B项,生产中对矿石进行粉碎,既可增大原料之间的相对接触面积(增大反应速率),又可提高原料的利用率(转化率),故B正确。
C项,从硫酸生产的三个反应看(FeS2→SO2→SO3→H2SO4,有两个反应要耗用氧气,故生产中可采用通入过量空气的方法来提高FeS2和SO2的转化率,故C正确。
D项,在吸收塔中,是用98%的浓硫酸吸收SO3的,所得到发烟硫酸,可用水或稀硫酸稀释,制得各种浓度的硫酸,故D错误。
练案A组(课堂反馈满分50分)一、选择题(每小题5分,共35分)1.在以下条件下,宜于建工厂的城市是( )。
A.城市郊区有丰富的黄铁矿资源,水源、能源充足B.城市是一座风光秀丽、空气清新的旅游城市C.城市有丰富的磷灰石,拟建一座大型的磷肥厂D.城市需使用硫酸的工业不多,却有丰富的黄铁矿资源1.AC【解析】本题考查了从综合的角度分析建设工厂的一般条件。
2.接触法制硫酸中,与之无关的设备是()A.吸收塔B.接触室C.沸腾炉D.氧化炉2.D【解析】接触法制硫酸三种设备:沸腾炉、接触室、吸收塔。
3.硫酸工业中燃烧硫铁矿生产SO2时,为提高生成SO2的速率,下列措施可行的是()A.把块状矿石粉碎成粉末B.降低温度C.减小压强D.使用催化剂Fe2O33.A【解析】生产中对矿石进行粉碎,既可增大原料之间的相对接触面积(增大反应速率),又可提高原料的利用率(转化率)。
4.化工厂厂址选择是一个复杂的问题,受到原料、水源、能源、土地供应、市场需求、交通运输和环境保护等诸多因素的制约,硫酸厂应建在( )①靠近原料产地,远离消费中心的地区②靠近消费中心,稍偏离原料产地的地区③交通便利,人口稠密的居民区④环保要求高的地区,便于“三废”的治理A.①②③④B.①③④C.①②④D.②4.D【解析】因硫酸是一种强腐蚀性液体,运输极不方便,需要较高的成本,所以硫酸工厂厂址选择上首先要考虑建在②且远离环保要求高的地区。
5.下列对硫酸生产中化学反应原理的分析中正确的是()。
A.硫酸生产中涉及的三个化学反应因原料的不同可能全部是非氧化还原反应B.硫酸生产中涉及的三个化学反应都是放热反应C.硫酸生产中涉及的三个化学反应都需要用催化剂D.硫酸生产中涉及的三个化学反应都需要在较高的温度下才能进行5.B【解析】硫酸生产中涉及的三个化学反应为:①S+O2SO2 ;②2SO2+ O22SO3;③SO3+H2O=H2SO4。
这三个反应中第一和第二个是氧化还原反应,第一和第三个反应不需催化剂反应就非常快,第三个反应在常温下就非常剧烈,这三个反应都是放热反应(工业还采取措施利用这些反应放出的热量),所以选项A、C、D都是错误的,选项B正确。
6.将三氧化硫溶解在硫酸中所得到的混合物称为“发烟硫酸”,通常以三氧化硫的质量分数表示其组成。
将 1185 g发烟硫酸试样溶于水,用125 mol·L-1的NaOH标准溶液滴定。
用去此标准溶液20 mL,恰好中和,则试样中SO3的质量分数为()A.15%B.17%C.34%D.60%6. A【解析】n(NaOH)=125mol·L-1×20×10-3L=2.5×10-3mol2NaOH + H 2SO 4=Na 2SO 4+2H 2O2mol 1mol2.5×10-3mol 1.25×10-3mol设发烟硫酸的组成为H 2SO 4·nSO 3,溶于水后1mol 发烟H 2SO 4生成(n +1)mol H 2SO 4。
