《制药单元操作技术(上)》教学课件—07蒸馏技术
合集下载
蒸馏技术—确定精馏操作条件(制药单元操作技术课件)

Ki
yi xi
式中: yi 和 xi 分别表示 i 组分在互为平衡的汽、液两相中的摩尔分数。 对于易挥发组分,Ki >1,即 yi > xi ; Ki 值越大,组分在汽、液两相中的摩尔分数相差越大,分离也越容易。
29
03 确定精馏操作条件
溶液中各组分的挥发性由挥发度来量衡,其定义为组分在汽相中的平衡蒸汽 压与在液相中的摩尔分数的比值。
8
确定精馏操作条件
相组成的表示法
(1)质量分率xw:混合液中某组分的质量与混合物总质量的比值。
xw,A =mA/m
xw,B =mB/m
xw,A + xw,B =1
(2)摩尔分率x:混合物中某组分的摩尔数与总摩尔数的比值。
xA =nA/n
xB =nB/n
xA + xB =1
(3)xw与x的关系
xA = (xw,A /MA)/[(xw,A /MA)+(xw,B /MB)]
6
03 确定精馏操作条件
常压蒸馏(或精馏)都是在恒压条件下进行,对于某一 双组分物料体系,若塔板上达到气液平衡,此时该板上影响 气相组成和液相组成的唯一因素是温度,即温度改变则气相 组成和液相组成均发生变化。当然,即使同一压力、同一温 度,物料体系不同,气液平衡时气相组成和液相组成也不同。
7
03
达的是一定总压下液相组成与溶液泡点温度关系。 已知溶液的泡点可由上式计算液相组成;反之,已知组成也可由
上式算出溶液的泡点,但一般需试差。
18
03 确定精馏操作条件
式中纯组分 A、B 的饱和蒸汽压与温度的关系,通常用安 托因(Antoine)方程表示:
ln po A B T C
p o ——任一纯组分的饱和蒸气压,Pa
精馏技术—认识蒸馏装置(化工单元操作课件)

蒸馏: 利用液体混合物中各组分间挥发度的差异,将各组分分 离的一种单元操作。将液体混合物部分气化并通过气液两 相间的质量传递来实现。
按分离的难易或对分离的要求高低来分,蒸馏操作可分为简单蒸馏、 平衡蒸馏、精馏和特殊精馏,对较易分离或对分离纯度要求不高的物料, 可采用简单蒸馏或平衡蒸馏,而对要求分离纯度高或难分离的物料,一 般采用精馏方法分离,另外对于普通蒸馏方法无法分离或分离时操作费 用和设备投资很大,经济上不合理时可采用特殊蒸馏,如恒沸精馏、萃 取精馏等。
按分离的难易或对分离的要求高低来分,蒸馏操作可分为简单蒸馏、 平衡蒸馏、精馏和特殊精馏,对较易分离或对分离纯度要求不高的物料, 可采用简单蒸馏或平衡蒸馏,而对要求分离纯度高或难分离的物料,一 般采用精馏方法分离,另外对于普通蒸馏方法无法分离或分离时操作费 用和设备投资很大,经济上不合理时可采用特殊蒸馏,如恒沸精馏、萃 取精馏等。
01 任务一 认识蒸馏装置
子任务3 认识蒸馏的工业应用
01 任务一 认识蒸馏装置
01 任务一 认识蒸馏装置
归纳与总结:
1. 蒸馏塔的辅助设备。 2. 蒸馏过程的工业应用。
模块五 精馏技术
目录
CONTENTS
01 任务一 认识蒸馏装置
在化工生产中,为了获得合格的产品(或中间产物)或者要 除去有害杂质,常需要对液体混合物进行分离提纯。
常用的分离方法有:蒸馏、萃取、蒸发和结晶等,其中蒸 馏是最常采用的一种分离方法。
蒸馏: 利用液体混合物中各组分间挥发度的差异,将各组分分 离的一种单元操作。将液体混合物部分气化并通过气液两 相间的质量传递来实现。
01 任务一 认识蒸馏装置
湿法发酵白酒的生产则通常需用蒸 馏塔进行蒸馏操作,其目的是将发酵后 的酿酒原料液蒸馏、提纯得到一定纯度 的白酒。发酵后的酿酒原料中乙醇含量 在10%左右,要求将其浓度进一步提高。
蒸馏ppt课件-PPT文档资料83页

4.1 温度–组成图(t – x – y图)
上曲线:平衡时汽相组
T
成与温度的关系,称为汽
相线(露点曲线);
t4
下曲线:平衡时液相组
t3
成与温度的关系,称为液 相线(泡点曲线)。
t2
两曲线将图分成三个区
t1
域:液相区、过热蒸汽区、
汽液共存区。
B
t-y
H
J
A
t-x
x1(y1) T---X(Y)
T—X—Y图 的作法
设备:包括精馏塔、塔底再沸器、塔反混顶冷凝器、原料预热器、
回流液泵等。
加料板:当某块塔板上的浓度与原料的浓度相近或相等时,
料液由此加入,该板称为加料板。
精馏段:加料板以上的部分,它起着回收原料中易挥发组分
增浓的作用。
提馏段:加料板以下的部分(包括加料板),它起着回收原
料中易挥发组分的作用。
X(Y)
二、多次部分气化和多次部分冷凝
Multi-partial gasification and condensing
T
从气相得到较纯的
易挥发组分;
从液相中则得到较
纯的难挥发组分 。
P=定值 B
A
xm
xF
yn
x(y)
y3
y3
(或xD)
y2
冷凝 器
y1 y1
xF
分离器 x1
x3 加热器 x2
精馏操作分为连续精馏和间歇精馏,流程如下图所示。
蒸汽
进 料 板 蒸汽
再沸器
进料
塔底产品
塔顶产品
冷却水
水蒸气
液体
冷凝水
连续精馏操作流程
全凝器
回流液
蒸馏-PPT(精)

塔板上的气液接触状态(增大接触面积)
鼓泡接触状态:当气速较低时,气体以鼓泡形 式通过液层。由于气泡的数量不多,形成的气 液混合物基本上以液体为主,此时塔板上存在 着大量的清液。因气泡占的比例较小,气液两 相接触的表面积不大,传质效率很低。
泡沫接触状态:当气速增加,缺泡数量集聚增 加,气泡不断的发生碰撞和破裂,此时板上液 体大部分以液膜的形式存在于气泡之间,形成 一些直径较小、扰动十分剧烈的动态泡沫,由 于泡沫接触的表面积大,并不断的更新,为两 相传质传热提供了良好的条件。
例题:某苯-甲苯混合液在45℃时沸腾, 外界压力为20.3kPa。此时PºA=22.7kPa; PºB=7.6, kPa试求其液相组成。
习题:某庚烷 –辛烷混合液在40℃时沸 腾,外界压力为101.3kPa。此时 PºA=122.7kPa; PºB=70.6, kPa试求其液 相组成。
三、相对挥发度:
当物系性质及塔板结构 已定时,塔的操作参数 即指气、液负荷。
负荷性能图即是将维持 塔的正常操作所允许的 气、液负荷范围的图示。
负荷性能图是由五条线围成,即漏液线、液体流 量下限线、液体流量上限线、液泛线和过量液沫 夹带线。由五条线所包围的区域为塔板的正常操 作区。塔的实际操作液气比应在此区域内。
挥发度——物质挥发的难易程度。用“ν”表示。
ALeabharlann PA xABPB xB
·相对挥发度——混合液中两组分挥发度之比称为该
两组分的相对挥发度,用α表示。
PAy/xAyAxB
PBy/xB yBxA
·用相对挥发度表 示的相平衡关系:
y x 1(1)x
y x 1(1)x
当α=1时,两组分在汽、液相中浓度相同,用普通精 馏是不能分离的;
第六章蒸馏PPT幻灯片课件

精馏段 L1 L2 Ln L 提馏段 L1 L2 Lm L
恒摩尔流的假定成立的条件: 各组分的摩尔汽化热相等 气液接触时因温度不同而交换的显热可以忽略 塔设备保温良好,热损失可忽略
22
二、物料衡算和操作线方程
1、全塔物料衡算
总物料 F D W
加热 苯和甲苯
苯(沸点低) 易挥发组分 冷凝
甲苯
难挥发组分
苯组成较高的产品
2
蒸馏在化工中的应用 原油蒸馏: 汽油、煤油、柴油及重油 混合芳烃蒸馏: 苯、甲苯及二甲苯 液态空气蒸馏: 液氧、液氮 2、特点 可直接得到所需产品 吸收、萃取等需外加其他组分 适用范围广,可分离液态、气态或固态混合物 蒸馏过程适用于各种浓度混合物的分离 操作耗能较大
yA
p
0 A
p
xA
k A 相平衡常数
y A k A x A 相平衡常数表示
的气液平衡关系
露点方程
yA
pA0 p
p
p
பைடு நூலகம்0 A
p
0 A
pB0
8
(3)以相对挥发度表示的气液平衡方程
挥发度
vA
pA xA
vB
pB xB
对于理想溶液,符合拉乌尔定律有
vA
p
0 A
vB
p
0 B
相对挥发度 易挥发组分的挥发度与难挥发组分的之比
4
二、两组分理想物系的气液平衡
1、气液平衡相图 温度—组成(t-x-y)图 饱和蒸气线t-y 饱和液体线t-x 液相区、过热蒸气区、气 液共存区
泡点温度 泡点线 露点温度 露点线
恒摩尔流的假定成立的条件: 各组分的摩尔汽化热相等 气液接触时因温度不同而交换的显热可以忽略 塔设备保温良好,热损失可忽略
22
二、物料衡算和操作线方程
1、全塔物料衡算
总物料 F D W
加热 苯和甲苯
苯(沸点低) 易挥发组分 冷凝
甲苯
难挥发组分
苯组成较高的产品
2
蒸馏在化工中的应用 原油蒸馏: 汽油、煤油、柴油及重油 混合芳烃蒸馏: 苯、甲苯及二甲苯 液态空气蒸馏: 液氧、液氮 2、特点 可直接得到所需产品 吸收、萃取等需外加其他组分 适用范围广,可分离液态、气态或固态混合物 蒸馏过程适用于各种浓度混合物的分离 操作耗能较大
yA
p
0 A
p
xA
k A 相平衡常数
y A k A x A 相平衡常数表示
的气液平衡关系
露点方程
yA
pA0 p
p
p
பைடு நூலகம்0 A
p
0 A
pB0
8
(3)以相对挥发度表示的气液平衡方程
挥发度
vA
pA xA
vB
pB xB
对于理想溶液,符合拉乌尔定律有
vA
p
0 A
vB
p
0 B
相对挥发度 易挥发组分的挥发度与难挥发组分的之比
4
二、两组分理想物系的气液平衡
1、气液平衡相图 温度—组成(t-x-y)图 饱和蒸气线t-y 饱和液体线t-x 液相区、过热蒸气区、气 液共存区
泡点温度 泡点线 露点温度 露点线
蒸馏课件

蒸馏
蒸馏:将液体部分气化,利用各组分挥发度的不同从 将液体部分气化,
而使混合物达到分离的单元操作。 而使混合物达到分离的单元操作。蒸馏是分离液相混 合物的典型单元操作。 合物的典型单元操作。
易挥发组分:沸点低的组分,又称为轻组分 沸点低的组分, 沸点低的组分 又称为轻组分。 难挥发组分:沸点高的组分,又称为重组分 沸点高的组分, 沸点高的组分 又称为重组分。
冷凝器
冷却水 原料液 蒸汽 蒸馏釜 收集 器
3.简单蒸馏的特点 3.简单蒸馏的特点
间歇操作 塔顶塔底组成不是 一对平衡组成 适合于混合物的粗 分离,特别适合于 沸点相差较大而分 离要求不高的场合, 例如原油或煤油的 初馏。
F,xF
W,x2
D, y
将一定组分的液体加热至泡点以上, 原理:将一定组分的液体加热至泡点以上,使 其部分气化,或者将一定组分的蒸汽冷却至露点以下, 其部分气化,或者将一定组分的蒸汽冷却至露点以下, 使其部分冷凝,两相达到平衡,然后将两相分离。 使其部分冷凝,两相达到平衡,然后将两相分离。此 过程的结果是易挥发组分在气相中富集, 过程的结果是易挥发组分在气相中富集,难挥发组分 在液相中富集。 在液相中富集。
根据道尔顿分压定律, 根据道尔顿分压定律,溶液上方的蒸汽总压为
P = pA + pB = p x + p (1 xA)
0 A A 0 B
P pB xA = 0 0 p A pB
0
(a) )
当总压P不高时,平衡的气相可视为理想气体,服从道尔 当总压 不高时,平衡的气相可视为理想气体, 不高时
顿分压定律,即
1.蒸馏分离的依据 1.蒸馏分离的依据
将液体混合物部分气化,利用其中各组分挥发度不同 的特性而达到分离目的的单元操作。 这种分离操作是通过液相和气相间的质量传递来实现 的。例如:加热苯的。例如:加热苯-甲苯的混合液,使之部分气化, 由于苯的沸点(353K)较甲苯的沸点(383K) 由于苯的沸点(353K)较甲苯的沸点(383K)低,即其 挥发度比甲苯的高,故苯较甲苯易于从液相中气化出 来。若将气化的蒸汽全部冷凝,即可得到苯组成高于 原料的产品,从而使苯和甲苯得以分离。 将沸点低的组分称为易挥发组分或轻组分, 表示。 将沸点低的组分称为易挥发组分或轻组分,用A表示。 将沸点高的组分称为难挥发组分或重组分, 表示。 将沸点高的组分称为难挥发组分或重组分,用B表示。 则混合液:A+B 则混合液:A+B
蒸馏:将液体部分气化,利用各组分挥发度的不同从 将液体部分气化,
而使混合物达到分离的单元操作。 而使混合物达到分离的单元操作。蒸馏是分离液相混 合物的典型单元操作。 合物的典型单元操作。
易挥发组分:沸点低的组分,又称为轻组分 沸点低的组分, 沸点低的组分 又称为轻组分。 难挥发组分:沸点高的组分,又称为重组分 沸点高的组分, 沸点高的组分 又称为重组分。
冷凝器
冷却水 原料液 蒸汽 蒸馏釜 收集 器
3.简单蒸馏的特点 3.简单蒸馏的特点
间歇操作 塔顶塔底组成不是 一对平衡组成 适合于混合物的粗 分离,特别适合于 沸点相差较大而分 离要求不高的场合, 例如原油或煤油的 初馏。
F,xF
W,x2
D, y
将一定组分的液体加热至泡点以上, 原理:将一定组分的液体加热至泡点以上,使 其部分气化,或者将一定组分的蒸汽冷却至露点以下, 其部分气化,或者将一定组分的蒸汽冷却至露点以下, 使其部分冷凝,两相达到平衡,然后将两相分离。 使其部分冷凝,两相达到平衡,然后将两相分离。此 过程的结果是易挥发组分在气相中富集, 过程的结果是易挥发组分在气相中富集,难挥发组分 在液相中富集。 在液相中富集。
根据道尔顿分压定律, 根据道尔顿分压定律,溶液上方的蒸汽总压为
P = pA + pB = p x + p (1 xA)
0 A A 0 B
P pB xA = 0 0 p A pB
0
(a) )
当总压P不高时,平衡的气相可视为理想气体,服从道尔 当总压 不高时,平衡的气相可视为理想气体, 不高时
顿分压定律,即
1.蒸馏分离的依据 1.蒸馏分离的依据
将液体混合物部分气化,利用其中各组分挥发度不同 的特性而达到分离目的的单元操作。 这种分离操作是通过液相和气相间的质量传递来实现 的。例如:加热苯的。例如:加热苯-甲苯的混合液,使之部分气化, 由于苯的沸点(353K)较甲苯的沸点(383K) 由于苯的沸点(353K)较甲苯的沸点(383K)低,即其 挥发度比甲苯的高,故苯较甲苯易于从液相中气化出 来。若将气化的蒸汽全部冷凝,即可得到苯组成高于 原料的产品,从而使苯和甲苯得以分离。 将沸点低的组分称为易挥发组分或轻组分, 表示。 将沸点低的组分称为易挥发组分或轻组分,用A表示。 将沸点高的组分称为难挥发组分或重组分, 表示。 将沸点高的组分称为难挥发组分或重组分,用B表示。 则混合液:A+B 则混合液:A+B
高等制药分离工程中国药科大学-课件蒸馏技术

2.萃取精馏
萃取精馏:在精馏过程中,从塔上部加 入萃取剂,以增加原溶液中组分间的相对 挥发度,从而实现分离。 在加入第三组分(萃取剂 )于溶液中, 使组分间的活度系数和相对挥发度发生变 化,由热力学原理得:
12 s
( r1 / r2 ) s 12 ( r1 / r2 )
萃取精馏流程以乙二醇为萃取剂分离乙 醇~水溶液为例。
11.2 水蒸汽蒸馏
过热水蒸汽蒸馏时,水蒸汽不冷凝,釜内 无水层。此时而随通入水蒸汽量而改变, 0 p P p 即 ,当确定了釜内压力和温度 S S 后,水蒸汽量为:
0 ( P pS )M S GS G A p0 AM A
水蒸汽蒸馏适用于某些中草药成分的提纯 (香油)、不易过滤的液固体系分离和易 爆炸体系的分离。 缺点:消耗大量的热,以使水和高沸点组 分一起汽化。
11.2 水蒸汽蒸馏
进行饱和水蒸汽蒸馏时,蒸馏物与水不 相溶,则水蒸汽的用量可根据分压定律来 计算。
0 GS / M S yS pS ps 0 GA / M A y A p A p A
0 pS MS GS G A 0 pAM A
G S 所需蒸汽的最小理论用量,实际用量还
需除以饱和系数φ (=0.6-0.8)。 A物质的蒸汽压越小,分子量越小,则 水蒸汽消耗量越多。
精馏式间歇精馏
间歇精馏装置流程
l一塔釜; 2一精馏塔; 3一冷凝器; 4一捕集器; 5一中间馏 分罐; 6,7一产品 罐
间歇精馏装置流程
提馏式间歇精馏
二、分离的主要影响因素 主要因素:相对挥发度、设备参数(理论塔 板数、持液量)和操作参数(塔压、回 流比、蒸发速率)。 1.相对挥发度α α 是反映混合物分离难易程度的物性参数。 yi y j KI ij /( ) xi x j Kj 相对挥发度与1 的差距越大,混合物的分离 越容易。
蒸馏PPT课件

水蒸汽蒸馏应用于: 1)分离其中仅有一个组份能 同水蒸汽挥发的混合物; 2)纯化物质,以去掉树脂状 杂质; 3)如果它能比减压蒸馏更完 全地把挥发性物质分开。
在100℃时蒸汽压小的高沸点 物质用过热水蒸汽蒸馏。
连续水蒸汽蒸馏及少量物质的蒸馏
分子蒸馏
在实验室中常常需要纯化在 沸点分解而又不能用提取、 结晶、层析来纯化的高沸点 物质。用分子蒸馏可以达到 达个目的,此时物质的沸点 降低200—300℃。分子蒸馏 是减压蒸馏的一种变种,它 在压力不高于0.001毫米汞柱 的条件下进行。
(3).蒸馏是通过对混合物加热建立汽液两相体系的,汽相还需要再冷 凝液化,因此需要消耗大量的能量(包括加热介质和冷却介质)。另外, 加压或减压,将消耗额外的能量。蒸馏过程中的节能是个值得重视的问 题。
蒸馏操作的分类
1、按蒸馏方式可分为平衡(闪蒸)蒸馏、简单蒸馏、精馏和特殊精馏 平衡蒸馏和简单蒸馏常用于混合物中各组分的挥发度相差较大,对分 离要求又不高的场合; 精馏是借助回流技术来实现高纯度和高回收率的分离操作,它是应用 最广泛的蒸馏方式。如果混合物中各组分的挥发度相差很小(相对挥发度 接近于1)或形成恒沸液时,则应采用特殊精馏(恒沸精馏和萃取精馏)。 若精馏时混合液组分间发生化学反应,称反应精馏,这是将化学反应 与分离操作耦合的新型操作过程。 对于含有高沸点杂质的混合液,若它与水互不相溶,可采用水蒸气蒸 馏,从而降低操作温度。 对于热敏性混合液,则可采用高真空下操作的分子蒸馏。
仪器的效率由三个因素决定: (1) 装置中的压力 (0.001~0.0001mmHg, (2) 冷却面到蒸发面的距离 (1~2cm) , (3) 待蒸馏物层的厚度。
恒沸精馏和萃取精馏的比较
共同点: (1)都加入另一组分。 (2)使相对挥发度增大。 (3)计算过程所用的基本关系式都是物料衡算、热量衡算和相平衡关系。 不同点: (1)恒沸精馏塔形成恒沸物,从塔顶蒸出。 (2)萃取精馏不形成恒沸物,从塔釜离开。
在100℃时蒸汽压小的高沸点 物质用过热水蒸汽蒸馏。
连续水蒸汽蒸馏及少量物质的蒸馏
分子蒸馏
在实验室中常常需要纯化在 沸点分解而又不能用提取、 结晶、层析来纯化的高沸点 物质。用分子蒸馏可以达到 达个目的,此时物质的沸点 降低200—300℃。分子蒸馏 是减压蒸馏的一种变种,它 在压力不高于0.001毫米汞柱 的条件下进行。
(3).蒸馏是通过对混合物加热建立汽液两相体系的,汽相还需要再冷 凝液化,因此需要消耗大量的能量(包括加热介质和冷却介质)。另外, 加压或减压,将消耗额外的能量。蒸馏过程中的节能是个值得重视的问 题。
蒸馏操作的分类
1、按蒸馏方式可分为平衡(闪蒸)蒸馏、简单蒸馏、精馏和特殊精馏 平衡蒸馏和简单蒸馏常用于混合物中各组分的挥发度相差较大,对分 离要求又不高的场合; 精馏是借助回流技术来实现高纯度和高回收率的分离操作,它是应用 最广泛的蒸馏方式。如果混合物中各组分的挥发度相差很小(相对挥发度 接近于1)或形成恒沸液时,则应采用特殊精馏(恒沸精馏和萃取精馏)。 若精馏时混合液组分间发生化学反应,称反应精馏,这是将化学反应 与分离操作耦合的新型操作过程。 对于含有高沸点杂质的混合液,若它与水互不相溶,可采用水蒸气蒸 馏,从而降低操作温度。 对于热敏性混合液,则可采用高真空下操作的分子蒸馏。
仪器的效率由三个因素决定: (1) 装置中的压力 (0.001~0.0001mmHg, (2) 冷却面到蒸发面的距离 (1~2cm) , (3) 待蒸馏物层的厚度。
恒沸精馏和萃取精馏的比较
共同点: (1)都加入另一组分。 (2)使相对挥发度增大。 (3)计算过程所用的基本关系式都是物料衡算、热量衡算和相平衡关系。 不同点: (1)恒沸精馏塔形成恒沸物,从塔顶蒸出。 (2)萃取精馏不形成恒沸物,从塔釜离开。
六章节蒸馏-PPT精选.ppt

logpo A B t C
07级制药工程《化工原理》
11
二、拉乌尔定律 Raoult’s law
拉乌尔定律:在一定温度下,溶液上方某组分的平衡 分压等于此组分在该温度下的饱和蒸汽压乘以其在溶
液中的摩尔分率。 即 pA = p0AxA
理想溶液:在全部浓度范围内都符合拉乌尔定律。在 这种溶液内,组分A、B分子间作用力与纯组分A的分 子间作用力或纯组分B的分子间作用力相等。
第六章 蒸馏
07级制药工程《化工原理》
1
概述
1. 蒸馏在工业上的应用 1)石油炼制工业 (原油 汽油、煤油、柴油等); 2)石油化工工业(基本有机原料、石油裂解气等分 离); 3)空气的分离(氧气、氮气的制备); 4)食品加工及医药生产。
精馏装置
07级制药工程《化工原理》
4
2. 蒸馏的目的和依据
17
(二)理想溶液的t-x-y关系式
1、温度(泡点)-液相组成关系式
理想溶液服从拉乌尔定律,在一定温度下,汽液相
达到平衡时,气相中组分A、B的分压: pA 、pB 与液相组成xA,xB的关系分别为:
pA= pAo . xA pB=pBo .xB
由道尔顿分压定律:
p = pA + pB pA = pAoxA = pAox
示混合物的平衡温度t与液相组成x之间的关系,称为饱和液体线(液相线) (泡点线)。
3个区域:液相区:代表未沸腾液体;过热蒸汽区:代表过热蒸汽;汽 液共存区:代表汽液同时存在。
2个端点:tA、tB代表纯A、07级纯制B药工组程分《化的工原沸理点》 。
14
t/C
气相区
露点
两相区
露点线
S
V
L
07级制药工程《化工原理》
11
二、拉乌尔定律 Raoult’s law
拉乌尔定律:在一定温度下,溶液上方某组分的平衡 分压等于此组分在该温度下的饱和蒸汽压乘以其在溶
液中的摩尔分率。 即 pA = p0AxA
理想溶液:在全部浓度范围内都符合拉乌尔定律。在 这种溶液内,组分A、B分子间作用力与纯组分A的分 子间作用力或纯组分B的分子间作用力相等。
第六章 蒸馏
07级制药工程《化工原理》
1
概述
1. 蒸馏在工业上的应用 1)石油炼制工业 (原油 汽油、煤油、柴油等); 2)石油化工工业(基本有机原料、石油裂解气等分 离); 3)空气的分离(氧气、氮气的制备); 4)食品加工及医药生产。
精馏装置
07级制药工程《化工原理》
4
2. 蒸馏的目的和依据
17
(二)理想溶液的t-x-y关系式
1、温度(泡点)-液相组成关系式
理想溶液服从拉乌尔定律,在一定温度下,汽液相
达到平衡时,气相中组分A、B的分压: pA 、pB 与液相组成xA,xB的关系分别为:
pA= pAo . xA pB=pBo .xB
由道尔顿分压定律:
p = pA + pB pA = pAoxA = pAox
示混合物的平衡温度t与液相组成x之间的关系,称为饱和液体线(液相线) (泡点线)。
3个区域:液相区:代表未沸腾液体;过热蒸汽区:代表过热蒸汽;汽 液共存区:代表汽液同时存在。
2个端点:tA、tB代表纯A、07级纯制B药工组程分《化的工原沸理点》 。
14
t/C
气相区
露点
两相区
露点线
S
V
L
第十章---蒸馏PPT课件

馏出液总量 V = L0 - L = 100-62 = 38mol 设馏出液中组分A的摩尔分数为ym , 作整个蒸馏过程组分A的物料衡算: L0x0 = Lx+Vym
y m L 0 x 0 V L x1 0 0 ..5 0 3 0 6 8 2 0 .2 8 0 .818 6
3.水蒸气蒸馏
ppwpA
(a)0.69,(b)0.88, (c) 0.92,(d)0.94。
.
27
10.3C 提馏段的物料衡算
LVW
LxmVym1WWx
提馏段操作线方程式:
ym1L'L W ' xmLW 'WxW
.
28
10-4 进料状态对精馏的影响
10.4A 进料热状态
1. 进料热状态参数 假设进料为汽液混合物, 每1mol进料中液相为qmol ,
轻组分 汽液两相单共存区
汽相线 汽相单相区
.
7
(2)定p下的T-x图 双组分体系
泡点(bubble point)
汽相单相区 露点
汽相线
露点(dew point)
汽液两相 平衡共存区。
泡点
液相线
液相单相区
.
8
(2)定p下的T-x图 双组分体系
恒沸物
恒沸物
最低恒沸点
.
最高恒沸点
9
(3)定p下的y-x图
.
43
,求 q 值:q H V H F V h c p ( T b T F ) 3 .1 2 0 .1 5 ( 3 9 6 3) 7 2 1 .2 8
H V H L V h
3 .1 2
q 1.20 6.00 q1 1.201
从对角线上y = x = xF = 0.45 的点作斜率为6.00 的直线,即为 q 线, 与精馏段操作线交于点d 。
y m L 0 x 0 V L x1 0 0 ..5 0 3 0 6 8 2 0 .2 8 0 .818 6
3.水蒸气蒸馏
ppwpA
(a)0.69,(b)0.88, (c) 0.92,(d)0.94。
.
27
10.3C 提馏段的物料衡算
LVW
LxmVym1WWx
提馏段操作线方程式:
ym1L'L W ' xmLW 'WxW
.
28
10-4 进料状态对精馏的影响
10.4A 进料热状态
1. 进料热状态参数 假设进料为汽液混合物, 每1mol进料中液相为qmol ,
轻组分 汽液两相单共存区
汽相线 汽相单相区
.
7
(2)定p下的T-x图 双组分体系
泡点(bubble point)
汽相单相区 露点
汽相线
露点(dew point)
汽液两相 平衡共存区。
泡点
液相线
液相单相区
.
8
(2)定p下的T-x图 双组分体系
恒沸物
恒沸物
最低恒沸点
.
最高恒沸点
9
(3)定p下的y-x图
.
43
,求 q 值:q H V H F V h c p ( T b T F ) 3 .1 2 0 .1 5 ( 3 9 6 3) 7 2 1 .2 8
H V H L V h
3 .1 2
q 1.20 6.00 q1 1.201
从对角线上y = x = xF = 0.45 的点作斜率为6.00 的直线,即为 q 线, 与精馏段操作线交于点d 。
蒸馏和萃取ppt5 人教课标版优质课件
体呈( 橙 )色,下层液体呈 无或颜色变浅 。
3、CCl4能把碘酒中的碘萃取出来吗?
不能,酒精与CCl4混溶
4. 用于分离或提纯物质的已学方法有:
A.萃取
B.分液
C.过滤
D.加热分解 E.蒸发
F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法
最合适?(把选用方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒 (C)
固体物质
蒸 获得溶液中 发 的溶质(分
离溶剂和溶 质)
装置
举例
除去氯化钠溶 液中的泥沙 注意事项: “一贴二低三 靠” 蒸发食盐溶液 获得食盐晶体 注意事项
方 适用范围 法
蒸 分离沸点不 馏 同而又相溶
的液态混合 物(分离固 液混合物)
萃 溶质在两种 取 互不相溶的
溶剂里溶解 度的不同
装置
举例
分离乙醇和水 的混合物;用 自来水制取蒸 馏水 注意事项
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
5 、再苦再累,只要坚持往前走,属于你的风景终会出现;只要是自己选择的,那就无怨无悔,青春一经典当,永远无法赎回;过去只可以用来回忆,别沉迷在它的阴影中,否则永远看不清前面的 路;不要期望所有人都懂你,你也没必要去懂所有人;聚散离合是人生的规律,无须伤春悲秋。 10 、面对问题,我们不能退缩,因为退缩并不能解决问题。只有努力寻求解决之道,才是上策。 1 、世上诸般美好事物中,有两者最公平,那就是青春与梦想,它不分尊卑,人人都可享有。 13 、时间是宝贵的,抓住了时间就抓住了成功。 4 、人生会遇到很多障碍,这些障碍就像阻挡我们的布帘子,我们要勇敢地掀起它。 5 、每个人在成功之初都会遇到各种困难。但失败是成功之母,只有经历失败的洗礼,才能有丰富的成功。要珍惜每个人的态度,再平凡的人也有自己的主见,也会决定你的质量。 12 、只要不让年轻时美丽的梦想随岁月飘逝,成功总有一天会出现在你的面前。 9 、善于把握事物的规律,掌握事物的正确动向,你就会事半功倍,而后取得最后的成功。 12 、俗话说得好:树挪死,人挪活。在现代激烈竞争社会,铁饭碗不复存在,一个人很少可能在同一个单位终其一生。所以多交一些朋友很有必要。 2 、拼一载春秋,搏一生无悔。 2 、把汗水变成珍珠,把梦想变成现实! 9 、祸兮福之所倚,福兮祸之所伏。孰知其极?其无正也。正复为奇,善复为妖。人之迷,其日固久。 20 、你要求的次数越多,你就越容易得到你想要的东西,而且也会享受到更多的乐趣。 9 、有时,成功就在我们眼前,但却被我们所忽略,以致最终地丧失。把握眼前,坚持做好每件事,那么,成功将会离我们越来越近。 4 、只有一条路不能选择——那就是放弃的路;只有一条路不能拒绝——那就是成长的路。 13 、我心飞翔,路在脚下。 5 、在你往上爬的时候,一定要保持梯子的整洁,否则你下来时可能会滑倒。 4 、为理想,早起三更,读迎晨曦,磨枪挫剑,不惧兵临城下! 6 、经过奋斗,终于拨开了云雾,见到了日出,走上了阳光大道。面对取得的成绩,不要骄傲,再接再励,继续向前行。
3、CCl4能把碘酒中的碘萃取出来吗?
不能,酒精与CCl4混溶
4. 用于分离或提纯物质的已学方法有:
A.萃取
B.分液
C.过滤
D.加热分解 E.蒸发
F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法
最合适?(把选用方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒 (C)
固体物质
蒸 获得溶液中 发 的溶质(分
离溶剂和溶 质)
装置
举例
除去氯化钠溶 液中的泥沙 注意事项: “一贴二低三 靠” 蒸发食盐溶液 获得食盐晶体 注意事项
方 适用范围 法
蒸 分离沸点不 馏 同而又相溶
的液态混合 物(分离固 液混合物)
萃 溶质在两种 取 互不相溶的
溶剂里溶解 度的不同
装置
举例
分离乙醇和水 的混合物;用 自来水制取蒸 馏水 注意事项
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
5 、再苦再累,只要坚持往前走,属于你的风景终会出现;只要是自己选择的,那就无怨无悔,青春一经典当,永远无法赎回;过去只可以用来回忆,别沉迷在它的阴影中,否则永远看不清前面的 路;不要期望所有人都懂你,你也没必要去懂所有人;聚散离合是人生的规律,无须伤春悲秋。 10 、面对问题,我们不能退缩,因为退缩并不能解决问题。只有努力寻求解决之道,才是上策。 1 、世上诸般美好事物中,有两者最公平,那就是青春与梦想,它不分尊卑,人人都可享有。 13 、时间是宝贵的,抓住了时间就抓住了成功。 4 、人生会遇到很多障碍,这些障碍就像阻挡我们的布帘子,我们要勇敢地掀起它。 5 、每个人在成功之初都会遇到各种困难。但失败是成功之母,只有经历失败的洗礼,才能有丰富的成功。要珍惜每个人的态度,再平凡的人也有自己的主见,也会决定你的质量。 12 、只要不让年轻时美丽的梦想随岁月飘逝,成功总有一天会出现在你的面前。 9 、善于把握事物的规律,掌握事物的正确动向,你就会事半功倍,而后取得最后的成功。 12 、俗话说得好:树挪死,人挪活。在现代激烈竞争社会,铁饭碗不复存在,一个人很少可能在同一个单位终其一生。所以多交一些朋友很有必要。 2 、拼一载春秋,搏一生无悔。 2 、把汗水变成珍珠,把梦想变成现实! 9 、祸兮福之所倚,福兮祸之所伏。孰知其极?其无正也。正复为奇,善复为妖。人之迷,其日固久。 20 、你要求的次数越多,你就越容易得到你想要的东西,而且也会享受到更多的乐趣。 9 、有时,成功就在我们眼前,但却被我们所忽略,以致最终地丧失。把握眼前,坚持做好每件事,那么,成功将会离我们越来越近。 4 、只有一条路不能选择——那就是放弃的路;只有一条路不能拒绝——那就是成长的路。 13 、我心飞翔,路在脚下。 5 、在你往上爬的时候,一定要保持梯子的整洁,否则你下来时可能会滑倒。 4 、为理想,早起三更,读迎晨曦,磨枪挫剑,不惧兵临城下! 6 、经过奋斗,终于拨开了云雾,见到了日出,走上了阳光大道。面对取得的成绩,不要骄傲,再接再励,继续向前行。
第七章 蒸馏技术 制药单元操作技术(教学课件)

•
第七章 蒸馏技术
第一节 蒸馏的主要任务 一、蒸馏及其在制药生产中的应用
蒸馏是分离均相物系最常用的方法和典型的单元操作之一,广泛地应用于化工、石 油、医药、食品、冶金及环保等领域
蒸馏——利用完全互溶的液体混合物中各组分沸点的差别(或挥发性的差别)实现
组分的分离与提纯的一种操作。
挥发性高的组分,即沸点较低的组分(称为易挥发组分或轻组分) 挥发性低的组分,即沸点较高的组分(称为难挥发组分或重组分)
pyB xB yB xB
或
yA xA
yB
xB
yA xA
1 yA 1xA
略去下标A,整理得:
y x 1( 1)x
即为汽液相平衡方程。
10
• 讨论:(1)对于理想溶液,则:
p
0 A
p
0 B
p
0 A
p
0 B
随温度而变化,而两者的比值变化不大。
当操作温度不很大时,相对挥发度近似为一常数。
通常 均 顶釜
均
顶
釜
2
(2)相对挥发度表示溶液分离的难易程度。
若 1, y=x,用普通蒸馏方法无法分离;
若 1 , y>x,易分离;
若
1, B组分为易挥发组分,A组分为难挥发组分。
11
• 一、简单蒸馏
第三节 简单蒸馏和精馏
简单蒸馏:使混合液在蒸馏釜中逐渐汽化,并不断将生成的蒸汽移出在冷凝器内冷 凝,使混合液中的组分部分分离的过程。
t-x-y图的应用: (1)确定温度—组成间的关系 (2)分析蒸馏及精馏原理
7
• 2.汽-液相组成图(y—x图) y—x图的绘制: 已知条件:操作总压、平衡数据。
步骤:(1)建立坐标系,作出y=x的对角线。
第七章 蒸馏技术
第一节 蒸馏的主要任务 一、蒸馏及其在制药生产中的应用
蒸馏是分离均相物系最常用的方法和典型的单元操作之一,广泛地应用于化工、石 油、医药、食品、冶金及环保等领域
蒸馏——利用完全互溶的液体混合物中各组分沸点的差别(或挥发性的差别)实现
组分的分离与提纯的一种操作。
挥发性高的组分,即沸点较低的组分(称为易挥发组分或轻组分) 挥发性低的组分,即沸点较高的组分(称为难挥发组分或重组分)
pyB xB yB xB
或
yA xA
yB
xB
yA xA
1 yA 1xA
略去下标A,整理得:
y x 1( 1)x
即为汽液相平衡方程。
10
• 讨论:(1)对于理想溶液,则:
p
0 A
p
0 B
p
0 A
p
0 B
随温度而变化,而两者的比值变化不大。
当操作温度不很大时,相对挥发度近似为一常数。
通常 均 顶釜
均
顶
釜
2
(2)相对挥发度表示溶液分离的难易程度。
若 1, y=x,用普通蒸馏方法无法分离;
若 1 , y>x,易分离;
若
1, B组分为易挥发组分,A组分为难挥发组分。
11
• 一、简单蒸馏
第三节 简单蒸馏和精馏
简单蒸馏:使混合液在蒸馏釜中逐渐汽化,并不断将生成的蒸汽移出在冷凝器内冷 凝,使混合液中的组分部分分离的过程。
t-x-y图的应用: (1)确定温度—组成间的关系 (2)分析蒸馏及精馏原理
7
• 2.汽-液相组成图(y—x图) y—x图的绘制: 已知条件:操作总压、平衡数据。
步骤:(1)建立坐标系,作出y=x的对角线。
制药化工原理课件2012-第08章 蒸馏

一. 溶液的蒸气压及拉乌尔定律
4. 拉乌尔定律( Raoult's law )
在一定温度下,理想溶液的气液相平衡关系服从拉乌尔定律,即某组分蒸 气压等于纯组分的饱和蒸气压乘以该组分的摩尔分数。对二元理想物系:
沸点、泡点、露点的概念
沸点:纯物质液态的蒸气压等于某一外界压力时的温度,称 为沸点,即沸腾温度。纯物质从开始沸腾到全部气化, 温度不变。 泡点:液相混合物在某一外界压力下开始沸腾时的温度 泡点:液相混合物在某 外界压力下开始沸腾时的温度,称 称 为泡点。液相混合物从开始沸腾到全部气化,温度不断 变化。 露点:气相混合物在某一外界压力下开始冷凝时的温度,称 为露点。气相混合物从开始冷凝到全部液化,温度不断
制药化工原理 第八章 蒸馏 7/156
一. 溶液的蒸气压及拉乌尔定律
3.道尔顿分压定律 (Dolton Partial pressure law)
A ↑↓
pA0
B ↑↓
pB0
pA+pB ↑↓
A
t
B
t
A+B
t
理想气体混合物中某一组分A的分压等于该组分单独存在于混 合气体的温度 T及总体积 V的条件下所具有的压力,即混合气 体的总压等于各组分单独存在于混合气体的温度、体积条件下 产生压力的总和。
制药化工原理
常压蒸馏:在常压下进行 3. 根据操作压力的高低: 加压蒸馏:常压为气相的物系分离 减压蒸馏:高沸点、热敏性物系分离 简单蒸馏:易分离,要求不高的物系 4. 根据操作方式: 平衡蒸馏:易分离,要求不高的物系 精馏:难分离,要求高的物系 特殊精馏:普通精馏不能分离物系
第八章 蒸馏 5/156
xA x
o P pB o po A pB
蒸馏和萃取的课件ppt

水煮西红柿汤
有油西红柿汤
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
水煮西红柿汤
加入油
有油西红柿汤
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
意事项。
一、蒸馏 1.原理
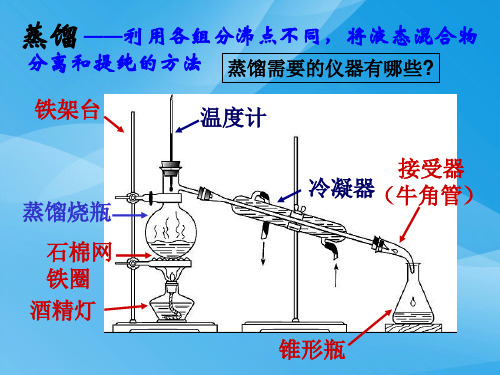
利用混合物中各组分的 沸点不同,除去液态混合物中易挥 发、 难挥发 或 不挥发的杂质的方法。(蒸发、冷凝) 2.制取蒸馏水 (1)仪器及装置图
圆底烧瓶 石棉网
铁架台 酒精灯
冷凝管 牛角管 锥形瓶
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
注入酒精后 (是/否)分层。
注入酒 精后不 分层,不 是萃取
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
实验
实验1:试管中注入约2 mL
碘水,再注入约1 mLCCl4, 振荡
实验2:试管中注入约2 mL
I2的CCl4溶液,再注入约1 mL水,振荡
实验过程
2. 把10毫升碘水和4毫升 CCl4加入分液漏斗中, 并盖好玻璃塞。
3.用右手压住分液漏斗口部, 左手握住活塞部分,把分液 漏斗倒转过来振荡;振荡后 打开活塞,使漏斗内气体放 出。
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
讨论
液体分层且 油层在上方
有油西红柿汤
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
水煮西红柿汤
加入油
有油西红柿汤
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
意事项。
一、蒸馏 1.原理
利用混合物中各组分的 沸点不同,除去液态混合物中易挥 发、 难挥发 或 不挥发的杂质的方法。(蒸发、冷凝) 2.制取蒸馏水 (1)仪器及装置图
圆底烧瓶 石棉网
铁架台 酒精灯
冷凝管 牛角管 锥形瓶
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
注入酒精后 (是/否)分层。
注入酒 精后不 分层,不 是萃取
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
实验
实验1:试管中注入约2 mL
碘水,再注入约1 mLCCl4, 振荡
实验2:试管中注入约2 mL
I2的CCl4溶液,再注入约1 mL水,振荡
实验过程
2. 把10毫升碘水和4毫升 CCl4加入分液漏斗中, 并盖好玻璃塞。
3.用右手压住分液漏斗口部, 左手握住活塞部分,把分液 漏斗倒转过来振荡;振荡后 打开活塞,使漏斗内气体放 出。
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
讨论
液体分层且 油层在上方
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pB
p
0 B
x
B
p B0
1 xA
4
•
A表示易挥发组分,
B表示难挥发组分;
x 表示液相组成,
y 表示汽相组成。
根据道尔顿分压定律可得溶液上方汽相总压为:
p
pA
pB
p
0 A
x
A
pB0 (1
xA)
xA
p pB0
p
0 A
p
0 B
yA
p
0 A
x
A
p
二、双组分理想溶液的汽液平衡相图
1.温度-组成( t x )y图
t-x-y图的应用: (1)确定温度—组成间的关系 (2)分析蒸馏及精馏原理
7
• 2.汽-液相组成图(y—x图) y—x图的绘制: 已知条件:操作总压、平衡数据。
步骤:(1)建立坐标系,作出y=x的对角线。
(2)由xA f (t) yA f (t) 将x和y对应点描点连线。
y—x图的讨论 (1)y>x,故y—x曲线在对角线之上 (2)互成平衡的气液组成点落在y—x曲线上 (3)操作压力越大,y—x曲线越靠近对角线,
原理:混合液逐渐受热汽化,蒸汽不断引出。 其特点:间歇操作,产品浓度不稳定。
原料液 蒸气
冷凝器 y
x
图7-5 简单蒸馏流程
t/C
露点线 M’
M 泡点线
0
xA
yA
1.0
x(y) 图 7-6 简单蒸馏原理
12
• 二、精馏原理
液体多次部分汽化同时进行汽体多次部分冷凝。
将液体混合物进行多次部分汽化,在液相 中可获得高纯度的难挥发组分。
理想溶液:分子之间作用力相等;混合前后体积不变;无混合热效应(混合前后总
焓值不变)。
。Байду номын сангаас
拉乌尔定律:对于完全互溶的理想溶液,在一定的温度下当汽液两相达到平衡时,
溶液上方汽相中任意组分的分压 p 等于此纯组分在该温度下的饱和蒸汽压 p 0 乘
x 以其在液相中的摩尔分数
A组分:
pA
p
0 A
x
A
即:
B组分:
•
第七章 蒸馏技术
第一节 蒸馏的主要任务 一、蒸馏及其在制药生产中的应用
蒸馏是分离均相物系最常用的方法和典型的单元操作之一,广泛地应用于化工、石 油、医药、食品、冶金及环保等领域
蒸馏——利用完全互溶的液体混合物中各组分沸点的差别(或挥发性的差别)实现
组分的分离与提纯的一种操作。
挥发性高的组分,即沸点较低的组分(称为易挥发组分或轻组分) 挥发性低的组分,即沸点较高的组分(称为难挥发组分或重组分)
分离越难进行
(4)x-y曲线上各点具有不同的温度 ,
y—x图的应用:图解理论塔板数目。
右上方温度低,左下方温度高
8
• 三、相对挥发度
挥发度:表示溶液挥发的难易程度。
可以用气相中的某一组分的分压和与之平衡的液相中的摩尔分数之比来表示,即:
vA
pA xA
vB
pB xB
讨论:(1)分压↑液相中的摩尔分数↓,则挥发度↑
液相为分散相,汽相为连续相 板式塔的结构如图7-2所示。 塔板是板式塔的核心,在塔板上,汽液两相密切接触,进行热量和质量的交换。
3
• 在正常操作下,液相为连续相,汽相为分散相。
液体靠重力自上而下流动;气体靠压力自下而上流动。
气液相逆流,传质及传热的推动力较大。
第二节 两组分溶液的汽液相平衡关系
一、理想溶液的汽液相平衡关系——拉乌尔定律
5
• t-x-y图的绘制(苯—甲苯) 已知条件:操作总压、平衡数据
步骤:(1)建立坐标系,确定纯组分沸点tA、tB
(2)确定t-x对应关系。
xA
p pB0
p
0 A
p
0 B
描点连线得 t x
曲线
(3)确定t-
y对应关系。
yA
p
0 A
x
A
p
描点连线得 t y 曲线
t-x-y图的构成:
气相线(露点线)t y 曲线;
均
顶
釜
2
(2)相对挥发度表示溶液分离的难易程度。
若 1, y=x,用普通蒸馏方法无法分离;
若 1 , y>x,易分离;
若 1 , B组分为易挥发组分,A组分为难挥发组分。
11
• 一、简单蒸馏
第三节 简单蒸馏和精馏
简单蒸馏:使混合液在蒸馏釜中逐渐汽化,并不断将生成的蒸汽移出在冷凝器内冷 凝,使混合液中的组分部分分离的过程。
蒸发:(1)溶质不具有挥发性,只有溶剂具有挥发性;
(2)通常浓缩液为产品; (3)传热过程 蒸馏:(1)各组分均具有挥发性; (2)通常冷凝液和残留液均为产品; (3)传质过程 二、汽液传质设备的分类 汽液传质设备的形式多样,用的最多的是板式塔和填料塔。 填料塔的结构如图7-1所示。 填料塔中气液两相在填料层内进行接触传质。在正常情况下,
pyB xB yB xB
或
yA xA
yB
xB
yA xA
1 yA 1 xA
略去下标A,整理得:
y x 1 ( 1)x
即为汽液相平衡方程。
10
• 讨论:(1)对于理想溶液,则:
p
0 A
p
0 B
p
0 A
p
0 B
随温度而变化,而两者的比值变化不大。
当操作温度不很大时,相对挥发度近似为一常数。
通常 均 顶 釜
(2)若为纯组分液体,v A p 0 A vB p 0 B v f (t) 挥发度随温度而变化。
相对挥发度:溶液中易挥发组分的挥发度与难挥发组分的挥发度之比,以 AB
表示。常省略下标用 表示。
则:
vA pA xA
vB pB xB
9
• 若操作压力 P 不高, 根据道尔顿分压定律
pyA xA yA xA
两条线:
液相线(泡点线)t x 曲线
液相区 三个区域: 气—液共存区
气相区
6
• t-x-y图的讨论: (1)互成平衡的汽液组成点在同一条等温线上; (2)在某一温度下,汽液达到平衡时,y>x,汽相线始终在液相线之上; (3)混合液沸点介于tA和tB之间; (4)在两相区内,温度升高液相中A组分浓度减小,温度降低汽相中A组分浓度提高; (5)平衡的汽液两相的量满足杠杆规则; (6)只有在两相区才能对混合液实行有效的分离; (7)压力对t—x—y图的影响:压力增大,温度升高,曲线上移,且两相区变窄。
汽相混合物经多次部分冷凝后,在汽相中 可获得高纯度的易挥发组分。
三、精馏装置及精馏操作流程 如图7-8所示 精馏装置的构成:
精馏塔、塔顶冷凝器、塔底再沸器构成,原料预热器、回流液泵、产品冷却器等。
蒸馏目的:对液体混合物的分离,提取或回收有用组分。 蒸馏依据:液体混合物中各组分挥发性的差异
蒸馏过程的分类:
1
• 蒸馏过程的分类:
简单蒸馏
按蒸馏方式
平衡蒸馏 按物系的组分数
特殊蒸馏
精馏
双组分蒸馏 多组分蒸馏
按操作方式
间歇蒸馏 连续蒸馏
按操作压
常压蒸馏 加压蒸馏 减压(真空)蒸馏
2
• 蒸馏与蒸发的区别:
