碳、硅及其化合物的方程式
碳、硅及其化合物的化学方程式和离子方程式(精选.)

碳硅及其化合物的化学方程式和离子方程式碳及其化合物的化学方程式和离子方程式一、碳1、碳在少量的氧气中燃烧:2C+O22CO2、碳在足量的氧气中燃烧:C+O2CO23、碳和硫蒸气高温反应:C+2S CS24、碳和氧化铁在高温下反应:2Fe2O3+3C2Fe+3CO2↑5、碳粉与氧化铜共热:2CuO+C2Cu+CO2↑6、碳和水蒸气高温反应:C+H2O CO+H27、碳和二氧化碳在高温下反应:C+CO22CO8、碳与浓硫酸共热:C+2H2SO4CO2↑+2SO2↑+2H2O9、碳与浓硝酸共热:C+4HNO3CO2↑+4NO2↑+2H2O10、碳与稀硝酸共热:3C+4HNO33CO2↑+4NO ↑+2H2O11、工业上制备粗硅:SiO2+2C Si+2CO↑12、工业上制备金刚砂:SiO2+3C SiC+2CO↑13、工业上制备碳化钙:CaO+3C CaC2+CO↑二、一氧化碳1、一氧化碳在氧气中燃烧:2CO+O22CO22、一氧化碳气体和氧化铁在高温下反应:Fe2O3+3CO2Fe+3CO23、一氧化碳通过灼热的氧化铜:CuO+CO Cu+CO24、一氧化碳和水蒸气反应:CO+H2O CO2+H2三、二氧化碳1、镁在二氧化碳中燃烧:2Mg+CO22MgO+C2、碳和二氧化碳在高温下反应:C+CO22CO3、氧化钠与二氧化碳反应:Na2O+CO2Na2CO34、氧化钙与二氧化碳反应:CaO+CO2CaCO35、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑6、二氧化碳和水反应:CO 2+H2O H2CO37、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、工业上生产碳铵:NH3+CO2+H2O NH4HCO310、向澄清石灰水中通入二氧化碳:Ca(OH)2+CO2CaCO3↓+H2OCa2++2OH-+CO2CaCO3↓+H2O11、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-12、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓13、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-14、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O Al(OH)3↓+HCO3-15、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓16、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓17、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-18、向苯酚钠溶液中通入二氧化碳气体:C6H5ONa+CO2+H2O C6H5OH+NaHCO3C6H5O-+CO2+H2O C6H5OH+HCO3-19、向次氯酸钠溶液中通入二氧化碳气体:NaClO+CO2+H2O HClO+NaHCO3ClO-+CO2+H2O HClO+HCO3-20、向次氯酸钙溶液中通入二氧化碳:Ca(ClO)2+CO2+H2O CaCO3↓+2HClOCa2++2ClO-+CO2+H2O CaCO3↓+2HClO四、碳酸钙1、碳酸钙溶于稀盐酸:CaCO3+2HCl CaCl2+CO2↑+H2OCaCO3+2H+Ca2++CO2↑+H2O2、碳酸钙溶于醋酸:CaCO3+2CH3COOH(CH3COO)2Ca+CO2↑+2H2OCaCO3+2CH3COOH2CH3COO-+Ca2++CO2↑+H2O3、碳酸钙溶于氯化铁溶液:3CaCO3+2FeCl3+3H2O2Fe(OH)3+3CaCl2+3CO2↑3CaCO3+2Fe3++3H2O2Fe(OH)3+3CO2↑+3Ca2+4、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑5、高温分解碳酸钙:CaCO3CaO+CO2↑6、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-五、碳酸氢钙1、碳酸氢钙与盐酸反应:Ca(HCO3)2+2HCl CaCl2+2CO2↑+2H2OHCO3-+H+CO2↑+H2O2、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O3、向碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O4、向碳酸氢钙溶液中加入石灰水:Ca(HCO3)2+Ca(OH)22CaCO3↓+2H2OCa2++HCO3-CaCO3↓+H2O5、加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O6、碳酸氢钙溶液与碳酸钠溶液反应:Ca(HCO3)2+Na2CO3CaCO3↓+2NaHCO3Ca2++CO32-CaCO3↓硅及其化合物的化学方程式和离子方程式一、硅1、硅和氟气反应:Si+2F2SiF42、硅和氯气加热:Si+2Cl2SiCl43、硅与氧气加热:Si+O2SiO24、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑5、硅和氢氟酸反应:Si+4HF SiF4+2H2↑二、二氧化硅1、工业上用二氧化硅制备粗硅:SiO2+2C Si+2CO↑2、工业上二氧化硅制备金刚砂:SiO2+3C SiC+2CO↑3、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑4、碳酸钠高温条件下与二氧化硅反应:Na2CO3+SiO2Na2SiO3+CO2↑5、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O6、将二氧化硅溶于氢氟酸:SiO2+4HF SiF4+2H2O7、二氧化硅高温与生石灰反应:CaO+SiO2CaSiO3三、硅酸1、硅酸溶于氢氧化钠溶液:H2SiO3+2NaOH Na2SiO3+2H2OH2SiO3+2OH-SiO32-+2H2O2、加热硅酸:H2SiO3SiO2+H2O四、硅酸钠1、硅酸钠溶液加入氯化钙溶液:Na2SiO3+CaCl2CaSiO3↓+2NaClSiO32-+Ca2+CaSiO3↓2、硅酸钠溶液呈碱性:Na 2SiO3+H2O NaHSiO3+NaOHSiO 32-+H2O HSiO3-+OH-3、向硅酸钠溶液中加入盐酸:Na2SiO3+2HCl2NaCl+H2SiO3↓SiO32-+2H+H2SiO3↓4、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓5、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓6、硅酸钠溶液与氯化铵溶液混合:Na2SiO3+2NH4Cl2NaCl+H2SiO3↓+2NH3↑SiO32-+2NH4+H2SiO3↓+2NH3↑最新文件仅供参考已改成word文本。
碳、硅和碳、硅的化合物常用化学方程式

第 1 页 共 1 页 碳、硅和碳、硅的化合物常用化学方程式与碳有关的化学方程式:)、(——————3233224HCO CO CO H CO CO C CH 一、C +CO 22CO C +H 2O CO +H 2(生成水煤气) 二、Fe 2O 3+3CO2Fe +3CO 2 CO +H 2O CO 2+H 2 三、Ca(HCO 3)2CaCO 3+CO 2↑+H 2O CaCO 3CaO +CO 2↑ MgCO 3MgO +CO 2↑ 四、C 与浓硫酸共热:C +2H 2SO 4CO 2↑+2SO 2↑+2H 2O C 与浓硝酸共热:C +4HNO 3CO 2↑+4NO 2↑+2H 2O 与硅有关的化学方程式:)(————233224SiO S iO H S iO S i S iH 一、硅的制取:①SiO 2+2CSi +2CO ↑(制得粗硅) ②Si (粗)+2Cl 2SiCl 4 ③SiCl 4+2H 2Si (纯)+4HCl 二、Si 的性质1.与非金属反应:Si +O 2SiO 2 Si +2F 2===SiF 42.Si 和氢氟酸反应:Si +4HF===SiF 4+2H 2↑3.Si 和NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑ Si +2OH -+H 2O===SiO 32-+2H 2↑三、SiO 2的性质(酸性氧化物)1.和NaOH 溶液反应:2NaOH +SiO 2===Na 2SiO 3+H 2O (常温下强碱缓慢腐蚀玻璃)2OH -+SiO 2===SiO 32-+H 2O2.和氢氟酸反应:SiO 2+4HF===SiF 4+2H 2O (氢氟酸腐蚀玻璃)3.和CaO 反应:CaO +SiO 2===CaSiO 3四、H 2SiO 3(弱酸性,不溶于水)1.H 2SiO 3制取:Na 2SiO 3+2HCl===2NaCl +H 2SiO 3↓(H 4SiO 4===H 2SiO 3↓+H 2O )五、Na 2SiO 31.与酸反应:Na 2SiO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3(说明H 2SiO 3酸性比碳酸弱)SiO 32-+CO 2+H 2O===CO 32-+H 2SiO 3↓(CO 2过量则生成HCO 3-) SiO 32-+2CO 2+2H 2O===2HCO 3-+H 2SiO 3↓2.Na 2CO 3高温条件下与SiO 2反应:Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ 3.CaCO 3高温条件下与SiO 2反应:CaCO 3+SiO 2CaSiO 3+CO 2↑。
碳、硅、氮、硫、氯及其化合物方程式和离子方程式锦集

碳、硅、氮、硫、氯及其化合物方程式和离子方程式锦集一、碳及其化合物方程式和离子方程式1、C(1)与氧气反应(不足):2C+O22CO(2)与氧气反应(充足): C+O2CO2(3)与氧化铜反应: 2CuO+C2Cu+CO2↑(4)与二氧化硅反应: SiO2+2C Si+2CO↑(5)与水蒸气反应(高温): C+H2O CO+H2(6)与浓硝酸反应: C+4HNO3CO2↑+4NO2↑+2H2O C+4H++4NO3-CO2↑+4NO2↑+2H2O(7)与浓硫酸反应: C+2H2SO4(浓)CO2↑+2SO2↑+2H2O(8)与二氧化碳反应: C+CO22CO2、CO(1)与氧气反应: 2CO+O22CO2(2)与氧化铜反应:CuO+CO Cu+CO2(3)与氧化铁反应:Fe2O3+3CO2Fe+3CO2(4)与水蒸气反应: CO+H2O CO2+H23、CO2(1)与水反应:CO2+H2O H2CO3(2)与碳单质反应:C+CO22CO(3)与镁单质反应:2Mg+CO22MgO+C(4)与氧化钙反应: CaO+CO2CaCO3(5)与过氧化钠反应: 2Na2O2+2CO22Na2CO3+O2↑(6)与少量氢氧化钠溶液反应: NaOH+CO2NaHCO3OH-+CO2HCO3-(7)与过量量氢氧化钠溶液反应:2NaOH+CO2Na2CO3+H2O 2OH-+CO2CO32-+H2O(8)与少量氢氧化钙溶液反应:Ca(OH)2+2CO2Ca(HCO3)2OH-+CO2HCO3-(9)与过量氢氧化钙溶液反应:Ca(OH)2+CO2CaCO3↓+H2O Ca2++2OH-+CO2CaCO3↓+H2O(10)与次氯酸钙反应: Ca(ClO)2+CO2+H2O CaCO3↓+2HClO Ca2++2ClO-+CO2+H2O CaCO3↓+2HClO(11)与碳酸钙反应:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-(12)与碳酸钠溶液反应:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-(13)与过量偏铝酸钠溶液反应:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-(14)与少量偏铝酸钠溶液反应:NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O Al(OH)3↓+HCO3-(15)与过量硅酸钠溶液反应:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3 SiO32-+CO2+H2O CO32-+H2SiO3↓(16)与少量硅酸钠溶液反应:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓(17)与苯酚钠溶液反应:C6H5ONa+CO2+H2O C6H5OH+NaHCO3C6H5O-+CO2+H2O C6H5OH+HCO3-(18)与过量氨水反应: CO2+2NH3·H2O(NH4) 2CO3 CO2+2NH3·H2O2NH4++CO32-(19)与少量氨水反应: CO2+NH3·H2O NH4HCO3 CO2+NH3·H2O NH4++HCO3-4.CaCO3(1)碳酸钙高温下分解: CaCO3+SiO2CaSiO3+CO2(2)溶于盐酸反应:CaCO3+2HCl CaCl2+CO2↑+H2O CaCO3+2H+Ca2++CO2↑+H2O(3)碳酸钙高温下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑(4)碳酸钙与二氧化碳和水反应:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-5.Ca(HCO3)2(1)与盐酸反应:Ca(HCO3)2+2HCl CaCl2+2CO2↑+2H2O HCO3-+H+CO2↑+H2O(2)与少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2O Ca2++HCO3-+OH-CaCO3↓+H2O(3)与过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O(4)与石灰水:Ca(HCO3)2+Ca(OH)22CaCO3↓+2H2O Ca2++HCO3-CaCO3↓+H2O(5)加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O(6)与碳酸钠溶液反应:Ca(HCO3)2+Na2CO3CaCO3↓+2NaHCO3Ca2++CO32-CaCO3↓二、硅及其化合物方程式和离子方程式1、Si(1)与氧气反应:Si+O2SiO2(2)与氯气反应:Si+2Cl2SiCl4(3)与氟气反应:Si+2F2SiF4(4)与氢氟酸反应:Si+4HF SiF4+2H2↑(5)与氢氧化钠溶液反应:Si+2NaOH+H2O Na2SiO3+2H2↑ Si+2OH-+H2O SiO32-+2H2↑2、SiO2(1)与氧化钙反应:CaO+SiO2CaSiO3(2)与氢氧化钠溶液反应:2NaOH+SiO2Na2SiO3+H2O 2OH-+SiO2SiO32-+H2O(3)与氢氟酸反应:SiO2+4HF SiF4+2H2O(4)与碳酸钠反应:Na2CO3+SiO2Na2SiO3+CO2↑(5)与碳酸钙反应:CaCO3+SiO2CaSiO3+CO2(6)与碳单质反应:SiO2+3C SiC+2CO↑3、SiCl4(1)与氢气反应:SiCl4+2H2Si+4HCl(2)与氧气反应:SiCl4+O2Si O2+2Cl24、H2SiO3(1)与氢氧化钠溶液反应:H2SiO3+2NaOH Na2SiO3+2H2O H2SiO3+2OH-SiO32-+2H2O(2)受热分解:H2SiO3SiO2+H2O5、Na2SiO3(1)与稀硫酸反应:Na2SiO3+H2SO4Na2SO4+H2SiO3↓ SiO32-+2H+H2SiO3↓(2)与二氧化碳和水反应:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓三、氮及其化合物方程式和离子方程式1.N2(1)与氢气反应:N2+3H2错误!未找到引用源。
碳硅及其重要化合物的化学方程式总结

碳硅及其重要化合物的化学方程式总结碳是地壳中被广泛存在的元素之一,它在地球上的循环过程中起着重要作用。
碳的化学方程式既可以描述它与其他元素的反应,也可以描述其重要化合物的合成和分解过程。
下面是一些碳及其重要化合物的化学方程式:碳与氧气反应会产生二氧化碳:C+O2-->CO2碳与水蒸气反应会产生一氧化碳和氢气:C+H2O-->CO+H2碳和硫的反应会产生二硫化碳:C+2S-->CS2碳和氯气反应会产生四氯化碳:C+2Cl2-->CCl4碳与氧化钙反应会生成氧化碳:C+CaO-->CaCO3碳和氢气反应会产生甲烷:C+2H2-->CH4碳与氯乙烯反应会生成四氯化碳和乙烯:C2H3Cl+5Cl2-->CCl4+2C2H4碳与氢氧化钠反应可以制备乙炔:2C+NaOH-->Na2CO3+C2H2这些化学方程式描述了碳与氧、氢、硫以及其他元素的反应。
除此之外,碳还能与其他非金属元素如氮、氟和氯等进行反应,生成一系列化合物。
硅是地壳中含量最丰富的非金属元素之一,它也具有重要的化学性质。
硅的化学方程式可以描述其与氧气、水和酸的反应,以及其重要化合物的合成和分解过程。
硅与氧气反应会生成二氧化硅:Si+O2-->SiO2硅与水反应会生成硅酸:Si+2H2O-->Si(OH)4硅与氢氟酸反应会产生气体六氟硅酸:Si+6HF-->H2SiF6+2H2硅与氯气反应会生成硅四氯化物:Si+2Cl2-->SiCl4硅与氢气反应会生成硅化钙:Si+CaH2-->CaSi2硅与硝酸反应会生成硝酸硅酯:Si+4HNO3-->Si(ONO)4+2H2O除了与氧、氢、氟和氯等元素的反应,硅还能与其他非金属元素如硫、磷等发生反应并形成相应的化合物。
总结起来,碳和硅是地壳中含量较丰富的元素之一,它们的化学方程式描述了它们与其他元素的反应以及重要化合物的合成和分解过程。
碳、硅、氮、硫、氯及其化合物方程式和离子方程式锦集(精选.)

碳、硅、氮、硫、氯及其化合物方程式和离子方程式锦集一、碳及其化合物方程式和离子方程式1、C(1)与氧气反应(不足):2C+O22CO(2)与氧气反应(充足): C+O2CO2(3)与氧化铜反应: 2CuO+C2Cu+CO2↑(4)与二氧化硅反应: SiO2+2C Si+2CO↑(5)与水蒸气反应(高温): C+H2O CO+H2(6)与浓硝酸反应: C+4HNO3CO2↑+4NO2↑+2H2O C+4H++4NO3-CO2↑+4NO2↑+2H2O(7)与浓硫酸反应: C+2H2SO4(浓)CO2↑+2SO2↑+2H2O(8)与二氧化碳反应: C+CO22CO2、CO(1)与氧气反应: 2CO+O22CO2(2)与氧化铜反应:CuO+CO Cu+CO2(3)与氧化铁反应:Fe2O3+3CO2Fe+3CO2(4)与水蒸气反应: CO+H2O CO2+H23、CO2(1)与水反应:CO2+H2O H2CO3(2)与碳单质反应:C+CO22CO(3)与镁单质反应:2Mg+CO22MgO+C(4)与氧化钙反应: CaO+CO2CaCO3(5)与过氧化钠反应: 2Na2O2+2CO22Na2CO3+O2↑(6)与少量氢氧化钠溶液反应: NaOH+CO2NaHCO3OH-+CO2HCO3-(7)与过量量氢氧化钠溶液反应:2NaOH+CO2Na2CO3+H2O 2OH-+CO2CO32-+H2O(8)与少量氢氧化钙溶液反应:Ca(OH)2+2CO2Ca(HCO3)2OH-+CO2HCO3-(9)与过量氢氧化钙溶液反应:Ca(OH)2+CO2CaCO3↓+H2O Ca2++2OH-+CO2CaCO3↓+H2O(10)与次氯酸钙反应: Ca(ClO)2+CO2+H2O CaCO3↓+2HClO Ca2++2ClO-+CO2+H2O CaCO3↓+2HClO(11)与碳酸钙反应:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-(12)与碳酸钠溶液反应:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-(13)与过量偏铝酸钠溶液反应:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-(14)与少量偏铝酸钠溶液反应:NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O Al(OH)3↓+HCO3-(15)与过量硅酸钠溶液反应:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3 SiO32-+CO2+H2O CO32-+H2SiO3↓(16)与少量硅酸钠溶液反应:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓(17)与苯酚钠溶液反应:C6H5ONa+CO2+H2O C6H5OH+NaHCO3C6H5O-+CO2+H2O C6H5OH+HCO3-(18)与过量氨水反应: CO2+2NH3·H2O(NH4) 2CO3 CO2+2NH3·H2O2NH4++CO32-(19)与少量氨水反应: CO2+NH3·H2O NH4HCO3 CO2+NH3·H2O NH4++HCO3-4.CaCO3(1)碳酸钙高温下分解: CaCO3+SiO2CaSiO3+CO2(2)溶于盐酸反应:CaCO 3+2HCl CaCl2+CO2↑+H2O CaCO3+2H+Ca2++CO2↑+H2O(3)碳酸钙高温下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑(4)碳酸钙与二氧化碳和水反应:CaCO 3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-5.Ca(HCO3)2(1)与盐酸反应:Ca(HCO 3)2+2HCl CaCl2+2CO2↑+2H2O HCO3-+H+CO2↑+H2O(2)与少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2O Ca2++HCO3-+OH-CaCO3↓+H2O(3)与过量氢氧化钠溶液:Ca(HCO 3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O(4)与石灰水:Ca(HCO 3)2+Ca(OH)22CaCO3↓+2H2O Ca2++HCO3-CaCO3↓+H2O(5)加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O(6)与碳酸钠溶液反应:Ca(HCO 3)2+Na2CO3CaCO3↓+2NaHCO3Ca2++CO32-CaCO3↓二、硅及其化合物方程式和离子方程式1、Si(1)与氧气反应:Si+O2SiO2(2)与氯气反应:Si+2Cl2SiCl4(3)与氟气反应:Si+2F 2SiF4(4)与氢氟酸反应:Si+4HF SiF4+2H2↑(5)与氢氧化钠溶液反应:Si+2NaOH+H 2O Na2SiO3+2H2↑ Si+2OH-+H2O SiO32-+2H2↑2、SiO2(1)与氧化钙反应:CaO+SiO2CaSiO3(2)与氢氧化钠溶液反应:2NaOH+SiO 2Na2SiO3+H2O 2OH-+SiO2SiO32-+H2O(3)与氢氟酸反应:SiO 2+4HF SiF4+2H2O(4)与碳酸钠反应:Na2CO3+SiO2Na2SiO3+CO2↑(5)与碳酸钙反应:CaCO3+SiO2CaSiO3+CO2(6)与碳单质反应:SiO2+3C SiC+2CO↑3、SiCl4(1)与氢气反应:SiCl4+2H2Si+4HCl(2)与氧气反应:SiCl4+O2Si O2+2Cl24、H2SiO3(1)与氢氧化钠溶液反应:H 2SiO3+2NaOH Na2SiO3+2H2O H2SiO3+2OH-SiO32-+2H2O(2)受热分解:H2SiO3SiO2+H2O5、Na2SiO3(1)与稀硫酸反应:Na 2SiO3+H2SO4Na2SO4+H2SiO3↓ SiO32-+2H+H2SiO3↓(2)与二氧化碳和水反应:Na 2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓三、氮及其化合物方程式和离子方程式1.N2(1)与氢气反应:N2+3H2催化剂高温高压2NH3(2)与金属镁应:3Mg+N2Mg3N2(3)与氧气反应:N 2+O22NO(放电)2.NH3(1)与水反应:NH 3+H2O NH3·H2O NH4++OH-(2)与氧气反应:4NH3+5O2 4NO+6H2O(3)与少量氯气反应:8NH3+3Cl2N2+6NH4Cl(4)与过量氯气反应:2NH3+3Cl2N2+6HCl(4)与氧化铜反应:2NH3+3CuO N2+3Cu+3H2O(5)与HCl气体反应:NH3+HCl NH4Cl(6)与水和少量二氧化碳反应:CO2+2NH3+2H2O(NH4) 2CO3 CO2+2NH3+H2O2NH4++CO32-(7)与水和少量二氧化碳反应:CO2+NH3+H2O NH4HCO3 CO2+NH3+H2O NH4++HCO3-(8)与过量硫酸反应:NH3+H2SO4NH4HSO4 NH3+H+NH4+(9)与少量硫酸反应:2NH3+H2SO4(NH4) 2SO4 NH3+H+NH4+(10)与硝酸反应:NH3+HNO3NH4NO3 NH3+H+NH4+(11)氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4Cl Mg2++2NH3·H2O Mg(OH)2↓+2NH4+(12)向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+3.NO(1)与氧气反应:2NO+O22NO2(2)与氧气和水应:4NO+3O2+2H2O4HNO3 4NO+3O2+2H2O4H++4NO3-(3)与氨气反应:4NH3+6NO5N2+6H2O4.NO2(1)与水反应:3NO2+H2O2HNO3+NO 3NO2+H2O2H++NO3-+NO(2)与氨气反应:8NH3+6NO27N2+12H2O(3)与氧气和水反应:4NO2+O2+2H2O4HNO3 4NO2+O2+2H2O4H++4NO3-5.HNO3(1)与氧化铜反应:CuO+2HNO3Cu(NO3)2+H2O CuO+2H+Cu2++H2O(2)与氢氧化铜反应:Cu(OH)2+2HNO3Cu(NO3)2+2H2O Cu(OH)2+2H+Cu2++2H2O(3)稀硝酸与氧化亚铁反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O 3FeO+10H++NO3-3Fe3++NO ↑+5H2O(4) 稀硝酸与氢氧化亚铁反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO ↑+8H2O 3Fe(OH)2+10H++NO3-3Fe3++NO ↑+8H2O (5)与氨气反应:NH3+HNO3NH4NO3 NH3+H+NH4+(6)浓硝酸与铜反应:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O Cu+4H++2NO3-Cu2++2NO2↑+2H2O (5)稀硝酸与铜反应:3Cu+8HNO3(稀)3Cu(NO3)2+2NO ↑+4H2O 3Cu+8H++2NO3-3Cu2++2NO ↑+4H2O (6)浓硝酸与银反应:Ag+2HNO3(浓)AgNO3+NO2↑+H2O Ag+2H++NO3-Ag++NO2↑+H2O(7)稀硝酸与银反应:3Ag+4HNO33AgNO3+NO ↑+2H2O 3Ag+4H++NO3-3Ag++NO↑+2H2O(8)少量的铁与浓硝酸共热:Fe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2O Fe+6H++3NO3-Fe3++3NO2↑+3H2O (8)稀硝酸与铁反应(硝酸过量):Fe+4HNO3Fe(NO3)3+NO↑+2H2O Fe+4H++NO3-Fe3++NO ↑+2H2O(9)稀硝酸与铁反应(铁过量):3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O 3Fe+8H++2NO3-3Fe2++2NO ↑+4H2O(10)浓硝酸与碳反应:C+4HNO3(浓)CO2↑+4NO2↑+2H2O6.铵盐(1)氢氧化钙固体与氯化铵固体反应:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O(2)氢氧化钠溶液与硫酸铵溶液反应(加热):(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O 2NH4++2OH-2NH3↑+2H2O(3)氯化铵固体受热分解:NH4Cl NH3↑+HCl↑(4)碳酸氢铵受热分解:NH4HCO3NH3↑+CO2↑+H2O四、硫及其化合物方程式和离子方程式1.S(1)与氢气反应:S+H22H2S(2)与金属汞反应:Hg + S HgS(3)与金属铁反应:Fe + S FeS(4)与金属铜反应:2Cu + S Cu2S(5)与氧气反应:S+O2SO2(6)加热时与氢氧化钠溶液反应:3S + 6NaOH 2Na2S+Na2SO3+3H2O 3S + 6OH-2S2-+SO32-+3H2O 2.H2S(1)受热分解:H2S H2 + S(2)与氧气反应(完全):2H2S + 3O22H2O + 2SO2(3)与氧气反应(不完全):2H2S + O22H2O + 2S(4)与二氧化硫反应:2H2S + SO2 3S↓ + 2H2O(5)与氯化铁溶液反应:H2S+2FeCl3S↓+2HCl+2FeCl2H2S + 2Fe3+S↓+2H+ +2Fe2+ (6)与少量氢氧化钠溶液反应:H2S + NaOH NaHS + H2O H2S + OH-HS-+ H2O(7)与少量氢氧化钠溶液反应:H2S + 2NaOH Na2S + 2H2O H2S + 2OH-S2-+ 2H2O(8)与氯气反应:H2S + Cl2S↓+ 2HCl3.SO2(1)与水反应:SO2 + H2O H2SO3(2)与氧化钙固体反应:SO2+CaO CaSO3(3)与过量氢氧化钠溶液反应:2NaOH+SO2Na2SO3+H2O 2OH-+CO2SO32-+H2O(4)与少量氢氧化钠溶液反应:NaOH+SO2NaHSO3OH-+CO2HSO3-(5)与过量氢氧化钙溶液反应:Ca(OH)2+SO2CaSO3↓+H2O Ca2++2OH-+SO2CaSO3↓+H2O(6)与少量氢氧化钙溶液反应:Ca(OH)2+2SO2Ca(HSO3)2OH-+SO2HSO3-(7)与亚硫酸钠溶液反应:Na2SO3+SO2 +H2O 2NaHSO3SO32-+SO2 +H2O 2HSO3-(8)与氧气反应:2SO2 + O2 2 SO3(7)与氯、溴、碘反应:SO2 + X2 + 2H2O H2SO4+2HX SO2 + X2 + 2H2O SO42-+2X-+ 4H+(8)与高锰酸钾溶液反应(离子方程式):5SO2 + 2KMnO4+2H2O K2SO4+2MnSO4+2H2SO4 5SO2 + 2MnO4-+2H2O5SO42-+2Mn2++4H+(9)与硫化氢气体反应:2H2S + SO2 3S↓ + 2H2O(10)与氯化铁溶液反应(离子方程式):SO2 +2 FeCl3 +2H2O H2SO4+2FeCl2+2HCl SO2 +2 Fe3+ +2H2O H2SO4 + 2Fe2+ + 2H+4.SO3(1)与水反应:SO3+ H 2O H2SO4(2)与氧化钙反应:SO3+ CaO CaSO4(3)与氢氧化钠溶液反应:SO3 + 2NaOH Na2SO4 + H2O5.H2SO4(1)与锌反应:Zn + H2SO4ZnSO4+H2↑Zn + 2H+Zn2++H2↑(2)与氧化铜反应:CuO + H2SO4CuSO4+ H2O CuO +2H+Cu2++ H2O(3)与氢氧化铜反应:Cu(OH)2 + H2SO4CuSO4+ 2H2O Cu(OH)2 + 2H+Cu2+ + 2H2O(4)与氢氧化钡溶液反应(离子方程式):Ba(OH)2 + H2SO4BaSO4↓+ 2H2O Ba2+ + 2OH-+ 2H+ +SO42-BaSO4↓+ 2H2O(5)与亚硫酸钠固体反应:Na2SO3 +H2SO4(浓)Na2SO4+SO2↑ +H2O Na2SO3 +H2SO4(浓)2Na+ + SO42-+SO2↑ +H2O(6)浓硫酸与铜反应:Cu + 2H2SO4(浓) 2SO2↑+CuSO4+2H2O(7)浓硫酸与碳反应:C + 2H2SO4(浓) 2SO2↑+CO2↑+2H2O(8)与氯化钡溶液反应:BaCl2 + H2SO4BaSO4↓+ 2HCl Ba2+ +SO42-BaSO4↓6.Na2SO3(1)与氧气反应:2Na2SO3 +O22Na2SO4 2SO32-+O22SO42-(2)与氯水反应:Na2SO3 + Cl2 + H2O Na2SO4 + 2HCl SO32-+ Cl2 + H2O SO4 2-+ 2H+ + 2Cl-(3)与次氯酸钠反应:Na2SO3 + NaClO Na2SO4 + NaCl SO32-+ ClO-SO42-+ Cl-(4)与高锰酸钾和硫酸溶液反应:5Na2SO3 + 2KMnO4+3H2SO45Na2SO4+ K2SO4 + 2MnSO4+3H2O5SO32-+ 2MnO4-+6H+5SO42-+ 2Mn2++3H2O(5)与硫化钠和硫酸反应:Na2SO3 +2Na2S+3H2SO43Na2SO4+ 3H2O+ 3S↓SO32-+2S2-+6H+3H2O+ 3S↓(6)与氯化钡溶液反应:Na2SO3 +2BaCl2 BaSO3↓+2 NaCl SO32-+2Ba2+BaSO3↓(7)与二氧化硫和水反应:Na2SO3 + SO2 +H2O2NaHSO3 SO32-+ SO2 +H2O2HSO3-7.其它(1)硫酸钠溶液与氯化钡溶液反应:Na2SO4 + 2BaCl2 BaSO4↓+2 NaCl SO42-+2Ba2+BaSO4↓(2)亚硫酸氢钠固体受热分解:2NaHSO3Na2SO3 + SO2 ↑+H2O五、氯及其化合物方程式和离子方程式:1.Cl2(1)与氢气反应:H2 + Cl22HCl(2)与少量磷单质反应:2P + 5Cl22PCl5(3)与过量磷单质反应2P + 3Cl22PCl3(4)与金属铁反应:2Fe + 3Cl22FeCl3(5)与金属铜反应:Cu + Cl2CuCl2(6)与水反应:Cl 2 + H2O HCl + HClO(7)与氢氧化钠溶液反应:Cl2 + 2NaOH NaCl + NaClO + H2O Cl2 + 2OH-Cl-+ ClO-+ H2O(8)与氢氧化钙溶液反应:2Cl2 + 2Ca(OH)2CaCl2 + Ca(ClO)2 + 2H2O Cl2 + 2OH-Cl-+ ClO-+ H2O(9)与硫化氢气体反应:Cl2 + H2S 2HCl+ S↓Cl2 + H2S2Cl-+ 2H+ + S↓(10)与氯化亚铁反应:Cl2 + 2FeCl22FeCl3Cl2 + 2Fe2+2Fe3+ + 2Cl-(11)与二氧化硫和水反应:Cl2 + SO2 +2H2O 2HCl + H2SO4Cl2 + SO2 +2H2O 2Cl-+ SO42-+ 4H+ (12)与碘化钾溶液反应:Cl2 + 2KI 2KCl + I2 Cl2 + 2I-2Cl-+ I2(13)与溴化钠溶液反应:Cl2 + 2NaBr 2NaCl + Br2 Cl2 + 2Br-2Cl-+Br2(14)与溴化亚铁溶液反应(当n(FeBr2)/n(Cl2)= 3 :4时):24Cl2 + 18FeBr22FeBr3 + 16FeCl3 + 15Br28Cl2 + 6Fe2+ + 10Br-6Fe3+ + 5Br2 + 16Cl-(15)与亚硫酸钠溶液反应:Cl2 + Na2SO3 +H2O Na2SO4+ 2HCl Cl2 + SO32-+ H2O 2SO42-+ 2Cl-+ 2H+(16)用浓盐酸和二氧化锰反应制氯气:4HCl(浓) + MnO2 Mn Cl2 + Cl2↑+ 2H2O 4H+ + 4Cl-+ MnO2 Mn2++ Cl2↑+ 2H2O (17)用浓盐酸和高锰酸钾反应制氯气:16HCl(浓)+2KMnO4 2MnCl2 +2KCl+5Cl2↑+8H2O 16H+ + 10Cl-+ MnO4- 2 Mn2++5Cl2↑+ 8H2O 2.HCl(1)与氨气反应:HCl + NH3 NH4Cl(3)与金属铁反应:2HCl + Fe FeCl2 +H2↑2H+ + Fe Fe2+ +H2↑(4)与氧化铁反应:6HCl + Fe2O3 2FeCl3 +3H2O 6H+ + Fe2O3 2Fe3+ +3H2O(5)与二氧化锰反应:4HCl(浓) + MnO2 Mn Cl2 + Cl2↑+ 2H2O 4H+ + 4Cl-+ MnO2 Mn2++ Cl2↑+ 2H2O(6)与过量碳酸钠反应:HCl+ Na2CO3 Na H CO3+Na Cl H++ CO32-H CO3-(7)与少量量碳酸钠反应2HCl+Na2CO32Na Cl+H2O+CO2↑2H++ CO32-H2O + CO2↑(8)与碳酸氢钠反应:HCl+NaHCO3Na Cl+H2O+CO2↑H++ HCO3-H2O + CO2↑(8)与碳酸钙反应:2HCl+CaCO3Ca Cl2+H2O+CO2↑2H++ CaCO3Ca2++ H2O + CO2↑3.HClO(1)见光分解:2HClO 光照2HCl + O2↑(2)次氯酸钙溶液与二氧化碳反应:Ca(ClO)2 + H2O + CO2 CaCO3↓ + 2HClO Ca2+ + 2ClO-+ H2O + CO2 CaCO3↓ + 2HClO 4.NaCl(1)与硝酸银溶液反应:NaCl + AgNO3 AgCl ↓+ NaNO3 Cl -+ Ag+AgCl↓(2)熔融电解:2NaCl(熔融) 2Na + Cl2↑ (电解)(3)电解饱和食盐水:2NaCl +2H2O 2NaOH + Cl2↑ +H2↑(电解) 2Cl-+2H2O 2OH- + Cl2↑ +H2↑(电解) 5.其它氟气与水反应:2F2 + 2H2O 4HF + O2最新文件仅供参考已改成word文本。
碳、硅及其重要化合物

碳、硅及其重要化合物一、碳、硅单质1.单质的结构、存在形态、物理性质和用途2.碳和硅的化学性质3.硅的工业制法及提纯石英砂――→①焦炭高温粗硅――→②氯气加热SiCl 4――→③氢气高温高纯硅反应①:□20SiO 2+C=====高温Si +2CO ↑。
反应②:□21Si +Cl 2=====△SiCl 4。
反应③:□22SiCl 4+2H 2=====高温Si +4HCl 。
二、碳、硅的氧化物 1.一氧化碳 (1)物理性质□01无色气体,□02有毒,□03难溶于水。
(2)化学性质 ①燃烧:2CO +O 2=====点燃2CO 2,□04淡蓝色火焰(空气中燃烧)。
②还原Fe 2O 3:□05Fe 2O 3+3CO=====高温2Fe +3CO 2(冶炼金属)。
2.二氧化碳和二氧化硅的比较续表三、硅酸、硅酸盐、无机非金属材料1.硅酸(H2SiO3)2.硅酸盐(1)硅酸盐是由硅、氧和金属元素组成的化合物的总称,是构成地壳岩石的重要成分。
(2)硅酸盐组成的表示方法通过用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成,如硅酸钠(Na2SiO3)可表示为Na2O·SiO2,长石(KAlSi3O8)可表示为□06K2O·Al2O3·6SiO2。
(3)硅酸钠①白色、可溶于水的粉末状固体,其水溶液俗称□07水玻璃,有黏性,水溶液显碱性。
②与酸性较硅酸强的酸反应与CO2水溶液反应的化学方程式Na2SiO3+H2O+CO2===□08Na2CO3+H2SiO3↓。
(3)用途:黏合剂(矿物胶),耐火阻燃材料。
3.无机非金属材料(1)传统无机非金属材料①三种硅酸盐工业生产的比较②主要用途:陶瓷、玻璃、水泥是重要建筑材料,也广泛应用于生活中。
(2)新型无机非金属材料①高温结构陶瓷:如氮化硅陶瓷具有较高的硬度和耐磨性、较强的抗化学侵蚀性和电绝缘性等。
②生物陶瓷:对机体无排异反应,不会引起代谢作用异常。
化学方程式大全

化学方程式大全一、钠及其化合物①4Na+O2===2Na2O2Na+2H2O===2NaOH+H2↑②Na2O+H2O===2NaOH2Na2O+O2△2Na2O2③2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2CO2===2Na2CO3+O2④CO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3⑤Na2CO3+2HCl=2NaCl+H2O+CO2↑Na2CO3+HCl===NaHCO3+NaCl(碳酸钠稀溶液中逐滴滴加稀盐酸)⑥2NaHCO3△Na2CO3+H2O+CO2↑NaHCO3+HCl===NaCl+H2O+CO2↑少量碳酸氢钠与氢氧化钡溶液混合:NaHCO3+Ba(OH)=BaCO3↓+H2O+NaOH碳酸氢钠与少量氢氧化钡溶液混合:2NaHCO3+Ba(OH)=BaCO3↓+2H2O+Na2CO3二、镁及其化合物Mg+Cl2点燃MgCl2Mg+Br2===MgBr22Mg+O2点燃2MgO Mg+2H2O(沸腾)△Mg(OH)2+H22Mg+CO2点燃2MgO+CMgCl2(熔融)通电Mg+Cl2三、铝及其化合物①2Al+Fe2O3高温Al2O3+2Fe2Al+6HCl===2AlCl3+3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+2NaOH+2H2O===2Na[Al(OH)4]+3H2↑②Al2O3+3H2SO4===Al2(SO4)3+3H2OAl2O3+2NaOH+3 H2O ===2 Na[Al(OH)4]③Al3++3NH3.H2O===Al(OH)3↓+3NH4+Al3++3OH-===Al(OH)3↓④Al(OH)3+OH-===[Al(OH)4]-Al(OH)3+3H+=== Al3++3 H2O⑤[Al(OH)4]-+ 4H+ === Al3++4H2O[Al(OH)4]-+CO2=== Al(OH)3↓+HCO3-[Al(OH)4]-+ Al3+===4Al(OH)3↓四、碳硅及其化合物①C+H2O高温CO+H2(生成水煤气)②CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2[Al(OH)4]-===2Al(OH)3↓+CO32-+H2OCO2+C6H5ONa+H2O===C6H5OH+NaHCO3③2C+SiO2高温Si+2CO↑(制得粗硅)Si+2NaOH+H2O===Na2SiO3+2H2↑④SiO2+CaO高温CaSiO3SiO2+2NaOH===Na2SiO3+H2OSiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑4HF+SiO2===SiF4↑+2H2O五、氮及其化合物①N2+3H2催化剂高温高压2NH3②3NO2+H2O===2HNO3+NO③4NH3+5O2催化剂△4NO+6H2O④NH3+H+===NH4+2NH4Cl+Ca(OH)2△CaCl2+2NH3↑+2H2O⑤3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2OCu+4HNO3===Cu(NO3)2+2NO2↑+2H2O4HNO3(浓)+C△CO2↑+4NO2↑+2H2O六、硫及其化合物①S+Fe△FeSS+2Cu△Cu2S②SO2+H2O===H2SO3放电N2+O22NO4HNO3(浓)===O2+4NO2+2H2O光照1Cl2+SO2 +2H2O===H2SO4 +2HCl SO2+Br2+2H2O===H2SO4+2HBr SO2+2H2S===3S+2H2O2SO2+O2催化剂△2SO3③2H2SO4(浓)+C △CO2↑+2SO2↑+2H2O2H2SO4(浓)+Cu △CuSO4+SO2↑+2H2O2H2SO3+O2===2H2SO4七、卤素及其化合物①2F2 +2H2O===4HF+O2②3Cl2 +2P点燃2PCl35Cl2 +2P 点燃2PCl53Cl2 +2Fe点燃2FeCl3Cl2+Cu点燃CuCl2③2Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I2④Cl2+H2O===HCl+HClO⑤Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O⑥4HCl(浓)+MnO2△MnCl2+Cl2↑+2H2O八、铁及其化合物①3Fe+4H2O(g)高温Fe3O4+4H2②2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2③2FeCl2+Cl2===2FeCl3九、水解①3CO32-+2Al3++3H2O===2Al(OH)3↓+3CO2↑3CO32-+2Fe3++3H2O===2Fe(OH)3↓+3CO2↑②3HCO3-+Al3+===Al(OH)3↓+3CO2↑3HCO3-+Fe3+===Fe(OH)3↓+3CO2↑③3S2-+Al3++6H2O===2Al(OH)3↓+3H2S↑④3[Al(OH)4]-+Al3+===4Al(OH)3↓十、原电池①铜锌原电池(电解质为硫酸铜溶液)负极:Zn—2e-=== Zn2+正极:Cu2++2e-===Cu电池反应:Zn +Cu2+ === Zn2++ Cu②氢氧燃料电池(电解质为酸性溶液):负极:2H2—4e-===4H+正极:O2+4H+ +4e-===2H2O电池反应:2H2+O2===2H2O③氢氧燃料电池(电解质为KOH溶液):负极:2H2+4OH--4e-===4H2O正极:O2+4H2O+4e-===4OH-电池反应:2H2+O2===2H2O④乙醇燃料电池(电解质为KOH溶液):负极:C2H5OH+16OH-===2CO32-+11H2O+12e-正极: O2+2H2O+4e-===4OH-电池反应:C2H5OH + 4OH-+3O2===2CO32-+ 5H2O十一、电解池①电解饱和食盐水:2Cl-+2H2O===Cl2+H2+2OH-阴极:2H+ +2e-=== H2↑阳极:2Cl- —2e-=== Cl2↑②电解硫酸铜溶液:2Cu2+ + 2H2O === 2Cu + O2 ↑+ 4H+阴极:2Cu2+ + 4e-===2Cu阳极:4OH-— 4e-===O2↑+2H2O③电解硫酸溶液:2H2O===2H2↑+ O2↑阴极:4H+ +4e-===2H2↑阳极:4OH--4e-=== O2↑+2H2O④电解精炼铜:阴极:Cu2+ +2e-=== Cu阳极:Cu —2e-=== Cu2+2限时45分钟,)一级方程式(限15分钟完成)1.钠在空气中点燃:2.用固液不加热法制O2的2种方法:3.P在足量氯气中点燃:4.有氮气参加的三个反应:;;。
非金属方程式(二)氮、硅化学方程式

碳、硅及其化合物方程式1.碳在氧气中燃烧化学方程式: 氧气不足: 氧气充足:2.碳与SiO 2、CO 2、Fe 2O 3、H 2O 等氧化反应化学方程式:2C+ SiO 22CO ↑+ Si C+CO 22CO 3C+Fe 2O 33CO ↑+2Fe C+H 2O(g) CO+H 2 注:高温下,以C 为还原剂还原氧化物一般生成CO3.碳被浓硫酸、浓硝酸氧化化学方程式:.C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O C+4HNO 3(浓)CO 2↑+4NO 2↑+2H 2O4. 常温下,Si 化学性质不活泼,只能与F 2、氢氟酸、强碱(如NaOH)反应,写出化学方程式: Si +2F 2 =SiF 4Si +2NaOH +H 2O =Na 2SiO 3+2H 2↑ Si +4HF =SiF 4↑+2H 2↑5.加热条件下,Si 与O 2、Cl 2反应化学方程式:Si +O 2 SiO 2 Si +2Cl 2 SiCl 46.高温条件下Si 与C 反应方程式:Si +CSiC(金刚砂)7.高纯硅的制备化学方程式:①制粗硅:SiO 2+2C Si+2CO↑②提纯(与Cl 2反应):粗Si 中含碳,造成SiCl 4中含CCl 4等杂质,通过分馏得纯SiCl 4 ③还原(用H 2还原): 8.CO 2分别与H 2O 、NaOH 溶液、CaO 反应化学方程式:CO 2+H 2O H 2CO 3 CO 2+2NaOH=Na 2CO 3+H 2O CO 2+CaO=CaCO 39. SiO 2与H 2O 不反应,与NaOH 溶液、CaO 反应化学方程式:SiO 2+2NaOH=Na 2SiO 3+H 2O (装碱性溶液试剂瓶不能用玻璃塞,要用橡胶塞) 离子方程式:SiO 2+2OH -= SiO 32-+H 2OSiO 2+CaO CaSiO 310. SiO 2与氢氟酸反应方程式: SiO 2+4HF=SiF 4↑+2H 2O(刻蚀玻璃、装氢氟酸不能用玻璃瓶,一般用铅制容器或塑料瓶)11. 制硅酸(水玻璃中加入盐酸或通入二氧化碳)化学方程式:Na 2SiO 3+2HCl=H 2SiO 3↓+2NaCl Na 2SiO 3+CO 2+H 2O=H 2SiO 3↓+Na 2CO 312.硅酸受热分解化学方程式:H 2SiO 3SiO 2+H 2O 13. 制普通玻璃化学方程式(两个):Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ CaCO 3+SiO 2CaSiO 3+CO 2↑氮及其化合物方程式1.氮气和氧气反应化学方程式:=== 高温 === 高温 === 高温 === 高温2.镁在氮气中燃烧化学方程式:3.工业合成氨气化学方程式:N2+3H22NH34. 一氧化氮在空气中变成红棕色化学方程式:2NO+O2=2NO25.NO 和O2按照4:3通入水中化学方程式:4NO+3O2+2H2O =4HNO36. NO氧化NH3化学方程式:6NO+4NH35N2+6H2O7.NO2氧化NH3化学方程式:6NO2+8NH3 7N2+12H2O8. NO2氧化SO2化学方程式:9. NO2和O2按照4:1通入水中化学方程式:4NO2+O2+2H2O =4HNO310. NO2和H2O反应化学方程式:3NO2+H2O=2HNO3+NO11. 用NaOH溶液除去NO2尾气化学方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O离子方程式:2NO2+2OH-=NO3-+NO2-+H2O12. NO 2 与N2O4之间的转化化学方程式:2NO2(g)N2O4(g) △<013. NO2与NO按照1:1通入NaOH溶液中:NO2+NO+2NaOH=2NaNO2+H2O14. 氨的实验室制法化学方程式:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑(不能写离方)实验室加热浓氨水制NH3化学方程式:NH3·H2O NH3↑+H2O15.解释:NH3溶于水显弱碱性NH 3+H2O NH3·H2O NH4++OH-或NH3+H2O NH4++OH-16. 氨气与盐酸、硝酸、硫酸反应化学方程式:NH3+HCl=NH4Cl; NH3+HNO3=NH4NO3 ; 2NH3+H2SO4=(NH4)2SO4;离子方程式:NH3+H+=NH4+17. 氨气与CO2反应化学方程式:CO2少量:2NH3+CO2+H2O=(NH4)2CO3CO2过量:NH3+CO2+H2O=NH4HCO3(碳铵)18. 氨气被氯气氧化化学方程式:2NH3(少量)+3Cl2=N2+6HCl8NH3 (过量)+3 Cl2= N2+6 NH4Cl(用于检验氯气管道是否泄漏,现象:产生大量白烟)19.氨气还原氧化铜化学方程式:2NH3+3CuO N2+3Cu+3H2O20. 氨水与可溶性铝盐制备氢氧化铝离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+21. NH 4Cl水解离子方程式:NH4++H2O NH3·H2O+ H+22. NH4+与SiO32-、AlO2-发生完全双水解离子方程式:SiO32-+2NH4+ =H2SiO3↓+2NH3↑AlO2-+NH4+ +H2O=Al(OH)3↓+2NH3↑23. 铵盐与强碱发生复分解,在水溶液中不加热时,反应的离子方程式为:NH+4+OH-=NH3·H2O加热时反应的离子方程式为:NH 4++OH - NH 3↑+H 2O浓溶液混合时离子方程式为:NH 4++OH -=NH 3↑+H 2O24. NH 4Cl 、NH 4HCO 3受热分解化学方程式:NH 4Cl NH 3↑+HCl↑; NH 4HCO 3NH 3↑+H 2O↑+CO 2↑25. NH 4+的检验方法:取少量溶液于试管中,加过量的浓强碱,加热,用湿润的红色石蕊试纸检验放出的气体,观察试纸是否变蓝26.稀硝酸加入紫色石蕊:变红色 浓硝酸加入紫色石蕊:先被红,再褪色27.硝酸分解化学方程式: 4HNO 3 Δ或光照 4NO 2↑+O 2↑+2H 2O28. 铜与浓硝酸反应化学方程式:Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O;离子方程式:Cu+4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O29.铜与稀硝酸反应化学方程式:3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O;离子方程式:3Cu+8H ++2NO 3-= 3Cu 2++2NO↑+4H 2O30. 稀硝酸与铁反应时离子方程式:铁少量:Fe +NO -3+4H +=Fe 3++NO↑+2H 2O铁过量:3Fe +2NO -3+8H +=3Fe 2++2NO↑+4H 2O31. 碳与浓硝酸反应化学方程式:C+4HNO 3(浓)CO 2↑+4NO 2↑+2H 2O32. 稀硝酸与Fe 2+、SO 2、SO 32-、I -反应离子方程式:3Fe 2++4H ++NO=3Fe 3++NO↑+2H 2O3SO 2+2H 2O +2NO=3SO 42-+2NO +4H +3SO 32-+2H ++2NO=3SO 42-+2NO↑+H 2O6I -+8H ++2NO=3I 2+2NO↑+4H 2O33. 苯的消化反应化学方程式:34.实验室制硝酸化学方程式:NaNO 3(固)+H 2SO 4(浓) NaHSO 4+HNO 3↑35.工业制硝酸(氨的催化氧化,也叫接触氧化)化学方程式:4NH 3+5O 24NO+6H 2O; 2NO+O 2 = 2NO 2; 3NO 2+H 2O=2HNO 3+NO=== 微热。
高中化学全部离子方程式大全总结高考必备

高中全部化学离子方程式总结钠及其化合物*1、钠与水反响:2Na++2H 2O=2Na++2OH–+H 2↑ 2、钠与硫酸铜溶液:2Na+2H 2O+Cu 2+=Cu(OH)2↓+H 2↑3、钠与稀硫酸:2Na+2H+=2Na++H 2↑*4、过氧化钠与水反响:2Na 2O 2+2H 2O=4Na ++4OH –+O 2↑碳、硅及其化合物*1、碳酸氢钠溶液与强酸溶液混合:HCO 3-+H+=CO 2↑+H 2O*2、碳酸氢钠溶液与氢氧化钠溶液:HCO 3-+OH –=H 2O+CO 32–3、向碳酸氢钙溶液中参加过量的氢氧化钠:2HCO 3-+Ca 2++2OH –=CaCO 3↓+2H 2O+CO 32–4、向碳酸氢钙溶液中参加少量的氢氧化钠:Ca 2++HCO 3-+OH –=CaCO 3↓+H 2O2++2OH –+CO 2=CaCO 3↓+H 2O*5、澄清石灰水通入少量CO 2:Ca*6、澄清石灰水通入过量CO 2:OH–+CO 2=HCO 3-7、碳酸氢钠溶液与少量石灰水反响:Ca 2++2OH –+2HCO 3-=CaCO 3↓+CO 32–+2H 2O 8、碳酸氢钠溶液与过量石灰水反响:HCO 3-+OH –+Ca 2+=CaCO 3↓+H 2O*9、碳酸钠溶液与少量盐酸反响:CO 32–+H+=HCO 3-*10、碳酸钠溶液与过量盐酸反响:CO 32–+2H+=CO 2↑+H 2O*11、向氢氧化钠溶液中通入少量的CO 2:CO 2+2OH –=CO 32–+H 2O *12、向氢氧化钠溶液中通入过量的CO 2:CO 2+OH–=HCO 3- ++HCO 3-+2OH –=NH 3↑+CO 32–+2H 2O13、碳酸氢铵溶液中参加过量氢氧化钠溶液:NH 4 *14、碳酸钙与盐酸反响:CaCO 3+2H +=Ca 2++CO 2↑+H 2O2++2CH 3COO -+CO 2↑+H 2O*15、碳酸钙与醋酸反响:CaCO 3+2CH 3COOH=Ca*16、澄清石灰水与稀盐酸反响:H++OH –=H 2O *17、碳酸氢盐溶液与醋酸溶液混合:HCO 3-+CH 3COOH=CO 2↑+H 2O+CH 3COO -*18、醋酸与氢氧化钾溶液反响:CH 3COOH+OH-=CH 3COO -+H 2O*19、醋酸与氨水反响:CH 3COOH+NH 3?H 2O=CH 3COO-+NH4++2H2O*20、二氧化硅与氢氧化钠溶液:SiO2+2OH -=SiO32-+H2O*21、硅酸钠溶液中通入二氧化碳:SiO32-+CO2=H2SiO3↓+CO32–氮及其化合物1、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O12、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O*3、单质铜与稀硝酸反响:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O*4、单质铜与浓硝酸反响:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O++Cu=2Ag+Cu2+5、铜片插入硝酸银溶液:2Ag++SO32-6、用氨水吸收少量SO2:SO2+2NH3+H2O=2NH47、用氨水吸收过量的SO2:NH3+H2O=NH4++HSO3-++OH-=NH3↑+H2O*8、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-=NH3·H2O*9、氯化铵与氢氧化钠两种稀溶液混合:NH4*10、氨水与稀盐酸:NH3·H2O+H +=NH4++H2O*11、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓*12、NO2溶于水:3NO2+H2O=2H ++2NO3-+NO↑硫及其化合物2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓*1、硫酸镁溶液跟氢氧化钡溶液反响:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O*2、硫酸溶液跟氢氧化钡溶液反响:Ba*3、硫酸氢钠溶液与氢氧化钡反响至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓*4、硫酸氢钠溶液与氢氧化钡反响至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O *5、硫酸铝钾溶液中参加过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓–+[Al(OH)4]*6、氢氧化镁与稀硫酸反响:Mg(OH)2+2H +=Mg2++2H2O*7、硫化钠与盐酸反响:S2–+2H+=H2S↑*8、硫化钠溶液中参加溴水:S2–+Br2=S↓+2Br2–+Br2=S↓+2Br –2++SO42-=BaSO4↓*9、氯化钡溶液与硫酸反响:Ba卤素单质及其化合物1、电解饱和食盐水:2Cl-+2H2O=2OH -+H2↑+Cl2↑*2、二氧化锰与浓盐酸共热:MnO2+2Cl -+4H+=Mn2++Cl2↑+2H2O *3、氯气通入冷的氢氧化钠溶液中:Cl2+2OH -=Cl-+ClO-+H2O4、氯气通入热的氢氧化钾溶液中:3Cl2+6OH -=5Cl-+ClO3-+3H2O*5、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=+HCO3-*6、次氯酸钠溶液中参加稀盐酸:ClO-+H+=HClO2*7、碘化钾溶液中参加氯水:2I-+Cl2=I2+2Cl-*8、氯气通入水中:Cl2+H2O=H ++Cl-+HClO9、亚硫酸钠溶液中参加溴水:SO32-+Br-+2H+2-+H2O+Br2=SO4*10、二氧化硫通入溴水中:SO2+Br2+2H2O=4H ++2Br-+SO42-*11、溴化钠溶液中参加氯水:2Br--+Cl2=Br2+2Cl12、亚硫酸溶液中参加氯水:H2SO3+Cl2+H2O=4H++2Cl-+SO42-13、向碘化亚铁溶液通入少量氯气:2I-+Cl2=I2+2Cl-铝及其化合物*1、铝和盐酸反响:2Al+6H +=2Al3++3H2↑*2、铝跟氢氧化钠溶液反响:2Al+2OH–+6H2O=2[Al(OH)4]–+3H2↑*3、氧化铝溶于强碱溶液:Al2O3+2OH –+3H2O=2[Al(OH)4]–*4、氧化铝溶于强酸溶液:Al2O3+6H +=2Al3++3H2O*5、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH –=[Al(OH)4]–*6、氢氧化铝与盐酸溶液反响:Al(OH)3+3H +=Al3++3H2O*7、四羟基合铝酸钠溶液中参加少量盐酸:[Al(OH)4]–+H+=Al(OH)3↓+H2O*8、四羟基合铝酸钠溶液中参加过量盐酸:[Al(OH)4]–+4H+=Al3++4H2O*9、氯化铝溶液中参加少量氢氧化钠溶液:Al3++3OH–=Al(OH)3↓3++4OH–=[Al(OH)4]–*10、氯化铝溶液中参加过量氢氧化钠溶液:Al*11、四羟基合铝酸钠溶液中通入足量二氧化碳:[Al(OH)4] –+CO2=Al(OH)3↓+HCO3–3++3NH3?H2O=Al(OH)3↓+3NH4+*12、氯化铝溶液中参加过量氨水:Al铁及其化合物*1、金属铁溶于盐酸中:Fe+2H +=Fe2++H2↑*2、铁粉与氯化铁溶液反响:Fe+2Fe 3+=3Fe2+*3、铜与氯化铁溶液反响:Cu+2Fe 3+=Cu2++3Fe2+*4、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–5、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2Fe2+3++2I–=2Fe2++I2*6、氯化铁溶液中滴加少量碘化钾溶液:2Fe*7、氯化铁溶液与氢氧化钠溶液反响:Fe3++3OH–=Fe(OH)3↓3++3NH3?H2O=Fe(OH)3↓+3NH4+*8、氯化铁溶液跟过量氨水反响:Fe*9、氯化铁溶液参加碘化钾溶液:2Fe3++2I-=2Fe2++I2*10、氧化铁溶于盐酸:Fe2O3+6H +=2Fe3++3H2O3*11、用氯化铁与沸水反响制氢氧化铁胶体:Fe 3++3H 2O=Fe(OH)3〔胶体〕+3H+2++4Br -+3Cl 2=2Fe3++2Br 2+6Cl -12、向溴化亚铁溶液通入足量的氯气:2Fe2++Cl 2=2Fe 3++2Cl -13、向溴化亚铁溶液通入少量氯气:2Fe2+或Fe 3+产生了浓厚兴趣,他采取1.某同学在观看电视广告时,对“朴雪〞口服液中含有Fe了以下做法,你认为不合理的是()A.由于维生素C 具有复原性,可以和朴雪口服液同时服用B .在检验铁的价态时,该同学先滴入KSCN 溶液后滴入氯水,能判断出铁元素的价态C .在检验铁元素的价态时,该同学先滴入氯水,后滴入KSCN 溶液[来源:Z*xx*k]2+氧化为Fe 3+D .Cl 2能够将Fe2.以下各组离子,能在溶液中大量共存的是()+、Mg 2+、Fe 2+、SO 2+、[Al(OH)4]-、Br -B .H--A.Na 4、NO32-2+、Al 3+、NH +-D .Ca +、NO--C .K4、CO3、OH3、Cl2-2-2--3.某溶液中可能含有SO 4、CO 3、Cl 。
(完整版)碳、硅、氮、硫、氯及其化合物方程式和离子方程式锦集

碳、硅、氮、硫、氯及其化合物方程式和离子方程式锦集一、碳及其化合物方程式和离子方程式1、C(1)与氧气反应(不足):2C+O22CO(2)与氧气反应(充足): C+O2CO2(3)与氧化铜反应: 2CuO+C2Cu+CO2↑(4)与二氧化硅反应: SiO2+2C Si+2CO↑(5)与水蒸气反应(高温): C+H2O CO+H2(6)与浓硝酸反应: C+4HNO3CO2↑+4NO2↑+2H2O C+4H++4NO3-CO2↑+4NO2↑+2H2O(7)与浓硫酸反应: C+2H2SO4(浓)CO2↑+2SO2↑+2H2O(8)与二氧化碳反应: C+CO22CO2、CO(1)与氧气反应: 2CO+O22CO2(2)与氧化铜反应:CuO+CO Cu+CO2(3)与氧化铁反应:Fe2O3+3CO2Fe+3CO2(4)与水蒸气反应: CO+H2O CO2+H23、CO2(1)与水反应:CO2+H2O H2CO3(2)与碳单质反应:C+CO22CO(3)与镁单质反应:2Mg+CO22MgO+C(4)与氧化钙反应: CaO+CO2CaCO3(5)与过氧化钠反应: 2Na2O2+2CO22Na2CO3+O2↑(6)与少量氢氧化钠溶液反应: NaOH+CO2NaHCO3OH-+CO2HCO3-(7)与过量量氢氧化钠溶液反应:2NaOH+CO2Na2CO3+H2O 2OH-+CO2CO32-+H2O(8)与少量氢氧化钙溶液反应:Ca(OH)2+2CO2Ca(HCO3)2OH-+CO2HCO3-(9)与过量氢氧化钙溶液反应:Ca(OH)2+CO2CaCO3↓+H2O Ca2++2OH-+CO2CaCO3↓+H2O(10)与次氯酸钙反应: Ca(ClO)2+CO2+H2O CaCO3↓+2HClO Ca2++2ClO-+CO2+H2O CaCO3↓+2HClO(11)与碳酸钙反应:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-(12)与碳酸钠溶液反应:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-(13)与过量偏铝酸钠溶液反应:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-(14)与少量偏铝酸钠溶液反应:NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O Al(OH)3↓+HCO3-(15)与过量硅酸钠溶液反应:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3 SiO32-+CO2+H2O CO32-+H2SiO3↓(16)与少量硅酸钠溶液反应:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓(17)与苯酚钠溶液反应:C6H5ONa+CO2+H2O C6H5OH+NaHCO3C6H5O-+CO2+H2O C6H5OH+HCO3-(18)与过量氨水反应: CO2+2NH3·H2O(NH4) 2CO3 CO2+2NH3·H2O2NH4++CO32-(19)与少量氨水反应: CO2+NH3·H2O NH4HCO3 CO2+NH3·H2O NH4++HCO3-4.CaCO3(1)碳酸钙高温下分解: CaCO3+SiO2CaSiO3+CO2(2)溶于盐酸反应:CaCO 3+2HCl CaCl2+CO2↑+H2O CaCO3+2H+Ca2++CO2↑+H2O(3)碳酸钙高温下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑(4)碳酸钙与二氧化碳和水反应:CaCO 3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-5.Ca(HCO3)2(1)与盐酸反应:Ca(HCO 3)2+2HCl CaCl2+2CO2↑+2H2O HCO3-+H+CO2↑+H2O(2)与少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2O Ca2++HCO3-+OH-CaCO3↓+H2O(3)与过量氢氧化钠溶液:Ca(HCO 3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O(4)与石灰水:Ca(HCO 3)2+Ca(OH)22CaCO3↓+2H2O Ca2++HCO3-CaCO3↓+H2O(5)加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O(6)与碳酸钠溶液反应:Ca(HCO 3)2+Na2CO3CaCO3↓+2NaHCO3Ca2++CO32-CaCO3↓二、硅及其化合物方程式和离子方程式1、Si(1)与氧气反应:Si+O2SiO2(2)与氯气反应:Si+2Cl2SiCl4(3)与氟气反应:Si+2F 2SiF4(4)与氢氟酸反应:Si+4HF SiF4+2H2↑(5)与氢氧化钠溶液反应:Si+2NaOH+H 2O Na2SiO3+2H2↑ Si+2OH-+H2O SiO32-+2H2↑2、SiO2(1)与氧化钙反应:CaO+SiO2CaSiO3(2)与氢氧化钠溶液反应:2NaOH+SiO 2Na2SiO3+H2O 2OH-+SiO2SiO32-+H2O(3)与氢氟酸反应:SiO 2+4HF SiF4+2H2O(4)与碳酸钠反应:Na2CO3+SiO2Na2SiO3+CO2↑(5)与碳酸钙反应:CaCO3+SiO2CaSiO3+CO2(6)与碳单质反应:SiO2+3C SiC+2CO↑3、SiCl4(1)与氢气反应:SiCl4+2H2Si+4HCl(2)与氧气反应:SiCl4+O2Si O2+2Cl24、H2SiO3(1)与氢氧化钠溶液反应:H 2SiO3+2NaOH Na2SiO3+2H2O H2SiO3+2OH-SiO32-+2H2O(2)受热分解:H2SiO3SiO2+H2O5、Na2SiO3(1)与稀硫酸反应:Na 2SiO3+H2SO4Na2SO4+H2SiO3↓ SiO32-+2H+H2SiO3↓(2)与二氧化碳和水反应:Na 2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓三、氮及其化合物方程式和离子方程式1.N2(1)与氢气反应:N2+3H2错误!未找到引用源。
硅及其化合物方程式
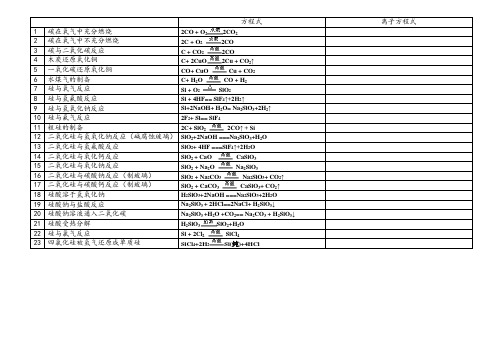
方程式离子方程式1 碳在氧气中充分燃烧2CO + O2CO222 碳在氧气中不充分燃烧2C + O22CO3 碳与二氧化碳反应 C + CO2CO24 木炭还原氧化铜C+ 2CuO2Cu + CO↑25 一氧化碳还原氧化铜CO+ CuO Cu + CO26 水煤气的制备C+ HO CO + H227 硅与氧气反应Si + O2SiO28 硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9 硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10 硅与氟气反应2F2+ Si== SiF411 粗硅的制备2C+ SiO2CO↑ + Si212 二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13 二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14 二氧化硅与氧化钙反应SiO+ CaO CaSiO3215 二氧化硅与氧化钠反应SiO+ Na2O Na2SiO3216 二氧化硅与碳酸钠反应(制玻璃)SiO+ Na2CO3Na2SiO3+ CO2↑217 二氧化硅与碳酸钙反应(制玻璃)SiO+ CaCO3CaSiO3+ CO2↑218 硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19 硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20 硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21 硅酸受热分解H2SiO3SiO2+H2O22 硅与氯气反应Si + 2ClSiCl4223 四氯化硅被氢气还原成单质硅SiCl+2H2Si(纯)+4HCl4。
江苏高考化学方程式集锦(全国通用)

江苏高考化学方程式集锦一、氯及其重要化合物1.H 2+Cl 2=2HCl (条件:点燃或光照)2.2Na +Cl 2=2NaCl (条件:点燃)3.Cu +Cl 2=CuCl 2(条件:点燃)4.2Fe +3Cl 2=2FeCl 3(条件:点燃)5.4HCl (浓)+MnO 2=MnCl 2+Cl 2↑+2H 2O (条件:加热)6.2NaCl +2H 2O = H 2↑+Cl 2↑+2NaOH (条件:通电)7.Cl 2+H 2O ?HCl+HClO8.Cl 2+2NaOH =NaCl +NaClO +H 2O9.2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O10.4HCl +Ca(ClO)2=CaCl 2+2H 2O +2Cl 2↑11.SO?+Cl ?+2H ?O=H ?SO ?+2HCl12.Cl 2+2NaBr=2NaCl+Br 213.Br 2+2NaI =I2+2NaBr 14.2KI+2FeCl 3=2FeCl 2+2KCl+I 2二、氮及其重要化合物1.N 2+3H 2?2NH 3(条件:高温、高压、催化剂)2.N 2+O 2=2NO(条件:放电)3.2NO+O2=2NO 24.3NO 2+H 2O=2HNO 3+NO5.4NO 2+2H2O+O 2=4HNO 36.2NO 2?N2O 47.2NO 2+2NaOH=NaNO 2+NaNO 3+H 2O8.NH 3+H 2O ?NH3·H 2O 9.4NH 3+5O 2=4NO+6H 2O(条件:高温、高压、催化剂)10.NH 3+HCl=NH4Cl 11.NH 4Cl=NH3↑+HCl ↑(条件:加热)12.NH 4HCO3=NH 3↑+CO 2↑+H 2O(条件:加热)13.NH 3·H 20=NH 3+H 2O (条件:加热)14.Ca(OH)2 +2NH 4Cl=CaCl 2+2NH 3↑+H 2O (条件:加热)15.N 4H +H 2O ?NH 3·H 20+H (水解)16.4HNO3=4NO 2↑+O 2↑+H 2O(条件:光照或加热) 17.Cu+4HNO3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 18.3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO ↑+4H 2O19.C+4HNO 3(浓)=CO 2↑+4NO 2↑+2H 2O (条件:加热)三、氧、硫及其重要化合物1.3O2=2O3(条件:放电)2.2H2O2=2H2O+O2↑(条件:二氧化锰催化剂)3.2KMnO4+5H2O2+2H2SO4=K2SO4+MnSO4+5O2↑+2H2O4.2FeCl2+H2O2+2HCl=2FeCl3+2H2O5.S+Fe=FeS(条件:加热)6.S+2Cu=Cu2S(条件:加热)7.S+O2=SO2(条件:点燃)8.2SO2+O2?2SO3(条件:催化剂、加热)9.ZnS+2HCl=ZnCl2+H2S↑10.2H2S+SO2=3S↓+2H2O11.H2S+CuSO4=H2SO4+CuS↓(黑色)12.4FeS2+11O2=2Fe2O3+8SO2(条件:高温)13.2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O(条件:加热)14.2H2SO4(浓)+C=CO2↑+2H2O+2SO2↑(条件:加热)四、重要有机官能团的性质1.BrCH2-CH2Br+2NaOH HOCH2-CH2OH+2NaBr(条件:水溶液、加热)2.BrCH2-CH2Br+2NaOH CH CH+2NaBr+2H2O(条件:醇溶液、加热)3.2Na+CH3CH2OH CH3CH2ONa+H2↑4.C2H5OH+HCl C2H5Cl+H2O(条件:加热)5.2CH3CH2OH+O22CH3CHO+2H2O(条件:铜、加热)2CH3CHO+O22CH3COOH(条件:催化剂、加热)6.CH3CH2OH+CH3COOH→CH3COOCH2CH3+H2O(条件:浓H2SO4、加热)7.C6H5OH+Na2CO3→C6H5ONa+NaHCO38.C6H5OH+NaOH→C6H5ONa+H2O9.CH3CHO+2Ag(NH3)2OH→CH3COONH4+H2O+2Ag↓+3NH3CH3CHO+H2→CH3CH2OH(条件:催化剂、加热)10.2R-COOH+Na2CO3→2R-COONa+CO2↑+H2O(条件:加热)11.RCOOR'+NaOH→RCOONa+R'OH五、钠及其重要化合物1.2Na+O2=2Na2O2.2Na+O2=Na2O2(条件:点燃)3.2Na+2H2O=2NaOH+H2↑4.2Na?O?+2H?O=4NaOH+O?↑5.2Na2O2+2CO2=2Na2CO3+O26.2NaHCO3=Na2CO3+H2O+CO2↑(条件:加热)7.2NaHCO?+Ca(OH)2(不足)=Na2CO?+CaCO?↓+2H2O8.NaHCO+Ca(OH)2(足量)=CaCO?↓+NaOH+H2O六、镁、钙及其重要化合物1.Mg+2H2O=Mg(OH)2+H2↑(条件:加热)2.2Mg+O2=2MgO(条件:点燃)3.3Mg+N2=Mg3N2(条件:点燃)4.2Mg+CO2=2MgO+C(条件:点燃)5.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑6.2CaO2+2H2O=2Ca(OH)2+O2↑7.CaO+H2O=Ca(OH)28.CO2+Ca(OH)2═CaCO3↓+H2O七、铝及其重要化合物1.2Al+6HCl=2AlCl3+3H2↑2.2Al+2NaOH+H2O=2NaAlO2+3H2↑3.2Al+ Fe2O3=Al2O3+ 2Fe(条件:高温)4.Al2O3+6HCl=2AlCl3+3H2O5.Al2O3+2NaOH=2NaAlO2+H2O6.2Al?O?=4Al+3O?↑(条件:冰晶石、通电)7.Al(OH)3+NaOH=NaAlO2+2H2O8.Al(OH)3+3HCl=AlCl3+3H2O9.Al2(SO4)3+6NH3H2O=2Al(OH)3↓+3(NH4)2SO410.AlCl3+3NaOH=Al(OH)3↓+3NaCl11.AlCl3+3NaHCO3=3NaCl+ Al(OH)3↓+3CO2↑12.NaHCO3+NaAlO2+H2O=Al(OH)3↓+Na2CO313.AlCl?+3NaAlO?+6H?O=3NaCl+4Al(OH)?↓八、铁及其重要化合物1.3Fe+4H2O(g)=Fe3O4+4H22.Fe(不足)+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O3.3Fe(过量)+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O4.Fe2O3+6HNO3=2Fe(NO3)3+3H2O5.Fe3O4+8HCl=2FeCl3+FeCl2+4H2O6.Cu+2FeCl?=2FeCl?+CuCl?7.Fe+2FeCl3=3FeCl28.2FeCl3+H2S=2FeCl2+2HCl+S↓9.FeCl3+3H2O?3HCl+Fe(OH)3(胶体)10.FeCl3+3KSCN=Fe(SCN)3(血红色)+3KCl311.FeCl?+3NH?·H?O=Fe(OH)?↓+3NH?Cl12.2FeCl2+Cl2=2FeCl313.3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+2H2O+NO↑14.30FeCl2+6KMnO4+24H2SO4=3K2SO4+6MnSO4+20FeCl3+5Fe2(SO4)3+24H2O15.FeCl2+2NaOH=Fe(OH)2↓+2NaCl16.4Fe(OH)2+O2+2H2O=4Fe(OH)317.2Fe(OH)3=Fe2O3+3H2O(条件:加热)九、碳、硅及其重要化合物1.C+4CuO=2Cu2O+CO2↑(条件:高温)2.C+H2O(g)=CO+H2(条件:高温)3.CuO+CO=Cu+CO2(条件:高温)4.3CO+Fe2O3=2Fe+3CO2(条件:高温)5.NaOH+CO2(过量)=NaHCO36.2NaOH+CO2(不足)=Na2CO3+H2O7.2NaOH(足量)+Ca(HCO3)2=CaCO3↓+Na2CO3+2H2O8.NaOH(不足)+Ca(HCO3)2=CaCO3↓+NaHCO3+H2O9.2NaHCO3=Na2CO3+H2O+CO2↑(条件:加热)10.SiO2+4HF=SiF4↑+2H2O11.SiO2+2NaOH=Na2SiO3+H2O12.SiO2+2C=Si(粗硅)+2CO↑(条件:高温)13.Si(粗硅)+2Cl2=SiCl4(条件:加热)14.SiCl4+2H2=Si(纯硅)+4HCl(条件:高温)15.Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3。
高中化学全部离子方程式大全总结高考必备

高中全部化学离子方程式总结钠及其化合物*1 、钠与水反应: 2Na ++2H 2O=2Na+–+2OH +H 2↑2+2、钠与硫酸铜溶液: 2Na+2H 2O+Cu =Cu(OH) 2↓+H 2↑++3、钠与稀硫酸: 2Na+2H =2Na+ H 2↑*4、过氧化钠与水反应: 2Na2 O2+2H 2O=4Na +–+4OH +O 2↑碳、硅及其化合物*1、碳酸氢钠溶液与强酸溶液混合:HCO3-+H + =CO2↑+H 2O*2、碳酸氢钠溶液与氢氧化钠溶液:HCO3-–2–+ OH = H 2O+CO33、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2+ +2OH –=CaCO3↓ +2H 2O+CO 32–4、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO 3-+OH –=CaCO3↓ +H 2O*5 、澄清石灰水通入少量CO2:Ca2+ +2OH –+CO2 =CaCO3↓ +H 2O*6 、澄清石灰水通入过量CO2–-:OH +CO2=HCO37、碳酸氢钠溶液与少量石灰水反应: Ca 2+–-=CaCO3↓+CO 32–+2OH +2HCO3+2H 2O -–2+8、碳酸氢钠溶液与过量石灰水反应:HCO3 +OH +Ca =CaCO3↓+H 2 O2–+-*9 、碳酸钠溶液与少量盐酸反应:CO3+H =HCO3*10、碳酸钠溶液与过量盐酸反应:2 –+=CO 2↑+H 2O CO3+2H*11、向氢氧化钠溶液中通入少量的– 2 –CO2:CO2+2OH =CO 3 +H 2O*12、向氢氧化钠溶液中通入过量的–-CO2:CO2+OH =HCO313、碳酸氢铵溶液中加入过量氢氧化钠溶液:++HCO3-–2–NH4+2OH =NH 3↑ +CO3+2H 2O*14、碳酸钙与盐酸反应: CaCO3+2H + =Ca 2+ +CO 2↑ +H 2O*15、碳酸钙与醋酸反应: CaCO3+2CH 3COOH=Ca2+ +2CH 3COO-+CO 2↑ +H 2O*16、澄清石灰水与稀盐酸反应: H+ +OH –=H 2O*17、碳酸氢盐溶液与醋酸溶液混合: HCO3-+CH3 COOH=CO2↑+H 2O+CH 3COO-*18、醋酸与氢氧化钾溶液反应:CH3 COOH+OH-=CH 3COO-+H 2 O*19、醋酸与氨水反应: CH3COOH+NH3 ?H2O=CH 3 COO-+NH 4+ +2H 2O*20、二氧化硅与氢氧化钠溶液: SiO2 + 2OH -=SiO 32-+H2O*21、硅酸钠溶液中通入二氧化碳: SiO32- + CO 2= H 2SiO3↓+ CO32–氮及其化合物1、单质铁溶于过量稀硝酸中(NO) :Fe+NO 3-+4H + =Fe 3+ +NO ↑+2H 2O2、过量单质铁溶于稀硝酸中(NO) :3Fe+2NO 3-+8H + =3Fe 2+ +2NO ↑ +4H 2 O *3 、单质铜与稀硝酸反应:3Cu+2NO 3-+8H + =3Cu 2+ +2NO ↑+4H 2O*4 、单质铜与浓硝酸反应:Cu+2NO 3-+4H + =Cu 2+ +2NO 2↑+2H 2O5、铜片插入硝酸银溶液:2Ag+ +Cu=2Ag+Cu 2+6、用氨水吸收少量 SO2:SO2+2NH 3+H 2O=2NH 4++SO32-7、用氨水吸收过量的 SO2: NH3+H 2O=NH 4+ +HSO 3-*8、氯化铵与氢氧化钠两种浓溶液混合加热:NH4+ +OH - =NH 3↑+H 2O*9、氯化铵与氢氧化钠两种稀溶液混合: NH4++OH - = NH 3·H2O*10、氨水与稀盐酸: NH3·H2O+H + = NH 4++H2O*11、硝酸银与盐酸及可溶性盐酸盐溶液: Ag+ +Cl -=AgCl ↓* 12、NO2溶于水:3NO2 +H 2 O=2H + +2NO 3-+NO ↑硫及其化合物*1、硫酸镁溶液跟氢氧化钡溶液反应:2+–2++SO2–Ba+2OH +Mg4=BaSO 4↓+Mg(OH) 2↓*2、硫酸溶液跟氢氧化钡溶液反应:2+–+2–Ba +2OH +2H+SO 4 =BaSO 4↓+2H 2O*3、硫酸氢钠溶液与氢氧化钡反应至中性:2H+ +SO 42–+2OH –+Ba 2+ =2H 2O+BaSO4↓*4、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:++SO42 ––2+=BaSO4 ↓+H2O H+OH +Ba*5、硫酸铝钾溶液中加入过量的氢氧化钡溶液: Al3+ +2SO 42- +2Ba 2+ +4OH -= 2BaSO 4↓+[Al(OH) 4] –*6、氢氧化镁与稀硫酸反应: Mg(OH) 2+2H + =Mg 2+ +2H 2O*72–+=H 2S↑、硫化钠与盐酸反应: S +2H*8、硫化钠溶液中加入溴水:2––S +Br 2=S ↓+2Br*9、氯化钡溶液与硫酸反应:Ba2+ +SO 42-=BaSO4↓卤素单质及其化合物1、电解饱和食盐水:2Cl- +2H 2 O =2OH -+H 2↑ +Cl 2↑*2、二氧化锰与浓盐酸共热:MnO2+2Cl -+4H + =Mn 2+ +Cl 2↑+2H 2O *3、氯气通入冷的氢氧化钠溶液中:Cl2+2OH -=Cl -+ClO -+H2O4、氯气通入热的氢氧化钾溶液中:3Cl2+6OH -=5Cl -+ClO 3-+3H 2O*5、次氯酸钙溶液通入过量的二氧化碳: ClO-+H 2O+CO2= +HCO 3-*6、次氯酸钠溶液中加入稀盐酸:ClO-+H + = HClO*7、碘化钾溶液中加入氯水:2I -+Cl2=I+2Cl -2*8、氯气通入水中:Cl2+H 2O=H + +Cl -+HClO9、亚硫酸钠溶液中加入溴水:SO32- +H 2O+Br 2 =SO 42- +Br -+2H + *10 、二氧化硫通入溴水中: SO2+Br 2+2H 2O=4H + +2Br -+SO 42-*11 、溴化钠溶液中加入氯水:2Br-+Cl 2=Br 2+2Cl -12、亚硫酸溶液中加入氯水:H2SO3+Cl2+H 2O=4H + +2Cl -+SO42-13、向碘化亚铁溶液通入少量氯气:2I -+Cl 2=I 2 +2Cl -铝及其化合物*1、铝和盐酸反应: 2Al+6 H + =2Al 3+ +3H 2↑*2、铝跟氢氧化钠溶液反应:2Al+2OH ––+6H 2 O=2[Al(OH)4] +3H 2↑*3–4 ]–、氧化铝溶于强碱溶液: Al2O3+2OH +3H 2O=2[Al(OH)*4、氧化铝溶于强酸溶液: Al2O3+6H + =2Al 3+ +3H 2 O*5、氢氧化铝与氢氧化钠溶液: Al(OH) 3+OH –=[Al(OH) 4] –*6、氢氧化铝与盐酸溶液反应: Al(OH) 3+3H + =Al 3+ +3H2O*7、四羟基合铝酸钠溶液中加入少量盐酸:[Al(OH) 4] –+H + =Al(OH) 3↓+H 2O *8、四羟基合铝酸钠溶液中加入过量盐酸:[Al(OH) 4] –+4H + =Al 3+ +4H2O*9、氯化铝溶液中加入少量氢氧化钠溶液:Al 3+–+3 OH = Al(OH) 3↓*10 、氯化铝溶液中加入过量氢氧化钠溶液:Al 3+––+4 OH =[Al(OH) 4 ]*11 、四羟基合铝酸钠溶液中通入足量二氧化碳:[Al(OH) 4] –+CO2= Al(OH) 3↓+HCO 3–*12 、氯化铝溶液中加入过量氨水:Al3+ +3NH 3?H2O=Al(OH) 3↓ +3NH 4+铁及其化合物*1 、金属铁溶于盐酸中: Fe+2H + =Fe 2+ +H 2↑*2 、铁粉与氯化铁溶液反应:Fe+2Fe 3+ =3Fe 2+*3 、铜与氯化铁溶液反应:Cu+2Fe 3+ =Cu 2+ +3Fe 2+*4、氯化亚铁溶液中通入氯气: 2Fe2+ +Cl 2 =2Fe 3+ +2Cl –5、氯化铁溶液中滴加少量硫化钠溶液:2Fe3+ +S 2–=S↓ +2Fe 2+*6、氯化铁溶液中滴加少量碘化钾溶液:3+–2++I 2 2Fe+2I =2Fe*7、氯化铁溶液与氢氧化钠溶液反应:Fe3+ +3OH –=Fe(OH) 3↓3++ *8 、氯化铁溶液跟过量氨水反应:Fe+3NH 3?H2O=Fe(OH) 3↓+3NH 4 *9 、氯化铁溶液加入碘化钾溶液:2Fe3+ +2I -=2Fe 2+ +I 2+3+*11 、用氯化铁与沸水反应制氢氧化铁胶体:Fe3+ +3H 2 O= Fe(OH) 3(胶体) +3H +2+--12、向溴化亚铁溶液通入足量的氯气:2Fe +4Br +3Cl2 =2Fe3++2Br 2+6Cl13、向溴化亚铁溶液通入少量氯气:2Fe2+ +Cl 2=2Fe 3+ +2Cl -1.某同学在观看电视广告时,对“朴雪”口服液中含有Fe2+或 Fe3+产生了浓厚兴趣,他采取了下列做法,你认为不合理的是()A.由于维生素 C 具有还原性,可以和朴雪口服液同时服用B.在检验铁的价态时,该同学先滴入KSCN 溶液后滴入氯水,能判断出铁元素的价态C.在检验铁元素的价态时,该同学先滴入氯水,后滴入KSCN 溶液 [来源 :Z*xx*] D.Cl2能够将 Fe2+氧化为 Fe3+2.下列各组离子,能在溶液中大量共存的是()A. Na +、 Mg 2+、[Al(OH)4]-、Br-.+、 Fe2+、SO42-、 NO3-B HC.K ++2-、OH-2+、Al3+--、NH4、CO3D. Ca、NO3、Cl.某溶液中可能含有2-2--。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳及其化合物的方程式
一、碳
1、碳在少量的氧气中燃烧:2C+O22CO
2、碳在足量的氧气中燃烧:C+O2CO2
3、碳和硫蒸气高温反应:C+2S CS2
4、碳和氧化铁在高温下反应:2Fe2O3+3C2Fe+3CO2↑
5、碳粉与氧化铜共热:2CuO+C2Cu+CO2↑
6、碳和水蒸气高温反应:C+H2O CO+H2
7、碳和二氧化碳在高温下反应:C+CO22CO
8、碳与浓硫酸共热:C+2H2SO4CO2↑+2SO2↑+2H2O
9、碳与浓硝酸共热:C+4HNO3CO2↑+4NO2↑+2H2O
10、碳与稀硝酸共热:3C+4HNO33CO2↑+4NO ↑+2H2O
11、工业上制备粗硅:SiO2+2C Si+2CO↑
12、工业上制备金刚砂:SiO2+3C SiC+2CO↑
13、工业上制备碳化钙:CaO+3C CaC2+CO↑
二、一氧化碳
1、一氧化碳在氧气中燃烧:2CO+O22CO2
2、一氧化碳气体和氧化铁在高温下反应:Fe2O3+3CO2Fe+3CO2
3、一氧化碳通过灼热的氧化铜:CuO+CO Cu+CO2
4、一氧化碳和水蒸气反应:CO+H2O CO2+H2
三、二氧化碳
1、镁在二氧化碳中燃烧:2Mg+CO22MgO+C
2、碳和二氧化碳在高温下反应:C+CO22CO
3、氧化钠与二氧化碳反应:Na2O+CO2Na2CO3
4、氧化钙与二氧化碳反应:CaO+CO2CaCO3
5、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑
6、二氧化碳和水反应:CO2+H2O H2CO3
7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O
2OH-+CO2CO32-+H2O
8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3
OH-+CO2HCO3-
9、工业上生产碳铵:NH3+CO2+H2O NH4HCO3
10、向澄清石灰水中通入二氧化碳:Ca(OH)2+CO2CaCO3↓+H2O
Ca2++2OH-+CO2CaCO3↓+H2O
11、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3
CO32-+CO2+H2O2HCO3-
12、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3
2Na++CO32-+CO2+H2O2NaHCO3↓13、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO3
2AlO2-+CO2+3H2O2Al(OH)3↓+CO32-14、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3
AlO2-+CO2+2H2O Al(OH)3↓+HCO3-15、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3
SiO32-+CO2+H2O CO32-+H2SiO3↓
16、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3
SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓17、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2
CaCO3+CO2+H2O Ca2++2HCO3-18、向苯酚钠溶液中通入二氧化碳气体:C6H5ONa+CO2+H2O C6H5OH+NaHCO3
C6H5O-+CO2+H2O C6H5OH+HCO3-19、向次氯酸钠溶液中通入二氧化碳气体:NaClO+CO2+H2O HClO+NaHCO3
ClO-+CO2+H2O HClO+HCO3-20、向次氯酸钙溶液中通入二氧化碳:
Ca(ClO)2+CO2+H2O CaCO3↓+2HClO
Ca2++2ClO-+CO2+H2O CaCO3↓+2HClO
四、碳酸钙
1、碳酸钙溶于稀盐酸:CaCO3+2HCl CaCl2+CO2↑+H2O
CaCO3+2H+Ca2++CO2↑+H2O
2、碳酸钙溶于醋酸:CaCO3+2CH3COOH(CH3COO)2Ca+CO2↑+2H2O
CaCO3+2CH3COOH2CH3COO-+Ca2++CO2↑+H2O
3、碳酸钙溶于氯化铁溶液:
3CaCO3+2FeCl3+3H2O2Fe(OH)3+3CaCl2+3CO2↑
3CaCO3+2Fe3++3H2O2Fe(OH)3+3CO2↑+3Ca2+
4、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑
5、高温分解碳酸钙:CaCO3CaO+CO2↑
6、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2
CaCO3+CO2+H2O Ca2++2HCO3-
五、碳酸氢钙
1、碳酸氢钙与盐酸反应:Ca(HCO3)2+2HCl CaCl2+2CO2↑+2H2O
HCO3-+H+CO2↑+H2O
2、向碳酸氢钙溶液中加入少量氢氧化钠溶液:
Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2O
Ca2++HCO3-+OH-CaCO3↓+H2O
3、向碳酸氢钙溶液中加入足量氢氧化钠溶液:
Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O
Ca2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O
4、向碳酸氢钙溶液中加入石灰水:Ca(HCO3)2+Ca(OH)22CaCO3↓+2H2O
Ca2++HCO3-CaCO3↓+H2O
5、加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O
6、碳酸氢钙溶液与碳酸钠溶液反应:Ca(HCO3)2+Na2CO3CaCO3↓+2NaHCO3
Ca2++CO32-CaCO3↓
硅及其化合物的方程式
一、硅
1、硅和氟气反应:Si+2F2SiF4
2、硅和氯气加热:Si+2Cl2SiCl4
3、硅与氧气加热:Si+O2SiO2
4、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑
Si+2OH-+H2O SiO32-+2H2↑
5、硅和氢氟酸反应:Si+4HF SiF4+2H2↑
二、二氧化硅
1、工业上用二氧化硅制备粗硅:SiO2+2C Si+2CO↑
2、工业上二氧化硅制备金刚砂:SiO2+3C SiC+2CO↑
3、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑
4、碳酸钠高温条件下与二氧化硅反应:Na2CO3+SiO2Na2SiO3+CO2↑
5、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O
2OH-+SiO2SiO32-+H2O
6、将二氧化硅溶于氢氟酸:SiO2+4HF SiF4+2H2O
7、二氧化硅高温与生石灰反应:CaO+SiO2CaSiO3
三、硅酸
1、硅酸溶于氢氧化钠溶液:H2SiO3+2NaOH Na2SiO3+2H2O
H2SiO3+2OH-SiO32-+2H2O
2、加热硅酸:H2SiO3SiO2+H2O
四、硅酸钠
1、硅酸钠溶液加入氯化钙溶液:Na2SiO3+CaCl2CaSiO3↓+2NaCl
SiO32-+Ca2+CaSiO3↓
2、硅酸钠溶液呈碱性:Na2SiO3+H2O NaHSiO3+NaOH
SiO32-+H2O HSiO3-+OH-
3、向硅酸钠溶液中加入盐酸:Na2SiO3+2HCl2NaCl+H2SiO3↓
SiO32-+2H+H2SiO3↓
4、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3
SiO32-+CO2+H2O CO32-+H2SiO3↓
5、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3
SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓6、硅酸钠溶液与氯化铵溶液混合:Na2SiO3+2NH4Cl2NaCl+H2SiO3↓+2NH3↑
SiO32-+2NH4+H2SiO3↓+2NH3↑。
