heyns重排
重排反应——精选推荐

重排反应有机化学中重排反应很早就被⼈们发现,研究并加以利⽤。
第⼀次被Wohler 发现的,由⽆机化合物合成有机化合物,从⽽掀开有机化学神秘⾯纱的反应—加热氰酸铵⽽得到尿素,今天也被化学家归⼊重排反应的范畴。
⼀般地,在进攻试剂作⽤或者介质的影响下,有机分⼦发⽣原⼦或原⼦团的转移和电⼦云密度重新分布,或者重键位置改变,环的扩⼤或缩⼩,碳架发⽣了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、⾃由基反应和周环反应四⼤类。
也有按照不同的标准,分成分⼦内重排和分⼦间重排,光学活性改变和不改变的重排反应,等等。
⼀、亲核重排重排反应中以亲核重排为最多,⽽亲核重排中⼜以1,2重排为最常见。
(⼀)亲核1,2重排的⼀般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发⽣亲核1,2重排的条件(1)转变成更稳定的正离⼦(在⾮环系统中,有时也从较稳定的离⼦重排成较不稳定的离⼦)(2)转变成稳定的中性化合物(3)减⼩基团间的拥挤程度,减⼩环的张⼒等⽴体因素。
(4)进⾏重排的⽴体化学条件:带正电荷碳的空p轨道和相邻的C-Z 键以及α碳和β碳应共平⾯或接近共平⾯(5)重排产物在产物中所占的⽐例不仅和正电荷的结果有关,⽽且和反应介质中存在的亲核试剂的亲核能⼒有关3.迁移基团的迁移能⼒(1)多由试验⽅法来确定基团的固有迁移能⼒(2)与迁移后正离⼦的稳定性有关(3)邻位协助作⽤(4)⽴体因素4.亲核1,2重排的⽴体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进⾏迁移的相对时机5.记忆效应:后⼀次重排好像和第⼀次重排有关,中间体似乎记住了前⼀次重排过程(⼆) 亲核重排主要包括基团向碳正离⼦迁移,基团向羰基碳原⼦迁移,基团向碳烯碳原⼦迁移,基团向缺电⼦氮原⼦转移,基团向缺电氧原⼦的迁移,芳⾹族亲核重排,下⾯就这六种迁移作简要介绍:1.基团向碳正离⼦迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)⽚那醇重排:邻⼆醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)⼆烯酮-酚重排:4,4-⼆取代环⼰⼆烯酮经酸处理重排成3,4-⼆取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作⽤⽣成⾼⼀级的同系物(6)烯丙基重排:烯丙基系统中双键发⽣位移的反应2.基团向羰基碳原⼦迁移:(1) Benzil-Benzilic Acid重排:α-⼆酮经强碱处理会发⽣重排,⽣成α-羟基⼄酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另⼀种酮3.基团向碳烯碳原⼦迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成⾼⼀级同系物的⽅法(2) 其他的碳烯重排反应,主要是1,2氢迁移⽣成烯4.基团向缺电⼦氮原⼦转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上⽆取代基酰胺经溴及碱处理,脱羰⽣成伯胺(3)Curtius重排:酰基叠氮热分解⽣成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,⽣成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍⽣物经类似Hoffmann的重排⽣成少⼀个碳的胺(6)Neber重排:肟酮的磺酸酯在⼄醇钾处理后⽔解⽣成α-氨基酮5.基团向缺电氧原⼦的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原⼦迁移到氧原⼦上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作⽤,在分⼦中插⼊氧⽣成酯的反应6.芳⾹族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺⼆、⾃由基重排反应1.1,2迁移:⽐正离⼦重排反应少得多,主要发⽣在:(1)某些双⾃由基的1,2-烷基和氢(2)烯基(迁移的⼄烯基若是环的⼀部分,则发⽣重排)2.⾮1,2迁移:多发⽣1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质⼦化N-卤化胺经热分解或光解形成六氢吡啶等的反应。
食品中的美拉德反应及其影响

当pH<7时,果糖基胺进1, 2-烯醇化反应,脱水生成羟甲基糠醛( hydroxymethylfurfural HMF) ,HMF的积累与褐变速度密切相关。当pH≥7时存在两个反应: 一是发生2, 3-烯醇化形成还原酮( reductones)和二羰基化合物;二是发生裂解反应生成二乙酰、乙酸、丙酮醛等。这些产物都为高活性的中间体,还原酮可进一步脱水并与胺类物质缩合生成类黑素。氨基酸在二羰基化合物存在下可发生脱羧、脱氨作用成为少1个碳的醛,氨基则转移到二羰基化合物上形成α-氨基酮,该反应也称为斯特勒克(Strecher)降解反应。
Maillard反应的研究中,得到了较大水溶解性和较强抗氧化能力的反应产物。
3Ma illa rd反应对食品加工性能的影响
蛋白质与糖类物质通过Maillard反应的羰氨缩合作用,可对蛋白质的溶解性能、乳化性能和抗氧化性能产生一定的影响。
3.1溶解性
Chung等通过壳聚糖-多糖的Maillard反应来增加壳聚糖的水溶性,特别是在中性或碱性溶液中的溶解性能。且pH一定时,壳聚糖-葡萄糖胺衍生物的溶解性比酸溶性的壳聚糖更好。同时壳聚糖—葡萄糖胺尚具有较强的金属离子螯合性。赵希荣在利用壳聚糖作为氨基供应体与含醛基的葡萄糖间发生
2.1.2 氨基化合物 氨基酸的种类、结构不同会导致反应速度的很大差异,如氨基酸中的氨基在ε-位或末位比在α-位反应速度快 ,碱性氨基酸比酸性氨基酸的反应速度要快。
2.2 温度
Maillard反应受温度的影响很大, 温度每变化10℃,褐变速度便相差3~5倍;同时Yu-Ting等在ε-聚赖氨酸(ε-polylysine,ε-PL)-葡聚糖的反应中,发现在温度大于80℃时反应速度较快,小于60℃时反应速度较慢。
分子重排-亲核重排

重排反应
反应中原子或基团迁移使碳架的位置发生变化,称 为重排反应。
W A
*A-迁移起点原子
W B A B
W-迁移基团/原子
B-迁移终点原子
重排反应一般分为三步: 生成活性中间体;重排;生成消去和取代产物。
(碳正离子,碳烯,氮烯,碳负离子,自由基等)
根据反应机理中迁移终点原子上的电子多少,将重排反应分为:
O
KOBr&H2COOH
O C NH C O
KOBr + 2KOH
O COH NH2
缺电子重排(亲核重排)
-Curtius(库尔修斯)重排
缺电子重排(亲核重排)
-Schmidt重排
缺电子重排(亲核重排)
-Schmidt重排
§1.缺电子重排(亲核重排)
-Lossen重排
周环反应中的σ键迁移反应也是常见的重排反应。
环氧丙烷重排
缺电子重排(亲核重排)
机理 1.缺电子中心的创建
CH3CH2CH2CH2OH H
+
H CH3CH2CH2CH2OH2 H2O H3CH2CHC CH2
2. 迁移基团带着一对电子迁移到缺乏电子中心
H H3CH2CHC CH2 H3CH2C C CH3
3.要满足迁移始点外层8电子结构,一般与亲核试剂结合或 通过β-消除完成重排过程
H3CH2C C CH3 H
+
CH3-CH=CH-CH3
缺电子重排(亲核重排)
碳正离子重排
CH3
Cl C CH2CH3 CH3
CH3C=CHCH3 CH3
OCH3 Cl
迁移基团迁移顺序:
>
>
> R3C- > R2CH-
有机化学重排反应-总结
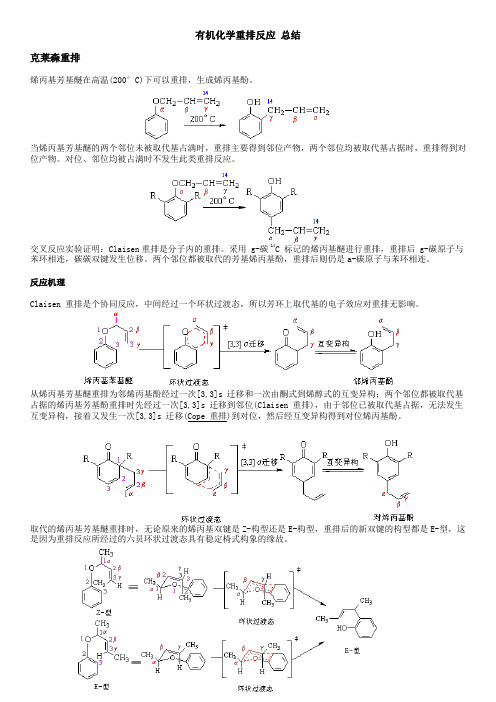
有机化学重排反应总结克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3.Bamberger,E.重排苯基羟胺〔N-羟基苯胺〕和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基〔或甲氧基〕苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
海因斯分子重排

海因斯分子重排
海因斯分子重排(Heyns rearrangement)是指α-酮醇或α-酰基醇在碱或酸催化下发生1,2-重排反应,生成β-酮醇或β-酰基醇的反应。
一、反应机理
海因斯分子重排的反应机理如下:
1.在碱或酸催化下,α-酮醇或α-酰基醇的羰基氧发生质子化,生成碳正离子中间体。
2.碳正离子中间体发生1,2-氢迁移,生成新的碳正离子中间体。
3.新的碳正离子中间体失去质子,生成β-酮醇或β-酰基醇。
二、反应条件
海因斯分子重排的反应条件通常如下:
1.催化剂:碱或酸,常用的碱催化剂包括氢氧化钠、氢氧化钾、碳酸钠等,常用的酸催化剂包括硫酸、盐酸、对甲苯磺酸等。
2.溶剂:水、乙醇、甲醇等。
3.温度:通常在室温或加热条件下进行。
三、应用
海因斯分子重排反应在有机合成中有着广泛的应用,可用于合成各种酮、醇、酸等化合物。
例如,可以通过海因斯分子重排反应合成β-酮醇,进而合成β-酮酸、β-羟基酮等化合物。
四、注意事项
海因斯分子重排反应对反应条件有一定的要求,例如催化剂的用量、反应温度等。
在进行该反应时,应注意控制反应条件,以获得最佳效果。
重排反应总结

重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)32(CH 3)33H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。
(完整版)美拉德反应(羰氨反应)实验报告

实验报告一美拉德反应(羰氨反应)陈晓占 200931305048一、实验目的(1)了解和掌握Maillard反应基本原理和条件控制(2)掌握Maillard反应的测定原理、方法和步骤(3)体会实验条件的控制和改变对实验结果的影响二、实验原理在一定的条件下,还原糖与氨基可发生的一系列复杂的反应,最终生成多种类黑精色素——褐色的含氮色素,并产生一定的风味,这类反应统称为美拉德反应(也称羰氨反应)。
美拉德反应会对食品体系的色泽和风味产生较大影响。
反应过程包括还原糖与胺形成葡基胺、Amadori重排(醛糖)或Heyns重排(酮糖)、经HMF,最后生成深色物质三个阶段。
三、实验方法1.试剂和仪器D-葡萄糖——50mgL-天门冬氨酸——50mgL-赖氨酸——50mgL-苯丙氨酸——50mgL-甲硫氨酸——50mgL-脯氨酸——50mgL-精氨酸——50mgL-亮氨酸——50mg电子天平、恒温水浴锅、锡箔纸2.步骤(1)向7根装有50mgD-葡萄糖的试管中添加7种不同的氨基酸(各管中添加量为50mg),再加入0.5mL水,充分混匀。
(2)嗅闻每根试管,描述其风味并记录感官现象。
(3)用铝箔纸将每根试管盖起来,放入100℃水浴中,加热45min,再在水浴中冷却到25℃,记录每根试管的气味(例如:巧克力味、马铃薯味、爆米花味等等)。
记录颜色0=无色,1=亮黄色,2=深黄色,3=褐色。
结论:不同的氨基酸对于美拉德反应产物具有很大的影响五、讨论1、导致食品体系发生褐变的常见因素有哪些?主要因素有:酶褐变和非酶褐变(1)酶褐变是由氧化酶对食品中多酚类物质氧化聚合而引起的褐变变化;(2)非酶褐变主要是由食品中的糖分、蛋白质、氨基酸等发生的化学变化所引起的,与酶没有直接关系,主要包括美拉德反应和焦糖化反应。
2、美拉德反应的机理和条件分别是什么?反应机理:还原糖与氨基发生的一系列复杂的反应,最终生成多种类黑精色素——褐色的含氮色素。
有机重排反应总结

有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质子化N-卤化胺经热分解或光解形成六氢吡啶等的反应。
美拉德反应实验报告
陈晓占 5048一、实验目的(1)了解和掌握Maillard反应基本原理和条件控制(2)掌握Maillard反应的测定原理、方法和步骤(3)体会实验条件的控制和改变对实验结果的影响二、实验原理在一定的条件下,还原糖与氨基可发生的一系列复杂的反应,最终生成多种类黑精色素——褐色的含氮色素,并产生一定的风味,这类反应统称为美拉德反应(也称羰氨反应)。
美拉德反应会对食品体系的色泽和风味产生较大影响。
反应过程包括还原糖与胺形成葡基胺、 Amadori重排(醛糖)或Heyns重排(酮糖)、经HMF,最后生成深色物质三个阶段。
三、实验方法1.试剂和仪器D-葡萄糖——50mgL-天门冬氨酸——50mgL-赖氨酸——50mgL-苯丙氨酸——50mgL-甲硫氨酸——50mgL-脯氨酸——50mgL-精氨酸——50mgL-亮氨酸——50mg电子天平、恒温水浴锅、锡箔纸2.步骤(1)向7根装有50mgD-葡萄糖的试管中添加7种不同的氨基酸(各管中添加量为50mg),再加入水,充分混匀。
(2)嗅闻每根试管,描述其风味并记录感官现象。
(3)用铝箔纸将每根试管盖起来,放入100℃水浴中,加热45min,再在水浴中冷却到25℃,记录每根试管的气味(例如:巧克力味、马铃薯味、爆米花味等等)。
记录颜色0=无色,1=亮黄色,2=深黄色,3=褐色。
五、讨论1、导致食品体系发生褐变的常见因素有哪些?主要因素有:酶褐变和非酶褐变(1)酶褐变是由氧化酶对食品中多酚类物质氧化聚合而引起的褐变变化;(2)非酶褐变主要是由食品中的糖分、蛋白质、氨基酸等发生的化学变化所引起的,与酶没有直接关系,主要包括美拉德反应和焦糖化反应。
2、美拉德反应的机理和条件分别是什么?反应机理:还原糖与氨基发生的一系列复杂的反应,最终生成多种类黑精色素——褐色的含氮色素。
具体步骤:注:截图选自龚平,阚建全美拉德反应产物性质的研究进展. 食品发酵工艺.2009年第35卷第4期(总第256期) 141影响因素有:羰基化合物、氨基酸化合物、pH值、水分、金属离子、亚硫酸盐但是本实验只能说明氨基酸化合物种类的不同对美拉德反应产物有影响。
有机化学中的重排反应

OH Ph Ph
O
Ph Ph
3. 碳烯(Carbene)重排
⑴ Wolff重排
α- 重氮甲酮在水、醇、或胺存在下,用Ag, Ag2O或光照 下催化,分解生成羧酸或酸酸衍生物——Wolff重排.
NO2 COCHN2 Ag2O H2O NO2 CH2CO2H
R C C L R C C -L R C C +H
+
Nu-
R Nu C C
R C C 重排 R C C -H
+
(CH3)3CCHCH3 OH
无水草酸 100—110 ℃
(CH3)3CCH=CH2 + (CH3)2CHC=CH2 CH3 31% 3%
+ (CH3)2C=C(CH3)2
反应机理是: 醇首先在酸作用下脱去羟基形成碳正离子,
CH2CH2CO2H H SO + HN3 2 4 CH2CH2CO2H
羧酸可以是直链脂肪族的一元或二元羧酸、脂环酸、芳香 酸等;与Hoffmann重排、Curtius反应相比,本反应胺的 收率较高。
例:
⑷.贝克曼(Beckmann)重排
①定义:醛或酮肟在 酸性条件下,重 排生成酰胺的反 应。(质子酸
H2SO4 , HCl, H3PO4 非质子酸PCl5, SOCl2, TsCl, AlCl3等)
C N
R C N
R' OH
H+ or PCl5
R'CONHR
OH
H+
+
C N
OH2
② 机理:反应被认 为是通过缺电子氮 进行的:
R C N R'
有机化学重排反应 总结

--有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用g-碳14C 标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
有机重排反应及机理小结

有机化学中的分子重排反应小结在一些有机反应中,反应底物分子在进攻试剂或反应介质的影响下,其中的一个原子或基团在分子中发生移位或碳骨架发生改变,从而生成与原反应物分子的组成相同但结构不同的新分子,这类反应成为分子重排反应。
根据反应历程不同,重拍反应可分为亲核重排、亲电重排、芳香重排及自由基重排。
一、亲核重排亲核重排是指反应物在亲电试剂的作用下,迁移基团带着成键电子对从一个原子迁移到另一个缺电子(带正电荷)的电子上,其反应过程为:a、反应底物在亲电试剂的作用下形成缺电子中心;b、该中心邻位碳原子上的基团带着成键电子对迁移到这个缺电子中心上,形成新的比较稳定的缺电子中心;c、缺电子中心与反应体系的负性部分结合生成重排取代产物或失去质子生成重排消除产物。
(一)涉及碳正离子的重排反应1、Pinacol重排邻二醇在无机酸作用下,发生脱水和碳骨架重排,生成不对称的醛或酮,此类反应称为Pinacol重排。
反应历程:醇羟基质子化后先失去一分子水形成一个缺电子中心——碳正离子,引起分子中烃基的亲核重排,然后失去一个质子形成羰基:在反应过程中,凡是能生成类似的碳正离子者,都能发生此类重排。
例如,α,β–卤代烃氨基醇和环氧化物、α-羟基酮等在相应的条件下的类似重排反应,该类反应称为半Pinacol重排。
例如:在Pinacol重排中,如果分子中四个R都相同,重排产物比较简单;当分子中四个R不相同时,重排产物不止一种,实际取得的产物取决于:反应过程中哪一个羟基脱掉后形成比较稳定的碳正离子,则该羟基优先被质子化。
形成的碳正离子的稳定性顺序为:p-CH3OC6H4 > C6H5 > 烷基> 氢当可迁移的集团为芳基、烷基或氢时,芳基优先于烷基优先于氢迁移,且芳基上有给电子集团时更有利于迁移。
例如:迁移基团的相对活性为:2、Wagner-Meerwein重排通过生成碳正离子中间体进行取代、消除和加成,并伴有碳骨架重排的反应称为Wagner-Meerwein重排。
食品中的美拉德反应及其影响

食品中的美拉德反应及其影响摘要:探讨了食品中发生的美拉德反应途径、底物、温度、水分活度、pH和金属离子等影响因素,同时讨论了抗菌性、抗氧化性和乳化性等食品功能性以及蛋白质的糖基化、溶解性和风味特性的修饰改进,并介绍了其对生物活性体的影响性以及丙烯酰胺等有害物质的生成与消除,丰富了食品化学理论并对食品加工生产应用有很好的指导意义。
美拉德反应(Maillard reaction) 又称羰氨反应(Amino-carbonyl reaction) ,是指羰基化合物(醛、酮、还原糖)与氨基化合物(氨基酸、蛋白质、胺、肽)经缩合、聚合反应生成高分子量聚合物——一类黑素(Melanoidin) 的反应, 由法国化学家Maillard 于1912年在将甘氨酸与葡萄糖的混合液共热时发现的,反应产物为棕色聚合物,因此,该反应又称“褐变反应(Browning reaction) ”,属非酶褐变反应(Non -enzymatic browning reaction) 。
1 Maillard反应机理美拉德反应可分成3个反应阶段,即初期( The early stage) 、中期( The advanced stage)和末期( The final stage)。
1.1 初期阶段还原糖的羰基和氨基酸的自由氨基(ε-NH2)缩合生成可逆的亚胺衍生物-薛夫碱( Schiff’s base),由于该物质不稳定即刻环化成N-葡萄糖基胺(N-substituted glycosylamine)。
N-葡萄糖基胺可在酸的催化下经过Amadori重排和Heys重排作用形成有反应活性的1-氨基-1-脱氧-2-酮糖(1-amino-1- deoxy-2-ketose) ,即酮糖基胺。
这一阶段基本上无色素或风味物质形成。
1.2 中期阶段当pH<7时,果糖基胺进1, 2-烯醇化反应,脱水生成羟甲基糠醛( hydroxymethylfurfural HMF) ,HMF的积累与褐变速度密切相关。
美拉德反应(羰氨反应)实验报告
实验报告一美拉德反应(羰氨反应)陈晓占 200931305048一、实验目的(1)了解和掌握Maillard反应基本原理和条件控制(2)掌握Maillard反应的测定原理、方法和步骤(3)体会实验条件的控制和改变对实验结果的影响二、实验原理在一定的条件下,还原糖与氨基可发生的一系列复杂的反应,最终生成多种类黑精色素——褐色的含氮色素,并产生一定的风味,这类反应统称为美拉德反应(也称羰氨反应)。
美拉德反应会对食品体系的色泽和风味产生较大影响。
反应过程包括还原糖与胺形成葡基胺、 Amadori重排(醛糖)或Heyns重排(酮糖)、经HMF,最后生成深色物质三个阶段。
三、实验方法1.试剂和仪器D-葡萄糖——50mgL-天门冬氨酸——50mgL-赖氨酸——50mgL-苯丙氨酸——50mgL-甲硫氨酸——50mgL-脯氨酸——50mgL-精氨酸——50mgL-亮氨酸——50mg电子天平、恒温水浴锅、锡箔纸2.步骤(1)向7根装有50mgD-葡萄糖的试管中添加7种不同的氨基酸(各管中添加量为50mg),再加入0.5mL水,充分混匀。
(2)嗅闻每根试管,描述其风味并记录感官现象。
(3)用铝箔纸将每根试管盖起来,放入100℃水浴中,加热45min,再在水浴中冷却到25℃,记录每根试管的气味(例如:巧克力味、马铃薯味、爆米花味等等)。
记录颜色0=无色,1=亮黄色,2=深黄色,3=褐色。
结论:不同的氨基酸对于美拉德反应产物具有很大的影响五、讨论1、导致食品体系发生褐变的常见因素有哪些?主要因素有:酶褐变和非酶褐变(1)酶褐变是由氧化酶对食品中多酚类物质氧化聚合而引起的褐变变化;(2)非酶褐变主要是由食品中的糖分、蛋白质、氨基酸等发生的化学变化所引起的,与酶没有直接关系,主要包括美拉德反应和焦糖化反应。
2、美拉德反应的机理和条件分别是什么?反应机理:还原糖与氨基发生的一系列复杂的反应,最终生成多种类黑精色素——褐色的含氮色素。
美拉德反应在食品中的应用

浙江工商大学研究生课程论文论文题目:美拉德反应在食品中的应用课程名称:高等有机化学专业名称:食品科学学号:1020000424姓名:陈方娟指导教师:周涛、韩晓祥、黄建颖成绩:日期:2010.11.10美拉德反应在食品中的应用摘要:本文通过对美拉德反应的机理及影响因素进行简述,且总结了美拉德反应在酒、牛奶等加工的作用,揭示了食品加工过程中的有机化学反应过程及影响因素,有利于更好的控制食品加工过程。
关键词:美拉德反应;影响因素;应用1912年,法国化学家Louis Maillard发现甘氨酸和葡萄糖混合加热的时候形成褐色物质,人们将此类反应命名为Maillard反应,又称为非酶褐变。
这类反应不仅影响食品的色泽,而且影响食品的风味,最近的研究发现,美拉德反应产物有清除自由基、抑制脂质氧化的作用,除此之外,产物还有抗诱变和诱发突变的作用。
Hodge等首先报道了有关美拉德反应产物(MRPs)具有防止植物油氧化的效果,Frnazke等也注意到MRPs具有提高人造奶油的氧化稳定性的功效。
直到20世纪80年代,MRPs抗氧化性才引起人们重视。
目前,MRPs已被看作功能食品成分,具有抗氧化、抗变态、抗菌、抗细胞毒素等功能。
在美拉德反应的模式系统中,啤酒、咖啡和焙烤食品里已发现美拉德反应产物MRPs具有高的抗氧化性能。
黑麦面包在焙烤过程抗氧化能力提高,其中MRPs 是主要的抗氧化物质;人参经蒸气处理后,MRPs含量增加,抗氧化能力显著增强;焙烤咖啡色泽越深,自由基清除能力越强;类黑精是MRPs主要颜色成分。
MRPs被用以代替酚类食用抗氧化剂,正逐渐引起人们的关注[1]。
1.美拉德反应简介1.1Maillard反应的机理Maillard反应是羰基化合物(尤其是还原糖)与胺、氨基酸、肽类、蛋白质等氨基化合物之间发生的反应。
热反应和长时间储藏都可以促使Maillard反应形成。
该反应通常分为三个阶段:第一个阶段是氨基酸和还原糖的缩合反应。
美拉德反应_实验报告

一、实验目的1. 了解和掌握美拉德反应的基本原理和条件控制;2. 掌握美拉德反应的测定原理、方法和步骤;3. 体会实验条件的控制和改变对实验结果的影响。
二、实验原理美拉德反应,又称羰氨反应,是指在一定的条件下,还原糖与氨基化合物发生的一系列复杂的反应。
该反应能够生成多种类黑精色素,即褐色的含氮色素,并产生一定的风味。
美拉德反应对食品体系的色泽和风味产生较大影响。
反应过程包括还原糖与胺形成葡基胺、Amadori重排(醛糖)或Heyns重排(酮糖)、经HMF,最后生成深色物质三个阶段。
三、实验材料与仪器1. 试剂:- D-葡萄糖:50mg- L-天门冬氨酸:50mg- L-赖氨酸:50mg- L-苯丙氨酸:50mg- L-甲硫氨酸:50mg- L-脯氨酸:50mg- L-精氨酸:50mg- L-亮氨酸:50mg2. 仪器:- 电子天平- 恒温水浴锅- 锡箔纸四、实验步骤1. 准备7根装有50mg D-葡萄糖的试管;2. 向每根试管中分别添加50mg的7种不同氨基酸,并加入0.5mL水,充分混匀;3. 嗅闻每根试管,描述其风味并记录感官现象;4. 用铝箔纸将每根试管盖起来,放入100℃水浴中,加热45min;5. 取出试管,观察并记录颜色变化;6. 将试管置于室温下冷却,继续观察并记录颜色变化。
五、实验结果与分析1. 随着加热时间的延长,各试管颜色逐渐变深,说明美拉德反应已发生;2. 不同氨基酸对美拉德反应的影响程度不同,其中L-赖氨酸和L-精氨酸对反应的促进作用最强;3. 实验过程中,部分试管出现独特的风味,如焦香味、甜香味等。
六、实验讨论1. 美拉德反应是食品加工中常见的反应,对食品的色泽和风味产生重要影响。
在食品工业中,合理控制美拉德反应条件,可提高食品品质;2. 本实验中,L-赖氨酸和L-精氨酸对美拉德反应的促进作用最强,可能与这两种氨基酸的化学结构有关;3. 实验过程中,部分试管出现独特的风味,这可能与美拉德反应产生的挥发性化合物有关。
人名反应重排反应

醛氧化的机理与此相似,但迁移的是氢负离子, 得到羧酸。
应用实例:
Bamberger,E.重排 (班伯格重排)
苯基羟胺(N-羟基苯胺)和稀硫酸一起加 热发生重排成对-氨基苯酚:
NHOH
H2SO4,H2O 98%
NH2 OH
在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基 (或甲氧基)苯胺:
反应机理:
当R为手性碳原子时,重排后手性碳原子的构 型不变:
Hofmann 重排(降解) (霍夫曼重排)
酰胺用溴(或氯)在碱性条件下处理转变为少一个 碳原子的伯胺:
Lossen 反应 (洛森反应)
异羟肟酸或其酰基化物在单独加热或在碱、脱水 剂(如五氧化二磷、乙酸酐、亚硫酰氯等)存在下加 热发生重排生成异氰酸酯,再经水解、脱羧得伯 胺:
HN COCH3
Cl N
HOCl 氯代
COCH3
HCl COCH3
Cl
+
Cl
又如将N-溴代-2,6-二甲基-乙酰苯胺溶于醋酸、 氯苯等溶液中也会发生重排成p-位及m-位溴代异 构体:
反应机理:
HN COCH3
Cl N
HOCl 氯代
H
COCH3
Cl- Cl N+
快 + HCl
重排反应
Arndt-Eister 反应 阿恩特-埃斯特尔反应
酰氯与重氮甲烷反应,然后在氧化银催化下与水 共热得到酸。
O
+ CH2N2
RC Cl
O
RCCHN2
Ag2O H2O
RCH2CO2H
反应机理:
重氮甲烷与酰氯反应首先形成重氮酮(1),(1) 在氧化银催化下与水共热,得到酰基卡宾(2), (2)发生重排得烯酮(3),(3)与水反应生成 酸,若与醇或氨(胺)反应,则得酯或酰胺。
赖氨酸-葡萄糖模拟体系中吡咯素生成条件的研究

赖氨酸-葡萄糖模拟体系中吡咯素生成条件的研究张瑛;袁鑫乐;王静【摘要】研究赖氨酸-葡萄糖(Lys-Glu)模拟体系中吡咯素的生成条件.构建赖氨酸-葡萄糖模拟体系,以吡咯素生成量为评价指标,采用高效液相色谱法(high performance liquid chromatography,HPLC)检测模型中吡咯素含量,在单因素试验的基础上采用Box-Behnken方法,通过响应面设计优化Lys-Glu模拟体系中吡咯素生成的最优条件,对吡咯素生成的加热时间、反应温度、缓冲溶液pH值、原料配比4个因素进行了探究.试验结果表明,加热时间、反应温度和原料中葡萄糖浓度对吡咯素的生成均有显著影响(P<0.05),并且Lys-Glu模拟体系在110℃,葡萄糖浓度0.5 mol/L、赖氨酸浓度0.6 mol/L,缓冲溶液pH值为7.4的条件下反应50 min,可得到吡咯素的最大生成量4.69μmol/L.【期刊名称】《食品研究与开发》【年(卷),期】2019(040)003【总页数】8页(P7-13,44)【关键词】食品加工;吡咯素;生成规律;响应面分析;高效液相色谱法【作者】张瑛;袁鑫乐;王静【作者单位】北京工商大学,北京100048;北京工商大学,北京100048;北京工商大学,北京100048【正文语种】中文食品加工中的热加工技术可以极大地改变食品的化学成分,尤其是加工过程发生的美拉德反应(maillard reaction)。
在美拉德反应中,还原糖的羰基与多肽或者蛋白质以及游离型氨基酸中的氨基最终生成棕色混合物[1-2]。
美拉德反应分为3个阶段,包括早期、晚期和末期[3]。
1984年Brownlee等科学家首次提出晚期糖基化终产物(advanced glycation end products,AGEs)的概念[4]。
AGEs是指在非酶条件下发生的美拉德反应,生成一类稳定、不可逆的化合物,能够通过膳食而进入人体[5]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
heyns重排重发内容,略有更新。
重排反应是有机合成中一种常见的反应。
根据反应机理,重排反应可分为基团迁移重排反应和环反应。
基团迁移重排反应反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
这类反应又可按价键断裂方式分为异裂和均裂,前者重要得多,其中尤以缺电子重排最为重要。
周环反应反应物因分子内共价键协同变化而发生重排的反应,有电环化反应和δ迁移反应。
下面对本已经发布过的重排反应进行汇总,便于小伙伴们查找学习。
点击反应标题可以查看详细内容。
一、 heyns重排 2酸或碱催化下醛糖的 N -糖苷(糖胺, glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为heyns重排 2。
二、 Baker-Venkataraman重排碱催化下邻酰氧基芳基酮重排得到相应的芳基β-二酮的反应被称为 Baker-Venkataraman重排。
β-二酮是非常重要的合成中间体,其可以用于合成色酮,黄酮,异黄酮和香豆素等。
此反应中常用的碱有:KOH, 叔丁醇钾的DMSO溶液,金属钠在甲苯中反应,KH或NaH,吡啶,三苯甲基钠。
三、Bamberger重排N-苯基羟胺在酸作用下重排为4-氨基苯酚的反应。
四、 Beckmann重排反应在酸催化下肟重排得到酰胺的反应,此反应与霍夫曼反应,Schmidt反应和Curtius 重排类似,反应中会形成带正电的氮原子,然后发生烷基迁移。
五、Brook重排反应该反应是1958年加拿大的化学家Brook发现报道的。
α-硅基氧负离子通过生成一个五配位硅中间体重排得到α-硅氧基碳负离子的反应称为 [1,2]-Brook重排,或 [1,2]-硅基迁移。
后来发现此类硅迁移反应普遍存在,因此 [1,n]-硅基由碳原子迁移到氧原子的反应统称为Brook重排。
六、Boulton–Katritzky重排加热条件下五元杂环重排和与其相连的三原子链重新生成新的五元环的反应。
七、Boyer-Schmidt-Aube重排(Boyer-Schmidt-Aube Rearrangement)叠氮与羰基化合物在路易斯酸的存在家发生重排,最终形成相同碳数酰胺的反应。
该反应经常被用于通过分子内反应合成生物碱骨架。
八、Carroll重排此反应是克莱森重排反应的变体,β- 酮酸烯丙酯通过阴离子辅助克莱森重排后脱羰基得到γ,δ- 不饱和酮的反应。
在Pd或者Ru催化的条件下,该反应能在温和的条件下进行,并且经常也被用于不对称中心的构建【 Shimizu, I.; Yamada, T.; Tsuji, J. Tetrahedron Lett. 1980, 21 , 3199. DOI:10.1016/S0040-4039(00)77444-2】。
丙二酸烯丙基酯也能作为该反应的底物。
Chan酰氧基乙酸酯重排反应强碱性条件下,酰氧基乙酸酯经过环氧化物中间体,重排生成2-羟基-3-酮酯的反应。
产物可以进一步氧化得到α,β-二酮酯。
九、查普曼重排反应(Chapman Rearrangement)O-芳基亚胺酯经过重排转化成芳香胺的反应。
十、 Ciamician–Dennstedt重排吡咯在强碱条件下与卤仿 (CHX 3 where X = Cl, Br, I)反应重排生成 3-卤代吡啶的反应。
此反应是由G.L. Ciamician在1881年首先发现,后来M.Dennstedt 利用甲醇钠催化吡咯和二碘甲烷反应制备得到吡啶,使此方法的应用范围更加广泛。
后来在此研究的基础上,利用吲哚和喹啉的方法也被发现。
因此此类反应都统称为Ciamician-Dennstedt重排反应。
此反应也会被看成非常规的 Reimer-Tiemann反应。
十一、 Claisen重排反应Claisen重排反应是由Rainer Ludwig Claisen在1912年发现,是第一个被发现的[3,3]-σ迁移重排。
此反应是强力生成碳碳键的反应,加热烯丙基烯基醚通过[3,3]-σ迁移重排生成γ,δ-不饱和羰基化合物的反应。
另外对位-Claisen重排, Belluš–Claisen r重排; Corey–Claisen反应, Eschenmoser–Claisen重排, Ireland–Claisen反应, Kazmaier–Claisen反应, Saucy–Claisen反应; orthoester Johnson–Claisen反应和Carroll重排都属于这个系列的反应。
Claisen重排反应是协同反应。
十二、 Ciamician–Dennsted重排吡咯和氯仿在氢氧化钠存在下反应制备3-氯吡啶的反应。
十三、 Cope重排反应反应属于[3,3]-σ单电子迁移重排,反应过程协同进行,反应可逆。
机理同克莱森重排。
十四、康福斯重排反应(Cornforth Rearrangement)4-位有羰基取代基的恶唑在加热条件下发生重排,噻唑也同样有相似的重排反应发生。
由澳大利亚化学家 John Cornforth(1917-)(1975年获化学诺奖)在1949年首先报道。
十五、 Curtius 重排酰基叠氮加热进行1,2-C-N迁移并放出氮气,生成异氰酸酯的反应被称为 Curtius重排。
反应中原位生成的异氰酸酯和各种亲核试剂反应,可以得到氨基甲酸酯,脲等各种N-酰基衍生物。
也可以直接水解得到伯胺。
十六、Curtius 重排合成胺及其衍生物Curtius 重排是一种常用的将羧酸转化为少一个碳的胺及相应衍生物的方法。
十七、 Demjanov重排一级胺转化为重氮化合物中间体经过C-C键迁移得到醇的反应。
十八、Dimroth重排反应杂环化合物的环内或环外杂原子和其取代基之间通过开环-关环交换位置异构化的反应被称为 Dimroth重排。
B. Rathke 在进行三嗪类化合物研究时首先发现了此类重排,但其没有对其机理进行解释。
1909年, O. Dimroth提出了三氮唑类化合物的重排机理。
上世纪50年代中期发现嘧啶类化合物也普遍存在此重排反应。
再到后期更多此重排反应被发现,许多含有氮原子的杂环都可以进行 Dimroth重排。
1963年,D.J. Brown和J.S. Harper发现了热催化的Dimroth重排。
十九、 Di-π-methane重排(Di-π-methane Rearrangement)在光照射下二烯发生重排,得到乙烯基环丙烷的反应。
在含有杂原子如O或者N,或者含有苯环取代基的底物也能进行该反应。
二十、 Dyotropic重排反应(dyotropic rearrangement)两个σ键发生协同性的组合变化进行的重排反应被称为dyotropic rearrangement标题图上部所示的被称为I型dyotropic rearrangement,也就是两个σ键重排后,取代基位置互换。
而下部的被称为II 型dyotropic rearrangement,重排后两个取代基相对位置不发生变化。
二十一、 Eschenmoser–Claisen酰胺缩酮重排N,O-乙烯酮缩酮进行[3,3]-单电子重排得到γ,δ-不饱和酰胺的反应。
由于Eschenmoser是基于Meerwein对于酰胺交换的研究而发现此反应,此反应也被称为Meerwein–Eschenmoser–Claisen重排。
二十二、 Favorskii重排可以烯醇化的α-卤代酮在烷氧基,羟基或胺催化下重排分别生成酯,羧酸或酰胺的反应。
环状底物的Favorskii重排quasi-Favorskii(类Favorskii)重排反应二十三、 Ferrier重排反应在Lewis酸催化下 O -取代的烯糖衍生物通过烯丙位重排与 O -, S -, C - N -, P -和卤代亲核试剂反应得到2,3-不饱和糖苷类化合物的反应。
1914年Emil Fischer在水中加热三- O -乙酰基-D-烯糖时发现了此反应。
后来经过Robin Ferrier 等人的系统研究,扩展到 O -, S -, C - N -, P -和卤代等亲核试剂。
通常情况下,此类反应要用路易斯酸催化,三氟化硼乙醚是最常用的催化剂,另外InCl3,SnCl4,ZnCl2等也会用于此反应。
常用溶剂有:二氯甲烷和甲苯等。
生成的糖苷化合物主要是直立键产物(α:β=7:1)。
Ferrier碳环化反应路易斯酸催化下一锅法高效地将5,6-不饱和呋喃糖转化为取代环己酮类化合物的反应。
此反应也被称为 Type II Ferrier rearrangement(与之相对的heyns重排 8 ,此反应可以用于合成手性的肌糖类化合物,如胺基肌糖,脱氧肌糖,不和肌糖,选择性- O -取代肌糖和肌糖膦酸酯等等。
反应底物可以很容易通过糖类合成,进而合成各种手性多取代的环己酮类化合物。
大多数反应,可以高产率的得到非对映异构体。
路易斯酸只需要催化量,因此此反应中酸敏感的复杂化合物不受影响。
二十四、 Fries重排Lewis酸催化下酚酯或酚酰胺重排得到 2-或 4-酮基苯酚的反应。
也被称为Fries- Finck重排。
二十五、 Fritsch–Buttenberg–Wiechell重排反应1,1′-二芳基-2-溴代烯烃在BuLi等强碱作用下发生α消除、通过卡宾重排形成炔烃的反应。
二十六、 Gabriel–Colman重排芳基邻二酰亚胺基乙酸酯在碱性条件下重排得到1,4-二酚异喹啉类似物的反应。
二十七、 Hofmann重排伯胺的酰胺通过次卤化物处理经过异氰酸酯中间体生成相应的伯胺的反应。
Hofmann–Löffler–Freytag反应二十八、 Lossen重排碱处理 O -酰基羟肟酸重排得到异氰酸酯的反应。
二十九、 [1,2]-Meisenheimer重排叔胺的N-氧化物通过[1,2]-σ单电子重排得到 O -取代羟胺的反应。
[2,3]-Meisenheimer重排烯丙基叔胺的N-氧化物通过[2,3]-σ单电子重排得到 O -烯丙基羟胺的反应。
三十、 Meyer–Schuster重排通过1,3-迁移α-炔基仲醇或叔醇异构化得到α,β-不饱和羰基化合物的反应。
当炔基是端基炔时,产物是醛,而非端基炔则为酮。
此反应机理与Rupe重排类似。
三十一、 Mislow–Evans重排反应烯丙型亚砜在P(OMe)3存在下加热,发生[2,3]-σ-单电子重排,得到次磺酸酯,进而在P(OMe)3作用下转化为烯丙醇的反应。
此反应立体选择性高。
此反应也可以利用烯丙位硫醚为底物,通过氧化,重排一锅法得到烯丙醇类产物。
常见的氧化剂有高点酸钠,MoO5-Pyr-HMPA(MoOPH)和mCPBA。
此反应的 E:Z 选择性和取代基的大小有关,取代基越大,选择性越好。
