(完整版)高二化学选修3第三章 晶体结构与性质习题
(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题
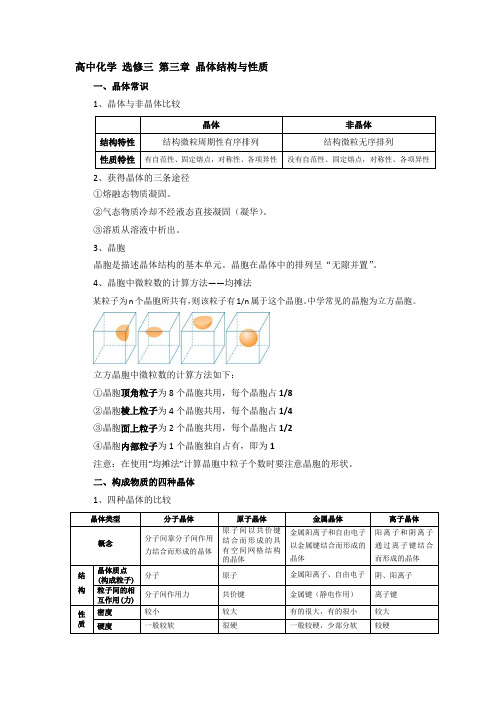
高中化学选修三第三章晶体结构与性质一、晶体常识1、晶体与非晶体比较2、获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
3、晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4、晶胞中微粒数的计算方法——均摊法某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学常见的晶胞为立方晶胞。
立方晶胞中微粒数的计算方法如下:①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2④晶胞内部粒子为1个晶胞独自占有,即为1注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。
二、构成物质的四种晶体1、四种晶体的比较晶体类型分子晶体原子晶体金属晶体离子晶体熔沸点很低很高一般较高,少部分低较高溶解性相似相溶难溶于任何溶剂难溶于常见溶剂(Na等与水反应)大多易溶于水等极性溶剂导电传热性一般不导电,溶于水后有的导电一般不具有导电性(除硅)电和热的良导体晶体不导电,水溶液或熔融态导电延展性无无良好无物质类别及实例气态氢化物、酸(如HCl、H2SO4)、大多数非金属单质(如P4、Cl2)、非金属氧化物(如SO2、CO2,SiO2除外)、绝大多数有机物(有机盐除外)一部分非金属单质(如金刚石、硅、晶体硼),一部分非金属化合物(如SiC、SiO2)金属单质与合金(Na、Mg、Al、青铜等)金属氧化物(如Na2O),强碱(如NaOH),绝大部分盐(如NaCl、CaCO3等)(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。
如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
人教版高中化学选修3第三章《晶体结构与性质》测试卷(含答案解析版)

人教版高中化学选修3第三章《晶体结构与性质》测试卷一、单选题(共15小题)1.金属具有的通性是①具有良好的导电性②具有良好的传热性③具有延展性④都具有较高的熔点⑤通常状况下都是固体⑥都具有很大的硬度A.①②③B.②④⑥C.④⑤⑥D.①③⑤2.为了确定SbCl3、SbCl5是否为离子化合物,以下分析正确的是()A.常温下,SbCl3、SbCl5均为液体,说明SbCl3和SbCl5都是离子化合物B. SbCl3、SbCl5的熔点依次为73.5 ℃、2.8 ℃。
说明SbCl3、SbCl5都不是离子化合物C.SbCl3、SbCl5溶液中,滴入酸化的AgNO3溶液,产生白色沉淀。
说明:SbCl3、SbCl5都是离子化合物D. SbCl3、SbCl5的水溶液都可以导电。
说明:SbCl3、SbCl5都是离子化合物3.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是()A.该晶体属于离子晶体B.晶体的化学式为Ba2O2C.该晶体晶胞结构与NaCl相似D.与每个Ba2+距离相等且最近的Ba2+共有12个4.下列有关离子晶体的数据大小比较不正确的是()A.熔点:NaF>MgF2>AlF3B.晶格能:NaF>NaCl>NaBrC.阴离子的配位数:CsCl>NaCl>CaF2D.硬度:MgO>CaO>BaO5.在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高。
由此判断下列各组金属熔沸点高低顺序,其中正确的是()A. Mg>Al>Ca B. Al>Na>LiC. Al>Mg>Ca D. Mg>Ba>Al6.下列关于晶体的说法正确的组合是()①组成金属的微粒是原子②在晶体中只要有阳离子就一定有阴离子③金刚石、Si,C,NaF、NaCl、H2O、H2S晶体的熔点依次降低④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合⑦晶体中分子间作用力越大,分子越稳定⑧氯化钠熔化时离子键被破坏A.①②③⑥B.①②④C.③⑤⑦D.③⑤⑧7.泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距1.0~1.5 nm,呈离子键;当两核靠近约距0.28 nm时,呈现共价键。
人教版高中化学选修三第3章《晶体结构与性质》测试试题(含答案解析版)

第3章《晶体结构与性质》测试题一、单选题(每小题只有一个正确答案)1.氮化硼(BN)是一种新型结构材料,具有超硬、耐磨、耐高温等优良特性,下列各组物质熔化时,所克服的微粒间作用与氮化硼熔化时克服的微粒间作用都相同的是( )A.硝酸钠和金刚石B.晶体硅和水晶 C.冰和干冰 D.苯和萘2.如图为金属镉的堆积方式,下列说法正确的是( )A.此堆积方式属于非最密堆积B.此堆积方式为A1型C.配位数(一个金属离子周围紧邻的金属离子的数目)为8D.镉的堆积方式与铜的堆积方式不同3.下列性质适合于离子晶体的是( )①熔点1 070 ℃,易溶于水,水溶液能导电②熔点10.31 ℃,液态不导电,水溶液能导电③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃④熔点97.81 ℃,质软,导电,密度0.97 g/cm3⑤熔点-218 ℃,难溶于水⑥熔点3 900℃,硬度很大,不导电⑦难溶于水,固体时导电,升温时导电能力减弱⑧难溶于水,熔点高,固体不导电,熔化时导电A.①⑧B.②③⑥C.①④⑦D.②⑤4.在常温常压下,下列物质中属于金属晶体的是( )A.铂B.汞 C.水晶 D.金刚石5.下列说法错误的是( )A.从CH4、NH、SO为正四面体结构,可推测PH、PO也为正四面体结构B. 1 mol金刚石晶体中,平均含有2 molC—C键C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE6.下列推论正确的A. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3B. NH4+为正四面体结构,可推测出PH4+也为正四面体结构C. CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体D. C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子7.关于SiO2晶体的叙述正确的是()A.通常状况下,60克SiO2晶体中含有的分子数为N A(N A表示阿伏加德罗常数的数值)B.60克SiO2晶体中,含有2N A个Si-O键C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点D.SiO2晶体中含有1个硅原子,2个氧原子8.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是( )A.氯化硼液态时能导电而固态时不导电 B.氯化硼加到水中使溶液的pH升高C.氯化硼分子呈正三角形,属极性分子 D.氯化硼遇水蒸气会产生白雾9.下列叙述错误的是( )A.带相反电荷的离子之间的相互吸引称为离子键B.金属元素与非金属元素化合时,不一定形成离子键C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键D.非金属原子间可能形成离子键10.在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是( )A.原子晶体干冰易汽化,可用作制冷剂B.原子晶体干冰有很高的熔点和沸点C.原子晶体干冰的硬度小,不能用作耐磨材料D. 1 mol原子晶体干冰中含2 mol C—O键11.在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上,碳原子数是( ) A. 2个 B. 3个 C. 4个 D. 6个12.已知铜的晶胞结构如图所示,则在铜的晶胞中所含铜原子数及配位数分别为()A. 14、6 B. 14、8 C. 4、8 D. 4、1213.表中原子化热、晶格能、键能的单位都是kJ•mol﹣1则下列说法正确的是()A. Na(s)与Cl2(g)反应生成1mol NaCl(s)放出的热量为556.1kJB. Si(s)+2Cl2(g)═SiCl4(g)△H=﹣602kJ•mol﹣1C.从表中可以看出,氯化钠的熔点比晶体硅高D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强14.如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )A. K2O B. K2O2 C. K2O3 D. KO215.石墨晶体是层状结构,在每一层内,每一个碳原子都跟其他3个碳原子相结合,下图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )A. 10个 B. 18个 C. 24个 D. 14个二、填空题16.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.(1)卤素互化物如Ibr ICl等与卤素单质结构相似、性质相近.Cl2、IB r、ICl沸点由髙到低的顺序为,I和Cl相比.电负性较大的是 C .(2)基态溴原子的电子排布式为,碘原子价电子的电子排布图为.(3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为,中心I原子的杂化轨道类型为.(4)请推测①HClO4②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为(填序号).(5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm(1)pm=10﹣12m),RbICl2晶胞中含有个氯原子,RbICl2晶体的密度是g•cnT3(只要求列箅式,不必计算出数值.阿伏伽德罗常数为N A).17.原子结构与元素周期表存在着内在联系。
(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题

(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题高中化学选修三第三章晶体结构与性质一、晶体常识1、晶体与非晶体比较2、获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
3、晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4、晶胞中微粒数的计算方法——均摊法某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学常见的晶胞为立方晶胞。
立方晶胞中微粒数的计算方法如下:①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2④晶胞内部粒子为1个晶胞独自占有,即为1注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。
二、构成物质的四种晶体1、四种晶体的比较晶体类型分子晶体原子晶体金属晶体离子晶体熔沸点很低很高一般较高,少部分低较高溶解性相似相溶难溶于任何溶剂难溶于常见溶剂(Na等与水反应)大多易溶于水等极性溶剂导电传热性一般不导电,溶于水后有的导电一般不具有导电性(除硅)电和热的良导体晶体不导电,水溶液或熔融态导电延展性无无良好无物质类别及实例气态氢化物、酸(如HCl、H2SO4)、大多数非金属单质(如P4、Cl2)、非金属氧化物(如SO2、CO2,SiO2除外)、绝大多数有机物(有机盐除外)一部分非金属单质(如金刚石、硅、晶体硼),一部分非金属化合物(如SiC、SiO2)金属单质与合金(Na、Mg、Al、青铜等)金属氧化物(如Na2O),强碱(如NaOH),绝大部分盐(如NaCl、CaCO3等)(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。
如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
2020-2021学年人教版高中化学选修3第三章《 晶体结构与性质》测试题(含答案)

第三章《 晶体结构与性质》测试题一、单选题1.下列物质中属于分子晶体的是①二氧化硅 ②碘 ③镁 ④蔗糖 ⑤冰 A .①②④B .②③⑤C .②④⑤D .①②④⑤2.下列说法不正确的是()A .在船外壳镶嵌锌块保护船身,锌为原电池的负极B .MgO 的熔点高于NaCl ,是因为MgO 的晶格能大于NaClC .31molFeCl 完全水解将产生236.0210⨯个胶体粒子D .水的离子积常数W K 随着温度的升高而增大,说明水的电离是吸热过程 3.下列含有极性键的离子晶体是①醋酸钠 ②氢氧化钾 ③金刚石 ④乙醇 ⑤氯化钙 A .①②⑤B .①②C .①④⑤D .①⑤4.关于液晶,下列说法正确的是 A .液晶是一种晶体B .液晶分子的空间排列是稳定的,具有各向异性C .液晶的化学性质与温度变化无关D .液晶的光学性质随外加电场的变化而变化5.毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺。
下列关于三聚氰胺分子的说法正确的是( )A .所有碳原子采用sp 3杂化,所有氮原子采用sp 3杂化B .一个分子中共含有15个σ键C .属于极性分子,故极易溶于水D .分子内既有极性键又有非极性键 6.下列关系不正确的是A .离子半径:Clˉ> F ˉ> Na + > Al 3+B .熔点:石英>食盐>冰>干冰C .碳酸盐的分解温度:MgCO 3>CaCO 3>BaCO 3D .热稳定性: HF > HCl > H 2S > PH 3 7.下列说法正确的是(N A 为阿伏加德罗常数)A.124 g P4含有P-P键的个数为4N AB.12 g石墨中含有C-C键的个数为1.5N AC.6 g金刚石中含有C-C键的个数为2N AD.60 g SiO2中含Si-O键的个数为2N A8.有三种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是A.①、②、③依次为简单立方堆积、六方最密堆积、体心立方堆积B.每个晶胞含有的原子数分别为:①1个,②2个,③6个C.晶胞中原子的配位数分别为:①6,②8 ,③12D.空间利用率的大小关系为:①>②>③9.“神七”火箭使用的燃料仍是偏二甲肼,其结构可以看作是两个甲基和一个氨基替代了氨气分子中的三个氢原子,下列关于偏二甲肼的说法不正确的是A.由碳、氢、氮三种元素组成B.所有N、C原子都在同一平面上C.固态时属于分子晶体D.分子式为C2H8N210.下列递变规律正确的是A.稳定性:HBr< HF B.还原性:S2–< Cl–C.沸点:乙烷>戊烷 D.酸性:HIO4> HClO411.目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述错误的是()A.该晶体为原子晶体B.该物质的熔沸点较低C.该物质是新化合物D.该物质的相对分子量质量为2400 12.物质结构包括原子结构、分子结构、晶体结构。
2020-2021学年人教版高中化学选修3第三章《 晶体结构与性质》测试题(含答案)

(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以_相结合,其晶胞中共有8个原子,其中在面心位置贡献__个原子。
(3)如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__。
A.二氧化硅的相对分子质量大于二氧化碳的相对分子质量
B.硅的原子半径大于碳的原子半径
C.干冰为分子晶体,二氧化硅为原子晶体
D.干冰易升华,二氧化硅不易升华
7.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是
A.碘与干冰分别受热变为气体B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中D.二氧化硅晶体与冰分别受热熔化
(1)简述检验工业烧碱中含有氯化钠的实验方法___;
(2)写出一种工业烧碱中还可能含有的杂质的化学式___;
(3)某同学采用硝酸银将离子沉淀的方法测定工业烧碱的纯度,取ag样品,经一系列操作,分离并称得氯化银的质量mg,则氢氧化钠纯度计算式为__。已知该测定结果偏低,可能的原因是__;
A.未将氢氧化钠去除B.氯化银颗粒细小,难以过滤
(4)比较下列储卤化物的熔点和沸点,分析其变化规律及原因__。
GeCl4
GeBr4
GeI4
熔点/℃
-49.5
26
146
沸点/℃
83.1
186
约400
三、元素或物质推断题
20.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
人教版高中化学选修三第三章《晶体结构和性质》检测题(含答案解析版)

人教版高中化学选修三第三章《晶体结构和性质》检测题(含答案解析版)第三章《晶体结构与性质》检测题一、单选题(每小题只有一个正确答案)1.下列物质由分子构成的是()A.水 B.铝 C.金刚石 D.氯化钠2.下列对晶体类型判断正确的是( )A.A B.B C.C D.D3.下列选项中不是常见的等径圆球堆积方式的是()A.面心立方最密堆积 B.体心立方最密堆积 C.六方最密堆积 D.简单立方堆积4.某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60的结构。
下列叙述正确的是()A.该物质有很高的熔点、很大的硬度 B.该物质形成的晶体属分子晶体C.该物质分子中Si60被包裹在C60里面 D.C60易溶于水5.下列各组晶体中,化学键的类型相同是()A.SO2与MgO B.NaCl与HCl C.CO2与H2O D.CCl4与KCl6.下面的叙述不正确的是()A.晶胞空间利用率:金属铜>金属镁>金属钾>金属钋B.硬度由大到小:金刚石>碳化硅>晶体硅C.晶体熔点由低到高:CH4<SiH4<GeH4<SnH4D.晶格能由大到小:NaF>NaCl>NaBr>NaI7.物质结构包括原子结构、分子结构、晶体结构。
下列关于物质结构与性质的说法正确的是()A.SiO2晶体为原子晶体,CO2晶体为分子晶体B.σ键都是由两个p轨道“头碰头”重叠形成的1 / 19C.VSEPR模型就是分子的空间构型D.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱8.下列说法正确的是()A.60gSiO2中含Si-O键的个数为4N AB.1molNa2O2晶体中阴离子与阳离子之比为1:1C.1molSi晶体中含有4molSi-Si键D.12g金刚石中含有C-C键的个数为N A9.心脏起搏器一般是给心跳缓慢的病人使用。
某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2=4LiCl+S+SO2,已知SOCl2结构式为,下列有关判断正确的是( )A.还原剂只有锂 B.氧化产物包括LiCl和SO2C.SOCl2中既有离子键,也有共价键 D.晶格能:LiCl<NaCl10.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。
人教版高中化学选修3第三章《 晶体结构与性质》测试题(含答案)

第三章《晶体结构与性质》测试题一、单选题1.下列有关晶体的说法中正确的是A.某晶体固态不导电,水溶液能导电说明该晶体是离子晶体B.原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力C.区分晶体和非晶体最科学的方法是对固体进行X﹣射线衍射实验D.任何晶体中,若含有阳离子也一定含有阴离子2.下列每组物质发生所述变化克服的作用属于同种类型的是()A.氯化铝和干冰升华B.钠和硫熔化C.食盐和氯化氢溶解于水D.二氧化硅和二氧化硫熔化3.对于氯化钠晶体,下列描述正确的是A.它是六方紧密堆积的一个例子B.58.5 g氯化钠晶体中约含6.02×1023个NaCl分子C.与氯化铯晶体结构相同D.每个Na+与6个Cl-作为近邻4.碳化硅(SiC)常用于电炉的耐火材料。
关于SiC说法正确的是A.易挥发B.能导电C.熔化时破坏共价键D.属于分子晶体5.下面有关晶体的叙述中,不正确的是A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子B.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有6个C.在冰中,每1molH2O分子形成2mol氢键D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子6.下列各组物质中,化学键类型相同,晶体类型也相同的是()A.C(金刚石)和CO2B.CH4和H2O C.NaBr和HBr D.Cl2和KCl 7.磷化硼是一种超硬耐磨涂层材料。
如图为其晶体结构中最小的重复单元。
下列有关说法正确的是B PA.磷化硼的化学式为2B.磷化硼晶体的熔点高,且熔融状态下能导电C.磷化硼晶体属于共价晶体D.磷化硼晶体在熔化时需克服范德华力8.下列各组顺序的排列错误的是A.半径:F—>Na+>Mg2+>Al3+B.沸点:H2O<H2S<H2SeC.酸性:HClO4>H2SO4>H3PO4D.熔点:SiO2>NaCl>CO29.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。
2020-2021学年人教版高中化学选修3第三章《 晶体结构与性质》测试题(含答案)

第三章《 晶体结构与性质》测试题一、单选题1.关于晶体和非晶体,下列说法中正确的( )A .铁是非晶体B .晶体和非晶体在熔化过程中温度都上升C .晶体熔化时吸热,非晶体熔化时不吸热D .晶体有固定熔点,非晶体没有固定熔点2.下列变化需克服相同类型作用力的是( )A .碘和干冰的升华B .二氧化硅和C 60的熔化 C .氯化氢和氯化铵的溶解D .溴和汞的气化3.已知X 、Y 、Z 三种元素组成的化合物是离子晶体,其晶胞结构如图所示,则下列表示该化合物的化学式正确的是A .3ZXYB .36ZX YC .48ZX YD .812ZX Y 4.下列叙述中正确的是A .具有规则几何外形的固体一定是晶体B .具有特定对称性的固体一定是晶体C .具有各向异性的固体一定是晶体D .依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、共价晶体 5.北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C 60形成的球碳盐K 3C 60。
实验测知该物质属于离子晶体,具有良好的超导性。
下列关于K 3C 60的组成和结构分析正确的是A .K 3C 60中既有离子键又有极性键B .1molK 3C 60中含有的离子数目为63×6.02×1023C .该晶体在熔融状态下能导电D .该物质的化学式可写作KC 206.下列有关金属键的叙述错误的是 ( )A .金属键没有饱和性和方向性B .金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用C .金属键中的自由电子属于整块金属D .金属的性质和金属固体的形成都与金属键有关7.下面的排序不正确的是( )A .多电子原子轨道能量高低:4s>3p>3s>2p x =2p yB .硬度由大到小:金刚石>碳化硅>晶体硅C .熔点由高到低:NaCl>SiO 2>Hg>P 4D .晶格能由大到小:KF>KCl>KB>KI8.设N A 为阿伏加德罗常数的值,下列叙述正确的是( )A .6.2g 白磷(分子结构如图)中所含P—P 键的数目为0.2N AB .1mol 甲苯中含有σ键数目为15N AC .6gSiO 2晶体中,含有的Si—O 键数目为0.2N AD .12g 金刚石含C—C 键数目为N A9.关于化学键的下列叙述中,正确的是A .离子化合物中可能含共价键,共价化合物也可能含离子键B .任何分子中一定含有化学键C .NaCl、NaOH、Na 2O 2 四种物质中含有的化学键类型完全相同D .共价化合物中不一定只存在极性共价键10.下列说法不正确...的是( ) A .干冰升华和液氯气化时,都只需克服分子间作用力B .硫酸氢钠晶体溶于水,需要克服离子键和共价键C .3NH 和3NCl 中,每个原子的最外层都具有8电子稳定结构D .石墨转化为金刚石时,既有共价键的断裂,又有共价键的形成11.下列实验事实可以用共价键键能解释的是A .氯化氢的沸点低于溴化氢B .金刚石熔点高于晶体硅C .氦气的化学性质稳定D .甲烷是正四面体型分子12.下表给出几种氯化物的熔点和沸点:有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化镁熔融状态下不能导电。
高二化学人教版选修3第三章 晶体结构与性质 强化练习

第三章晶体结构与性质一、选择题1.在普通陶瓷中添加氧化铝,在加压条件下烧至2 100 ℃左右,就可得到高致密氧化铝陶瓷,堪称“点石成金”之妙。
某氧化铝陶瓷晶体中含有X、Y、Z三种元素,其晶胞如图所示,则三种原子的原子个数比为()A.1∶3∶1B.2∶1∶6C.4∶8∶1D.8∶12∶12.下列哪些性质不能区别晶体与玻璃体()A.各向异性B.X-射线衍射C.导电性D.有无固定的熔点3.铁有δ、γ、α三种同素异形体,其结构分别如图所示,三种晶体在不同温度下能发生相互转化。
下列说法不正确的是 ()A.δFe晶体中与每个铁原子等距离且最近的铁原子有8个B.αFe晶体中与每个铁原子等距离且最近的铁原子有6个C.若δFe晶胞边长为a cm,αFe晶胞边长为b cm,则两种晶体密度比为2b3∶a3D.将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体的堆积模型相同4.晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是()A.C60摩尔质量是720B.C60与苯互为同素异形体C.在C60晶胞中有14个C60分子D.每个C60分子周围与它距离最近等距离的C60分子有12个5.组成干冰和二氧化硅晶体的化合物均属于第ⅣA族元素的最高价氧化物,但它们的熔、沸点差别很大,原因是()A.二氧化硅的相对分子质量大于二氧化碳的相对分子质量B.C===O键键能比Si—O键键能小C.干冰为分子晶体,二氧化硅为原子晶体D.干冰易升华,二氧化硅不能6.如图是金属晶体内部的电子气理论示意图。
电子气理论可以用来解释金属的性质,其中正确的是()A.金属能导电是因为金属阳离子在外电场的作用下做定向运动B.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导C.金属具有延展性是因为在外力的作用下,金属阳离子各层间会出现相对滑动,但由于自由电子的存在,可以起到润滑的作用,使金属不会断裂D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以延展性增强,硬度减小7.在冰晶石(Na3AlF6)晶胞中,[AlF6]3-占据的位置相当于NaCl晶胞中Cl-占据的位置,则冰晶石晶胞中含Na+数为()A.12个B.8个C.4个D.3个8.根据晶体中晶胞的结构,判断下列晶体的化学式不正确的是()A.AB2 B.C2DC.EF D.XY3Z9.钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。
高二化学人教版选修3第三章 晶体结构与性质 增分练习

第三章晶体结构与性质一、选择题1.如图所示是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子数都达到8个电子的稳定结构。
下列说法不正确的是()A.该化合物的化学式是Al2Cl6B.该化合物是离子化合物,在熔融状态下能导电C.该化合物在固态时所形成的晶体是分子晶体D.该化合物中不存在离子键,也不含有非极性共价键2.已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是()A.1 mol该单元中有2 mol YB.1 mol该单元中有6 mol OC.1 mol该单元中有2 mol BaD.该化合物的化学式是YBa2Cu3O63.某离子晶体结构中最小的重复单元如图所示,A为阴离子,在立方体内,B为阳离子,分别在立方体的顶角和面心,则该晶体的化学式为()A.B2A B.BA2C.B7A4D.B4A74.如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层都达到8电子的稳定结构。
下列说法不正确的是()A.该化合物的化学式是Al2Cl6B.该化合物是离子化合物,在熔融状态下能导电C.该化合物在固态时所形成的晶体是分子晶体D .该化合物中不存在离子键,也不含有非极性共价键5.要使金属晶体熔化必须破坏其中的金属键。
金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键与金属阳离子所带电荷的多少及半径大小有关。
由此判断下列说法正确的是( )A .金属镁的熔点高于金属铝B .碱金属单质的熔、沸点从Li 到Cs 是逐渐升高的C .金属铝的硬度大于金属钠D .金属镁的硬度小于金属钙6.据报道:用激光可将置于铁室中的石墨靶上的碳原子“炸松”,再用一个射频电火花喷射出氮气,可使碳、氮原子结合成碳氮化合物的薄膜,该碳氮化合物的硬度比金刚石更坚硬,则下列分析正确的是( )A .该碳氮化合物呈片层状结构B .该碳氮化合物呈立体网状结构C .该碳氮化合物中C —N 键长比金刚石的C —C 键长长D .相邻主族非金属元素形成的化合物的硬度比单质小7.SiCl 4的分子结构与CCl 4相似,对其进行下列推测,不正确的是( )A .SiCl 4晶体是分子晶体B .常温、常压下SiCl 4是气体C .SiCl 4的分子是由极性键形成的非极性分子D .SiCl 4的熔点高于CCl 48.已知NaCl 的摩尔质量为58.5 g·mol -1,其晶体密度为d g·cm -3,若图中钠离子与最近的氯离子的核间距为a cm ,那么阿伏加德罗常数的值可表示为( )A .117a 3d B.58.52a 3d C.234a 3d D.58.54a 3d9.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方堆积和体心立方堆积,如图a 、b 、c 分别代表这三种晶胞的结构,其1个晶胞中所含金属原子个数比为( )A.3∶2∶1B.11∶8∶4C.9∶8∶4D.21∶4∶910.X 是核外电子数最少的元素,Y 是地壳中含量最丰富的元素,Z 在地壳中的含量仅次于Y ,W 可以形成自然界中最硬的原子晶体。
人教版高中化学选修三第三章 晶体结构与性质(含答案)

第三章晶体结构与性质一、单选题1.下列化合物,按其晶体的熔点由高到低排列正确的是A. SiO2CsCl CBr4CF4B. SiO2CsCl CF4CBr4C. CsCl SiO2CBr4CF4D. CF4CBr4CsCl SiO22.如图,石墨晶体结构的每一层里平均每个最小的正六边形占有碳原子数目为()A. 2B. 3C. 4D. 63.下列说法正确的是()A.分子晶体中一定存在分子间作用力,不一定存在共价键B.分子中含两个氢原子的酸一定是二元酸C.含有金属阳离子的晶体一定是离子晶体D.元素的非金属性越强,其单质的活泼性一定越强4.如图为金属镉的堆积方式,下列说法正确的是( )A.此堆积方式属于非最密堆积B.此堆积方式为A1型C.配位数(一个金属离子周围紧邻的金属离子的数目)为8D.镉的堆积方式与铜的堆积方式不同5.下列性质适合于分子晶体的是()A.熔点1070 ℃,易溶于水,水溶液导电B.熔点2853 ℃,液态不导电,水溶液也不导电C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃D.熔点97.81 ℃,质软导电,密度为0.97 g·cm-36.下列有关金属晶体的说法中不正确的是()A.常温下不都是晶体B.最外层电子数少于3个的原子不都是金属C.任何状态下都有延展性D.都能导电、传热7.下面的排序不正确的是()A.晶体熔点由低到高:F2<Cl2<Br2<I2B.熔点由高到低: Na>Mg>AlC.硬度由大到小:金刚石>碳化硅>晶体硅D.晶格能由大到小: MgO>CaO>NaF> NaCl8.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中○—X、●—Y、⊗—Z。
其对应的化学式不正确的是()A.答案AB.答案BC.答案CD.答案D9.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是() A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。
人教版高中化学选修3第三章《 晶体结构与性质》测试题(含答案)

第三章《 晶体结构与性质》测试题一、单选题1.下列说法正确的是A .第三周期主族元素从左到右,最高价氧化物中离子键的百分数逐渐增大B .大多数晶体都是过渡晶体C .过渡晶体是指某些物质的晶体通过改变条件,转化为另一种晶体D .2Na O 是纯粹的离子晶体,2SiO 是纯粹的共价晶体2.下列说法正确..的是 A .氯化铵固体受热分解和干冰升华均只需克服分子间作用力B .I 2、Br 2、Cl 2、F 2的熔、沸点逐渐降低C .HCl 气体溶于水和NaOH 熔化破坏的化学键类型相同D .NaF 、H 2SO 4中所含化学键的类型相同3.氮化硅(Si 3N 4)是一种新型的耐高温耐磨材料,氮化硅属于A .离子晶体B .分子晶体C .金属晶体D .原子晶体 4.有下列离子晶体的空间结构示意图:以M 代表阳离子,以N 代表阴离子,•为阳离子,。
为阴离子,化学式为MN 2的晶体结构为( )A .B .C .D . 5.下列生活中的问题,不能用电子气理论知识解释的是A .铁易生锈B .用金属铝制成导线C .用金箔做外包装D .用铁制品做炊具 6.北京大学和中国科学院的化学工作者已成功研制出碱金属与C 60形成的球碳盐K 3C 60,实验测知该物质属于离子晶体,具有良好的超导性。
以下有关分析正确的选项是 A .熔融状态下该晶体能导电B .K 3C 60中碳元素显-3价 C .K 3C 60中只有离子键D .C 60与12C 互为同素异形体7.下列叙述正确的是A .氯化铯晶体中,每1个Cs +与其他8个Cs +等距离紧邻B .金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子C .熔点由高到低的顺序是:金刚石>碳化硅>晶体硅D .PCl 3和了BCl 3分子中所有原子的最外层都达到8电子稳定结构8.碳化硅()SiC 的一种晶体具有类似金刚石的结构,其中C 原子和Si 原子的位置是交替的.在下列三种晶体:①金刚石②晶体硅③碳化硅中,它们的熔点由高到低的顺序是A.①②③B.①③②C.③①②D.②①③9.下列有关说法不正确的是A.水合铜离子的模型如图所示,1个水合铜离子中有4个配位键B.CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+ C.H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动D.金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为1210.金属原子在二维空间里的两种放置方式如图所示,下列说法中正确的是A.图a为非密置层B.图b为密置层C.图a在三维空间里堆积可得到最密堆积D.图b在三维空间里堆积可得到最密堆积11.下下下下下下下下下下下下下下下下下下下下下下下D Ba(OH)2下下下下下MgA.A B.B C.C D.D12.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方堆积和体心立方堆积,如图a、b、c分别代表这三种晶胞的结构,其晶胞内金属原子个数比为A.3:2:1B.11:8:4C.9:8:4D.21:4:9 13.金属钠晶体(如图)为体心立方晶胞,晶胞的边长为a,假定金属钠原子为等径的刚性球,且晶胞中处于体对角线上的三个球相切,则钠原子的半径r为()A.a2B.3a C.3a D.2a14.有关晶体的叙述中正确的是A.在SiO2晶体中,最小的单元环是由6个硅原子组成的六元环B.在124g白磷(P4)晶体中,含P—P共价键个数为4N AC.金刚石的熔沸点高于晶体硅,是因为C—C键键能小于Si—Si键D.12g金刚石中含C原子与C—C键之比为1:215.已知硅酸盐中,通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
人教版高中化学 选修三第三章 晶体结构与性质单元训练题

第三章晶体结构与性质一、单选题1.二氧化硅晶体是立体的网状结构,其结构如图所示。
关于二氧化硅的下列说法中,不正确的是()A.晶体中Si、O原子个数比为1∶2B.晶体中最小原子环上的原子数为8C.晶体中最小原子环上的原子数为12D.晶体中Si、O原子最外层都满足8电子稳定结构2.某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为()A. B2AB. BA2C. B7A4D. B4A73.下列关于金属键的叙述中,正确的是()A.金属键是金属阳离子和自由电子间的强烈相互作用,不是一种电性作用B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性C.金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键有饱和性和方向性D.构成金属键的自由电子在整个金属内部的三维空间中做自由运动4.下列叙述正确的是()A.分子晶体中的每个分子内一定含有共价键B.原子晶体中的相邻原子间只存在非极性共价键C.离子晶体中可能含有共价键D.金属晶体的熔点和沸点都很高5.PH3是一种无色剧毒气体,其分于结构和NH3相似,但P-H键键能比N—H键键能低。
下列判断错误的是A. PH3分子呈三角锥形B. PH3分子是极性分子C. PH3沸点低于NH3沸点,因为P-H键键能低D. PH3分子稳定性低于NH3分子,因为N-H键键能高6.下列物质中,属于含有极性共价键的离子晶体的是()A. CsClB. KOHC. H2OD. Na2O27.下列叙述正确的是A.金属与盐溶液的反应都是置换反应B.阴离子都只有还原性C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物D.分子晶体中都存在范德华力,可能不存在共价键8.下列有关金属晶体判断正确的是()A.简单立方、配位数6、空间利用率68%B.钾型、配位数6、空间利用率68%C.镁型、配位数8、空间利用率74%D.铜型、配位数12、空间利用率74%9.下列晶体中,任何一个原子都被相邻四个原子包围,以共价健形成正四面体,并向空间伸展成网状结构的是()A.金刚石B.石墨C.足球烯D.水晶10.如图为金属镉的堆积方式,下列说法正确的是( )A.此堆积方式属于非最密堆积B.此堆积方式为A1型C.配位数(一个金属离子周围紧邻的金属离子的数目)为8D.镉的堆积方式与铜的堆积方式不同11.结合课本上干冰晶体图分析每个CO2分子周围距离相等且最近的CO2分子数目为( )A. 6B. 8C. 10D. 1212.金属晶体的熔沸点之间的差距是由于A.金属键的强弱不同B.金属的化合价的不同C.金属的晶体中电子数的多少不同D.金属的阳离子的半径大小不同13.对于离子键的说法正确的是()A.阴阳离子间的静电引力是离子键B.阴阳离子间的静电吸引是离子键C.阴阳离子间的相互作用即为离子键D.阴阳离子间强烈的相互作用是离子键14.为了确定SbCl3、SbCl5是否为离子化合物,以下分析正确的是()A.常温下,SbCl3、SbCl5均为液体,说明SbCl3和SbCl5都是离子化合物B. SbCl3、SbCl5的熔点依次为73.5 ℃、2.8 ℃。
人教版高中化学选修3第三章《 晶体结构与性质》测试题(含答案)

第三章《晶体结构与性质》测试题一、单选题1.在单质的晶体中,一定不存在的粒子是A.原子B.阴离子C.阳离子D.分子2.关于非晶体的叙述错误的是()A.玻璃属于非晶体B.内部微粒的排列是长程无序和短程有序的C.非晶体材料的所有性能都优于晶体材料D.金属形成的合金也有非晶体3.有关晶体的叙述中,错误的是A.区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验B.晶体与非晶体的本质区别在于是否具有规则的几何外形C.分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键D.在金属铜的晶体中,由于存在自由电子,因此铜能导电4.下列有关物质性质的比较,结论正确的是A.碱性:LiOH<RbOH B.溶解度:Na2CO3<NaHCO3C.热稳定性:PH3<SiH4D.沸点:C2H5OH<C2H5SH5.下列各物质中,按熔点由高到低的顺序排列正确的是()A.CH4>SiH4>GeH4>SnH4B.KCl>NaCl>MgCl2>MgOC.Rb>K>Na>Li D.金刚石>Si>钠6.金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。
据此判断下列金属熔点逐渐升高的A.Li Na K B.Na Mg Al C.Li Be Mg D.Li Na MgH”的变化过程中,被破坏的作用力依次是7.在“冰→水→水蒸气→2A.分子间作用力、分子间作用力、分子间作用力B.分子间作用力、分子间作用力、共价键C.分子间作用力、共价键、共价键D.共价键、共价键、共价键8.F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次增强),都极易与水反应。
已知2232+12H O=2XeO +4Xe +24HF 6XeF +3O ↑↑,下列推测正确的是( )A .XeF 2分子中各原子均达到8电子的稳定结构B .某种氟化氙晶体的基本结构单元如图所示,可推知其化学式为XeF 6C .XeF 4与水反应时,每生成2 mol Xe 转移8 mol 电子D .XeF 2加入水中,在水的作用下,将生成Xe 和F 29.下列说法中正确的是( )A .P 4和CH 4都是正四面体分子且键角都为109o 28ˊB .H 2O 是一种非常稳定的化合物,这是由于氢键所致C .NO 3-和CO 32-和和和和和和和和和和和和和和和和D .金属晶体与熔融态的离子晶体导电都是物理变化10.冰晶石(化学式为Na 3AlF 6)的晶体结构单元如图所示(●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心)。
人教版化学选修3第三章《 晶体结构与性质》测试题(含答案)

第三章《 晶体结构与性质》测试题一、单选题1.下列化合物中,属于原子晶体的是A .干冰B .氯化钠C .氟化硅D .二氧化硅 2.如图是a 、b 两种不同物质熔化时的温度变化曲线,下列说法正确的是( )A .a 没有固定的熔点B .a 是非晶体C .b 是晶体D .b 是非晶体 3.以下过程与化学键断裂无关的是A .氯化钠熔化B .干冰升华C .金刚石熔化D .金属汞汽化 4.下列叙述错误的是( )A .区别晶体与非晶体最科学的方法是对固体进行X −射线衍射实验B .外观呈现规则多面体的物质,内部微观粒子在三维空间一定呈周期性有序排列C .晶体具有各向异性,所以用红热的铁针刺中涂有石蜡的水晶柱面,熔化的石蜡呈椭圆形D .乙醇和水都是极性分子,符合相似相溶原理,且它们易形成分子间氢键,故乙醇易溶于水5.对于下列性质的比较正确的是A .离子半径:r(Cl -)>r(S 2-)>r(Na +)B .元素的电负性:Si<P<NC .稳定性:H 2O>H 2S>HClD .晶格能:MgO>NaBr>NaCl 6.晶体具有各向异性,如蓝晶石(Al 2O 3·SiO 2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的电导率是与层平行的方向上的电导率的4110。
晶体的各向异性主要表现在( )①硬度 ②导热性 ③导电性 ④光学性质A .①③B .②④C .①②③D .①②③④ 7.下列说法中错误的是①H 2O 汽化成水蒸气破坏分子间作用力、H 2O 分解为H 2和O 2,需要破坏共价键 ②C 4H 10的两种同分异构体因为分子间作用力大小不同,因而沸点不同③因为晶体硅的摩尔质量比金刚石的摩尔质量大,所以晶体硅的熔点比金刚石的高④SiO2与CO2的分子结构类似,所以化学性质类似⑤分子晶体中,共价键键能越大,该分子晶体的熔、沸点越高A.①②⑤B.①②③C.②④⑤D.③④⑤8.根据下表中的数据,结合学过的化学知识,判断下列说法正确的是A.以上四种物质中,只有SiCl4是共价化合物B.若上述数据变化规律具有普遍性,则可预测:LiCl 的沸点大于BCl3的沸点C.因为AlCl3的沸点低,所以工业上可用电解熔融AlCl3制备AlD.据上述数据,可判断NaCl、MgCl2为分子晶体9.下列对一些实验事实的理论解释正确的是()A.A B.B C.C D.D10.W、X、Y、Z均为短周期主族元素,原子序数依次增加,X、Y同周期,W、Z同主族,且X、Y最外层电子数之和是W、Z最外层电子数之和的6倍。
人教版高中化学 选修三第三章 晶体结构与性质单元练习题

第三章晶体结构与性质一、单选题1.如图是某原子晶体A空间结构中的一个单元。
A与某物质B反应生成C,其实质是在每个A—A 键中间插入一个B原子。
则C物质的化学式为 ()A. ABB. A5B4C. AB2D. A2B52.离子晶体熔点的高低决定于阴、阳离子的核间距离、晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是()A. KCl>NaCl>BaO>CaOB. NaCl>KCl>CaO>BaOC. CaO>BaO>KCl>NaClD. CaO>BaO>NaCl>KCl3.下列说法中一定正确的是()A.固态时能导电的物质一定是金属晶体B.熔融状态能导电的晶体一定是离子晶体C.水溶液能导电的晶体一定是离子晶体D.固态不导电而熔融状态导电的晶体一定是离子晶体4.现有如下各种说法:①在水中氢、氧原子间均以化学键相结合②金属和非金属化合形成离子键③离子键是阳离子、阴离子的相互吸引④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键⑤H2和Cl2的反应过程是H2、Cl2里共价键发生断裂生成H、Cl,而后H、Cl形成离子键的过程则对各种说法的判断正确的是()A.①②⑤正确B.都不正确C.④正确,其他不正确D.仅①不正确5.有个实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是()A. CO2的原子晶体和分子晶体互为同素异形体B.在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合C. CO2的原子晶体和CO2的分子晶体具有相同的物理性质D.在一定条件下,CO2原子晶体转化为分子晶体是物理变化6.下列关于晶体的说法一定正确的是()CaTiO3的晶体结构模型(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)A.分子晶体中都存在共价键B. CaTiO3晶体中每个Ti4+与12个O2-相紧邻C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合D.金属晶体的熔点都比分子晶体的熔点高7.已知某晶体晶胞如图所示,则该晶体的化学式为()A. XYZB. X2Y4ZC. XY4ZD. X4Y2Z8.如图所示的是某原子晶体A空间结构的一个单元,A与某物质B反应生成C,其实质是每个A﹣A键中插入一个B原子,则C物质的化学式为()A. ABB. A5B4C. AB2D. A2B59.金属键具有的性质是A.饱和性B.方向性C.无饱和性和方向性D.既有饱和性又有方向性10.下面关于SiO2晶体网状结构的叙述正确的是()A.存在四面结构单元,O处于中心,Si处于4个顶角B.平均每个最小的环上,有3个Si原子和3个O原子C.平均每个最小的环上,Si和O原子数之比为1:2D.平均每个最小的环上,有6个Si原子和6个O原子二、双选题11.(多选)普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是()A.化学式可以表示为KFe2(CN)6B.一个立方体中含有12个π键C.普鲁士蓝中含有配位键D. Fe3+周围有12个Fe2+离子12.(多选)分析NaCl和CsCl的晶体结构,判断下列说法错误的是()A. NaCl和CsCl都属于AB型的离子晶体B. NaCl和CsCl晶体中阴、阳离子个数比相同,所以阴、阳离子的配位数相等C. NaCl和CsCl晶体中阴、阳离子的配位数分别为6和8D. NaCl和CsCl都属于AB型的离子晶体,所以阴、阳离子半径比相同13.(多选)如图为碘晶体晶胞结构.有关说法中正确的是()A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构B.用均摊法可知平均每个晶胞中有4个碘原子C.碘晶体为无限延伸的空间结构,是原子晶体D.碘晶体中的碘原子间存在非极性键和范德华力14.(多选)下列晶体直接由原子构成的有()A.硫磺B.石英晶体C.晶体硅D.金属铝三、填空题15.溴化钠、氯化钠和氧化镁等离子晶体的核间距和晶格能(部分)如下表所示(1)溴化钠晶体比氯化钠晶体晶格能________(填“大”或“小”),主要原因是_______________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
章末质量检测(三)晶体结构与性质
一、选择题(本题包括12小题,每小题4分,共48分)
1.下列说法正确的是()
A.晶体在受热熔化过程中一定存在化学键的断裂
B.原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力
C.区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验
D.非金属元素的原子间只形成共价键,金属元素的原子与非金属元素的原子间只形成离子键
解析:选C A项,分子晶体受热熔化时破坏的是分子间作用力而不是化学键,错误;B项,有的分子晶体中存在氢键,错误;D项,金属元素原子与非金属元素原子间也可形成共价键,如AlCl3,错误。
2.下列说法中正确的是()
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔、沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
解析:选D选项A中离子晶体中每个离子周围吸引带相反电荷的离子数目与离子半径有关,如一个Cs+可同时吸引8个Cl-;选项B中金属内部的自由电子不是在电场力的作用下产生的;选项C中分子晶体的熔、沸点很低,在常温下也有呈固态的,如S属于分子晶体,它在常温下为固态。
3.下列有关冰和干冰的叙述不正确的是()
A.干冰和冰都是由分子密堆积形成的晶体
B.冰是由氢键形成的晶体,每个水分子周围有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中只存在范德华力不存在氢键,一个分子周围有12个紧邻的分子
解析:选A干冰晶体中CO2分子间作用力只有范德华力,分子采取紧密堆积,一个分子周围有12个紧邻的分子;冰晶体中水分子间除了范德华力还存在氢键,由于氢键具有方向性,每个水分子周围有4个紧邻的水分子,采取非紧密堆积的方式,空间利用率小,因而密度小。
干冰融化只需克服范德华力,冰融化还需要克服氢键,由于氢键比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华。
4.下表中的数据是对应物质的熔点(℃)。
物质NaCl Na2O AlF3AlCl3BCl3CO2SiO2
熔点/℃801 920 1 291 190 -107 -57 1 723
A.铝的化合物的晶体中有离子晶体
B.同族元素中的氧化物可形成不同类型的晶体
C.表中只有BCl3和干冰是分子晶体
D.不同元素的氯化物可形成相同类型的晶体
解析:选C由表中所给熔点数据可知,BCl3的熔点最低,为分子晶体;SiO2的熔点最高,为原子晶体;AlCl3的熔点较低,为分子晶体;AlF3的熔点较高,为离子晶体。
5.下列各项所述的数字不是6的是()
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的层状结构中,最小的环上的碳原子个数
解析:选C二氧化硅晶体中,每个最小的环上有6个O原子和6个Si原子共12个原子。
6.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是()
A.HF、HCl、HBr、HI的热稳性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
解析:选D HF、HCl、HBr、HI热稳定性依次减弱是因为它们的共价键键能逐渐减小,与键能有关;金刚石的硬度大于硅,熔、沸点高于硅是因为C—C键键能大于Si—Si 键键能;NaF、NaCl、NaBr、NaI的熔点依次降低是它们的离子键键能随离子半径增大逐渐减小;F2、Cl2、Br2、I2为分子晶体,熔、沸点的高低由分子间作用力决定,与键能无关。
7.观察下列模型并结合有关信息,判断有关说法正确的是()
B12结构单元SF6分子S8HCN
结构模
型示意
图
备注熔点1 873 K —易溶于CS2—
B.SF6是由极性键构成的极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H C N
解析:选A SF6空间结构高度对称,是由极性键构成的非极性分子,B项错误;根据S8易溶于CS2可知,固态硫S8属于分子晶体,C项错误;HCN的结构式应为H—C≡N,D 项错误。
8.有关晶体的结构如下图所示,下列说法中不正确的是()
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D.该气态团簇分子的分子式为EF或FE
解析:选D由于是气态团簇分子,其分子式应为E4F4或F4E4;CaF2晶体中,Ca2+
占据8个顶点和6个面心,故Ca2+共8×1
8+6×1
2
=4个;金刚石晶体中,每个C原子与4
个C原子相连,而碳碳键为2个碳原子共用,C原子与C—C键个数比为1∶2。
9.氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述错误的是() A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和Al2O3的化学键类型不同
D.AlON和Al2O3晶体类型相同
解析:选D AlON与石英均为原子晶体,所含化学键均为共价键,故A、B项正确;。
