第十二讲 杂环化合物_PPT幻灯片
合集下载
12 杂环化合物《有机化学》

Br
(80%)
O
O Cl2
-40℃ , CH3COOH
Cl
O
(64%)
Br2
CH3COOH
Br
S
(78%)
S Cl2
50℃
Cl
S
(36%)
I2,HgO C6H6, 0℃
I
S
(70%)
吡咯极易卤化生成四卤吡咯。
(2)硝化
呋喃和吡咯很易被氧化,遇无机酸容易发生聚合, 因而不能用硝酸硝化。通常用比较温和的非质子硝化试 剂,如用硝酸乙酰酯
离域能 呋喃、吡咯和噻吩的离域能分别为: 67 kJ·mol-1、 88 kJ·mol-1和117 kJ·mol-1 比苯的离域能(150.5 kJ·mol-1 )低,但比大多数共 轭二烯烃的离域能(约12~28 kJ·mol-1 )要大得多。
芳香性:苯>噻吩>吡咯>呋喃
2、 呋喃、噻吩和吡咯化学性质
有机化学 第12章 杂环化合物
基本要求:
• 1.掌握呋喃、吡咯、噻吩、吡啶、嘧啶、 喹啉、吲哚、嘌呤及其衍生物的命名。
• 2.掌握呋喃、吡咯、噻吩、吡啶的结构 与芳香性的关系,结构与亲电取代反应 活性的关系。
• 3.掌握吡咯和吡啶的酸碱性,呋喃、吡 咯、噻吩、吡啶的亲电取代反应(卤代、 磺化),还原反应,吡啶侧链的氧化反应。
COOH
(烟酸 )
N
HNO3
COOH
COOH
N
△
COOH △
N
N
吡啶可被催化加氢或用乙醇和钠还原而成为六氢吡啶。
Na + C2H5OH
N
或 H2/Pt ,0.3MPa,25℃
N H
常见吡啶衍生物
12杂环化合物-51页PPT精品文档

O
C N(C2H5)
N
烟酰二乙胺(可拉明)
CONHNH2
N
异烟酰肼 (雷米封)
CH2OH
HO
CH2OH
H3C N
维生素B6
O
H HS
NH
·H2O
NH2
N
O
CH3
COOH
头 孢 氨 苄 ( 先 锋 霉 素 I V)
N NH 烟碱(尼古丁)
O H3C
CH3
NN
O NN
咖啡碱 CH3
CH CH2 CH3
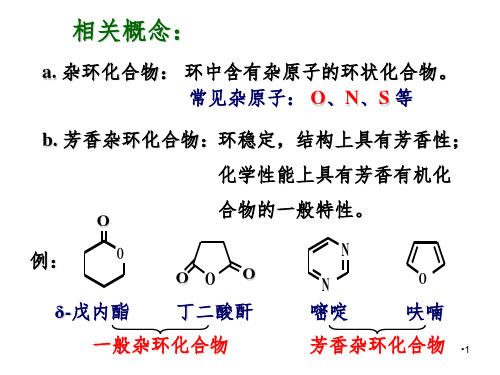
杂环化合物:环中含有杂原子的环状化物。
常见的杂原子有:O、S、N。
• 已经学过的杂环化合物:
• 这些化合物容易开环,的性质与相应的脂肪族化合 物相近。 本章主要讨论的是最重要的、最令人感兴趣的那 些环比较稳定,具有芳香结构和芳香性的杂环化 合物。(简称芳杂化合物)。
12.1 杂环化合物的分类、命名和结构
有一定程度的不饱和化合物的性质(发生加成反应)。 (1)取代反应—— 位取代 • 溴代:
• 硝化(缓和试剂):
• 磺化(缓和试剂):
吡啶与SO3的络合物
傅-克酰基化反应 (使用缓和路易斯酸催化剂)
结论:五元多π芳杂环的亲电取代 a.反应活性比苯大; b.使用温和的反应条件; c.反应部位主要为α-位。
常见的杂环有:
呋喃
噻吩
吡咯
吡啶
喹啉
噻唑
嘧啶
吲哚
命名1:带有取代基的杂环化合物
• 母体选择:磺酸、羧酸及其衍生物外,一般 以杂环为母体。
• 杂环的编号:从杂原子开始;环上有多个 相同杂原子时,使杂原子位号符合最低系列 原则;不同杂原子按O、S、N的次序编号。
杂环化合物hPPT课件
N
1、吡咯的结构特点
H
(1)杂化方式: sp2
p
sp2 p
C:
C:
吡啶
sp2 p 吡咯
sp2 p
N:
N:
同: 成环的C、N原子均为sp2杂化 异: 吡啶N:孤电子对处于sp2杂化轨道中
吡咯N:孤电子对处于未杂化的p轨道中 •39
(2)成键方式: e
吡啶:
● ●
●
●
●
吡咯:
●
●
N● ●
●
e
●
●
●
●●
C H = C H2 N
奎宁 (抗疟疾药)
N
CH3
H3CO
α
合成原料应选择:
Nβ
4-甲基-6-甲氧基喹啉
NH2
+ OCH3
β αO CH2=CH-C-CH3
H3CO
NO2
浓H2SO4
H3CO
CH3
N •32
HOOC 例4: 以苯为起始物合成:
N C6H5
合成路线:
CH3Cl AlCl3
CH3
HNO3 H2SO4
① 与质子酸的成盐反应:(无机强酸)
反应:
+ HCl
N
② 与Lewis酸的成盐反应:
+
N
H
Cl -
反应: N + SO3
+
N
–SO-3
N • SO3
N-磺酸吡啶 (温和的非质子磺化剂)
N + CrO3
+
N
–CrO-3
N • CrO3
N-铬酸吡啶
(温和的非质子氧化剂) •15
(3)吡啶芳环的亲电取代反应
第十二章 杂环化合物PPT26页

❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
第十二章 杂环化合物
•
46、寓形宇内复几时,曷不委心任去 留。
•
47、采菊东篱下,悠然见南山。
•
48、啸傲东轩下,聊复得此生。
•
49、勤学如春起之苗,不见其增,日 有所长 。
•
50、环堵萧然,不蔽风日;短褐穿结 ,箪瓢 屡空, 晏如也 。
谢谢你的阅读
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
第十二章 杂环化合物
•
46、寓形宇内复几时,曷不委心任去 留。
•
47、采菊东篱下,悠然见南山。
•
48、啸傲东轩下,聊复得此生。
•
49、勤学如春起之苗,不见其增,日 有所长 。
•
50、环堵萧然,不蔽风日;短褐穿结 ,箪瓢 屡空, 晏如也 。
谢谢你的阅读
第十二讲 杂环化合物

H N
S
1 2 a
O
O
基本环环边编号
N O N H N
基本环
N N
N N
O
噻吩并[3,2b]吡咯
呋喃并[3,2b]吡喃
吡唑并[4,5d]恶唑
吡嗪并[2,3d]哒嗪
二、六元杂环化合物
(一)吡啶:
H H H N
吡啶分子 中的键
H H
吡啶分子 中的p轨道
N
吡啶分子中 的共轭体系
吡啶键长平均化程度较高,有芳香性。 吡啶环亲电取代比苯难。 取代基进入间位,且收率偏低。
O
O
O
O
O
O
O
O
O
O
α-吡喃 α-吡喃酮 γ-吡喃 γ-吡喃酮 香豆素
O
H
+
色酮
OH
O
O
γ -吡喃酮的徉盐是芳香体系。
CH=CHPh N PhCH=CH N CH=CHPh
羟醛缩合型
CH3 N H3C N CH3
PhLi
CH2Li N H3C N CH3
C H3I
CH2CH3 N H3C N CH3
烷基化反应
嘧啶的合成
由-二羰基化合物(或类似物)与1,1-二胺类 化合物合成
常用的1,1-二胺类化合物:
H2N O H2N
N
-甲基吡啶
COOH
N
H
N
-呋喃甲醛 3-呋喃甲醛
-吡啶甲酸 3-吡啶甲酸
-吡咯甲酰胺 2-吡咯甲酰胺
-吡啶甲酸 3-吡啶甲酸
互变异构
H N H3C N N H N
H3C
Br
H N N Br
N NH
S
1 2 a
O
O
基本环环边编号
N O N H N
基本环
N N
N N
O
噻吩并[3,2b]吡咯
呋喃并[3,2b]吡喃
吡唑并[4,5d]恶唑
吡嗪并[2,3d]哒嗪
二、六元杂环化合物
(一)吡啶:
H H H N
吡啶分子 中的键
H H
吡啶分子 中的p轨道
N
吡啶分子中 的共轭体系
吡啶键长平均化程度较高,有芳香性。 吡啶环亲电取代比苯难。 取代基进入间位,且收率偏低。
O
O
O
O
O
O
O
O
O
O
α-吡喃 α-吡喃酮 γ-吡喃 γ-吡喃酮 香豆素
O
H
+
色酮
OH
O
O
γ -吡喃酮的徉盐是芳香体系。
CH=CHPh N PhCH=CH N CH=CHPh
羟醛缩合型
CH3 N H3C N CH3
PhLi
CH2Li N H3C N CH3
C H3I
CH2CH3 N H3C N CH3
烷基化反应
嘧啶的合成
由-二羰基化合物(或类似物)与1,1-二胺类 化合物合成
常用的1,1-二胺类化合物:
H2N O H2N
N
-甲基吡啶
COOH
N
H
N
-呋喃甲醛 3-呋喃甲醛
-吡啶甲酸 3-吡啶甲酸
-吡咯甲酰胺 2-吡咯甲酰胺
-吡啶甲酸 3-吡啶甲酸
互变异构
H N H3C N N H N
H3C
Br
H N N Br
N NH
杂环化合物PPT课件

.
8
二、六员杂环的结构
1.吡啶的结构 吡啶的构造式可表示为:
或
N
N
• 吡啶环上的C与 N原子均为sp2
杂化, 各提供一个 p-电子, 共有6
个(4n+2) p电子相互重叠, 形成 环状封 闭的共轭体系, 具有芳
NN H
香性. N原子sp2杂化轨道有未成
键电子对,可与质子结合, 具有
碱性.
• sp2-N吸电子能力较sp2- C强, 故吡啶为缺电子体系.
Br2, 0℃
O Br O O
C l2
+
O -40℃ O C l C l O C l
80%
吡咯卤化常得四卤化物,唯有2-氯吡咯可直接卤化制
得。
Br
Байду номын сангаасBr
Br N Br H
Br2, 0℃
SOCl2 (1 mol)
EtOH
N
H
Et2O, 0℃
N Cl H 80%
.
12
(2) 硝化
呋喃、噻吩和吡咯通常用较温和的硝化试剂-硝酸乙酰 酯在低温下进行反应;
§12-1 杂环化合物的简介
在环上含有杂原子(非碳原子)的有机物称为杂环化合物。
一、 脂杂环 没有芳香特征的杂环化合物称为脂杂环。
三元杂环
O
(环氧乙烷)
H
N (氮杂环丙烷)
四元杂环
O
(β-丙内酯)
O O
O
(β-丙内酰胺)
NH
五元杂环
O (顺丁烯二酸酐)
O
七元杂环
(氧杂 )
O
(1H-氮杂 )
N H
.
1
OO
O
有机化学 杂环化合物PPT课件

2021/7/23
第11页/共76页
五元杂环化合物亲电取代反应发生在α-位可用共
振论解释:
+ E+ Z
= Z ( NH、O、S )
+
E ZH
E +Z H
正电荷可在三个原子上离域
E
E
H
H
+
Z
Z
+
正电荷只能在两个原子上离域
E ZH
+
2021/7/23
由此可见,进攻2–位所形成的共振杂化体比进 攻3–位所形成的共振杂化体稳定。
2021/7/23
+ Ac2O
H3PO4
S
+ Ac2O
BF3
O
S COCH3 O COCH3
第17页/共76页
(5) 吡咯的特殊反应 吡咯十分活泼,活性类似于苯胺、苯酚.
H+ + C6H5N2+ClN H
N N=NC6H5 H
+ CHCl3 + KOH N H
2021/7/23
第18页/共76页
CHO N H
环状有机化合物中,成环原子除碳原子外还含有 其他原子,这种环状化合物称为杂环化合物。
2021/7/23
杂环化合物
、
非芳香性杂环化合物, 如: O
N H
内酯、环状酸酐等。
芳香性杂环化合物
本章讨论的是那些环为平面型,环内π电 子数符合4n+2规则,具有一定芳香性的 芳杂环化合物。
第1页/共76页
20.1 杂环化合物的分类与命名
5 - 位被占, 则进入4 - 位, 而不进入2 - 位
第19页/共76页
12杂环化合物有机化学B201109

(C8H7N)2 .H2Cr2O7
可用此法精制喹啉。
上页 下页
退出
取代反应
喹啉可发生亲电取代反应,但由于吡啶环难发生 亲电取代反应,所以取代基多进入苯环(5或8位)。 喹啉与吡啶一样,也能发生亲核取代反应,取代基则 进入吡啶环(2或4位)。
N
N NH2
+
N
Li N
上页 下页
退出
氧化
吡啶比苯稳定,不易被氧化,一般都是侧链被氧 化,而杂环不被破坏,结果生成吡啶甲酸。
CH3 KMnO4,OH
COOH
N
N 3-吡啶甲酸(烟酸)
CH3 N
V2O5 空气
COOH
N 4-吡啶甲酸(异烟酸)
上页 下页
退出
还原
吡啶比苯易被还原,经催化氢化或用乙醇和钠 还原,可得六氢吡啶。
N SO3
O
O
SO3H
N SO3
N H
N
SO3H
H
H2SO4
S
30℃
S SO3H
上页 下页
退出
硝化
呋喃、噻吩和吡咯必须在特殊的条件下硝化,即用酸 酐和硝酸在低温下进行硝化,生成相应的α-硝基化合物。
+ + O
H N O3(C H3 C O)2 O -5~ -3℃ 0 O N O2
C H3 C O O H
呋喃是无色液体,沸点32℃,具有类似氯仿 的气味,微溶于水,易溶于乙醇、 乙醚等有机溶 剂。呋喃能使盐酸浸过的松木片显绿色,此现象可 检验呋喃的存在。
噻吩与苯共存于煤焦油中, 噻吩是无色而有 特殊气味的液体,沸点84℃。噻吩和靛红(吲哚满 二酮)在硫酸作用下呈蓝色,此现象可检验噻吩的 存在。
可用此法精制喹啉。
上页 下页
退出
取代反应
喹啉可发生亲电取代反应,但由于吡啶环难发生 亲电取代反应,所以取代基多进入苯环(5或8位)。 喹啉与吡啶一样,也能发生亲核取代反应,取代基则 进入吡啶环(2或4位)。
N
N NH2
+
N
Li N
上页 下页
退出
氧化
吡啶比苯稳定,不易被氧化,一般都是侧链被氧 化,而杂环不被破坏,结果生成吡啶甲酸。
CH3 KMnO4,OH
COOH
N
N 3-吡啶甲酸(烟酸)
CH3 N
V2O5 空气
COOH
N 4-吡啶甲酸(异烟酸)
上页 下页
退出
还原
吡啶比苯易被还原,经催化氢化或用乙醇和钠 还原,可得六氢吡啶。
N SO3
O
O
SO3H
N SO3
N H
N
SO3H
H
H2SO4
S
30℃
S SO3H
上页 下页
退出
硝化
呋喃、噻吩和吡咯必须在特殊的条件下硝化,即用酸 酐和硝酸在低温下进行硝化,生成相应的α-硝基化合物。
+ + O
H N O3(C H3 C O)2 O -5~ -3℃ 0 O N O2
C H3 C O O H
呋喃是无色液体,沸点32℃,具有类似氯仿 的气味,微溶于水,易溶于乙醇、 乙醚等有机溶 剂。呋喃能使盐酸浸过的松木片显绿色,此现象可 检验呋喃的存在。
噻吩与苯共存于煤焦油中, 噻吩是无色而有 特殊气味的液体,沸点84℃。噻吩和靛红(吲哚满 二酮)在硫酸作用下呈蓝色,此现象可检验噻吩的 存在。
大学有机化学课件-杂环化合物

(糠醛)
β —CHO
γ 4 5 6
3β 2α
COOH
1 吡啶—3—甲酸 (尼古丁酸 —吡啶甲酸 或烟酸)
N
CH3
4 5
3 N
Br
2
4 5
N S1
2
3
N1 H
5—甲基咪唑
4—溴噻唑
9
稠杂环化合物(P232)
5 6 7 8 N 1 4 3 2
6 7 8 1 5 4 3
N2
喹啉 (quinoline)
糠醛是不具α—氢的芳醛,能进行类似于苯甲 醛的反应。
NaOH
__
O
CH2OH
+
O
__
COONa
O
2
O
__
CHO
康尼查罗反应
OH KCN 乙醇
__
CH___ C___
O
O
安息香缩合反应
O CH3COONa CHO + (CH3CO)2O 150C CH=CHCOOH O
30
普尔金反应
O
CH3COONa CHO + (CH3CO)2O 150C
4β 5α
O 1
β 3 α2
4β 5α
β 3
4β 5α
β 3 α2
呋喃(furan)
1 α2 N H
吡咯(pyrrole)
S 1 噻吩(thiophene)
唑的命名 含有两个或两个以上杂原子的五元杂环,若至少有 一个杂原子是氮时,则该杂环化合物称为唑。
4 5 N H1 3 N2
5 4 N3 2
4 5
N H
>
O
>
S
>
>
12
β —CHO
γ 4 5 6
3β 2α
COOH
1 吡啶—3—甲酸 (尼古丁酸 —吡啶甲酸 或烟酸)
N
CH3
4 5
3 N
Br
2
4 5
N S1
2
3
N1 H
5—甲基咪唑
4—溴噻唑
9
稠杂环化合物(P232)
5 6 7 8 N 1 4 3 2
6 7 8 1 5 4 3
N2
喹啉 (quinoline)
糠醛是不具α—氢的芳醛,能进行类似于苯甲 醛的反应。
NaOH
__
O
CH2OH
+
O
__
COONa
O
2
O
__
CHO
康尼查罗反应
OH KCN 乙醇
__
CH___ C___
O
O
安息香缩合反应
O CH3COONa CHO + (CH3CO)2O 150C CH=CHCOOH O
30
普尔金反应
O
CH3COONa CHO + (CH3CO)2O 150C
4β 5α
O 1
β 3 α2
4β 5α
β 3
4β 5α
β 3 α2
呋喃(furan)
1 α2 N H
吡咯(pyrrole)
S 1 噻吩(thiophene)
唑的命名 含有两个或两个以上杂原子的五元杂环,若至少有 一个杂原子是氮时,则该杂环化合物称为唑。
4 5 N H1 3 N2
5 4 N3 2
4 5
N H
>
O
>
S
>
>
12
有机化学第十二章杂环精品PPT课件

N CH3O KH M-n/O△4
N COOH
• 吡啶比苯易还原,易于加氢:
H2/Pt
N Na+C2H5OH
N H
NH2 N
ON H
O H N
ON H
胞嘧啶
尿嘧啶
2-氧-4-氨基嘧啶 2,4-二氧嘧啶
(cytosine,C) (uracil,U)
O H N CH3 ON
H
胸腺嘧啶 5-甲基-2,4-二氧嘧啶
• 二、命名(母核)
• 杂环化合物的命很复杂。主要讨论最 常用的译音法,即将杂环母核根据国 际通用英文译音,选同音汉字再加 “口”字旁命名。例如:
O
呋喃 Furan
S
噻吩 Thiophene
H N
吡咯 Pyrrole
N
O 恶唑
oxazole
N
S 噻唑
thiazole
N N H
吡唑
pyrazole
N
N H 咪唑
imidazole
N 吡啶 Pridine
N
N
嘧啶 Pyrimidine
N
喹啉 Quinoline
NN
NH
异喹啉 Isoquinoline
NN
嘌呤
Purine
NH
吲哚 Indole
• 1.单杂环的编号原则:从杂原子开始,靠 近杂原子的碳原子为α位,其次为β、γ位。
• 2.如果多于1个杂原子,要使其它杂原子 的编号尽可能小。
• 亲电取代比苯要困难,
• 亲核取代变得容易些。
• 氧化变难,
• 还原变易。
• 氮原子上有未共用电子对(居于sp2轨道 上),没有参与环状共轭体系,能接受质 子而呈碱性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+ N来自甲苯Li0℃
+ P h N Li
加 成
H
PhN Li
-H O 2 o r H N O 3
消 除
P h N L i
+L i+ P h N
齐齐巴宾(Chichibabin, A.E.)反应——氨化
——吡啶与氨基钠作用生成2-氨基吡啶的反应
N
+ NaNH2
100oC C6H5N(CH3)2
+H2↑
吲哚
N H
N
N
N
N H
嘌呤
喹啉
N
N 异喹啉
取代基
当杂环上连有-R,-X, -OH,-NH2等取代基 时,以杂环为母体,标 明取代基位次;
当杂环连有-CHO 、 -COR 、 -SO3H、 -COOH、-CONH2、 -COOR等时,则把杂环作 为取代基。
Br
N
CHO O
N3
4 N3
编号
N1
H
N (氮杂环丙烷)
O
(β-丙内酯)
O
O
O
(β-丙内酰胺)
NH
O (顺丁烯二酸酐)
O
(氧杂 )
O
(1H-氮杂 )
N H
芳杂环 具有芳香特征的杂环化合物称为芳杂环
五元杂环 六元杂环
呋喃
O N
噁唑
O
吡啶
N
噻吩
S N
噻唑
S
N 嘧啶
N
N
吡咯
H
N
咪唑
N 吡唑
N H
N H
吡喃(无芳香性)
O
苯并杂环 杂环并杂环
I-
CH 3
CH3I
+
N
H
+
N
H+
RCOCl 石油醚
COR
Br2/CCl4
+ N
Br -
Br
N
NO2+BF4+
乙醚 室温
SO3
+ N
S
O
3
+ N
NO
2 BF
4
吡啶盐的十分重要的用途:
温和的磺化、硝化、卤化、烷基化、酰基化的试剂
+ N S3O
(2)亲电取代反应
N E+
N E
E+ E+
N
H E
N H
H E
COOH
N
N NH-Na+
H2O
N NH 2
考研题
吡啶与NaNH2/NH3反应生成2-氨基吡啶的机 理属于(A ) A. 吡啶负离子历程 B. 吡啶炔历程 C. 吡啶正离子历程 D. 自由基历程
置换易离去基团的亲核取代反应
如在,γ位有好的离去基团,如Cl、-NO2、Br,可
以与氨(或胺)、烷氧化物、水等较弱的亲核试剂发
-H + -H +
S3 H O + N
N
E
N E
E
浮石催化
+Br2
N
300℃
+Br2
FeBr3 50℃
Br
N
Br
+ HNO3 H2SO4
NO 2
N
300℃ N
+ HNO3
H2SO4 50-60℃
NO 2
+ H2SO4 >350℃
SO3H -吡啶磺酸
N
N
70-80℃ + H2SO4
SO3H
结论: 1. 吡啶比苯难发生亲电取代反应。 2. 吡啶的一元取代总是发生在间位。
反应特点
*1 发生傅克烷基化、酰基化反应? 不能
*2 硝化、磺化、卤化必须在强烈条件下才能发生; *3 吡啶环上有给电子基团时,反应活性?
取增代高反应位置的控制: *4 吡啶在N可温以和看条作件是下一,个亲间电位试定剂位主基要;与N反应;
在强烈条件下,C取代为主。
0.87
(3)吡啶的亲核取代反应
吡啶键长平均化程度较高,有芳香性。 吡啶环亲电取代比苯难。 取代基进入间位,且收率偏低。
0.87 1.01
0.84
N 1.43
共轭效应和
=2.20D 诱导效应都
是吸电子的
吡啶与水能以任意比例混溶,同时又能溶解大多数 极性及非极性有机化合物,它是一个良好的溶剂。
原因:吡啶具有极性;氮原子的未共用电子对未参 与共轭体系,易与水形成氢键。
H3C 5 S 2
H
1
一般从杂原子开始编号。
环上只有一个杂原子时,杂原子的编号为1。
环上有两个或两个以上相同杂原子时,应从连接有氢 或取代基的杂原子开始编号,并使这些杂原子所在位 次的数字之和为最小。
环上有不同杂原子时,则按氧、硫、氮为序编号。
另有特殊编号的,如异喹啉、嘌呤等,(见书p409)
有时也以希腊字母α、β及γ编号,邻近杂原子的碳原 子为α位,其次为β位,再次为γ位。
H3C
C 2H 5
O CH3 2,4-二甲基呋喃
N H 3-乙基吡咯
O2N S CH3
2-甲基-5-硝基噻吩
CH3
CH3
N
N
N
3-甲基吡啶 4-甲基嘧啶
CH3
4
N3
N H
H3C 5 S 2 1
3-甲基吲哚
5-甲基噻唑
杂环化合物
碳原子和其它非碳原子组成的环状有机化合物 称为杂环化合物。
非碳原子叫做杂原子,常见的有氮、氧、硫。 杂环化合物数量几乎占已知有机化合物的三分
之一,用途也很多。 叶绿素、血红素、核酸和药物。
脂杂环:没有芳香特征的杂环化合物称为脂杂环。
三元杂环 四元杂环 五元杂环 七元杂环
O (环氧乙烷)
例:
H N
S
噻吩并[3,2b]吡咯
3 b
12
SO a
O
O
呋喃并[3,2b]吡喃
附加环 附加环编号 噻吩并[2,3-b]呋喃 基本环环边编号 基本环
N N
ON H
吡唑并[4,5d]恶唑
N N N
N
吡嗪并[2,3d]哒嗪
二、六元杂环化合物
(一)吡啶:
H
H
H
HNH
吡啶分子 中的键
吡啶分子 中的p轨道
N
吡啶分子中 的共轭体系
置换氢的亲核取代反应
1.01
N
0.84
1.43
一般机制:
γ
N u - ( 亲 核 取 代 )
N α
H Z ( 负 氢 接 受 体 )
+ Z H -
N Nu
NNu
*1 负氢不易离去,一般需要强碱性的亲核试剂(如RLi); *2 亲核取代优先在α位上发生,如果α位上有取代基,则
反应在γ位上发生。
烷基化、芳基化反应
CH3 CH3
H3C S -甲基噻吩
O
-甲基呋喃
N
-甲基吡啶
CHO O
COOH N
O
C
N
NH 2
H
-呋喃甲醛 -吡啶甲酸 3-呋喃甲醛 3-吡啶甲酸
-吡咯甲酰胺 2-吡咯甲酰胺
COOH
N
-吡啶甲酸 3-吡啶甲酸
互变异构
H3C
H N
N
H
N
Br
N
H3C
N
N H
N Br
NH
无特定名称的稠杂环母环的命名规则
生亲核取代反应(在亲核取代反应中,吡啶N对邻、对 位活化)。
NH3 , ZnC 2 l
N Cl 220℃
N NH 2
P420练
(4)吡啶的氧化还原反应
吡啶环本身不易被氧化,但它的侧链很容易 被氧化成醛或羧酸。
N
C3H
O 2, DMF
COOH
t-BuOK,
室温
N
N
Se2O
C3 H
N CHO
N
HN3O
化学性质
吡啶的弱碱性(pKa=5.19) N + HCl
N HCl
吡啶碱性比苯胺强,但比氨弱,碱性:
脂肪胺﹥氨﹥吡啶﹥苯胺
原因:在于吡啶环上未参与共轭体系的这一对未共 用电子对处于sp2杂化轨道上,其s成分较sp3杂化 轨道多,受原子核束缚强,因而较难与H+结合。
(1)氮原子上的反应
+ N
+ P h N Li
加 成
H
PhN Li
-H O 2 o r H N O 3
消 除
P h N L i
+L i+ P h N
齐齐巴宾(Chichibabin, A.E.)反应——氨化
——吡啶与氨基钠作用生成2-氨基吡啶的反应
N
+ NaNH2
100oC C6H5N(CH3)2
+H2↑
吲哚
N H
N
N
N
N H
嘌呤
喹啉
N
N 异喹啉
取代基
当杂环上连有-R,-X, -OH,-NH2等取代基 时,以杂环为母体,标 明取代基位次;
当杂环连有-CHO 、 -COR 、 -SO3H、 -COOH、-CONH2、 -COOR等时,则把杂环作 为取代基。
Br
N
CHO O
N3
4 N3
编号
N1
H
N (氮杂环丙烷)
O
(β-丙内酯)
O
O
O
(β-丙内酰胺)
NH
O (顺丁烯二酸酐)
O
(氧杂 )
O
(1H-氮杂 )
N H
芳杂环 具有芳香特征的杂环化合物称为芳杂环
五元杂环 六元杂环
呋喃
O N
噁唑
O
吡啶
N
噻吩
S N
噻唑
S
N 嘧啶
N
N
吡咯
H
N
咪唑
N 吡唑
N H
N H
吡喃(无芳香性)
O
苯并杂环 杂环并杂环
I-
CH 3
CH3I
+
N
H
+
N
H+
RCOCl 石油醚
COR
Br2/CCl4
+ N
Br -
Br
N
NO2+BF4+
乙醚 室温
SO3
+ N
S
O
3
+ N
NO
2 BF
4
吡啶盐的十分重要的用途:
温和的磺化、硝化、卤化、烷基化、酰基化的试剂
+ N S3O
(2)亲电取代反应
N E+
N E
E+ E+
N
H E
N H
H E
COOH
N
N NH-Na+
H2O
N NH 2
考研题
吡啶与NaNH2/NH3反应生成2-氨基吡啶的机 理属于(A ) A. 吡啶负离子历程 B. 吡啶炔历程 C. 吡啶正离子历程 D. 自由基历程
置换易离去基团的亲核取代反应
如在,γ位有好的离去基团,如Cl、-NO2、Br,可
以与氨(或胺)、烷氧化物、水等较弱的亲核试剂发
-H + -H +
S3 H O + N
N
E
N E
E
浮石催化
+Br2
N
300℃
+Br2
FeBr3 50℃
Br
N
Br
+ HNO3 H2SO4
NO 2
N
300℃ N
+ HNO3
H2SO4 50-60℃
NO 2
+ H2SO4 >350℃
SO3H -吡啶磺酸
N
N
70-80℃ + H2SO4
SO3H
结论: 1. 吡啶比苯难发生亲电取代反应。 2. 吡啶的一元取代总是发生在间位。
反应特点
*1 发生傅克烷基化、酰基化反应? 不能
*2 硝化、磺化、卤化必须在强烈条件下才能发生; *3 吡啶环上有给电子基团时,反应活性?
取增代高反应位置的控制: *4 吡啶在N可温以和看条作件是下一,个亲间电位试定剂位主基要;与N反应;
在强烈条件下,C取代为主。
0.87
(3)吡啶的亲核取代反应
吡啶键长平均化程度较高,有芳香性。 吡啶环亲电取代比苯难。 取代基进入间位,且收率偏低。
0.87 1.01
0.84
N 1.43
共轭效应和
=2.20D 诱导效应都
是吸电子的
吡啶与水能以任意比例混溶,同时又能溶解大多数 极性及非极性有机化合物,它是一个良好的溶剂。
原因:吡啶具有极性;氮原子的未共用电子对未参 与共轭体系,易与水形成氢键。
H3C 5 S 2
H
1
一般从杂原子开始编号。
环上只有一个杂原子时,杂原子的编号为1。
环上有两个或两个以上相同杂原子时,应从连接有氢 或取代基的杂原子开始编号,并使这些杂原子所在位 次的数字之和为最小。
环上有不同杂原子时,则按氧、硫、氮为序编号。
另有特殊编号的,如异喹啉、嘌呤等,(见书p409)
有时也以希腊字母α、β及γ编号,邻近杂原子的碳原 子为α位,其次为β位,再次为γ位。
H3C
C 2H 5
O CH3 2,4-二甲基呋喃
N H 3-乙基吡咯
O2N S CH3
2-甲基-5-硝基噻吩
CH3
CH3
N
N
N
3-甲基吡啶 4-甲基嘧啶
CH3
4
N3
N H
H3C 5 S 2 1
3-甲基吲哚
5-甲基噻唑
杂环化合物
碳原子和其它非碳原子组成的环状有机化合物 称为杂环化合物。
非碳原子叫做杂原子,常见的有氮、氧、硫。 杂环化合物数量几乎占已知有机化合物的三分
之一,用途也很多。 叶绿素、血红素、核酸和药物。
脂杂环:没有芳香特征的杂环化合物称为脂杂环。
三元杂环 四元杂环 五元杂环 七元杂环
O (环氧乙烷)
例:
H N
S
噻吩并[3,2b]吡咯
3 b
12
SO a
O
O
呋喃并[3,2b]吡喃
附加环 附加环编号 噻吩并[2,3-b]呋喃 基本环环边编号 基本环
N N
ON H
吡唑并[4,5d]恶唑
N N N
N
吡嗪并[2,3d]哒嗪
二、六元杂环化合物
(一)吡啶:
H
H
H
HNH
吡啶分子 中的键
吡啶分子 中的p轨道
N
吡啶分子中 的共轭体系
置换氢的亲核取代反应
1.01
N
0.84
1.43
一般机制:
γ
N u - ( 亲 核 取 代 )
N α
H Z ( 负 氢 接 受 体 )
+ Z H -
N Nu
NNu
*1 负氢不易离去,一般需要强碱性的亲核试剂(如RLi); *2 亲核取代优先在α位上发生,如果α位上有取代基,则
反应在γ位上发生。
烷基化、芳基化反应
CH3 CH3
H3C S -甲基噻吩
O
-甲基呋喃
N
-甲基吡啶
CHO O
COOH N
O
C
N
NH 2
H
-呋喃甲醛 -吡啶甲酸 3-呋喃甲醛 3-吡啶甲酸
-吡咯甲酰胺 2-吡咯甲酰胺
COOH
N
-吡啶甲酸 3-吡啶甲酸
互变异构
H3C
H N
N
H
N
Br
N
H3C
N
N H
N Br
NH
无特定名称的稠杂环母环的命名规则
生亲核取代反应(在亲核取代反应中,吡啶N对邻、对 位活化)。
NH3 , ZnC 2 l
N Cl 220℃
N NH 2
P420练
(4)吡啶的氧化还原反应
吡啶环本身不易被氧化,但它的侧链很容易 被氧化成醛或羧酸。
N
C3H
O 2, DMF
COOH
t-BuOK,
室温
N
N
Se2O
C3 H
N CHO
N
HN3O
化学性质
吡啶的弱碱性(pKa=5.19) N + HCl
N HCl
吡啶碱性比苯胺强,但比氨弱,碱性:
脂肪胺﹥氨﹥吡啶﹥苯胺
原因:在于吡啶环上未参与共轭体系的这一对未共 用电子对处于sp2杂化轨道上,其s成分较sp3杂化 轨道多,受原子核束缚强,因而较难与H+结合。
(1)氮原子上的反应
+ N
