专题训练(十) 定量分析计算考试题及答案 .doc
《定量分析》测试题(有答案)---精品资料

一、选择题:
1、减小偶然误差的方法: (C )
A 、用标准样作对照实验; B、用标准方法作对照实验;
C、增加平行测定次数,舍去可疑值后,取其余数据平均值;
D、校准仪器。
2、 4.300 (240.2 230.20) 计算式的结果有效数字应为 5.2 0 0 0
A 、四位
B、三位 C、二位
中性红作指示剂,当滴定至溶液呈红色时,终止滴定,此时溶液 PH=6.8,
则该滴定 ______C________
A 、无终点误差
B、有负的终点误差
C、有正的终点误差
D、无法确定
21、在被测溶液中, 加入已知量且又过量的标准溶液, 当其与被测物质反应完
全后,用另一种标准溶液滴定第一种标准溶液的余量,这种滴定法称为
B、Na2B4O7·7H2O
C、NaOH
D、 HCl
19、某弱酸型的酸碱指示剂 HIn, 指示剂电离常数 K HIn , 当溶液 PH>1+ K HIn 时 , 溶液呈 _______( C )。
A 、无颜色 B、酸式色 C、碱式色
D、混合色
20、用 0.1000mol l·-1 的 HCl 标准溶液滴定与其浓度接近的 NaOH 试液,用中
Ka2 = 1.0 10×-6), 要指示可能出现的突跃,应使用的指示剂为பைடு நூலகம் D )
A 、甲基红和酚酞
B、甲基红或酚酞
C、甲基红
D、酚酞
11、用盐酸标准溶液滴定 NH 3·H2O—NH 4Cl 缓冲液中的 NH 3·H2O 的含量,宜
采用的方法: ( D )
A 、先加入甲醛与
NH
+
4
定量分析方法课程综合练习题
定量分析方法课程综合练习题说明:为了帮助大家巩固所学的定量分析基本方法,建立定量分析思维,特给出一下练习题,其中有些问题已列出了参考答案,没有给出参考答案的问题主要供大家讨论完成。
1. 为研究气温的变化情况,气象局对北方某城市1—2月份各天气的气温进行了记录,结果如下:-3 2 -4 -7 -11 -1 6 8 9 -6-14 -18 -15 -9 -6 -1 0 5 -4 -9-6 -8 -12 -16 -19 -15 -22 -25 -24 -19-8 -6 -15 -11 -12 -19 -25 -24 -18 -17-14 -22 -13 -10 -6 0 -1 5 -4 -9-3 2 -4 -4 -16 -1 7 3 -6 -5(1)指出上面的数据属于什么类型?(2)对上面的数据进行适当的分组;(3)作一个直方图,说明该城市气温分布的特点。
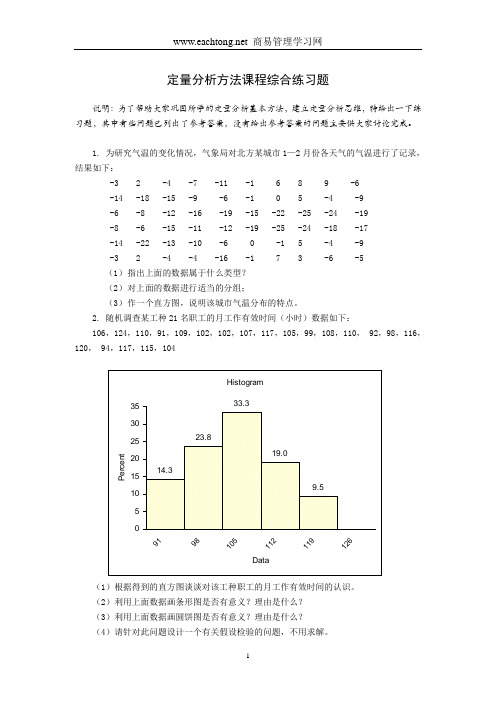
2. 随机调查某工种21名职工的月工作有效时间(小时)数据如下:106,124,110,91,109,102,102,107,117,105,99,108,110, 92,98,116,120, 94,117,115,104(1)根据得到的直方图谈谈对该工种职工的月工作有效时间的认识。
(2)利用上面数据画条形图是否有意义?理由是什么?(3)利用上面数据画圆饼图是否有意义?理由是什么?(4)请针对此问题设计一个有关假设检验的问题,不用求解。
3.某机关采购部的一个员工称他和少数其他几个员工几乎要干所有的活。
为了支持他的观点,他收集了以下的数据,即该部门在一个具有代表性的星期中16个员工每人处理的采购单数目。
计算该数据的集中趋势及离散程度所有测度指标。
对该员工的主张进行评论,是否少数员工几乎在做全部工作?12 22 8 14 15 32 17 24 20 37 15 23 16 40 19 21(均数=20.94,中位数=19.5,众数=15,标准差=8.55。
定量分析试卷及部分答案

MPA定量分析方法试卷说明:本卷满分为100分.第1题共分7类凡20个名词,任选其10作答,每题3分;第2至第14题任选其7作答,每题10分.1 名词解释(30%)(1)赢家联盟,输家联盟,否决权联盟;(2)零和对策,William 方法,非零和对策,Nash 平衡点;(3)图的哈密顿回路,极小母树,消棱法,近棱法;(4)整分技巧的.Jefferson 方法,Webster-Willcox 方法和Adams 方法;(5)规划理论中的角点原理;(6)格雷亨的平均分析法,最坏状态分析法,降时排序分析法;.(7)正态曲线的标准偏差,68-95-99.7规则.2 (10%)说明“一票否决制”的定义,并计算此系统的配额,各成员的权力指数.3 (10%)计算三人委员会[3:2,1,1].三成员的彭翠芙指数.4 (10%)下表是某大学学生人数表,如果要产生一个成员为100的学生会,试用Hamilton 方法予以分配,并填入表中配额栏.671633.580483224.160409320.465321116.055852 4.260296 1.48020000100.00学院学生数百分比配额科学与艺术工程农学商学法学建筑合计5 (10%)试算出下面几个对策的最佳策略:玩家2 玩家二 玩家二a) 玩家1 A 1046B 659C 237I II III b) 玩家一 5331P N P N -- c) 玩家一 2543365444A B CDE ⎛⎫ ⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎝⎭6 (10%)如果对于一堆特殊的任务,在三条流水线上的最佳完工时间(一般说来这个时间是不知道的)是450分钟.(1) 用格雷享分析法估计出最坏的完工时间;(2) 用格雷享降时排序分析法估计出最长的完工时间.7(10%)下面是京、沪、沈、滇四城市完备图的权数表四城市完备图权数表京沪沈滇京——300 541 562沪300 ———349 425沈541 349 ———774滇562 425 774 ———(1)试画出一个含有四个城市的带权完备图.(2)以北京为起点,用短棱法,将得到怎样的回路?(3)再用消棱法给出一个回路.8 (10%)下图是某企业五个子公司的位置图,各边上的数字表示安装电缆的费用(以万无为单位),公司决定安装可视电话,问应如何铺设电缆才使费用最小?费用是多少?9(10%)墨西哥城有一家木板厂生产两种畅销全球的三合板:外镶板和内镶板.前者的原材料是两块甲种面板和两块乙种面板,生产过程是10分钟;后者的原材料是四块乙种板面,生产需5分钟.厂里共有十二台压板机,每台每天运作500分钟.另一方面,原材料厂每天只能为该厂提供1000块甲种面板和3000块乙种面板.外镶板和内镶板的利润分别是6美元/块和5美元/块.现在厂长面对的问题是:应当怎样安排一天的生产,才能使这一天获得最大利润?10(10%)某汽车厂需要在流水线上将最后50辆汽车中的5辆进行质检,为避免偏袒性,请问应如何进行抽样.(可设你已在随机数表中查得一组随机数为73063,63623,29388.)11(10%)高考分数是一个以全体考生为样本的正态分布,某年其平均值为500分,标准偏差为100分.问名次在前25%的学生最低分数为多少?200与800分之间的学生百分比是多少?超过700的学生百分比是多少?12(10%)假定下表是从全国范围内进行抽样调查统计出来的,因此是个随机事件. 请问随机选出一个二人以上的家庭的概率是多少?全国范围的家庭平均人口幅度是多少?成员 1 2 3 4 5 6 7概率0.236 0.320 0.181 0.156 0. 069 0.024 0.01413(10%)随机地选择100颗种子测试发芽率,结果是100颗中有87颗发芽.你能不能有95%的把握估计出一个真实的发芽率.14(10%)请写出三个著名非零和对策,并算出其中之一的Nash平衡点.部分答案2 一个每一成员都构成否决权联盟的加权系统称为一票否决系统。
管理定量分析习题与答案
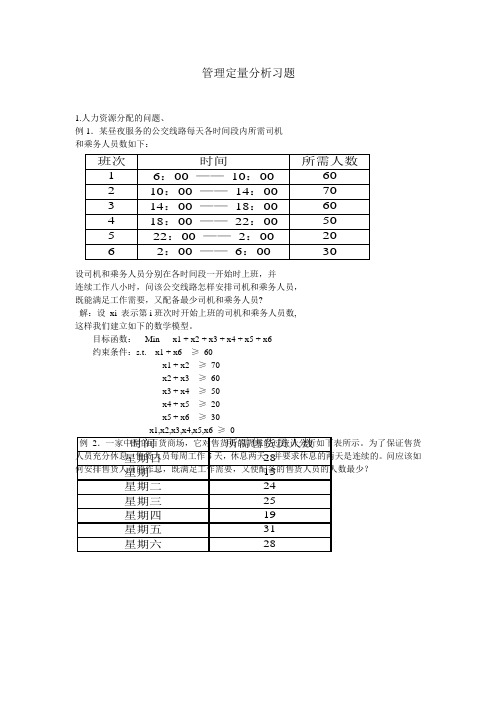
管理定量分析习题1.人力资源分配的问题、例1.某昼夜服务的公交线路每天各时间段内所需司机和乘务人员数如下:设司机和乘务人员分别在各时间段一开始时上班,并 连续工作八小时,问该公交线路怎样安排司机和乘务人员,既能满足工作需要,又配备最少司机和乘务人员?解:设 xi 表示第i 班次时开始上班的司机和乘务人员数,这样我们建立如下的数学模型。
目标函数: Min x1 + x2 + x3 + x4 + x5 + x6约束条件:s.t. x1 + x6 ≥ 60x1 + x2 ≥ 70x2 + x3 ≥ 60x3 + x4 ≥ 50x4 + x5 ≥ 20x5 + x6 ≥ 30 x1,x2,x3,x4,x5,x6 ≥ 0例2.一家中型的百货商场,它对售货员的需求经过统计分析如下表所示。
为了保证售货人员充分休息,售货人员每周工作5天,休息两天,并要求休息的两天是连续的。
问应该如何安排售货人员的作息,既满足工作需要,又使配备的售货人员的人数最少?班次 时间 所需人数 1 6:00 —— 10:00 60 2 10:00 —— 14:00 70 3 14:00 —— 18:00 60 4 18:00 —— 22:00 50 5 22:00 —— 2:0020 6 2:00 —— 6:00 30 时间所需售货员人数星期日28星期一15星期二24星期三25星期四19星期五31星期六28解:设 xi ( i = 1,2,…,7)表示星期一至日开始休息的人数,这样我们建立如下的数学模型。
目标函数: Min x1 + x2 + x3 + x4 + x5 + x6 + x7约束条件:s.t. x1 + x2 + x3 + x4 + x5 ≥ 28x2 + x3 + x4 + x5 + x6 ≥ 15x3 + x4 + x5 + x6 + x7 ≥ 24x4 + x5 + x6 + x7 + x1 ≥ 25x5 + x6 + x7 + x1 + x2 ≥ 19x6 + x7 + x1 + x2 + x3 ≥ 31x7 + x1 + x2 + x3 + x4 ≥ 28x1,x2,x3,x4,x5,x6,x7 ≥ 0§2 生产计划的问题例3.某公司面临一个是外包协作还是自行生产的问题。
定量分析单选、判断题库及参考答案

注意:答案仅供参考第一章定量分析概论-单项选择题1、使分析天平较快停止摆动的部件是(C)A、吊耳B、指针C、阻尼器D、平衡螺丝2、天平零点相差较小时,可调节(B)A、指针B、拔杆C、感量螺丝D、吊耳3、天平及砝码应定时检定,一般规定检定时间间隔不超过(B)A、半年B、一年C、二年D、三年4、使用分析天平进行称量过程中,加减砝码或取放物体时应该把天平横梁托起是为了(B)A、称量迅速B、减少玛瑙刀口的磨损C、防止天平的摆动D、防止天平梁的弯曲5、使用电光分析天平时,标尺刻度模糊,这可能是因为(A)A、物镜焦距不对B、盘托过高C、天平放置不水平D、重心铊位置不合适6、同一样品分析,采取一种相同的分析方法,每次测得的结果依次为31.27%、31.26%、31.28%,其第一次测定结果的相对偏差是(B)A、0.03%B、0.00%C、0.06%D、-0.06%7、下列方法中可以减少分析中偶然误差的是(A)A、增加平行试验的次数B、进行对照试验C、进行空白试验D、进行仪器的校正8、测定某铁矿石中硫的含量,称取0.2952g,下列分析结果合理的是(C)A、32%B、32.4%C、32.42%D、32.420%9、三人对同一样品的分析,采用同样的方法,测得结果为:甲:31.27%、31.26%、31.28%;乙:31.17%、31.22%、31.21%;丙:31.32%、31.28%、31.30%。
则甲、乙、丙三人精密度的高低顺序为(A)A、甲>丙>乙B、甲>乙>丙C、乙>甲>丙D、丙>甲>乙10、在一组平行测定中,测得试样中钙的百分含量分别为22.38、22.36、22.40、22.48,用Q 检验判断、应弃去的是(C )。
(已知:n=5时,Q0.90 =0.64)A、22.38B、22.40C、22.48D、22.3911、对某试样进行平行三次测定,得CaO 平均含量为30.60% ,而真实含量为30.30% 则30.60%-30.30%=0.30% 为(B )A、相对误差B、绝对误差C、相对偏差D、绝对偏差12、测定某石灰石中的碳酸钙含量,得以下数据:79.58%、79.45%、79.47%、79.50% 79.62%、79.38%其平均值的标准偏差为(A )A、0.09%B、0.11%C、0.90%D、0.06%13、用25mL移液管移出溶液的准确体积应记录为(C)A、25mLB、25.0mLC、25.00mLD、25.000mL14、下列四个数据中修改为四位有效数字后为0.5624的是:(C )(1)0.56235(2)0.562349 (3)0.56245 (4)0.562451A、1,2B、3,4C、1,3D、2,415、下列各数中,有效数字位数为四位的是(C)A、[H+]=0.0003mol/LB、pH=8.89C、c(HCl)=0.1001mol/LD、4000mg/L16、测得某种新合成的有机酸的pKa值为12.35,其Ka值应表示为(B)A、4.5×1013B、4.5×10-13C、4.46×1013D、4.46×10-1317、在某离子鉴定时,怀疑所用蒸馏水含有待检离子,此时应(D )A、另选鉴定方法B、进行对照试验C、改变溶液酸度D、进行空白试验18、在进行某离子鉴定时未得肯定结果,如怀疑试剂已变质,应进行(B )A、重复实验B、对照试验C、空白试验D、灵敏性试验19、能更好的说明测定数据分散程度的是(A )A、标准偏差B、相对偏差C、平均偏差D、相对平均偏差20、测定过程中出现下列情况,导致偶然误差的是(C )A、砝码未经校正B、试样在称量时吸湿C、几次读取滴定管的读数不能取得一致D、读取滴定管读数时总是略偏高21、计算式(30.582—7.43)+(1.6—0.54)+2.4963中,绝对误差最大的数据是(C)A、30.582B、7.43C、1.6D、0.5422、若一组数据中最小测定值为可疑时,用Q检验法的公式为(D )A、d/RB、S/RC、(Xn-Xn-1)/RD、(X2-X1)/(Xn-X1)23、定量分析工作要求测定结果的误差(D )A、愈小愈好B、等于0C、没有要求D、在允许误差范围内24、标准偏差的大小说明(A)A、数据的分散程度B、数据与平均值的偏离程度C、数据的大小D、数据的集中程度25、按被测组分含量来分,分析方法中常量组分分析指含量(D)A、<0.1%B、>0.1%C、<1%D、>1%26、分析工作中实际能够测量到的数字称为(D)A、精密数字B、准确数字C、可靠数字D、有效数字27、1.34×10-3%有效数字是(C)位。
管理定量分析习题与答案

管理定量分析习题1.人力资源分配的问题、例1.某昼夜服务的公交线路每天各时间段内所需司机和乘务人员数如下:设司机和乘务人员分别在各时间段一开始时上班,并 连续工作八小时,问该公交线路怎样安排司机和乘务人员,既能满足工作需要,又配备最少司机和乘务人员?解:设 xi 表示第i 班次时开始上班的司机和乘务人员数,这样我们建立如下的数学模型。
目标函数: Min x1 + x2 + x3 + x4 + x5 + x6约束条件:s.t. x1 + x6 ≥ 60x1 + x2 ≥ 70x2 + x3 ≥ 60x3 + x4 ≥ 50x4 + x5 ≥ 20x5 + x6 ≥ 30 x1,x2,x3,x4,x5,x6 ≥ 0例2.一家中型的百货商场,它对售货员的需求经过统计分析如下表所示。
为了保证售货人员充分休息,售货人员每周工作5天,休息两天,并要求休息的两天是连续的。
问应该如何安排售货人员的作息,既满足工作需要,又使配备的售货人员的人数最少?班次 时间 所需人数 1 6:00 —— 10:00 60 2 10:00 —— 14:00 70 3 14:00 —— 18:00 60 4 18:00 —— 22:00 50 5 22:00 —— 2:0020 6 2:00 —— 6:00 30 时间所需售货员人数星期日28星期一15星期二24星期三25星期四19星期五31星期六28解:设 xi ( i = 1,2,…,7)表示星期一至日开始休息的人数,这样我们建立如下的数学模型。
目标函数: Min x1 + x2 + x3 + x4 + x5 + x6 + x7约束条件:s.t. x1 + x2 + x3 + x4 + x5 ≥ 28x2 + x3 + x4 + x5 + x6 ≥ 15x3 + x4 + x5 + x6 + x7 ≥ 24x4 + x5 + x6 + x7 + x1 ≥ 25x5 + x6 + x7 + x1 + x2 ≥ 19x6 + x7 + x1 + x2 + x3 ≥ 31x7 + x1 + x2 + x3 + x4 ≥ 28x1,x2,x3,x4,x5,x6,x7 ≥ 0§2 生产计划的问题例3.某公司面临一个是外包协作还是自行生产的问题。
《定量分析方法》模拟试题

《定量分析方法》模拟试题一、单项选择题(每小题4分,共20分)1. 若某物资的总供应量小于总需求量,则可增设一个( ),其供应量取总需求量与总供应量的差额,并取该产地到各销地的单位运价为0,可将供不应求运输问题化为供求平衡运输问题。
(A) 虚产地(B) 虚销地(C) 需求量(D) 供应量2.某物流企业计划生产A ,B 两种产品,已知生产A 产品1公斤需要劳动力7工时,原料甲3公斤,电力2度;生产B 产品1公斤需要劳动力10工时,原料甲2公斤,电力5度。
在一个生产周期内,企业能够使用的劳动力最多6300工时,原料甲2124公斤,电力2700度。
又已知生产1公斤A ,B 产品的利润分别为10元和9元。
为建立能获得最大利润的线性规划模型,设生产A 产品1x 公斤,生产B 产品2x 公斤,则对于原料甲,有如下约束条件( )。
(A) 31x +22x =2124 (B) 31x +22x ≤2124 (C) 31x +22x ≥2124(D) 31x +22x ≤63003.设⎥⎦⎤⎢⎣⎡--=⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡-=413021,430421B A ,则 B A T +=( )。
(A) ⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡--831650(B) ⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡412314 (C) ⎥⎦⎤⎢⎣⎡--815360 (D) ⎥⎦⎤⎢⎣⎡134421 4. 设某公司运输某物品的总成本(单位:百元)函数为C (q)=500+2q +2q ,则运输量为100单位时的边际成本为( )百元/单位。
(A) 202(B) 107(C) 10700(D) 7025. 已知运输某物品q 吨的边际收入函数(单位:元/吨)为MR (q)=100-2q ,则运输该物品从100吨到200吨时收入的增加量为( )。
(A) ⎰-200100d )2100(qq(B) ⎰-100200d )2100(q q (C) ⎰-qq d )2100((D) ⎰-200100d )1002(q q二、计算题(每小题7分,共21分) 1.已知矩阵⎥⎦⎤⎢⎣⎡-=⎥⎦⎤⎢⎣⎡--=⎥⎦⎤⎢⎣⎡-=024*********C B A ,,,求:AB +C 。
定量分析计算例题

定量分析计算例题例1 呋塞米含量测定:取本品0.4988g,加乙醇30ml,微热使溶解,放冷,加甲酚红指示液4滴与麝香草酚兰指示液1滴,用氢氧化钠滴定液(0.1003mol/L)滴定至溶液显紫红色,消耗氢氧化钠滴定液(0.1003mol/L)14.86ml;并将滴定的结果用空白试验校正,消耗氢氧化钠滴定液(0.1003mol/L)0.05ml。
每1ml氢氧化钠滴定液(0.1mol/L)相当于33.07mg的呋塞米。
按干燥品计算,含C12H11ClN2O5S不得少于99.0%。
【98.5%】例2 司可巴比妥原料药含量测定:取本品0.1043g,置250ml碘量瓶中,加水10ml,振摇使溶解,精密加溴滴定液(0.1 mol/L)25ml,再加盐酸5ml,立即密塞并振摇1分钟,在暗处静置15分钟后,微开瓶塞,加碘化钾试液10ml,立即密塞,摇匀后,用硫代硫酸钠滴定液(0.1012mo l/L)滴定,至近终点时,加淀粉指示液,继续滴定至蓝色消失,并将滴定结果用空白试验校正。
每1ml溴滴定液(0.1 mol/L)相当于13.01mg的C12H17N2NaO3。
按干燥品计算,含C12H17N2NaO3不得少于98.5%。
已知样品消耗硫代硫酸钠滴定液(0.1012mol/L)17.20ml,空白试验消耗硫代硫酸钠滴定液(0.1012m o l/L)25.02ml。
【98.7%】例3 奥沙西泮原料药含量测定:精密称定本品0.0157g,置200ml容量瓶中,加乙醇150ml,于温水浴中加热,振摇使溶解,放冷,用乙醇稀释至刻度,摇匀,精密量取5ml,置100ml容量瓶中,用乙醇稀释至刻度,摇匀,按分光光度法,在229nm处测定吸光度为0.480;另精密称取奥沙西泮对照品0.0149g,同法操作,测得229n m处吸光度为0.460;《中国药典》规定,本品按干燥品计算,含C15H11ClN2O2应为98.0%~102.0%。
(完整版)定量分析化学习题汇总.docx

第一章定量分析概论习题一1.将下列数据修约为两位有效数字3.667 ;3.651 ;3.650 ;3.550 ; 3.649 ;pK a=3.664解: 3.7 ;3.7 ; 3.6 ; 3.6 ;3.6 ;3.662.根据有效数字运算规则计算下列结果:(1)2.776+36.5789 - 0.2397+6.34(2)( 3.675 ×0.0045 )- (6.7 ×10-2 )+(0.036 ×0.27)(3)50.00 ×( 27.80 -24.39 )× 0.11671.3245解:( 1)45.46 ;( 2)- 0.040 ;( 3)15.13.测定镍合金的含量,6次平行测定的结果是34.25%、34.35%、34.22%、34.18%、34.29%、34.40%,计算(1)平均值;中位值;平均偏差;相对平均偏差;标准偏差;平均值的标准偏差。
(2)若已知镍的标准含量为34.33%,计算以上结果的绝对误差和相对误差。
解:( 1)34.28%;34.27%; 0.065%;0.19%; 0.082%; 0.034%(2)- 0.05%;;- 0.15%4.分析某试样中某一主要成分的含量,重复测定 6 次,其结果为 49.69%、50.90%、48.49%、 51.75%、 51.47%、48.80%,求平均值在 90%、95%和 99%置信度的置信区间。
解:置信度为 90%的置信区间μ =(50.18 ±1.15 ) %置信度为 95%的置信区间μ =(50.18 ±1.46 ) %置信度为 99%的置信区间μ =(50.18 ±2.29 ) %14.用某法分析汽车尾气中 SO2含量( %),得到下列结果: 4.88 ,4.92 , 4.90 ,4.87 ,4.86 ,4.84 ,4.71 ,4.86 ,4.89 ,4.99 。
高中化学定量分析练习题参考答案

高中化学定量分析练习题参考答案1. 题目:计算溶液中溶质的浓度答案:在这个问题中,我们可以采用浓度公式来计算溶液中溶质的浓度,即浓度(C)等于溶质的物质量(m)除以溶液的体积(V)。
具体计算步骤如下:步骤一:确定需要计算的溶质的量(单位可根据题目给出的信息决定,如克、摩尔等)。
步骤二:确定溶液的体积(单位可根据题目给出的信息决定,如升、毫升等)。
步骤三:将溶质的量除以溶液的体积,得到溶质的浓度。
确保单位一致。
举例:假设有一个溶液中含有25克NaCl,溶液的体积为500毫升。
我们可以使用上述公式计算出NaCl的浓度:C = m/V = 25 g / 500 mL = 0.05 g/mL = 50 g/L因此,该溶液中NaCl的浓度为50克/升。
2. 题目:酸碱中和反应的计算答案:酸碱中和反应主要涉及到物质的化学计量比例。
在计算酸和碱反应时,需要确定反应方程式,并根据反应方程式中酸碱的化学计量比例进行计算。
步骤一:列出反应方程式,确定反应物和生成物。
步骤二:确定反应物的化学计量比例。
通过平衡反应方程式,可以得到各个物质的摩尔比例。
步骤三:根据题目给出的物质的量(单位可以是克、摩尔等),按照摩尔比例计算其他物质的量。
举例:考虑以下反应方程式:2HCl + NaOH → NaCl + H2O假设题目中给出了HCl的量为30毫摩尔,我们可以按照酸碱的化学计量比例进行计算:根据反应方程式,HCl与NaOH的摩尔比例为2:1。
因此,NaOH的量为HCl量的一半,即15毫摩尔。
生成物NaCl和H2O的量分别等于NaOH的量,即15毫摩尔。
因此,在此次酸碱中和反应中,HCl与NaOH的摩尔量分别为30毫摩尔和15毫摩尔,生成物NaCl和H2O的摩尔量均为15毫摩尔。
3. 题目:氧化还原反应的计算答案:氧化还原反应涉及到物质的电荷转移,常常需要通过计算反应物的物质量或摩尔数来计算其他物质的物质量或摩尔数。
步骤一:列出氧化还原反应的反应方程式,确定反应物和生成物。
定量分析学考试试题及答案

定量分析学考试试题及答案1. 题目描述以下是一份定量分析学考试试题,包含选择题和计算题。
请仔细阅读每道题目,并根据题目要求提供相应的答案和解析。
2. 选择题2.1 问题描述:某公司在过去的3年内,每年销售额均增长30%。
如果该公司去年的销售额为50万美元,今年的销售额为多少?A. 65万美元B. 70万美元C. 75万美元D. 80万美元2.2 问题描述:某品牌手机的市场份额在过去的5年内每年稳定增长3%。
如果该品牌手机去年的市场份额为15%,今年的市场份额为多少?A. 15.45%B. 15.95%C. 16.45%D. 16.95%2.3 问题描述:某投资组合在过去的2年内每年的回报率分别为10%和12%。
如果该投资组合去年的总回报率为15%,今年的总回报率为多少?A. 14%B. 15%C. 16%D. 17%3. 计算题3.1 问题描述:一辆汽车在过去的4小时内以每小时60公里的速度行驶。
如果这辆汽车在第二个小时行驶时速度突然下降为每小时40公里,在第三个小时时重新加速至每小时80公里,那么这辆汽车的总行驶路程是多少公里?3.2 问题描述:某商品在过去的3个季度内的销售量分别为100、150和200个,而价格分别为10、8和6美元。
根据这些数据,请计算该商品的平均价格。
4. 答案和解析2.1 答案:C. 75万美元解析:根据题目中提到的公司销售额每年增长30%,可得到去年的销售额为50万美元。
今年的销售额可通过去年的销售额乘以增长率(1+0.3),即50万美元 × 1.3 = 65万美元。
因此,今年的销售额为75万美元。
2.2 答案:A. 15.45%解析:根据题目中提到的市场份额每年增长3%,可得到去年的市场份额为15%。
今年的市场份额可通过去年的市场份额乘以增长率(1+0.03),即15% × 1.03 = 15.45%。
因此,今年的市场份额为15.45%。
2.3 答案:D. 17%解析:根据题目中提到的投资组合去年的总回报率为15%以及前两年的回报率分别为10%和12%,我们可以设今年的回报率为x。
定量分析概论部分习题.doc

定量分析概论部分习题.doc定量分析概论部分习题一、下列情况引起的误差属于哪种误差,如果是系统误差,如何减免?1.天平盘被腐蚀2.天平零点有微小波动3.读数时,发现标尺有些漂移4.试剂中含有微量杂质干扰主反应5.试剂中还有微量待测组分6.待测液未充分混均7.滴定管读数最后一位估读不准8.滴定管刻度不均匀9.测量过程中,电压温度的波动10.滴定过程中,滴定剂不慎滴在台面上二、根据有效数字修约规则,将下列数据修约到小数点后第三位。
3.1415926;0.51749;15.454546;0.378502;7.6915;2.3625三、根据有效数字运算计算下式。
1.50.2+2.51-0.6581 = ? (52.1)2.0.0121X25.66X2.7156=? (0.114)八八eg /20.00-14.39)162.2060.0982 x ----------------- x -----------3. -------------- ————,--------------- --- x!00% = ?(21.0%)1.41824. 1.187X0.85+9.6X 10-3 - 0.0326 X 0.00824 4- 2.1 X 10-3 = ?(0.9)四、滴定结果的计算1.以间接法配制O-lmol L'1的盐酸溶液,现用基准物质Na2CO3标定。
准确称取基准试剂Na2CO30.1256g,置于250mL锥形瓶中,加入20?30mL蒸馅水完全溶解后,加入甲基橙指示剂,用待测HC1标准溶液滴定,到达终点时消耗的体积为21.30mL,计算该HC1 标准溶液的浓度o (OJlBmol-L'1)2.测某试样中铝的含量,称取0.1996g试样,溶解后加入c(EDTA)=0.02010 mol-I/1的标准溶液30.00mL,调节酸度并加热使AF+完全反应,过量的EDTA标准溶液用c(Zn2+)=0.02045 molT标准溶液网滴至终点,消耗Zn"标准溶液6.00mL。
(完整版)《定量分析》测试题(有答案)(可编辑修改word版)

(完整版)《定量分析》测试题(有答案)(可编辑修改word版)《定量分析》测试题(A)⼀、选择题:1、减⼩偶然误差的⽅法:(C )A、⽤标准样作对照实验;B、⽤标准⽅法作对照实验;C、增加平⾏测定次数,舍去可疑值后,取其余数据平均值;D、校准仪器。
2、4.300 ? (240.2 - 230.20)计算式的结果有效数字应为 B 位?5.2000A、四位B、三位C、⼆位D、⼀位3、PM= 3.240 的有效数字位数( B )A、四位B、三位C、⼆位D、⼀位4、下列说法正确的是:(C )A、精密度是衡量系统误差⼤⼩的尺度;B、精密度好,则准确度⾼;C、精密度好是准确度⾼的前提;D、精密度与准确度没有实质性区别。
5、下列四组数据,按Q0.9检验法,只有⼀组应将逸出值0.2038 舍去,这组数据是( B )A、0.2038 0.2042 0.2043 0.2048 0.2052B、0.2038 0.2048 0.2049 0.2052 0.2052C、0.2038 0.2046 0.2048 0.2050 0.2052D、0.2038 0.2044 0.2046 0.2050 0.20526、滴定的初读数为(0.05 ± 0.01)ml, 终读数为(19.10 ± 0.01)ml ,滴定剂的体积波动范围:(C )A、(19.05 ± 0.01)mlB、(19.15 ± 0.01)mlC、(19.05 ± 0.02)mlD、(19.15 ± 0.02)ml7、有五位学⽣测定同⼀试样,报告测定结果的相对平均偏差如下,其中正确的是:( C )A、0.1285%B、0.128%C、0.13%D、0.12850%8、⽤差减法从称量瓶中准确称取0.4000g 分析纯的NaOH 固体,溶解后稀释到100.0ml ,所得NaOH 溶液的浓度为( A )A、⼩于0.1000mol·l-1B、等于0.1000mol·l-1C、⼤于0.1000mol·l-1D、上述三种情况都有可能9、某学⽣为改善甲基橙指⽰剂的变⾊敏锐性,将它与中性染料靛蓝混合,但使⽤时发现混合指⽰剂在不同酸度的溶液中具有相近的颜⾊,对此合理的解释为:( B )A、甲基橙与靛蓝两者颜⾊没有互补关系B、靛蓝过量C、甲基橙过量D、该混合指⽰剂在碱性区域变⾊10、0.1mol·l-1NaOH 滴定20.00ml 0.1mol·l-1⼆元酸H2A (Ka1 = 1.0×10-4,Ka2 = 1.0 ×10-6), 要指⽰可能出现的突跃,应使⽤的指⽰剂为(D )A、甲基红和酚酞B、甲基红或酚酞C、甲基红D、酚酞11、⽤盐酸标准溶液滴定NH3·H2O—NH4Cl 缓冲液中的NH3·H2O 的含量,宜采⽤的⽅法:( D )A、先加⼊甲醛与NH4+作⽤后,再滴定;B、先⽤NaOH 标准溶液将NH4+滴定为NH3·H2O,再⽤HCl 滴定NH3·H2O的总量;C、加⼊NaOH 并加热蒸发NH3⽤硼酸吸收后滴定;D、加⼊甲基红指⽰剂后直接滴定。
高考化学复习 物质的定量分析含答案及解析

物质的定量分析(时间:45分钟满分:100分)一、选择题(本题包括12小题,每小题5分,共60分,每小题只有一个选项符合题目要求)1.电子天平是定量分析中常用的精密仪器,下列关于电子天平的说法正确的是( )A.电子天平操作方便、读数稳定、准确度高,不同型号的电子天平具有相同的精确度B.电子天平是电子仪器,十分精密,不需要校准和调零C.电子天平有归零键,烧杯不洁净或潮湿不影响使用D.电子天平使用时,要关上附近的窗户,不要撞击使用天平所在的桌面;读数时,侧门应关闭,防止气流影响称重答案D解析电子天平十分精密,不同型号的电子天平具有不同的精确度;使用时需要校准和调零;烧杯不洁净或者潮湿都不能使用其称量。
2.下列关于滴定的说法正确的是( )A.所有的滴定实验都需要加指示剂B.滴定实验中待测溶液一定盛放于锥形瓶中C.酸碱中和滴定只适用于强酸或强碱浓度的测定D.所有的滴定都需要用到酸式或碱式滴定管答案D解析A项,用酸性KMnO4溶液进行的氧化还原滴定一般不需再另加指示剂;B项,待测液和标准液都可盛放在锥形瓶中;C项,酸碱中和滴定也可用于弱酸、弱碱浓度的测定;D项,不管哪种滴定都需要用滴定管逐滴滴加液体。
3.在25 mL的碱式滴定管中盛有溶液,液面恰好在20 mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为( ) A.5 mL B.20 mLC.大于5 mLD.小于5 mL答案C解析滴定管最上端的刻度为0,且滴定管最下端的一部分溶液并不能通过滴定管刻度反映出来。
4.下列有关实验的叙述,正确的是( )A.用待测液润洗滴定用的锥形瓶B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pHC.为减小中和滴定误差,锥形瓶应洗净烘干后才能使用D.读取滴定管内液体的体积,俯视读数导致读数偏小答案D解析用待测液润洗锥形瓶相当于增加待测液,会引起滴定误差,A错;pH试纸不能润湿,润湿后会改变待测液的浓度,可能导致测定结果不准,B错;C项中,锥形瓶不需要烘干,洗净即可。
《定量分析》测试题(有答案)

《定量分析》测试题(A)一、选择题:1、减小偶然误差的方法:(C )A、用标准样作对照实验;B、用标准方法作对照实验;C、增加平行测定次数,舍去可疑值后,取其余数据平均值;D、校准仪器。
2、2000.5)20. 2302.240(300.4-⨯计算式的结果有效数字应为 B 位?A、四位B、三位C、二位D、一位3、PM= 3.240 的有效数字位数( B )A、四位B、三位C、二位D、一位4、下列说法正确的是:(C )A、精密度是衡量系统误差大小的尺度;B、精密度好,则准确度高;C、精密度好是准确度高的前提;D、精密度与准确度没有实质性区别。
5、下列四组数据,按Q0.9检验法,只有一组应将逸出值0.2038舍去,这组数据是( B )A、0.2038 0.2042 0.2043 0.2048 0.2052B、0.2038 0.2048 0.2049 0.2052 0.2052C、0.2038 0.2046 0.2048 0.2050 0.2052D、0.2038 0.2044 0.2046 0.2050 0.20526、滴定的初读数为(0.05±0.01)ml, 终读数为(19.10±0.01)ml ,滴定剂的体积波动范围:(C )A、(19.05±0.01)mlB、(19.15±0.01)mlC、(19.05±0.02)mlD、(19.15±0.02)ml7、有五位学生测定同一试样,报告测定结果的相对平均偏差如下,其中正确的是:( C )A、0.1285%B、0.128%C、0.13%D、0.12850%8、用差减法从称量瓶中准确称取0.4000g分析纯的NaOH固体,溶解后稀释到100.0ml ,所得NaOH溶液的浓度为( A )A、小于0.1000mol·l-1B、等于0.1000mol·l-1C、大于0.1000mol·l-1D、上述三种情况都有可能9、某学生为改善甲基橙指示剂的变色敏锐性,将它与中性染料靛蓝混合,但使用时发现混合指示剂在不同酸度的溶液中具有相近的颜色,对此合理的解释为:( B )A、甲基橙与靛蓝两者颜色没有互补关系B、靛蓝过量C、甲基橙过量D、该混合指示剂在碱性区域变色10、0.1mol·l-1NaOH滴定20.00ml 0.1mol·l-1二元酸H2A (Ka1= 1.0×10-4,Ka2 = 1.0 ×10-6), 要指示可能出现的突跃,应使用的指示剂为(D )A、甲基红和酚酞B、甲基红或酚酞C、甲基红D、酚酞11、用盐酸标准溶液滴定NH3·H2O—NH4Cl缓冲液中的NH3·H2O的含量,宜采用的方法:( D )A、先加入甲醛与NH4+作用后,再滴定;B、先用NaOH标准溶液将NH4+滴定为NH3·H2O,再用HCl滴定NH3·H2O的总量;C、加入NaOH并加热蒸发NH3用硼酸吸收后滴定;D、加入甲基红指示剂后直接滴定。
《定量分析》测试题(A)(1)1

《定量分析》测试题(A)专业_________ 姓名________ 学号____________一、选择题:1、减小偶然误差的方法:()A、用标准样作对照实验;B、用标准方法作对照实验;C、增加平行测定次数,舍去可疑值后,取其余数据平均值;D、校准仪器。
2、4.300 (240.2 230.20)计算式的结果有效数字应为5.2000位?A、四位B、三位C、二位D、一位3、PM= 3.240的有效数字位数()A、四位B、三位C、二位D、一位4、下列说法正确的是:()A、精密度是衡量系统误差大小的尺度;B、精密度好,则准确度高;C、精密度好是准确度高的前提;D、精密度与准确度没有实质性区别。
5、下列四组数据,按Q o.9检验法,只有一组应将逸出值0.2038舍去,这组数据是()A、0.20380.20420.2043 0.20480.2052B、0.2038 0.20480.20490.20520.2052C、0.20380.20460.2048 0.20500.2052D、0.2038 0.20440.20460.20500.20526、滴定的初读数为(0.050.01)ml,终读数为(19.100.01)ml,滴定剂的体积波动范围:()A、(19.050.01) mlB、(19.150.0)ml C、( 19.05 0.02) ml D、(19.150.02) ml7、有五位学生测定同一试样,报告测定结果的相对平均偏差如下,其中正确的是:()A、0.1285%B、0.128%C、0.13%D、0.12850%8、用差减法从称量瓶中准确称取0.4000g分析纯的NaOH固体,溶解后稀释到100.0ml ,所得NaOH溶液的浓度为()A、小于0.1000mol卜1B、等于0.1000mol • 1C、大于0.1000mol l 7 1D、上述三种情况都有可能9、某学生为改善甲基橙指示剂的变色敏锐性,将它与中性染料靛蓝混合,但使用时发现混合指示剂在不同酸度的溶液中具有相近的颜色,对此合理的解释为:()A、甲基橙与靛蓝两者颜色没有互补关系B、靛蓝过量C、甲基橙过量D、该混合指示剂在碱性区域变色10、0.1mol l 71 NaOH 滴定20.00ml 0.1mol l7 1二元酸H2A (Ka1 = 1.0 W74, Ka2 = 1.0 1076),要指示可能出现的突跃,应使用的指示剂为()A、甲基红和酚酞B、甲基红或酚酞C、甲基红D、酚酞11、用盐酸标准溶液滴定NH3 H2O —NH4CI缓冲液中的NH3 H2O的含量,宜采用的方法:A、先加入甲醛与NH4*作用后,再滴定;B、先用NaOH标准溶液将NH4+滴定为NH3出。
高三化学二轮专题训练--(10)

O O R'O 高三化学二轮专题训练 (10)7.用N A 表示阿伏伽德罗常数的值,下列说法正确的是( )A .由2H 和18O 所组成的水11g ,所含的中子数为4N AB .1mol CO 2中含有的共价键的数目为2N AC .在0.1mol/L K 2CO 3溶液中,阴离子数目大于0.1N AD .NO 2和H 2O 反应毎生成2mol HNO 3时的电子数目为2N A8.常温下,下列各组离子在指定的溶液中可能大量共存的是( )A .无色透明溶液中:Al 3+、Ca 2+、Cl -、HCO 3-B .含大量Fe 3+的溶液中:K +、I -、SO 42-、NO 3-C .与Al 反应放出H 2的溶液中:NH 4+、Na +、NO 3-、F -D .由水电离出的c (H +) = 1.0×10-14mol/L 的溶液中:Mg 2+、K +、Cl -、SO 42-9.分子式为C 4H 8O 2可发生水解的同分异构体有(不考虑立体异构)A .2种B .3种C .4种D .5种10.2012年12月,酒鬼酒塑化剂事件引起大家关注,塑化剂中主要含有的是邻苯二甲酸酯( R 和R ’为不同的烷基)类物质,关于邻苯二甲酸酯的下列叙述正确的是( )A .若R 为甲基,R ’为乙基,其分子式为C 11H 13O 4B .1mol 邻苯二甲酸酯可以和2mol NaOH 反应C .1mol 邻苯二甲酸酯可以和5mol H 2加成D .苯环上的一氯代物有2种11.下列实验操作能达到目的的是( )A .可用图①所示装置收集SO 2B .可用图②所示装置比较KMnO 4、Cl 2、S 的氧化性强弱C .可用图③所示装置除去CH 4中混有的少量C 2H 4D .可用图④所示装置防止铁钉生锈12.目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。
这种电池使用特殊技术吸附空气中的氧,以苛性钠溶液为电解质,电池放电时的总反应为2Zn + O2= 2ZnO,下列判断正确的是( )A.放电时,OH-向负极方向移动B.放电时,正极反应式为Zn + 2OH- - 2e- = ZnO + H2OC.充电时,Zn发生氧化反应D.充电时,阴极反应为O2 + 2H2O + 4e- = 4OH-13.单质碳和氧化铜在一定温度下反应时,氧化铜可被还原为Cu20、Cu。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题训练(十) 定量分析计算考试题及答案
姓名:_____________ 年级:____________ 学号:______________
题型选择题填空题
简答题xx题xx题xx题总分
得分
一、计算题(共8题)
1.将适量二氧化碳通入100 g氢氧化钠溶液中,恰好完全反应后,得到108.8 g
碳酸钠溶液。
请计算:
(1)参加反应的二氧化碳的质量为________g。
(2)氢氧化钠溶液的溶质质量分数。
【答案】(1)8.8
(2)解:设氢氧化钠溶液中溶质的质量分数为x。
2NaOH +CO2===Na2CO3+H2O
8044
100 g×x8.8 g
=
x=16%
答:氢氧化钠溶液的溶质质量分数为16%。
难度:中等知识点:利用化学方程式的简单计算
2.某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下:
图KZ10-1
请回答下列问题。
(1)滤液可作化肥使用,你认为它属于________肥。
(2)该同学制得氧气的质量是________g。
(3)计算滤液中溶质质量分数。
【答案】(1)钾(或K) (2)4.8
(3)解:设生成氯化钾的质量为x。
2KClO32KCl+3O2↑
14996
x4.8 g
评卷人得分
=x=7.45 g
滤液中氯化钾的质量分数为×100%=14.9%。
答:滤液中溶质质量分数为14.9%。
难度:中等知识点:利用化学方程式的简单计算
3.今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气。
先向气体发生装置中加入一定量的锌粒,然后将60克稀硫酸分三次加入,每次生成气体的质量如下表:
次数
第一次
第二次
第三次
加入稀硫酸质量/g
20
20
20
生成氢气的质量/g
0.08
0.08
0.04
试计算:(1)共制得氢气________g。
(2)实验所用稀硫酸中溶质的质量分数。
(写出计算过程)
【答案】(1)0.2
(2)解:设20 g稀硫酸中所含硫酸的质量为x。
Zn+H2SO4===ZnSO4+H2↑
982
x0.08 g
=x=3.92 g
所用稀硫酸中溶质的质量分数为×100%=19.6%。
答:实验所用稀硫酸中溶质的质量分数为19.6%。
难度:中等知识点:酸和碱单元测试
4.学习小组测定某工业废水(含有H2SO4、HNO3,不含固体杂质)中H2SO4的含量。
取100 g废水于烧杯中,加入100 g BaCl2溶液,恰好完全反应,经过滤得到176.7 g溶液(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)。
(1)充分反应后生成沉淀的质量为________g。
(2)该工业废水中硫酸的质量分数为多少?(写出计算过程)
(3)为避免工业废水污染环境,排放前应对废水进行中和处理,需加入的物质是________。
【答案】(1)23.3
(2)解:设100 g工业废水中硫酸的质量为x。
BaCl2+H2SO4===BaSO4↓+2HCl
98233
x23.3 g
=
x=9.8 g
该工业废水中硫酸的质量分数为×100%=9.8%。
答:该工业废水中硫酸的质量分数为9.8%。
(3)氢氧化钙
难度:中等知识点:化学与生活单元测试
5..某合作学习小组的同学们,欲测定一定量的某种石灰石样品中碳酸钙的质量,进行了如下实验:(1)配制溶质质量分数为7.3%的稀盐酸。
图KZ10-2
①配制100 g溶质质量分数为7.3%的稀盐酸,需图KZ10-2所示盐酸的质量________g。
②量取盐酸与水时,视线要与量筒内液体凹液面的________保持水平,再读出液体的体积;将两种液体都倒入________(填仪器名称)中,用玻璃棒搅拌,使溶液混合均匀。
(2)将(1)中配制好的稀盐酸加入盛有石灰石样品的烧杯中,产生气体的质量与加入的稀盐酸的质量关系如图KZ10-3所示(假设石灰石样品中的杂质不与稀盐酸反应)。
计算:该石灰石样品中碳酸钙的质量。
图KZ10-3
【答案】(1)①20②最低处烧杯
(2)解:设该石灰石样品中碳酸钙的质量为x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
10073
x75 g×7.3%
=x=7.5 g
答:该石灰石样品中碳l=x=9.8 g
稀硫酸中溶质的质量分数为×100%=9.8%。
答:稀硫酸中溶质的质量分数为9.8%。
难度:中等知识点:溶质的质量分数
7.硫酸亚铁在工农业生产中有重要用途,也有较高的医用价值。
工业上用废铁屑和含硫酸的废液来制取硫酸亚铁,变废为宝。
现用5.6 t铁屑与100 t废液恰好完全反应(已知铁屑只和废液中的硫酸反应),请你计算:
(1)可生成硫酸亚铁的质量。
(2)所用废液中硫酸的溶质质量分数。
【答案】解:(1)设生成硫酸亚铁的质量为x,100 t废液中硫酸的质量为y。
Fe +H2SO4===FeSO4+H2↑
5698152
5.6 tyx
=x=15.2 t
=y=9.8 t
(2)废液中硫酸的溶质质量分数为×100%=9.8%。
答:(1)可生成硫酸亚铁的质量为15.2 t;(2)所用废液中硫酸的溶质质量分数为9.8%。
难度:中等知识点:金属及金属材料单元测试
8.一定质量的金属铁和稀硫酸恰好完全反应,产生气体的质量为0.2 g。
(1)反应后溶液中溶质FeSO4的质量为________g。
(2)向反应后的溶液中加入BaCl2溶液,当加入的BaCl2溶液质量为208 g时,恰好完全反应,此时生成沉淀的质量为________g。
(3)计算所加BaCl2溶液的溶质质量分数________。
【答案】(1)15.2 (2)23.3 (3)10%
[解析] (1)设反应生成硫酸亚铁的质量为x。
Fe+H2SO4===FeSO4+H2↑
1522
x0.2 g
=x=15.2 g
(2)设加入氯化钡溶液后生成沉淀的质量为y,反应的氯化钡的质量为z。
BaCl2+FeSO4===BaSO4↓+FeCl2
208152233
z15.2 gy
=y=23.3 g
=z=20.8 g
(3)溶质质量分数是溶质质量与溶液质量之比,则氯化钡溶液的溶质质量分数为×100%=10%。
难度:中等知识点:金属的化学性质。
