2016年巨细胞病毒核酸检测室间质量评价计划及要求
ELISA法检测巨细胞病毒CMV抗体测定(CMV-IgM)标准操作程序

1.检测原理采用酶联免疫捕获法原理进行检测。
利用抗人IgM单克隆抗体制备包被板,辣根过氧化物酶标记CMV 抗原制备酶结合物。
通过免疫反应形成固相二抗-抗体-抗原-酶复合物,该复合物催化底物显色,显色强度与CMV-IgM抗体含量成正比。
2. 样本类型及处理方法3.试剂注意事项:开启所有试剂(包括校准品、标准品、质控品)需注明日期及签名。
每个试剂容器都需贴上写有以下内容的标签:启用日期、截止日期。
开启时应检查试剂是否变色,是否肉眼可见的细菌生长迹象、浊度、沉淀反应等,这些表示试剂已经变质或超过保质期。
不同批号试剂盒中各组份不可以互换,组份所标示量为最低分装量。
4.仪器设备备注:“溯源方式”栏填写送较、自校、送检、自检、比对等。
5.质量控制5.1使用的质控品5.2质控周期5.2.1每一批次标本均需运行一次质控。
5.2.2每一批标本最大量为:92个标本。
5.3变异系数CV<20%5.4质控判断标准即时质控法5.5失控处理:对质控失控需查找原因并进行分析5.5.1先观察整块酶标板显色是否正常。
5.5.2查找操作过程是否按照SOP文件进行。
5.5.3质控品S/CO值>3SD或质控品S/CO值<3SD,结合模式报告结果。
6.操作步骤6.1选用试剂:郑州安图生物工程股份有限公司6.2平衡:从冷藏环境中取出的试剂盒内全部瓶装试剂及待测标本所需微孔反应条应放置室温平衡30分钟后方可使用,余者应及时放入有干燥剂的自封袋封存于冰箱中备用。
在平衡试剂的同时,待测标本需放置室温平衡30分钟后再行测试。
6.3配液:取1包固体洗液用500ml纯化水溶解后备用。
配制好的洗涤液如用不完可放置2-8℃冷藏储存,使用前应放置室温平衡20分钟后方可使用。
6.4加样:用移液器在反应孔中分别加入阴、阳性对照血清和CMV-IgM质控品各100ul,测定孔中加入样品稀释液100ul,再依次加入待测血清样品10ul,用封口膜封板。
PCR实验室检查要点(2016)

聚合酶链反应(PCR)检验实验室检查要点指南(2016版)聚合酶链反应检验实验室是指通过基因扩增的方式检测特定的DNA或RNA的检验实验室。
聚合酶链反应(Polymerase Chain Reaction,PCR)是一种在体外特异性扩增靶DNA序列的技术,其基本过程为模板双链DNA的变性、引物与模板DNA的退火和在DNA 聚合酶引导下的链延伸反应三个阶段的多次循环。
每一次循环后的扩增产物均可作为下一轮循环的模板,理论上,扩增产物量呈指数形式上升,即经过n个循环后,产物量增加到2n倍。
PCR试剂操作简单,短时间内在体外可获得数百万个特异靶DNA序列的复制,为临床疾病的诊断、治疗监测和预后评估提供了一种极有帮助的实验室辅助手段。
PCR检验实验室是PCR试剂生产企业在产品检验过程中不可缺少的工作环境,其环境控制水平和质量管理水平直接影响着最终产品是否合格,能否放行。
由于该产品本身的特殊性,《医疗器械生产质量管理规范附录体外诊断试剂》、《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》条款中,明确对PCR试剂的生产和检验环境做出规定。
此外现行卫生行业的法规、标准以及相关文献中对于PCR检验实验室均作出规定,主要涉及《全国临床检验规程》(第三版)、《医疗机构临床基因扩增管理办法》(卫办医政发〔2010〕194号)、《医疗机构临床基因扩增检验实验室工作导则》及《临床诊断中聚合酶链反应(PCR)技术的应用》(WS/T 230-2002)等行业标准的相关要求。
本检查指南旨在帮助北京市医疗器械监管人员增强对PCR检验相关过程的认知和把握,指导全市医疗器械监管人员对PCR检验实验室设计建设与质量控制的监督检查工作。
同时,为PCR试剂生产企业在PCR检验实验室的设计建造和管理要求提供参考。
当国家相关法规、标准、检查要求发生变化时,应当重新讨论以确保本检查指南持续符合要求。
一、适用范围本检查指南可作为北京市食品药品监督管理局组织、实施的体外诊断试剂产品注册质量管理体系现场核查、《医疗器械生产许可证》现场核查、医疗器械生产监督检查等各项涉及PCR检验实验室检查的参考资料。
卫生部临床检验中心室间质量评价标准

2017年卫生部临床检验中心室间质量评价标准临床化学NCCL-C-012017年2016年钾靶值±6%靶值±0.5mmol/L钠靶值±4%靶值±4mmol/L氯靶值±5%靶值±5%钙靶值±5%靶值±0.250mmol/L1.0mg/dL磷靶值±10%靶值±0.097mmol/L或靶值±10.7%取大者葡萄糖靶值±7%靶值±0.33mmol/L6mg/dL或±10%取大者尿素靶值±8%靶值±0.71mmol/L或±9%取大者尿酸靶值±12%靶值±17%肌酐靶值±12%靶值±26.5ummol/L0.3mg/dL或±15%取大者总蛋白靶值±5%靶值±10%白蛋白靶值±6%靶值±10%总胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值±30%总胆红素靶值±15%靶值±6.84mmol/L0.4mg/dL或±20%取大者丙氨酸氨基转移酶靶值±16%靶值±20%天门冬氨酸氨基转移酶靶值±15%靶值±20%碱性磷酸酶靶值±18%靶值±30%淀粉酶靶值±15%靶值±30%肌酸激酶靶值±15%靶值±30%乳酸脱氢酶靶值±11%靶值±20%直接胆红素靶值±2s靶值±2s铁靶值±15%靶值±20%总铁结合力靶值±2s 镁靶值±15%靶值±25%锂靶值±0.3mmol/L或±20%取大者铜靶值±2s锌靶值±2s酸性磷酸酶靶值±30%γ-谷氨酰基转移酶靶值±11%靶值±20%α-羟丁酸脱氢酶靶值±30%靶值±30%胆碱酯酶靶值±20%靶值±20%脂肪酶靶值±20%靶值±20%心肌标志物肌酸激酶-MBug/L靶值±30%靶值±30%肌红蛋白靶值±30%靶值±30%肌钙蛋白-I靶值±30%靶值±30%肌钙蛋白-T靶值±30%靶值±30%肌酸激酶-MBU/L靶值±30%超敏CRP靶值±30%靶值±30%同型半胱氨酸靶值±2.5μmol/L或±20%取大者脂类胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值±30%靶值±30%低密度脂蛋白胆固醇靶值±30%靶值±30%载脂蛋白A1靶值±30%靶值±30%载脂蛋白B靶值±30%靶值±30%脂蛋白a靶值±30%血气分析pH靶值±0.04靶值±0.04pCO2靶值±5mmHg或±8%取大者靶值±5mmHg或±8%取大者pO2靶值±8%靶值±2SNa+靶值±4%靶值±4mmol/LK+靶值±6%靶值±0.5mmol/LCa2+靶值±5%靶值±0.25mmol/LCl-靶值±4%靶值±5%特殊蛋白IgG、IgA、IgE、IgM、C3、C4、C-反应蛋白CRP、类风湿因子RF、抗链球菌溶血素OASO、转铁蛋白TRF、前白蛋白PA靶值±25%靶值±25%内分泌总T4靶值±20%靶值±20%叶酸靶值±30%靶值±30%皮质醇、雌二醇、FSH、LH、孕酮、催乳素、睾酮、C-肽、FT3、TT3、FT4、胰岛素、维生素B12、25-OH-VD2、25-OH-VD3、总25-OH-VD靶值±25%靶值±25%肿瘤标志物CEA、AFP、HCG、PSA、CA199、CA125、CA153、β2-微球蛋白、铁蛋白、总β-HCG、游离PSA靶值±25%全血治疗药物监测环孢霉素A、他克莫司、西罗莫司靶值±25%血清治疗药物监测卡马西平靶值±25%地高辛靶值±20%或±0.2μg/L苯妥英靶值±25%茶碱靶值±25%丙戊酸靶值±25%糖化血红蛋白HbA1c靶值±8%脑钠肽/N末端前脑钠肽BNP、NT-proBNP靶值±30%尿液定量生化钾靶值±29%钠靶值±26%氯靶值±26%钙靶值±31%镁靶值±25%磷靶值±23%葡萄糖靶值±20%尿素靶值±21%肌酐靶值±17%总蛋白靶值±44%白蛋白靶值±30%淀粉酶靶值±30%微量白蛋白靶值±30%半胱氨酸蛋白酶抑制剂C半胱氨酸蛋白酶抑制剂C靶值±25%代谢物、总蛋白正确度验证葡萄糖靶值±3.5%尿素靶值±4.0%尿酸靶值±6%肌酐靶值±6%总蛋白靶值±2.8%脂类正确度验证总胆固醇靶值±4.5%甘油三酯靶值±7.5%高密度脂蛋白胆固醇靶值±6.5%酶学正确度验证ALT含磷酸吡哆醛靶值±6%AST含磷酸吡哆醛靶值±5%GGT靶值±5.5%LDH靶值±4%CK靶值±5.5%AMY靶值±7.5%糖化血红蛋白正确度验证HbA1c靶值±6% 电解质正确度验证钠靶值±1.5%钾靶值±2%钙靶值±2%镁靶值±5.5%一般免疫学抗核抗体反应性或阴性抗-HIV反应性或阴性肝炎HBsAg;anti-HBc;HBeAg反应性或阴性风疹反应性或阴性全血细胞计数白细胞计数靶值±15%红细胞计数靶值±6%血红蛋白测定靶值±6%血细胞比容靶值±9%血小板计数靶值±20%MCV靶值±7%MCH靶值±7%MCHC靶值±8%凝血试验PT靶值±15%INR靶值±20%APTT靶值±15%Fbg靶值±20%尿液化学分析比重靶值±1等级PH靶值±1等级蛋白、葡萄糖、胆红素、酮体、红细胞、尿胆原、白细胞阳性时:靶值±1等级亚硝酸盐阴性或阳性红细胞沉降率测定红细胞沉降率靶值±3.0≤10时或靶值±30%>10时流式细胞分析CD3+、CD3+CD4+、CD3+CD8+、CD3-CD16+CD56+、CD3-CD19+靶值±2s血液粘度检测切变率为1/S下的粘度mPa.s靶值±2s切变率为50/S下的粘度mPa.s靶值±2s切变率为200/S下的粘度mPa.s靶值±2s网织红细胞计数网织红细胞百分比%靶值±2s全血细胞计数正确度验证白细胞计数靶值±15%红细胞计数靶值±6%血红蛋白测定靶值±6%血细胞比容靶值±9%血小板计数靶值±20%MCV靶值±7%MCH靶值±7%MCHC靶值±8%凝血因子检测FⅧ、FⅨ靶值±30%D-二聚体检测D-Dimer靶值±2s新生儿遗传代谢病筛查-Phe、TSH苯丙氨酸靶值±30%或±1mg/dL取大值促甲状腺素靶值±30%中孕期母血清产前筛查AFP靶值±30%或±5μg/L取大值hCG靶值±30%β-hCG靶值±30%Free-β-hCG靶值±30%游离雌三醇靶值±30%血铅血铅靶值±40μg/L或±10%取大值便携式血糖检测仪葡萄糖靶值±20%或±1mmol/L取大值脑脊液生化白蛋白靶值±10%或±0.1g/L取大值总蛋白靶值±10%或±0.1g/L取大值氯化物靶值±5%葡萄糖靶值±10%或±1.0mmol/L取大值乳酸脱氢酶靶值±20%IgA靶值±25%IgG靶值±25%IgM靶值±25%乳酸靶值±20%或±0.1mmol/L取大值全血五元素铜靶值±2s锌靶值±2s钙靶值±0.25mmol/L镁靶值±25%铁靶值±20%新生儿遗传代谢病筛查-G6PDG6PD靶值±30%新生儿遗传代谢病筛查-17羟孕酮17-羟孕酮靶值±30% 新生儿遗传代谢病串联质谱筛查-氨基酸和酰基肉碱瓜氨酸靶值±25%亮氨酸靶值±25%甲硫氨酸靶值±25%苯丙氨酸靶值±25%酪氨酸靶值±25%缬氨酸靶值±25%游离肉碱靶值±30%丙酰肉碱靶值±30%异戊酰肉碱靶值±30%辛酰肉碱靶值±30%月桂酰肉碱靶值±30%棕榈酰肉碱靶值±30%十八碳酰肉碱靶值±30%血红蛋白A2和血红蛋白F血红蛋白A2靶值±20%血红蛋白F靶值±20%早孕期母血清产前筛查PAPP-Aμg/L靶值±30%PAPP-AmU/L靶值±30%Free-β-HCGμg/L靶值±30% Free-β-HCGmIU/mL靶值±30%。
PCR实验室检查要点(2016)

聚合酶链反应(PCR)检验实验室检查要点指南(2016版)聚合酶链反应检验实验室是指通过基因扩增的方式检测特定的DNA或RNA的检验实验室。
聚合酶链反应(Polymerase Chain Reaction,PCR)是一种在体外特异性扩增靶DNA序列的技术,其基本过程为模板双链DNA的变性、引物与模板DNA的退火和在DNA 聚合酶引导下的链延伸反应三个阶段的多次循环。
每一次循环后的扩增产物均可作为下一轮循环的模板,理论上,扩增产物量呈指数形式上升,即经过n个循环后,产物量增加到2n倍。
PCR试剂操作简单,短时间内在体外可获得数百万个特异靶DNA序列的复制,为临床疾病的诊断、治疗监测和预后评估提供了一种极有帮助的实验室辅助手段。
PCR检验实验室是PCR试剂生产企业在产品检验过程中不可缺少的工作环境,其环境控制水平和质量管理水平直接影响着最终产品是否合格,能否放行。
由于该产品本身的特殊性,《医疗器械生产质量管理规范附录体外诊断试剂》、《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》条款中,明确对PCR试剂的生产和检验环境做出规定。
此外现行卫生行业的法规、标准以与相关文献中对于PCR检验实验室均作出规定,主要涉与《全国临床检验规程》(第三版)、《医疗机构临床基因扩增管理办法》(卫办医政发〔2010〕194号)、《医疗机构临床基因扩增检验实验室工作导则》与《临床诊断中聚合酶链反应(PCR)技术的应用》(WS/T 230-2002)等行业标准的相关要求。
本检查指南旨在帮助市医疗器械监管人员增强对PCR检验相关过程的认知和把握,指导全市医疗器械监管人员对PCR检验实验室设计建设与质量控制的监督检查工作。
同时,为PCR试剂生产企业在PCR检验实验室的设计建造和管理要求提供参考。
当国家相关法规、标准、检查要求发生变化时,应当重新讨论以确保本检查指南持续符合要求。
一、适用范围本检查指南可作为市食品药品监督管理局组织、实施的体外诊断试剂产品注册质量管理体系现场核查、《医疗器械生产许可证》现场核查、医疗器械生产监督检查等各项涉与PCR检验实验室检查的参考资料。
2016年临床基因扩增检验实验室质量手册

目录实验室公正性说明修订页第一章质量方针分子生物实验室组织结构图分子生物实验室设置平面图第二章管理程序文件程序管理文件编码目录JS-LJ-SMP0000-000 实验室内务管理程序JS-LJ-SMP0001-000 实验室人员配置及培训程序JS-LJ-SMP0002-000 实验室质量控制管理程序JS-LJ-SMP0003-000 仪器设备管理程序JS-LJ-SMP0004-000 临床标本的管理程序JS-LJ-SMP0005-000 实验室生物防护与安全管理程序JS-LJ-SMP0006-000 实验室文件、记录的管理程序JS-LJ-SMP0007-000 实验耗材购买、验收、储放程序JS-LJ-SMP0008-000 抱怨处理程序JS-LJ-SMP0009-000 仪器设备校准程序JS-LJ-SMP0010-000 实验室检测结果报告程序JS-LJ-SMP0011-000 检验过程中发生故障时的应急处理程序JS-LJ-SMP0012-000 实验室清洁消毒程序JS-LJ-SMP0013-000 文件修改程序JS-LJ-SMP0014-000肿瘤分子检测实验室标准操作规程文件编码目录JS-LJ-SOP0000-000 石蜡包埋组织DNA提取标准操作规程JS-LJ-SOP0001-000 石蜡包埋组织样本RNA提取标准操作规程JS-LJ-SOP0002-000 血液DNA提取标准操作规程JS-LJ-SOP0003-000 口腔拭子/唾液DNA提取标准操作规程JS-LJ-SOP0004-000 组织DNA提取标准操作规程JS-LJ-SOP0005-000组织RNA提取标准操作规程JS-LJ-SOP0006-000 反转录标准操作流程JS-LJ-SOP0007-000 基因mRNA表达检测标准操作规程JS-LJ-SOP0008-000 EGFR基因突变Q-PCR 标准操作规程JS-LJ-SOP0009-000 KRAS基因突变Q-PCR 标准操作规程JS-LJ-SOP0010-000 BRAF基因突变Q-PCR 标准操作规程JS-LJ-SOP0011-000 PDGFRA基因突变Q-PCR 标准操作规程JS-LJ-SOP0012-000 叶酸基因多态性 Q-PCR 标准操作规程JS-LJ-SOP0013-000 基因SNP Q-PCR 标准操作规程JS-LJ-SOP0014-000 1p19q LOH 标准操作规程JS-LJ-SOP0015-000 MGMT甲基化标准操作规程JS-LJ-SOP0016-000JS-LJ-SOP0017-000 样本脱包、分类、编号、登录、发放标准操作规程临床标本采集、验收、拒收标准操作规程JS-LJ-SOP0018-000 临床标本保存标准操作规程JS-LJ-SOP0019-000 试剂质检标准操作规程JS-LJ-SOP0020-000 实验结果有效性判断标准操作规程JS-LJ-SOP0021-000 室内质量控制标准操作规程JS-LJ-SOP0022-000 室间质量评价标准操作规程JS-LJ-SOP0023-000 主要仪器使用、维护、校准操作规程JS-LJ-SOP0024-000 实验室废弃物处理程序JS-LJ-SOP0025-000 申请单必须信息JS-LJ-SOP0026-000 肿瘤个体化检测样本采集注意事项JS-LJ-SOP0027-000 叶酸基因检测样本采集注意事项JS-LJ-SOP0028-000 检测报告标准操作规程JS-LJ-SOP0029-000修订页修订序号修订的章节条款简要修订内容批准人批准日期第一章质量方针质量方针题目:质量方针起草:日期:审核:日期:编号:JS-LJ-ZLC0001-000 批准:日期:颁发部门:技术部生效日期:分发部门:技术部临床基因扩增检验实验室是严格按照卫生部、山东省临床基因扩增实验室规范化、标准化要求进行管理与操作,我中心的质量方针为:公正、科学、准确、高效我们的检验工作必须做到:行为公正—任何情况下,不被各种利益所驱动,客观公正、独立诚实地开展检验工作。
病毒鉴定实验室建设基本要求

病毒鉴定实验室建设基本要求
本文档旨在提供病毒鉴定实验室建设的基本要求,以确保实验
室的高效运作和准确的病毒鉴定结果。
实验室设施
- 实验室应建立在合适的场所,远离人流密集区和污染源。
- 实验室应具备充足的空间,以容纳所需的设备、试剂和样品。
- 实验室应配备必要的安全设施,包括通风系统和事故处理装置。
- 实验室内应设有适当的实验台和储存柜,以确保病毒样品的
安全和有序管理。
实验设备
- 实验室应配备先进的病毒鉴定设备,包括核酸提取仪、PCR 仪、荧光显微镜等。
- 实验室应定期维护和校准设备,以确保其功能正常和准确性。
- 实验室应配备足够数量的微量吸管、离心管、试管等必要的
实验用品。
试剂和耗材
- 实验室应采购质量可靠的试剂和耗材,以确保可靠的病毒鉴
定结果。
- 实验室应储备足够的试剂和耗材,以应对各种病毒鉴定需求。
- 实验室应按照规定的存储条件和有效期限储存试剂和耗材。
实验室操作和管理
- 实验室应建立操作手册,详细记录病毒鉴定的操作步骤和标准。
- 实验室操作人员应接受相关培训,熟悉实验操作流程和安全
操作规程。
- 实验室应建立样品流程管理制度,确保样品的准确记录和跟踪。
- 实验室应定期对实验环境进行清洁和消毒,以避免交叉污染。
以上为病毒鉴定实验室建设的基本要求,通过遵守这些要求,
可以建立一个高效、安全和可靠的病毒鉴定实验室。
卫生部临床检验中心室间质量评价计划项目及所属室间

血清
锂(Li)
常规化学、干化学
26
血清
铜(Cu)
常规化学、干化学
27
血清
锌(Zn)
常规化学、干化学
28
血清
γ-谷氨酰基转移酶(GGT)
常规化学、干化学
29
血清
α-羟丁酸脱氢酶(α-HBDH)
常规化学、干化学
30
血清
胆碱酯酶
常规化学、干化学
31
血清
脂肪酶
常规化学、干化学
32
血清
肌酸激酶-MB (CK-MB)
15
血清
天门冬氨酸氨基转移酶(AST)
常规化学、干化学、酶学正确度验证、酶学参考实验室比对
16
血清
总胆红素(TBil)
常规化学、干化学
17
血清
碱性磷酸酶(ALP)
常规化学、干化学、酶学正确度验证、酶学参考实验室比对
18
血清
淀粉酶(AMY)
常规化学、干化学、酶学正确度验证、酶学参考实验室比对
19
血清
肌酸激酶(CK)
常规化学、干化学
6
血清
血糖(Glu)
常规化学、干化学、代谢物/总蛋白正确度验证、代谢物参考实验室比对
7
血清
尿素(Urea)
常规化学、干化学、代谢物/总蛋白正确度验证、代谢物参考实验室比对
8
血清
尿酸(UA)
常规化学、干化学、代谢物/总蛋白正确度验证、代谢物参考实验室比对
9
血清
肌酐(Cre)
常规化学、干化学、代谢物/总蛋白正确度验证、代谢物参考实验室比对
肿瘤标志物、中孕期母血清产前筛查
83
血清
临床检验室间质量评价计划

临床检验室间质量评价计划临床检验室间质量评价计划是一个非常重要的评估体系,它主要目的是为了确保医疗机构的检测服务质量,同时也能够提高患者的诊疗水平和健康保障水平。
以下是关于该计划的详细介绍。
第一步:计划起步阶段该计划的第一步是将各区域或医疗机构纳入质量评价的范畴,并建立起各区域或医疗机构之间的质量评价的关系。
此阶段的动作包括:1.确定评价的科目包括的项目,如生化学、体液学、微生物学、免疫学和分子诊断学等,分别根据各个科目的检测项目和特殊检测要求进行评价,以确保每个科目的检测过程和结果都能达到可靠、准确、流程标准化和稳定的效果。
2.确定各项评估指标,包括参加质控的比例、结果合格率、误差值分布范围、设备维护保养状况、标本运送状况等等。
3.每个质控环节与各区域或医疗机构的质量评价之间进行衔接,确保所评价的关系清晰、完整。
第二步:评价基础建立阶段此阶段主要是通过定期的评估工作,在评价成果得到反馈以及吸取经验后,建立质量评价的基础,保障质量评价的可持续发展。
该阶段需要做以下工作:1. 对于各区域或医疗机构的质量评价进行监督管理,要及时记录各项指标与标准的非合格点,并向相关人员进行反馈,以便于及时改正。
2. 当出现疑难问题时,应由专业人员经过多种方式(电话、在线、现场等)认真解答,确保解决问题的可持续性。
3. 定期召开各区域或医疗机构间质量评价交流会,以确保互通所得、共同进步。
第三步:系统化、标准化建设阶段该阶段主要是从质量管理的角度出发,对质量评价的每一个环节进行规范和标准化的建设,以确保质量评价的持续发展和普及。
此阶段的动作包括:1. 确定评价流程,并建立相关评价表格和指南。
2. 定期对评价体系进行修订和改进,并确保评价标准的透明度和公正性。
3. 对每个评价科目、模块、指标等进行培训和维护,提升评价过程的标准化和可持续性。
总结:临床检验室间质量评价计划是一个很好的评估体系,可以确保各区域或医疗机构之间的质量评价的可持续性,同时也能够保障患者的健康和医疗质量的提高。
巨细胞病毒实验室检测方法流程及其评价
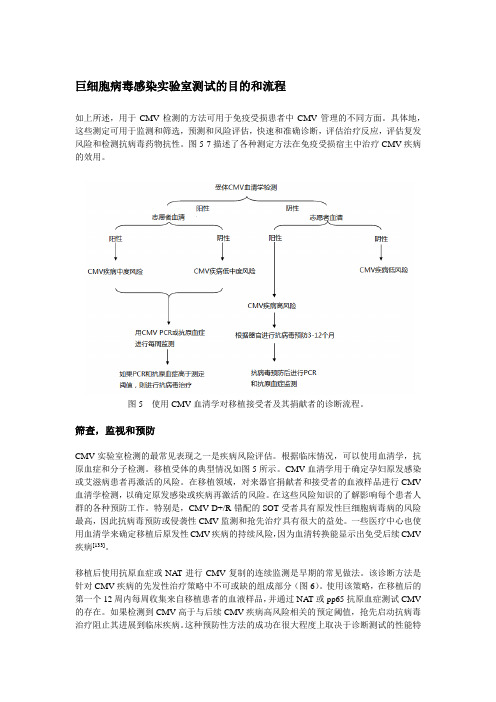
巨细胞病毒感染实验室测试的目的和流程如上所述,用于CMV检测的方法可用于免疫受损患者中CMV管理的不同方面。
具体地,这些测定可用于监测和筛选,预测和风险评估,快速和准确诊断,评估治疗反应,评估复发风险和检测抗病毒药物抗性。
图5-7描述了各种测定方法在免疫受损宿主中治疗CMV疾病的效用。
图5 使用CMV血清学对移植接受者及其捐献者的诊断流程。
筛查,监视和预防CMV实验室检测的最常见表现之一是疾病风险评估。
根据临床情况,可以使用血清学,抗原血症和分子检测。
移植受体的典型情况如图5所示。
CMV血清学用于确定孕妇原发感染或艾滋病患者再激活的风险。
在移植领域,对来器官捐献者和接受者的血液样品进行CMV 血清学检测,以确定原发感染或疾病再激活的风险。
在这些风险知识的了解影响每个患者人群的各种预防工作。
特别是,CMV D+/R-错配的SOT受者具有原发性巨细胞病毒病的风险最高,因此抗病毒预防或侵袭性CMV监测和抢先治疗具有很大的益处。
一些医疗中心也使用血清学来确定移植后原发性CMV疾病的持续风险,因为血清转换能显示出免受后续CMV 疾病[133]。
移植后使用抗原血症或NA T进行CMV复制的连续监测是早期的常见做法。
该诊断方法是针对CMV疾病的先发性治疗策略中不可或缺的组成部分(图6)。
使用该策略,在移植后的第一个12周内每周收集来自移植患者的血液样品,并通过NA T或pp65抗原血症测试CMV 的存在。
如果检测到CMV高于与后续CMV疾病高风险相关的预定阈值,抢先启动抗病毒治疗阻止其进展到临床疾病。
这种预防性方法的成功在很大程度上取决于诊断测试的性能特征,理想情况下,该测试应具有高度敏感性,高度特异性和高预测性。
这种情况下,PCR 和抗原血症测定已经进行测试并比较。
然而,目前使用哪种检测方法(PCR与抗生素血症)的争论备受争议,应该以每个中心机构的可用资源为指导[66,88,134-137]。
pp65抗原和分子方法已经在检测CMV和在引导抢先治疗展示出优秀的临床效用[82,137]。
卫生部临床检验中心室间质量评价标准精选文档

卫生部临床检验中心室间质量评价标准精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-2017年卫生部临床检验中心室间质量评价标准临床化学(NCCL-C-01)2017年2016年钾靶值±6%靶值±L钠靶值±4%靶值±4mmol/L氯靶值±5%靶值±5%钙靶值±5%靶值±LdL)磷靶值±10%靶值±L或靶值±%(取大者)葡萄糖靶值±7%靶值±L(6mg/dL)或±10%(取大者)尿素靶值±8%靶值±L或±9%(取大者)尿酸靶值±12%靶值±17%肌酐靶值±12%靶值±L(dL)或±15%(取大者)总蛋白靶值±5%靶值±10%白蛋白靶值±6%靶值±10%总胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值±30%总胆红素靶值±15%靶值±L(dL)或±20%(取大者)丙氨酸氨基转移酶靶值±16%靶值±20%天门冬氨酸氨基转移酶靶值±15%靶值±20%碱性磷酸酶靶值±18%靶值±30%淀粉酶靶值±15%靶值±30%肌酸激酶靶值±15%靶值±30%乳酸脱氢酶靶值±11%靶值±20%直接胆红素靶值±2s靶值±2s铁靶值±15%靶值±20%总铁结合力靶值±2s镁靶值±15%靶值±25%锂靶值±L 或±20%(取大者)铜靶值±2s锌靶值±2s酸性磷酸酶靶值±30%γ-谷氨酰基转移酶靶值±11%靶值±20%α-羟丁酸脱氢酶靶值±30%靶值±30%胆碱酯酶靶值±20%靶值±20%脂肪酶靶值±20%靶值±20%心肌标志物肌酸激酶-MB(ug/L)靶值±30%靶值±30%肌红蛋白靶值±30%靶值±30%肌钙蛋白-I靶值±30%靶值±30%肌钙蛋白-T靶值±30%靶值±30%肌酸激酶-MB(U/L)靶值±30%超敏CRP靶值±30%靶值±30%同型半胱氨酸靶值±μmol/L 或±20%(取大者)脂类胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值±30%靶值±30%低密度脂蛋白胆固醇靶值±30%靶值±30%载脂蛋白 A1靶值±30%靶值±30%载脂蛋白 B靶值±30%靶值±30%脂蛋白(a)靶值±30% 血气分析pH靶值±靶值±靶值±5mmHg 或±8%(取大者)靶值±5mmHg或±8%(取大者)pO2靶值±8%靶值±2SNa+靶值±4%靶值±4mmol/LK+靶值±6%靶值±LCa2+靶值±5%靶值±LCl-靶值±4%靶值±5%特殊蛋白IgG、 IgA、IgE、IgM、C3、C4、C-反应蛋白(CRP)、类风湿因子(RF)、抗链球菌溶血素O(ASO)、转铁蛋白(TRF)、前白蛋白(PA)靶值±25%靶值±25%内分泌总T4靶值±20%靶值±20%叶酸靶值±30%靶值±30%皮质醇、雌二醇、FSH、LH、孕酮、催乳素、睾酮、C-肽、FT3、TT3、FT4、胰岛素、维生素B12、25-OH-VD2、25-OH-VD3、总25-OH-VD靶值±25%靶值±25%肿瘤标志物CEA、AFP、HCG、PSA、CA199、CA125、CA153、β2-微球蛋白、铁蛋白、总β-HCG、游离PSA靶值±25%全血治疗药物监测环孢霉素 A、他克莫司、西罗莫司靶值±25%血清治疗药物监测卡马西平靶值±25%地高辛靶值±20% 或±μg/L苯妥英靶值±25%茶碱靶值±25%丙戊酸靶值±25%糖化血红蛋白HbA1c靶值±8%脑钠肽/N末端前脑钠肽BNP、NT-proBNP靶值±30%尿液定量生化钾靶值±29%钠靶值±26%氯靶值±26%钙靶值±31%镁靶值±25%磷靶值±23%葡萄糖靶值±20%尿素靶值±21%尿酸靶值±24%肌酐靶值±17%总蛋白靶值±44%白蛋白靶值±30%淀粉酶靶值±30%微量白蛋白靶值±30%半胱氨酸蛋白酶抑制剂C半胱氨酸蛋白酶抑制剂C靶值±25%代谢物、总蛋白正确度验证葡萄糖靶值±%尿素靶值±%尿酸靶值±6%肌酐靶值±6%总蛋白靶值±%脂类正确度验证总胆固醇靶值±%甘油三酯靶值±%高密度脂蛋白胆固醇靶值±%酶学正确度验证ALT(含磷酸吡哆醛)靶值±6%AST(含磷酸吡哆醛)靶值±5%GGT靶值±%LDH靶值±4%CK靶值±%AMY靶值±%ALP靶值±10%糖化血红蛋白正确度验证HbA1c靶值±6%电解质正确度验证钠靶值±%钾靶值±2%钙靶值±2%镁靶值±%一般免疫学抗核抗体反应性或阴性抗-HIV反应性或阴性肝炎(HBsAg,anti-HBc,HBeAg)反应性或阴性风疹反应性或阴性全血细胞计数白细胞计数靶值±15%红细胞计数靶值±6%血红蛋白测定靶值±6%血细胞比容靶值±9%血小板计数靶值±20%MCV靶值±7%MCH靶值±7%MCHC靶值±8%凝血试验PT靶值±15%INR靶值±20%APTT靶值±15%Fbg靶值±20%尿液化学分析比重靶值±1等级PH靶值±1等级蛋白、葡萄糖、胆红素、酮体、红细胞、尿胆原、白细胞阳性时:靶值±1等级亚硝酸盐阴性或阳性红细胞沉降率测定红细胞沉降率靶值±(≤10时)或靶值±30%(>10时)流式细胞分析CD3+、 CD3+CD4+、 CD3+CD8+、 CD3-CD16+CD56+、CD3-CD19+ 靶值±2s血液粘度检测切变率为1/S下的粘度()靶值±2s切变率为50/S下的粘度()靶值±2s切变率为200/S下的粘度()靶值±2s网织红细胞计数网织红细胞百分比(%)靶值±2s全血细胞计数正确度验证白细胞计数靶值±15%红细胞计数靶值±6%血红蛋白测定靶值±6%血细胞比容靶值±9%血小板计数靶值±20%MCV靶值±7%MCH靶值±7%MCHC靶值±8%凝血因子检测FⅧ、FⅨ靶值±30%D-二聚体检测D-Dimer靶值±2s新生儿遗传代谢病筛查-Phe、TSH苯丙氨酸靶值±30% 或±1mg/dL(取大值)促甲状腺素靶值±30%中孕期母血清产前筛查AFP 靶值±30% 或±5μg/L(取大值)hCG 靶值±30%β-hCG靶值±30%Free-β-hCG 靶值±30%游离雌三醇靶值±30%血铅血铅靶值±40μg/L 或±10%(取大值)便携式血糖检测仪葡萄糖靶值±20% 或±1mmol/L(取大值)脑脊液生化白蛋白靶值±10% 或±L(取大值)总蛋白靶值±10% 或±L(取大值)氯化物靶值±5%葡萄糖靶值±10% 或±L(取大值)乳酸脱氢酶靶值±20%IgA靶值±25%IgG靶值±25%IgM靶值±25%乳酸靶值±20% 或±L(取大值)全血五元素铜靶值±2s锌靶值±2s钙靶值±L镁靶值±25%铁靶值±20%新生儿遗传代谢病筛查-G6PDG6PD靶值±30%新生儿遗传代谢病筛查-17羟孕酮17-羟孕酮靶值±30%新生儿遗传代谢病串联质谱筛查-氨基酸和酰基肉碱瓜氨酸靶值±25%亮氨酸靶值±25%甲硫氨酸靶值±25%苯丙氨酸靶值±25%酪氨酸靶值±25%缬氨酸靶值±25%游离肉碱靶值±30%丙酰肉碱靶值±30%异戊酰肉碱靶值±30%辛酰肉碱靶值±30%月桂酰肉碱靶值±30%棕榈酰肉碱靶值±30%十八碳酰肉碱靶值±30%血红蛋白A2和血红蛋白F血红蛋白A2 靶值±20%血红蛋白F 靶值±20%早孕期母血清产前筛查PAPP-A(μg/L) 靶值±30% PAPP-A(mU/L) 靶值±30%Free-β-HCG(μg/L) 靶值±30%Free-β-HCG(mIU/mL)靶值±30%。
临床检验室间质量评价计划

临床检验室间质量评价计划临床检验室间质量评价计划是为了保证临床检验结果的准确性和可靠性,对临床检验室的质量进行全面评估以及监测的计划。
该计划旨在通过有效的质量管理措施,提高临床检验室的工作质量,保证临床检验结果的准确性、及时性和可重复性,从而为临床提供可靠的检验结果,为医疗服务提供支持。
1.背景和目的:临床检验室是医疗机构中非常重要的一部分,负责为医务人员和患者提供准确的检验结果,对疾病的早期诊断、治疗以及预后评估至关重要。
然而,临床检验涉及到多项复杂的技术工作,因此需要有严格的质量管理和质量控制机制。
本评价计划的目的是通过对临床检验室间的质量评价来监测和提高临床检验的质量水平。
2.评价指标:(1)常规检验项目的准确性和可靠性;(2)临床检验室设备的正常工作状态和维护情况;(3)工作人员的素质和技术水平;(4)标本采集和保存的方法和质量;(5)临床检验室的质量控制管理系统。
3.评价方法:(1)内部评价:由临床检验室自行进行的质量评价,包括对各项检验项目结果的比对和分析,设备设施的维护情况,工作人员的培训和素质提高等。
(2)外部评价:由临床检验室外部专业评价机构进行的质量评价,以确保评价的客观和公正性。
主要包括对临床检验项目结果的比对和分析,临床检验质量控制体系的考核等。
4.评价周期和频率:(1)内部评价:每月进行一次自评,每季度进行一次对比分析,每年进行一次全面评估。
(2)外部评价:每年进行一次外部质量评价。
5.评价结果处理:(1)内部评价:根据评价结果,制定改进方案并进行改进措施的实施,以提高临床检验室的质量水平。
(2)外部评价:根据评价结果,及时采取纠正措施,并报告给上级管理部门和相关机构。
6.质量保证:7.评价结果的应用:评价结果将作为临床检验室管理的依据,用于改进工作流程和管理措施,提高临床检验室的质量水平和服务质量。
评价结果还可以用于医院和相关机构对临床检验室的评估和监督。
总之,临床检验室间质量评价计划是为了保证临床检验结果的准确性和可靠性,对临床检验室的质量进行全面评估以及监测的计划。
卫生部临床检验中心室间质量评价标准

卫生部临床检验中心室间质量评价标准文件管理序列号:[K8UY-K9IO69-O6M243-OL889-F88688]2017年卫生部临床检验中心室间质量评价标准临床化学(NCCL-C-01)2017年2016年钾靶值±6%靶值±0.5mmol/L钠靶值±4%靶值±4mmol/L氯靶值±5%靶值±5%钙靶值±5%靶值±0.250mmol/L(1.0mg/dL)磷靶值±10%靶值±0.097mmol/L或靶值±10.7%(取大者)葡萄糖靶值±7%靶值±0.33mmol/L(6mg/dL)或±10%(取大者)尿素靶值±8%靶值±0.71mmol/L或±9%(取大者)尿酸靶值±12%靶值±17%肌酐靶值±12%靶值±26.5ummol/L(0.3mg/dL)或±15%(取大者)总蛋白靶值±5%靶值±10%白蛋白靶值±6%靶值±10%总胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值±30%总胆红素靶值±15%靶值±6.84mmol/L(0.4mg/dL)或±20%(取大者)丙氨酸氨基转移酶靶值±16%靶值±20%天门冬氨酸氨基转移酶靶值±15%靶值±20%碱性磷酸酶靶值±18%靶值±30%淀粉酶靶值±15%靶值±30%肌酸激酶靶值±15%靶值±30%乳酸脱氢酶靶值±11%靶值±20%直接胆红素靶值±2s靶值±2s铁靶值±15%靶值±20%总铁结合力靶值±2s镁靶值±15%靶值±25%锂靶值±0.3mmol/L或±20%(取大者)铜靶值±2s锌靶值±2s酸性磷酸酶靶值±30%γ-谷氨酰基转移酶靶值±11%靶值±20%α-羟丁酸脱氢酶靶值±30%靶值±30%胆碱酯酶靶值±20%靶值±20%脂肪酶靶值±20%靶值±20%心肌标志物肌酸激酶-MB(ug/L)靶值±30%靶值±30%肌红蛋白靶值±30%靶值±30%肌钙蛋白-I靶值±30%靶值±30%肌钙蛋白-T靶值±30%靶值±30%肌酸激酶-MB(U/L)靶值±30%超敏CRP靶值±30%靶值±30%同型半胱氨酸靶值±2.5μmol/L或±20%(取大者)脂类胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值±30%靶值±30%低密度脂蛋白胆固醇靶值±30%靶值±30%载脂蛋白A1靶值±30%靶值±30%载脂蛋白B靶值±30%靶值±30%脂蛋白(a)靶值±30%血气分析pH靶值±0.04靶值±0.04pCO2靶值±5mmHg或±8%(取大者)靶值±5mmHg或±8%(取大者)pO2靶值±8%靶值±2SNa+靶值±4%靶值±4mmol/LK+靶值±6%靶值±0.5mmol/LCa2+靶值±5%靶值±0.25mmol/LCl-靶值±4%靶值±5%特殊蛋白IgG、IgA、IgE、IgM、C3、C4、C-反应蛋白(CRP)、类风湿因子(RF)、抗链球菌溶血素O (ASO)、转铁蛋白(TRF)、前白蛋白(PA)靶值±25%靶值±25%内分泌总T4靶值±20%靶值±20%叶酸靶值±30%靶值±30%皮质醇、雌二醇、FSH、LH、孕酮、催乳素、睾酮、C-肽、FT3、TT3、FT4、胰岛素、维生素B12、25-OH-VD2、25-OH-VD3、总25-OH-VD靶值±25%靶值±25%肿瘤标志物CEA、AFP、HCG、PSA、CA199、CA125、CA153、β2-微球蛋白、铁蛋白、总β-HCG、游离PSA靶值±25%全血治疗药物监测环孢霉素A、他克莫司、西罗莫司靶值±25%血清治疗药物监测卡马西平靶值±25%地高辛靶值±20%或±0.2μg/L苯妥英靶值±25%茶碱靶值±25%丙戊酸靶值±25%糖化血红蛋白HbA1c靶值±8%脑钠肽/N末端前脑钠肽BNP、NT-proBNP靶值±30%尿液定量生化钾靶值±29%钠靶值±26%氯靶值±26%钙靶值±31%镁靶值±25%磷靶值±23%葡萄糖靶值±20%尿素靶值±21%尿酸靶值±24%肌酐靶值±17%总蛋白靶值±44%白蛋白靶值±30%淀粉酶靶值±30%微量白蛋白靶值±30%半胱氨酸蛋白酶抑制剂C半胱氨酸蛋白酶抑制剂C靶值±25%代谢物、总蛋白正确度验证葡萄糖靶值±3.5%尿素靶值±4.0%尿酸靶值±6%肌酐靶值±6%总蛋白靶值±2.8%脂类正确度验证总胆固醇靶值±4.5%甘油三酯靶值±7.5%高密度脂蛋白胆固醇靶值±6.5%酶学正确度验证ALT(含磷酸吡哆醛)靶值±6% AST(含磷酸吡哆醛)靶值±5%GGT靶值±5.5%LDH靶值±4%CK靶值±5.5%AMY靶值±7.5%ALP靶值±10%糖化血红蛋白正确度验证HbA1c靶值±6%电解质正确度验证钠靶值±1.5%钾靶值±2%钙靶值±2%镁靶值±5.5%一般免疫学抗核抗体反应性或阴性抗-HIV反应性或阴性肝炎(HBsAg,anti-HBc,HBeAg)反应性或阴性风疹反应性或阴性全血细胞计数白细胞计数靶值±15%红细胞计数靶值±6%血红蛋白测定靶值±6%血细胞比容靶值±9%血小板计数靶值±20%MCV靶值±7%MCH靶值±7%MCHC靶值±8%凝血试验PT靶值±15%INR靶值±20%APTT靶值±15%Fbg靶值±20%尿液化学分析比重靶值±1等级PH靶值±1等级蛋白、葡萄糖、胆红素、酮体、红细胞、尿胆原、白细胞阳性时:靶值±1等级亚硝酸盐阴性或阳性红细胞沉降率测定红细胞沉降率靶值±3.0(≤10时)或靶值±30%(>10时)流式细胞分析CD3+、CD3+CD4+、CD3+CD8+、CD3-CD16+CD56+、CD3-CD19+靶值±2s血液粘度检测切变率为1/S下的粘度(mPa.s)靶值±2s切变率为50/S下的粘度(mPa.s)靶值±2s切变率为200/S下的粘度(mPa.s)靶值±2s网织红细胞计数网织红细胞百分比(%)靶值±2s全血细胞计数正确度验证白细胞计数靶值±15%红细胞计数靶值±6%血红蛋白测定靶值±6%血细胞比容靶值±9%血小板计数靶值±20%MCV靶值±7%MCH靶值±7%MCHC靶值±8%凝血因子检测FⅧ、FⅨ靶值±30%D-二聚体检测D-Dimer靶值±2s新生儿遗传代谢病筛查-Phe、TSH苯丙氨酸靶值±30%或±1mg/dL(取大值)促甲状腺素靶值±30%中孕期母血清产前筛查AFP靶值±30%或±5μg/L(取大值)hCG靶值±30%β-hCG靶值±30%Free-β-hCG靶值±30%游离雌三醇靶值±30%血铅血铅靶值±40μg/L或±10%(取大值)便携式血糖检测仪葡萄糖靶值±20%或±1mmol/L(取大值)脑脊液生化白蛋白靶值±10%或±0.1g/L(取大值)总蛋白靶值±10%或±0.1g/L(取大值)氯化物靶值±5%葡萄糖靶值±10%或±1.0mmol/L(取大值)乳酸脱氢酶靶值±20%IgA靶值±25%IgG靶值±25%IgM靶值±25%乳酸靶值±20%或±0.1mmol/L(取大值)全血五元素铜靶值±2s锌靶值±2s钙靶值±0.25mmol/L镁靶值±25%铁靶值±20%新生儿遗传代谢病筛查-G6PDG6PD靶值±30%新生儿遗传代谢病筛查-17羟孕酮17-羟孕酮靶值±30%新生儿遗传代谢病串联质谱筛查-氨基酸和酰基肉碱瓜氨酸靶值±25%亮氨酸靶值±25%甲硫氨酸靶值±25%苯丙氨酸靶值±25%酪氨酸靶值±25%缬氨酸靶值±25%游离肉碱靶值±30%丙酰肉碱靶值±30%异戊酰肉碱靶值±30%辛酰肉碱靶值±30%月桂酰肉碱靶值±30%棕榈酰肉碱靶值±30%十八碳酰肉碱靶值±30%血红蛋白A2和血红蛋白F血红蛋白A2靶值±20%血红蛋白F靶值±20%早孕期母血清产前筛查PAPP-A(μg/L)靶值±30% PAPP-A(mU/L)靶值±30%Free-β-HCG(μg/L)靶值±30%Free-β-HCG(mIU/mL)靶值±30%。
2016EB病毒核酸检测室间质评测定方法、仪器、试剂编码表
ABI 5700荧光定量PCR仪
218105
Genelight 9800全自动医用PCR分析系统
218012
ROCHE Lightcycler(毛细管)
218106
Genelight 2400全自动医用PCR分析系统
218013
Bio-Rad iCycle
218107
伯乐CFX96实时定量PCR仪
北京市临床检验中心
EB病毒核酸检测室间质量评价
测定方法、仪器和试剂编码表(2016)
测定方法编码:
编码
方法
编码
方法
2101
酶联免疫吸附试验(ELISA)
2118
酶免疫化学发光试验(ECA)
2102
放射免疫试验(RIA)
2119
聚合酶链反应(PCR)
2103
荧光免疫试验(IFA)
2120
逆转录-聚合酶链反应(RT-PCR)
218111
Auto lumiS 2000
218022
COBAS AMPLICOR
218112
Auto lumiS 3000
218023
COBAS TaqMan
218113
ADC ELISA
218024
ABI 7300荧光定量PCR仪
218114
迈克IS 1200全自动化学发光测定仪
218025
ABI 7500荧光定量PCR仪
医用核酸分子快速杂交仪HHM-2
218002
ABI 9600 PCR仪
218101
Luminex 100
218003
ABI 9700 PCR仪
218102
Luminex 200
新型冠状病毒核酸检测室间质量评价活动作业指导书

新型冠状病毒核酸检测室间质量评价活动作业指导书1. 引言本作业指导书旨在指导新型冠状病毒核酸检测室间质量评价活动的具体操作步骤和要求。
通过对各实验室之间的检测结果进行比对和评估,能够有效提高核酸检测室间质量,确保检测结果的准确性和可靠性。
2. 活动准备在开始室间质量评价活动之前,需要进行相应的准备工作:•确定评价活动的时间和地点,并提前通知参与实验室的相关人员。
•开展评价活动前,实验室需要保证所使用的检测试剂和设备符合质量要求,并进行必要的校准和验证。
3. 活动步骤3.1 样本准备•每家参与实验室需提供一定数量的标准样本,确保样本数量足够用于室间比对。
•样本应具有代表性和多样性,以反映真实的检测情况。
可以使用已知的阳性和阴性样本,及各种不同浓度的样本。
•样本要妥善保存,以确保其活性和稳定性。
3.2 检测操作•确保所有参与实验室具有相同的操作流程和操作规范。
•在同一天内,所有实验室应同时进行检测操作,以避免时间和环境因素对结果产生的不确定性。
3.3 结果记录和数据分析•每家实验室需记录所有检测结果,包括阳性和阴性结果,及其相关数据。
•结果记录应规范、完整和准确,以便进行后续的数据分析和比对。
3.4 数据比对和评估•将所有实验室的检测结果进行比对和统计分析,计算各实验室之间的一致性、准确性和可靠性。
•应使用合适的统计方法进行数据比对和评估,如计算相对误差、一致性系数等。
4. 结果分析和改进措施•根据室间质量评价活动的结果,分析各实验室之间的差异和不一致性,找出问题的原因。
•基于分析结果,制定改进措施,采取针对性措施解决问题,提高实验室的核酸检测质量。
5. 结束语通过室间质量评价活动,可以全面了解各实验室的核酸检测情况,及时发现问题并采取措施进行改进。
这对于确保核酸检测结果的准确性和可靠性,提高疫情防控工作的效果具有重要意义。
注意:请在使用本作业指导书时,根据实际情况进行适当修改和调整。
PCR实验室检查要点(2016)

聚合酶链反应(PCR)检验实验室检查要点指南(2016版)聚合酶链反应检验实验室是指通过基因扩增的方式检测特定的DNA或RNA的检验实验室。
聚合酶链反应(Polymerase Chain Reaction ,PCR)是一种在体外特异性扩增靶DNA序列的技术,其基本过程为模板双链DNA的变性、引物与模板DNA的退火和在DNA 聚合酶引导下的链延伸反应三个阶段的多次循环。
每一次循环后的扩增产物均可作为下一轮循环的模板,理论上,扩增产物量呈指数形式上升,即经过n个循环后,产物量增加到2n倍。
PCR试剂操作简单,短时间内在体外可获得数百万个特异靶DNA序列的复制,为临床疾病的诊断、治疗监测和预后评估提供了一种极有帮助的实验室辅助手段.PCR检验实验室是PCR试剂生产企业在产品检验过程中不可缺少的工作环境,其环境控制水平和质量管理水平直接影响着最终产品是否合格,能否放行。
由于该产品本身的特殊性,《医疗器械生产质量管理规范附录体外诊断试剂》、《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》条款中,明确对PCR试剂的生产和检验环境做出规定。
此外现行卫生行业的法规、标准以及相关文献中对于PCR 检验实验室均作出规定,主要涉及《全国临床检验规程》(第三版)、《医疗机构临床基因扩增管理办法》(卫办医政发〔2010〕194号)、《医疗机构临床基因扩增检验实验室工作导则》及《临床诊断中聚合酶链反应(PCR)技术的应用》(WS/T 230-2002)等行业标准的相关要求。
本检查指南旨在帮助北京市医疗器械监管人员增强对PCR检验相关过程的认知和把握,指导全市医疗器械监管人员对PCR检验实验室设计建设与质量控制的监督检查工作。
同时,为PCR试剂生产企业在PCR检验实验室的设计建造和管理要求提供参考.当国家相关法规、标准、检查要求发生变化时,应当重新讨论以确保本检查指南持续符合要求。
一、适用范围本检查指南可作为北京市食品药品监督管理局组织、实施的体外诊断试剂产品注册质量管理体系现场核查、《医疗器械生产许可证》现场核查、医疗器械生产监督检查等各项涉及PCR检验实验室检查的参考资料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京市临床检验中心
2016年巨细胞病毒核酸检测(CMV DNA)室间质量评价
计划及要求
一、质评项目及活动时间安排:
2016年北京市巨细胞病毒核酸检测(CMV DNA)室间质量评价将进行2次活动(共10个批号样本),测定项目是巨细胞病毒核酸检测(CMV DNA)。
具体时间安排如下:
二、质评样本保存及处理:
质评样本为液体血清,0.5ml/支,冷冻在-20ºC以下。
该样本使用时待完全融化且平衡至室温,颠倒5次以上混匀后方可使用;如当日未
用完且无污染,可2-8ºC保存,1周内用完;应避免反复冻融和重新分
装。
质评样品的检测应与病人标本相同,并以潜在传染性物品处理。
三、室间质评数据网络填报及传输要求:
结果回报要求填写完整,明确填出阴性( )或阳性(+),不能有可疑结果。
仪器、方法、试剂编码填写时,请参照北京市临床检验中心2016年编码表填写相应的编码,若相关内容超出编码表范围,请在纸质回报表上填写具体内容并将回报表回报至北京市临床检验中心。
请认真填写好测定结果,如有单位错误、误填,恕不做更改。
传输要求见“北京市临床检验中心2016年室间质评数据网络传输的相关说明”。
四、联系方式:
地址:北京市朝阳区南三里屯路35号院210室
北京市临床检验中心核酸检测(病毒学)组
邮编: 100020
联系电话: 65917380
联系人:刘璐
北京市临床检验中心核酸检测(病毒学)组
2016年4月5日。
