2016届高考化学一轮复习:第七章化学反应速率和化学平衡第二讲概述.ppt
合集下载
高考化学一轮复习 第七章 化学反应速率和化学平衡 第二节 化学平衡状态 化学平衡移动课件 新人教版
(2)等价标志 ①体系中各组分的质量、物质的量浓度、体积分数、 物质的量分数保持不变。 ②对同一物质而言,断裂的化学键的物质的量与形成 的化学键的物质的量相等。 ③对于有有色物质参加或生成的可逆反应,体系的颜 色不再随时间而变化。例如,2NO2(g) N2O4(g)。 ④体系中某反应物的转化率或某生成物的产率达到最 大值且不再随时间而变化。 ⑤全部是气体参加的气体体积可变的反应,体系的压 强、平均相对分子质量不再随时间而变化。例如,N2(g)+ 3H2(g) 2NH3(g)。
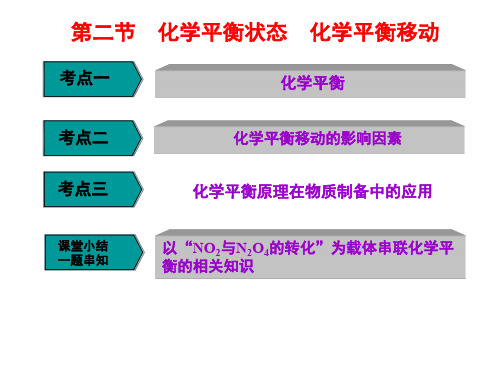
第二节 化学平衡状态 化学平衡移动
考点一
化学平衡
考点二 考点三
化学平衡移动的影响因素
化学平衡原理在物质制备中的应用
课堂小结 一题串知
以“NO2与N2O4的转化”为载体串联化学平 衡的相关知识
1.了解化学反应的可逆性。 2.了解化学平衡建立的过程。 3.理解外界条件(浓度、温度、压强、催化剂等)对化学 平衡的影响,认识并能用相关理论解释其一般规律。
[注意] 以下几种情况不能作为可逆反应达到化学平衡状态 的标志:
①某一时刻,各物质的浓度(或物质的量或分子数)之比等于 化学计量数之比的状态。
②恒温、恒容条件下气体体积不变的反应,混合气体的压强 或气体的总物质的量不随时间而变化,如 2HI(g) I2(g)+H2(g)。
③全部是气体参加的体积不变的反应,体系的平均相对分子 质量不随时间而变化,如 2HI(g) I2(g)+H2(g)。
[考向合作探究]
化学平衡状态的判断 1.化学平衡状态判断的“两审” 一审题干条件:是恒温恒容还是恒温恒压。 二审反应特点: ①全部是气体参与的等体积反应还是非等体积反应; ②有固体参与的等体积反应还是非等体积反应。 2.化学平衡状态判断的“两标志” (1)本质标志 v 正=v 逆≠0。对于某一可逆反应来说,正反应消耗掉某 反应物的速率等于逆反应生成该反应物的速率。
高考复习方案2016届高考化学一轮复习 第七单元 化学反应速率和化学平衡课件
返回目录
考 点 分 层 突 破
考点一 焓变 燃烧热和中和热
返回目录
第25讲 化学反Βιβλιοθήκη 速率知识归纳1.基础知识
化学计量数之比 返回目录
第25讲 化学反应速率
知识归纳
2.化学反应速率的计算 在解题过程中先写出有关反应的化学方程式;找出各物
质的起始量、转化量、某时刻量;根据已知条件列方程
式计算。例如,对于反应:mA+nB,FpC+qD,A 的浓 度为 a mol·L-1,B 的浓度为 b mol·L-1,反应进行至 t1 s 时,A 消耗了 x mol·L-1,则反应速率可计算如下: mA(g)+nB(g),FpC(g)+qD(g) 起始浓度/mol·L-1 a b 0 0
返回目录
使用建议
(3)要重视化学实验,认真观察和理解课本上安排的有关实 验,弄清实验现象,发生的反应及所要说明的问题,通过 典型的实验得出一般规律,加深对所学概念、理论的理解 和应用,提高解决实际问题的能力。 (4)要学会对图表、数据进行综合分析的方法,加强练习, 做到学、用、练、纠相结合,以提高解决各类问题的能力。
· 新课标(RJA))··
新课标·人教A版
课件编辑说明
本课件是由精确校对的word书稿制作的“逐字编辑”课 件,如需要修改课件,请双击对应内容,进入可编辑状态。
如果有的公式双击后无法进入可编辑状态,请单击选中此 公式,点击右键、“切换域代码”,即可进入编辑状态。修 改后再点击右键、“切换域代码”,即可退出编辑状态。
江苏10(选择);天 津6(选择);福建 23(解答);海南 15(解答)
2013年
福建12(选择)、23(解 答);四川6(选择); 重庆11(解答);新课 标全国Ⅱ28(解答)
考 点 分 层 突 破
考点一 焓变 燃烧热和中和热
返回目录
第25讲 化学反Βιβλιοθήκη 速率知识归纳1.基础知识
化学计量数之比 返回目录
第25讲 化学反应速率
知识归纳
2.化学反应速率的计算 在解题过程中先写出有关反应的化学方程式;找出各物
质的起始量、转化量、某时刻量;根据已知条件列方程
式计算。例如,对于反应:mA+nB,FpC+qD,A 的浓 度为 a mol·L-1,B 的浓度为 b mol·L-1,反应进行至 t1 s 时,A 消耗了 x mol·L-1,则反应速率可计算如下: mA(g)+nB(g),FpC(g)+qD(g) 起始浓度/mol·L-1 a b 0 0
返回目录
使用建议
(3)要重视化学实验,认真观察和理解课本上安排的有关实 验,弄清实验现象,发生的反应及所要说明的问题,通过 典型的实验得出一般规律,加深对所学概念、理论的理解 和应用,提高解决实际问题的能力。 (4)要学会对图表、数据进行综合分析的方法,加强练习, 做到学、用、练、纠相结合,以提高解决各类问题的能力。
· 新课标(RJA))··
新课标·人教A版
课件编辑说明
本课件是由精确校对的word书稿制作的“逐字编辑”课 件,如需要修改课件,请双击对应内容,进入可编辑状态。
如果有的公式双击后无法进入可编辑状态,请单击选中此 公式,点击右键、“切换域代码”,即可进入编辑状态。修 改后再点击右键、“切换域代码”,即可退出编辑状态。
江苏10(选择);天 津6(选择);福建 23(解答);海南 15(解答)
2013年
福建12(选择)、23(解 答);四川6(选择); 重庆11(解答);新课 标全国Ⅱ28(解答)
高考化学大一轮复习 7.23 化学平衡的移动和化学反应进行的方向精讲课件

第三十四页,共78页。
应用 1 [2012·安徽卷]一定条件下,通过下列反应可实
现燃煤烟气中硫的回收:
催化剂
SO2(g)+2CO(g)
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的
是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
第三十五页,共78页。
C.平衡时,其他条件不变,升高温度可提高 SO2 的转化 率
D.其他条件不变,使用不同催化剂,该反应的平衡常数 不变
第三十六页,共78页。
解析:本题主要考查外界条件对化学平衡的影响,同时 考查考生应用基础知识解决简单化学问题的能力。因反应前 后气体分子数不相等,达到平衡前容器内压强逐渐变小,A 项错误;硫为纯液体,减少硫的量不影响化学反应速率,B 项错误;升高温度,化学平衡逆向移动,SO2 的转化率降低, C 项错误;只有温度的改变,会影响反应的平衡常数,采用 不同的催化剂,只会改变化学反应速率,对化学平衡无影响, 化学平衡常数不变,D 项正确。
第二十七页,共78页。
核心考点(kǎo diǎn) 引领 通关
考点(kǎo diǎn)分类 点点 击破
第二十八页,共78页。
考点一 化学平衡移动的分析 1.实质 化学平衡移动的实质是外界条件(如浓度、温度、压强)破
坏了原平衡状态,使正、逆反应速率不再相等,当 v(正)>v(逆) 时,平衡向正反应方向移动,当 v(正)<v(逆)时,平衡向逆反 应方向移动,当 v(正)=v(逆)时,平衡不发生移动,然后在新 的条件下达到正、逆反应速率再次相等。
再 如 转 化 关 系 : AgNO3 ―C―l-→ AgCl ―B―r-→ AgBr ――I-→ AgI―S―2-→Ag2S↓得以进行,也是由于打破了各物质的溶解平 衡,生成了更难溶的物质。
应用 1 [2012·安徽卷]一定条件下,通过下列反应可实
现燃煤烟气中硫的回收:
催化剂
SO2(g)+2CO(g)
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的
是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
第三十五页,共78页。
C.平衡时,其他条件不变,升高温度可提高 SO2 的转化 率
D.其他条件不变,使用不同催化剂,该反应的平衡常数 不变
第三十六页,共78页。
解析:本题主要考查外界条件对化学平衡的影响,同时 考查考生应用基础知识解决简单化学问题的能力。因反应前 后气体分子数不相等,达到平衡前容器内压强逐渐变小,A 项错误;硫为纯液体,减少硫的量不影响化学反应速率,B 项错误;升高温度,化学平衡逆向移动,SO2 的转化率降低, C 项错误;只有温度的改变,会影响反应的平衡常数,采用 不同的催化剂,只会改变化学反应速率,对化学平衡无影响, 化学平衡常数不变,D 项正确。
第二十七页,共78页。
核心考点(kǎo diǎn) 引领 通关
考点(kǎo diǎn)分类 点点 击破
第二十八页,共78页。
考点一 化学平衡移动的分析 1.实质 化学平衡移动的实质是外界条件(如浓度、温度、压强)破
坏了原平衡状态,使正、逆反应速率不再相等,当 v(正)>v(逆) 时,平衡向正反应方向移动,当 v(正)<v(逆)时,平衡向逆反 应方向移动,当 v(正)=v(逆)时,平衡不发生移动,然后在新 的条件下达到正、逆反应速率再次相等。
再 如 转 化 关 系 : AgNO3 ―C―l-→ AgCl ―B―r-→ AgBr ――I-→ AgI―S―2-→Ag2S↓得以进行,也是由于打破了各物质的溶解平 衡,生成了更难溶的物质。
高考化学一轮总复习配套课件第七章课时2化学平衡状态及其移动

________。
(2)在恒压容器中进行,达到平衡状态的标志是________。
①单位时间内生成 n mol O2 的同时生成 2n mol NO2 ②单位 时间内生成 n mol O2 的同时生成 2n mol NO ③用 NO2、NO、 O2 的物质的量浓度变化表示的反应速率的比为 2∶2∶1 的状 态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度
考素点养深优度化
⑥中,由⑤中的分析可知,混合气体的总物质的量不再变化, 说明反应已达到平衡;⑦中,消耗A的量与生成B的量之比与 它们在化学方程式中的计量数之比相等,也就是反应正向进 行和逆向进行的速率相等,说明反应已达到平衡;⑧中,A、 B、C的分子数之比为1∶3∶2只是反应进程中的某一时刻的 状态,不能说明反应已达到平衡。 答案 A
考素点养深优度化
解析 (1)由图可知 10 min 时反应达到平衡,所以 v(CO)=0.03 mol·L-1/10 min=0.003 mol·L-1·min-1,方程式的化 学计量数之比等于反应时物质转化的浓度之比,所以反应达平衡 时,c(H2)=c(CO2)=0.03 mol·L-1。(2)反应达到平衡的标志是反应 体系组成不变,正、逆反应速率相等且不为零。CO 减少的化学 反应速率是正反应速率,CO2 减少的化学反应速率是逆反应速率。 所以选①③。 答案 (1)0.003 mol·L-1·min-1 0.03 mol·L-1 (2)①③
1.可逆反应 (1)定义 在 同一条件下既可以向 正 反应方向进行,同时又可以向 逆 反应方向进行的化学反应。
考素点养深优度化
(2)特点 ①二同:a.相同条件下;b.正逆反应同时进行。 ②一小:反应物与生成物同时存在,任一组分的转化率都 小于 (填 “大于”或“小于”)100%。 (3)表示 在方程式中用“ ”表示。
高考化学总复习第7章化学反应速率和化学平衡第1节化学反应速率及其影响因素课件新人教版

图中:E1 为__正__反__应__的__活__化__能______,使用催化剂时的活化能 为___E_3______,反应热为__E_1_-__E_2____。
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
1.增大反应物的浓度,能够增大活化分子的百分含量,所 以反应速率增大( × ) 2.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高 温度,反应速率 v(H2)和 H2 的平衡转化率均增大( × ) 3.往锌与稀硫酸反应混合液中加入 NH4HSO4 固体,反应速 率不变( × ) 4.对于反应 2H2O2===2H2O+O2↑,加入 MnO2 或降低温 度都能加快 O2 的生成速率( × )
考点一 化学反应速率
1.表示方法 通常用单位时间内_反__应__物__浓__度__的__减__少__或_生__成__物__浓__度__的__增__加_ 来表示。
2.表达式
v=ΔΔct,单位:_m_o_l_·_L_-_1_·__s-_1_或___m__o_l·_L_-_1_·__m__in_-。1 如密闭容 器中,合成氨的反应 N2+3H2 2NH3,开始时 c(N2)= 8 mol·L-1,2 min 后 c(N2)=4 mol·L-1,则用 N2 表示的反应 速率为__2_m__o_l·__L__-_1·__m__in__-_1 ___。
第七章·化学反应速率和化学平衡
第 1 节 化学反应速率及其影响因素
第七章·化学反应速率和化学平衡
【考纲要求】 了解化学反应速率的概念和定量表示方法。能正确计算
化学反应的转化率(α)。 了解反应活化能的概念,了解 催化剂的重要作用。 理解外界条件(浓度、温度、压强、 催化剂等)对反应速率的影响,能用相关理论解释其一般规 律。 了解化学反应速率的调控在生活、生产和科学研究 领域中的重要作用。
人教版高考化学一轮复习 第七章 化学反应速率和化学平衡 第2讲 化学平衡状态 化学平衡的移动 (2)

D.c1的取值范围为0<c1<0.19 mol·L-1
答案 C
解析 N2、H2平衡浓度之比为1∶2,转化浓度之比为1∶3,故c1∶c2≠1∶3,N2、
H2的转化率不相等,A错误,C正确;v生成(H2)表示逆反应,v生成(NH3)表示正反
应,平衡时,v生成(H2)∶v生成(NH3)=3∶2,B不正确;当0.08 mol·
(3)可逆反应的“三同一小”
”表示。
2.化学平衡状态
(1)定义:一定条件下的可逆反应,当正反应速率和逆反应速率相等时,反应
混合物中各组分浓度或质量分数保持不变的状态,称为化学平衡状态。
但不一定相等
(2)化学平衡的建立
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中发生
反应,化学平衡的建立过程可用下图表示:
密闭容器中进行时,反应温度会增大,则当容器中温度不再改变时,说明正、
逆反应速率相等,反应已达到平衡,故D正确。
针对训练
1.一定条件下:2NO2(g)
N2O4(g)
ΔH<0。在测定NO2的相对分子质量
)
A.容器内气体压强不再改变
B.容器内气体密度不再改变
C.容器内气体颜色不再改变
D.断裂1 mol Cl—CD
解析 在恒容密闭容器中发生反应2HI(g)+Cl2(g)
2HCl(g)+I2(s),反应过
程中压强为变量,压强不再改变说明达到平衡;反应过程中气体质量为变量,
2SO3(g),当SO3的生成
速率与SO2的消耗速率相等时,反应达到平衡状态。( × )
(4)在一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,生成2
mol NH3。( × )
答案 C
解析 N2、H2平衡浓度之比为1∶2,转化浓度之比为1∶3,故c1∶c2≠1∶3,N2、
H2的转化率不相等,A错误,C正确;v生成(H2)表示逆反应,v生成(NH3)表示正反
应,平衡时,v生成(H2)∶v生成(NH3)=3∶2,B不正确;当0.08 mol·
(3)可逆反应的“三同一小”
”表示。
2.化学平衡状态
(1)定义:一定条件下的可逆反应,当正反应速率和逆反应速率相等时,反应
混合物中各组分浓度或质量分数保持不变的状态,称为化学平衡状态。
但不一定相等
(2)化学平衡的建立
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中发生
反应,化学平衡的建立过程可用下图表示:
密闭容器中进行时,反应温度会增大,则当容器中温度不再改变时,说明正、
逆反应速率相等,反应已达到平衡,故D正确。
针对训练
1.一定条件下:2NO2(g)
N2O4(g)
ΔH<0。在测定NO2的相对分子质量
)
A.容器内气体压强不再改变
B.容器内气体密度不再改变
C.容器内气体颜色不再改变
D.断裂1 mol Cl—CD
解析 在恒容密闭容器中发生反应2HI(g)+Cl2(g)
2HCl(g)+I2(s),反应过
程中压强为变量,压强不再改变说明达到平衡;反应过程中气体质量为变量,
2SO3(g),当SO3的生成
速率与SO2的消耗速率相等时,反应达到平衡状态。( × )
(4)在一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,生成2
mol NH3。( × )
高考专题:化学平衡常数第二课时课件高三高考化学一轮复习

真题再现
1.(2019·海南,14)由γ-羟基丁酸生成γ-丁内酯的反应如下:
在298 K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的 浓度随时间变化的数据如表所示。回答下列问题:
t/min 21
50
80 100 120 160 220 ∞
c/mol· 0.024 0.050 0.071 0.081 0.090 0.104 0.116 0.132
反应为吸热反应,提高温度,平衡正向移动,可提高环戊烯的平衡转化率, B项符合题意; 增加环戊烯浓度,能提高I2(g)的平衡转化率,但环戊烯的平衡转化率降低, C项不符合题意; 增加I2(g)的浓度,能提高环戊烯的平衡转化率,D项符合题意。
第七单元 化学反应速率与化学平衡
第21讲 化学平衡常数及反应方向的判断
第二课时 化学平衡常数的计算
• 高三化学组
考纲要求: 1.了解化学平衡常数(K)的含义。 2.能利用化学平衡常数进行相关计算。 3.能正确计算化学反应的转化率(α)。
根据题目新信息计算化学平衡常数
【高考母题示例】顺-1,2-二甲基环丙烷和反-1,2-二
起起始始:戊c0 烯a的物质c0的a 量为x,00 列出0三0 段式:
第21讲 化学平衡常数及反应方向的判断
(p根1()N据平O上衡2)述常=p实数总验K×可结x用(果N反O判2应断)]体。,系还中原(气Cgo)体O物(s质)+为分C压o(s表I)的示2(倾,g向)即=是K=表C=O达_式__中__用_H平2(衡(g填分)“+大压于代2”替或H平“小I衡(于g浓)”)度。,分压=总压×物质的量分数[例如:
能正确计算化学反应的转化率(α)。
起始: a a 一恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Mr
不一定 平衡
达到平衡! 温 度 任何化学反应都伴随着能量变化,在其他条 件不变的条件下,体系温度一定时
体系的密 ρ密度一定
度
平衡
不一定 平衡
12
例1、一定条件下,反应A2(g)+B2(g) 2AB(g) 达到平衡的标志是 A、单位时间内生成n mol A2同时生成n molAB
B√、单位时间内生成2n mol AB 同时生成n mol B2
第七章 化学反应速率和化学平衡
第2讲 化学平衡状态 化学平衡移动
.精品课件.
1
安徽省高考说明要求
(1)了解化学反应速率的概念、反应速率的定量表示 方法。 (2)了解催化剂在生产、生活和科学研究领域中的重 大作用。 (3)了解化学反应的可逆性。 (4)了解化学平衡建立的过程。理解化学平衡常数的 含义,能够利用化学平衡常数进行简单的计算。
条件:一定条件(温度、浓度与压强)
强 调 对象:可逆反应 四 本质:正反应速率=逆反应速率 点 现象:各组分百分含量(或质量)、浓度
(或体积分数)等保持不变
2、化学平衡状态的特征
(1)逆:研究对象可逆反应。
(2)等:正反应速率=逆反应速率≠0
(3)动:动态平衡(正逆反应仍在进行)
(4)定:反应混合物中各组分的浓度保持不变, 各组分的百分含量一定。 (5)变条件下建立新的平衡。
8
化学平衡的性质: ⑴反应条件:——条件不变是基础
温度、压强、浓度等不变
⑵研究对象:——可逆反应是前提
可逆反应,不可逆反应一般不会出现平衡状态
⑶本质: ——速率相等是实质 v正= v逆
即同一物质消耗速率与生成速率相等 ⑷现象: ——浓度不变是标志
反应混合物组成成分的浓度保持不变
4 化学平衡状态的判断:
逆反应:从右向左进行的反应。
可逆反应的特点:
⑴同一条件下正、逆反应同时进行 ⑵可逆反应通常不能进行到底,反应物的 转化率不能达到100%,反应体系中得到的总是 反应物与生成物的混合物。
复习:什么叫可逆反应?可逆反应有哪些特点?
在相同条件下,既能向正反应方向进行,同时, 又能向逆反应方向进行的化学反应,叫做可逆反应。
(5)理解外界条件(浓度、温度、压强、催化剂等) 对反应速率和化学平衡的影响,认识其一般规律。 (6)了解化学反应速率和化学平衡的调控在生活、生 产和科学研究领域中的重要作用。
可逆反应 在同一条件下向正反应方向进行的 同时又向逆反应方向进行的反应.
用
表示。 例: H2+I2
2HI
正反应:从左向右进行的反应。
可逆反应的特点: ①同一条件、同时反应、方向对立 ②不可能完全转化
思考:化学反应速率研究反应的快慢,研究一个化学反应 还需要讨论哪些内容?
还需要研究化学反应进行的程度——化学平衡
(一)化学平衡状态的概念与特征
1、定义:化学平衡状态,就是在一定条件下 可逆反应里,当正反应速率与逆反应速率相等 时,反应混合物中各组成成分的百分含量保持 不变的状态。
2.过程
.精品课件.
15
1、化学平衡移动的定义:
化学上把这种可逆反应中旧化学平衡的破 坏、新化学平衡建立的过程叫做化学平衡 的移动 2、化学平衡的移动方向的速率判断:
⑴若外界条件变化引起v正> v逆: 平衡向正反应方向移动
⑵若外界条件变化引起v正< v逆: 平衡向逆反应方向移动
⑶若外界条件变化引起v正= v逆: 旧平衡未被破坏,平衡不移动
举例 mA(g) + nB(g) 反应
pC(g) + qD(g)
混合 ①各物质的物质的量或各物质的 物体 物质的量分数一定
系中 ②各物质的质量或各物质的质量 各成 分数一定
分的 ③各气体的体积或体积分数一定 含量 ④总压强、总体积、总物质的量 一定
平衡
平衡 平衡 不一定 平衡
.精品课件.
10
①在单位时间内消耗了m molA
⑤气体的密度或平均相对分子质量不随时间改变而改变
⑥反应物的转化率、生成物的产率不再发生变化;
⑦反应物反应时破坏的化学键与逆反应得到的反应物形
成的化学键种类和数量相同;
⑧对于气体体积数不同的可逆反应,达到化学平衡时,
体积和压强也不再发生变化。
⑨ 各组分的分子数不变。
⑩ 各组分的分子数之.精品比课不件. 变。
3.化学平衡的标志
(1)直接标志:
①、速率标志:v正=v逆≠0;
②、反应混合物中各组分的体积分数、物质的 量分数、质量分数不再发生变化;
.精品课件.
7
(2)间接标志:
①各组分的浓度不随时间改变而改变
②各物质的物质的量不随时间改变而改变
③各气体的压强(分压)不随时间改变而改变
④气体的颜色(有颜色变化的)不随时间改变而改变
举例反应
mA(g) + nB(g)
pC(g) + qD(g)
压 强 ①m+n≠p+q时,总压强一定(其他条件一定) 平衡 (恒容)
②m+n=p+q时,总压强一定(其他条件一定) 不一定 平衡
混合气体 ① 一定时,只有当m+n≠p+q时,
的平均
平衡
正逆相等,变量不变, 分子量 ②一定,但m+n=p+q时
同时生成m molA,即
平衡
v正=v逆
②在单位时间内消耗了n molB同
正、逆反 应速率
时生成p molC, 均指 v正
不一定 平衡
的关系 ③vA:vB:vC:vD=m:n:p:q, v正不 一定等于v逆
不一定 平衡
④在单位时间内生成了n molB, 不一定 同时消耗q molD,因均指 v逆 平衡
C、单位时间内生成n mol A2 同时生成n mol B2
D√ 、单位时间内生成n mol A2 同时消耗n mol B2
例2、一定条件下,反应N2+3H2 2NH3达到平衡 的标志是
A√ 、一个N≡N键断裂的同时,有三个H-H键形成
B、一个N≡N键断裂的同时,有三个H-H键断裂
C√ 、一个N≡N键断裂的同时,有六个N-H键断裂
D、一个N≡N键断裂的同时,有六个N-H键形成
在判断化学平衡时,要注意化学键数与反应 物质的物质的量之间的联系,同时要注意成 键、断键与反应方向之间的关系。
(二)化学平衡的移动
1.化学平衡移动的概念
可逆反应达到平衡状态以后,若反应条件 (如温度、压强、浓度等)发生了变化,平衡 混合物中各组分的浓度也会随之改变,从 而在一段时间后达到新的平衡状态。这种 由原平衡状态向新平衡状态的变化过程, 叫做化学平衡的移动。
不一定 平衡
达到平衡! 温 度 任何化学反应都伴随着能量变化,在其他条 件不变的条件下,体系温度一定时
体系的密 ρ密度一定
度
平衡
不一定 平衡
12
例1、一定条件下,反应A2(g)+B2(g) 2AB(g) 达到平衡的标志是 A、单位时间内生成n mol A2同时生成n molAB
B√、单位时间内生成2n mol AB 同时生成n mol B2
第七章 化学反应速率和化学平衡
第2讲 化学平衡状态 化学平衡移动
.精品课件.
1
安徽省高考说明要求
(1)了解化学反应速率的概念、反应速率的定量表示 方法。 (2)了解催化剂在生产、生活和科学研究领域中的重 大作用。 (3)了解化学反应的可逆性。 (4)了解化学平衡建立的过程。理解化学平衡常数的 含义,能够利用化学平衡常数进行简单的计算。
条件:一定条件(温度、浓度与压强)
强 调 对象:可逆反应 四 本质:正反应速率=逆反应速率 点 现象:各组分百分含量(或质量)、浓度
(或体积分数)等保持不变
2、化学平衡状态的特征
(1)逆:研究对象可逆反应。
(2)等:正反应速率=逆反应速率≠0
(3)动:动态平衡(正逆反应仍在进行)
(4)定:反应混合物中各组分的浓度保持不变, 各组分的百分含量一定。 (5)变条件下建立新的平衡。
8
化学平衡的性质: ⑴反应条件:——条件不变是基础
温度、压强、浓度等不变
⑵研究对象:——可逆反应是前提
可逆反应,不可逆反应一般不会出现平衡状态
⑶本质: ——速率相等是实质 v正= v逆
即同一物质消耗速率与生成速率相等 ⑷现象: ——浓度不变是标志
反应混合物组成成分的浓度保持不变
4 化学平衡状态的判断:
逆反应:从右向左进行的反应。
可逆反应的特点:
⑴同一条件下正、逆反应同时进行 ⑵可逆反应通常不能进行到底,反应物的 转化率不能达到100%,反应体系中得到的总是 反应物与生成物的混合物。
复习:什么叫可逆反应?可逆反应有哪些特点?
在相同条件下,既能向正反应方向进行,同时, 又能向逆反应方向进行的化学反应,叫做可逆反应。
(5)理解外界条件(浓度、温度、压强、催化剂等) 对反应速率和化学平衡的影响,认识其一般规律。 (6)了解化学反应速率和化学平衡的调控在生活、生 产和科学研究领域中的重要作用。
可逆反应 在同一条件下向正反应方向进行的 同时又向逆反应方向进行的反应.
用
表示。 例: H2+I2
2HI
正反应:从左向右进行的反应。
可逆反应的特点: ①同一条件、同时反应、方向对立 ②不可能完全转化
思考:化学反应速率研究反应的快慢,研究一个化学反应 还需要讨论哪些内容?
还需要研究化学反应进行的程度——化学平衡
(一)化学平衡状态的概念与特征
1、定义:化学平衡状态,就是在一定条件下 可逆反应里,当正反应速率与逆反应速率相等 时,反应混合物中各组成成分的百分含量保持 不变的状态。
2.过程
.精品课件.
15
1、化学平衡移动的定义:
化学上把这种可逆反应中旧化学平衡的破 坏、新化学平衡建立的过程叫做化学平衡 的移动 2、化学平衡的移动方向的速率判断:
⑴若外界条件变化引起v正> v逆: 平衡向正反应方向移动
⑵若外界条件变化引起v正< v逆: 平衡向逆反应方向移动
⑶若外界条件变化引起v正= v逆: 旧平衡未被破坏,平衡不移动
举例 mA(g) + nB(g) 反应
pC(g) + qD(g)
混合 ①各物质的物质的量或各物质的 物体 物质的量分数一定
系中 ②各物质的质量或各物质的质量 各成 分数一定
分的 ③各气体的体积或体积分数一定 含量 ④总压强、总体积、总物质的量 一定
平衡
平衡 平衡 不一定 平衡
.精品课件.
10
①在单位时间内消耗了m molA
⑤气体的密度或平均相对分子质量不随时间改变而改变
⑥反应物的转化率、生成物的产率不再发生变化;
⑦反应物反应时破坏的化学键与逆反应得到的反应物形
成的化学键种类和数量相同;
⑧对于气体体积数不同的可逆反应,达到化学平衡时,
体积和压强也不再发生变化。
⑨ 各组分的分子数不变。
⑩ 各组分的分子数之.精品比课不件. 变。
3.化学平衡的标志
(1)直接标志:
①、速率标志:v正=v逆≠0;
②、反应混合物中各组分的体积分数、物质的 量分数、质量分数不再发生变化;
.精品课件.
7
(2)间接标志:
①各组分的浓度不随时间改变而改变
②各物质的物质的量不随时间改变而改变
③各气体的压强(分压)不随时间改变而改变
④气体的颜色(有颜色变化的)不随时间改变而改变
举例反应
mA(g) + nB(g)
pC(g) + qD(g)
压 强 ①m+n≠p+q时,总压强一定(其他条件一定) 平衡 (恒容)
②m+n=p+q时,总压强一定(其他条件一定) 不一定 平衡
混合气体 ① 一定时,只有当m+n≠p+q时,
的平均
平衡
正逆相等,变量不变, 分子量 ②一定,但m+n=p+q时
同时生成m molA,即
平衡
v正=v逆
②在单位时间内消耗了n molB同
正、逆反 应速率
时生成p molC, 均指 v正
不一定 平衡
的关系 ③vA:vB:vC:vD=m:n:p:q, v正不 一定等于v逆
不一定 平衡
④在单位时间内生成了n molB, 不一定 同时消耗q molD,因均指 v逆 平衡
C、单位时间内生成n mol A2 同时生成n mol B2
D√ 、单位时间内生成n mol A2 同时消耗n mol B2
例2、一定条件下,反应N2+3H2 2NH3达到平衡 的标志是
A√ 、一个N≡N键断裂的同时,有三个H-H键形成
B、一个N≡N键断裂的同时,有三个H-H键断裂
C√ 、一个N≡N键断裂的同时,有六个N-H键断裂
D、一个N≡N键断裂的同时,有六个N-H键形成
在判断化学平衡时,要注意化学键数与反应 物质的物质的量之间的联系,同时要注意成 键、断键与反应方向之间的关系。
(二)化学平衡的移动
1.化学平衡移动的概念
可逆反应达到平衡状态以后,若反应条件 (如温度、压强、浓度等)发生了变化,平衡 混合物中各组分的浓度也会随之改变,从 而在一段时间后达到新的平衡状态。这种 由原平衡状态向新平衡状态的变化过程, 叫做化学平衡的移动。
