他唑巴坦杂质结构式列表
我国对原料药的质量控制要点

A晶型 B晶型
西咪替丁DSC图谱
结晶性检查的局限性
▪ 冷冻干燥样品中通常为无定型和结 晶型样品的混合物,当两种工艺同 时存在,质量标准又不相同时,单 凭偏光显微镜很难判断产品的属性。 如头孢哌酮钠,结晶型样品水分的 限度为5.0%,无定型产品水分的限 度为2.0%,水分超出2.0%的样品很 难判断是否属于结晶型产品。
(2)主药+水分+有机溶媒+无机杂质+有 机杂质
谢谢!再会!
▪ 头孢唑林钠 ▪ 头孢呋辛钠 ▪ 头孢曲松钠
(3)干燥失重和水分
▪ 干燥失重系指按照中国药典附录方法, 在规定的条件下,测定药品中所含能 被驱去的挥发性物质,既包括水,也 药品中的残留水和结晶水的总和, 但不包括其他挥发性物质。
1,2-二氯乙 烷
1,1-二氯乙 烯
1,1-三氯乙
5 8 1500
有毒 有毒 环境毒
表 2 第二类溶剂(应限制使用的溶剂)
溶剂 乙腈 氯苯 氯仿 环乙烷 1,2-二氯乙烯 二氯甲烷 1,2-二甲氧基乙烷 N,N-二甲基乙酰 胺 N,N-二甲基甲酰 胺
PDE (mg/支) 4.1 3.6 0.6 38.8 18.7 6.0 1.0 10.9
8.8
浓度限值(ppm) 410 360 60 3880 1870 600 100 1090
880
▪ (7)微量毒性杂质
β内酰胺抗生素中高聚
物的控制——头孢噻肟钠、
头孢哌酮钠、头孢曲松钠、
O
O
H
头孢他啶 C2H5 N
N C N C* C
OH
O
OH
N
H O
S
N CH2
COOH
NN
高效液相色谱法测定注射用哌拉西林钠他唑巴坦钠主药及杂质的含量

高效液相色谱法测定注射用哌拉西林钠他唑巴坦钠主药及杂质的含量田力;祝红杰【摘要】Objective To determine the content of the main drugs and impurities in injectable piperacillin sodium and tazobactam sodium of three manufacturers. Methods The chromatographic column was Hypersil BDS Clg (4. 6 mm ×250 mm,5 μm) .the mobile phase was methanol and tetrabutyl ammonium hydroxide(pH 3. 5,50:50)at a flow-rate of 0. 8mL/min, the detection wavelength was 220 nm at room temperature. Results The content of piperacillin sodium in three sample solutions were 102. 8% ,96. 4% ,103. 1% respectively. The content of tazobactam sodium in three sample solutions were 99. 8% ,93. 3% ,98. 1% respectively. The content of impurities in three sample solutions were 1. 72% ,2. 74% , 1. 85% . Conclusion The contents of piperacillin sodium, tazobactam sodium and impurities in the products of three manufacturers are in accordance with the related requirements of the Chinese Pharmacopoeia.%目的考察3个厂家生产的注射用哌拉西林钠他唑巴坦钠的主药和杂质的含量.方法采用Hypersil BDS-C18色谱柱(4.6mm×250 mm,5μm),甲醇:四丁基氢氧化铵水溶液(pH 3.5,50:50)为流动相,流速0.8 mL/min,检测波长为220 nm,室温下进行检测.结果 3种样品的哌拉西林含量分别为标示量的102.8%、96.4%、103.1%;他唑巴坦含量分别为标示量的99.8%、93.3%、98.1%;杂质的含量分别为1.72%、2.74%、1.85%.结论本实验结果表明,3个厂家生产的注射用哌拉西林钠他唑巴坦钠的主药与杂质的含量均符合药典规定.【期刊名称】《实用药物与临床》【年(卷),期】2011(014)006【总页数】2页(P490-491)【关键词】哌拉西林钠;他唑巴坦钠;杂质;HPLC【作者】田力;祝红杰【作者单位】大连医科大学附属第一医院,大连116011;大连医科大学附属第一医院,大连116011【正文语种】中文哌拉西林钠和他唑巴坦钠组成的复方制剂具有很好的协同抗菌作用,临床用于治疗各种感染性疾病。
常用化学药物结构式总汇

常用化学药物结构式总汇化学药物是指以化学合成方法制备的用于医学治疗、预防或诊断疾病的药物。
其作用机制主要是通过与生物体内分子的相互作用,调节生理和代谢过程,达到治疗或预防疾病的目的。
下面是一些常用化学药物的结构式及其作用机制的总汇。
1. 麻黄碱(Ephedrine):麻黄碱是中药麻黄中的有效成分,具有兴奋中枢神经系统、扩张支气管、促进血管收缩以及抗菌等作用。
其结构式为:2. 阿司匹林(Aspirin):阿司匹林是一种非甾体类抗炎药,具有镇痛、退热、抗炎和抗血小板聚集等作用。
其结构式为:3. 盐酸吗啡(Morphine HCl):盐酸吗啡是一种镇痛药,作用于中枢神经系统的阿片受体,缓解疼痛。
其结构式为:4. 环丙沙星(Ciprofloxacin):环丙沙星是一种广谱抗生素,属于喹诺酮类抗生素,通过抑制细菌DNA酶的活性来杀死细菌。
其结构式为:5. 氟哌酸(Fluoxetine):氟哌酸是一种选择性5-HT再摄取抑制剂,用于抑郁症治疗。
其结构式为:6. 雷尼替丁(Ranitidine):雷尼替丁是一种H2受体拮抗剂,用于治疗胃溃疡和消化道溃疡等胃肠疾病。
其结构式为:7. 布地奈德(Budesonide):布地奈德是一种糖皮质激素类药物,用于治疗哮喘和鼻炎等炎症性疾病。
其结构式为:8. 甲磺酸麦角新碱(Mitomycin C):甲磺酸麦角新碱是一种抗肿瘤药物,通过与DNA反应形成DNA交联物,抑制肿瘤细胞的增殖。
其结构式为:9. 氨基糖苷类抗生素(Aminoglycoside Antibiotics):氨基糖苷类抗生素包括庆大霉素和链霉素等药物,具有广谱抗菌活性,通过与细菌核糖体结合抑制细菌蛋白质合成。
其典型结构式为:10. 阿托伐他汀(Atorvastatin):阿托伐他汀是一种他汀类药物,通过抑制3-羟基-3-甲基戊二酸还原酶来降低胆固醇合成,用于治疗高胆固醇和动脉粥样硬化等疾病。
其结构式为:以上只是常用化学药物结构式的一部分,还有许多其他药物也值得关注。
他唑巴坦报告

他唑巴坦及其中间体合成研究进展报告一、小组成员冯冬萍胡婷占坚周凯周良华二、报告摘要他唑巴坦是一种新型β-内酰胺酶抑制剂,具有很强的抑酶活性。
报告综述了近些年来国内外对于他唑巴坦及其中间体的合成研究进展,并对各种反应方法进行了比较和总结。
三、药物简介他唑巴坦(tazobactam)是日本大鹏制药公司开发的新型青霉烷砜类β-内酰胺酶抑制剂。
化学名3α-甲基-7-氧代-3β-(1H-1,2,3,-三唑-1-亚甲基)-4-硫杂-1-氮杂双环[3.2.0]庚烷-2α-羧酸4,4-二氧化物,其最早由Hall T.W[1]等人从6-氨基青霉烷酸(6-aminopenicillianic aicd,6-APA)出发制得,它的结构是在舒巴坦的基础上增加一个三氮唑环,以提高抑酶效果,它是目前临床效果最佳的β-内酰胺酶抑制剂,具有稳定性高、活性低、毒性低、抑酶活性强等特点。
1992年,他唑巴坦的复方药物他唑巴坦/哌拉西林(1:8)首次在法国上市,用于治疗多种细菌感染。
他唑巴坦的结构图四、合成方法他唑巴坦的合成根据所采用的原料不同,主要有三条合成路线,分别以舒巴坦,青霉素G钾盐,和6-氨基青霉烷酸(6-APA)为起始原料。
1、他唑巴坦的合成方法他唑巴坦的合成根据所采用的原料不同,主要有三条合成路线,分别以舒巴坦,青霉素G钾盐,和6-氨基青霉烷酸(6-APA)为起始原料。
1.1 以舒巴坦为原料图1.1有人采用舒巴坦为原料,经叠氮化、保护、环合和脱保护合成他唑巴坦[2](见图1.1)。
这条路线主要存在以下两个缺点:(1)原料价格高,舒巴坦是以6-APA为原料,经重氮化、氧化,氢解、脱溴等几步反应制得的,收率仅为40%多,市场上以原料药形式出售,价格较高。
(2)甲基的直接叠氮化反应难于发生,产率很低,是制约本合成路线的关键所在。
邻位的硫已被完全氧化且甲基上没有其它取代基的情况下,叠氮化反应是非常困难的。
因此,这条路线只能作为理论研究丰富他唑巴坦的合成方法,并不能用于实际生产中去。
舒巴坦杂质列表

E)
Sulbactam
Impurity
24158-88 10mg-25mg-50mg
6
舒巴坦杂质 6 6(Sulbactam
≥99
-1
-100mg
EP Impurity
F)
广州隽沐生物主营各种杂质对照品:紫杉醇杂质,莫西沙星杂质,达托霉素杂质,
阿奇霉素杂质,帕拉米韦杂质,克拉霉素磷酸酯杂质,西格列汀杂质,林可霉素
依鲁替尼杂质列表(部分)
序号
1
2
产品名称
舒巴坦杂质 1
舒巴坦杂质 2
英文名称
Sulbactam Impurity
1(Sulbactam EP Impurity
A) Sulbactam
Impurity 2(Sulbactam EP Impurity
B)
CAS 号
规格
23315-18 10mg-25mg-50mg
Impurity 4(Sulbactam EP Impurity
73335-78 10mg-25mg-50mg
-1
-100mg
≥99
D)
Sulbactam
Impurity
76646-91 10mg-25mg-50mg
5
舒巴坦杂质 5 5(Sulbactam
≥99
-8
-100mg
EP Impurity
杂质,奥拉帕利杂质,阿加曲班杂质,法莫替丁杂质,他达拉非杂质,厄洛替尼
杂质,替格瑞洛杂质等;并提供 COA、NMR、HPLC、MS、定量核磁等结构确证
图谱。
177 二 813 八 655
代理中检所/EP/BP/USP/LGC/TRC/TLC/MC/SIGMA/等品牌。
卡巴他赛杂质-(最新结构)列表
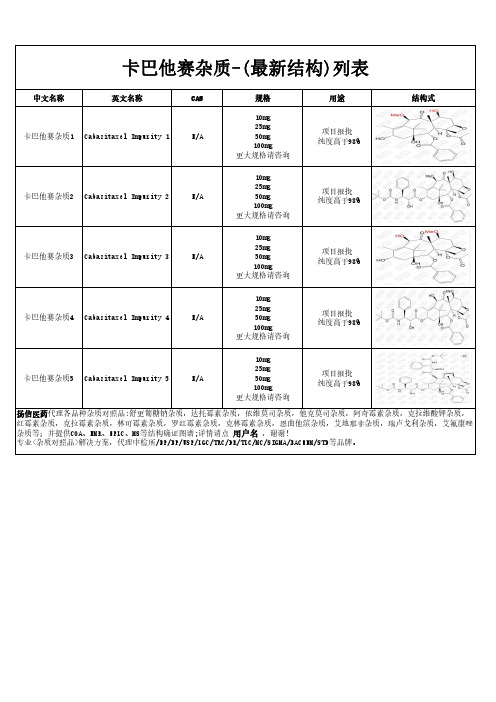
项目报批 纯度高于98%
卡巴他赛杂质3 Cabazitaxel Impurity 3
N/A
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
卡巴他赛杂质4 Cabazitaxel Impurity 4
N/A
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
卡巴他赛杂质5 Cabazitaxel Impurity 5
N/A
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高更葡糖钠杂质,达托霉素杂质,依维莫司杂质,他克莫司杂质,阿奇霉素杂质,克拉维酸钾杂质, 红霉素杂质,克拉霉素杂质,林可霉素杂质,罗红霉素杂质,克林霉素杂质,恩曲他滨杂质,艾地那非杂质,瑞卢戈利杂质,艾氟康唑 杂质等;并提供COA、NMR、HPLC、MS等结构确证图谱;详情请点 用户名 ,谢谢! 专业<杂质对照品>解决方案,代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌。
卡巴他赛杂质-(最新结构)列表
中文名称
英文名称
CAS
卡巴他赛杂质1 Cabazitaxel Impurity 1
N/A
规格
10mg 25mg 50mg 100mg 更大规格请咨询
用途
项目报批 纯度高于98%
结构式
卡巴他赛杂质2 Cabazitaxel Impurity 2
N/A
10mg 25mg 50mg 100mg 更大规格请咨询
注射用头孢哌酮钠他唑巴坦钠说明书

注射用头孢哌酮钠他唑巴坦钠说明书【药品名称】通用名:注射用头孢哌酮钠他唑巴坦钠商品名:凯斯英文名:Cefoperagone?Sodium?and??Tazobactam?Sodium?for?lnjection汉语拼音:Zhusheyong Toubaopaitongna Tazuobatanna本品为复方制剂,其组份为:头孢哌酮钠与他唑巴坦钠头孢哌酮钠化学名称为:(6R,7R)-3-[[(1-甲基-1H-四唑-5-基)硫]甲基]-7[(R)-2-(4-乙基-2,3-二氧代-1-哌嗪碳酰氨基)-2-对羟基苯基]-8-氧代-5硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸钠盐。
????????其结构式为:分子式:C25H27N9NaO8S2???分子量:667.66他唑巴坦钠化学名称为:[2S-(2α,3β,5α)]-3-甲基-7-氧-3-(1H,-1,2,3-三唑-1-甲基)-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠-4,4-二氧化物其结构式为:分子式:C10H11N4NaO5S分子量:322.28【性状】白色或类白色冻干粉未或结晶性粉末,无臭;有引湿性。
【药理毒理】本品主要抗菌成分为头孢哌酮(先锋必)为临床应用最广泛的第三代头孢菌素之一,通过抑制细菌细胞壁合成而起杀菌作用。
另一组分为β-内酰胺酶抑制剂舒巴坦的优化换代产品——他唑巴坦,其稳定性较克拉维酸好,对多种质粒和染色体介导的革兰阴性茵产出的β-内酰胺酶的抑制作用,比克拉维酸和舒巴坦强。
对多种耐药菌株产生的β-内酰胺酶有不可逆的竞争抑制作用,从而大大增强头孢哌酮的疗效。
体内外实验均证实头孢哌酮与他唑巴坦联用对各种耐药菌株具有十分显着的协同抗菌作用。
而且对一些头孢哌酮敏感的临床分离的细菌,也表现为对本品更加敏感。
本品与单用头孢哌酮相比,对下列各种常见致病菌:金黄色葡萄球菌、表皮葡萄球菌、变形球菌、绿脓杆菌、大肠杆菌、不动杆菌、产气肠杆菌、沙门氏菌属、阴沟杆菌也具有显着的协同作用(MIC值可降低2—4倍)。
卡巴他赛杂质结构式整理-杂质对照品

卡巴他赛杂质——孟成科技(上海)有限公司名称信息结构式卡巴他赛杂质Cabazitaxel Impurity分子式/Molecular Formula :C46H59NO14分子量/Molecular Weight :849.98卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C32H42O10分子量/Molecular Weight :586.69卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C51H71NO14Si分子量/Molecular Weight :950.22卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C43H59NO14分子量/Molecular Weight :813.95卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C45H59NO14分子量/Molecular Weight :837.97卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C45H57NO14分子量/Molecular Weight :835.95卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C49H65NO15分子量/Molecular Weight :908.06卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C13H17NO3分子量/Molecular Weight :235.29卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C49H65NO15分子量/Molecular Weight :908.06卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C18H25NO5分子量/Molecular Weight :335.40卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C33H44O10分子量/Molecular Weight :600.71卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C22H25NO6分子量/Molecular Weight :399.44CAS#:859498-34-3卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C31H42O10分子量/Molecular Weight :574.67卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C29H42O10分子量/Molecular Weight :550.65卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C24H21NO5分子量/Molecular Weight :403.44卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C24H21NO5分子量/Molecular Weight :403.43CAS#:949459-76-1卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula :C22H25NO6分子量/Molecular Weight :399.44CAS#:153652-67-6卡巴他赛杂质Cabazitaxel Impurity 分子式/Molecular Formula:C24H21NO5分子量/Molecular Weight:403.43CAS#:1262147-55-6。
沃诺拉赞杂质2019最新列表(名称、结构式、CAS号)

以上杂质品种包括中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD 等各大品牌:
1.替卡格雷杂质
2.利伐沙班杂质
3.阿考替胺杂质
4.普拉克索杂质
5.阿哌沙班杂质
6.氨氯地平杂质
7.硼替佐米杂质
8.比索洛尔杂质
9.阿比特龙杂质班杂质6.氨氯地
平杂质7.硼替佐米杂质8.比索洛尔杂质9.阿比特龙杂质拉非尼杂质15.维格列汀
杂质16.阿伐那非杂质17.托法替尼杂质18.米格列奈杂质19.沃替西汀杂质20尼
贝地平杂质21.艾帕列净杂质22.阿普斯特杂质23.门冬氨酸缩合物24.依托考昔
杂质25.达格列净杂质26.尼达尼布杂质27.托匹司他杂质28.坎格列净杂质29.帕
泊昔利布杂质30.依鲁替尼杂质31.盐酸氨溴索杂质32.达比加群酯杂质等等,
更多杂质请查阅文章左上角,未完待续。
哌拉西林钠他唑巴坦纳

我公司(系江苏海宏制药有限公司)生产的注 射用哌拉西林钠,于2002年4月29日获得国家食品 药品监督管理局注册批件,由于生产工艺的先进 性,产品在水分、含量及杂质与国内其它企业生产 的该品种相比,具有非常明显的质量优势,故该品 种于2006年8月28日获得国家发展和改革委员会的 单独定价文件(发改价格[2006]1542号《国家发展 改革委关于制定青霉素等99种抗微生物药品最高 零售价格的素G
无效及不耐酶水解
天然青霉素
(第一代) • 抗菌谱窄、不耐胃酸口服
• 耐酸、耐酶、广谱类、 半合成青霉 抗绿脓杆菌广谱类 素(第二代)
• 抗菌谱广、针对性强
第三代青 霉素类
• 氮咪青霉素
• 对阴性菌有效,绿脓 杆菌效果差
哌拉西林钠
属于半合成青霉素类抗菌药。 青霉素是一种高效、低毒、临床应用广泛的重要抗生素 。40年代初用于临床,此后人们进行了大量的研究,通过改 变侧链结构生成一系列的耐酸、耐酶、针对性强的青霉素。 1953年中国第一批青霉素诞生,揭开中国生产抗生素 的历史。截至2001年,中国青霉素年产量已占世界的60%, 居首位。
他唑巴坦钠为β-内酰胺酶抑制剂
阻断β-内酰胺酶对哌拉西林钠的灭活,合用后使哌 拉西林对产酶大肠杆菌、克雷伯菌属、变形菌属、铜绿假 单胞菌、革兰阳性菌、厌氧菌抗菌作用增强。 它能够提高哌拉西林钠的抗菌功效,该工艺为按照注 射用哌拉西林钠(发改委单独定价)生产工艺生产的无菌 哌拉西林钠,加入他唑巴坦钠混匀后进行冻干而得。
《海峡药学》2008年第20卷第12期
在静滴哌拉西林钠-他唑巴坦钠后出现白细胞、血 小板计数明显减少,值得引起重视
《中南药学》2006年第4卷第6期
二、适用症 阑尾炎(伴发穿孔或脓肿)、腹膜炎 皮肤及软组织感染:蜂窝织炎、皮肤脓肿、 缺血性或糖尿病性足部感染 产后子宫内膜炎、盆腔炎 社区获得性肺炎 中、重度医院获得性肺炎 全身、局部细菌感染
他唑巴坦相关杂质
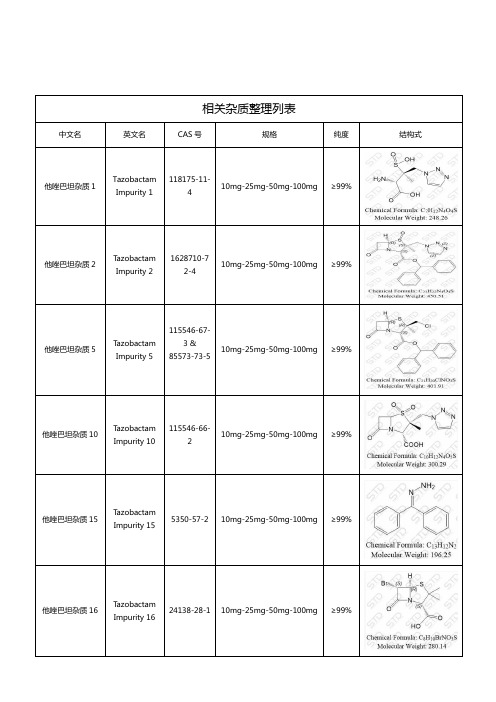
相关杂质整理列表中文名英文名CAS号规格纯度结构式他唑巴坦杂质1 TazobactamImpurity 1118175-11-410mg-25mg-50mg-100mg ≥99%他唑巴坦杂质2 T azobactamImpurity 21628710-72-410mg-25mg-50mg-100mg ≥99%他唑巴坦杂质5 T azobactamImpurity 5115546-67-3 &85573-73-510mg-25mg-50mg-100mg ≥99%他唑巴坦杂质10 T azobactamImpurity 10115546-66-210mg-25mg-50mg-100mg ≥99%他唑巴坦杂质15 T azobactamImpurity 155350-57-2 10mg-25mg-50mg-100mg ≥99%他唑巴坦杂质16 T azobactamImpurity 1624138-28-1 10mg-25mg-50mg-100mg ≥99%他唑巴坦杂质33 T azobactamImpurity 33104862-31-910mg-25mg-50mg-100mg ≥99%他唑巴坦杂质34 T azobactamImpurity 3480353-26-0 10mg-25mg-50mg-100mg ≥99%他唑巴坦杂质36 T azobactamImpurity 3687579-79-1 10mg-25mg-50mg-100mg ≥99%湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD、LGC、TLC、EP、USP、TRC等多个品牌产品,提供上万种标准品对照品,真诚为您服务。
他唑巴坦杂质A国家标准物质的研制

学报Journal of China Pharmaceutical University2021,52(1):60-6560他唑巴坦杂质A国家标准物质的研制肖亭1,王晨1,田冶1,张夏1,刘颖1,马步芳1,刘书妤2,姚尚辰1*,冯艳春1**(1中国食品药品检定研究院,北京102629;2上海工程技术大学,上海201620)摘要研制他唑巴坦杂质A国家标准物质,为提高国内他唑巴坦的质量控制标准提供依据。
对他唑巴坦杂质A进行合成,利用红外、质谱、核磁共振波谱技术进行结构确认,并对杂质A进行含量均匀性检查和短期稳定性考察,再测定其水分和炽灼残渣含量,并以10mmol/L醋酸铵溶液-乙腈(98∶2)为流动相的高相液相色谱法测定杂质A的纯度,应用质量平衡法确定首批他唑巴坦杂质A国家标准物质的含量,同时采用核磁共振波谱定量法测定其含量,与质量平衡法结果相互验证。
结果发现,本研究所研制的他唑巴坦杂质A标准物质与《中华人民共和国药典:二部》(2015年版)他唑巴坦系统适用性溶液中最大降解杂质和USP41中收载的他唑巴坦有关物质A标准物质结构一致;在95%置信范围内,分装后杂质A的瓶间和瓶内方差之比为0.61(小于F0.05(11,12)),均匀性良好;杂质A中有机杂质含量为0.90%,水分含量为1.24%,无机杂质含量为0.25%,以质量平衡法确定杂质A含量为97.6%,与核磁共振波谱定量法结果97.1%基本一致;在25℃条件下,杂质A面积归一化纯度在0、3、5和10d的均值均为99.1%,证明样品在室温下10d内稳定。
本研究首次制备了他唑巴坦杂质A国家标准物质。
关键词他唑巴坦;他唑巴坦杂质A;杂质标准物质;结构确证;质量平衡法;赋值中图分类号R917文献标志码A文章编号1000-5048(2021)01-0060-06doi:10.11665/j.issn.1000-5048.20210108引用本文肖亭,王晨,田冶,等.他唑巴坦杂质A国家标准物质的研制[J].中国药科大学学报,2021,52(1):60–65.Cite this article as:XIAO Ting,WANG Chen,TIAN Ye,et al.Establishment of national reference standard of tazobactam impurity A[J].J China Pharm Univ,2021,52(1):60–65.Establishment of national reference standard of tazobactam impurity A XIAO Ting1,WANG Chen1,TIAN Ye1,ZHANG Xia1,LIU Ying1,MA Bufang1,LIU Shuyu2,YAO Shangchen1*, FENG Yanchun1**1National Institutes for Food and Drug Control,Beijing102629;2Shanghai University of Engineering Science,Shanghai201620,ChinaAbstract To improve the standard of quality control of tazobactam and its preparations in China,national refer⁃ence standard of tazobactam impurity A was developed.After tazobactam impurity A was synthesized,its struc⁃ture was validated by infrared(IR),mass spectrometry(MS)and nuclear magnetic resonance(NMR),and its content uniformity and short-term stability were measured and investigated.Then,water content and residue on ignition of impurity A were determined,and its purity was determined using high performance liquid chromatogra⁃phy(HPLC)with10mmol/L ammonium acetate solution-acetonitrile(98∶2)as the mobile phase.Mass balance method was used to determine the content of the first batch of tazobactam impurity A national standard sub⁃stance.Meanwhile,nuclear magnetic quantitative method was used to calculate the content,which was mutually verified with the mass balance method.The developed reference material of tazobactam impurity A is consistent with the maximum degradation impurity in tazobactam system applicability solution and the reference material of tazobactam related substance A contained in USP41.Within the95%confidence range,the ratio of inter-and收稿日期2020-09-29通信作者*Tel:************E-mail:yaoshangchen@**Tel:************E-mail:fyc@基金项目国家科技支撑计划资助项目(No.2015BAK45B01)第52卷第1期肖亭,等:他唑巴坦杂质A国家标准物质的研制intra-bottle variance of impurity A after separation was0.61(<F0.05(11,12)),proving that the uniformity was satisfy⁃ing.The contents of organic impurity,water content and inorganic impurity in impurity A were0.90%,1.24% and0.25%,respectively.The content of impurity A was determined to be97.6%by mass balance method, which was basically consistent with the result of nuclear magnetic quantitative method(97.1%).Under the condition of25°C,the area normalized purity of impurity A was99.1%at0,3,5and10days,proving that the sample was stable at room temperature for10days.Finally the first batch of national standard substance of tazo⁃bactam impurity A was established successfully.Key words tazobactam;tazobactam impurity A;national impurity reference standard;structural identification;mass balance method;content assignmentThis study was supported by National Science and Technology Support Program(2015BAK45B01)国家药品标准物质系指供国家法定药品标准中药品的物理、化学及生物学等测试用,具有确定的特性或量值,用于校准设备、评价测量方法、给供试药品赋值或鉴别用的物质,应具备稳定性、均匀性和准确性[1]。
他唑巴坦酸生产工艺

他唑巴坦酸生产工艺一、起始原料准备他唑巴坦酸的生产需要经过多个化学反应步骤,因此起始原料的准备是至关重要的。
常用的起始原料包括他唑巴坦、丙二酸二乙酯、硫酸二甲酯等。
在准备原料时,需要确保它们的纯度和稳定性,以避免对后续的化学反应产生影响。
二、投料按照生产工艺的要求,将起始原料按照一定的比例混合在一起,准备进行化学反应。
投料的过程需要注意精确控制原料的配比和混合均匀度,以保证化学反应的顺利进行。
三、反应在投料完成后,将混合物加热至适当的温度,并加入催化剂或引发剂,开始进行化学反应。
在反应过程中,需要监测温度、压力、pH值等参数,确保反应在最佳条件下进行。
四、纯化反应完成后,需要对产物进行纯化,去除其中的杂质和副产物。
常用的纯化方法包括结晶、过滤、萃取、蒸馏等。
根据产物的性质和要求,选择合适的纯化方法。
五、结晶与干燥经过纯化后的产物需要进行结晶和干燥处理,以提高产品的纯度和稳定性。
结晶和干燥的条件需要根据产物的性质和要求进行选择,确保得到的产品符合质量标准。
六、质量检测在每个生产环节完成后,需要对产品进行质量检测,确保符合预定的质量标准。
质量检测的内容包括化学组成、物理性质、纯度、含量等方面的测定。
七、包装经过质量检测合格的产品需要进行包装,以保护产品在储存和运输过程中的质量和安全。
包装材料应选择符合相关规定和标准的材料,包装设计应考虑防潮、防震、防尘等方面的要求。
八、储存与运输他唑巴坦酸在储存和运输过程中需要保持干燥、避光和密封,以避免受潮、氧化和污染等影响产品质量的问题发生。
同时,应根据产品的性质和要求选择合适的运输方式和储存条件,确保产品在储存和运输过程中的安全性和稳定性。
他唑巴坦

他唑巴坦TazuobatanTazobactamC10H12N4O5S 300.30 本品为[2S-(2α,2β,5α)]-3-甲基-7-氧代-3-(1H-1,2,3-三唑-1-甲基)-4-硫杂-1-氮杂双环-[3,2,0]-庚烷-2-羧酸-4,4-二氧化物。
按无水物计算,含他唑巴坦(C10H12N4O5S)应为98.0%~102.0%。
【性状】本品为白色或类白色粉末或结晶性粉末;无臭,味苦;略有引湿性。
本品在二甲基甲酰胺中易溶,在甲醇或丙酮中微溶,在乙醇或水中微溶或极微溶解。
比旋度取本品,精密称定,用甲醇-水(1:1)溶解并定量稀释制成每1ml中约含10mg 的溶液,依法测定(附录ⅥE),比旋度为+127°至+139°。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集图)一致。
【检查】酸度取本品,加水制成每1ml中含2.5mg的溶液,超声使溶解,依法测定(附录Ⅵ H),pH值应为2.0~2.5。
溶液的澄清度与颜色取本品5份,分别加5%碳酸氢钠溶液制成每1ml中含0.1g的溶液,溶液应澄清无色;如显浑浊,与1号浊度标准液(附录Ⅸ B)比较,均不得更浓;如显色,与黄色或黄绿色4号标准比色液(附录Ⅸ A第一法)比较,均不得更深。
有关物质取本品适量,精密称定,用流动相溶解并稀释制成每1ml中约含5.0mg的溶液,作为供试品溶液;精密量取1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。
照含量测定项下的色谱条件,取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的20%~25%,精密量取供试品溶液和对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积(1.0%),各杂质峰面积的和不得大于对照溶液主峰面积的1.5倍(1.5%)。
哌拉西林钠他唑巴坦钠检验标准

哌拉西林钠他唑巴坦钠检验标准嘿,咱今天来聊聊哌拉西林钠他唑巴坦钠检验标准哈。
就说有一次啊,我在实验室里,看着那一瓶瓶的哌拉西林钠他唑巴坦钠,心里就想着,这玩意儿可得好好检验检验呀。
我就像个侦探似的,仔细地观察着每一个细节。
先拿起一瓶,看看它的颜色,嗯,得是那种正常的白色啥的,可不能有啥奇怪的颜色出现。
然后再闻闻味道,不能有异味呀,不然肯定有问题。
接着呢,我又开始检测它的纯度,这可不能马虎,一点点杂质都可能影响效果呢。
我在那捣鼓来捣鼓去,一会儿用这个仪器测测,一会儿用那个试剂试试,忙得不亦乐乎。
就感觉自己像是在守护这些哌拉西林钠他唑巴坦钠的小卫士,可不能让不合格的产品从我的眼皮子底下溜走咯。
哎呀呀,这就是我对哌拉西林钠他唑巴坦钠检验标准的一次细致体验啦,真的是要特别特别认真才行呢,这样才能保证用它治病救人的时候不出差错呀!这检验标准可真是太重要啦,咱可不能含糊,得把好关呀!嘿嘿。
