高中化学溶解性表
新课标高中化学选修3第三节溶性、手性、无机氧酸分子的酸性

第2课时溶解性、手性、无机含氧酸分子的酸性学业要求素养对接1.知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
2.结合实例初步认识分子的手性对其性质的影响。
3.会判断常见无机含氧酸酸性强弱。
微观探析:键的极性和分子的极性。
模型认知:运用“相似相溶”规律判断物质的溶解性、运用无机含氧酸酸性强弱理论判断无机含氧酸酸性的强弱。
[知识梳理]一、溶解性1.相似相溶规律非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
如蔗糖和氨易溶于水,难溶于四氯化碳。
萘和碘易溶于四氯化碳,难溶于水。
2.影响物质溶解性的因素(1)外界因素:主要有温度、压强等。
(2)氢键:溶剂和溶质之间的氢键作用力越大,溶解性越好(填“好”或“差”)。
(3)分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性越大。
如乙醇与水互溶,而戊醇在水中的溶解度明显较小。
(4)溶质是否与水反应:溶质与水发生反应,溶质的溶解度会增大。
如SO2与水反应生成的H2SO3可溶于水,故SO2的溶解度增大。
【自主思考】1.有机溶剂都是非极性溶剂吗?提示有机溶剂大多数是非极性溶剂,如CCl4、C6H6等,但也有少数的极性溶剂,如酒精。
二、手性1.手性异构体具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。
2.手性分子有手性异构体的分子叫做手性分子。
如乳酸()分子。
三、无机含氧酸分子的酸性1.对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
2.含氧酸的通式可写成(HO)m RO n,若成酸元素R相同,则n值越大,酸性越强。
【自主思考】2.强酸的水溶液酸性一定比弱酸的水溶液酸性强吗?提示不一定,如很稀的稀硫酸的酸性没有饱和亚硫酸溶液的酸性强,溶液的酸性强弱除与酸的强弱有关外,还与酸溶液浓度大小有关。
[自我检测]1.判断正误,正确的打“√”;错误的打“×”。
(1)卤化氢易溶于水,不易溶于四氯化碳。
高中化学记不住溶解性表记忆口诀

高中化学记不住溶解性表记忆口诀(学习版)编制人:__________________审核人:__________________审批人:__________________编制学校:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的学习资料,如英语资料、语文资料、数学资料、物理资料、化学资料、生物资料、地理资料、历史资料、政治资料、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides various types of learning materials for everyone, such as English materials, language materials, mathematics materials, physical materials, chemical materials, biological materials, geographic materials, historical materials, political materials, other materials, etc. Please pay attention to the data format and writing method!高中化学记不住溶解性表记忆口诀--> 溶解性表是大家学习化学必备的解题技巧,这张表的知识点所占的分值是比较大的,比如大家不太擅长的化学推导题就会依照这张表的性质去推断,所以大家一定要掌握这部分知识,那么今天就为大家带来了十一个口诀,无论如何都要记住这部分知识哦!溶解性口诀一钾钠铵盐溶水快,硫酸沉钡银铅钙。
化学常用物质溶解性表及沉淀颜色

化学溶解性表盐类溶解性表的规律可编成如下口诀记忆:钾、钠铵盐都可溶,硝盐遇水影无踪;硫(酸)盐不溶铅和钡,氯(化)物不溶银、亚汞。
氢气还原氧化铜实验,操作顺序可编成如下口诀记忆:氢气应早去晚归,酒精灯迟到早退,试管口下倾水滴。
氧化一还原反应的定义、性质、特征可编成如下口诀记忆:升失氧,降得还;若说剂,两相反。
盐类水解规律可编成如下口诀记忆:无“弱”不水解,谁“弱”谁水解;愈“弱”愈水解,又“弱”剧水解;谁“强”显谁性,双“弱”由K定。
盐类水解离子方程式的书写可编成如下口诀:左边水写分子式,中间符号写可逆,右边不写“↑”和“↓”。
溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③口诀中未有皆下沉。
④注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;③硝酸盐都溶于水;④口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀四钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
溶解性口诀五钾钠铵盐硝酸盐完全溶解不困难氯化亚汞氯化银硫酸钡和硫酸铅生成沉淀记心间氢硫酸盐和碱类碳酸磷酸硝酸盐可溶只有钾钠铵钾钠铵盐溶水快,①硫酸盐除去钡铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③口诀中未有皆下沉。
(完整版)高中化学有机化合物知识点总结

— CHO ~2Cu(OH) 2~ Cu 2O
HCHO ~ 4Cu(OH) 2~ 2Cu 2O
7.能跟 I2 发生显色反应的是:淀粉。 8.能跟浓硝酸发生颜色反应的是:含苯环的天然蛋白质。
三、各类烃的代表物的结构、特性
类别 通式
烷烃 CnH2n+2(n≥ 1)
烯烃 CnH2n(n ≥2)
炔烃
苯及同系物
,要抓住某些有机物的特征反应,选用合适
1 .常用的试剂及某些可鉴别物质种类和实验现象归纳如下:
试剂 名称
酸性高锰 酸钾溶液
溴水 少量
银氨 溶液
新制 Cu(OH) 2
碘水
酸碱 指示剂
NaHCO 3
被鉴 别物 质种 类
含 碳 碳 双 含碳碳双 键、三键的 键、三键 物质、烷基 的物质。 苯。但醇、 但醛有干 醛有干扰。 扰。
一、重要的物理性质
高中化学有机物知识点总结
1 .有机物的溶解性
( 1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、
羧酸等。
( 2)易溶于水的有:低级的 [一般指 N(C ) ≤ 4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
( 3)具有特殊溶解性的:
① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。
两性化合物 能形 成肽键
蛋白 质
结构复杂 不可用通式表示
肽键 氨基 —NH 2
1.两性
酶
多肽链间有四级结构
2.水解
3.变性
4.颜色反应
5
羧基 — COOH
羟基— OH 多数可用下列通
醛基— CHO 糖 式表示:
Cn(H 2O) m
化学溶解度表和化学价的口诀

化学溶解度表和化学价的口诀溶解性口诀一:1钾钠铵盐溶水快,2硫酸盐除去钡铅钙。
3氯化物不溶氯化银4硝酸盐溶液都透明。
4口诀中未有皆下沉。
溶解性口诀二:钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
溶解性口诀三:钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀四:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
溶解性口诀五钾钠铵盐硝酸盐完全溶解不困难氯化亚汞氯化银硫酸钡和硫酸铅生成沉淀记心间氢硫酸盐和碱类碳酸磷酸硝酸盐可溶只有钾钠铵化学价合价一:一价氟氯溴碘氢,还有金属钾钠银。
二价氧钡钙镁锌,铝三硅四都固定。
氯氮变价要注意,一二铜汞一三金。
二四碳铅二三铁,二四六硫三五磷。
常见元素的主要化合价二:氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
化合价口诀三:一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;全铜以二价最常见。
常见根价口诀:一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
金属活动性顺序表:(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
(高中)钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金。
高中化学溶解性表

高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
沉淀鉴别
色沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;
Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住(见上表)。
溶解度表

溶解度表维基百科,自由的百科全书跳转到:导航, 搜索关于高中阶段使用的用于判断溶解性的简易表格,请参见溶解性表。
溶解度表以化学品中特征元素的拼音顺序排列。
所有数据都为1atm下的数据,单位为g/100cm3。
内容列表:锕、氨、铵、钯、钡、铋、铂、钚、氮、镝、铒、钒、钆、钙、锆、镉、铬、汞、钴、硅、铪、氦、钬、镓、钾、金、钪、镧、锂、硫、镥、铝、镁、锰、钠、镍、钕、硼、铍、钋、镨、氢、铅、铷、铯、钐、砷、铈、锶、铊、碳、铽、锑、铁、铜、钍、锡、氙、锌、溴、氩、氧、铟、钇、镱、银、铀、铕、有机化合物物质化学式0°C 10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C氢氧化锕(III)Ac(OH)30.0022氨NH388.5 70 56 44.5 34 26.5 20 15 11 8 7叠氮化铵NH4N316 25.3 37.1苯甲酸铵NH4C7H5O220碳酸氢铵NH4HCO311.9 16.1 21.7 28.4 36.6 59.2 109 170 354溴化铵NH4Br60.6 68.1 76.4 83.2 91.2 108 125 135 145碳酸铵(NH4)2CO3100氯酸铵NH4ClO328.7氯化铵NH4Cl29.4 33.2 37.2 41.4 45.8 50.4 55.3 60.2 65.6 71.2 77.3氯铂酸铵(NH4)2PtCl60.289 0.374 0.499 0.637 0.815 1.44 2.16 2.61 3.36铬酸铵(NH4)2CrO425 29.2 34 39.3 45.3 59 76.1重铬酸铵(NH4)2Cr2O718.2 25.5 35.6 46.5 58.5 86 115 156砷酸二氢铵NH4H2AsO433.7 48.7 63.8 83 107 122磷酸二氢铵NH4H2PO422.7 39.5 37.4 46.4 56.7 82.5 118 173氟硅酸铵(NH4)2SiF618.6甲酸NH4HCO2102 143 204 311 533铵磷酸一氢铵(NH4)2HPO442.9 62.9 68.9 75.1 81.8 97.2硫酸氢铵NH4HSO4100酒石酸氢铵NH4HC4H4O61.882.7碘酸铵NH4IO32.6碘化铵NH4I155 163 172 182 191 209 229 250硝酸铵NH4NO3118 150 192 242 297 421 580 740 871高碘酸铵(NH4)5IO62.7草酸铵(NH4)2C2O42.23.214.45 6.09 8.18 14 22.4 27.9 34.7高氯酸铵NH4ClO412 16.4 21.7 37.7 34.6 49.9 68.9高锰酸铵NH4MnO40.8磷酸铵(NH4)3PO426.1硒酸铵(NH4)2SeO496 105 115 126 143 192硫酸铵(NH4)2SO470.6 73 75.4 78 81 88 95 103亚硫酸铵(NH4)2SO347.9 54 60.8 68.8 78.4 104 144 150 153酒石酸铵(NH4)2C4H4O645 55 63 70.5 76.5 86.9硫氰酸铵NH4SCN120 144 170 208 234 346硫代硫酸铵(NH4)2S2O32.15钒酸铵NH4VO30.48 0.84 1.32 2.42(II)10-10氢氧化钯(IV)Pd(OH)45.247×10-14乙酸钡Ba(C2H3O2)258.862 72 7578.575 74 74.8砷酸钡Ba3(AsO4)22.586×10-9叠氮化钡Ba(N3)212.516.1 17.4溴酸钡Ba(BrO3)20.290.44 0.65 0.951.312.273.520.951.31溴化钡BaBr298 101 104 109 114 123 135 149碳酸钡BaCO31.409×10-3氯酸钡Ba(ClO3)220.326.9 33.9 41.649.766.784.8105氯化钡BaCl231.233.5 35.8 38.140.846.252.555.859.4氯酸钡Ba(ClO2)243.944.6 45.447.953.866.680.8铬酸钡BaCrO42.775×10-4氰化钡Ba(CN)280亚铁氰化钡Ba2Fe(CN)69.732×10-3氟化钡BaF20.1590.160.162氟硅酸钡BaSiF62.8×10-2甲酸钡Ba(HCO2)226.228 31.9 3438.644.247.651.3磷酸氢钡BaHPO41.3×10-2亚磷酸氢钡BaHPO30.687氢氧化钡Ba(OH)2·8H2O1.672.483.89 5.598.2220.9101碘酸钡Ba(IO3)23.5×4.6×5.7×10-210-210-2碘化钡BaI2182 201 223 250 264 291 301钼酸钡BaMoO46×10-3硝酸钡Ba(NO3)24.956.67 9.02 11.514.120.427.234.4亚硝酸钡Ba(NO2)250.360 72.8 102 151 222 261 325草酸钡BaC2O4·2H2O3×10-3氧化钡BaO 3.8高氯酸钡Ba(ClO4)2239 336 416 495 575 653高锰酸钡Ba(MnO4)21.5×10-2焦磷酸钡Ba2P2O79×10-3硒酸钡BaSeO45×10-3硫酸钡BaSO42.448×10-4硫化钡BaS2.884.89 7.86 10.414.927.749.967.360.3砷酸铋BiAsO47.298×10-4氢氧化铋Bi(OH)32.868×10-7碘化铋BiI37.761×10-4磷酸铋BiPO41.096×10-10硫化铋Bi2S31.561×10-20氢氧化铂(II)Pt(OH)23.109×10-11溴化铂(IV)PtBr41.352×10-7物质化学式°C10°C 20°C 30°C 40°C 50°C 60°C 70°C 80°C 90°C 100°C 一氧化氮NO5.6×10-3一氧化二氮N 2O0.112铬酸镝(III )Dy 2(CrO 4)3·10H2O0.663(III )·9H2O氢氧化钆(III )Gd(OH)31.882×10-5硫酸钆(III )Gd2(SO4)33.98 3.3 2.6 2.32氯化钙CaCl259.5 64.7 74.5 100 128 137 147 154 159乙酸钙Ca(C2H3O2)2·2H2O37.4 36 34.7 33.8 33.2 32.7 33.531.129.7砷酸钙Ca3(AsO4)23.629×10-3叠氮化钙Ca(N3)245苯甲酸钙Ca(C7H5O2)2·3H2O2.32 2.45 2.723.02 3.424.71 6.878.558.7碳酸氢钙Ca(HCO3)216.1 16.6 17.1 17.5 17.9 18.4溴酸钙Ca(BrO3)2230溴化钙CaBr2125 132 143 213 278 295 312霰石CaCO3-霰石7.753×10-4方解石CaCO3-方解石6.170×10-4氯酸钙Ca(ClO3)2209铬酸钙CaCrO44.5 2.25 1.83 1.49 0.83磷酸二氢钙Ca(H2PO4)21.8氟化钙CaF28.575×10-3氟硅酸钙CaSiF60.518甲酸钙Ca(HCO2)216.1 16.6 17.1 17.5 17.9 18.4磷酸氢钙CaHPO44.303×10-3氢氧化钙Ca(OH)20.1890.1820.1730.160.1410.1218.6×10-27.6×10-2碘酸钙Ca(IO3)29×10-20.24 0.38 0.52 0.65 0.660.67碘化钙CaI264.6 66 67.6 70.8 74 78 81钼酸钙CaMoO44.099×10-3硝酸钙Ca(NO3)2·4H2O102 115 129 152 191 358 363亚硝酸钙Ca(NO2)2·4H2O63.9 84.5 104 134 151 166 178草酸钙CaC2O46.7×10-4高氯酸钙Ca(ClO4)2188高锰酸钙Ca(MnO4)2338磷酸钙Ca3(PO4)22×10-3硒酸钙CaSeO4·2H2O 9.73 9.77 9.22 8.79 7.14硫酸钙CaSO4·2H2O0.2230.2440.2550.2640.2650.2440.2340.205钨酸钙CaWO42.387×10-3氟化锆ZrF41.32硫酸锆Zr(SO4)2·4H2O52.5砷酸镉Cd3(AsO4)27.091×10-6苯甲酸镉Cd(C7H5O2)22.81溴酸镉Cd(BrO3)2125溴化镉CdBr256.3 75.4 98.8 129 152 153 156 160碳酸镉CdCO33.932×10-5氯酸镉Cd(ClO3)2299 308 322 348 376 455氯化镉CdCl2100 135 135 135 135 136 140 147氰化镉Cd(CN)22.2×10-2亚铁氰化镉Cd2Fe(CN)68.736×10-5氟化镉CdF24甲酸镉Cd(HCO2)28.3 11.1 14.4 18.6 25.3 59.5 80.585.294.6氢氧化镉Cd(OH)22.697×10-4碘酸镉Cd(IO3)29.7×10-2碘化镉CdI278.7 84.7 87.9 92.1 100 111 125硝酸镉Cd(NO3)2122 136 150 194 310 713草酸镉CdC2O4.3H2O6.046×10-3高氯酸镉Cd(ClO4)2180 188 195 203 221 243 272磷酸镉Cd3(PO4)26.235×10-6硒酸镉CdSeO472.5 68.4 64 58.9 55 44.2 32.527.222硫酸镉CdSO475.4 76 76.6 78.5 81.8 66.763.160.8硫化镉CdS1.292×10-12钨酸镉CdWO44.642×10-2硝酸铬Cr(NO3)3108 124 130 152高氯酸铬Cr(ClO4)3104 123 130硫酸铬Cr2(SO4)3·18H2O220叠氮化亚汞Hg2(N3)22.727×10-2溴化亚汞Hg2Br21.352×10-6碳酸亚汞Hg2CO34.351×10-7氯化亚汞Hg2Cl23.246×10-5铬酸亚汞Hg2CrO42.313×10-3氰化亚汞Hg2(CN)22.266×10-12高氯酸亚汞Hg2(ClO4)2)282 325 407 455 499 541 580硫酸亚汞Hg2SO44.277×10-2乙酸汞Hg(C2H3O2)225苯甲酸汞Hg(C7H5O2)2·H2O1.1溴酸汞Hg(BrO3)2·2H2O0.08溴化汞HgBr20.3 0.4 0.56 0.66 0.91 1.68 2.77 4.9氯酸汞Hg(ClO3)225氯化汞HgCl23.634.82 6.57 8.34 10.2 16.3 30 61.3氰化汞Hg(CN)29.3碘酸汞Hg(IO3)22.372×10-3碘化汞HgI26×10-3草酸汞HgC2O41.1×10-2硫化汞HgS2.943×10-25硫氰酸汞Hg(SCN)26.3×10-2溴酸钴Co(BrO3)2·6H2O45.5溴化钴CoBr291.9 112 128 163 227 241 257氯酸钴Co(ClO3)2135 162 180 195 214 316氯化钴CoCl243.5 47.7 52.9 59.7 69.5 93.8 97.6 101 106氟化钴CoF21.36氟硅酸钴CoSiF6·6H2O118碘酸钴Co(IO3)2·2H2O1.02 0.9 0.88 0.82 0.73 0.7碘化钴CoI2203硝酸钴Co(NO3)284 89.6 97.4 111 125 174 204 300亚硝酸钴Co(NO2)27.6×0.24 0.4 0.61 0.85物质化学式°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C氢氧化铪(III )Hf(OH)34.50305×10-4氢氧化铪(IV)Hf(OH)44.503×10-6氦He0.6 氢氧化钬(III )Ho(OH)32.519×10-5物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C氢氧化镓Ga(OH)38.616×10-9草酸镓Ga2(C2O4)3·42O0.4硒酸镓Ga2(SeO4)3·16H2O18.1乙酸钾KC2H3O2216 233 256 283 324 350 381 398砷酸钾K3AsO419叠氮化KN341.446.250.855.861 106钾苯甲酸钾KC7H5O265.870.776.782.1溴酸钾KBrO33.094.726.919.6413.122.734.149.9溴化钾KBr53.659.565.370.775.485.594.999.2104溴铂酸钾K2PtBr61.89碳酸钾K2CO3105 109 111 114 117 127 140 148 156氯酸钾KClO33.3 5.2 7.310.113.923.837.546 56.3氯化钾KCl2831.234.237.240.145.848.851.353.956.3铬酸钾K2CrO456.360 63.766.767.870.174.5氰化钾KCN50 重铬酸钾K2Cr2O74.7 7 12.318.126.345.673砷酸二氢钾KH2AsO419磷酸二氢钾KH2PO414.818.322.6 2835.550.270.483.5铁氰化钾K3Fe(CN)630.238 46 5359.370 91亚铁氰化钾K4Fe(CN)614.321.128.235.141.454.866.971.574.2氟化钾KF44.753.594.9 108 138 142 150甲酸钾KHCO2313 337 361 398 471 580 658碳酸氢钾KHCO322.527.433.739.947.565.6磷酸一氢钾K2HPO4150硫酸氢钾KHSO436.248.654.36176.496.1122氢氧化钾KOH95.7103 112 126 134 154 178碘酸钾KIO34.66.278.0810.312.618.324.832.3碘化钾KI128 136 144 153 162 168 176 192 198 206 硝酸钾KNO313.921.931.645.361.3106 167 203 245亚硝酸钾KNO2279 292 306 320 329 348 376 390 410草酸钾K2C2O425.531.936.439.943.853.263.669.275.3高氯酸钾KClO40.761.061.682.563.737.313.417.722.3高碘酸钾KIO40.170.280.420.651 2.1 4.4 5.9高锰酸钾KMnO42.834.316.349.0312.622.1过二硫酸钾K2S2O84.7磷酸钾K3PO481.592.3 108 133硒酸K2SeO4107 109 111 113 115 119 121 122钾硫酸钾K2SO47.4 9.3 11.1 1314.818.221.422.924.1四苯硼钾KBC24H201.8×10-5硫氰酸钾KSCN177 198 224 255 289 372 492 571 675硫代硫酸钾K2S2O396 155 175 205 238 293 312钨酸钾K2WO451.5三氯化金AuCl368三碘化金AuI31.295×10-10镧×10-2钼酸镧La2(MoO4)32.473×10-3硝酸镧La(NO3)3100 136 168 247硒酸镧La2(SeO4)350.545 45 45 4518.55.4 2.2硫酸镧La2(SO4)332.722.33 1.91.671.260.910.790.68钨酸镧La2(WO4)3·3H2O 6.06乙酸锂LiC2H3O231.235.140.850.668.6叠氮化锂LiN361.364.267.271.275.486.6100苯甲酸锂LiC7H5O238.941.644.753.8溴酸锂LiBrO3154 166 179 198 221 269 308 329 355溴化锂LiBr143 147 160 183 211 223 245 266 碳酸Li2CO3 1.5 1.4 1.33 1.2 1.1 1.0 1.00.80.72锂 4 3 6 7 8 1 5氯酸锂LiClO3241 283 372 488 604 777氯化锂LiCl69.274.583.586.289.898.4112 121 128铬酸锂Li2CrO4.2H2O142重铬酸锂Li2Cr2O7.2H2O151磷酸二氢锂LiH2PO4126氟化锂LiF0.16氟硅酸锂Li2SiF6.2H2O73甲酸锂LiHCO232.335.739.344.149.564.792.7116 138亚磷酸氢锂Li2HPO34.439.977.617.116.03氢氧化锂LiOH12.712.712.812.913.13.313.815.317.5碘化锂LiI151 157 165 171 179 202 435 440 481钼酸锂Li2MoO482.679.579.578 73.9硝酸锂LiNO353.460.870.1 138 152 175亚硝酸锂LiNO270.982.596.8 114 133 177 233 272 324草酸锂Li2C2O48高氯酸锂LiClO442.749 56.163.672.392.3128 151高锰酸锂LiMnO471.4磷酸锂Li3PO43.821×10-2硒化锂Li2Se57.7亚硒酸锂Li2SeO32523.321.519.617.914.711.911.19.9硫酸锂Li2SO436.135.534.834.233.732.631.430.9酒石酸锂Li2C4H4O64231.827.126.627.229.5硫氰酸锂LiSCN114 131 153钒酸锂LiVO32.5 4.826.284.382.67二氧化硫SO29.4氢氧化镥(III )Lu(OH)31.164×10-5硫酸镥(III )Lu2(SO4)3·8H2O57.9氯化铝AlCl343.944.945.846.647.348.148.649氟化铝AlF30.560.560.670.780.911.11.321.72硝酸铝Al(NO3)36066.773.981.888.7106 132 153 160高氯酸铝Al(ClO4)3122 128 133物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C乙酸镁Mg(C2H3O2)256.759.753.468.675.7118苯甲酸镁Mg(C7H5O2)2·H2O 5溴酸镁Mg(BrO3)2·6H2O58溴化镁MgBr298 99 101 104 106 112 125碳酸镁MgCO33.9×10-2氯酸镁Mg(ClO3)2114 123 135 155 178 242 268氯化镁MgCl252.953.654.655.857.56166.169.573.3铬酸镁MgCrO4·7H2O137氟化镁MgF27.325×10-3氟硅酸镁MgSiF626.330.834.944.4甲酸镁Mg(HCO2)21414.214.414.915.917.920.522.222.9氢氧化镁Mg(OH)29.628×10-4碘酸镁Mg(IO3)27.2 8.6 1011.715.215.515.6碘化镁MgI2120 140 173 186钼酸镁MgMoO413.7硝酸镁Mg(NO3)262.166 69.573.678.978.991.6106草酸镁MgC2O40.104高氯酸镁Mg(ClO4)249.6磷酸镁Mg3(PO4)22.588×10-4硒酸镁MgSeO42030.438.344.348.655.8亚硒酸镁MgSeO35.454×10-2硫酸镁MgSO42228.233.738.944.554.655.852.950.4硫代硫酸镁MgS2O350溴化锰MnBr2127 136 147 157 169 197 225 226 228碳酸锰MnCO34.877×10-5氯化锰MnCl263.468.173.980.888.5109 113 114 115亚铁氰化锰Mn2Fe(CN)61.882×10-3氟化锰MnF210.60.670.440.48氟硅酸锰MnSiF6·6H2O140氢氧化锰Mn(OH)23.221×10-4硝酸锰Mn(NO3)2102 118 139 206草酸锰MnC2O4·2H22×10-22.4×10-22.8×10-23.3×10-2硫酸锰MnSO452.959.762.962.96053.645.640.935.3物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C乙酸钠CH3COONa36.240.846.454.665.6139 153 161 170叠氮化钠NaN338.939.940.8苯甲酸钠NaC7H5O253.0溴酸钠NaBrO324.230.336.442.648.862.675.790.8溴化钠NaBr80.285.290.898.4107 118 120 121 121碳酸钠Na2CO3712.521.539.749 4643.943.9氯酸钠NaClO379.687.695.9 105 115 137 167 184 204氯化钠NaCl35.735.835.936.136.437.13838.539.2铬酸Na2CrO431.50.84 88 96 115 125 126钠7 1氰化钠NaCN40.848.158.771.2水解重铬酸钠Na2Cr2O7163 172 183 198 215 269 376 405 415磷酸二氢钠NaH2PO456.569.886.9 107 133 172 211 234氟化钠NaF3.664.064.224.44.684.895.08甲酸钠HCOONa43.962.581.2 102 108 122 138 147 160碳酸氢钠NaHCO37 8.1 9.611.112.716氢氧化钠NaOH98 109 119 129 174碘酸钠NaIO32.484.598.0810.713.319.826.629.533碘化钠NaI159 167 178 191 205 257 295 302钼酸钠Na2MoO444.164.765.366.968.671.8硝酸钠NaNO37380.887.694.9102 122 148 180亚硝酸钠NaNO271.275.180.887.694.9111 113 160草酸钠Na2C2O42.693.053.413.814.184.935.716.5高氯酸钠NaClO4167 183 201 222 245 288 306 329高碘酸钠NaIO41.835.6 10.319.930.4磷酸钠Na3PO44.5 8.2 12.116.320.220.96068.177焦磷酸钠Na4P2O72.26硒酸钠Na2SeO413.325.226.9 7781.878.674.873 72.7硫酸钠Na2SO44.9 9.1 19.540.848.845.343.742.742.5硫代硫酸钠Na2S2O371.57377.690.897.2溴酸镍Ni(BrO3)2·6H2O28溴化镍NiBr2113 122 131 138 144 153 154 155碳酸镍NiCO39.643×10-4氯酸镍Ni(ClO3)2111 120 133 155 181 221 308氯化镍NiCl253.456.366.870.673.281.286.687.6氟化镍NiF22.552.562.562.59碘酸镍Ni(IO3)20.746.2×10-21.43碘化镍NiI2124 135 148 161 174 184 187 188硝酸镍Ni(NO3)279.294.2 105 119 158 187 188高氯酸镍Ni(ClO4)2105 107 110 113 117焦磷酸镍Ni2P2O71.017×10-3硫酸镍NiSO4·6H2O44.446.649.255.664.570.176.7乙酸钕(III )Nd(C2H3O2)3·H2O26.2溴酸钕(III )Nd(BrO3)343.959.275.695.2116氯化钕(III )NdCl396.79899.6102 105钼酸钕(III )Nd2(MoO4)31.9×10-3硝酸钕(III )Nd(NO3)3127 142 145 159 211硒酸钕(III )Nd2(SeO4)345.244.641.839.939.943.97 3.3硫酸钕(III Nd2(SO4)313 9.7 7.1 5.3 4.1 2.8 2.2 1.2物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C硼酸H3BO35.7三氧化二硼B2O32.2碳酸铍BeCO30.218氯化铍BeCl242 42钼酸铍BeMoO43.02硝酸铍Be(NO3)297 102 108 113 125 178草酸铍BeC2O4·3H2O63.5高氯酸铍Be(ClO4)2147硒酸BeSeO4·4H2O49硫酸铍BeSO43737.639.141.445.853.167.282.8硫化钋(II)PoS2.378×10-14乙酸镨(III )Pr(C2H3O2)3·H2O32溴酸镨(III )Pr(BrO3)355.973 91.8 114 144氯化镨(III )PrCl3104钼酸镨(III )Pr2(MoO4)31.5×10-3硝酸镨(III )Pr(NO3)3112 162 178硫酸镨(III Pr2(SO4)319.815.612.69.892.565.043.5 1.1 0.91物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C砷化氢AsH38×10-2氯化氢HCl81 75 7065.56157.553 50 47 43 40硫化氢H2S0.33乙酸铅Pb(C2H3O2)219.829.544.369.8116叠氮化铅Pb(N3)22.49×10-2溴酸铅Pb(BrO3)27.92溴化PbBr20.450.630.861.121.52.293.323.864.55碳酸铅PbCO37.269×10-5氯酸铅Pb(ClO3)23.7×10-2氯化铅PbCl20.670.821 1.2 1.42 1.94 2.542.883.2铬酸铅PbCrO41.71×10-5亚铁氰化铅PbFe(CN)65.991×10-4氟化铅PbF24.634×10-2氟硅酸铅PbSiF6190 222 403 428 463磷酸氢PbHPO43.457×10-4亚磷酸氢铅PbHPO32.187×10-2氢氧化铅Pb(OH)21.615×10-4碘酸铅Pb(IO3)22.4×10-3碘化铅PbI24.4×10-25.6×10-26.9×10-29×10-20.1240.1930.2940.42钼酸铅PbMoO41.161×10-5硝酸铅Pb(NO3)237.546.254.363.472.1 91.6 111 133草酸铅PbC2O46.495×10-4高氯酸Pb(ClO4)2·3H2O440硒酸铅PbSeO41.31×10-2硫酸铅PbSO43.836×10-3硫化铅PbS6.767×10-13酒石酸铅PbC4H4O62.5×10-3硫氰酸铅Pb(SCN)20.553硫代硫酸铅PbS2O32.02×10-2钨酸铅PbWO42.838×10-2氢氧化Pb(OH)47.229×物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C乙酸铷RbC2H3O286溴酸铷RbBrO33.6 5.1溴化铷RbBr90 99 108 119 132 158 氯酸铷RbClO32.13.1 5.4 8 11.6 22 38 49 63氯化铷RbCl77 84 91 98 104 115 127 133 143 铬酸铷Rb2CrO462 67.5 73.6 78.9 85.6 95.7重铬Rb2Cr2O75.9 10 15.2 32.3铷氟化铷RbF300 氟硅酸铷Rb2SiF60.157甲酸铷RbHCO2443 554 614 694 900碳酸氢铷RbHCO3110氢氧化铷RbOH180 碘酸铷RbIO31.96碘化铷RbI144硝酸RbNO319.5 33 52.9 81.2 117 200 310 374 452物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C乙酸铯CsC2H3O21010叠氮化铯CsN3307溴酸铯CsBrO30.213.664.535.3。
(完整版)高中化学有机化合物知识点总结

高中化学有机物知识点总结一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
(3)具有特殊溶解性的:① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。
② 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味.③有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑤氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂)3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:① 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态② 衍生物类:一氯甲烷......沸点为...-.21℃...)...(HCHO,.....).甲醛....(CH...3.Cl..,.沸点为...-.24.2℃(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3甲醇CH3OH甲酸HCOOH 乙醛CH3CHO★特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
如,石蜡C12以上的烃饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态4.有机物的颜色☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;☆淀粉溶液(胶)遇碘(I2)变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色. 5.有机物的气味许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味:☆甲烷无味☆乙烯稍有甜味(植物生长的调节剂)☆液态烯烃汽油的气味☆乙炔无味☆苯及其同系物芳香气味,有一定的毒性,尽量少吸入。
高中化学有机化合物知识点总结

高中化学有机物知识点总结一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。
②乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
③有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑤氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂)3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(....,沸点为...HCHO...).....-.21℃...-.24.2℃.....CH..3.Cl..,.沸点为.....).甲醛((2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3甲醇CH3OH甲酸HCOOH 乙醛CH3CHO★特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
如,石蜡C12以上的烃饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态4.有机物的颜色☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;☆淀粉溶液(胶)遇碘(I2)变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
高中化学溶解性表

高中化学溶解性表化学溶解性表是一种重要的参考资料,用于描述化合物在不同溶剂中的溶解性。
它通常包括物质名称、分子式、分子量、密度、熔点、沸点、溶解度等信息,这些信息对于化学实验、工业生产和学术研究等领域都有着重要的应用。
在化学溶解性表中,化合物的溶解度是最为重要的信息之一。
溶解度是指单位体积的溶媒中最多可以溶解的物质量,它通常用质量分数或摩尔分数来表示。
常见的溶解度单位包括克/升、毫摩尔/升、摩尔/升等。
化学溶解性表中的溶解度数据通常是在特定条件下测定得到的,比如温度、压力、PH等,因此在使用溶解度数据时要注意所使用的条件是否与表中给出的一致。
此外,化学溶解性表中的溶解度数据可能会受到杂质、离子强度等因素的影响,因此在具体应用时需要结合实际情况进行调整。
在高中化学教学中,化学溶解性表常常用于讲解化学反应的平衡和化学结构的影响,具有重要的理论和实践意义。
下面是一些常见的化学溶解性表的应用案例:1. 判断产物生成的可行性:在反应中,如果反应物的溶解度大于产物的溶解度,则反应会进行到最大极限,产物生成的可能性较小;反之,如果产物的溶解度大于反应物,则产物生成的可能性较大。
2. 调节反应条件:溶解度信息还可以用于调节反应条件,如调节溶液浓度、溶剂种类、温度等,从而调节反应速率、选择性等。
例如,当反应速率过低时,可以增加反应物浓度,提高反应速率;当需要选择性反应时,可以通过调节溶剂种类或温度等控制产物选择性。
3. 确定溶解度限度:化学溶解性表还可以用于确定某些物质的溶解度限度。
通过查看化学溶解性表中的数据,我们可以确定某些物质在溶剂中最大可以溶解的量,从而避免过量添加产生的废物或残留物。
总之,化学溶解性表是化学研究、实验和应用中十分重要的参考资料,它可以帮助我们更好地了解化合物的溶解度、反应特性和应用范围,从而为化学发展做出贡献。
科学溶解性表

编辑本段物质的溶解性介绍溶解性表离子种类OHˉNO3ˉClˉSO42ˉS2ˉSO32ˉCO32ˉSiO32ˉPO43ˉH+—溶、挥溶、挥溶溶、挥溶、挥溶、挥微溶NH4+溶、挥溶溶溶溶溶溶—溶K+溶溶溶溶溶溶溶溶溶Na+溶溶溶溶溶溶溶溶溶Ba2+溶溶溶难—微难难难Ca2+微溶溶微—难难难难Mg2+难溶溶溶—微微难难Al3+难溶溶溶———难难Mn2+难溶溶溶难难难难难Zn2+难溶溶溶难难难难难Cr3+难溶溶溶———难难Fe2+难溶溶溶难难难难难Fe3+难溶溶溶———难难Sn2+难溶溶溶难———难Pb2+难溶微难难难难难难Cu2+难溶溶溶难难难难难Hg2+—溶溶溶难难——难Ag+—溶难微难难难难难图例溶:该物质可溶于水难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解常见沉淀白色:BaSO4BaCO3CaCO3AgClAg2CO3Mg(OH)2Fe(OH)2Al(OH)3 CuCO3 ZnCO3 MnCO3 Zn(OH)2 蓝色:Cu(OH)2浅黄色:AgBr红褐色:Fe(OH)3浅绿色:Fe(OH)2编辑本段常见化合物沉淀Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀CuO 黑色沉淀Cu2O 红色沉淀Fe2O3 红棕色沉淀FeO 黑色沉淀FeS2 黄色沉淀PbS 黑色沉淀FeCO3 灰色沉淀Ag2CO3 黄色沉淀AgBr 浅黄色沉淀AgCl 白色沉淀Cu2(OH)2CO3 暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀(且有CO2生成)BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)编辑本段溶解性口诀不建议死记硬背,只需记住每个阴离子里哪个不溶即可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙。
高中化学盐溶解性表及元素周期表
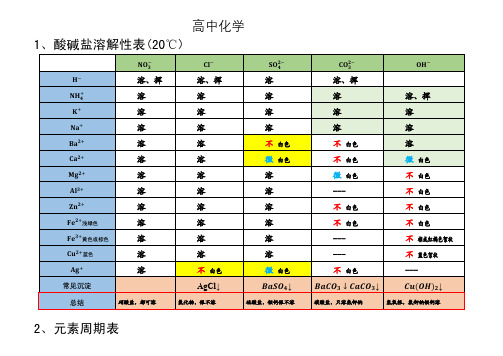
高中化学盐溶解性表及元素周期表
1、酸碱盐溶解性表(20℃)
−
−
−
−
−
−
溶、挥
溶、挥
溶
溶、挥
+
溶
溶
溶
溶
溶、挥
+
溶
溶
溶
溶
溶
+
溶
溶
溶
溶
溶
+
溶
溶
不
白色
不
白色
溶
&色
不
白色
微
白色
+
溶
溶
溶
微
白色
不
白色
+
溶
溶
溶
---
不
白色
+
溶
溶
溶
不
白色
不
白色
+ 浅绿色
溶
溶
溶
不
白色
不
白色
+ 黄色或棕色
溶
溶
溶
---
不
棕或红褐色絮状
+ 蓝色
溶
溶
溶
---
不
蓝色絮状
溶
不
不
---
+
AgCl↓
常见沉淀
总结
白色
硝酸盐,都可溶
2、元素周期表
氯化物,银不溶
微
白色
↓
高中化学记不住溶解性表记忆口诀

溶解性表是大家学习化学必备的解题技巧,这张表的知识点所占的分值是比较大的,比如大家不太擅长的化学推导题就会依照这张表的性质去推断,所以大家一定要掌握这部分知识,那么今天就为大家带来了十一个口诀,无论如何都要记住这部分知识哦!溶解性口诀一钾钠铵盐溶水快,硫酸沉钡银铅钙。
氯盐不溶氯化银,硝盐溶液都透明。
碱溶锂钾钠钡氨,口诀未提皆下沉。
注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水。
溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
说明:以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三钾钠铵硝皆可溶,氯盐不溶银亚汞;硫酸盐不溶钡和铅,碳磷酸盐多不溶。
多数酸溶碱少溶,只有钾钠铵钡溶溶解性口诀四钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不溶有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
溶解性口诀五(适合初中化学课本后面的附录)钾钠铵盐硝酸盐①氢氧根多钡离子②硫酸盐除钡钙银③碳酸溶氢钾钠铵④生成沉淀氯化银⑤溶解性口诀六(初学记忆)钾、钠、铵、硝都可溶,氯化物里银不溶;硫酸盐里钡不溶,磷酸碳酸多不溶。
解释:①钾盐、钠盐、铵盐、硝酸盐都溶于水②除了以上四种,氢氧根和钡离子结合时也溶于水③硫酸根除了和钡离子、钙离子、银离子结合时不溶于水,其他都溶④碳酸根除了和氢离子、钾离子、钠离子和铵离子结合时溶于水,其他都不溶⑤氯离子只有和银离子结合时不溶于水⑥磷酸盐除钾钠铵都不溶溶解性口诀七铵钾钠钡氢氧溶①碳酸只溶铵钾钠②所有硝酸都能溶③盐酸只有银不溶④硫酸只有钡不溶⑤解释①氢氧化铵,氢氧化钾,氢氧化钠,氢氧化钡都溶于水,其余带氢氧根的都不溶于水。
使用溶解性表书写离子方程式问题例析

非常道Җ㊀甘肃㊀石兴龙㊀㊀在高中化学离子反应 教学和高考复习中,常要借助教材中 部分酸㊁碱和盐的溶解性表(室温) (以下简称 表 )中物质溶解性书写离子方程式,从学生平时练习和考前检测中常出现的错误可以看出,学生在使用 表 时常感到困惑,出现了不少问题.现以近几年部分高考选择题解答为例,进行问题讨论,点评小结,让学生明晰产生错误的原因,以减少问题的发生.1㊀应用物质溶解性书写离子方程式1 1㊀注意微溶物处理例1㊀下列离子方程式书写是否正确(㊀㊀).(2017年浙江卷)澄清石灰水中通入过量C O 2:C O 2+OH -=H C O -3.分析㊀澄清石灰水中微溶物C a (O H )2电离成C a2+和OH -,书写离子方程式时要改写成离子.通入少量C O 2离子方程式为C a 2++2O H -+C O 2=C a C O 3ˌ+H 2O ;通入过量C O 2时,C O 2与H 2O ㊁C O 2-3反应生成H C O -3,使c (C O 2-3)减小,C a C O 3沉淀溶解平衡移动,生成能溶于水的C a (H C O 3)2,离子方程式为C O 2+OH -=H C O -3,该离子方程式正确.B a (O H )2溶液通入少量㊁足量C O 2㊁S O 2的离子方程式写法与本题相似.教材中的 表 显示M g C O 3㊁C a S O 4㊁A g 2S O 4是微溶物,如纯碱溶液中滴入氯化镁溶液,离子方程式为M g 2++C O 2-3=M g C O 3ˌ;硫酸钠溶液加入澄清石灰水,离子方程式为C a 2++S O 2-4=C a S O 4ˌ;硝酸银溶液中加入硫酸钾溶液,离子方程式为2A g ++S O 2-4=A g 2S O 4ˌ.表 中没有列出的物质(如M g S O 3㊁P b C l 2㊁H g 2S O 4)也是微溶物,一些没有列出或说明溶解性的(如C a (H C O 3)2㊁C a (H S O 3)2㊁B a (H C O 3)2㊁B a (H S O 3)2㊁磷酸氢盐(除B a H P O 4㊁C a H P O 4)㊁磷酸二氢盐等能溶于水),这些物质的溶解性在书写离子方程式时要注意学习应用.写离子方程式时,反应物中微溶物的澄清溶液要改写成离子,悬浊液写化学式,生成物中的微溶物写化学式;如果弱酸酸式盐溶于水,要改写成离子,但弱酸酸式酸根不能拆写;强酸酸式盐(如N a H S O 4)在水中完全溶解电离,要拆写成离子(N a +㊁H +㊁S O 2-4).1 2㊀注意难溶物沉淀转化例2㊀下列离子方程式书写是否正确(㊀㊀).(2018年江苏卷)饱和N a 2C O 3溶液与C a S O 4固体反应:C O 2-3+C a S O 4=C a C O 3+S O 2-4.分析㊀C a C O 3是难溶物,C a S O 4是微溶物,结合C a 2+能力:C O 2-3>S O 2-4,使c (C a 2+)和c (C O 2-3)减小,促使微溶物C a S O 4沉淀溶解平衡移动,生成难溶的C a C O 3,离子方程式为:C O 2-3+C a S O 4=C a C O 3+S O 2-4,反应前后均出现微溶物或难溶物,不标ˌ,该离子方程式正确.相似的离子反应有,向F e C l 3溶液中加入M g (O H )2:3M g (O H )2+2F e 3+=2F e (O H )3+3M g 2+.反应中M g (O H )2和F e (O H )3都是难溶物,但K s p [F e (O H )3]更小,F e (O H )3溶解性更小,所以生成更难溶的F e (O H )3.C a 2+㊁M g 2+的碳酸氢盐与碱溶液(如澄清石灰水㊁B a (O H )2等)也会发生沉淀转化,产物与碱的用量有关.如M g (H C O 3)2溶液加入少量石灰水:M g 2++2OH -=M g (O H )2ˌ;M g (H C O 3)2溶液加入足量石灰水虽有M g C O 3微溶物生成,但在O H -足量时转化为M g (O H )2;比较K s p 大小,M g (O H )2㊁C a C O 3比M g C O 3更难溶㊁更稳定,所以离子方程式为M g 2++2H C O -3+2C a 2++4O H -=M g (O H )2ˌ+2C a C O 3ˌ+2H 2O.C a (H C O 3)2溶液中加入少量B a (O H )2溶液:C a 2++2H C O -3+B a 2++2O H -=C a C O 3ˌ+B a C O 3ˌ+2H 2O ;C a (H C O 3)2溶液加入足量B a (O H )2溶液:B a 2++H C O -3+OH -=B a C O 3ˌ+H 2O.B a 2+过量时,主要生成B a C O 3沉淀.表 中没有列出或说明的除含K +㊁N a +㊁N H +4的硅酸盐㊁亚硫酸盐㊁硫化物㊁磷酸盐能溶于水外,其他金属离子的盐大多难溶于水,这些物质的溶解性,在学习中要逐步掌握应用.应用 表 时要把 表 中标 不 的物质理解为难 ,因难溶物在水中存在沉淀溶解平衡,溶解量虽少,但总能溶解一部分,要把物质溶解性大小与碱性强弱㊁电解质强弱区分开来.如在 表 中标 不 的76非常道M g (O H )2,难溶于水,事实上M g (OH )2是中强碱,也是强电解质; 表 中标 不 的B a C O 3㊁B a S O 4等难溶物,虽难溶于水,但都是强电解质.若反应中出现几种难溶物,要考虑沉淀溶解平衡移动和沉淀转化,依据物质在常温下水中溶度积常数K s p 来比较溶解性大小,K s p 越小,溶解性越小.2㊀水解反应的离子方程式书写2 1㊀注意水解规律的应用例3㊀下列反应的离子方程式是否正确(㊀㊀).(2019年天津卷)向沸水中滴加饱和氯化铁溶液得到红褐色液体:F e 3++3H 2O=F e (O H )3+3H +.分析㊀F e (O H )3是难溶物,含F e 3+的可溶性强酸盐溶液水解显弱酸性,p H<7,存在水解平衡,受热水解反应加剧,形成胶体,两边用 ә连接,离子方程式为F e 3++3H 2O әF e (O H )3(胶体)+3H +,该离子方程式错误.明矾净水原理为A l 3++3H 2O⇌A l (O H )3(胶体)+3H +.含C O 2-3㊁S O 2-3㊁P O 3-4㊁H P O 2-4可溶性强碱盐溶液水解显弱碱性,主要以第一步为主,两边用 ⇌连接;如N a 2C O 3溶液中C O 2-3水解,分步写为C O2-3+H 2O⇌H C O -3+O H -,H C O -3+H 2O ⇌H 2C O 3+O H -,由此可判断出N a 2C O 3溶液中离子种类和浓度大小.含H C O -3㊁H 2P O -4的可溶性强碱盐溶液中存在微弱水解和电离,水解程度大于电离程度,溶液显弱碱性,p H>7,离子方程式写法相似;但H S O -3可溶性强碱盐溶液显弱酸性,因溶液中H S O -3的电离程度大于水解程度.表 中没有列出N a 2S ㊁K 2S ㊁B a S ㊁C a S 在水溶液中易水解,放出有毒H2S 气体,要注意密封保存.含弱碱根㊁弱酸根或弱酸酸式根离子的可溶性盐在溶液中发生水解,水参加反应,离子方程式两边用 ⇌ 连接;书写时注意水解规律(如谁强显谁性㊁越弱越水解㊁越热越水解)应用.2 2㊀注意溶液中发生的双水解反应例4㊀下列反应的离子方程式是否正确(㊀㊀).(2017年海南卷)向硫酸铝溶液中滴加碳酸钠溶液:2A l 3++3C O 2-3=A l 2(C O 3)3ˌ.分析㊀C O 2-3是二元弱酸根,与A l 3+在溶液中发生双水解反应:2A l 3++3C O 2-3+3H 2O =2A l (O H )3ˌ+3C O 2ʏ,双水解较为彻底,用 = 连接,沉淀标ˌ,气体标ʏ,该离子方程式错误.表 中标 - 的含F e 3+㊁F e 2+㊁A l 3+㊁C O 2-3或H C O -3的盐在溶液中发生双水解;在 表 中没有列出的(N H 4)2S ,在溶液中发生双水解,放出N H 3和有毒H 2S 气体,取用时要注意密封保存. 表 中标 - 的含C u 2+与C O 2-3的盐在溶液中既生成沉淀,又发生水解;生成沉淀:C u 2++C O 2-3=C u C O 3ˌ;发生双水解:C u 2++C O 2-3+H 2O =C u (O H )2ˌ+C O 2ʏ,总反应为2C u 2++2C O 2-3+H 2O=C u 2(O H )2C O 3ˌ+C O 2ʏ. 表 中标 - 的金属阳离子(如H g +㊁H g 2+㊁A g +)与O H -反应,产物不稳定,发生分解.如A g +与O H -生成白色沉淀,能短暂存在,久置分解成棕褐色A g 2O ,离子方程式为A g ++O H -=A g OHˌ,2A g O H=A g 2O+H 2O.含弱碱根㊁弱酸根或弱酸酸式根离子组成的盐在溶液中发生双水解反应,反应较为彻底,仍用 = 连接,沉淀标ˌ,气体标ʏ,H 2O 参加反应,不能漏写.3㊀反应物浓度、性质影响反应产物的离子方程式书写例5㊀下列反应的离子方程式是否正确(㊀㊀).(2019年天津卷)氧化亚铁溶于稀HN O 3:F e O+2H +=F e 2++H 2O.分析㊀H N O 3表现酸性和氧化性,稀HN O 3被还原,放出无色N O 气体,浓H N O 3被还原,放出红棕色N O 2气体;F e O 溶于稀H N O 3㊁浓H N O 3离子方程式分别为3F e O+10H ++N O -3=3F e 3++N Oʏ+5H 2O ,F e O+4H ++N O -3=F e 3++N O 2ʏ+2H 2O ,该离子方程式错误.随浓度增大,H N O 3的氧化性增强,HN O 3的性质如强氧化性㊁不稳定性㊁挥发性都是考试的热点,要引起重视.在 表 中盐酸㊁碳酸㊁硝酸用 溶㊁挥 标示,但要根据具体性质理解应用.把浓盐酸㊁浓硝酸试剂瓶盖打开,瓶口出现 白雾 ,说明具有挥发性;盐酸挥发放出H C l 气体,盐酸要密封低温保存;实际反应中C O 2-3与少量H +反应生成H C O -3,与足量H +反应生成不稳定的H 2C O 3,挥发放出的是H 2C O 3分解后的C O 2;HN O 3见光或受热易分解,实际上硝酸挥发气体成分中有HN O 3蒸气㊁N O 或N O2气体,硝酸要密封低温避光保存.受反应物浓度㊁性质影响,反应现象㊁生成物也会发生变化;书写时注意元素化合物性质知识的应用;涉及氧化还原反应,书写时注意检查是否符合 三守恒 规律.86非常道4㊀反应物用量影响反应产物的离子方程书写例6㊀下列反应的离子方程式是否正确(㊀㊀).(2020年浙江卷)(N H 4)2F e (S O 4)2溶液与少量B a (O H )2溶液反应:S O 2-4+B a 2+=B a S O 4ˌ.分析㊀(N H 4)2F e (S O 4)2溶于水,完全电离,与少量B a (O H )2溶液反应:F e 2++S O 2-4+Ba 2++2O H -=B a S O 4ˌ+F e (O H )2ˌ;与足量B a (O H )2溶液反应时,O H -与N H +4生成N H 3 H 2O :2NH +4+F e 2++2S O 2-4+2B a 2++4O H -=2B a S O 4ˌ+F e (O H )2ˌ+2N H 3 H 2O ,该离子方程式错误.N H +4与O H -的反应产物,在 表 中用 溶㊁挥 标示.实际上N H+4与足量O H -反应,稀溶液中产物主要是N H 3 H 2O ,浓度很大或加热时挥发放出的是N H 3,标ʏ.含A l3+的可溶性盐溶液与含O H -的碱溶液反应,生成 表 中标 不 的难溶物A l (O H )3,实际反应与O H -量有关.O H -少量时,生成物为A l (O H )3,当O H -过量时,A l (O H )3发生酸式电离,生成偏铝酸盐而溶解;A l (O H )3与强酸发生碱式电离,生成铝酸盐而溶解,表现两性[Z n (O H )2性质与A l (O H )3相似,也表现两性].A l (O H )3难溶于弱酸(如H 2C O 3)㊁弱碱(如N H 3 H 2O ),可用于制取A l (O H )3,分解后的A l 2O 3,在熔融状态电解得到金属A l .一些特殊的离子反应与用量有关,虽然 表 中没有列出或标示,但在学习中要注意掌握应用.如A g +㊁C u 2+与浓氨水,A g O H ㊁C u (O H )2溶于过量浓氨水发生配位反应,生成[A g (N H 3)2]+和[C u (N H 3)4]2+,产物与氨水浓度和用量有关.书写与量有关的离子方程式,把少量反应物化学计量数设定为 1,再判定另一种足量反应物化学计量数;拆写时,注意反应物用量㊁反应现象和产物对应关系;与量有关的氧化还原反应,注意强先弱后规律应用.5㊀相同类型反应的离子方程式书写例7㊀下列反应的离子方程式是否正确(㊀㊀).(2017年江苏卷)向氢氧化钡溶液加入稀硫酸:B a 2++O H -+H ++S O 2-4=B a S O 4ˌ+H 2O.分析㊀反应中O H -㊁H +和H 2O 计量数都是2,但B a 2+㊁S O 2-4㊁B a S O 4计量数是1,不能将2约去,离子方程式应写为B a 2++2O H -+2H ++S O 2-4=B a S O 4ˌ+2H 2O ,该离子方程式错误.若N a H S O 4溶液中滴入B a (O H )2溶液反应至中和B a 2++2O H -+2H ++S O 2-4=B a S O 4ˌ+2H 2O ;N a H S O 4溶液中滴入B a (O H )2溶液至S O 2-4完全沉淀,O H -过量,应写为B a 2++OH -+H ++S O 2-4=B a S O 4ˌ+H 2O.含B a 2+和S O 2-4可溶性盐反应生成 表 中标 不 的难溶物B a S O 4,可用B a C l 2㊁B a (N O 3)2溶液与N a 2S O 4或K 2S O 4溶液反应,也可用B a (O H )2溶液与稀H 2S O 4㊁B a (O H )2溶液与N a H S O 4或K H S O 4溶液反应生成.同样,N a H C O 3溶液中加入足量B a (O H )2溶液反应㊁B a (H C O 3)2溶液中加入少量N a O H 溶液反应的离子方程式相同,都写为H C O -3+B a 2++O H -=B a C O 3ˌ+H 2O.N a H C O 3溶液中加入足量的澄清石灰水㊁C a (H C O 3)2溶液中加入少量Na O H 溶液反应的离子方程式相同,都为H C O -3+C a 2++O H -=C a C O 3ˌ+H 2O.含B a 2+和C O 2-3可溶性盐反应生成 表 中标 不 的难溶物B a C O 3,可采用N a 2C O 3㊁K 2C O 3溶液与B a C l 2或B a (N O 3)2溶液反应生成,也可采用N a H C O 3溶液与B a (O H )2溶液反应生成.生成难溶物C a C O 3的方法与此相似.不同反应物交换离子成分,虽反应物用量不同,但产物㊁离子方程式相同,书写时灵活应用表 ,注意反应物用量与产物对应关系.对离子反应方程式相同的离子反应,可写出反应物不同的化学方程式.生产中可应用物质性质设计出制取某种物质的可行途径.学生进入高中化学学习阶段,教材内容拓展加深,要掌握的知识点多,而现行高中化学实验教材中表 的内容少,有些物质的溶解性在 表 中没有标示或说明,需要在平时进一步学习掌握.学生在使用 表 书写离子方程式时既要参考,又不能依赖,更不能照搬,要结合所掌握知识,灵活应用;不仅要比较反应物质溶解性差异,还要具体分析判断参加反应物质的不同浓度㊁用量㊁性质㊁反应现象等;要仔细拆写,掌握规律方法,平时多练习体会,提高准确率,以避免或减少问题的发生.(作者单位:甘肃省高台县第一中学)96。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
—:该物质不存在或遇水发生水解
红褐色:Fe(OH)3
沉淀鉴别
沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;
Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);
BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);
不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住(见上表)。
