缓冲液的配制方法
常见缓冲液配制方法

常见缓冲液配制方法
一、介绍
缓冲液是常见的生物或化学反应的催化剂,主要用于维持反应物的酸
碱度在一定的范围内,有利于提高反应效率。
缓冲液有许多种,其配制方
法也多种多样。
下面将介绍常见缓冲液的配制方法,包括常用缓冲液的配
制方法,复合缓冲液的配制方法,以及常见的国际标准缓冲液的配制方法。
二、常用缓冲液的配制方法
1、磷酸缓冲液的配制
磷酸缓冲液是常用的酸性缓冲液,可以根据需要使用不同浓度的磷酸
来配制。
比如,将0.2mol/L的磷酸钠和0.2mol/L的磷酸氢钠混合,可以
得到一种磷酸缓冲液,其碱度为pH7.0。
同样,如果需要制备一种低碱度
的磷酸缓冲液,可以将3mol/L的磷酸钠和3mol/L的磷酸氢钠混合,以得
到其pH值为2.12的缓冲液。
2、碳酸缓冲液配制
碳酸缓冲液是常用的酸性缓冲液,可以根据需要使用不同浓度的碳酸
氢钠来配制。
比如,将0.2mol/L碳酸氢钠和0.2mol/L碳酸钠混合,可以
得到一种碳酸缓冲液,其碱度为pH7.0。
同样,如果需要制备一种低碱度
的碳酸缓冲液,可以将3mol/L碳酸氢钠和3mol/L碳酸钠混合,以得到其pH值为2.12的缓冲液。
3、氨水缓冲液配制
氨水缓冲液是常用的碱性缓冲液。
常用缓冲液的配制方法

1N
40.00
碳酸钠Na2CO3
106.00
1N
53.00
磷酸氢二钠Na2HPO4.12H2O
358.20
1N
358.20
磷酸二氢钾KH2PO4
136.10
1/15M
9.08
重铬酸钾K2Cr2O7
294.20
0.1N
4.9035
碘化钾KI
166.00
0.5N
83.00
高锰酸钾KMO4
158.00
GR.
ACS.
PA.
XЦ.
CP.
PUSS.
Puriss.
ЦДA.
LR.
EP.
Ц.
p.
pure
用途
纯度最高,杂质含量最少的试剂。适用于最精确分析及研究工作
纯度较高,杂质含量较低。适用于精确的微量分析工作,为分析实验室广泛使用
质量略低于二级试剂,适用于一般的微量分析实验,包括要求不高的工业分析和快速分析
4.2
2.65
7.35
5.4
8.60
1.40
4.4
3.70
6.30
5.6
9.10
0.90
4.6
4.90
5.10
5.8
9.40
0.60
(三)巴比妥钠-盐酸缓冲液(18℃)
PH
0.04M巴比妥钠溶液ml
0.2N盐酸
(毫升)
PH
0.04M巴比妥钠溶液ml
0.2N盐酸
(毫升)
6.8
100
18.4
8.4
100
0.1N
3.16
醋酸钠NaC2H3O2
82.04
实验常用试剂缓冲液的配制方法

实验常用试剂缓冲液的配制方法
一、常用试剂和试剂配置
1、氯仿。
将1L 99.7%纯度的氯仿加入水中,调节pH值至7.4,溶解
即可得到0.5mol/L的氯仿溶液。
2、二氧化碳水。
将100mL弱碳酸氢氧化钠溶液(NaHCO3,0.5mol/L)加入1L水中,经过气泡交换,可制得CO2水。
3、磷酸盐缓冲液。
将200mL磷酸盐溶液(K2HPO4,0.5mol/L)加入800mL水中,调节pH值至7.2,搅拌均匀,即可得到0.2mol/L磷酸盐缓
冲液。
4、EDTA标准溶液。
将25.0g EDTA·4Na(C10H14N2O8Na2)加入
1000mL水中,热溶解,调节pH值至7.0,搅拌均匀,得到0.2mol/LEDTA
标准溶液。
5、肌酐标准溶液。
将10.0g肌酐(C10H13N3O8)=14.2H2O)加入
1000mL的水中,搅拌,调节pH值至7.4,搅拌均匀,即可得到0.1mol/L
的肌酐标准溶液。
二、缓冲液的配置
1、弱酸缓冲液。
将3.0mL 0.2mol/L磷酸钠溶液(Na2HPO4)加入到
97mL 0.2mol/L磷酸钙溶液(Ca(H2PO4)2)中,搅拌均匀,即可得到
0.2mol/L的弱酸缓冲液。
2、弱碱缓冲液。
将3.0mL 0.2mol/L磷酸氢氧化钠溶液(NaH2PO4)
加入到97mL 0.2mol/L碳酸氢钙溶液(Ca(HCO3)2)中,搅拌均匀,即可
得到0.2mol/L的弱碱缓冲液。
3、弱盐缓冲液。
各种缓冲液的配制方法

各种缓冲液的配制方法缓冲液(Buffer)在生物化学和分子生物学实验中起到了至关重要的作用,它可以维持溶液的稳定性,调节pH值,同时还提供所需的离子环境。
这是一个关于不同类型缓冲液的配制方法的综合指南。
1. Tris缓冲液Tris缓冲液是实验室中最常用的缓冲液之一、以下是Tris缓冲液的配制方法:- 配制0.1 M Tris缓冲液(pH 7.4):a. 在100 mL去离子水中加入12.11 g Tris(Tris(hydroxymethyl)aminomethane)粉末。
b.用盖住容器的滤纸纸带覆盖容器,并将其放在磁力搅拌器上。
c.用盖住容器的锡纸覆盖容器,加热至溶解。
搅拌以加速溶解过程。
d.继续搅拌,使其冷却至室温。
e.使用0.1MHCl或0.1MNaOH调节pH值至7.4,直到所需的pH值稳定。
f.用去离子水稀释至总体积100mL。
2.PBS缓冲液PBS缓冲液是生物学实验中常用的缓冲液之一、以下是PBS缓冲液的配制方法:-配制10×PBS缓冲液:a.在1L去离子水中加入80gNaCl,2gKCl,14.4gNa2HPO4,2.4gKH2PO4b.使用10MNaOH或10MHCl调节pH值至7.4c.用去离子水稀释至总体积1L。
-配制1×PBS缓冲液:a.取10×PBS缓冲液100mL,用去离子水稀释至总体积1L。
3.TAE缓冲液TAE缓冲液常用于琼脂糖凝胶电泳。
以下是TAE缓冲液的配制方法:-配制50×TAE缓冲液:a. 在1 L去离子水中加入242 g Tris base,57.1 mL 0.5 M EDTA,100 mL冰醋酸。
b.用10MNaOH或10MHCl调节pH值至8.3c.用去离子水稀释至总体积1L。
-配制1×TAE缓冲液:a.取50×TAE缓冲液20mL,用去离子水稀释至总体积1L。
4. Tris-HCl缓冲液Tris-HCl缓冲液常用于DNA或RNA的酶切反应。
常见缓冲溶液配制方法

常见缓冲溶液配制方法1.醋酸钠/醋酸酸性缓冲液醋酸钠/醋酸酸性缓冲液适用于pH范围为4.0-6.0的实验。
配制方法如下:- 准备质量浓度为0.1mol/L的醋酸钠溶液和0.1mol/L的醋酸溶液。
-根据所需pH值,按照相应的比例混合醋酸钠溶液和醋酸溶液即可。
2.磷酸/盐酸性缓冲液磷酸/盐酸性缓冲液适用于pH范围为1.0-3.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L和0.1mol/L的磷酸溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和磷酸溶液即可。
3.磷酸/氢磷酸二盐酸性缓冲液磷酸/氢磷酸二盐酸性缓冲液适用于pH范围为2.0-7.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L、0.1mol/L和0.05mol/L的氢磷酸二盐溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和氢磷酸二盐溶液即可。
4.磷酸盐缓冲液磷酸盐缓冲液适用于pH范围为5.0-8.0的实验。
配制方法如下:- 准备分别为0.2mol/L的梯度磷酸盐溶液。
-根据所需pH值,按照相应的比例混合相应浓度的磷酸盐溶液即可。
5.三氯乙酸/三氯乙酸钠酸性缓冲液三氯乙酸/三氯乙酸钠酸性缓冲液适用于pH范围为3.0-4.6的实验。
配制方法如下:- 准备质量浓度为0.2mol/L的三氯乙酸钠溶液和0.2mol/L的三氯乙酸溶液。
-根据所需pH值,按照相应的比例混合三氯乙酸钠溶液和三氯乙酸溶液即可。
以上是一些常见的缓冲溶液配制方法,具体的配制过程可能会因实验需求和具体试剂而略有不同。
在配制缓冲溶液时,一定要注意使用高纯度的试剂,并按照配制方法进行准确的实验操作。
缓冲溶液及其配制方法

缓冲溶液及其配制方法
以下是一些常见的缓冲溶液及其配制方法:
1.甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25mL,加酚酞
指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75mL,用水稀释至200mL,调节pH值至
3.25~3.30即可。
2.邻苯二甲酸盐缓冲液(pH5.6):取邻苯二甲酸氢钾10g,加
水900mL,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000mL,混匀即可。
3.氨-氯化铵缓冲液(pH8.0):取氯化铵1.07g,加水使溶解成
100mL,再加稀氨溶液(1→30)调节pH值至8.0即可。
4.氨-氯化铵缓冲液(pH10.0):取氯化铵
5.4g,加水20mL溶
解后,加浓氯溶液35mL,再加水稀释至100mL即可。
5.硼砂-碳酸钠缓冲液(pH10.8~11.2):取无水碳酸钠5.30g,
加水使溶解成1000mL;另取硼砂 1.91g,加水使溶解成100mL。
各种缓冲液的配制方法_

各种缓冲液的配制方法_
一、磷酸缓冲液的配制方法
1.准备:蒸馏水或纯净水、磷酸二铵,滴定级别不低于AR级;
2.计算配制用量:根据实验要求,计算出所需磷酸二铵的总量,用m1表示(单位:克);
3.将磷酸二铵加入蒸馏水或纯净水中,用称取出适量的磷酸二铵,用m2表示(单位:克),加入搅拌槽中,充分搅拌均匀,然后加入剩余的磷酸二铵(m3=m1-m2,单位:克),继续搅拌;
4.检查温度:温度应大于室温;
5.检查pH值:用pH计测量溶液的pH值,调整到与实验要求相符的值;
6.搅拌均匀,过滤,储存,可使用或直接投放使用;
二、碳酸缓冲液的配制方法
1.准备:蒸馏水或纯净水、碳酸氢钠,滴定级别不低于AR级;
2.计算配制用量:根据实验要求,计算出所需碳酸氢钠的总量,用m1表示(单位:克);
3.将碳酸氢钠加入蒸馏水或纯净水中,用称取出适量的碳酸氢钠,用m2表示(单位:克),加入搅拌槽中,充分搅拌均匀,然后加入剩余的碳酸氢钠(m3=m1-m2,单位:克),继续搅拌;
4.检查温度:温度应大于室温;
5.检查pH值:用pH计测量溶液的pH值。
各种缓冲液的配制方法

各种缓冲液的配制方法缓冲液是一种用于调节溶液酸碱度(pH值)的溶液,它可以稳定溶液的pH值,满足实验的需要。
不同实验需要使用不同pH值的缓冲液,因此配制方法也会有所不同。
下面将介绍常见的几种缓冲液的配制方法。
1.磷酸盐缓冲液:磷酸盐缓冲液是最常用的一种缓冲液,在生物化学和分子生物学实验中广泛应用。
配制方法:-0.2M磷酸盐酸(pH2.5):用稀磷酸(H3PO4)溶液调节酸度至所需pH值。
-0.2M磷酸盐盐(pH2.5):用0.2M磷酸钠(Na2HPO4)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的磷酸盐缓冲液。
2.乙酸缓冲液:乙酸缓冲液常用于酶催化反应的研究和生物制剂的稳定。
配制方法:-0.1M乙酸酸(pH3.6):用浓烧碱(CH3COOH)溶液调节酸度至所需pH值。
-0.1M乙酸盐(pH3.6):用0.1M乙酸钠(CH3COONa)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的乙酸缓冲液。
3.碳酸氢盐缓冲液:碳酸氢盐缓冲液常用于生命科学实验中。
配制方法:-0.1M碳酸酸(pH6.0):用稀碳酸(H2CO3)溶液调节酸度至所需pH 值。
-0.1M碳酸盐(pH6.0):用0.1M碳酸氢钠(NaHCO3)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的碳酸氢盐缓冲液。
4. Tris缓冲液:Tris缓冲液是一种多用途的缓冲液,在生物化学和分子生物学研究中广泛应用。
配制方法:- 0.1 M Tris酸(pH 8.0):用三羟甲基氨基甲烷(Tris)溶液调节酸度至所需pH值。
- 0.1 M Tris盐(pH 8.0):用0.1 M Tris盐溶液调节碱度至所需pH值。
- 混合上述两种液体,按体积比例混合即可配制所需pH值的Tris缓冲液。
配制缓冲液时需要准备所需浓度的酸液和盐液,然后根据所需pH值逐渐调整酸度和碱度至目标值。
各种缓冲液配制方法

各种缓冲液配制方法不同缓冲液的缓冲范围pH缓冲液是化学实验室中常用的一种试剂,可以帮助维持溶液的酸碱度。
下面介绍三种常用缓冲液的配制方法和缓冲范围。
一、甘氨酸-盐酸缓冲液(0.05 mol/L)配制方法:取X毫升0.2 mol/L甘氨酸和Y毫升0.2 mol/L 盐酸,加入适量的水稀释至200毫升。
缓冲范围:pH值在2.2至3.6之间,X和Y的取值见上表。
二、邻苯二甲酸-盐酸缓冲液(0.05 mol/L)配制方法:取X毫升0.2 mol/L邻苯二甲酸氢钾和Y毫升0.2 mol/L盐酸,加入适量的水稀释至20毫升。
缓冲范围:pH值在2.2至3.8之间,X和Y的取值见上表。
三、磷酸氢二钠-柠檬酸缓冲液配制方法:根据上表中的数据,取相应的0.2 mol/L和0.1 mol/L的Na2HPO4和柠檬酸,加入适量的水稀释至20毫升。
缓冲范围:pH值在2.2至8.0之间,具体取值见上表。
以上缓冲液的配制方法和缓冲范围可根据实验需要进行调整和改变。
在实验过程中,正确选择缓冲液可以提高实验的成功率和准确性。
以下是已经修改好的文章:柠檬酸的浓度可以用毫升表示,其浓度数据如下:9.28 mL8.85 mL8.40 mL7.91 mL7.37 mL6.78 mL6.15 mL5.45 mL4.55 mL3.53 mL2.61 mL1.83 mL1.27 mL0.85 mL0.55 mL对于Na2HPO4,其分子量为141.98,0.2 mol/L的溶液需要28.40 g/L。
而Na2HPO4·2H2O的分子量为178.05,0.2 mol/L的溶液需要35.61 g/L。
最后,Na2HPO4·12H2O的分子量为358.22,0.2 mol/L的溶液需要71.64 g/L。
对于C6H8O7·H2O,其分子量为210.14,0.1 mol/L的溶液需要21.01 g/L。
以下是柠檬酸-氢氧化钠-盐酸缓冲液的相关数据:pH: 2.2.3.1.3.3.4.3.5.3.5.8.6.5钠离子浓度(mol/L): 0.20.0.20.0.20.0.20.0.35.0.45.0.38柠檬酸(g) 氢氧化钠(g) 盐酸(mL)C6H8O7·H2O NaOH 97% HCl (浓)210 210 210210 245 285266 84 8383 144 186156 160 116106 45 68105 126最终体积(L):10使用时可以每升中加入1克酚。
实验室几种缓冲溶液的配制方法

几种溶液的配制方法1、PBS:取ZLI-9061 PBS溶于1000ml的蒸馏水中,混匀,测pH 值应在7.2~7.4之间,若偏离此范围,请用0.1N的HCL 或NaOH调整。
2、TBS:2.1 Tris缓冲液配方:(0.5 M pH7.6)Tris(三羟甲基氨基甲烷)60.57g1N HCL 约420ml双蒸水加至1000mlTris缓冲液配制方法:先以少量双蒸水(300~500ml)溶解Tris,加入HCl后,用HCl(1N)或NaOH(1N)将pH调至7.6,最后双蒸水加至1000ml。
此液为储备液,4℃冰箱中保存。
2.2 TBS配方:Tris-HCI缓冲液(0.5M pH7.6)100mlNaCI 8.5~9g (0.15mol/L)双蒸水加至1000mlTBS配制方法:先以少量双蒸水溶解NaCl,再加入Tris-HCl 缓冲液,最后加双蒸水至1000ml,充分摇匀。
3、枸橼酸盐缓冲液(Citrat e buffer):3.1 储存液:A. 0.1M枸橼酸溶液:称取21.01g枸橼酸(C6H8O7·H20)溶于1000ml蒸馏水中。
B. 0.1M枸橼酸钠溶液:称取29.41g枸橼酸钠(C6H5Na3O7·2H20)溶于1000ml蒸馏水中。
3.2 工作液:取9ml A液和41ml B液加入450ml蒸馏水中,溶液pH值应为6.0±0.14、胰酶(Trypsin):4.1 ZLI-9011胰蛋白酶消化液:常用浓度为0.125%,即使用前将一滴试剂1胰酶溶液和三滴试剂2胰酶稀释液均匀混合(1:3稀释),则可直接滴加使用。
胰酶的最终浓度可以根据使用者的要求进行调整,浓度范围可以从0.05%(1:10稀释)至0.25%(1:1稀释)。
4.2 ZLI-9010胰蛋白酶:取0.05g或0.1g胰蛋白酶加入到100ml 0.05%或0.1% pH7.8的无水氯化钙水溶液中,溶解即可。
各种缓冲液的配制方法

各种缓冲液的配制方法
缓冲液是指在化学实验或生物学实验中,为了稳定反应介质,保持反应环境不变,在
浓度比较小的溶液中加入一定量的弱酸、弱碱、盐类或其他缓冲剂来维持溶液的酸碱度,
以达到保持反应的稳定性和准确性的目的。
因此,缓冲液在各类实验技术中都发挥着非常
重要的作用。
以下是各种缓冲液的配制方法。
一、PBS缓冲液(磷酸盐缓冲盐水)
1、配制PBS缓冲液,准备好以下试剂:
10×PBS缓冲液:NaCl 80 g,KCl 2 g,Na2HPO4 14.4 g,KH2PO4 2.4 g。
用蒸馏水调节至1 L。
2、按照以下比例制备:
0.5×PBS缓冲液:10×PBS 50 mL,蒸馏水450 mL,混合搅拌均匀即可。
二、TE缓冲液
Tris-HCl pH8.0 10 mM,EDTA pH8.0 1 mM。
Tris-HCl pH7.4,Tris-HCl pH8.0,Tris-Cl pH8.0,Tris-HCl pH8.3,Tris-HCl pH8.5,Tris-HCl pH8.8,Tris-HCl pH9.5
Tris-HCl pH8.5:Tris 7.4 g,NaCl 8.8 g,HCl 2 mL,蒸馏水至1 L。
MES 20 mM,NaOH 0.5 M,NaCl 100 mM。
七、HEPES缓冲液
HEPES 1 M,NaOH。
HEPES缓冲液:HEPES 1 M约5 mL,NaOH 2 M溶液若干,蒸馏水至100 mL。
缓冲液配制操作方法

缓冲液配制操作方法一、缓冲液的定义和作用缓冲液是一种能够稳定溶液中pH值的溶液,广泛应用于生物学、化学、制药和环境科学等领域的研究中。
缓冲液的主要作用是在化学反应或生物反应中,保持反应环境的稳定性,使反应过程更加准确和可靠。
二、缓冲液配制的常用方法缓冲液的配制可以使用以下几种常见方法:(一)用缓冲液配制试剂盒在现代化学实验室和生物学实验室中,使用缓冲液配制试剂盒的方法是最为常见的。
这种方法的优点在于配制方便、精度高、成本较低,同时还能根据需要自由调整pH值。
(二)使用溶液配制仪器溶液配制仪器也是制备缓冲液的常见工具。
根据需要使用相应的软件和仪器,即可调整缓冲液的浓度和pH值。
(三)手动配制如果实验室没有设备或工具,还可以手动配制缓冲液。
这种方法非常简单,只需按照配方中提供的原材料比例准备好所需的化学试剂,然后将其加入适量的溶剂中,搅拌均匀即可。
三、缓冲液配制操作指南缓冲液配制操作步骤如下:(一)根据实验需求选择缓冲液种类和pH值:缓冲液按照pH值不同可分为酸性缓冲液、中性缓冲液和碱性缓冲液。
在使用前需要先确定实验需求,选择合适的缓冲液种类和pH值。
(二)准备所需的原料和试剂准备好所需的原料和试剂,包括缓冲液配方、水、化学试剂等。
(三)计算并称取所需的化学试剂根据所需缓冲液的容积和配方将需使用的化学试剂依照比例称量入量杯或烧杯。
(四)加入适量的水或其他溶剂将称取好的化学试剂转移至烧杯中,加入适量的水或其他溶剂,将烧杯放到旋转振荡器上,搅拌均匀。
(五)调整pH值使用pH计确定缓冲液的pH值是否符合要求。
如果pH值不符合要求,可以使用酸或碱调节剂进行精确调节。
(六)调整溶液浓度使用纳米计等仪器测定缓冲液的溶液浓度,根据需要调整溶液浓度。
一般来说,pH值在调整后会对溶液浓度造成影响,因此同步考虑这两个因素。
(七)过滤和包装将缓冲液过滤后,按照实验需求将其分装到装在塑料瓶或玻璃瓶中,标明缓冲液种类和pH值,放置在阴凉干燥处储存。
53种常见缓冲液配制方法

53种常见缓冲液配制方法
一、磷酸缓冲液
1.0M磷酸缓冲液的配制方法
(1)将0.883克无水磷酸二铵(Na2H2PO4·2H2O)加入5升水中,
然后煮沸,以消除少量的氧气和杂质,然后用烧杯内的冻干机进行冻干;
(2)将上述冻干的水溶液加入到10升容量的烧瓶中,加热至90℃,按1.0M标准比重进行称重,比重合适时停止加热;
(3)将上述溶液加入15升的容量瓶中,加入足够的水,使它达到正
确的pH值(也就是7.00),用它精确测量pH值;
(4)最后,用0.1N硫酸钠溶液精确测量缓冲液的比重,最终得到
1.0M磷酸缓冲液。
二、氯化缓冲液
1.0M氯化缓冲液的配制方法
(1)将0.314克氯化钠加入到5升水中,然后煮沸,以消除少量的
氧气和杂质,然后用烧杯内的冻干机进行冻干;
(2)将上述冻干的水溶液加入到10升容量的烧瓶中,加热至90℃,按1.0M标准比重进行称重,比重合适时停止加热;
(3)将上述溶液加入15升的容量瓶中,加入足够的水,使它达到正
确的pH值(也就是7.00),用它精确测量pH值;
(4)最后,用0.1N硫酸钠溶液精确测量缓冲液的比重,最终得到
1.0M氯化缓冲液。
三、氨基乙酸缓冲液
1.0M氨基乙酸缓冲液的配制方法。
史上最全缓冲溶液配制方法
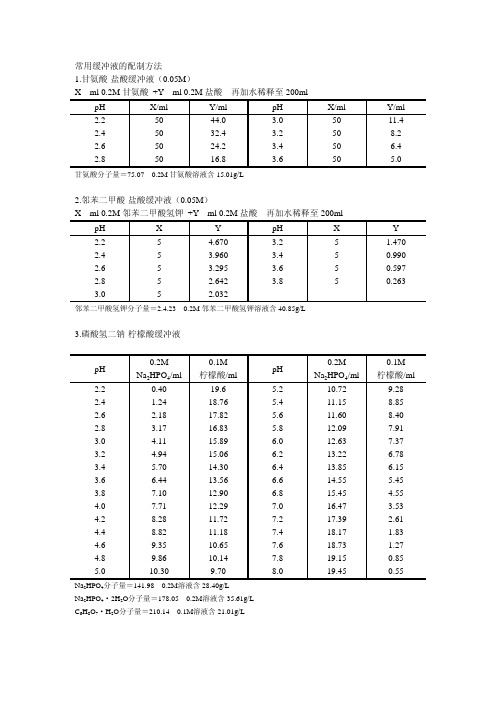
常用缓冲液的配制方法1.甘氨酸-盐酸缓冲液(0.05M)X ml 0.2M甘氨酸 +Y ml 0.2M盐酸再加水稀释至200mlpH X/ml Y/ml pH X/ml Y/ml2.2 50 44.03.0 50 11.42.4 50 32.43.2 50 8.22.6 50 24.23.4 50 6.42.8 50 16.83.6 50 5.0 甘氨酸分子量=75.07 0.2M甘氨酸溶液含15.01g/L2.邻苯二甲酸-盐酸缓冲液(0.05M)X ml 0.2M邻苯二甲酸氢钾 +Y ml 0.2M盐酸再加水稀释至200mlpH X Y pH X Y2.2 5 4.6703.2 5 1.4702.4 53.960 3.4 5 0.9902.6 53.295 3.6 5 0.5972.8 5 2.6423.8 5 0.2633.0 5 2.032邻苯二甲酸氢钾分子量=2.4.23 0.2M邻苯二甲酸氢钾溶液含40.85g/L3.磷酸氢二钠-柠檬酸缓冲液pH0.2MNa2HPO4/ml0.1M柠檬酸/mlpH0.2MNa2HPO4/ml0.1M柠檬酸/ml2.2 0.40 19.6 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.534.2 8.28 11.72 7.2 17.39 2.614.4 8.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55 Na2HPO4分子量=141.98 0.2M溶液含28.40g/LNa2HPO4·2H2O分子量=178.05 0.2M溶液含35.61g/LC6H8O7·H2O分子量=210.14 0.1M溶液含21.01g/L4.柠檬酸-氢氧化钠-盐酸缓冲液pH 钠离子浓度/M柠檬酸C6H8O7·H2O/g氢氧化钠NaOH/g浓盐酸HCl/ml终体积/L2.2 0.20 210 84 160 103.1 0.20 210 83 116 103.3 0.20 210 83 106 104.3 0.20 210 83 45 105.3 0.35 245 144 68 105.8 0.45 285 186 105 106.5 0.38 266 156 126 10 使用时可以每升中加入1g酚,若最后pH有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
常用缓冲溶液的配制方法

常用缓冲溶液的配制方法缓冲溶液是在化学实验和生物实验中常用的一种溶液,用于调节溶液的pH值,使其保持在特定的pH范围内。
常用缓冲溶液的配制方法有许多种,下面将介绍几种常见的缓冲溶液的配制方法。
一、Tris缓冲液配制方法:Tris缓冲液是一种常用的生物学缓冲液,常用于蛋白质电泳、酶反应等实验中,其配制方法如下:1. 准备所需的试剂:Tris碱(Tris base,化学名三羟基甲基氨基甲烷)。
2. 在计量瓶中称取适量的Tris碱,并将其溶解于蒸馏水中,得到所需浓度的Tris碱溶液。
3. 调节溶液pH值:使用盐酸(HCl)或氢氧化钠(NaOH)调节Tris溶液的pH值。
通常,Tris缓冲液的pH范围为7-9,具体的pH值取决于实验的要求。
4.定容:将溶液调节至最终所需体积,通过加入蒸馏水来调节。
二、Phosphate缓冲液配制方法:Phosphate缓冲液是生化实验中常用的一种缓冲液,其配制方法如下:1.准备所需的试剂:磷酸二氢钠(NaH2PO4)和磷酸氢二钠(Na2HPO4)。
2.在计量瓶中称取适量的NaH2PO4和Na2HPO4,分别溶解于蒸馏水中,得到所需浓度的NaH2PO4和Na2HPO4溶液。
3.调节溶液pH值:根据所需pH范围选择NaH2PO4和Na2HPO4的比例,同时用盐酸(HCl)或氢氧化钠(NaOH)调节pH值。
4.定容:将溶液调节至最终所需体积。
三、Acetate缓冲液配制方法:Acetate缓冲液是一种常用的酸性缓冲液,在酶反应、DNA电泳等实验中常用,其配制方法如下:1. 准备所需的试剂:乙酸(Acetic acid)和醋酸钠(Sodium acetate)。
2.在计量瓶中称取适量的乙酸和醋酸钠,分别溶解于蒸馏水中,得到所需浓度的乙酸和醋酸钠溶液。
3.调节溶液pH值:根据所需pH范围选择乙酸和醋酸钠的比例,同时用盐酸(HCl)或氢氧化钠(NaOH)调节pH值。
4.定容:将溶液调节至最终所需体积。
缓冲溶液的配制方法

缓冲溶液的配制方法
缓冲溶液是一种能够维持溶液中pH稳定的溶液,常用于实验室化学和生物化学实验中。
缓冲溶液的配制方法通常包括以下几个步骤:
1. 选择缓冲体系:确定所需的缓冲体系,如醋酸/醋酸钠、磷酸/磷酸盐、碳酸氢盐/碳酸盐等。
2. 确定所需的pH值:根据实验需要确定所需的pH值。
可以根据缓冲溶液的pKa值和哈登-哈斯尔巴尔方程计算出所需配比。
3. 准备缓冲液的正负离子:根据所选的缓冲体系,准备相应的正负离子溶液。
正离子溶液通常是酸性物质,如醋酸,而负离子溶液通常是盐,如醋酸钠。
4. 混合正负离子溶液:按照所需的pH值和配比,将正负离子溶液混合起来。
可以使用计量器具如量筒或移液器准确地混合所需体积的溶液。
5. 调整pH值:使用pH计检测混合后的溶液的pH值,并根据需要进行调整。
如果pH值偏离所需值,可以添加少量的酸碱溶液(如盐酸或氢氧化钠)来调整。
6. 最终调整和稳定:一旦达到所需的pH值,可以再次使用pH计检测并调整溶液。
然后,对溶液进行必要的稳定处理,如过滤或离心。
需要注意的是,配制缓冲溶液时应注意实验条件,如环境温度和压力,以确保所配制的缓冲溶液能够在实验过程中保持稳定的pH值。
此外,也需要注意选择适当的试剂纯度和使用纯水进行稀释,以避免对实验结果产生干扰。
实验室常用缓冲液配置方案

实验室常用缓冲液配置方案实验室里,各种缓冲液就像是实验操作的基石,有了它们,实验才能顺利进行。
今天,我就来和大家分享一下,我积累十年的实验室常用缓冲液配置经验,保证你一看就懂,一学就会!一、磷酸盐缓冲液(PBS)PBS,这可是实验室的“老熟人”了。
配置方法如下:1.称取8克NaCl,0.2克KCl,1.44克Na2HPO4,0.24克KH2PO4,放入烧杯中。
2.加入800毫升去离子水,用玻璃棒搅拌至溶解。
3.用pH计调整溶液至7.4。
4.定容至1000毫升,过滤,分装,灭菌。
二、Tris缓冲液Tris缓冲液,用途广泛,特别是在蛋白质实验中,是不可或缺的。
1.称取121.1克Trisbase,放入烧杯中。
2.加入800毫升去离子水,用玻璃棒搅拌至溶解。
3.用浓HCl调整溶液至所需pH值。
4.定容至1000毫升,过滤,分装,灭菌。
三、醋酸缓冲液醋酸缓冲液,主要用于微生物实验和细胞培养。
1.称取5.7克NaAc·3H2O,放入烧杯中。
2.加入800毫升去离子水,用玻璃棒搅拌至溶解。
3.用冰醋酸调整溶液至所需pH值。
4.定容至1000毫升,过滤,分装,灭菌。
四、甘氨酸缓冲液甘氨酸缓冲液,适用于蛋白质电泳等实验。
1.称取15.1克甘氨酸,放入烧杯中。
2.加入800毫升去离子水,用玻璃棒搅拌至溶解。
3.用NaOH调整溶液至所需pH值。
4.定容至1000毫升,过滤,分装,灭菌。
五、氨水缓冲液氨水缓冲液,主要用于微生物实验。
1.量取100毫升浓氨水,放入烧杯中。
2.加入800毫升去离子水,搅拌均匀。
3.用浓HCl调整溶液至所需pH值。
4.定容至1000毫升,过滤,分装,灭菌。
六、硼酸缓冲液硼酸缓冲液,适用于核酸实验。
1.称取12.4克硼酸,放入烧杯中。
2.加入800毫升去离子水,用玻璃棒搅拌至溶解。
3.用NaOH调整溶液至所需pH值。
4.定容至1000毫升,过滤,分装,灭菌。
七、EDTA缓冲液EDTA缓冲液,主要用于金属离子螯合实验。
53种常见缓冲液配制方法(总结)

53种常见缓冲液配制方法(总结)
第一类:氢氧化物缓冲液
1、氢氧化硫酸缓冲液:添加一定量的硫酸钾到相当量的硝酸钾中,按需可加入一定量的氢氧化钠,并使氢离子浓度保持在 0.05~0.10mol / L,即可得到pH为2.5~3.0的硫酸缓冲液,其综合离子强度约为 0.150 mol/L。
2、硝酸缓冲液:将一定量的硝酸钾溶解于水中,并在此基础上添加一定量的氢氧化钠,使氢离子浓度保持在 0.1~0.2mol / L,即可得到pH 约为4.7的硝酸缓冲液,其综合离子约为 0.10~0.15 mol/L。
3、三甲基磺酰胺缓冲液:将一定量的三甲基磺酰胺溶解于水中,并在此基础上添加一定量的氢氧化钠,使得氢离子浓度保持在
0.05~0.10mol / L,即可得到pH为7.2~7.5的三甲基磺酰胺缓冲液,其综合离子约为 0.10 mol/L。
第二类:基态缓冲液
1、乙醇缓冲液:将一定量的乙醇溶解于水中,并在此基础上添加一定量的氢氧化钠,使得氢离子浓度保持在 0.1~0.2mol / L,即可得到pH 约为6.3的乙醇缓冲液,其综合离子约为 0.10~0.15 mol/L。
2、氢氟酸缓冲液:将一定量的氢氟酸溶解于水中,并在此基础上添加一定量的氢氧化钠,使得氢离子浓度保持在 0.05~0.08mol / L,即可得到pH约为2.2的氢氟酸缓冲液,其综合离子约为 0.06~0.10 mol/L。
常用缓冲液的配制方法

常用缓冲液的配制方法
一、缓冲液的概念
缓冲液(buffer solution)是一种能够保持溶液的pH值在一定范围
内的溶液,在赋予它特定pH值的同时,缓冲液也具有起到稳定溶液pH的
作用。
比如,在温度或其它参数发生变化的情况下,缓冲液能够促使溶液
的pH值趋于稳定,从而使细胞、酶和其它反应活性的物质的环境稳定。
1、配制pH=6.8的phosphate buffer solution (PBS)
(1)取50ml无菌的水放在一个容量为200ml的玻璃包装容器中;
(2)取5.0gNa2HPO4和1.44gKH2PO4,加入到容器中,搅拌均匀,
直到被完全溶解;
(3)用无菌的水将总量补充到200ml,并搓揉盖部分以保证其中没
有空气;
(4)将缓冲液放到25℃恒温量瓶中,调节pH值到6.8,通常可用
1NNaOH或1NHCl来调节;
(5)滴入5μl 10N NaOH,然后使用pH仪测量,调整pH值到6.8,
并用无菌的水将容量补充到200ml;
(6)将缓冲液置于4℃冷藏或20℃分装,以便日后使用。
2、配制pH=4.5的Citrate buffer solution (CBS)
(1)取50ml无菌的水放在一个容量为200ml的玻璃包装容器中;
(2)取2.7gNa2H2C2O4和2.7gNaHC2O4,加入到容器中,搅拌均匀,直到被完全溶解;
(3)用无菌的水将总量补充到200ml,并搓揉盖部分以保证其中没有空气;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
核酸电泳相关试剂、缓冲液的配制方法50×TAE Buffer (pH8.5)组份浓度 2 M Tris-醋酸,100 mM EDTA配制量 1 L配制方法3.加入57.1 ml的乙酸,充分搅拌。
4.加去离子水将溶液定容至l L后,室温保存。
10×TBE Buffer (pH8.3)组份浓度 890 mM Tris-硼酸,20 mM EDTA配制量 1 L配制方法3.加去离子水将溶液定容至l L后,室温保存。
10×MOPS(3-吗啉基丙磺酸)Buffer组份浓度 200 rnM MOPS,20 mM NaOAc,10 mM EDTA配制量 1 L配制方法 1.称41.8 g MOPS,置于1 L烧杯中。
2.加约700 ml DEPC处理水,搅拌溶解。
3.使用2 N NaOH调节pH值至7.0。
6.用0.45 m滤膜过滤除去杂质。
7.室温避光保存。
注:溶液见光或高温灭菌后会变黄。
变黄时也可使用,但变黑时不要使用。
溴乙锭 (10 mg/ml)组份浓度 10 mg/ml溴乙锭配制量 100 ml配制方法 1.称量1 g溴乙锭,加入到100 ml容器中。
2.加入去离子水100 ml,充分搅拌数h完全溶解溴乙锭。
3.将溶液转移至棕色瓶中,室温避光保存。
4.溴乙锭的工作浓度为0.5 g/ml。
注意:溴乙锭是一种致癌物质,必须小心操作。
Agarose凝胶配制方法 1.配制适量的电泳及制胶用的缓冲液(通常是0.5×TBE或1×TAE)。
2.根椐制胶量及凝胶浓度,准确称量琼脂糖粉,加入适当的锥形瓶中。
3.加入一定量的电泳缓冲液(总液体量不宜超过锥形瓶的50%容量)。
注:用于电泳的缓冲液和用于制胶的缓冲液必须统一。
4.在锥形瓶的瓶封上保鲜膜,并在膜上扎些小孔,然后在微波炉中加热熔化琼脂糖。
加热过程中,当溶液沸腾后,请戴上防热手套。
小心摇动锥形瓶。
使琼脂糖充分均匀熔化。
此操作重复数次,直至琼脂糖完全熔化。
必须注意,在微波炉中加热时间不宜过长,每次当溶液起泡沸腾时停止加热,否则会引起溶液过热暴沸,造成琼脂糖凝胶浓度不准,也会损坏微波炉。
熔化琼脂糖时,必须保证琼脂糖充分完全熔化,否则,会造成电泳图像模糊不清。
5.使溶液冷却至60℃左右,如需要可在此时加入溴乙锭溶液(终浓度0.5 µg/ml)。
并充分混匀。
注:溴乙锭是一种致癌物质。
使用含有溴乙锭的溶液时,请戴好手套。
6.将琼脂糖溶液倒入制胶模中,然后在适当位置处插上梳子。
凝胶厚度一般在3~5 min之间。
7.在室温下使胶凝固(大约30 min~1 h),然后放置于电泳槽中进行电泳。
注:凝胶不立即使用时,请用保鲜膜将凝胶包好后在4℃下保存,一般可保存2~5天。
琼脂糖凝胶浓度与线形DNA的最佳分辨范围6× Loading Buffer(DNA电泳用)组份浓度配制量 500 ml配制方法3.加入180 ml的甘油(Glycerol)后,使用2 N NaOH调节pH值至7.0。
4.用去离子水定容至500 ml后,室温保存。
10 × Loadlng Buffer(RNA电泳用)组份浓度配制置配制方法3.加入5 ml的甘油(Glycerol)后,充分混匀。
4.用DEPC处理水定容至10 ml后,室温保存。
四、核酸、蛋白质杂交用相关试剂、缓冲液的配制方法20×SSC组份浓度 3.0 M NaCl,0.3 M Na3citrate·2H2O(柠檬酸钠)配制量 1 L配制方法 1.3滴加14 N HCl,调节pH值至7.0后,加去离子水将溶液定容至1 L。
4.高温高压灭菌后,室温保存。
20×SSPE Buffer组份浓度 3.0 M NaCl,0.2 M NaH2PO4,0.02 M EDTA配制量 1.L配制方法3.加NaOH 调节pH 值至7.4(约6.5 ml 的10 N NaOH)。
4.加去离子水将溶液定容至l L 。
5.高温高压灭菌后,室温保存。
50 X Denhardt’S 溶液组份浓度 配制量500 ml 配制方法 1.称量下列试剂,置于500 ml 烧杯中。
2.加去离子水约400 ml ,充分搅拌溶解3.加去离子水将溶液定容至500 ml 。
4.用0.45µm 滤膜过滤后,分装成每份25 ml 。
5.-20℃保存。
0.5 M 磷酸盐Buffer组份浓度 0.5 M Na2HPO 4。
配制量 l L配制方法 1.称量134 g Na 2HPO 4·7H 2O 置于l L 烧杯中。
2.加入约800 ml 的去离子水充分搅拌溶解。
3.加入85%的H 3PO 4(浓磷酸)调节溶液pH 值至7.2。
4.加去离子水定容至1 L 。
5.高温高压灭菌后,室温保存。
Salmon DNA (鲑鱼精DNA)组份浓度 10 mg/ml Salmon DNA配制量 约100 ml配制方法 1.称取鲑鱼精DNA 2 g 置于500 ml 烧杯中,加入约200 ml 的TE Buffer 。
2用磁力搅拌器室温搅拌2~4 h ,溶解后加入4 ml 的5 M NaCl ,使其终浓度为0.1 M 。
3.用苯酚和苯酚/氯仿各抽提1次。
4.回收水相溶液后,使用17号皮下注射针头快速吸打溶液约20次,以 切断DNA 。
5.加入2倍体积的预冷乙醇进行乙醇沉淀。
6.离心回收DNA 后,溶解于100 ml 的去离子水中。
测定溶液的OD 260值。
7.计算溶液的DNA 浓度后,稀释DNA 溶液至10 mg/ml 。
8.煮沸10min 后,分装成小份(1 ml/份)。
-20℃保存。
9.使用前在沸水浴中加热5min 后,迅速冰浴冷却。
DNA 变性缓冲液组份浓度 1.5 M NaCl ,0.5 M NaOH配制量 1 L配制方法3.加去离子水将溶液定容至l L 后,室温保存。
预杂交液/杂交液 (DNA 杂交用)组份浓度配制置 100 ml配制方法 1.称量下列试剂,置于200 ml 烧杯中。
2.充分混匀后,使用0.45 µm 滤膜滤去杂质后使用。
预杂交液/杂交液(RNA 杂交用)组份浓度配制量 100 mL配制方法 1.称量下列试剂,置于200 ml 烧杯中。
2.充分混匀后,使用0.45µm 滤膜滤去杂质后使用。
膜转移缓冲液(Western 杂交用)组份浓度 39 mM Glycine ,48 mM Tris ,0.037%(W/V)SDS ,20%(V/V)甲醇 配制量 1 L配制方法3.加去离子水将溶液定溶至800 ml 后,加入200 ml 的甲醇。
4.室温保存。
TBST Buffer(Western 杂交膜清洗液)组份浓度 20 mM Tris-HCl ,150 mM NaCl ,0.05%(V/V)Tween 20配制量 1 L配制方法3.加入0.5 ml Tween 20后充分混匀。
4.加去离子水将溶液定容至l L 后,4℃保存。
封闭缓冲液(Western 杂交用)组份浓度 5%(W/V)脱脂奶粉/TBST Buffer配制量 100 ml配制方法 1.称5 g 脱脂奶粉加入到100 ml TBST Buffer 中,充分搅拌溶解。
2.4℃保存待用(本封闭液应该现配现用)。
五、实验室常用培养基的配制方法Ampicillin(氨卡青霉素)(100 mg/ml)组份浓度 100 mg/ml Ampicillin配制量 50 ml配制方法 1.称量5 g Ampicillin置于50 ml离心管中。
2.加入40 ml灭菌水,充分混合溶解后,定容至50 ml。
3.用0.22 µm过滤膜过滤除菌。
4.小份分装(1 ml/份)后,-20℃保存。
IPTG(异丙基-β-D-硫代半乳糖苷)(24 mg/ml)组份浓度 24 mg/mL IPTG配制量 50 mL配制方法 1.称1.2 g IPTG置于50 ml离心管中。
2.加入40 ml灭菌水,充分混合溶解后,定容至50 ml。
3.用0 22 µm过滤膜过滤除菌。
4小份分装(1 ml,份)后,-20℃保存。
X-Gal (20 mg/ml)组份浓度 20 mg/ml X-Gal配制量 50 ml配制方法 1.称量l g X-Gal置于50 ml离心管中。
2.加入40 ml DMF(二甲基甲酰胺),充分混合溶解后,定容至50 ml。
3.小份分装(1 ml/份)后,-20℃避光保存。
LB培养基组份浓度 1%(W/V)Tryptone(胰蛋白胨),0.5%(W/V)Yeast Extract(酵母提取物),1%(W/V)NaCl配制量 1 L配制方法3.滴加5 N NaOH(约0.2 m1),调节pH值至7.0。
4.加去离子水将培养基定容至1 L。
5高温高压灭菌后,4。
C保存。
LB/Amp培养基组份浓度配制量配制方法3.滴加5 N NaOH(约0.2 mL)。
调节pH 值至7.0。
4.加去离子水将培养基定容至1 L 。
5.高温高压灭菌后,冷却至室温。
6.加入1 ml Ampicillin(100 mg/ml)后均匀混合。
7.4℃保存。
TB 培养基组份浓度配制量 1.L配制方法 1.配制磷酸盐缓;中液(0.17 M KH 2PO4,0.72 M K 2HPO 4)100 ml 。
溶解2.31 g KH 2PO 4和l2.54 g K 2HPO 4于90 ml 的去离子水中,搅拌溶解 后,加去离子水定容至100 ml ,高温高压灭菌。
4.加去离子水将培养基定容至1 L 后,高温高压灭菌。
5.待溶液冷却至60℃以下时,;加入100 ml 的上述灭菌磷酸盐缓冲液。
6.4℃保存。
TB/Amp培养基组份浓度配制量配制方法 1.配制磷酸盐缓冲液(0.17 M KH2PO4,0.72 M K2HPO4)100 ml。
溶解2.31 g KH2PO4,和12.54g K2HPO4于90 ml的去离子水中,搅拌溶解后,加去离子水定容至100 ml,高温高压灭菌。
4.加去离子水将培养基定容至l L后,高温高压灭菌。
5.待溶液冷却至60℃以下时,加入100 ml的上述灭菌磷酸盐缓冲液。
6.均匀混合后4℃保存。
SOB培养基组份浓度配制量配制方法 1.配制250 mM KCl溶液。
在90 ml的去离子水中溶解l.86 g KCl后,定容至100 ml。
2.配制2 M MgCl2溶液。
在90 ml去离子水中溶解19 g MgCl2后,定容至100 ml,高温高压灭菌。
5.量取10 m1 250 mM KCl溶液,加入到烧杯中。
6.滴加5 N NaOH溶液(约0.2 m1),调节pH值至7.0。
7.加入去离子水将培养基定容至l L。
