第三章稀土元素的电子结构和镧系收缩
稀土元素 镧系

稀土元素镧系镧系元素是指周期表中镧(La)到镱(Yb)这15个元素,它们统称为镧系元素。
镧系元素是稀土元素中的一类,具有独特的化学和物理性质,广泛应用于各个领域。
下面将对镧系元素进行详细介绍。
一、镧系元素的概述镧系元素是指原子核中电子的填充顺序为4f的元素,它们的外层电子结构为5d1 6s2。
镧系元素的原子序数从57到71,依次为镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱。
这些元素的原子半径逐渐缩小,原子质量逐渐增加。
二、镧系元素的性质1. 化学性质镧系元素具有较强的还原性和氧化性,可以与大多数非金属和金属反应。
其中镧、铈和钇是相对稳定的,而镝、钬和铒则比较活泼。
镧系元素的化合价一般为+3,但也可表现出+2和+4的化合价。
2. 物理性质镧系元素是金属,具有良好的导电性和热导性。
它们的熔点和沸点较高,且在常温下呈固态。
镧系元素的磁性多样,有的呈铁磁性,有的呈反铁磁性,还有的呈顺磁性。
三、镧系元素的应用1. 钢铁冶炼镧系元素可用作钢铁冶炼中的合金元素,能够提高钢的强度、塑性和耐腐蚀性。
其中钕铁硼磁体是应用最广泛的稀土磁体,被广泛应用于电机、传感器、声学设备等领域。
2. 光学材料镧系元素的化合物具有良好的光学性能,可用于制备激光材料、光纤通信材料和荧光材料。
镧系元素的荧光粉被广泛应用于LED照明、荧光屏幕和激光显示器等领域。
3. 催化剂镧系元素的化合物具有良好的催化性能,可用作汽车尾气净化催化剂、石油加工催化剂和化学合成催化剂。
镧系催化剂能够提高反应速率、改善反应选择性和延长催化剂寿命。
4. 核能材料镧系元素的同位素镧-138是一种重要的核能材料,可用于核反应堆的燃料制备。
镧系元素还可用于制备核探测仪器、核医学放射性示踪剂和放射治疗药物。
5. 稀土磷光粉镧系元素的磷光粉广泛应用于荧光显示器、荧光屏幕、LED照明等领域。
镧系元素的磷光粉具有高亮度、长寿命和良好的发光特性。
6. 其他应用镧系元素还可用于制备陶瓷材料、玻璃材料、高温超导材料和磁性材料等。
镧系元素
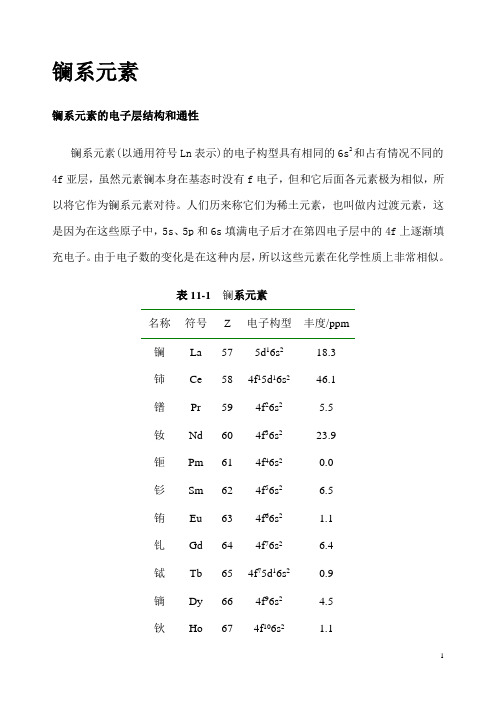
镧系元素镧系元素的电子层结构和通性镧系元素(以通用符号Ln表示)的电子构型具有相同的6s2和占有情况不同的4f亚层,虽然元素镧本身在基态时没有f电子,但和它后面各元素极为相似,所以将它作为镧系元素对待。
人们历来称它们为稀土元素,也叫做内过渡元素,这是因为在这些原子中,5s、5p和6s填满电子后才在第四电子层中的4f上逐渐填充电子。
由于电子数的变化是在这种内层,所以这些元素在化学性质上非常相似。
表11-1 镧系元素名称符号Z 电子构型丰度/ppm镧La 57 5d16s218.3铈Ce 58 4f15d16s246.1镨Pr 59 4f26s2 5.5钕Nd 60 4f36s223.9钷Pm 61 4f46s20.0钐Sm 62 4f56s2 6.5铕Eu 63 4f66s2 1.1钆Gd 64 4f76s2 6.4铽Tb 65 4f75d16s20.9镝Dy 66 4f96s2 4.5钬Ho 67 4f106s2 1.1铒Er 68 4f116s2 2.5铥Tm 69 4f126s20.2镱Yb 70 4f136s2 2.7镥Lu 71 4f145d16s20.8它们性质上的微小差别,主要是由“镧系收缩”引起的。
因为核内每增加一个质子,相应进入4f亚层的电子却太分散,不象定域程度更高的内层电子那样能有效地屏蔽核电荷,所以随着镧系元素原子序数的增加,原子核对最外层电子的引力就不断地增大,这就使得原子体积从镧到镥依次减小。
三价阳离子的收缩是十分规则的,从La3+的106pm收缩到Lu3+的35pm。
图11.1A所示金属半径,虽然总的趋向是减小,但Eu和Yb的半径比其余原子的要大得多。
它们是形成二价阳离子的倾向最大的两个镧系元素。
在固体中,这两种原子可能只将两个电子给予导带,而所形成的2+离子和其余镧系金属的3+离子相比,其半径较大、离子间的结合力较弱。
金属铕(Eu)和镱(Yb),与表中相邻的金属比,显然具有较低的密度,较低的熔点(图11.1B)和较低的升华能。
稀土元素

15
2L11n10原5 子Ln半原离径子和半离径子半径
Eu
200
210150
128000
105
La Ce
La
Pr
Nd
Pm
Sm Eu
Eu
Sm
Gd Tb
Dy
Ho
Yb
Ln(+II) Ln Er LnTm(+III) Lu
Ce
Ln(+IV)
116905
100
Pr Nd
Yb
190
14905
185
11289000 11078055
1 、氧化物
19
4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr
钾钙 钪钛 钒 铬锰铁钴镍 铜 锌镓锗砷硒 溴氪
5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe
97.9
-2.29
96.4
-2.30
95.0
-1.99
93.8 -2.28
92.3
-2.31
90.8
-2.29
89.4
-2.33
88.1
-2.32
86.9
-2.32
85.8
-2.22
8
84.8
-2.30
从上图中可以看出,镧系元素的原子半径和
离子半径在总的趋势上都随着原子序数的增加而
镧系收缩在无机化学中是一个重要的化学现象

镧系收缩在无机化学中是一个重要的化学现象镧系收缩在无机化学中是一个重要的化学现象。
其存在对元素周期表中某些元素的性质,有相当大的影响。
以至于在需要解释这些相关性质的“反常”时,可以一言以蔽之是“镧系收缩”的影响。
从而使得镧系收缩更有了一些“理论”的味道。
但镧系收缩这个概念本身并不很严格,对其产生原因的分析也多有不妥,需通过讨论、加以厘清才好。
一、镧系收缩的内涵原子半径是元素的最主要性质之一。
由于元素周期表的核心是,随原子序数的增加,原子核外电子排布有周期性的变化,并导致元素性质有规律性变化。
因而,从元素周期表的角度来看,原子半径变化也是有规律的。
即在同一周期中,原子半径有从前到后逐渐减小的趋势;在同一族中,有原子半径自上而下逐渐增大的趋势。
在周期表的绝大部分区域都是如此。
而单独就原子半径问题,提出“镧系收缩”的概念,显然是要强调镧系元素的某种、对元素周期表有较为显著影响或“干扰”的特殊性。
镧系元素的原子半径的特殊性有两点:第一点是,随原子序数,原子半径极为缓慢的缩小。
这一特点是很突出的。
如,在同周期的主族元素(s区或p区内)间,原子序数增加1,原子半径平均会有10 pm的减小;在同周期的过渡元素(d区或ds区内)间,原子序数增加1,原子半径平均会有5 pm的减小;而在同周期的内过渡元素(f区内)间,原子序数增加1,原子半径平均只有1 pm的减小。
镧系元素原子与离子半径的相近(加之离子所带电荷相等),是造成它们常共生、及彼此间难以分离的内在原因。
第二点是,在镧系元素内部,随核电荷不断增加、原子半径减小的虽然不多,但14次半径减小的积累量还是十分可观的(从镧到镥原子半径共减小了14.3 pm)。
其对外部的直接影响就是,造成了钇(Y)的半径与镧系元素中的铕(Eu)相近,从而钇也归属于“希土”;使紧随其后的d区元素的原子半径明显偏小,出现第三过渡系的前几个元素的原子半径,与第二过渡系的相应元素的原子半径几乎相等(大家熟知的锆与铪、铌与钽、钼与钨)的现象。
镧系收缩

第二周期比第一周期多了p区的元素,第三周期的元素与第二周期种类相同,第四周期比第三元素周期表周期多了d区的元素,第五周期与第四周期的元素种类又相同,第六周期比第五周期多了f区元素,第七周期与第六周期的元素种类又相同。
若上下周期元素种类相同,则从上到下,递变规律很有规律性,
若上下周期元素种类突然增加了,往往带来反常。
因为经历了镧系,在内层多了14个电子,导致有效核电荷增大,对核外电子的吸引力增大,导致半径发生了收缩。由这个现象,还带出了一些其它的性质。
这个现象称为镧系收缩,但其实并不只发生在镧系身上。
现象
原子半径镧系元素的原子半径和离子半径随原子序数增大而减小的现象。
从镧到镥,原子半径收缩了15皮米,平均每增加一个核电荷,半径收缩1皮米。其中铕、镱半径明显大,而铈略小于镨。这是由于在镧系元素的离子中铕、镱是+2价离子,铈是+4价离子,其余是+3价离子。从La3+到Lu3+,离子半径从 106.1皮米均匀地降为84.8皮米,这是由于Ln3+离子结构的变化是由f0到f14,电子数是均匀改变的。Ln2+、Ln4+的离子半径也是随原子序数增大而收缩。
镧系收缩使镧系元素的性质从镧到镥呈现有规律的变化:如金属标准电极电势值E°增大,Ln3+水解倾向增强,Ln(OH)3的碱性减弱、溶解度减小,对于给定配位体其稳定常数K增大,盐的水解温度降低……等(表2)。所有这些均与镧系元素的离子势φ=Z/r(Z为化合价,r为离子半径)逐渐增大有关。价数相同的全部镧系元素,其化合物的晶形往往也相同。
如,Zr是160,Hf是159。
周期表中,从上到下,电子层数逐渐增大,原子半径应该逐渐增大,但第五周期到第六周期的同族元素,半径却很接近,甚至下面的第六周期的还可能更小一点。
稀土元素的结构与材料学性能

1、Ln3+的基态,4f轨道与正常的价电子轨道5d6S6P相比属内层,因此4f电子被有效地屏蔽起来,成为一种希气型结构的离子,所以f电子在通常情况下,不参加成键,难以杂化,只有更高能量的5d6S6P可以形成共价键,但CFSE相当小,约1000cm-1。 2、Ln3+离子半径比较大,是希气结构的离子与Ca2+、Sr2+、Ba2+相似。 Ca2+ 3S23P6 99pm Ba2+ 5S25P6 134pm Ln3+ 4f n5S25P6 106.1~85pm Al3+ 2S22P6 51pm
稀土镁合金比强度较高,对减轻飞机重量,提高战术性能具有广泛用前景。
1
2
在冶金工业中的应用:稀土钛合金 70年代初,北京航空材料研究院(简称:航材院)在Ti-A1-Mo系钛合金中用稀土金属铈(Ce)取代部分铝、硅,限制了脆性相的析出,使合金在提高耐热强度的同时,也改善热稳定性能。
2、在石油化工
早在50年代我国仿制的飞机和导弹的蒙皮、框架及发动机机匣已采用稀土镁合金,70年代后,随着我国稀土工业的迅速发展,航空稀土开发应用跨入了自行研制的新阶段。新型稀土镁合金、铝合金、钛合金、高温合金、非金属材料、功能材料及稀土电机产品也在歼击机、强击机、直升机、无人驾驶机、民航机以及导弹卫星等产品上逐步得到推广和应用。
1、在冶金工业中的应用:稀土镁合金
稀土镁合金强度高,对减轻飞机重量,提高战术性能具有广泛的应用前景。中国航空工业总公司研制的稀土镁合金包括铸造镁合金及变形镁合金约有10个牌号,很多牌号已用于生产,质量稳定。稀土元素在镁合金中溶解度大,因而有明显的热处理强化作用。在铸造和变型镁合金中加入金属钕、钇显著地提高强度和工艺性能。
镧系元素

原子半径/pm
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4
Ln3+半径 /pm E q /V
106.1 -2.38
103.4 -2.34
101.3 -2.35
99.5 -2.32
97.9
-2.29
96.4
-2.30
95.0
-1.99
93.8 -2.28
92.3
-2.31
90.8
-2.29
89.4
-2.33
88.1
-2.32
86.9
-2.32
85.8
-2.22
84.8
-2.30
7Hale Waihona Puke 从上图中可以看出,镧系元素的原子半径和
离子半径在总的趋势上都随着原子序数的增加而
缩小的幅度很小,这叫做
2
3 Li
锂
4 Be
铍
5 B 6 C 7 N 8 O 9 F 10 Ne
硼 碳 氮氧 氟 氖
3
11 Na
钠
12 Mg
镁
IIIB
IVB
VB
VIB VIIB
VIII
13 Al 14 Si 15 P 16 S 17 Cl 18 Ar
IB IIB 铝 硅 磷 硫 氯 氩
4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr
整个电子壳层依次收缩的积累造成总的镧系收缩
镧系收缩

1镧系收缩镧系元素的原子半径和离子半径列于表1,从表中数据可以看出,从钪(Sc)经钇(Y)到镧(La)原子半径和+3离子半径逐渐增大,但从镧(La)到镥(Lu)的镧系元素的原子半径和相同氧化态的离子半径随着原子序数的增加,从整体来看都有减小的趋势.从La到Lu原子半径总共收缩14.42 pm,+3离子半径总共收缩21.3 pm.此减小趋势也可从图1、图2中看出.这种镧系元素的原子半径和离子半径随着原子序数的增加而逐渐减小的现象称为镧系收缩.2镧系收缩的原因原子半径和离子半径的大小,主要取决于原子和离子的最高能级中电子的主量子数和其所经受的有效核电荷(z*)的引力大小.对镧系元素的原子及离子来说,主量子数没有差别,因此半径的差别主要来自z*的不同.在镧系元素中,随着原子序数的增加,新增加的电子相继填充在外数第三层的4f轨道上,造成镧系收缩的原因首先在于4f电子虽处于内层轨道,但由于4f轨道形状分散(四瓣梅花形),在空间伸展得又较远,以致4f电子对原子核的屏蔽不完全,不象轨道形状比较集中的其他内层电子那样有效地屏蔽核电荷,结果随着原子序数的递增,外层电子所经受的有效核电荷的引力递增,因而使电子壳层依次有所减小.镧系元素的原子和+3离子的有效核电荷见表2.其次,由于4f轨道形状分散,4f电子相互之间的屏蔽也非常不完全,在填充4f电子的同时,每个4f电子所经受的有效核电荷也在逐渐增加,结果4fn电子壳层也逐渐减小.整个电子壳层依次收缩的积累造成了镧系收缩.3镧系收缩中的反常现象3.1铕(Eu)和镱(Yb)的原子半径突然增大从图1和图2中可以看出:原子半径的收缩不仅比离子半径收缩得慢,而且不如离子半径收缩变化有规律,它只是总的趋势减小,但在Eu和Yb 处出现双峰,即这两种元素原子半径特别大.这是由于Eu和Yb分别有半充满的4f7和全充满的4f14电子构型,根据洪特规则,这种具有半充满和全充满状态的电子构型是比较稳定的,在Eu和Yb的金属晶体中每个原子只能提供2个6S电子参加形成金属键,而其它镧系元素的原子一般有3个电子参加形成金属键,所以Eu和Yb的金属键远比其他镧系元素弱,结果是其金属半径自然要大得多.这与Eu和Yb比其左右邻居有较低的密度、熔点、升华能是相吻合的.3.2铈(Ce)的原子半径较其左、右邻居都小铈(Ce)具有4f15d16s2电子构型,4个价电子全部参与形成金属键时,简并的4f、5d轨道处于比较稳定的全空状态,所以在铈(Ce)的金属晶体中每个Ce原子有4个价电子参与成键,其金属键比其它镧系元素强,结果是其金属半径自然比其左右邻居都小.4镧系收缩的结果4.1镧系两相邻原子半径约缩小1 pm例65Tb66Dy67Ho68Er69Tmr/pm178.33180.13176.61175.66174.62同周期相邻两元素的原子半径缩小幅度为:主族约10 pm、副族约5 pm、镧系约1 pm.这是由于主族元素随着原子序数的增大,新增加的电子依次填充在最外层的nS或nP轨道上,有效核电荷增加显著(平均约0.2~0.3);副族元素新增加的电子依次填充在次外层的(n-1)d轨道上,有效核电荷增加较多(平均约0.07);而镧系元素新增加的电子依次填充在外数第3层的(n-2)f 轨道上,有效核电荷增加较少(平均约0.02).所以镧系元素两相邻原子半径缩小的幅度较小. 4.2镧系两相邻+3离子半径约缩小1.5 pm例65Tb3+66Dy3+67Ho3+68Er3+69Tm3+ r/pm92.390.889.488.186.9镧系元素+3离子中的4f电子对原子核的屏蔽作用比其原子中4f电子对原子核的屏蔽作用小.从表2可以看出,从La到Lu随着原子序数的增大,相邻两原子有效核电荷约增加0.02,两相邻+3离子有效核电荷约增加0.1.因而镧系金属离子半径收缩较原子半径显著.4.3从镧(La)到镥(Lu)原子半径共收缩14.3 pm,+3离子半径共收缩21.3 pm。
第2章稀土元素的电子结构和镧系收缩 PPT

遵循洪特规则,即等价轨道全充满、半充满或全空的状
态比较稳定。
稀土元素原子核外电子的分布(电子构型)
稀土元素的价电子层结构和氧化态
原子 序数
符号
原子价电子 层结构
RE2+
氧化态 RE3+
RE4+
21
Sc
3d14s2
—
39
Y
4d15s2
—
57
La
5d16s2
—
58
Ce
4f15d16s2
[Xe]4fn6s2和[Xe]4fn-15d16s2 其中[Xe]=1s22s22p63s23p63d104s24p64d105s25p6。
La后其它的元素,电子填充4f轨道,两种情 况4fn-15d16s2 ;4fn6s2 ШB族基态价电子层结构
21 Sc 3d14s2 1s22s22p63s23p63d14s2 39 Y 4d15s2 1s22s22p63s23p63d104s24p64d15s2 57 La 5d16s2 1s22s22p63s23p63d104s24p64d105s25p65d16s2
例如镧的一种电子组态 1s22s22p63s23p63d104s24p64d105s25p65d16s2,表示占 据能量为ε1s的单电子状态的电子数为2,占据能量 为ε2s的单电子状态的电子数为2,占据能量为ε2p的 单电子状态的电子数为6等。
电子组态
构造原理:多电子原子中电子在轨道上的排布规律称为 “构造原理”。 基态原子的电子在原子轨道中填充 排布的顺序通常为: ls, 2s,2p, 3s,3p, 4s,3d,4p, 5s,4d, 5p, 6s,4f,5d,6p, 7s,5f,6d … … 据此可写出大多数原子基态的电子组态。在某些 特殊情况下,上述填充排布的顺序稍有变化。 构造原理图示如下, 这也是元素周期律的基础。
在周期系中,你知道什么是镧系元素?什么是稀土元素吗?它们的电子层结构和性质有什么特点?

在镧系收缩中,为什么原子半径的收缩比离子半径的收缩小得多呢?
想想看?这是因为离子比金属原子少一电子层,电子失去最外层6s电子之后,4f轨道则处于倒数第二层(倒数第一层为5s、5p轨道),这种状态的4f轨道比原子中的4f轨道(倒数第三层)对核电荷的屏蔽作用小,从而使得离子半径的收缩效果比原子半径明显。
我国稀土矿藏遍及18个省(区),是世界上储量最多的国家。内蒙包头的白云鄂博矿是世界上最大的稀土矿。在我国,具有重要工业意义的稀土矿物有氟碳铈矿Ce(CO3)F,独居石矿RE(PO4),它们是轻稀土的主要来源。磷钇矿YPO4和褐钇铌矿YNbO4是重稀土的主要来源。
我们从以下几个方面来讨论镧系元素的通性:
从表Ln-2所列镧系元素第三电离能I3的数据看,它们随原子序数的增加起伏较大,镧系元素由Ln2+
→Ln3+主要是由第三电离能I3决定的。I3的数值以Eu和Yb最大,其次为Tm和Sm,所以这些元素的+2价相对比较稳定。
另外从Ln-3可以看出,Eu2+和Yb2+的稳定性还与它们离子的电子层结构是半充满(Eu2+为4f7)和全充满(Yb2+为4f14)构型有关。Eu14和Yb2+就比Sm2+(4f6)和Tm2+(4f13)稳定。
从表Ln-8中的数据可见,镧系金属的密度、熔点除Eu和Yb以外,基本上随着原子序数的增加而增加。Eu和Yb的密度、熔点比它们各自左右相邻的两种金属都小。这是由于它们具有4f半充满和4f全充满的电子构型,使屏蔽效应增大,有效核电苛降低,导致原子核对外层6s电子的吸引力减小,而使它们的原子半径突然增大,以致它们的原子半径与碱土金属的原子半径相近,例如:
镧系元素.ppt

6铕36铕3EEuu 9镅59镅5AAmm
664钆4钆GGdd 9锔9锔66CCmm
6655铽铽TTbb 9977锫锫BBkk
6969镝锎68镝锎68DCDCyfyf69钬7锿969钬7H锿9EHoEsos160镄8铒1060镄8铒FE0mrFEm1r60铥钔911MT60铥钔9dm1MT1dm70镱锘021NY70镱 锘ob02NY170ob1镥铹3 L1L701u镥铹r3 LLur
原子半径/pm
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4
Ln3+半径 /pm E q /V
106.1 -2.38
103.4 -2.34
101.3 -2.35
99.5 -2.32
三、氧化态
+III氧化态是所有Ln元素的特征氧化态。
Ce(4f15d16s2),Pr(4f36s2),Tb(4f96s2),Dy(4f106s2) 能形成+IV氧化态即
Ce(4f0),Pr(4f1),Tb(4f7),Dy(4f8) 。
Sm(4f66s2),Eu(4f76s2),Tm(4f136s2),Yb(4f146s2) 能形成+II氧化态即
钫 镭 Ac-Lr 钅卢 钅杜 钅喜 钅波 钅黑 钅麦 Uun Uuu Uub
114 116 118
镧 锕系 系镧锕系系85镧 锕97ALca85镧锕97A5L9铈 钍80caTC59he铈钍80 TC59he9镨镤1 P5P99镨镤1arPP69ar0钕2铀N690U钕2d铀NUd69钷 镎136P9N钷镎13mpPNmp69钚24钐69钚24PS钐PSumum
稀土元素-PPT课件

优点:
①电动机的效率增强;
磁性材料
②电动汽车起动机的起动力会大大 增加而体积却大大减小; ③家用电器能耗显著降低; ④有广泛的应用前景,如:磁悬浮 高速列车,自动化高速公路。
缺点:成本变高
结构材料:使钢铁得到良好特性 贮氢材料:高容量充电电池的电极。
超导材料:混合稀土-钡-铜-氧超导体
发光材料:节能光源
稀 土 元 素 的 发 现
稀土金属是芬兰学者加多林 (Johan Gado1in)在1794年发现的。 当时在瑞典的矿石中发现了矿物 组成类似“土”状物而存在的钇 土,且又认为稀少,便定名为 (Baxe Earth)。
①燃点低。 ②比其他金属元素都活泼。 ③ 氧化物稳定。
④氧化物熔点高,生成自由能负值大。
2REF3 + 3Ca --------→2RE + 3CaF2
金属热还原法
除用金属 Ca做还原剂外,也有用金属 Ba 或 Mg 做还原剂,稀土卤化物也有以溴化 物作原料的。用金属热还原法制得的稀 土金属,不同程度的含有各种杂质,还 需进一步提纯。此外,还有氧化物的镧、 铈还原法,其主要反应为:
RE2O3(s) + 2La(s)-----→2RE(g) + La2O3(s) (RE代表Sm、Eu、Yb)
稀土元素在基态时的电子排布特征是最后填充的电子大都进入4f亚层只有钇和镧例外下表列出稀土元素原子和离子re图1稀土元素的原子性从上表中可看到gd轨道为半充满lu轨道为全充满这些都是稳定的电子构从上表中可看到la4f空轨道gd的4f轨道为半充满lu的4f轨道为全充满这些都是稳定的电子构镧系元素的原子半径及ln离子半径在总的趋势上都随着原子核电荷数的增大而减小这一现象叫做系原子半径收缩的过程和镱的原子半径突然增大在图中出现了两个峰值
No3元素周期系与过渡元素概论-6镧系稀土元素

Ln3+ La3+ Ce3+ Pr3+ Nd3+ Pm3+ Sm3+ Eu3+ Gd3+ 4f n 0 1 2 3 4 5 6 7
Ln3+具有特征颜色
颜
4f n 14 13 12 11 10 9 8 ——
液
中
Ln3+ 的
颜色 无 无 浅绿 粉红 淡黄 黄 浅粉红 ——
色
Ln3+ Lu3+ Yb3+ Tm3+ Er3+ Ho3+ Dy3+ Tb3+ ——
一. 按物理性质分类 1.轻稀土元素组— 铈组 La Ce Pr Nd Pm Sm 2.重稀土元素组— 钇组 Eu Gd Tb Dy Y Ho Er Tm Yb Lu Sc 二. 按稀土元素分离工艺分类 轻稀土( 铈组 ) La Ce Pr Nd Pm Sm 中重稀土(铽组) Eu Gd Tb Dy 重稀土( 钇组 ) Y Ho Er Tm Yb Lu Sc
例:Tb3+ : 4f8 L=∑ml S
=2×3+2+1-1-2-3 =3
S=∑ms
=1/2×6 =3
J= L +
= 3+3 = 6
+3 +2 +1 0 - 1 -2 -3
∴ Tb3+基态光谱项: 2S+1LJ → 7F6
八.磁性
镧系元素中除La3+(4f0)和Lu3+(4f14)组态没有未成 对电子,呈逆磁性外.其它4f n组态含有未成对电子, 因而都是顺磁性的.
μ = g J ( J + 1)
(J:总角动量; g :朗德因子)
解释镧系收缩效应

解释镧系收缩效应
镧系收缩效应是指在镧系元素中,随着电子层数的增加,原子半径逐渐缩小的现象。
这种现象是由于镧系元素的电子结构特殊而引起的。
镧系元素的电子结构是由4f电子和5s、5p电子组成的。
4f电子是内层电子,对原子半径的影响较小,而5s、5p电子是外层电子,对原子半径的影响较大。
在镧系元素中,由于4f电子的层数增加,5s、5p电子的层数减少,导致原子半径逐渐缩小。
镧系元素的电子结构还具有一些特殊的性质,如电子互斥效应和电子屏蔽效应。
电子互斥效应是指4f电子和5s、5p电子之间存在一种排斥作用,使得5s、5p电子的有效核电荷数减少,从而导致原子半径缩小。
电子屏蔽效应是指4f电子对5s、5p电子的屏蔽作用,使得5s、5p电子的有效核电荷数减少,也会导致原子半径缩小。
镧系收缩效应在化学和物理学中都有重要的应用。
在化学中,镧系元素的收缩效应会影响其化学性质,如原子半径的缩小会导致化学反应的速率加快,化学键的强度增加等。
在物理学中,镧系元素的收缩效应也会影响其物理性质,如原子半径的缩小会导致电子云的密度增加,从而影响其光谱性质等。
镧系收缩效应是一种特殊的现象,它是由于镧系元素的电子结构特殊而引起的。
这种现象在化学和物理学中都有重要的应用,对于深
入理解镧系元素的性质和行为具有重要的意义。
第2章稀土元素的电子结构和镧系收缩

第2章稀土元素的电子结构和镧系收缩稀土元素是指周期表中镧系元素,从镧(La)到镥(Lu)。
它们被称为稀有土壤元素,因为它们在地壳中的含量相对较低。
稀土元素具有独特的电子结构和镧系收缩现象,这些特征使得它们在化学和物理领域中具有广泛的应用。
稀土元素的电子结构是其独特性质的基础之一、稀土元素的原子核中有一种称为4f电子的内层电子,这些电子处于7s轨道之下,因此它们在化学反应中几乎没有参与。
然而,稀土元素的外层电子又和常规的d电子和f电子(把f电子放在外侧)在能量上非常接近。
这使得稀土元素具有很多特殊的化学性质,如高磁性、发光性等。
另一个重要的特征是稀土元素的镧系收缩。
镧系收缩是指在元素周期表中,随着电子逐渐填充4f轨道,原子半径逐渐减小的现象。
这是因为随着电子数目的增加,电子云的电子-电子排斥力增大,使得整个原子缩小。
镧系收缩的结果是稀土元素具有非常相似的化学性质,难以分离和区分。
这也是为什么稀土元素在过去很长一段时间内被认为是难以研究和利用的原因之一然而,稀土元素的电子结构和镧系收缩也为其在化学和物理领域中的应用提供了很多机会。
稀土元素在催化剂、磁性材料、发光材料等方面具有重要的应用价值。
由于其独特的电子结构和化学性质,稀土元素可以用来设计和制备具有特殊性质和功能的材料。
例如,稀土元素的电子结构使得它们在磁性材料中表现出色。
稀土元素的f电子对电子自旋和轨道运动具有很强的耦合作用,导致稀土离子具有强磁性。
稀土磁性材料具有广泛的应用,如磁存储器、电动机等。
此外,稀土元素还在发光材料中发挥重要作用。
稀土元素的f电子级间跃迁可以产生具有特定波长的光,使得稀土元素成为制备发光材料的理想选择。
例如,镧系元素中的铕和钆常用于制备红色和绿色荧光材料。
稀土元素的电子结构和镧系收缩也对稀土化学和化学分析提出了挑战。
由于稀土元素具有相似的化学性质,分离和鉴定稀土元素变得十分困难。
然而,随着分析技术的不断发展,如高效液相色谱、电感耦合等离子体质谱等,稀土元素的分析变得更加精确和高效。
镧系与稀土PPT课件

双峰效应:缺少5d电子,只提供6s 电子(离域电子)参与形成金属键, 使其金属键比其他Ln元素弱,原子 半径明显增大
8
二、金属活泼性
镧系金属都是活泼金属
其活泼性仅次于碱金属,与镁接近,都是强还原剂; 活泼性顺序由Sc、Y、La递增,由La~Lu递减
在不太高的温度下即可与氧、硫、氯、氮等反应,所 以在冶金工业中常用作脱硫、脱氧剂
△
LnCl3·6H2O ==== LnOCl+HCl↑+5H2O
得到无水氯化物要在HCl气流中加热
Ln2O3+C+Cl2 → LnCl3+CO
Ln2O3+SOCl2 → LnCl3+SO2↑
Ln2O3+NH4Cl → LnCl3+NH3↑+H2O
△
Ln2(C2O4)3
Ln2O3 +CO↑+CO2 ↑
4. 氧化态为+4和+2的化合物
铈(Ce)、镨(Pr)、铽(Tb)、镝(Dy)都能形成+4氧化态 的化合物,其中以四价铈的化合物最重要
四价铈化合物既能存在于水溶液,又能存在于固体 四价均是强氧化剂
2CeO2+8HCl = 2CeCl3 + Cl2 + 4H2O 2CeO2 + 2KI + 8HCl = 2CeCl3 + I2 + 2KCl + 4H2O 钐(Sm)、铕(Eu)和镱(Yb)能形成+2氧化态化合物; Sm2+, Eu2+, Yb2+具有不同程度的还原性 铕(Ⅱ)盐的结构类似于Ba, Sr相应的化合物,如 EuSO4同BaSO4结构相同,难溶于水
镧系收缩及后果

镧系收缩及后果
1.镧系收缩现象
镧系元素的原子(离子)半径,随着原子序数的增大而缩小,这种现象称为镧系收缩。
(a) Ln原子半径与原子序数的关系(b) Ln3+ 离子半径与原子序数的关系
2.镧系收缩的特点:
原子半径收缩的较为缓慢,相邻原子半径之差仅为1pm左右,但从La~Lu经历14个元素,原子半径收缩积累14pm之多。
离子半径收缩要比原子半径明显的多。
【问题1】为什么出现镧系收缩?
【问题2】为什么在原子半径总的收缩趋势中,铕与镱原子半径比相邻元素的原子半径大得多?
【问题3】为什么原子半径收缩小,而离子半径却收缩的十分明显?
【问题4】在Ln3+离子半径减小曲线中,为什么在Gd3+离子处出现微小的不连续?
3.镧系收缩的后果
(1)离子半径为88pm,落在(88.1pm)附近,因而自然界中,Y常同镧系共生,成为稀土元素成员。
(2)镧系后面元素的原子半径、离子半径分别和同族上面一个元素的原子半径和离子半径相为接近。
上述三对元素半径十分接近,化学性质十分相似,常伴生在一起,难以分离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
团结 信赖 创造 挑战
2.1 稀土元素的自由原子和离子体系的能量
2.1.1稀土元素自由原子和离子的基态电子组态
2.1.1.1电子组态 由n和l(n为主量子数,l为角量子数)所决定的一
种原子(或离子)中的电子排布方式,称为电子组态。 电子组态用符号nlan′l′b…来表示,a和b分别代表占 据能量εnl和εn′l′的单电子状态的电子数。
电子组态有两种类型:
[Xe]4fn6s2和[Xe]4fn-15d16s2
其中[Xe]=1s22s22p63s23p63d104s24p64d105s25p6。
La后其它的元素,电子填充4f轨道,两种情
况4fn-15d16s2 ;4fn6s2
ШB族基态价电子层结构
21 Sc 3d14s2 1s22s22p63s23p63d14s2 39 Y 4d15s2 1s22s22p63s23p63d104s24p64d15s2 57 La 5d16s2 1s22s22p63s23p63d104s24p64d105s25p65d16s2
2PDFGHIKLMNI 4SPDF G HIKLM
6PFH
4 57 6 7 55 3 2
2 3 4 43 3 2
73 198
1SPDFGHIKLMNQ 3PDFGHIKLMNO 5SPDFGHIKL 7F
4 648473422 6 5 9 79 6633 32322
119 295
2SPDFGHIKLMNOQ4SPDFGHIKLMN6 119 327 PDFGHI8S
89 Ac 6d17s2
遵循洪特规则,即等价轨道全充满、半充满或全空的状
态比较稳定。
团结 信赖 创造 挑战
稀土元素原子核外电子的分布(电子构型) 团结 信赖 创造 挑战
稀土元素的价电子层结构和氧化态
原子 序数
符号
原子价电子 层结构
RE2+
氧化态 RE3+
RE4+
21
Sc
3d14s2
—
[Ar]
—
39
团结 信赖 创造 挑战
➢La3+(4f0), Gd3+(4f7) 和 Lu3+(4f14) 处于稳定 结构,获得 +2 和 +4 氧化态是相当困难的;
➢Ce3+(4f1) 和 Tb3+(4f8) 失去一个电子即达稳 定结构,因而出现 +4 氧化态;
➢Eu3+(4f6) 和 Yb3+(4f13) 接受一个电子即达稳 定结构,因而易出现 +2 氧化态 。
2571010997542 2 26575533
团结 信赖 创造 挑战
1001 2002 3003
3432
2.1.2.2 影响镧系原子和离子能级的因素
➢ 对于电荷为+Ze的原子核和n个电子(质量为m,电 荷为-e)组成的体系,在核静止条件下,体系的 Schrodinger方程式中的Hamilton算符的形式为:
团结 信赖 创造 挑战
IA-IIA IIIA-VIIIA IIIB-VIIIB La系
IB-IIB
Ac系
周期
核
7s
7p
7
外
6s
6p
6d
6
电
子
5s
5p
5d
5f
5
填
充
4s
4p
4d
4f
4
顺
序
3s
3p
3d
3
图
2s
2p
2
1s
1
团结 信赖 创造 挑战
2.1.1.2 镧系元素自由原子的基态电子组态
根据能量最低原理,镧系元素自由原子的基态
—
4f7
—
65
Tb
4f96s2
—
4f8
4f7
66
Dy
4f106s2
—
4f9
4f8
67
Ho
4f116s2
—
4f10
—
68
Er
4f126s2
—
4f11
—
69
Tm
4f136s2
4f13
4f12
—
70
Yb
4f146s2
4f14
4f13
—
71
Lu
4f145d16s2
— 团结 4信f14赖 创造—挑战
排布原理: 1.能量最低原理 2.保里原理 3.洪特规则
Y
4d15s2
—
[Kr]
—
57
La
5d16s2
—
[Xe]
—
58
Ce
4f15d16s2
4f2
4f1
[Xe]
59
Pr
4f36s2
—
4f2
4f1
60
Nd
4f46s2
4f4
4f3
4f2
61
Pm
4f56s2
—
4f4
—
62
Sm
4f66s2
4f6
4f5
—
63
Eu
4f76s2
4f7
ห้องสมุดไป่ตู้
4f6
—
64
Gd
4f15d16s2
图2.1对中性的镧系原子来说fns2和fn-1d团1s结2组信态赖的近创似造的挑相战对位置
氧化态
通常是+3,也有+2,+4。 17个稀土元素原子最外两层电子结构相似,
与其它元素化合时,先失去最外层S2d1的电子, 无d电子时失去一个f电子,所以通常为“+3 价”。
镧系元素全部都能形成稳定的+3氧化态。 某些RE有+2价(S m 、E u 、Y b),+4价 (Ce 、Pr 、Tb),也遵循洪特规则。 变价也有动力学、热力学的因素。
• 例如镧的一种电子组态 1s22s22p63s23p63d104s24p64d105s25p65d16s2,表示占 据能量为ε1s的单电子状态的电子数为2,占据能量 为ε2s的单电子状态的电子数为2,占据能量为ε2p的 单电子状态的电子数为6等。
团结 信赖 创造 挑战
电子组态
构造原理:多电子原子中电子在轨道上的排布规律称为 “构造原理”。 基态原子的电子在原子轨道中填充 排布的顺序通常为: ls, 2s,2p, 3s,3p, 4s,3d,4p, 5s,4d, 5p, 6s,4f,5d,6p, 7s,5f,6d … … 据此可写出大多数原子基态的电子组态。在某些 特殊情况下,上述填充排布的顺序稍有变化。 构造原理图示如下, 这也是元素周期律的基础。
f7
Pr3+、Tm3+ 1SDGI 3PFH
7 13 91
Nb3+、Er3+ 2PDFGHIKL 4SDFGI 2 2 22
17 41 364
Pm3+、 Ho3+
Sm3+、 Dy3+
Eu3+、Tb3+
Gd3+
1SDFGHIKLN 3PDFGHIKLM 5SGFGI 47 107 2 4 4 2 3 2 3 243 4 22
H ˆi n 18h 2 2 m ii n 1Z r e i2 i n j 1e ri2 ji n 1 (ri)sili
团结 信赖 创造 挑战
团结 信赖 创造 挑战
团结 信赖 创造 挑战
团结 信赖 创造 挑战
2.1.2 镧系原子和离子在基组态时能级的分裂
2.1.2.1镧系原子和离子在基组态时体系的状态
组态
Ln3+
谱项
谱 项
J级能
状态 数
数数
f1、f13 Ce3+、Yb3+ 2F
1 2 14
f2、f12 f3、f11 f4、f10 f5、f9 f6、f8
