标准缓冲液pH值与温度对照表
标准缓冲液pH值与温度对照表

常用蛋白质分子量标准参照物
高分子量标准参照 蛋白质 肌球蛋白 β-半乳糖苷酶 磷酸化酶B 牛血清清蛋白 过氧化氢酶 醛缩酶 中分子量标准参物 低分子量标准参照 Mr Mr 蛋白质 97 400 212 000 磷酸化酶B 66 200 116 000 牛血清清蛋白 55 000 97 400 谷氨酸脱氢酶 42 700 66 200 卵清蛋白 40 000 57 000 醛缩酶 31 000 40 000 碳酸酐酶 21 500 大豆胰蛋白酶抑制剂 14 400 溶菌酶 蛋白质 碳酸酐酶 大豆胰蛋白酶制剂 马心肌球蛋白 溶菌酶 肌球蛋白(F1) 肌球蛋白(F2) 肌球蛋白(F3) Mr 31 000 21 500 16 900 14 400 8 100 6 200 2 500
(四)凝胶过滤层析介质的技术数据
凝胶过滤介质 名称 分离范围 Superdex 30 Superdex 75 Superdex200 Superose 6 Superose 12 Sephacryl S-100 HR Sephacryl S-200 HR Sephacryl S-300 HR Sephacryl S-400 HR Sepharose 6 Fast Flow Sepharose 4 Fast Flow Sepharose 2B Sepharose 4B Sepharose 6B Sepharose CL-2B Sepharose CL-4B Sepharose CL-6B 45~165 60000~20×105 10000~4×106 45~165 颗粒 大小 (μm) 24~44 <10000 24~44 3000~70000 24~44 3 000 10000~600000 20~40 20~40 5000~5×106 25~75 1000~300000 1000~ 100000 25~75 5000~250000 10000~1.5×106 20000~8×106 10000~4×106 60000~20×106 70000~40×106 60000~20×106 10000~4×106 70000~40×106 45~165 45~165 60~200 25~75 25~75 平均90 平均90 60~200 特性/应用 肽类、寡糖、小蛋白等 重组蛋白、细胞色素 单抗、大蛋白 蛋白、肽类、多糖、核酸 蛋白、肽类、寡糖、多糖 肽类、小蛋白 蛋白,如清蛋白 蛋白、抗体 多糖、具延伸结构的大分 子如蛋白多糖、脂质体 巨大分子 巨大分子如重组乙型肝 炎表面抗原 pH稳定性工作 耐压(Mpa) 最 快 流速 (cm/h) 0.3 100 3~12 0.3 100 3~12 0.3 100 3~12 0.4 30 3~12 0.7 30 3~12 0.2 20~39 3~11 3~11 3~11 3~11 2~12 2~12 4~9 0.2 0.2 0.2 0.1 0.1 0.004 0.008 0.02 0.005 20~39 20~39 20~39 300 250 10 11.5 14 15
标准缓冲液的配制
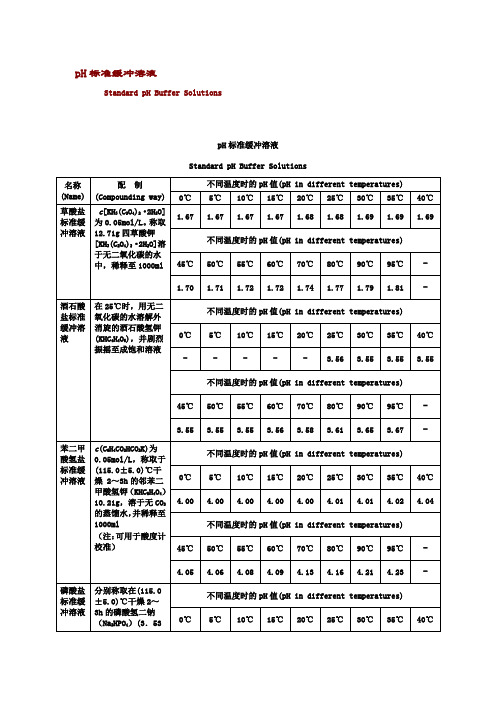
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
-
-
-
-
-
3.56
3.55
3.55
3.55
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
3.55
3.55
3.55
3.56
3.58
3.61
3.65
3.67
-
苯二甲酸氢盐标准缓冲溶液
-
磷酸盐标准缓冲溶液
分别称取在(115.0±5.0)℃干燥2~3h的磷酸氢二钠(Na2HPO4)(3.53±0.01)g和磷酸二氢钾(KH2PO4) (3.39±0.01)g,溶于预先煮沸过15~30min并迅速冷却的蒸馏水中,并稀释至1000ml(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
11.84
11.71
11.57
11.45
-
-
-
-
-
注:为保证pH值的准确度,上述标准缓冲溶液必须使用pH基准试剂配制。
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
1.70
1.71
1.72
1.72
1.74
1.77
1.79
1.81
-
酒石酸盐标准缓冲溶液
PH计校准及缓冲液配置

标准缓冲溶液(均用pH标准缓冲物质配制)1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pH=4.003)。
苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下:a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。
保存于聚乙烯瓶中。
b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。
保存于聚乙烯瓶中。
1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pH=6.864):磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH 标准缓冲物质分别包装)两种。
配制方法如下:a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。
b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。
1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413):磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。
保存于聚乙烯瓶中。
1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。
生物实验中常见buffer的配制
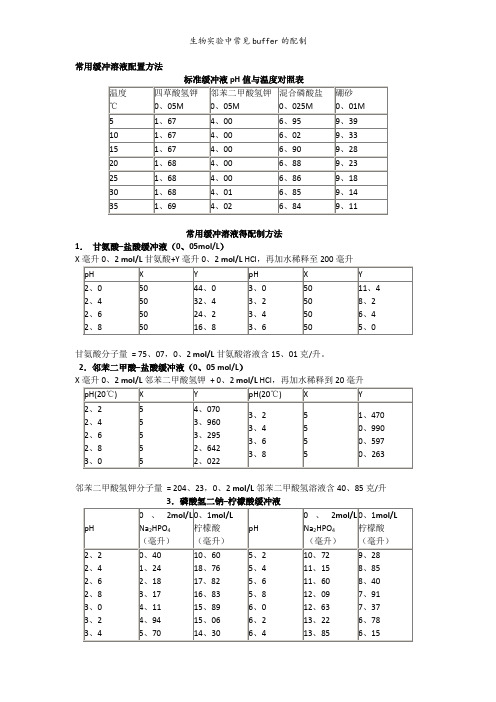
常用缓冲溶液配置方法常用缓冲溶液得配制方法1.甘氨酸–盐酸缓冲液(0、05mol/L)X甘氨酸分子量= 75、07,0、2 mol/L甘氨酸溶液含15、01克/升。
2.邻苯二甲酸–盐酸缓冲液(0、05 mol/L)X邻苯二甲酸氢钾分子量= 204、23,0、2 mol/L邻苯二甲酸氢溶液含40、85克/升Na2HPO4分子量= 14、98,0、2 mol/L溶液为28、40克/升。
Na2HPO4-2H2O分子量= 178、05,0、2 mol/L溶液含35、01克/升。
C4H2O7·H2O分子量= 210、14,0、1 mol/L溶液为21、01克/升。
4①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5柠檬酸C6H8O7·H2O:分子量210、14,0、1 mol/L溶液为21、01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294、12,0、1 mol/L溶液为29、41克/毫升。
6.乙酸–乙酸钠缓冲液(0、2 mol/L)Na2Ac·3H2O分子量= 136、09,0、2 mol/L溶液为27、22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0、2)Na2HPO4·2H2O分子量= 178、05,0、2 mol/L溶液为85、61克/升。
Na2HPO4·2H2O分子量= 358、22,0、2 mol/L溶液为71、64克/升。
Na2HPO4·2H2O分子量= 156、03,0、2 mol/L溶液为31、21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)Na2HPO4·2H2O分子量= 178、05,1/15M溶液为11、876克/升。
KH2PO4分子量= 136、09,1/15M溶液为9、078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0、05M)X巴比妥钠盐分子量=206、18;0、04M溶液为8、25克/升10.Tris–盐酸缓冲液(0、05M,25℃)50毫升0、1M三羟甲基氨基甲烷(Tris)溶液与X毫升0、1N盐酸混匀后,加水稀释至100毫升。
标准缓冲液pH值与温度对照表

标准缓冲液pH值与温度对照表温度℃四草酸氢钾 0。
05M邻苯二甲酸氢钾0.05M混合磷酸盐0.025M硼砂0。
01M5 1.67 4.00 6。
95 9.3910 1。
67 4.00 6.02 9。
3315 1.67 4。
00 6.90 9。
2820 1。
68 4.00 6。
88 9.2325 1.68 4.00 6。
86 9.1830 1。
68 4。
01 6。
85 9。
1435 1。
69 4.02 6.84 9.11常用缓冲溶液的配制方法1.甘氨酸-盐酸缓冲液(0.05mol/L)X毫升0。
2 mol/L甘氨酸+Y毫升0。
2 mol/L HCI,再加水稀释至200毫升pH X Y pH X Y2.0 50 44.0 3。
0 50 11。
42.4 50 32.4 3。
2 50 8.22.6 50 24.23.4 50 6。
42。
8 50 16.8 3。
6 50 5。
0 甘氨酸分子量=75。
07, 0.2 mol/L甘氨酸溶液含15。
01克/升。
2.邻苯二甲酸-盐酸缓冲液(0。
05 mol/L)X毫升0。
2 mol/L邻苯二甲酸氢钾+ 0。
2 mol/L HCl,再加水稀释到20毫升pH(20℃)X Y pH(20℃)X Y2。
2 5 4.0703。
2 5 1。
4702.4 53.9603。
4 5 0.9902.6 53.2953。
6 5 0.597 2。
8 5 2。
6423.8 5 0.2633。
0 5 2。
022邻苯二甲酸氢钾分子量=204.23, 0。
2 mol/L邻苯二甲酸氢溶液含40。
85克/升3.磷酸氢二钠-柠檬酸缓冲液pH 0。
2mol/LNa HPO(ml) 0。
1mol/L柠檬酸 (ml)pH 0.2mol/L Na HPO (ml) 0。
1mol/L 柠檬酸 (ml) 2.2 0.40 10。
60 5。
2 10.72 9。
28 2.4 1.24 18.76 5.4 11.15 8.85 2。
十三、标准缓冲液pH值对照参考表
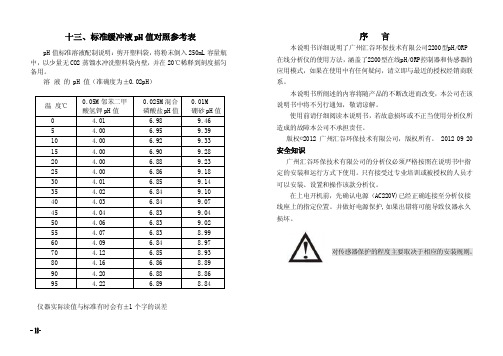
十三、标准缓冲液pH 值对照参考表pH 值标准溶液配制说明:剪开塑料袋,将粉末倒入250mL 容量瓶中,以少量无CO2蒸馏水冲洗塑料袋内壁,并在20℃稀释到刻度摇匀备用。
溶 液 的 pH 值(准确度为±0.02pH)温 度℃ 0.05M 邻苯二甲 酸氢钾pH 值 0.025M 混合 磷酸盐pH 值 0.01M 硼砂pH 值 0 4.01 6.98 9.46 5 4.00 6.959.39 10 4.00 6.92 9.33 15 4.00 6.90 9.28 20 4.00 6.88 9.23 25 4.00 6.86 9.18 30 4.01 6.85 9.14 35 4.02 6.84 9.10 40 4.03 6.84 9.07 45 4.04 6.83 9.04 50 4.06 6.83 9.02 55 4.07 6.83 8.99 60 4.09 6.84 8.97 70 4.12 6.85 8.93 80 4.16 6.86 8.89 90 4.20 6.88 8.86 954.226.898.84仪器实际读值与标准有时会有±1个字的误差序 言本说明书详细说明了广州汇谷环保技术有限公司2200型pH/ORP 在线分析仪的使用方法,涵盖了2200型在线pH/ORP 控制器和传感器的应用模式,如果在使用中有任何疑问,请立即与最近的授权经销商联系。
本说明书所阐述的内容将随产品的不断改进而改变,本公司在该说明书中将不另行通知,敬请谅解。
使用前请仔细阅读本说明书,若故意损坏或不正当使用分析仪所造成的故障本公司不承担责任。
版权©2012 广州汇谷环保技术有限公司,版权所有。
2012 09 20安全知识广州汇谷环保技术有限公司的分析仪必须严格按照在说明书中指定的安装和运行方式下使用。
只有接受过专业培训或被授权的人员才可以安装、设置和操作该款分析仪。
在上电开机前,先确认电源(AC220V)已经正确连接至分析仪接线座上的指定位置。
标准缓冲液的配制方法

13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)
o X 毫升 0.05M 硼砂+Y 毫升 0.2NNaOH 加水稀释至 200 毫升
-专 io pH
X
9.3
50
9.4
50
b 9.6
50
Y
pH
X
6.0
9.8
50
11.0
10.0
0.2V 盐酸 pH
pH(20℃) 7.0 7.2 7.4 7.6 7.8 8.0
X (毫升) 5 5 5 5 5 5
Y(毫升) 2.963 3.500 3.950 4.280 4.520 4.680
0.04M 巴比妥钠溶液(毫升)
0.2N 盐酸(毫升)
o 6.8
100
18.4
8.4 100
5.21
0.3 mol/L HAc(毫升)
9.25 8.80 8.20 7.35 6.30 5.10
0.2 mol/L
pH(18℃) NaAc(毫升)
4.8
5.90
5.0
7.00
5.2
7.90
5.4
8.60
5.6
9.10
5.8
9.40
Na2Ac·3H2O 分子量 = 136.09,0.2 mol/L 溶液为 27.22 克/升。
Na2HPO4 分子量 = 14.98,0.2 mol/L 溶液为 28.40 克/升。 Na2HPO4-2H2O 分子量 = 178.05,0.2 mol/L 溶液含 35.01 克/升。
Y 11.4 8.2 6.4 5.0
Y 1.470 0.990 0.597 0.263
0.1mol/L 柠檬酸 (毫升) 9.28 8.85 8.40 7.91 7.37 6.78 6.15 5.45 4.55 3.53 2.61 1.83 1.27 0.85 0.55
温度与ph值关系对照表

温度与ph值关系对照表温度与pH值关系对照表温度与pH值是化学和生物学中两个重要的指标,它们之间存在一定的关系。
本文将通过对温度与pH值关系的对照表进行解读,以便更好地理解它们之间的关联。
一、温度与pH值的基本概念温度是物体内部或周围分子的平均热运动能力的度量,通常用摄氏度(℃)表示。
pH值是用来表示溶液酸碱性的指标,其值的范围从0到14,7代表中性,小于7代表酸性,大于7代表碱性。
二、温度对pH值的影响根据实验观察,温度对溶液的酸碱性有着一定的影响。
一般情况下,温度越高,溶液的酸碱性也会发生相应的变化。
1. 酸性溶液:在常温下,酸性溶液的pH值通常在1到6之间。
当温度升高时,酸性溶液的酸性会增强,pH值会降低。
这是因为温度升高会增加酸性物质的离解度和反应速率。
2. 中性溶液:中性溶液的pH值通常为7,不受温度的影响。
无论温度如何变化,中性溶液的pH值都保持不变。
3. 碱性溶液:在常温下,碱性溶液的pH值通常在8到14之间。
当温度升高时,碱性溶液的碱性会增强,pH值会升高。
这是因为温度升高会增加碱性物质的离解度和反应速率。
三、温度与pH值关系对照表温度(℃) pH值0 110 220 330 440 550 660 770 880 990 10100 11110 12120 13130 14由上表可见,随着温度的升高,酸性溶液的酸性增强,碱性溶液的碱性增强,而中性溶液的pH值保持不变。
这表明温度对溶液的酸碱性有一定的影响。
四、温度与pH值关系的应用温度与pH值的关系在许多领域都有着重要的应用。
以下是一些示例:1. 生物化学:在生物体内,温度和pH值是维持生物体正常功能的重要参数。
温度和pH值的变化可能会影响酶的活性,从而影响生物体的新陈代谢和生理功能。
2. 环境保护:对于水体的监测和处理,温度和pH值是两个重要的指标。
温度和pH值的测量可以帮助判断水体的污染程度和适宜的生物区域,从而指导环境保护工作的开展。
生物实验中常见buffer的配制

常用缓冲溶液配置方法常用缓冲溶液得配制方法1.甘氨酸–盐酸缓冲液(0、05mol/L)X甘氨酸分子量= 75、07,0、2 mol/L甘氨酸溶液含15、01克/升。
2.邻苯二甲酸–盐酸缓冲液(0、05 mol/L)X邻苯二甲酸氢钾分子量= 204、23,0、2 mol/L邻苯二甲酸氢溶液含40、85克/升Na2HPO4分子量= 14、98,0、2 mol/L溶液为28、40克/升。
Na2HPO4-2H2O分子量= 178、05,0、2 mol/L溶液含35、01克/升。
C4H2O7·H2O分子量= 210、14,0、1 mol/L溶液为21、01克/升。
4①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5柠檬酸C6H8O7·H2O:分子量210、14,0、1 mol/L溶液为21、01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294、12,0、1 mol/L溶液为29、41克/毫升。
6.乙酸–乙酸钠缓冲液(0、2 mol/L)Na2Ac·3H2O分子量= 136、09,0、2 mol/L溶液为27、22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0、2)Na2HPO4·2H2O分子量= 178、05,0、2 mol/L溶液为85、61克/升。
Na2HPO4·2H2O分子量= 358、22,0、2 mol/L溶液为71、64克/升。
Na2HPO4·2H2O分子量= 156、03,0、2 mol/L溶液为31、21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)Na2HPO4·2H2O分子量= 178、05,1/15M溶液为11、876克/升。
KH2PO4分子量= 136、09,1/15M溶液为9、078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0、05M)X巴比妥钠盐分子量=206、18;0、04M溶液为8、25克/升10.Tris–盐酸缓冲液(0、05M,25℃)50毫升0、1M三羟甲基氨基甲烷(Tris)溶液与X毫升0、1N盐酸混匀后,加水稀释至100毫升。
PH计校准及缓冲液配置

标准缓冲溶液(均用pH标准缓冲物质配制)1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pH=4.003)。
苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方式如下:a)袋装配制法:在250 mL(或500 mL)量瓶中(按照袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。
保留于聚乙烯瓶中。
b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。
保留于聚乙烯瓶中。
1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pH=6.864):磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH标准缓冲物质别离包装)两种。
配制方式如下:a)袋装配制法:在量瓶(按照袋上说明肯定量瓶大小)中按袋上说明配制成所需浓度后,保留于聚乙烯瓶中。
b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL 量瓶中,加水至标线,混匀。
1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413):磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质别离用瓶包装,配制方式如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。
保留于聚乙烯瓶中。
1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。
标准缓冲液的配制
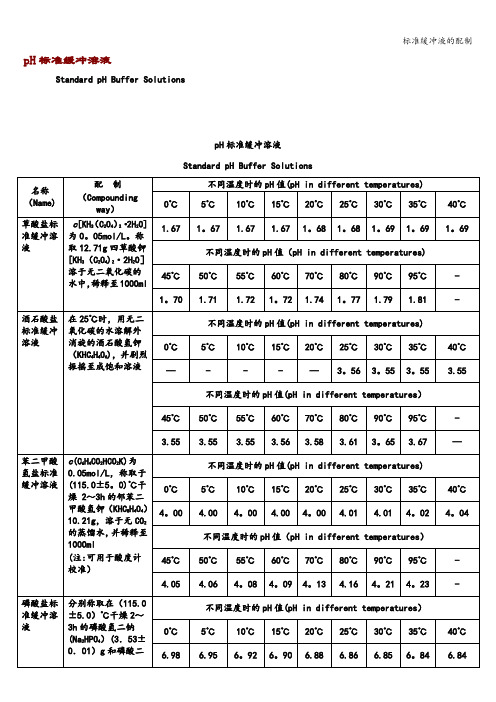
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
9.46
9。40
9.33
9。27
9.22
9.18
9.14
9。10
9.06
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
-
磷酸盐标准缓冲溶液
分别称取在(115.0±5.0)℃干燥2~3h的磷酸氢二钠(Na2HPO4)(3.53±0.01)g和磷酸二氢钾(KH2PO4) (3.39±0.01)g,溶于预先煮沸过15~30min并迅速冷却的蒸馏水中,并稀释至1000ml(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
—
-
-
-
—
3。56
3。55
3。55
3.55
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
3.55
3.55
3.55
3.56
3.58
3.61
3。65
3.67
—
苯二甲酸氢盐标准缓冲溶液
25℃
30℃
35℃
40℃
草酸盐标准缓冲溶液
标准缓冲液pH值与温度对照表【范本模板】

标准缓冲液pH值与温度对照表常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 142.98,0.2 mol/L溶液为28。
40克/升。
Na2HPO4·2H2O分子量 = 178。
05,0。
2 mol/L溶液含35.61克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21。
01克/升。
4.柠檬酸–氢氧化钠—盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
②柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21。
01克/升。
6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O:分子量294。
12,0.1 mol/L 溶液为29。
41克/毫升.227.磷酸盐缓冲液242NaH 2PO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升.242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0。
1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100毫升。
232升。
Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严.2472硼酸H 2BO 3,分子量=61。
84,0.2M 溶液为12。
37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存.2472硼酸H 2BO 3,分子量=61.84, 0。
2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存.12.甘氨酸–氢氧化钠缓冲液(0。
05M)13.硼砂—氢氧化钠缓冲液(0.05M 硼酸根)14.碳酸钠—碳酸氢钠缓冲液(0。
标准缓冲液pH值与温度对照表
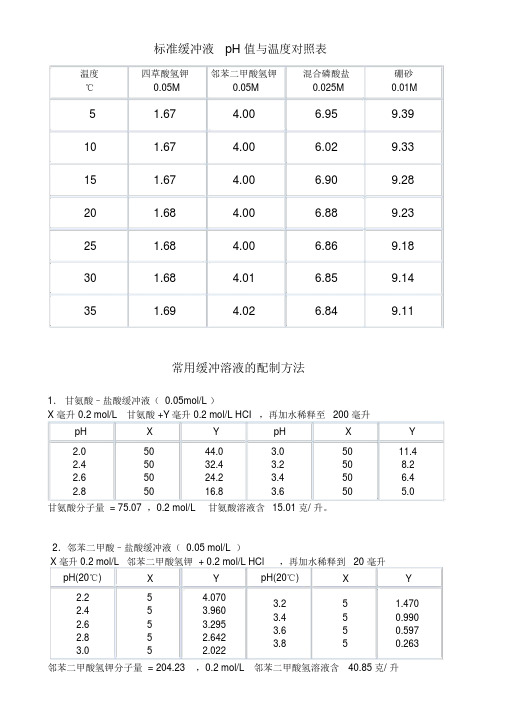
标准缓冲液pH 值与温度对照表温度四草酸氢钾邻苯二甲酸氢钾混合磷酸盐硼砂℃0.05M0.05M0.025M0.01M5 1.67 4.00 6.959.3910 1.67 4.00 6.029.3315 1.67 4.00 6.909.2820 1.68 4.00 6.889.2325 1.68 4.00 6.869.1830 1.68 4.01 6.859.1435 1.69 4.02 6.849.11常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液( 0.05mol/L )X 毫升 0.2 mol/L甘氨酸 +Y毫升 0.2 mol/L HCI,再加水稀释至200 毫升pH X Y pH X Y2.05044.03.05011.42.45032.43.2508.22.65024.23.450 6.42.85016.83.650 5.0甘氨酸分子量 = 75.07 ,0.2 mol/L甘氨酸溶液含15.01 克/ 升。
2.邻苯二甲酸–盐酸缓冲液( 0.05 mol/L )X 毫升 0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20 毫升pH(20℃)X Y pH(20℃)X Y2.25 4.0703.25 1.4702.453.9603.450.9902.653.2953.650.5972.85 2.6423.850.2633.05 2.022邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85 克/ 升3.磷酸氢二钠–柠檬酸缓冲液0.2mol/L0.1mol/L0.2mol/L0.1mol/LpH Na2HPO4柠檬酸pH Na2HPO4柠檬酸(ml)(ml)(ml)(ml)2.20.4010.60 5.210.729.282.4 1.2418.76 5.411.158.852.6 2.1817.82 5.611.608.402.83.1716.83 5.812.097.913.04.1115.896.012.637.373.24.9415.066.213.22 6.783.4 5.7014.30 6.413.85 6.153.6 6.4413.56 6.614.555.453.87.1012.90 6.815.454.554.07.7112.297.016.47 3.534.28.2811.727.217.39 2.614.48.8211.187.418.17 1.834.69.3510.657.618.73 1.274.89.8610.147.819.150.855.010.309.708.019.450.55 Na2HPO4分子量 = 142.98,0.2 mol/L溶液为 28.40克/ 升。
温度与ph值关系对照表

温度与ph值关系对照表温度与pH值关系对照表温度和pH值是化学反应中的两个重要参数,它们之间存在一定的关系。
本文将为读者介绍温度与pH值之间的关系,并提供一个关系对照表。
一、温度对pH值的影响温度对pH值有着显著的影响。
一般来说,温度升高会导致溶液中溶质的离解程度增加,从而使pH值发生变化。
具体而言,温度升高会增加化学反应的速率,使溶质更容易解离,从而使pH值上升。
相反,温度降低则会导致pH值下降。
二、温度与pH值关系对照表下面是一个温度与pH值关系对照表,用于展示不同温度下的pH值变化情况。
温度(摄氏度) pH值0 7.010 6.820 6.530 6.240 5.850 5.560 5.270 4.980 4.690 4.3100 4.0从上表可以看出,随着温度升高,pH值呈现递减的趋势。
当温度从0摄氏度升高到100摄氏度时,pH值从7.0下降到4.0。
三、温度与pH值的实际应用温度和pH值的关系在许多化学和生物过程中起着重要作用。
例如,在酸碱中和反应中,温度的变化会影响反应速率和产物的生成。
在生物体内,温度和pH值的变化也会对酶的活性和生物代谢产生影响。
在实际应用中,了解温度和pH值之间的关系可以帮助我们调整实验条件,优化反应过程。
例如,在生物制药中,根据目标产物的要求,我们可以通过调节反应温度和溶液的pH值来控制产物的纯度和收率。
此外,在环境保护领域,了解温度和pH值的关系也可以帮助我们预测和评估水体的酸碱性,从而采取相应的措施进行调整和保护。
四、温度与pH值关系的研究进展温度和pH值之间的关系一直是科学研究的热点之一。
目前,研究人员通过实验和理论模拟等手段,深入探讨了温度和pH值对各种化学反应和生物过程的影响机制。
这些研究对于提高化学工艺的效率、优化生物工程的设计以及保护环境具有重要意义。
总结:温度和pH值是化学反应和生物过程中的重要参数,它们之间存在一定的关系。
温度的变化会导致溶液中溶质的离解程度发生变化,从而引起pH值的变化。
标准缓冲液pH值与温度对照表

标准缓冲液pH值与温度对照表温度四草酸氢钾0.05M 邻苯二甲酸氢钾0.05M混合磷酸盐0.025M硼砂0.01M5 1.67 4.00 6.95 9.3910 1.67 4.00 6.02 9.3315 1.67 4.00 6.90 9.2820 1.68 4.00 6.88 9.2325 1.68 4.00 6.86 9.1830 1.68 4.01 6.85 9.1435 1.69 4.02 6.84 9.11常用缓冲溶液的配制方法1.甘氨酸-盐酸缓冲液(0.05mol/L )X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI ,再加水稀释至200毫升pH X Y pH X Y2.0 50 44.03.0 50 11.42.4 50 32.43.2 50 8.22.6 50 24.23.4 50 6.42.8 50 16.83.6 50 5.0 甘氨酸分子量=75.07,0.2 mol/L甘氨酸溶液含15.01克/升2.邻苯二甲酸-盐酸缓冲液(0.05 mol/L )X毫升0.2 mol/L邻苯二甲酸氢钾+ 0.2 mol/L HCl ,再加水稀释到20毫升pH(20C) X Y pH(20C) X Y2.2 5 4.0703.2 5 1.4702.4 53.960 3.4 5 0.9902.6 53.295 3.6 5 0.5972.8 5 2.6423.8 5 0.263邻苯二甲酸氢钾分子量 =204.23 , 0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠-柠檬酸缓冲液pH 0.2mol/L N Q HPO(ml)0.1mol/L柠檬酸(ml)pH0.2mol/L N Q HPO(ml)0.1mol/L柠檬酸(ml)2.2 0.40 10.60 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.534.2 8.28 11.72 7.2 17.39 2.614.4 8.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55 N&HPC分子量=142.98,0.2 mol/L 溶液为 28.40 克/ 升N Q HPO 2HO分子量二178.05 , 0.2 mol/L 溶液含 35.61 克/ 升C4H2O7 - H2O分子量二210.14 , 0.1 mol/L 溶液为 21.01 克/ 升4.柠檬酸-氢氧化钠-盐酸缓冲液pH 钠离子浓度(mol/L)柠檬酸(g)C6H8O7 H2O氢氧化钠(g)NaOH 97%盐酸(ml)HCl (浓)最终体积(L)①2.2 0.20 210 84 160 103.1 0.20 210 83 116 103.3 0.20 210 83 106 104.3 0.20 210 83 45 105.3 0.35 245 144 68 105.8 0.45 285 186 105 106.5 0.38 266 156 126 10① 使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
标准缓冲液pH值与温度对照表
常用缓冲溶液的配制方法
1.甘氨酸–盐酸缓冲液(0.05mol/L)
X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升
甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)
X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升
邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升
3.磷酸氢二钠–柠檬酸缓冲液
Na
2HPO
4
分子量 = 14.98,0.2 mol/L溶液为28.40克/升。
Na
2HPO
4
-2H
2
O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C 4H
2
O
7
·H
2
O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液
①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢
氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)
柠檬酸C
6H
8
O
7
·H
2
O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na
3 C
6
H
5
O
7
·2H
2
O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)
Na
2Ac·3H
2
O分子量 = 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液
(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)
Na
2HPO
4
·2H
2
O分子量 = 178.05,0.2 mol/L溶液为85.61克/升。
Na
2HPO
4
·2H
2
O分子量 = 358.22,0.2 mol/L溶液为71.64克/升。
Na
2HPO
4
·2H
2
O分子量 = 156.03,0.2 mol/L溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)
242
KH
2PO
4
分子量 = 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M)
X毫升0.2M K
2PO
4
+ Y毫升0.2N NaOH加水稀释至29毫升
9.巴比妥钠-盐酸缓冲液(18℃)
巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升
50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水
稀释至100毫升。
三羟甲基氨基甲烷(Tris)HOCH2 CH2OH HOCH2 NH2 C 分子量=121.14;
0.1M溶液为12.114克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将
瓶盖严。
11.硼酸–硼砂缓冲液(0.2M硼酸根)
2472
硼酸H
2BO
3
,分子量=61.84,0.2M溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
2472硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升。
硼砂 易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M )
X 毫升0.2M 甘氨酸
+Y 毫升0.2NnaOH 加水稀释至200毫升
甘氨酸分子量=75.07;0.2M 溶液含15.01克/升。
13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根) X 毫升0.05M 硼砂+Y 毫升0.2NNaOH 加水稀释至200毫升
硼砂Na 2B 4O 7·10H 2O,分子量=381.43;0.05M 溶液为19.07克/升。
Ca 2+、Mg 2+存在时不得使用
Na 2CO 2·10H 2O 分子量
=286.2;0.1M 溶液为28.62克/升。
N 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升。
15.“PBS ”缓冲液。
