2017公开课《乙醇》教学课件
乙醇课件(公开课) PPT

黑色
HH || H—C— C—H || H O—H
乙醇
+CuO
黑色
HH || H—C — C =O + Cu +H2O | H
乙醛
红色
Cu
2CH3CH2OH
+
O2
→
△
2CH3CHO
+
2H2O
乙醇在人体内发生了哪些化学变化?
乙醇脱氢酶
乙醇
氧化成乙醛 乙酸
C2H5OH CH3CHO
CO2+H2O
排出体外同时放热
4.乙醇分子中的各种化学键如图所示,下列关于乙醇
在各种反应中断键情况的说明不正确的是( C )
A.和金属钠反应时键①断裂 B.在铜催化共热下与O2反应时断裂①和③键 C.在银催化共热下与O2反应时断裂①和⑤键 D.在空气中完全燃烧时断裂①②③④⑤键
定原理有关的是( C )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性
④乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
3.关于乙醇的说法中正确的是( D )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离 出OH-而显碱性 B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性 C.乙醇与钠反应可以产生氢气,所以乙醇显酸性 D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子 不如水中的氢原子活泼
1、乙醇与钠的反应
①
HH H—C —C—O—H
HH
①处O—H键断开
2 CH3CH2OH +2 Na →2CH3CH2ONa + H2↑
现象分析:
1.钠浮在水面上,而沉在乙醇中?
水的密度>钠的密度>乙醇的密度
乙醇课件(公开课)

H—C—C—O—H ,
H H③
2、重要化学性质: A、与活泼金属发生取代反应产生H2 ,断 ① 键; B、燃烧(优质燃料);催化氧化(制醛),断 ①③ 键;
与水互溶飘清香 电离水比乙醇强 钠粒投入放氢气 氧化成醛铜帮忙
请不要酒后驾车
交警判断驾驶员是否酒后驾
车的方法 .
K2Cr2O7 (橙红色)
Cr2(SO4)3 (绿色)
身边的化学Ⅲ 乙醇的生理机理
(1)扩散作用:进入血液,分布至全身各器官, 主要是在肝脏和大脑中。 (2)代谢作用:酒精肝脏 乙醛(有毒) 乙 酸(营养成分) CO2和H2O。 (3)酒精中毒:酒精在人体内的代谢速率是有限 的,如果一个人饮酒的速率大于体内代谢的速 率,酒精就会在体内器官,特别是在肝脏和大 脑中积蓄,积蓄至一定程度即出现酒精中毒症 状。
2、请写出乙醇与钠反应的化学反应方程式
2Na + 2CH3CH2OH → 2CH3CH2ONa + H2↑
三、乙醇的化学性质
• 1.乙醇与活泼金属反应生成氢气 根据钠和乙醇反应原理,类比书写钾和乙醇反应 化学方程式?
2K+2CH3CH2OH →2 CH3CH2OK+H2↑
2.氧化反应
(1)、燃烧
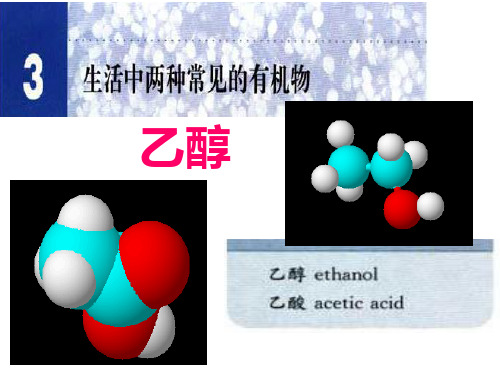
二、乙醇的结构
分子式
结构式 H
C2H6O
HH
C—C—O—H
特殊原子团: 羟基写作-OH
HH 结构简式: CH3CH2OH或C2H5OH
根据刚才实验思考下列问题:
1、根据钠与水、乙醇反应实验现象说明羟基中氢
> 原子的活泼性顺序为: H-OH _____C2H5-OH,乙醇比
水更_______ (难或易)电离出H+.
公开课 优质课件 乙醇 PPT

K2Cr2O7 (橙色)
Cr2(SO4)3 (绿色)
开车不喝酒, 喝酒不开车!
根据世界卫生 组织事故调查 显示,大约 50%-60%的交 通事故与酒后 驾驶有关。
22
(3)乙醇(或酒)的用途
用作燃料,如酒精灯等 制造饮料和香精外,食品加工业
重要的有机化工原料,如制造乙酸、乙醚等。 乙醇又是一种有机溶剂。 医疗上常用75%(体积分数)的酒精作消毒剂。
中国的酒文化博大精深,从古 到今,源远流长!
对酒 当歌,人生几何? 何以解忧?唯有 杜康 。(曹操)
白日放歌需 _纵___酒___,青春作伴好还乡。(杜甫)
明月几时有, 把酒 问青天。(苏轼)
请同学们认真
观察桌上的无水乙 醇,分别从颜色、 气味、状态、溶解 性,挥发性等方面 说说乙醇的物理性 质。
一、乙醇的物理性质
颜 色 : 无色 气 味 : 特殊香味 状 态 : 液体 溶解性 :能溶于水,跟水以任意比互溶
挥发性 :易挥发
二、乙醇的分子结构
球棍模型
比例模型
1、分子式: C2H6O
HH 2、结构式: H C—C—O—H
HH
醇的官能团-羟基(-OH)
3、官能团:决定有机化合物的化学特性
的原子或原子团叫做官能团。
4 、 结 构 简 CH3CH2OH或C2H5OH 式:
分析这种构的化学键特点
①②③④处 的化学键均可在 一定条件下发生 断裂
观察与思考
• 实验1:向1至2mL无水乙醇中加入一小粒 金属钠。
向无水乙醇中加入钠有什么现象? 说明
什么问题?
现象:钠沉入底部,有气体产生。说明乙 醇与钠发生了化学反应。
醇催氧化过程:
2017乙醇(公开课)ppt课件
11
四、乙醇的用途
溶剂
乙醇 燃料
化工原料
12
交警判断驾驶员是否酒后驾车的方法 杜绝酒驾
K2Cr2O7 (橙红色)
乙醇
Cr2(SO4)3 (绿色)
13
小结
乙醇
HH
➢物理性质: ➢分子结构: ➢化学性质:
电 子 式:
结构简式:
CH3CH2OH 或C2H5OH
填充模型
4
三、乙醇的化学性质
实验
实验现象
实验结论
实验1:向一干燥的试管中加入 约2mL无水乙醇,再放一小块金 属钠,观察发生的现象
钠沉于底部,有无色气泡在 钠粒表面生成后逸出液面,最 终钠粒消失,液体仍为无色 透明
乙醇能与钠反 应
5
[问题探源]
(1)钠在乙醇中产生的气体是什么气体?
(2)如果是氢气,那么氢元素是来自哪里?
HH HCCOH
HH
乙醇分子中存在-OH,O-H键容易断裂。在 钠的作用下,-OH中的氢被置换出来形成H2。
6
三、乙醇的化学性质 1、乙醇与钠的反应
—置换反应
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ (乙醇钠)
HH H C C O H 乙醇与钠反应时的断键位置?
HH
[活学活用]乙醇也可与其它活泼金属如钾、钙等反应产生H2 。
7
启迪思考:比较乙醇和水分别与钠反应强弱?
钠+水
钠+乙醇
因为乙醇分子与水分子相比,乙醇的羟基连接的是乙基, 不同于水现的象结构,说明乙基影响了羟基氢的活性,现使象羟 基不易电离出氢,导致化学活性降低
乙醇公开课ppt课件

使用过程中安全问题及注意事项
远离火源和热源
乙醇易燃,使用时应远离火源和 热源,避免引发火灾和爆炸事故
。
防止静电
在乙醇的运输和使用过程中,应采 取防静电措施,如使用导电性良好 的容器和管道,避免静电积聚引发 火灾。
注意通风
在使用乙醇的场所,应保持良好的 通风,避免乙醇蒸气积聚引发中毒 和火灾事故。
废弃物处理与环保要求
主要生产国家及地区
美国、巴西、中国等是全球主要的乙 醇生产国家,其中美国和巴西以玉米 和甘蔗为原料生产乙醇,中国则主要 以粮食和木薯为原料。
产业发展特点
全球乙醇产业在技术创新、原料多元 化、市场拓展等方面取得显著进展, 生物燃料乙醇和化工乙醇成为发展重 点。
中国乙醇产业发展现状及挑战
中国乙醇产量及消费情况
废弃物分类
将乙醇废弃物与其他废弃物分类 收集,避免对环境造成污染。
回收利用
对于可回收利用的乙醇废弃物, 应进行回收处理,减少资源浪费
。
无害化处理
对于无法回收利用的乙醇废弃物 ,应进行无害化处理,如通过焚 烧或生物降解等方式,避免对环
境造成危害。
06
实验操作演示与互动环节
实验目的和原理介绍
01
实验目的
03
乙醇应用领域拓展
能源领域:生物柴油、燃料乙醇等
01
生物柴油
利用乙醇与脂肪酸或脂肪酸酯 进行酯交换反应,生成生物柴 油,具有可再生、环保等优点
。
02
燃料乙醇
将乙醇与汽油按一定比例混合 ,形成燃料乙醇,可有效降低 汽车尾气排放,改善空气质量
。
03
乙醇燃料电池
直接将乙醇转化为电能,具有 高效、清洁、可再生等特点, 是未来能源领域的研究热点。
乙醇 课件(共16张PPT)

任务二:乙醇分子结构的探究
猜想与假设
乙烷
二、乙醇的分子结构
C2H6
分子式:C2H6O
猜想 依据乙醇分子式,推测乙醇可能有哪些结构?
结构式: HH
HH
H—C—C—O—H
H—C O C—H
HH A式
OH H
类比 H
H
B式
如何证明乙醇的分子结构究竟是前者还是后者
任务一:乙醇分子结构的探究
实验验证 [探究实验1-对比钠与水反应]
HH
2CH3CH2O-H +2 Na →2 CH3CH2ONa + H2↑
乙醇钠 该反应属于置换反应
7
任务二:乙醇化学性质的探究
2.氧化反应
(1)燃烧
C2H5OH +3O2 点→燃 2CO2+3H2O
8
任务二:乙醇化学性质的探究
(2)乙醇的催化氧化
[探究实验2] 1、取两支试管分别加入2 mL乙醇 2、点燃酒精灯,将铜丝在酒精灯外焰上灼烧约至铜丝红热,观察铜 丝颜色的变化; 3、小心将灼热铜丝插入乙醇后,用大拇指捂住试管口,观察铜丝颜 色变化,反复几次操作。 4、两支试管中的液体气味进行对比。
2 CH3C=O +2 H2O
H
10
任务二:乙醇化学性质的探究
酒后驾车的检查原理
(3)乙醇与强氧化剂的反应
[探究实验3]取1-2mL酸性K2Cr2O7溶液于试管中,再加入 1mL乙醇溶液进去,观察现象。
K2Cr2O7
重铬酸钾 (橙色) CH3CH2OH
乙醇
乙醇
Cr2(SO4)3 硫酸铬
(绿色) CH3COOH
将表面煤油已经擦干净的金属钠投入盛有1-2mL乙 醇的试管中,观察钠的形状,记录实验现象于表 格,比较钠与水、与乙醇反应的现象有何异、同
乙醇(公开课)PPT课件
二、乙醇的分子结构
分子式:C2H6O
烃的衍生物
HH 结构式:
H C—C—O—HFra bibliotekHH结构简式:
CH3CH2OH
醇的官能团-羟 基(-OH)
或C2H5OH
乙醇分子可以看作是乙烷分子里的一个氢原子
被羟基所取代的产物
官能团: 决定化合物的特殊性质的原子或原子团
物质名称 结 构 简 式
官能团及名称
氯乙烷 乙醇 硝基苯 乙酸 乙烯 乙炔
检验产物
产生淡蓝色 烧杯壁上出现
火焰
液滴
乙醇
HH
||
H—C—C —O—H
||
HH
钠沉在液面下, 反应速率比钠与 水反应慢,没有 熔成光亮的小球
产生淡蓝 色火焰
烧杯壁上出现 液滴,石灰水 不浑浊
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
乙醇钠
探究乙醇分子的结构 钠与乙醇的反应 (定量实验)
?
探究乙醇分子的结构
1 钠与乙醇的反应
实验仪器: 试管 镊子 实验药品: 金属钠 乙醇
实验步骤: 取一小块金属钠,用滤纸将表面的煤
油吸干净,然后投入盛有约5mL乙醇的 试管中,观察现象。
1、与金属反应
物质
水
H—O—H
金属钠的变化
钠浮在水面上, 四处游动,熔成 光亮的小球,发 出咝咝的响声。
气体燃烧现 象
节省石油资源 乙醇掺入汽油能让燃料变“绿”
一、乙醇的物理性质
❖ 颜 色 : 无色透明 ❖ 气 味 :特殊香味 ❖ 状 态 : 液体 ❖ 密 度 :比水小,200C时的密度是0.7893g/cm3 ❖ 溶解性:跟水以任意比互溶,能够溶解多
乙醇课件(公开课)-(含多场合)

乙醇课件(公开课)一、引言乙醇是一种重要的有机化合物,具有广泛的应用领域。
本课件旨在通过公开课的形式,向大众介绍乙醇的基本知识、制备方法、性质和应用,使大家对乙醇有一个全面、深入的了解。
二、乙醇的基本知识1.乙醇的结构与命名乙醇的分子式为C2H5OH,由乙基和羟基组成。
乙醇的结构简式为CH3CH2OH,其中乙基表示一个乙烷分子去掉一个氢原子后剩下的基团,羟基表示一个氧原子和一个氢原子组成的官能团。
乙醇的IUPAC命名为乙醇,俗称酒精。
2.乙醇的物理性质乙醇是一种无色、透明、具有刺激性气味的液体,沸点为78.5℃,熔点为-114.1℃。
乙醇的密度比水小,可溶于水,与水可以形成任意比例的混合物。
乙醇的挥发性较强,易燃,具有可燃性。
3.乙醇的化学性质乙醇是一种醇类化合物,具有醇类化合物的通性。
它可以发生脱水反应、氧化反应、取代反应等多种化学反应。
乙醇的化学性质使其在许多领域具有重要的应用价值。
三、乙醇的制备方法1.发酵法发酵法是工业上最早采用的乙醇生产方法。
发酵法以淀粉质或糖类为原料,通过微生物发酵乙醇。
发酵法具有原料丰富、成本低廉等优点,但生产效率较低,乙醇纯度不高。
2.水合乙烯法水合乙烯法是一种重要的乙醇生产方法。
该方法以乙烯为原料,在催化剂的作用下与水发生加成反应乙醇。
水合乙烯法具有生产效率高、乙醇纯度高等优点,但原料成本较高。
3.生物质转化法生物质转化法是一种新兴的乙醇生产方法。
该方法以生物质为原料,通过化学或生物催化转化为乙醇。
生物质转化法具有原料可再生、环保等优点,但技术尚不成熟,生产成本较高。
四、乙醇的性质与应用1.消毒剂乙醇具有杀菌消毒作用,可用作消毒剂。
75%的乙醇溶液对细菌、病毒等病原体具有良好的灭活效果,广泛用于医疗卫生、食品加工等领域。
2.燃料乙醇具有可燃性,可作为燃料。
乙醇燃料具有清洁、环保等优点,可减少化石能源消耗,降低大气污染。
乙醇燃料在汽车、火箭等领域有广泛应用。
3.化工原料乙醇是一种重要的化工原料,广泛应用于有机合成、高分子材料、涂料、染料等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
经济日报(2017年3月28日) 中国又成功了个大项目! 世界首创,惠及百姓!
酒后驾车危害
(一)视觉障碍 (二)运动反射神经迟钝 (三) 触觉能力降低 (四) 使判断能力和操作能力降低 (五) 使心理变态。酒精刺激下,人有时会过 高估计自己,对周围人劝告常不予理睬,往往 做出力不从心的事。 (六)易疲劳。表现为行驶不规范、空间视觉 差等疲劳驾驶的行为而引发交通事故。
生命不能承受之“醉”
乙醇
乙醇脱氢酶 乙醛脱氢酶
乙醛
CH3COOH
CO2 + H2O
醉酒(acute alcoholic intoxication)
俗称急性酒中毒,是因一次大量饮 酒或酒精饮料而引起的中枢神经系统 兴奋或抑制状态。表现不同程度的兴 奋和激动,失去约束力、行为异常、 多语和发音不清、运动和步态失调、 激越、困倦,以及严重患者出现木僵和 昏迷。
2017年5月4日
乙 醇
是真的吗? “喷完花露水别做饭以防烧身”
(1)花露水为什么可燃? (2)写出乙醇燃烧的反应方程式。 (3)多大浓度的花露水可以燃烧?你会 如何设计实验探究? (4)生活中使用、存放花露水有何需要 注意的地方?
酒精在人体的分解代谢途径:
肝脏、皮肤和呼吸系统;其中约95%通过 肝脏的酶系统进行氧化代谢。 解酒药就是增强肝脏酶系统的功能,起 到分解酒精的作用。 原理如下:
酒驾检测
酒精的快速检测:让驾驶人呼出的气体接触经 过硫酸酸化处理的氧化剂三氧化铬的硅胶,可测出 呼出的气体中是否含有乙醇及乙醇含量的高低。
如果呼出的气体中含有乙醇蒸气,乙醇就会被三
氧化铬氧化成乙酸,橙色的三氧化铬被还原成绿色
硫酸铬。
酒驾检测
电子传感器、血液检测
组成、结构
乙醇与钠反应
乙醇氧化
