三叶鱼藤的鱼藤酮化学成分
鱼藤酮的杀虫方法,鱼藤酮的用量和杀虫种类.doc

鱼藤酮的杀虫方法,鱼藤酮的用量和杀虫种类
鱼藤酮作为最常用的杀虫剂之一,我们当然需要对它进行一些必要的了解,下面小编为大家分享鱼藤酮的杀虫方法和鱼藤酮用量以及杀虫种类:
鱼藤酮的杀虫方法
鱼藤酮广泛地存在于植物的根皮部,在毒理学上是一种专属性很强的物质,对昆虫尤其是菜粉蝶幼虫、小菜蛾和蚜虫具有强烈的触杀和胃毒两种作用。
早期的研究表明鱼藤酮的作用机制主要是影响昆虫的呼吸作用,主要是与NADH 脱氢酶与辅酶Q之间的某一成分发生作用。
鱼藤酮使害虫细胞的电子传递链受到抑制,从而降低生物体内的ATP水平最终使害虫得不到能量供应,然后行动迟滞、麻痹而缓慢死亡。
鱼藤酮用量和杀虫种类
蚜虫、飞虱、黄条跳甲、蓟马、黄守瓜、猿叶虫、菜青虫、斜纹夜
蛾、甜菜夜蛾、小菜蛾等。
防治菜青虫和蚜虫,亩用4%·鱼藤酮乳油80-120毫升,兑水30公斤喷雾。
防治小菜蛾用4%鱼藤酮乳油80-160毫升兑水30公斤喷雾。
防治斜纹夜蛾,亩用制剂4%鱼藤酮乳油80-120毫升兑水30公斤喷雾。
防治蔬菜跳甲,亩用制剂4%鱼藤酮乳油80-160毫升兑水30公斤喷雾。
通过小编的文章大家是否对鱼藤酮有了更多的了解呢?大家使用鱼藤酮的时候注意不能与碱性药剂混用。
鱼藤酮对家畜、鱼类和家蚕高毒,施药时要避免药液飘移到附近水池及桑树上。
红水廖A中易分解,应随配随用;应贮存于阴凉、黑暗处,避免高温、曝光,远离火源。
十字花科蔬菜的安全采收间隔期为3天。
鱼藤和毒鱼藤粉中的鱼藤酮化学分析方法

鱼藤和毒鱼藤粉中的鱼藤酮农药成分结晶法A试剂A.a纯化过的鱼藤酮溶解鱼藤酮于沸腾的CCl4,在冰箱或冰浴中于0-10℃冷却到鱼藤-CCl4的溶剂化物沉淀完全。
用瓷漏斗过滤,以冰冷的CCl4洗一到两次。
浓缩滤液,同前边一样再次进行结晶和过滤。
将结晶转移到烧杯中,加入约2倍体积的乙醇,加热近沸〔不必完全溶解结晶〕,冷至室温,用瓷漏斗过滤。
吸入空气,使乙醇尽可能地除去。
取出鱼藤酮,空气干燥,最后在105℃干燥1h。
在派热克斯玻璃仪器中测定熔点,纯品应为163-164℃〔母液可以被浓缩,结晶出鱼藤酮-CCl4溶剂化物。
此结晶可进一步纯化或保存起来供制备洗液用,或作为测定中透导结晶的籽晶用〕。
A.b鱼藤酮-CCl4溶剂化物从CCl4溶液中沉淀鱼藤酮,抽滤,空气干燥。
A.c鱼藤酮-CCl4洗液0℃下饱和的CCl4溶液,在使用过程中保持0℃。
A.d室温下用鱼藤酮饱和的乙醇。
A.e活性炭中性。
B溶液的制备B.a称取30g细粉状的根〔如果样品中含有的鱼藤酮的量大于7%,所取样品的量应使得200ml溶液中含有1.0-1.5g鱼藤酮〕和10g活性炭(e),放入500ml 锥形瓶中,加入300mlCHCl3,在室温下测量;塞紧塞子,放在振荡器上振荡4h以上,最好在间隙振荡下过夜〔或者在不断振荡下过夜〕。
用带有槽纹的滤纸,迅速将混合物滤进合适的瓶中,不要抽吸,在漏斗上盖上表面皿以防止蒸发损失。
塞紧瓶子并将滤液的温度调节到CCl3的原来的温度。
B.b交替提取法〔如果样品中含有的鱼藤酮的量大于7%,所取样品的量应使得200ml溶液中含有1.0-1.5g鱼藤酮〕和10g活性炭(e),放入500ml 锥形瓶中,加入300mlCHCl3,在室温下测量;塞紧塞子,放在振荡器上振荡4h以上,最好在间隙振荡下过夜〔或者在不断振荡下过夜〕。
用带有槽纹的滤纸,迅速将混合物滤进合适的瓶中,不要抽吸,在漏斗上盖上表面皿以防止蒸发损失。
塞紧瓶子并将滤液的温度调节到CCl3的原来的温度。
鱼藤酮的化学结构

鱼藤酮的化学结构
鱼藤酮是一种有机化合物,其化学结构如下:
鱼藤酮是一种环状化合物,由一个酮基和两个醇基组成。
它的分子式为C9H10O2,相对分子质量为150.17 g/mol。
鱼藤酮在化学中也被称为2,5-二甲基-4-巯基-3-戊酮,具有独特的化学特性和生物活性。
鱼藤酮是从一种名为鱼藤的植物中提取得到的。
这种植物主要生长在亚洲地区,尤其是中国和印度。
它是一种常见的中草药,被用于传统医学中治疗各种疾病。
鱼藤酮具有多种药理活性,包括抗炎、抗氧化和抗肿瘤活性。
它被认为具有潜在的抗癌作用,可以抑制肿瘤细胞的生长和扩散。
此外,鱼藤酮还被用于治疗风湿病、关节炎和其他炎症性疾病。
鱼藤酮的化学结构决定了它的生物活性。
酮基和醇基的存在使得鱼藤酮具有一定的亲水性,可以与生物体内的水分子发生作用。
此外,巯基的存在使得鱼藤酮具有一定的还原性,可以参与细胞内氧化还原反应。
鱼藤酮的化学结构还决定了它的稳定性和溶解性。
由于其环状结构的存在,鱼藤酮在一定条件下可以形成稳定的分子结构。
此外,鱼藤酮在水中的溶解度较高,这使得它可以更容易地与生物体内的其他分子发生相互作用。
鱼藤酮是一种具有独特化学结构和生物活性的有机化合物。
它的存在为研究和开发新的药物和治疗方法提供了潜在的机会。
通过深入研究鱼藤酮的化学结构和作用机制,我们可以更好地理解它的药理活性,并为人类健康的改善做出贡献。
论述鱼藤酮的杀虫机理

目录摘要 (1)关键词 (1)1 前言 (1)2 应用开发现状 (1)2.1 资源 (1)2.2 化学成分 (1)2.2.1 酚性类成分 (2)2.2.2 萜类化合物 (2)2.3 检测现状 (2)3 杀虫机理 (2)3.1 毒理学性质 (2)3.2 致死过程 (3)3.3 导致细胞凋亡 (4)4 对人体的潜在危害 (4)4.1 对人有致死性 (4)4. 2 造成环境污染 (4)4.3 对健康的危害 (4)参考文献: (5)论述鱼藤酮的杀虫机理XXX摘要:鱼藤酮是一种毒性极强的杀虫剂,本文论述了鱼藤酮的发展状况,分析了其化学成分,主要论述了其杀虫机理,也辩证的讨论了鱼藤酮对人类的潜在危害。
关键词:鱼藤酮杀虫机理农药1 前言鱼藤酮目前是一种比较完善的植物源生物杀虫剂,具有对害虫的广谱作用大,对天敌干扰少,在环境中易于降解,资源丰富等特点。
且可防治的有害生物种类多[1]。
对果树、蔬菜、茶叶、花卉及粮食作物上的数百种害虫有良好的防治效果,对哺乳动物低毒,对害虫天敌和农作物安全,是害虫综合治理上较为理想的杀虫剂,被广泛应用于蔬菜、果树等农作物和园林害虫的防治。
其市场发展空间极其广阔,为了顺应绿色食品发展的要求,近年来我国鱼藤酮产品的发展十分迅速[2]。
目前市场中销售制剂中大多是乳油,也有少数是可湿性粉剂。
本文就鱼藤酮的应用开发现状进行了论述,主要论述了鱼藤酮的毒理学性质,以及在及在长期的应用过程中对人和生态系统的潜在危害。
2 应用开发现状2.1 资源鱼藤酮的资源十分丰富,目前发现的总共有68种豆科植物含有鱼藤酮,主要分布于鱼藤属、尖荚豆属和灰叶属植物中。
生长于东南亚各国的豆科鱼藤属植物毛鱼藤,毛鱼藤的根、茎中的鱼藤酮含量都很丰富。
是目前我国鱼藤酮相关产业的主要原料。
此外,生长于非洲的山毛豆是鱼藤酮的一种新资源。
其植株的叶片、豆荚、根、种子、茎秆等多个部位都含有活性成分,是豆科植物中一种优秀的杀虫植物,对很多害虫具有生物活性。
鱼藤酮搽剂的消肿镇痛作用

差,不会发生胃潴留、十二指肠液返流和倾倒现象等并发症。
在H SV的基础上加做含胃窦粘膜在内的半胃切除,可以防止因迷切不完全和G细胞过度分泌胃泌素等所致的溃疡复发,去神经的胃体在胃窦浆肌层带动下,功能不会受到影响,可以避免H SV所致的胃潴留,上述结论已被动物试验所证实。
国外有人应用放射性核素和胃液胆酸测定,对H SV治疗消化性溃疡进行研究,证实十二指肠——幽门的正常关系对防止胆汁返流起重要作用[7]。
H SV由于消除了迷走神经的作用,胃腔接受适应性舒张调节减少,改变了胃内压力容积关系,进食后胃腔内压力高,可防止胆汁返流和加速胃排空。
至于H SV+H G术后胆汁返流低和胃粘膜病理变化较H SV轻的原因,可能是单纯H SV由于胃去神经后发生胃潴留,迷切不完全致胃酸没能降到应有的水平所致。
H SV+H G由于保留了含神经和血液供应的胃窦浆肌层,使胃腔的压力高,加速胃排空,而且在H SV的基础上加做含胃窦粘膜在内的半胃切除,使胃酸进一步降低。
胆汁返流、胃潴留和溃疡复发率也较H SV低。
关键词 消化性溃疡;术式评价 中图法分类号 R656.62参考文献1李仲科.保留幽门的胃切除术治疗溃疡病的进展.医师进修杂志,1993;16(1):432陈 斌,夏穗生.胆汁胰液在胃粘膜损伤中的作用.中华实验外科杂志,1994;11(3):1373StselV H C,E rik sson S,H u ldt B O et al.Sereen ing du ring 17years fo r gastric stump carcinom a.J Grstroen tero l,1991; 26(8):10204陈 杰,陈声乐.术后碱性返流性胃炎与癌前病变.国外医学:肿瘤分册,1992;19(3):1515John ston D.H igh ly selective vago tom y w ithou t a drainage D rocedu re in the treatm en t of duodenal u lcer.B r J Su rg, 1970;57(3):2896孙念绪,马宏敏.高选为切加保留胃窦浆肌层的半胃切除对防止胆汁返流的价值.中国普通外科杂志,1995;4(6):3457A ugerino s.D uodenogastric reflux befo re and after su rgical o r m edicsal therapy fo r duodenal u lcer.Am erican J Gas2 troen tero logy,1985;20(2):150(收稿:1996211207;修回:1997203211)(编辑 汪勤俭)鱼藤酮搽剂的消肿镇痛作用The an ti-i nf lammatory and analgesic effects of rotenone赵春景Ξ 梁 明ΞΞ 管智声33 (第三军医大学附属西南医院药剂科)重庆,400038 提 要 目的:观察鱼藤酮的消肿镇痛作用。
植物源农药鱼藤酮

植物源农药——鱼藤酮简介
剂型 2.5%、4%、7.5%乳油。
鱼藤酮是一种植物源广谱性中等毒性杀虫剂,对害虫具有触杀和胃毒作用,并有一定的驱避作用,药剂进入虫体后,抑制C-谷氨醛脱氢酶的活性,阻碍呼吸,而导致害虫死亡。
该药具有选择性,无内吸性,见光易分解,在空气中易氧化,在作物上残留时间短,持效期短,对环境无污染,对天敌安全。
适用作物及防治对象:鱼藤酮主要应用于十字花科蔬菜叶菜上,防治蚜虫。
使用技术:鱼藤酮主要用于喷雾,从害虫迅速发生初期开始用药,喷药应均匀、周到。
用于防治十字花科蔬菜、叶菜蚜虫时,每亩使用2.5%乳油100~150毫升或7.5%乳油30~40毫升,对水50~60公斤喷雾。
注意事项:不能与碱性药剂混用。
本剂对家畜、鱼类和家蚕高毒,施药时要避免药液飘移到附近水池及桑树上。
在水溶液中易分解,应随配随用。
应贮存于阴凉、黑暗处,避免高温、曝光,并远离火源。
十字花科蔬菜的安全采收间隔期为3天。
鱼藤酮杀虫活性及其应用研究

鱼藤酮杀虫活性及其应用研究摘要:鱼藤酮是一种广谱性杀虫剂,对害虫高效且不易产生抗药性。
本文对鱼藤酮的来源分布、杀虫活性及其在防治害虫的应用现状、存在问题和展望等几个方面进行了比较详细的论述。
关键字:鱼藤酮;杀虫活性;应用研究Abstract:Is a broad spectrum insecticide rotenone,resistance to pests is efficientand easy.This paper on the distribution of sources of rotenone,insecticidal activity and its application in pest status,problems and prospects,and other aspects are discussed in detail.Key words:rotenone;insecticidal activity;applied research前言鱼藤酮主要来源于豆科的鱼藤属、灰毛豆属、合生果属、鸡血藤属、紫槐属、黄檀属、毒鱼豆属和蝶豆属等植物,迄今已发现的鱼藤酮类化合物在74种以上[1]-[3]。
鱼藤酮是一种抑制神经组织和肌肉组织的选择性植物源杀虫剂,具有广谱的杀虫活性、良好的生态效益,并在自然界大量存在,而被广泛应用于蔬菜、果树等农作物害虫的防治[4]。
1 鱼藤酮的来源与分布鱼藤,别名毒鱼藤。
为豆科鱼藤属(Derris Lour.)豆科蝶形花亚科多年生木质藤本植物,产于亚洲热带和亚热带地区,如东印度半岛,菲律宾群岛,马来半岛等地。
我国有20多种,产于西南部经中部至东南部。
它是我国三大传统杀虫植物之一,其根部含有鱼藤酮,是主要的杀虫成分[5]。
2 鱼藤酮的产品和应用范围近年来,鱼藤酮的产品的使用呈逐年递增的趋势,从1991年广东省广州农药厂从化市分厂登记第一个鱼藤酮产品到现在,共有11家企业登记鱼藤酮产品18个厂次,其中原药2个,单剂4个,复配制剂12个。
鱼藤酮:防治蔬菜害虫农药.doc

鱼藤酮:防治蔬菜害虫农药
鱼藤酮是一种含在鱼藤植物根部的杀虫剂,鱼藤酮广泛地存在于植物的根皮部,在毒理学上是一种专属性很强的物质,对昆虫尤其是菜粉蝶幼虫、小菜蛾和蚜虫具有强烈的触杀和胃毒两种作用。
它的有机溶剂从鱼藤根中将鱼藤酮提取出来,再加工程2.5%,3.5%、7.5%的鱼藤酮乳油。
用于防治蔬菜的蚜虫、黄守瓜、黄条跳甲、蓟马、猿叶虫、菜青虫、二十八星瓢虫等,一般亩用2.5%乳油100毫升,3.5%乳油35-50毫升或7.5%乳油35毫升,兑水喷雾。
也可选用鱼藤混剂,使用方法如下:
1氰戊·鱼藤酮是鱼藤酮与氰戊菊酯复配的混剂,产品有7.5%、2.5%、1.3%乳油。
用于防治菜青虫和蚜虫,亩用2.5%乳油80-120毫升或1.3乳油100-120毫升,兑水喷雾.防治小菜蛾用7.5%乳油40-75毫升兑水喷雾。
21.8%阿维·鱼藤酮乳油由鱼藤酮和阿维菌素复配而成,用与防治小菜蛾,亩用制剂30-40毫升,兑水喷雾。
318%藤酮·辛硫磷乳油由鱼藤酮与辛硫磷复配而成。
用于防治斜纹夜蛾,亩用制剂60-120毫升兑水喷雾。
防治蔬菜蚜虫,亩用制剂40-60毫升兑水喷雾。
鱼藤酮原料-概述说明以及解释

鱼藤酮原料-概述说明以及解释1.引言1.1 概述鱼藤酮是一种重要的原料,被广泛应用于许多领域。
它是从鱼藤这种天然植物中提取得到的化合物,具有独特的化学特性。
鱼藤酮具有多种生物活性,如抗菌、抗炎、抗氧化等作用,使其在医药、化妆品、食品等领域中得到广泛的应用。
鱼藤酮的制备方法有多种,包括传统的水煎提取法、超声波提取法、微波提取法等。
其中,微波提取法是一种高效、简便的提取方法,可以显著提高鱼藤酮的产率。
鱼藤酮原料在许多行业中具有重要的地位。
在医药领域中,鱼藤酮常被用作中药配方的重要成分,具有镇痛、消肿等功效,可以用于治疗各种疾病。
同时,鱼藤酮也被广泛应用于化妆品领域,用于护肤品的研发和生产,具有紧致、抗皱等效果。
此外,鱼藤酮还被用作食品添加剂,在食品加工中起到增香、保鲜等作用。
鱼藤酮原料的发展前景非常广阔。
随着人们对健康和美容的重视程度不断提高,对天然、绿色原料的需求也越来越大。
而鱼藤酮作为一种天然植物提取物,符合这些需求,并且具有多种生物活性,具有广阔的市场前景。
未来,随着技术的不断发展和提升,鱼藤酮原料的开发和应用将会更加广泛,为人们的生活带来更多的福祉。
综上所述,鱼藤酮原料是一种重要的化学物质,具有多种生物活性,在医药、化妆品、食品等领域中得到广泛应用。
鱼藤酮原料的发展前景非常广阔,将为人们的生活带来更多的好处。
在接下来的章节中,我们将详细介绍鱼藤酮的定义和特性,以及其在各个应用领域中的具体应用和制备方法。
1.2 文章结构本文将按照以下结构进行阐述鱼藤酮原料的相关内容:1. 引言:在引言部分,将对鱼藤酮原料进行概述,介绍鱼藤酮原料的定义、特性以及其重要性和发展前景。
2. 正文:正文部分将分为三个小节,分别介绍鱼藤酮的定义和特性、鱼藤酮的应用领域以及鱼藤酮的制备方法。
2.1 鱼藤酮的定义和特性:在这一节中,将详细介绍鱼藤酮的化学结构、物理性质以及其在化学和医药领域的重要性。
2.2 鱼藤酮的应用领域:这一节将探讨鱼藤酮在食品、医药和化工等领域的广泛应用,包括其作为药物活性成分的应用,以及在食品添加剂和化工催化剂中的应用等。
鱼藤酮的晶体结构
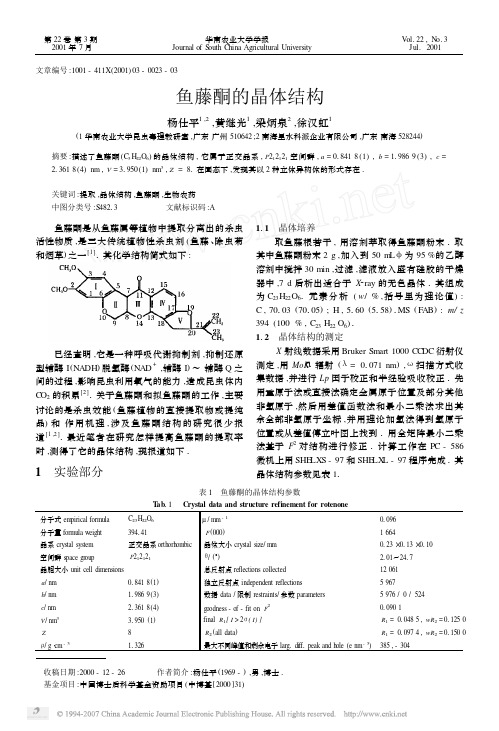
文章编号:1001-411X (2001)03-0023-03鱼藤酮的晶体结构杨仕平1,2,黄继光1,梁炳泉2,徐汉虹1(1华南农业大学昆虫毒理教研室,广东广州510642;2南海里水科派企业有限公司,广东南海528244)摘要:描述了鱼藤酮(C 3H 22O 6)的晶体结构,它属于正交晶系,P 212121空间群,a =018418(1),b =119869(3),c =213618(4)nm ,V =31950(1)nm 3,Z =81在固态下,发现其以2种立体异构体的形式存在1关键词:提取,晶体结构,鱼藤酮,生物农药中图分类号:S48213 文献标识码:A 鱼藤酮是从鱼藤属等植物中提取分离出的杀虫活性物质,是三大传统植物性杀虫剂(鱼藤、除虫菊和烟草)之一[1]1其化学结构简式如下: 已经查明,它是一种呼吸代谢抑制剂,抑制还原型辅酶I (NADH )脱氢酶(NAD +,辅酶I )~辅酶Q 之间的过程,影响昆虫利用氧气的能力,造成昆虫体内C O 2的积累[2]1关于鱼藤酮和拟鱼藤酮的工作,主要讨论的是杀虫效能(鱼藤植物的直接提取物或提纯品)和作用机理,涉及鱼藤酮结构的研究很少报道[1,2]1最近笔者在研究怎样提高鱼藤酮的提取率时,测得了它的晶体结构,现报道如下11 实验部分111 晶体培养取鱼藤根若干,用溶剂萃取得鱼藤酮粉末1取其中鱼藤酮粉末2g ,加入到50m L φ为95%的乙醇溶剂中搅拌30min ,过滤,滤液放入盛有硅胶的干燥器中,7d 后析出适合于X 2ray 的无色晶体1其组成为C 23H 22O 61元素分析(w /%,括号里为理论值):C ,70103(70105);H ,5160(5158)1MS (FAB ):m/z 394(100%,C 23H 22O 6)1112 晶体结构的测定X 射线数据采用Bruker Smart 1000CC DC 衍射仪测定,用MoKα辐射(λ=01071nm ),ω扫描方式收集数据,并进行Lp 因子校正和半经验吸收校正1先用重原子法或直接法确定金属原子位置及部分其他非氢原子,然后用差值函数法和最小二乘法求出其余全部非氢原子坐标,并用理论加氢法得到氢原子位置或从差值傅立叶图上找到1用全矩阵最小二乘法基于F 2对结构进行修正1计算工作在PC -586微机上用SHE LXS -97和SHE LX L -97程序完成1其晶体结构参数见表11表1 鱼藤酮的晶体结构参数T ab 11 Crystal d ata and structure refinement for rotenone分子式em pirical formula C 23H 22O 6μ/mm -101096分子量formula weight 394141F (000)1664晶系crystal system 正交晶系orthorhombic晶体大小crystal size/mm0123×0113×0110空间群space group P 212121θ/(°)2101~2417晶胞大小unit cell dimensions总反射点reflections collected 12061a /nm 018418(1)独立反射点independent reflections 5967b /nm 119869(3)数据data /限制restraints/参数parameters5976/0/524c /nm 213618(4)g oodness -of -fit on F 2010901V /nm 331950(1)final R 1[I >2σ(I )]R 1=010485,wR 2=011250Z8R 2(all data )R 1=010974,wR 2=011500ρ/g ・cm -311326最大不同峰值和剩余电子larg 1diff 1peak and h ole (e nm -3)385,-304 收稿日期:2000-12-26 作者简介:杨仕平(1969-),男,博士1基金项目:中国博士后科学基金资助项目(中博基[2000]31) 第22卷第3期 2001年7月 华南农业大学学报Journal of S outh China Agricultural University V ol.22,N o.3 Jul.2001 2 结果和讨论鱼藤酮的晶体结构如图1所示,它是由2个结构独立,带有不同键长和键角的C23H22O6分子单元所构成1其键长和键角见表21按图1的结构简式,鱼藤酮分子中的C7、C8和C21是手性碳原子,再考虑环的构象,应该出现多种不同的异构体化合物1而分析其结构发现,2个独立的结构分子单元是存在的互为立体异构体(图1和图2)1而造成这种结果的原因认为是环III采取不同的构象(六元环,船式或椅式)的结果1Y amam oto指出[3],鱼藤酮在C7、C8和C20的氢原子全都处在β位;结构分析证明C7、C8的氢原子处在β位,而C20的氢原子则处在α位1该结果与H organ[4]指出的相一致1在2种立体异构体中,由于环I和I V的苯环的双键作用,使得环I、II和I V、V几乎分别处在一个平面内;而环III的不同构象,则导致了在各个单元中的2个平面分别垂直(图2)1图2更清楚的看出,环I、II和I V、V构成的3个平面互相垂直,类似于三维空间互相垂直的3个平面1表2 鱼藤酮的键长和键角T ab12 Bond lengths and bond angles for rotenone异构体1 Steveois omeride1异构体2 Steveois omeride2键长bond lengths/nm键长bond lengths/nmO(1)-C(20)011421(5)O(1)-C(1)011370(5)O(7)-C(43)011444(6)O(7)-C(24)011376(5) O(2)-C(3)011400(5)O(2)-C(4)011420(5)O(8)-C(27)011424(5)O(8)-C(26)011381(5) O(3)-C(6)011365(5)O(3)-C(5)011432(5)O(9)-C(28)011434(6)O(9)-C(29)011376(5) O(4)-C(10)011365(5)O(4)-C(9)011465(7)O(10)-C(32)011476(6)O(10)-C(33)011365(6) O(5)-C(14)011217(6)O(6)-C(19)011424(5)O(11)-C(37)011218(6)C(41)-O(12)011385(5) C(18)-O(6)011372(5)C(1)-C(2)011376(6)O(12)-C(42)011440(5)C(24)-C(25)011360(6) C(2)-C(3)011391(6)C(18)-C(1)011412(6)C(24)-C(41)011400(6)C(26)-C(25)011394(6) C(4)-C(5)011500(6)C(3)-C(16)011364(6)C(26)-C(39)011381(6)C(28)-C(27)011504(6) C(6)-C(7)011386(6)C1(5)-C(15)011514(6)C(28)-C(38)011522(7)C(29)-C(36)011409(7) C(7)-C(10)011401(6)C(6)-C(13)011403(6)C(29)-C(30)011370(7)C(30)-C(31)011503(7) C(8)-C(9)011529(6)C(7)-C(8)011491(7)C(30)-C(33)011368(6)C(32)-C(31)011558(6) C(11)-C(10)011369(6)C(9)-C(21)011460(1)C(32)-C(44)011495(6)C(33)-C(34)011380(7) C(13)-C(12)011422(6)C(11)-C(12)011381(6)C(34)-C(35)011359(8)C(36)-C(37)011474(8) C(15)-C(14)011536(6)C(13)-C(14)011458(6)C(36)-C(35)011408(6)C(38)-C(37)011488(7) C(16)-C(17)011400(6)C(16)-C(15)011518(6)C(39)-C(38)011518(6)C(39)-C(40)011405(6) C(18)-C(17)011382(6)C(21)-C(22)011510(2)C(41)-C(40)011379(6)C(44)-C(45)011493(7) C(21)-C(23)011282(2)C(44)-C(46)011297(6)键角bond angles/(°)键角bond angles/(°)C(6)-O(3)-C(5)11613(4)C(3)-O(2)-C(4)11518(3)C(26)-O(8)-C(27)11719(4)C(33)-O(10)-(32)10817(3)C(3)-C(16)-C(17)11813(4)C(3)-C(16)-C(15)12113(4)C(25)-C(24)-O(7)12510(4)C(25)-C(24)-C(41)11917(4)C(17)-C(16)-C(15)12014(3)O(3)-C(6)-C(7)11712(4)O(7)-C(24)-C(41)11513(4)O(10)-C(33)-C(30)11312(4)O(3)-C(6)-C(13)12213(4)C(7)-C(6)-C(13)12015(4)O(10)-C(33)-C(34)12135(4)C(30)-C(33)-C(34)12312(5)C(16)-C(3)-O(2)12313(4)C(16)-C(3)-C(2)12212(4)O(12)-C(41)-C(40)12319(4)O(12)-C(41)-C(24)11610(4)O(2)-C(3)-C(2)11415(3)O(6)-C(18)-C(17)12515(4)C(40)-C(41)-C(24)12011(4)C(30)-C(29)-O(9)11715(5)O(6)-C(18)-C(1)11418(4)C(17)-C(18)-C(1)11916(4)C(30)-C(29)-C(36)12017(4)O(9)-C(29)-C(36)12119(4)C(6)-C(13)-C(12)11814(4)C(6)-C(13)-C(14)12112(4)O(8)-C(26)-C(39)12412(4)O(8)-C(26)-C(25)11418(4)C(12)-C(13)-C(14)12012(5)C(6)-C(7)-C(10)11717(5)C(39)-C(26)-C(25)12110(4)C(33)-C(30)-C(29)11817(5)C(6)-C(7)-C(8)13215(4)C(10)-C(7)-C(8)10917(4)C(33)-C(30)-C(31)10916(4)C(29)-C(30)-C(31)13117(4)C(10)-O(4)-C(9)10812(4)C(2)-C(1)-O(1)12511(4)O(10)-C(32)-C(44)11114(4)O(10)-C(32)-C(31)10516(4)C(2)-C(1)-C(18)11913(4)O(1)-C(1)-C(18)11516(3)C(44)-C(32)-C(31)11317(4)C(24)-C(25)-C(26)12013(4)C(18)-C(17)-C(16)12019(4)C(5)-C(15)-C(16)10818(3)C(29)-C(36)-C(35)11718(5)C(29)-C(36)-C(37)12013(4)C(5)-C(15)-C(14)11116(3)C(16)-C(15)-C(14)11211(4)C(35)-C(36)-C(37)12115(5)C(35)-C(34)-C(33)11718(5)C(10)-C(11)-C(12)11615(4)C(1)-C(2)-C(3)11916(4)C(26)-C(39)-C(40)11815(4)C(26)-C(39)-C(38)11916(4)O(2)-C(4)-C(5)11117(3)O(5)-C(14)-C(13)12314(4)C(40)-C(39)-C(38)12210(4)C(41)-C(40)-C(39)12013(4)O(5)-C(14)-C(15)12110(4)C(13)-C(14)-C(15)11515(5)O(9)-C(28)-C(27)10712(4)O(9)-C(28)-C(38)11210(4)O(3)-C(5)-C(4)11014(3)O(3)-C(5)-C(15)11410(3)C(27)-C(28)-C(38)11016(4)C(37)-C(38)-C(39)11213(4)C(4)-C(5)-C(15)11015(4)C(11)-C(12)-C(13)12211(5)C(37)-C(38)-C(28)11016(4)C(39)-C(38)-C(28)10816(4)C(11)-C(10)-O(4)12314(4)C(11)-C(10)-C(7)12416(4)C(34)-C(35)-C(36)12118(5)O(8)-C(27)-C(28)11416(4)O(4)-C(10)-C(7)11119(5)C(7)-C(8)-C(9)10210(4)C(30)-C(31)-C(32)10213(3)O(11)-C(37)-C(36)12217(5)C(21)-C(9)-O(4)10917(6)C(21)-C(9)-C(8)11516(5)O(11)-C(37)-C(38)12210(5)C(36)-C(37)-C(38)11512(5)O(4)-C(9)-C(8)10717(4)C(23)-C(21)-C(9)12310(1)C(24)-O(7)-C(43)11614(4)C(46)-C(44)-C(45)12319(5)C(18)-O(6)-C(19)11617(3)C(1)-O(1)-C(20)11711(3)C(46)-C(44)-C(32)12312(5)C(45)-C(44)-C(32)11219(4)C(23)-C(21)-C(22)12810(1)C(9)-C(21)-C(22)10910(1)C(41)-O(12)-C(42)11710(4)C(29)-O(9)-C(28)11611(4) 42 华 南 农 业 大 学 学 报第22卷图1 鱼藤酮的晶体结构(为了清楚,H 原子没有标出)Fig 11 Ortep view of the rotenone (omitting the H atoms for clarity )图2 鱼藤酮的2种立体异构体Fig 12 Ortep view for tw o stereois omerides of rotenone参考文献:[1] 黄瑞纶1杀虫药剂学[M ]1北京:财政经济出版社,195613771[2] 山本出,深见顺一1农药的生物活性和作用机制及今后的农药[M]1尚尔才,沙家骏译1北京:化学工业出版社,199011751[3] Y AM AM OT O I 1M ode of action of pyrethroids ,nicotinoids ,and rotenoids[J ]1Ann Rev Ent ,1970,15:257-2721[4] H ORG AN D J ,SI NGER T P ,C ASI DA J E 1S tudies on therespiratory chain -linked reduced nicotinamide adeine dinu 2cleotide dehydrogenase [J ]1J Bio Chem ,1968,243:834-8431Crystal Structure of R otentoneY ANG Shi 2ping 1,2,H UANGJi 2guang 1,LI ANG Bing 2quan 2,X U Han 2hong 1(1Lab 1of Insect T oxicology ,S outh China Agric 1Univ 1,G uangzhou 510642,China ;2F opai Enterprises C o 1LT D ,Nanhai 528244,China )Abstract :R otentone was characterized by single 2crystal X 2ray analysis 1Crystal data :Orthorhombic ,space groupP 212121,a =0184178(1),b =119869(3),c =213618(4)nm ,V =31950(1)nm 3,Z =81The crystal structure shows that there are tw o stereois omerides of rotenone in s olid state 1K eyw ords :extract ;crystal structure ;rotentone ;biopesticide【责任编辑 周志红】52第3期杨仕平等:鱼藤酮的晶体结构 。
鱼藤酮质量标准

鱼藤酮质量标准
鱼藤酮的质量标准包括以下方面:
1. 外观性状:鱼藤酮应为无色斜方片状结晶。
2. 熔点:鱼藤酮的熔点为244.6±30.2°C。
3. 精确质量:39
4.141632。
4. PSA:63.22。
5. LogP:4.65。
6. 蒸汽压:0.0±1.5 mmHg at 25°C。
7. 折射率:1.591。
此外,鱼藤酮的储存条件应为塑料袋密封包装,贮存于阴凉、干燥通风处,不得与食物或饲料共贮,勿使孩童接近。
同时,鱼藤酮性质不稳定,在有日光、空气、高温、水分、碱性物质等存在下,易分解失效。
请注意,这些标准可能因不同的生产厂商、不同的批次而有所差异。
因此,在使用鱼藤酮时,建议参考具体产品的说明书和质量标准,以确保其安全、有效地使用。
鱼藤酮的化学结构

鱼藤酮的化学结构
鱼藤酮,又称鱼藤酮素,是一种天然的有机化合物,其化学结构具有独特的特点和功能。
鱼藤酮的分子式为C30H44O3,相对分子质量为452.66。
鱼藤酮的分子结构由四个环状结构组成,分别是A、B、C和D环。
A环是一个苯环,B环是一个呋喃环,C环是一个十字花环,D环是一个环戊烷。
这种特殊的结构赋予了鱼藤酮独特的性质和活性。
鱼藤酮是一种具有多种生物活性的天然产物。
它在植物中广泛存在,尤其在鱼藤科植物中含量较高。
鱼藤酮具有抗氧化、抗炎、抗菌、抗肿瘤等多种药理活性,因此被广泛应用于药物研发和临床治疗领域。
鱼藤酮的抗氧化活性使其具有对抗自由基损伤的能力,可以保护细胞免受氧化应激的伤害。
它还可以抑制炎症反应,减轻炎症症状,对于治疗炎症性疾病具有重要作用。
鱼藤酮还具有抗菌活性,可以抑制多种细菌的生长和繁殖,对于治疗感染性疾病具有一定的疗效。
此外,鱼藤酮还表现出抗肿瘤活性,可以抑制肿瘤细胞的增殖和转移,对于肿瘤的治疗具有潜在的应用价值。
鱼藤酮作为一种天然产物,在药物研发和临床应用中具有重要的地位。
研究人员通过对鱼藤酮的结构和活性进行深入研究,不断挖掘
其潜在的药理作用,为新药的开发提供了重要的参考。
鱼藤酮作为一种具有多种生物活性的天然产物,其化学结构的独特性赋予了其特殊的功能和药理活性。
通过深入研究和开发利用,鱼藤酮有望在药物研发和临床治疗中发挥更大的作用,为人类的健康做出贡献。
鱼藤酮微胶囊剂及其制备方法[发明专利]
![鱼藤酮微胶囊剂及其制备方法[发明专利]](https://img.taocdn.com/s3/m/e716432f58f5f61fb63666e0.png)
专利名称:鱼藤酮微胶囊剂及其制备方法专利类型:发明专利
发明人:徐汉虹,黄继光,江定心,周利娟申请号:CN03139959.2
申请日:20030728
公开号:CN1486610A
公开日:
20040407
专利内容由知识产权出版社提供
摘要:本发明涉及以鱼藤酮为主要杀虫成分配制的农药制剂及其制备方法。
具体地是以鱼藤酮晶体粉末或含鱼藤酮的提取物为原料制造鱼藤酮微胶囊及其制备方法,通过界面聚合法,以鱼藤酮晶体粉末或含鱼藤酮的提取物为囊芯,制成鱼藤酮微胶囊剂。
本制剂具有防虫效果好,持效期长,制备工艺简单,生产成本低等优点。
申请人:华南农业大学
地址:510642 广东省广州市天河区五山华南农业大学
国籍:CN
更多信息请下载全文后查看。
鱼藤酮的制造方法_概述说明以及解释

鱼藤酮的制造方法概述说明以及解释1. 引言1.1 概述本文旨在探讨鱼藤酮的制造方法,对其进行综述和解释。
鱼藤酮是一种具有广泛应用潜力的有机化合物,在医药领域和化妆品领域都有重要的应用。
本文将介绍鱼藤酮的定义、特点以及常见的制造方法,并探讨其在不同领域的应用。
1.2 文章结构文章主要分为五个部分,分别是引言、鱼藤酮的制造方法、鱼藤酮的应用领域、现有问题和挑战,以及结论与展望。
1.3 目的本文旨在全面了解和描述鱼藤酮的制造方法,并对其应用领域、现有问题以及未来发展方向进行评估和探讨。
通过该文章,读者能够了解到当前关于鱼藤酮制造方法研究的最新进展,并认识到相关问题所面临的挑战。
此外,文章还会给予对于改善现有问题和提出改进建议。
2. 鱼藤酮的制造方法:2.1 定义和特点:鱼藤酮是一种从植物中提取的化合物,具有多种生物活性和药理作用。
其化学结构为苯环加上一个乙二醇基团,并且存在于不同植物种类中。
鱼藤酮被广泛应用于药物领域和化妆品领域,并且在其他应用领域也有潜力。
2.2 常见的制造方法:目前,根据已有的研究成果,常见的鱼藤酮制造方法包括以下几种:a) 植物提取法:这是最常用和传统的制造方法之一。
通过采集含有高浓度鱼藤酮的特定植物材料,如秋水仙或爬山虎等,然后进行溶剂提取,得到含有高纯度鱼藤酮的溶液。
这个过程需要合适的溶剂选择、提取温度和时间控制等步骤。
b) 化学合成法:这是一种人工合成鱼藤酮的方法,通过化学反应将原料转化为目标产物。
具体而言,可以使用苯环化合物和乙二醇的反应来制造鱼藤酮。
这种方法需要合成路线的设计和优化,以及合适的催化剂和反应条件。
c) 生物发酵法:这是一种利用微生物进行鱼藤酮生产的方法。
通过选择和改良适宜的微生物菌株,并提供适宜的培养基,通过发酵过程使菌株产生并分泌鱼藤酮。
这种方法通常需要对发酵条件、培养基成分等进行优化,以提高产量和纯度。
2.3 制造方法的优缺点:不同的制造方法各有优缺点,具体取决于目标产量、成本效益、纯度要求等因素。
鱼藤酮 葡萄糖代谢

鱼藤酮葡萄糖代谢
鱼藤酮(ketohexokinase)是一种参与葡萄糖代谢的酶,它参
与葡萄糖的代谢路径中的第一步,将葡萄糖转化为葡萄糖-6-
磷酸。
葡萄糖-6-磷酸随后进一步代谢通过糖解途径产生能量
或通过糖原合成途径转化为糖原,以便在需要时供给能量。
葡萄糖代谢是维持机体能量供应的重要过程,在身体中广泛发生,包括在肝脏、肌肉和脑中。
鱼藤酮通过催化葡萄糖和ATP反应生成葡萄糖-6-磷酸和ADP,在这个过程中消耗了一个分子的ATP。
此酶在肝脏和肾脏中
高度表达,同时也在其他组织中存在,如肌肉、胰岛β细胞和肠道。
葡萄糖代谢是机体内能量供给的主要途径之一。
鱼藤酮作为葡萄糖代谢的关键酶之一,参与葡萄糖的初步代谢,确保能量产生和储存的平衡。
不过,葡萄糖代谢紊乱可能导致一系列代谢性疾病,如糖尿病、肥胖症等。
三叶鱼藤的鱼藤酮化学成分

© 1994-2007 China Academic Journal Electronic Publishing House. All rights reserved.
致谢 :中国协和医科大学药物研究所贺文义教授代测核磁共振 谱 ,再帕尔教授课题组代测质谱 。
参考文献
[ 1 ] 国家中医药管理局 1中华本草 1第七分册 1上海 :上海 科技出版社 , 1999: 84128421
[ 2 ] Phan T T, HughesM A , Cherry GW 1 Effects of an aque2
化合物 Ⅷ:浅黄色粉末 , mp206~207℃,盐酸 2镁 粉反 应 阳 性 ; E I2M S m / z ( % ) : 302 [ M ] + 1 H 2NMR (DM SO 2d6 )δ: 5110 ( 1H , d, J = 1115 Hz, H 23 ) , 5177 (1H , d, J = 615Hz, H 22) , 5186 ( 1H , d, J = 210Hz, H 2 6) , 5190 ( 1H , d, J = 210Hz, H 28 ) , 6195 ( 2H , d, J = 815Hz) , H 23′, 5′) , 7142 ( 2H , d, J = 815Hz, H 22′, 6′) ;碳谱数据见表 1。根据以上理化性质及光谱数 据 ,对照文献〔9〕,鉴定该化合物为 3, 5, 72三羟基 24′2 甲氧 基 二 氢 黄 酮 醇 , 即 二 氢 山 柰 素 ( dihydro2 kaempferide) 。
( 3H , s, OCH3 ) ; 13 C2NMR ( CDC l3 , 124MHz)δ: 10911 (C21a) , 11011 ( C21 ) , 14411 ( C22 ) , 14910 ( C23 ) ,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
stances of brazilian p ropolis1 Chem Pharm Bull, 2003, 51
(8) : 98429851
(2006 - 11 - 27收稿 )
三叶鱼藤的鱼藤酮化学成分
徐鲁荣 1 ,李 杉 1 ,吴 军 2 ,张 偲 2 (11上海大学生命科学学院 ,上海 200444; 21中国科学院南海海洋研究所 、广东省海洋药物重点实验室 ,广 东广州 510301)
致谢 :中国协和医科大学药物研究所贺文义教授代测核磁共振 谱 ,再帕尔教授课题组代测质谱 。
参考文献
[ 1 ] 国家中医药管理局 1中华本草 1第七分册 1上海 :上海 科技出版社 , 1999: 84128421
[ 2 ] Phan T T, HughesM A , Cherry GW 1 Effects of an aque2
China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China) Abstract Five rotenoids named dehydrodeguelin, dehydrorotenone, 12a2hydroxy rotenone, tephrosin and 12αβ2hydroxyrot22′2
1 H 2NMR 和 13 C2NMR 用 B ruker AVANCE 500MHz核磁共振波谱仪测定 ; 制备色谱用 W aters 600E半 制 备 型 高 效 液 相 色 谱 仪 ; E I2MS 用 岛 津 QP25050A 及 QP22010 型气相色谱 2质谱仪联用仪 测定 ;柱层析用硅胶 ( 2002300 目 )为青岛海洋化工 厂生产 ,试剂为天津化百世化工有限公司生产 ;三叶 鱼藤于 2002年 10月采自海南省三亚市 ,由中科院 南海海洋研究所海洋生物实验室张偲教授鉴定 。 2 提取与分离
三叶鱼藤地上部分 10 kg,粉碎 ,分别用 95%乙 醇 , 50%乙醇加热回流提取 。提取物分别用石油醚 、 乙酸乙酯萃取 3次 。乙酸乙酯提取物 150 g进行硅 胶柱层析 ,以 CHCl3 2CH3OH (99∶1~1∶1)梯度洗脱 , 其中 Frl进行硅胶柱层析 ,正己烷 2乙酸乙酯 (20∶1~ 1∶1)梯度洗脱 ,其中第 63个流分经重结晶得化合物 1 (8 mg) ;第 68 ~76 个流分合并 ,经重结晶得化合 物 2 (23 mg) ;第 89~96个流分合并 ,经反复硅胶柱 层析 , sephadex LH 220 柱层析 ,反相柱层析 ,得粗品 500 mg, HPLC 制 备 ( C18 , M eOH 2H2 O ~71 ∶29, flow rate 7 m l/m in)得化合物 3 ( 30 mg) 和化合物 4 ( 20 mg) 。 Fr3进行硅胶柱层析 [氯仿 2乙酸乙酯 ( 20∶1~ 1∶1) ]、LH 220柱层析 、制备高效液相色谱得化合物 5。 3 结构鉴定
中药材 Journal of Chinese M edicinal M aterials 第 30卷第 6期 2007年 6月
·661·
三叶鱼藤 (D erris trifolia ta)为多年生 ,藤本或直 立灌木 ,属豆科鱼藤属植物 ,原产亚洲热带及亚热带 地区 ,以印度尼西亚各岛 、菲律宾群岛 、马来半岛 、台 湾和海南为著名 。该植物根 、茎 、叶均有毒 ,民间常 用作捕鱼或杀虫剂 。
基金项目 :国家基础研究重大项目前期研究专项 (2005CCA04800) ;上海大学选拔优秀青年教师基金
© 1994-2007 China Academic Journal Electronic Publishing House. All rights reserved.
human dermal fibroblasts and ep idermal kerationocytes a2
gainst hydrogen peroxide and hypoxanthine2xanthine oxi2
dase induced damage1 Burns, 2001, 27 (4) : 31923271 [ 4 ] 袁经权 ,杨峻山 ,缪剑华 1飞机草化学成分研究 1中草
enonic acid were isolated from aerial parts of D erris trifolia ta1 A ll these compounds were isolated from this p lant for the first time1 Key words Legum inosae; D erris trifolia ta; Rotenoids
·660·
中药材 Journal of Chinese M edicinal M aterials 第 30卷第 6期 2007年 6月
9147 ( 3H , br s, 7, 4′, 3′2OH ) , 7141 ( 1H , dd, J = 210Hz, 814Hz, 6′2H ) , 7139 ( 1H , d, J = 210Hz, 2′2H ) , 6187 ( 1H , d, J = 814Hz, 5′2H ) , 6167 ( 1H , s, 32H ) , 6143 ( 1H , d, J = 210Hz, 82H ) , 6117 ( 1H , d, J = 210Hz, 62H ) ;碳谱数据见表 1。以上数据与文献〔8〕 报道木犀草素一致 ,故鉴定为木犀草素 ( luteolin) 。
摘要 从三叶鱼藤的乙酸乙酯提取部位分离得到五个鱼藤酮类化合物 ,分别为 dehydrodeguelin, dehydrorote2 non, 12a2hydroxy rotenone, tephrosin, 122hydroxyrot22′2enonic acid。以上化合物均为从该植物中首次分离得到 。
( 3H , s, OCH3 ) ; 13 C2NMR ( CDC l3 , 124MHz)δ: 10911 (C21a) , 11011 ( C21 ) , 14411 ( C22 ) , 14910 ( C23 ) ,
10014 (C24 ) , 14613 ( C24a ) , 6418 ( C26 ) , 15612 ( C2
化合物 1:黄色针状结晶 (丙酮 ) , E I2M S (m / z) 392 [M ] + ,结合 1 H 2NMR , 13 C2NMR 和 DEPT可确定 分子式为 C23 H20 O6 。1 H 2NMR ( CDC l3 , 500 MHz)δ:
8145 (1H , s, H 21) , 6155 ( 1H , s, H 22 ) , 6187 ( 1H , d, J
鱼藤属植物富含类型广泛的黄酮类化合物〔1〕, 包括黄酮 ,异黄酮 ,二氢黄酮 ,二氢异黄酮 ,查尔酮 , 黄酮苷 ,鱼藤酮等 。我们对三叶鱼藤的乙酸乙酯部 位进行色谱分离 ,得到五个鱼藤酮类化合物 ,分别 为 : dehydrodeguelin ( 1 ) ; dehydrorotenone ( 2 ) ; 12a2 hydroxyrotenone (3) , tephrosin (4) , 12αβ2hydroxylrot2 2′2enonic acid (5) 。这五个化合物均为首次从该植 物中分离得到 。 1 仪器 、试剂与材料
ous extract from the leaves of Ch rom olaena odora ta on the
p roliferation of human keratinocytes and on their m igration
in an in vitro model of reep ithelialization1 Wound Repair
= 815Hz, H 210 ) , 8104 ( 1H , d, J = 815Hz, H ቤተ መጻሕፍቲ ባይዱ11 ) , 6177 ( 1H , d, J = 1010Hz, H 24′) , 5173 ( 1H , d, J = 1010Hz, H 25′) , 1150 ( 6H , s, H 27′, 8′) , 3187 /3196
药 , 2005, 36 (12) : 1771217731 [ 5 ] 王欣 ,汪红 ,王强 1加杨雄花序的化学成分研究 1中国
药科大学学报 , 2000, 31 (3) : 17121731 [ 6 ] 于德泉 ,杨峻山 1分析化学手册 1第二版 1第七分册 1
核磁共振波谱分析 1北京 :化学工业出版社 , 1999: 8201 [ 7 ] 张晓璐 ,彭树林 ,王明奎 ,等 1聚花过路黄化学成分的研
究 1药学学报 , 1999, 34 (11) : 83528381 [ 8 ] 吉海锋 ,陈若芸 ,孙玉华 ,等 1香青兰化学成分的研究 1
中国中药杂志 , 2004, 29 (3) : 23222341
[ 9 ] A laa M N , Mohamed A E1 Cyclodextrin2enclosed sub2
Regen, 2001, 9 (4) : 30523131
[ 3 ] Thang P T, Patrick S, Teik L S, et al1 Anti2oxidant effects
of the extracts from the leaves of Ch rom olaena odora ta on
6a) , 15111 ( C27a) , 11015 (C28) , 15712 (C29) , 11417
(C210 ) , 13016 ( C211 ) , 11815 ( C211a ) , 17414 ( C2 12 ) , 11118 ( C212a ) , 11514 ( C24′) , 12615 ( C25′) , 7718 ( C26′) , 2811 ( C27′/8′) , 5613 /5519 ( 2OCH3 ) 。 波谱数据与参考文献〔2〕一 致 , 鉴 定为 去氢 鱼藤 素 ( dehydrodeguelin) 。
