中山大学医学院——2、无机化学(上)期末考试试卷
《无机化学》期末考试试卷

《无机化学》期末考试试卷一、单选(共40小题,每题2分,共80分。
)(题下选项可能多个正确,只能选择其中最佳的一项。
)1.下列溶液中与血浆等渗的是:() [单选题] *A.90g/L的NaCl溶液B.9g/L的NaCl溶液(正确答案)C.100g/L的葡萄糖溶液D.50g/L的NaHCO3溶液E.20g/L的乳酸钠溶液2.下列溶液能使红细胞发生皱缩的是:() [单选题] *A.1.5g/L的NaHCO3溶液B.1.0 g/L的NaCl溶液C.9g/L的NaCl溶液D.100g/L的葡萄糖溶液(正确答案)E.20g/L的乳酸钠溶液3.欲使半透膜两侧的溶液不发生渗透现象的条件是:() [单选题] *A.两溶液酸度相等B.两溶液体积相等C.两溶液的物质的量浓度相等D.两溶液的渗透浓度相等(正确答案)E.两溶液温度一致4.配制300ml、0.10mol/L的NaOH溶液,需要称取固体NaOH(M=40)的质量为:() [单选题] *A.1.2g(正确答案)B.1.2mgC.4.0gD.4.0mgE.40g5.在下列单位中,哪一个是物质的量浓度的单位:() [单选题] *A.g·LB.g·molC.g·mLD.mol·L(正确答案)E.16.对于物质的体积分数,下列表示正确的是:() [单选题] *A.φ=VB/V(正确答案)B.ρ=mB/VC.wB=mB/mD.CB= nB/VE.E.xB=mB/M7.在生活中,常用75℅酒精消毒,这个浓度是指:() [单选题] *A.物质的量浓度B.质量浓度C.体积分数(正确答案)D.质量分数E.摩尔质量浓度8.溶液、胶体和悬浊液这三种分散系的根本区别是() [单选题] *A.是否是大分子或离子的聚集体B.能否透过滤纸或半透膜C.是否均匀、稳定、透明D.分散质微粒直径的大小(正确答案)E.没有区别9.胶粒稳定的主要原因是:() [单选题] *A.布朗运动B.胶粒带电(正确答案)C.溶剂化膜D.丁达尔现象E.渗透现象10.某可逆反应的正反应为吸热反应,欲使平衡向逆反应方向移动,可采取的措施是:() [单选题] *A.升高温度B.降低温度(正确答案)C.加催化剂D.加压E.减压11.有关催化剂的叙述不正确的是() [单选题] *A.能改变化学反应的历程B.能降低反应的活化能C.能使不反应的物质相互发生反应(正确答案)D.反应前后质量没有发生变化E.催化作用是化学作用12.增加气体反应物的压强能加快化学反应速率的原因是() [单选题] *A.增加了反应体系内分子总数B.增加了反应体系内活化分子数C.降低了化学反应的活化能D.增加了单位体积的活化分子数(正确答案)E.减少了单位体积的活化分子数13.一些药物需要保存在冰箱中,以防其变质,其主要作用是() [单选题] *A.避免与空气接触B.保持药物干燥C.避免药物受光照D.降低温度,减缓药物变质的反应速率(正确答案)E.以上都不对14.若用NH3和HCl来配置缓冲溶液,缓冲溶液的抗碱成分是:() [单选题] *B.HClC.NH4Cl(正确答案)D.NH3E.OH-15.人体血液中最重要的缓冲对的抗酸成分是:() [单选题] *A.H3PO4B.H2PO4-C.HCO3-(正确答案)D.H2CO3E.H2O16.正常人血浆的pH范围是:() [单选题] *A.7~8B.7~7.5C.7.5~8D.7.45~7.55E.7.35~7.45(正确答案)17.下列化合物中,属于两性物质的是:() [单选题] *A.HClB.NaOHC.H2O(正确答案)D.NH4Cl18.根据酸碱质子理论,下列叙述不正确的是:() [单选题] *A.H2CO3和CO32-不是共轭酸碱对B.酸越强,其共轭碱也越强(正确答案)C.酸失去质子转变成共轭碱D.酸碱反应的实质是质子的转移E.碱得到质子生成其共轭酸19.当pH=4的时候,则 [H+]的浓度为:() [单选题] *A.5B.104C.10-4(正确答案)D.4E.1020.下列酸中,属于一元弱酸的是:() [单选题] *A.HAc(正确答案)B.H2CO3C.H3PO4D.H3BO3E.H2SO321.同离子效应将使弱电解质的电离平衡:() [单选题] *A.左移(正确答案)C.不移动D.无法确定E.以上都对22.室温下,1.0mol/L氨水中,水的离子积常数为() [单选题] *A.1.0×10-10B.1.0×10-4C.1.0×10-14(正确答案)D.1.0×10-7E.2.0×10-723.下列溶液中酸性最强的是() [单选题] *A.pH=5B.pH=2C.[H+]=0.1mol/L(正确答案)D.[OH-]=10-2mol/LE.[OH-]=10-7mol/L24.在含有CrO42-和Cl-的混合溶液中加入AgNO3溶液,先有白色沉淀生产,后有砖红色沉淀生成,这种现象称为:() [单选题] *A.分步沉淀(正确答案)B.沉淀的生成C.沉淀是转化D.沉淀的溶解E.以上都不对25.在AgCl饱和溶液中加入NaCl,使其溶解度减小的现象称为() [单选题] *A.盐效应B.同离子效应(正确答案)C.缓冲效应D.配位效应E.沉淀效应26.沉淀生成的必要条件是() [单选题] *A.Ip>Ksp(正确答案)B.加入强电解质C.加入与难溶强电解质具有相同离子的盐D.Ip<KspE.加入氧化剂或还原剂27.下列化合物中,S的氧化数为+4的是:() [单选题] *A.H2SB.Na2S2O3C.Na2SO3(正确答案)D.Na2SO4E.S28.在原电池中, 发生氧化反应的是:() [单选题] *A.正极B.负极(正确答案)C.正极和负极D.正极或负极E.以上都对29.13号元素在元素周期表的位置是:() [单选题] *A.4周期ⅠA族B.4周期ⅡA族C.3周期ⅢA族(正确答案)D.4周期ⅥA族E.4周期ⅢA族30.某元素处在元素周期表的第三周期,该元素原子的电子层数为:() [单选题] *A.1B.2C.3(正确答案)D.4E.531.水的沸点“反常”,这是由于分子间存在着:() [单选题] *A.范德华力B.共价键C.氢键(正确答案)D.离子键E.E.配位键32.配合物中特征化学键是:() [单选题] *A.离子键B.共价键C.配位键(正确答案)D.氢键E.化学键33.下列盐中,难溶于水的是:() [单选题] *A.Ca(HCO3)2B.CaCO3(正确答案)C.Na2CO3D.(NH4)2CO3E.NH4Cl34.下列物质中,不能用做消毒剂的是:() [单选题] *A.氯水B.臭氧C.双氧水D.蒸馏水(正确答案)E.都不能做消毒剂35.H2O2不具备的性质是:() [单选题] *A.氧化性B.还原性C.不稳定性D.酸性E.既没有氧化性也没有还原性(正确答案)36.下列物质中与Cl2 作用能生成漂白粉的是:() [单选题] *A.CaCO3B.CaSO4C.Mg(OH) 2D.Ca(OH) 2(正确答案)E.MgSO437.下列化学药品在实验室常作氧化剂的是:() [单选题] *A.硫酸铜B.活泼金属C.高锰酸钾(正确答案)D.氯化钠E.水38.用自来水养金鱼时,通常先将自来水日晒段时间后,再注入鱼缸,其目的是()[单选题] *A.利用紫外线杀死水中的细菌B.提高水温,有利于金鱼生长C.增加水中氧气的含量D.促进水中的次氯酸分解(正确答案)E.以上说法均不正确39.下列关于Al(OH) 3性质的叙述错误的是() [单选题] *A.Al(OH) 3是两性的,其酸性与碱性相当B.可溶于酸C.Al(OH) 3是两性的,其酸性弱于碱性(正确答案)D.可溶于过量的强碱E.Al(OH) 3是碱性的40.参与构成人体和维持机体正常生理功能的元素称为:() [单选题] *A.人体微量元素B.人体常量元素C.人体必需元素(正确答案)D.人体有益元素E.人体有害元素二、是非(共10小题,每题1分,共10分。
无机化学期末考试试题及参考答案

药学院无机化学试题及参考答案(无机化学试题部分)一、填空题(每空1分,共20分)1.NH3分子的空间构型是,中心原子N原子采取杂化。
2.原子轨道以方式重叠,轨道重叠部分是沿着键轴呈圆柱形对称而分布的共价键叫键。
3.BeCl2分子为型分子,中心原子采取杂化,分子的固有偶极矩μ(>0,=0)。
4.某反应的△H和△S皆为负值,当温度升高时,△G(增大,减小)。
5.具有ns2np1~6电子构型的是区元素,具有(n-1)d5ns2电子构型的是族元素。
6.酸碱质子理论认为,是酸,是碱。
7.在含有AgCl固体的饱和溶液中加入盐酸,则AgCl的溶解度;如加入氨水,则其溶解度;若加入KNO3,则其溶解度。
8.298K时,Mg(OH)2的K sp为1.2×10-11;Ag2CrO4的K sp为9×10-12,则溶解度较大的是者。
9.产生渗透现象必须具备两个条件,一是,二是。
10.将0.115g奎宁(M=329.12克/摩)溶解在1.36g樟脑中,其凝固点为442.6K(T f=452.8K,K f=39.70)则凝固点降低为,m为。
二、选择题(请在备选答案中选择一个正确的答案,并用“√”符号表示。
每小题1分,共20分)1.下列各组物质中,属于等电子体系的是:( )A.NO和CN— B.CO和N2 C.O2和NO D.NO和O22.第二主族元素的+2价阳离子的碳酸盐(MCO3)中最稳定的是:( )A.MgCO3 B.CaCO3 C.SrCO3 D.BaCO33.下列各分子或离子的稳定性按递增顺序排列的是:( )A.NO+< NO < NO— B.NO—< NO < NO+C.NO< NO—< NO+ D.NO< NO+ < NO—4.下列各组量子数中,不合理的一组是:( )A.3,0,0,+1/2 B.3,2,3,1/2 C.2,1,0,-1/2 D.4,2,0,1/25.298K和101.3kPa下,下列化学方程式所表示的化学反应中属于熵减少的是:( )A.C(s)+ O2(g) = CO2(g)B.S(s)+ O2(g) = SO2(g)C.2Na(s)+ O2(g) = Na2O2(s)D.N2(g)+ O2(g) = 2NO(g)6.已知NH3(g)的标准生成热,则反应N2(g)+3H2(g)=2NH3(g)的热效应为():A.-46.2; B.46.2 C.-92.4 D.92.47.a,b,c三个电子具有的量子数(n,l,m)为a:3,2,0;b:3,1,0;c:3,1,-1。
《无机化学》期末考试试卷(B)

《无机化学》期末考试试卷(B)适用专业:注意:请将答案写在答题纸上。
一、单项选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题1分,共40分)1.下列物质不属于弱电解质的是()A.HAc B.NH3·H2O C.AgCl D.H2O2.下列元素中,非金属性最强的是()A.F B.Cl C.S D.O3.下列选项中导电性最好的金属是()A.Fe B.Cu C.Na D.Ag4.地壳中含量最多的元素是()A.O B.S C.Fe D.Si5.下列符号通常代表弱酸的解离常数的是()A.K a B.K b C.K w D.K sp6.0.1 mol·L 1氢氧化钠溶液的pH值为()A.1 B.12 C.2 D.137.原子核外电子层第一层最多容纳的电子数是多少个()A.2 B.6 C.8 D.10 8.配制FeCl3溶液时,常加入少量盐酸,其目的是()A.防止Fe2+被氧化B.防止Fe2+水解C.防止Fe3+被氧化D.防止Fe3+水解9.下列物质中,属于共价化合物的是()A.NaCl B.HCl C.Na2CO3D.Na 10.可逆反应达到平衡后()A.V正>V逆B.V正=V逆C.V正<V逆D.无法确定11.将pH=3.5的盐酸溶液与pH=10.5的NaOH溶液等体积混合后,溶液的pH是()A.7 B.<7C.>7 D 无法判断12.离子键最可能存在于()A.金属原子之间B.非金属原子之间C.金属原子与非金属原子之间D.任意两种元素的原子之间13.用0.1000 mol/L NaOH溶液滴定等体积、等pH值的HCl溶液和HAc 溶液时,所消耗NaOH溶液的体积()A.相同B.V NaOH(HCl溶液消耗)> V NaOH(HAc溶液消耗)C.V NaOH(HCl溶液消耗)< V NaOH(HAc溶液消耗)D.无法确定14.34.2 g/L蔗糖溶液的物质的量浓度为(蔗糖的摩尔质量为342 g/mol)()A.0.01 mol/L B.0.1 mol/LC.0.001 mol/L D.1 mol/L15.摩尔是表示()A.物质的量的单位B.摩尔质量的单位C.物质浓度的单位D.物质微粒的单位16.目前对人类环境造成危害的酸雨主要是由下列哪种气体污染造成的()A.CO2B.H2S C.SO2D.CO17.配制医疗上用的生理盐水是采用固体()A.NaCl B.KCl C.CaCl2 D.MgCl2 18.下列不能与氯气直接化合的物质是()A.H2B.Na C.Fe D.N219.没有强烈刺激性气味的气体是()A.O2 B.NH3C.SO2D.Cl220.原子序号11~17号的元素,随核电核数的递增而逐渐变小的是()A.电子层数B.最外层电子数C.原子半径D.元素最高化合价21.金属Na长时间放置在空气中,最终的产物是()A.Na2CO3B.NaOHC.Na2O D.Na2O222.已知某溶液,可使石蕊试液变红,使甲基橙变黄色,则该溶液的pH 值范围为( ) A.8~10 B.5~8C.4.4~5.0 D.3.1~4.423.一定温度下,加水稀释弱酸,下列数值将减少的是()A.[H+] B.pH C.Ka D.不确定24.可逆反应C(s)+H2+H2(g)-Q (表示正反应为吸热反应)达平衡状态时,若降低温度,则化学平衡向哪移动()A.正反应方向B.逆反应方向C.没有D.无法判断25.下列指示剂中,不属于酸碱指示剂的是()A.酚酞B.甲基橙C.石蕊D.淀粉26.下列关于催化剂作用的叙述中错误的为()A.可以加速某些反应的进行B.可以抑制某些反应的进行C.可以使正逆反应速度以相等的速度加快D.可以改变反应进行的方向27.醋酸与NaOH溶液等浓度等体积混合后,溶液的pH是()A.等于7 B.小于7 C.大于7 D.无法判断28.某同学选择HAc~NaAc作缓冲对,配制pH=5.0的缓冲溶液,经酸度计测定所配溶液的pH为4.78,则应向此缓冲溶液中滴加少量什么溶液来调节。
《无机化学》(上册)期末考试试卷及答案

《无机化学》(上册)期末考试试卷试卷(一)一、填空题(每空1分,共44分)1.当体系的状态被改变时,状态函数的变化只决定于_________,而与_________无关2.空气中的SO2与水作用并经氧化,生成___________ 使大理石转化为_________, ________,因而使雕象遭到破坏.3.已知:碘元素的电势图: 0.145V Eø0.535VIO3–IO–I2–0.49V则:EøIO–/I2=_______, EøIO3–/I–=_____________4.电解浓度为1mol·L﹣1的H2SO4溶液(铂为电极),阴极产物是______, 阳极产物是______ 已知:Eø O2/OH﹣=1.229V, Eø H+/H2 = 0.000V, Eø S2O82﹣/SO42﹣=2.01V5.我国化学家徐光宪总结归纳出了能级的相对高低与____________________有关,且能级的高低与值有关的近似规律.6.制备胶体的方法有_______和_______.7.气体的基本特征是它的性和性。
8.在0.1mol·L-1的HAc溶液中加入0.1mol·L-1NaAc溶液,HAc的电离度将________________,这种作用被称为__________________.9.离子的结构特征一般包括: 离子电荷、、三个方面.10.已知:2A+B=2C为简单反应,此反应对A物质反应级数为___________,总反应为____________级反应.11.共价键按共用电子对来源不同分为_____________和_______________;共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反应而制得水溶液,它极不稳定迅速分解,反应式为:。
中山大学无机化学题库

國立中山大學無機化學題庫第1章 化学热力学 一、选择题 1-1 下列物质中,f mH ϑ∆不等于零的是 ( )(A) Fe (s) (B) C (石墨) (C) Ne (g) (D) Cl2 (l) 答案: D1-2盖斯定律认为化学反应的热效应与途径无关。
这是因为反应处在( ) (A) 可逆条件下进行 (B) 定压无非体积功条件下进行 (C) 定容无非体积功条件下进行(D) 以上都正确 答案: D1-3如果X 是原子,X2 是实际存在的分子,反应的2221H (g) + O (g) = H O (l)2的rH∆应该是( )(A) 负值 (B) 正值 (C) 零 (D) 不能确定 答案: B1-4 下列说法正确的是( )(A) 水的生成热即是氢气的燃烧热(B) 水蒸气的生成热即是氢气的燃烧热 (C) 水的生成热即是氧气的燃烧热 (D) 水蒸气的生成热即是氧气的燃烧热 答案: A 1-52H 和2O 在绝热钢筒中反应生成水,则下列状态函数中,增加为零的是( )(A)U ∆ (B)H ∆(C)S∆(D)G ∆答案:AB1-6将一台电冰箱放置在一室内,然后打开电冰箱的门,并使冰箱中的致冷机运转。
一段时间后,室温变化情况是属于( )(A)降温很多(B)降温很少(C)升温很多(D)不变 答案: D1-7已知298K 时,-1(HI , g)=-25.9kJ mol H ϑ∆⋅,下列说法正确的( )(A)0.5mol 2H O(g)混合物在101.325kPa 和298K 时生成HI(g)的反应热为-125.9kJ mol -⋅(B)22H (g) + I (g) 2HI(g)→反应的标准焓变在298K 时为-125.9kJ mol -⋅(C)反应22H (g) + I (s) 2HI(g)→在298K 时的标准焓变为-125.9kJ mol -⋅(D)反应2211H (g) + I (s) HI(g)22→在298K 时的标准焓变为-125.9kJ mol -⋅答案:D1-8反应221CuCl (s) CuCl(s) + Cl (g)2→,在298K 及101.325kPa 下不自发,但在高温时能自发进行。
《无机化学》期末考试试卷附答案

《无机化学》期末考试试卷附答案一、单选(共20小题,每小题3分,共60分)1、在标准状态下, 1.0 dm3氢气的质量应为()A、0.089 gB、0.11 gC、9.0 gD、11.2 g2、扩散速率三倍于水蒸气的气体是()A、HeB、H2C、CO2D、CH43、欲配制 pH = 13.00 的溶液 10.0 dm3, 所需 NaOH 固体的质量是()(相对原子质量: Na 23 )A、 40 gB、 4.0 gC、 4.0×10-11 gD、 4.0×10-12 g4、有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经过足够的时间,开盖看到的情况是()A、砚中墨汁干枯,外圈水成淡墨B、砚中墨汁变淡,外圈水成淡墨,且二者浓度相同C、砚中墨汁变淡,外圈水干枯D、没有发生变化5、下列说法正确的是()A、当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B、液体混合物的蒸气压等于各纯组分液体的蒸气压之和C、非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积D、蒸气压的大小与容器体积的大小有关6、已知:2H2(g) + S2(g)2H2S(g) K p12Br2(g) + 2H2S(g)4HBr(g) + S2(g) K p2H2(g) + Br2(g)2HBr(g) K p3则K p3 等于()A、(K p1 / K p2 )1/2B、(K p2·K p1)1/2C、K p2 /K p1D、K p2·K p17、氢硫酸电离常数K1 = 1 ⨯ 10-7,K2 = 1 ⨯ 10-13,在0.1 mol·dm-3 H2S水溶液中溶液的pH值是()A、10-2B、 2C、 3D、48、用0.20 mol·dm-3 HAc和0.20 mol·dm-3 NaAc溶液直接混合(不加水),配制1.0 dm3pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3HAc 溶液为( ) (p K a (HAc) = 4.75)A 、6.4 ⨯ 102cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102cm 3 D 、3.6 ⨯ 102cm 39、钒的电势图为 1.000.360.25()()()()VVVV V V IV V III V II ++-已知: ϕ(Zn 2+/Zn) = -0.76 V , ϕ(Sn 4+/Sn 2+) = +0.15 Vϕ(Fe 3+/Fe 2+) = +0.77 V , ϕ(S/H 2S) = +0.14 V欲将V(V) 还原到V(IV),在下列还原剂中应选用( ) A 、FeSO 4 B 、Zn C 、SnCl 2 D 、H 2S10、对于下面两个反应方程式,说法完全正确的是( )2Fe 3+ + Sn 2+Sn 4+ + 2Fe 2+Fe 3+ + 21Sn2+21Sn 4+ + Fe 2+A 、两式的 E ,m r G ∆,K C 都相等 B 、两式的 E , m r G ∆,K C 不等 C 、两式的 m r G ∆相等, E ,K C 不等 D 、两式的 E 相等, m r G ∆,K C 不等11、铅蓄电池在充电时,阳极反应是( )A 、PbSO 4 + H 2O =PbO 2 + 4H ++ SO -24+ 2e -B 、Pb + SO -24= PbSO 4+ 2e -C 、PbSO 4+ 2e -= Pb + SO -24D 、PbO 2+ 4H ++ SO -24+ 2e -= PbSO 4 + 2H 2O12、已知金属 M 的下列标准电极电势数据:( )(1) M 2+ (aq) + e - =M +(aq)1ϕ= -0.60 V(2) M 3+(aq) + 2e -= M +(aq)2ϕ= 0.20 V 则M 3+(aq) + e -= M 2+ (aq) 的ϕ是A 、0.80 VB 、-0.20 VC 、-0.40 VD 、1.00 V13、对于一个一级反应,如其半衰期t 1/2在0.0100 s 以下即称为快速反应,此时它的速率常数k 值在( )A 、 69.3 s -1以上 B 、6.39 s -1以上 C 、0.0693 s -1以上D 、6.39 s -1以下14、反应2A −→−B 为二级反应,若A 的起始浓度为1.00 mol ·dm -3,在开始反应1 h 之后减少了一半,那么2 h 后,A 的浓度将为( ) A 、 0.125B 、0.333C 、0.250D 、0.49115、在各种不同的原子中3d 和4s 电子的能量相比时( ) A 、3d 一定大于4s B 、 4s 一定大于3d C 、3d 与4s 几乎相等D 、不同原子中情况可能不同16、下列关于屏蔽效应的说法中,正确的一个是( )A 、4s 电子的屏蔽常数σ 4s 反映了4s 电子屏蔽原子核作用的大小B 、当n 和Z 相同时,某电子的σ 值愈大,该电子的能量就愈低C 、主量子数n 相同,角量子数l 不同;随l 增大,电子的屏蔽作用增大D 、当屏蔽电子数目愈多或被屏蔽电子离核愈远时,σ 值也愈大 17、下列各对分子型物质中,沸点高低次序不正确的是( ) A 、HF > NH 3 B 、 S 2(g) > O 2 C 、NH 3 > PH 3 D 、SiH 4 > PH 3 18、已知金刚石晶胞是类似于立方 ZnS 型的面心立方晶格 ,则晶胞中碳原子数是 ( ) A 、4B 、8C 、12D 、619、按分子轨道理论,-2O 的键级是 ( ) A 、1 B 、2 C 、1 D 、220、下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V 形)的是( ) A 、+4NH B 、SO 2C 、H 3O +D 、OF 2二、填空(共20空,每空2分,共40分)1、0℃ 和标准压力下,1 dm 3水能溶解49.0 cm 3O 2 和23.5 cm 3N 2,在相同的条件下,1 dm 3水约能溶解空气 ________________________ cm 3。
《无机化学》(上册)期末考试试卷及答案

《无机化学》(上册)期末考试试卷及答案9.离子的结构特征一般包括: 离子电荷、、三个方面.10.已知:2A+B=2C为简单反应,此反应对A物质反应级数为___________,总反应为____________级反应.11.共价键按共用电子对来源不同分为_____________和_______________;共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反应而制得水溶液,它极不稳定迅速分解,反应式为:。
13.在化学反应方程式2KMnO4+5H2O2+6HNO3=2Mn(NO3)2+2KNO3+8H2O+5O2↑中,氧化产物为___________, 还原产物为____________14.O2分子中有_________________________键,依公式_________________ 可以算出O2的磁矩.15.A,B两种气体反应,设A的浓度增加一倍,速度增加一倍,B的浓度增加一倍,则反应速度增加三倍,若总压力减小为原来的1/2时,反应速度将变为原来的_________倍,该反应的总反应级数为____________.16.稀有气体的第一个化合物—————————,,是由————————于————————年制备的。
17.写出具有下列指定量子数的原子轨道符号:A. n = 4, l = 1B. n = 5, l = 318.某种只含C 、H 、Cl的化合物在298 K和101.3 kPa压力下, 其蒸汽密度为3.965g·L-1, 如果化合物分子中C:H:Cl = 1:1:1, 则该化合物的分子量为_______ , 分子式为__________ .19.缓冲容量表示缓冲溶液___________________的大小,缓冲剂的浓度越大,则缓冲容量越____________.20.为防止水在仪器中结冰, 可以加入甘油C3H8O3以降低凝固点。
大学无机化学期末复习题及答案

无机化学复习题(答案)一.填空(1)共价键的键参数是指 键长 , 键角 和 键能 。
(2)弱电解质的解离度与解离常数的平方根成正比,与弱电解质浓度的平方根成反比的这种关系叫做稀释定律。
(3)化学平衡是指一个化学反应处于 正反应速率 与 逆反应速率 相等的表观静止状态。
(4)在弱电解质或难溶强电解质的溶液中加入 与弱电解质或与难溶强电解质不具有相同离子的易溶强电解质 使弱电解质或难溶强电解质的 解离度增大 或 溶解度升高 的现象叫盐效应。
(5)气体的分压是指 混合气体中某一组分单独占有混合气体的体积 时所具有的压力。
(6)一化学反应的反应浓度(或分压)商Q 与K O比较,当 Q<K O时平衡 正向 移动,而当Q>K O时平衡 逆向 移动 。
(7)分子内 相邻原子或离子间主要的、强烈的相互作用力 称为化学键。
(9)状态函数的改变量只取决于系统的 始态 与 终态 ,而与 系统变化的途径 无关。
(11)任何温度都能自发的化学反应必然具有 △H < 0 和 △S > 0 的特点。
(14)体系与环境之间既 无能量交换 又 无物质传递 的体系被称为隔离体系。
(15)改变平衡系统的条件之一 温度,浓度,压力平衡向减弱这个改变的方向移动;这个原理被称为 吕查德 原理。
(16)若干个 能级相近 的原子轨道 相互混合 形成 电子云高度集中于某一方向且彼此间获得最大夹角 的新的原子轨道,这种新的原子轨道称为 杂化轨道 。
(17) 摩尔分数是指 混合物中某一组分的摩尔数与混合物总摩尔数的百分比 。
(20)酸碱质子理论又称为 共轭 酸碱理论。
该理论中酸的定义是: 质子的给出体 ,碱的定义是: 质子的接受体 。
二. 选择题 (单选)1. 下列分子的Δf H 0m (B ,物态,T) 值不等于零的是( C )。
A .石墨(s) B .H 2(g) C .H 2O(g) D .Cl 2(g) 4. 关于缓冲溶液的性质,正确的说法是: ( B )A.在醋酸溶液中加入过量氢氧化钠,所得溶液有缓冲作用B.在氢氧化钠溶液中加入过量醋酸,所得溶液有缓冲作用C.在盐酸溶液中加入过量氢氧化钠,所得溶液有缓冲作用D.在氢氧化钠溶液中加入过量盐酸,所得溶液有缓冲作用5. 某温度下,反应 2A + B= D 的k 0 =5,则反应 2D = 4A +2 B 的标准平衡常数为: ( C )A.25B. 0.2C. 0.04D.1011.下列水溶液中(各相关物质浓度均为0.10 mol ·L -1),pH 值最小的是: ( A )A. HOAc-HCl 混合溶液;B. HOAc-NaOAc 混合溶液;C. NH 4Cl 水溶液;D. pH = 1的水溶液 12. 反应 H 2 (g)+Br 2 (g)= 2HBr (g) 在800K 时K θ=3.8×105,1000K 时K θ=1.8×103,则此反应是:( B )A. 吸热反应;B. 放热反应;C. 无热效应的反应;D. 无法确定15. 既能衡量元素金属性强弱,又能衡量其非金属性强弱的物理量是:( A )A. 电负性;B. 电离能;C. 电子亲核能;D. 偶极矩17. 已知下列反应的平衡常数:H 2 (g) + S (s) == H 2S (g) : θ1K ; O 2 (g) + S (s) == SO 2 (g): θ2K ; 则反应:H 2 (g) + SO 2 (g) == O 2 (g) + H 2S (g) 的平衡常数为:( D )A. θ1K -θ2K ;B. θ1K ·θ2K ;C. θ2K /θ1K ;D. θ1K /θ2K18.表示正确的一组量子数是 ( 4 )(1)(4、1、2) (2) (2、0、-1)(3)(3、1、2) (4) (3、2、-2)22.下列哪种条件其过程必然是自发的 ( 4 )(1)△H>0 △S>0 (2)△H<0 △S<0 (3)△H>0 △S<0 (4)△H<0 △S>0三.完成下表表:1表:2表:35. 命名下表中的化学式并指出类别四.回答下列问题2.能否将0.1mol/L的NaOH溶液稀释至C OH- = 1.0×10-8mol/L?答:不能! 因为纯水的自偶解离已经使CH+ = 1.0×10-7mol/L。
大学无机化学期末试卷及答案

《无机化学》试题学号: 姓名: 座号:系别: 年级: 专业:复核人:一、单项选择题 (在每小题列出的四个选项中只有一个选项是符合题目要求的,请选出正确选项并在❽答题卡❾的相应位置上涂黑。
多涂、少涂、错误均无分。
每小题 分,共 分)、对于☪⏹ + ☪⏹电对,增大☪⏹ +的浓度,则其标准电极电势将 ( )✌ 增大 减小 不变 无法判断、 ◆ +离子的外层电子构型为( )✌ e e 型 +e ~ e 型、设氨水的解离平衡常数为θb K 。
浓度为m ❍☐●☹- 的氨水溶液 若将其用水稀释一倍 则溶液中 ☟-的浓度(❍☐●☹- )为( ) ✌ m 21 θb K m ⋅21 2/m K b ⋅θ m、已知θspK ☎✌♑ ✆ ,其溶解度为☎ ✆✌ ❍☐●⑦☹ ; ❍☐●⑦☹ ; ❍☐●⑦☹ ; ❍☐●⑦☹、下列各组物质,能自发发生反应的是 ( )✌ ◆、 ◆ ; ❒ 、 ❒ ; ⏹ 、 ⏹ ; ⏹● 、 ⏹、 ♎轨道的磁量子数可能是 ( )✌ 、下列各分子中 以♦☐ 不等性杂化轨道成键的是( )✌ ♏● ● ☞ ♓☟、熔化下列晶体时 只需克服色散力的是 ( )✌ ☟☞ ✌♑ ☞ 已知VE A/ : ❒ ❒ ❒ ❒,则判断发生歧化反应的是 ( )✌ 都不能 ❒ ❒ ❒ 下列各物质中 熔点最高的是 ( )✌ ♑ ♋ ☠♋稀溶液依数性的本质是( )✌ 渗透压 沸点升高 蒸汽压下降 凝固点降低要降低反应的活化能,可以采取的手段是 ☎ ✆✌ 升高温度 降低温度 移去产物 使用催化剂如果一个反应的吉布斯自由能变为零 则反应 ☎ ✆✌ 能自发进行 是吸热反应 是放热反应 处于平衡状态反应 ✌ ,焓变小于零,若温度升高 ℃,其结果是 ☎ ✆✌对反应没有影响 使平衡常数增大一倍 不改变反应速率 使平衡常数减小在☟✌♍☠♋✌♍缓冲溶液中,若☯☟✌♍☯☠♋✌♍,则该缓冲溶液 ( )✌抗酸能力强于抗碱能力 抗酸能力弱于抗碱能力 抗酸能力等于抗碱能力 无法判断在室温下, ❍☐● ☹ ☠☟ 水溶液中的☐♦是( )✌ 按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是 ☎ ✆✌●- ☠☟ + ☟ - ☟ +✌♑●在纯水中溶解度比 ❍☐●☹- ☠♋●溶液中 ☎✌♑● ♦☐ - ✆ ☎ ✆✌大 小 一样大 无法判断♋ 在 ❍☐● ☹ ☠♋☠ 溶液中的溶解度比在纯水中 ☎ ✆✌略有减小 略有增加 相等 无法判断已知: ♦☐,✌♑●= - , ♦☐,✌♑ ❒ = - 在等浓度的 ❒ -和 ●-的混合溶液中,逐滴加入✌♑☠ 时: ( )✌先产生✌♑●❽ 先产生✌♑ ❒ ❽ 两种同时沉淀 两者都不沉淀在酸性溶液中,当适量的 ⏹ 与☠♋ 反应时出现的现象是 ( )✌ 棕色沉淀 紫色褪去 绿色溶液 都不对下列电对中☜ ♐ 值最大的是 ☎ ✆✌.☜ ♐ ☎✌♑+ ✌♑✆ .☜ ♐ ☎✌♑☎☠☟ ✆ ✌♑✆ .☜ ♐ ☎✌♑● ✌♑✆ .☜ ♐ ☎✌♑✋✌♑✆当 ☐☟ 时,氢电极的电极电势是 ☎ ✆✌ ✞ ✞ ✞ ✞♦电子的径向分布图有 ☎ ✆✌. 个峰 . 个峰 . 个峰 . 个峰属于主量子数⏹ 的一个电子的四个量子数⏹,●,❍,❍♦ 取值正确的是 ☎ ✆✌ 量子力学中所说的原子轨道是指 ☎ ✆✌.波函数 ⏹,●,❍,❍♦ .电子云 .波函数 ⏹,●,❍ .概率密度 ☎, , ✆代表简并轨道中的一个轨道是 ☎ ✆✌. ☐轨道 . ♎轨道 . ♦轨道 . ♐轨道下列轨道上的电子,在⌧⍓平面上的电子云密度为零的是 ☎✆✌. . ⌧ . . ⍓ 某元素原子基态的电子构型为 ☯✌❒ ♎ ♦ ,它在元素周期表中的位置是 ☎✆✌.♦区 .☐区 .♎区 .♐区 ✌♑的价电子层结构是 ☎ ✆✌. ♎ ♦ . ♎ ♦ . ♎ ♦ . ♎ ♦下列分子和离子中中心原子成键轨道不是♦☐ 杂化的是☎ ✆✌. ☞ .☟☟ . ☟ .☠☟按分子轨道理论, 的键级是 ☎ ✆✌. . . .下列各分子中,偶极矩为零的分子为 ☎ ✆✌.☟ .☠☟ . ☞ .☟●下列化合物中没有氢键的是 ☎ ✆✌ ☟ ☠☟ ☟☞ ☟ ☠☟ 中☠原子采取的杂化方式是: ( )✌ 等性 ♎ 不等性☯☠♓☎♏⏹✆ 离子中镍的价态和配位数是 ☎ ✆✌. , . , . , . , ☞♏☎Ⅲ✆形成的配位数为 的外轨配合物中,☞♏ 离子接受孤对电子的空轨道是 ☎ ✆✌.♎ ♦☐ . ♦☐ ♎ .☐ ♎ . ♦♎ 能够用于鉴定☞♏ 的特效试剂有( )✌☠ ☟● 邻二氮菲 赤血盐在热碱性溶液中,次氯酸根离子不稳定,它的分解产物是 ☎ ✆✌. ●-和 ● . ●-和 ● - . ●-和 ● - . ●-和 ● -在温度❆和压力☐时理想气体反应:(ⅰ) ☟ ☎♑✆= ☟ ☎♑✆+ ☎♑✆θ1K (ⅱ) ☎♑✆= ☎♑✆+ ☎♑✆ θ2K 则反应:(ⅲ) ☎♑✆+☟ ☎♑✆= ☎♑✆+☟ ☎♑✆的θ3K 应为( )✌ θθθ213/K K K = θθθ213K K K ⋅= θθθ213/K K K = θ3K θ1K θ2K二、判断题(判断正确答案,选项并在❽答题卡❾的相应位置填涂,认为正确的涂❽✌❾错误的涂❽ ❾。
医专无机化学试卷(AB)--附答案

医专无机化学试卷(AB)--附答案医专无机化学试卷(A)一、选择(2×15)1. 1. 基态K原子的外层钠原子的四个量子数是()A. 4,0,0,+1/2B. 4,3,0,+1/2C. 4,2,0, +1/2D. 4,1,0, -1/22.某元素的价电子构型为3d14s2,则该元素的原子序数为()A.20B.21C.30D.253.下列运动状态中,正确的是( )A.n=1,l=2 ,m=0B.n=2,l=0,m=±1C. .n=3,l=3,m=±3D.n=4,l=3,m=±24.NH3分子中的碳采取sp3杂化,分子的空间构型为()A. 三角形B. 直线形C.正四面体形D. 三角锥形5.下列分子中偶极矩不等于零的是( )A.CO2 B.CH4C.H2O D.BF36.下列关于分散系概念的描述错误的是( )A.分散系由分散相和分散介质组成B.分散系包括均相体系和非均相体系C.高分子溶液属于胶体分散系D.分散相颗粒直径大于100nm的体系成为胶体分散系7.淀粉溶液中含有少量的NaCl,出去NaCl可用的方法是( )A.萃取B.渗析C.过滤D.盐析8.下列分散系由丁达尔现象,加少量电解质不聚沉的是( )A. NaCl溶液B.AgI溶胶C.蛋白质溶液D.泥浆水9.表面张力与下述哪些因素无关( )A.物质的本性B.物质总的体积C.温度D.与物质接界的其它物质10.可逆反应2A+B 2C已达到平衡,升高温度时,生成物C的浓度增加,这个可逆反应的正反应是( )A.放热反应B.吸热反应C.没有明显的热效应D.无法判断11.下列物质中能组成缓冲对的是( )A.NH3H2O NaOH b.HCl NaCl C. NaHCO3Na2CO3D. NH3H2O CH3COOH12.关于速率常数k的叙述不正确的是( )A. k与反应物浓度成反比B.条件一定时,反应的k值恒定不变C. k值越大,说明该反应速率越快D. k值随温度的改变而改变13.今有四种溶液, ①1.0mol.L NaCl; ②1.0mol.LC 6H12O6; ③1.0mol.LH24; ④1.0mol.LCaCl2,其沸点由高到低的排列顺序为( )A. ①>②>③>④B.③>②>①>④C. ④>③>①>②D.③>①>②>④14.下列物质中加入少量AgNO 3,能产生AgCl沉淀的是( )A.[Pt(NH3)2Cl2] B.K2[PtCl4] C.[Ag(NH3)2] Cl D.H[AuCl4]15.下列属于共轭酸碱对的是( )2SO4- SO42- B.H3PO4- H3PO4- C.HAc-Cl- D. HCl-Ac-二、填空题(每题2分,共30分)1.描述电子运动状态的四个量子数是, , 和.2.原子序数为17的元素位于周期表的周期, 族.3.某元素的价电子构型是3s23p4,其应在周期表的周期, 族,属于区元素.4.下列分子是极性分子, 非极性分子.BCl3H2S CCl4CHCl35.碘酒,葡萄糖溶液,NaCl溶液,泥浆都属于分散系,其中分散质分别是,分散剂分别是.6.晶体渗透压是由产生的,其主要的生理功能为;胶体的渗透压是由产生的,主要生理功能是.7.溶胶稳定的因素有, , ,加入可增加溶胶的稳定性.影响表面张力的因素有, , .8.溶液产生渗透现象的条件是和,从净结果看,总是由溶液向溶液渗透. 9活化能是指活化分子的与反应物分子的平均能量之差。
大学无机化学期末试卷及答案复习整理

《无机化学》试题学号: 姓名: 座号: 系别: 年级: 专业:总分合计人: 复核人:一、单项选择题 (在每小题列出的四个选项中只有一个选项是符合题目要求的,请选出正确选项并在“答题卡”的相应位置上涂黑。
多涂、少涂、错误均无分。
每小题1分,共40分)1、对于Zn 2+/Zn 电对,增大Zn 2+的浓度,则其标准电极电势将 ( )A 增大B 减小C 不变D 无法判断 2、Cu2+离子的外层电子构型为( )A 8eB 18e 型C 18+2eD 9~17e 型3、设氨水的解离平衡常数为θb K 。
浓度为m mol ·L -1的氨水溶液,若将其用水稀释一倍,则溶液中OH -的浓度(mol ·L -1)为( )A m 21B θb K m ⋅21 C 2/m K b ⋅θD 2m4、已知θK(Ag3PO4) = 1.4×10-16,其溶解度为sp( )A 1.1×10-4mol·L-1;B 4.8×10-5mol·L-1;C 1.2×10-8mol·L-1;D 8.3×10-5mol·L-15、下列各组物质,能自发发生反应的是()A Cu、Cu2+;B Cr2O72-、Cr3+;C MnO2、Mn2+;D SnCl4、Sn6、3d轨道的磁量子数可能是()A 1,2,3B 0,1,2C 0,±1D 0, ±1, ±27、下列各分子中,以sp3不等性杂化轨道成键的是()A BeCl2B PCl3C BF3D SiH48、熔化下列晶体时,只需克服色散力的是()A HFB AgC KFD CO29.已知VE A/θ:Cr2O72- +1.36 Cr3+ -0.41 Cr2+ -0.86 Cr,则判断发生歧化反应的是()A 都不能B Cr2O72-C Cr3+D Cr2+10.下列各物质中,熔点最高的是()A K2OB MgOC CaOD Na2O11稀溶液依数性的本质是()A. 渗透压B. 沸点升高C. 蒸汽压下降D. 凝固点降低12要降低反应的活化能,可以采取的手段是( )A. 升高温度B. 降低温度C. 移去产物D. 使用催化剂13如果一个反应的吉布斯自由能变为零,则反应( )A. 能自发进行B. 是吸热反应C. 是放热反应D. 处于平衡状态14.反应 A + B C,焓变小于零,若温度升高10℃,其结果是( )A.对反应没有影响B. 使平衡常数增大一倍C.不改变反应速率D.使平衡常数减小15.在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A.抗酸能力强于抗碱能力B.抗酸能力弱于抗碱能力C.抗酸能力等于抗碱能力D.无法判断16.在室温下,0.0001mol.L-1NH3水溶液中的pKw是()A. 14B. 10C.4D.817.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是 ( )A.Cl-B. NH4+C. HCO3-D. H3O+18.AgCl在纯水中溶解度比0.10 mol·L-1 NaCl溶液中 (AgCl: K sp = 1.77×10-10 ) ( )A.大B.小C.一样大D.无法判断19.CaSO4在0.1mol.L-1NaNO3溶液中的溶解度比在纯水中( )A.略有减小B.略有增加C.相等D.无法判断20.已知:Ksp,AgCl=1.8×10-10,Ksp,Ag2CrO4=1.1×10-12在等浓度的CrO42-和Cl-的混合溶液中,逐滴加入AgNO3时:()A.先产生AgCl↓B.先产生Ag2CrO4↓C.两种同时沉淀D.两者都不沉淀21.在酸性溶液中,当适量的KMnO4与Na2SO3反应时出现的现象是()A. 棕色沉淀B. 紫色褪去C.绿色溶液D.都不对22.下列电对中值最大的是( )A. (Ag+/Ag) B. (Ag(NH3)2+/Ag) C. (AgCl /Ag) D. (AgI/Ag)23.当pH = 10 时,氢电极的电极电势是- ( )A.-0.59 VB. -0.30 VC. 0.30 VD. 0.59 V24.4s电子的径向分布图有: ( )A.3个峰B.2个峰C.4个峰D.1个峰25.属于主量子数n= 3 的一个电子的四个量子数n,l,m,m s 取值正确的是 ( )A. 3,2,1,0B.3,2, -1,C. 3,3,1,D. 3,1, 2,26.量子力学中所说的原子轨道是指( )A.波函数ψn,l,m,ms B.电子云C.波函数ψn,l,m D.概率密度27.ψ(4,2,1)代表简并轨道中的一个轨道是( )A.4p轨道B.4d轨道C.4s轨道D.4f轨道28.下列轨道上的电子,在xy平面上的电子云密度为零的是( )A.3S B.3P x C.3Pz D.3Py29.某元素原子基态的电子构型为 [Ar] 3d 8 4s2 ,它在元素周期表中的位置是 ( )A.s区B.p区C.d区D.f区30. Ag的价电子层结构是( )A.3d 10 4s1 B.3d 9 4s2C.4d 10 5s1D.4d 10 4s231下列分子和离子中中心原子成键轨道不是sp2 杂化的是( )A.BF3 B.HCHO C.C2H4 D.NH332按分子轨道理论,O2的键级是- ( )A.1 B.1C. 2 D.233.下列各分子中,偶极矩为零的分子为( )A.H2 O B.NH3 C.BF3 D.HCl34.下列化合物中没有氢键的是( )A.C2H4B.NH3C.HFD.H2O35.NH3中N原子采取的杂化方式是:()A. SP2B. SP3等性C. SP2dD. SP3不等性36.[Ni(en)3]2+离子中镍的价态和配位数是( )A.+2,3 B. +3,6 C. +2,6 D. +3,337. Fe(Ⅲ)形成的配位数为 6 的外轨配合物中,Fe3+离子接受孤。
大一无机化学期末考试试题 精选

C、ΔrGm越小反应速度越快 D、Ea越小反应速度越快
( D )9.下列四个量子数(依次为n,l,m,ms)不合理的一组是:
A、(3、1、0、+)
B、(4、3、1、-)
C、(4、0、0、+)
D、(2、0、1、-)
B )10.下列四个量子数所描述的电子运动状态中,能量最高的电子
是:
A、(4、1、0、+)
减小容器的体积,平衡 正向 移动,平衡常数 不变 ;若提高体系的温
度,平衡 正向 移动,平衡常数增大
7.在配制FeCl3、SnCl2溶液时,通常要加入浓HCL中其目的是为了
抑制水解 。
8.溶度积规则是指:当 J=Ksp 达到沉淀溶解平衡,形成饱和溶液;
当 J>Ksp 为过饱和溶液,会有沉淀产生;当 J<Ksp 为不饱和溶
5.下列各对物质中,分子间作用力最弱的是-----------------------------------
( D )20.在XeF4分子中,中心原子“Xe”的价层电子对数是:
A、3对 B、4对 C、5对 D、6对
5.可逆反应 2A(g)+B(g)===D(g)+E(g) 达到平衡时,其平衡常数表 示式为Kc=P(D)P(E)/P(A)P(A)P(B)P*,Kp与 Kc的关系为Kp=Kc (RT-1)。
6.反应 C(s)+H2O(g)===CO(g)+H2(g),ΔrHmo > 0 达到平衡时,若
a.大于零
b.小于零
c.等于零
d.无法确定
(13)不合理的一套量子数(n,l,m,ms)是:b
a.4,0,0,
b.4,0,-1,
c.4,3,+3,
中山大学无机化学题库

國立中山大學無機化學題庫第1章 化学热力学 一、选择题 1-1 下列物质中,f mH ϑ∆不等于零的是 ( )(A) Fe (s) (B) C (石墨) (C) Ne (g) (D) Cl2 (l) 答案: D1-2盖斯定律认为化学反应的热效应与途径无关。
这是因为反应处在( ) (A) 可逆条件下进行 (B) 定压无非体积功条件下进行 (C) 定容无非体积功条件下进行(D) 以上都正确 答案: D1-3如果X 是原子,X2 是实际存在的分子,反应的2221H (g) + O (g) = H O (l)2的rH∆应该是( )(A) 负值 (B) 正值 (C) 零 (D) 不能确定 答案: B1-4 下列说法正确的是( )(A) 水的生成热即是氢气的燃烧热(B) 水蒸气的生成热即是氢气的燃烧热 (C) 水的生成热即是氧气的燃烧热 (D) 水蒸气的生成热即是氧气的燃烧热 答案: A 1-52H 和2O 在绝热钢筒中反应生成水,则下列状态函数中,增加为零的是( )(A)U ∆ (B)H ∆(C)S∆(D)G ∆答案:AB1-6将一台电冰箱放置在一室内,然后打开电冰箱的门,并使冰箱中的致冷机运转。
一段时间后,室温变化情况是属于( )(A)降温很多(B)降温很少(C)升温很多(D)不变 答案: D1-7已知298K 时,-1(HI , g)=-25.9kJ mol H ϑ∆⋅,下列说法正确的( )(A)0.5mol 2H O(g)混合物在101.325kPa 和298K 时生成HI(g)的反应热为-125.9kJ mol -⋅(B)22H (g) + I (g) 2HI(g)→反应的标准焓变在298K 时为-125.9kJ mol -⋅(C)反应22H (g) + I (s) 2HI(g)→在298K 时的标准焓变为-125.9kJ mol -⋅(D)反应2211H (g) + I (s) HI(g)22→在298K 时的标准焓变为-125.9kJ mol -⋅答案:D1-8反应221CuCl (s) CuCl(s) + Cl (g)2→,在298K 及101.325kPa 下不自发,但在高温时能自发进行。
大学无机化学期末试卷及答案

⼤学⽆机化学期末试卷及答案《⽆机化学》试题学号:姓名: 座号:: 复核⼈:⼀、单项选择题(在每⼩题列出得四个选项中只有⼀个选项就是符合题⽬要求得,请选出正确选项并在“答题卡”得相应位置上涂⿊。
多涂、少涂、错误均⽆分.每⼩题1分,共40分)1、对于Zn2+/Zn电对,增⼤Zn2+得浓度,则其标准电极电势将()A 增⼤B减⼩ C 不变D⽆法判断2、Cu2+离⼦得外层电⼦构型为()A8 B 18型C18+2 D 9~17型3、设氨⽔得解离平衡常数为。
浓度为mol·L-1得氨⽔溶液,若将其⽤⽔稀释⼀倍,则溶液中OH-得浓度(mol·L-1)为()AB C D 24、已知(Ag3PO4)=1、4×10-16,其溶解度为( )A1、1×10-4mol?L-1; B 4、8×10—5mol?L-1;C1、2×10-8mol?L—1; D8、3×10-5mol?L-15、下列各组物质,能⾃发发⽣反应得就是()ACu、Cu2+;B Cr2O72—、Cr3+; CMnO2、Mn2+;D SnCl4、Sn6、3d轨道得磁量⼦数可能就是()A 1,2,3B 0,1,2C0,±1 D 0,±1,±27、下列各分⼦中,以sp3不等性杂化轨道成键得就是()ABeCl2BPCl3 C BF3 D SiH48、熔化下列晶体时,只需克服⾊散⼒得就是( )AHF BAg CKF D CO29、已知:Cr2O72— +1、36 Cr3+ -0、41Cr2+—0、86 Cr,则判断发⽣歧化反应得就是()A 都不能B Cr2O72-C Cr3+D Cr2+10、下列各物质中,熔点最⾼得就是( )A K2OB MgOC CaO DNa2O11稀溶液依数性得本质就是()A、渗透压B、沸点升⾼C、蒸汽压下降D、凝固点降低12要降低反应得活化能,可以采取得⼿段就是()A、升⾼温度B、降低温度C、移去产物D、使⽤催化剂13如果⼀个反应得吉布斯⾃由能变为零,则反应( )A、能⾃发进⾏B、就是吸热反应C、就是放热反应D、处于平衡状态14、反应A+ BC,焓变⼩于零,若温度升⾼10℃,其结果就是()A、对反应没有影响B、使平衡常数增⼤⼀倍C、不改变反应速率D、使平衡常数减⼩15、在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A、抗酸能⼒强于抗碱能⼒B、抗酸能⼒弱于抗碱能⼒C、抗酸能⼒等于抗碱能⼒D、⽆法判断16、在室温下,0、0001mol、L-1NH3⽔溶液中得pKw就是( )A、14B、10 C、4D、817、按酸碱质⼦理论考虑,在⽔溶液中既可作酸亦可作碱得物质就是()A、Cl-B、NH4+C、HCO3-D、H3O+18、AgCl在纯⽔中溶解度⽐0、10 mol·L-1 NaCl溶液中(A gCl: K sp =1、77×10-10) ( )A、⼤B、⼩C、⼀样⼤D、⽆法判断19、CaSO4在0、1mol、L-1NaNO3溶液中得溶解度⽐在纯⽔中()A、略有减⼩B、略有增加C、相等D、⽆法判断20、已知:Ksp,AgCl=1、8×10—10,Ksp,Ag2CrO4=1、1×10-12在等浓度得CrO 2-与Cl-得混合溶液中,逐滴加⼊AgNO43时:( )A、先产⽣AgCl↓B、先产⽣Ag2CrO4↓C、两种同时沉淀D、两者都不沉淀21、在酸性溶液中,当适量得KMnO4与Na2SO3反应时出现得现象就是()A、棕⾊沉淀B、紫⾊褪去C、绿⾊溶液D、都不对22、下列电对中值最⼤得就是()A。
无机化学期末考试试题及参考答案

药学院无机化学试题及参考答案(无机化学试题部分)一、填空题(每空1分,共20分)1.NH3分子的空间构型是,中心原子N原子采取杂化。
2.原子轨道以方式重叠,轨道重叠部分是沿着键轴呈圆柱形对称而分布的共价键叫键。
3.BeCl2分子为型分子,中心原子采取杂化,分子的固有偶极矩μ(>0,=0)。
4.某反应的△H和△S皆为负值,当温度升高时,△G(增大,减小)。
5.具有ns2np1~6电子构型的是区元素,具有(n-1)d5ns2电子构型的是族元素。
6.酸碱质子理论认为,是酸,是碱。
7.在含有AgCl固体的饱和溶液中加入盐酸,则AgCl的溶解度;如加入氨水,则其溶解度;若加入KNO3,则其溶解度。
8.298K时,Mg(OH)2的K sp为1.2×10-11;Ag2CrO4的K sp为9×10-12,则溶解度较大的是者。
9.产生渗透现象必须具备两个条件,一是,二是。
10.将0.115g奎宁(M=329.12克/摩)溶解在1.36g樟脑中,其凝固点为442.6K(T f=452.8K,K f=39.70)则凝固点降低为,m为。
二、选择题(请在备选答案中选择一个正确的答案,并用“√”符号表示。
每小题1分,共20分)1.下列各组物质中,属于等电子体系的是:( )A.NO和CN— B.CO和N2 C.O2和NO D.NO和O22.第二主族元素的+2价阳离子的碳酸盐(MCO3)中最稳定的是:( )A.MgCO3 B.CaCO3 C.SrCO3 D.BaCO33.下列各分子或离子的稳定性按递增顺序排列的是:( )A.NO+< NO < NO— B.NO—< NO < NO+C.NO< NO—< NO+ D.NO< NO+ < NO—4.下列各组量子数中,不合理的一组是:( )A.3,0,0,+1/2 B.3,2,3,1/2 C.2,1,0,-1/2 D.4,2,0,1/25.298K和101.3kPa下,下列化学方程式所表示的化学反应中属于熵减少的是:( )A.C(s)+ O2(g) = CO2(g)B.S(s)+ O2(g) = SO2(g)C.2Na(s)+ O2(g) = Na2O2(s)D.N2(g)+ O2(g) = 2NO(g)6.已知NH3(g)的标准生成热,则反应N2(g)+3H2(g)=2NH3(g)的热效应为():A.-46.2; B.46.2 C.-92.4 D.92.47.a,b,c三个电子具有的量子数(n,l,m)为a:3,2,0;b:3,1,0;c:3,1,-1。
《无机化学》期末考试试卷及参考答案
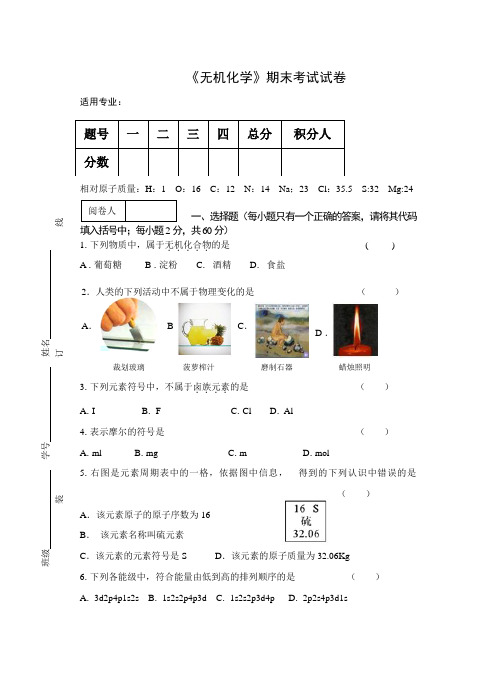
《无机化学》期末考试试卷适用专业:相对原子质量:H :1 O :16 C :12 N :14 Na ;23 Cl :35.5 S:32 Mg:24一、选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题2分,共60分) 1.下列物质中,属于无机化合物.....的是 ( ) A .葡萄糖 B .淀粉 C . 酒精 D . 食盐3.下列元素符号中,不属于卤族元素....的是 ( ) A .I B . F C .Cl D . Al4.表示摩尔的符号是 ( ) A .ml B .mg C .m D .mol5.右图是元素周期表中的一格,依据图中信息, 得到的下列认识中错误的是( )A .该元素原子的原子序数为16B . 该元素名称叫硫元素C .该元素的元素符号是SD .该元素的原子质量为32.06Kg 6.下列各能级中,符合能量由低到高的排列顺序的是 ( ) A . 3d2p4p1s2s B . 1s2s2p4p3d C . 1s2s2p3d4p D . 2p2s4p3d1s题号 一 二 三 四 总分 积分人 分数裁划玻璃A .B 菠萝榨汁C .磨制石器D .蜡烛照明2.人类的下列活动中不属于物理变化的是 ( ) 阅卷人班级 学号 姓名 - -------------------------------------装--------------------------------------------订---------------------------------------线-------------------------------------7. 5.5 mol 水的质量是 ( ) A . 18g B . 9g C . 99g D . 108g( )9.在标准状况下,任何气体的标准摩尔体积都是 ( ) A . 2.24L B . 11.2L C . 22.4L D . 224L10.下列物质的分子中属于极性分子的是 ( ) A . CO 2 B . O 2 C . HCl D . I 211.NaOH 的摩尔质量是 ( ) A . 4g B . 40 g/mol C . 40 Kg D . 28 mol12.在0.0001 mol/L 的NaOH 溶液中H +浓度为 ( ) A .10-4 mol/L B .10-10 mol/L C . 10-14 mol/L D .10-7mol/L14. 196g H 2SO 4的物质的量是 ( ) A .1mol B .2mol C .3mol D . 0.2mol 15. 浓度为0.01 mol/L 的稀盐酸的pH 是 ( ) A . 7 B . 2 C . 4 D . 816. 在标准状况下44.8L N 2气体的物质的量是 ( ) A .2mol B .1mol C .0.5mol D . 0.2mol17.配制250mL0.1mol/L 的NaOH 溶液需要NaOH 的质量是 ( ) A . 1g B . 10g C . 0.1g D .4gA . 试管B .烧瓶 D . 锥形C .容量瓶8.配制一定物质的量的浓度的溶液应选用的主要仪器是13.下列图像中不是..p 亚层电子云的是 ( ) A.C .B.D.19.配制250mL0.1mol/L 的NaCl 溶液应该选用的容量瓶的规格是 ( ) A . 250 mL B .200mL C . 100mL D . 500mL 20. 0.5mol 的水中含有的水分子个数是 ( ) A .3.01×1023B .6.02×1023C . 1.8×1023D .6.02×102221.标准状况下,与6.4gO 2的分子数目相同的CO 2气体的体积是 ( ) A . 22.4L B .11.2L C .4.48L D .2.24L22.在纯水中pH=7的原因是纯水 ( ) A . [H +]﹥[OH -] B . [H +]﹤[OH -] C . [H +]=[OH -] D .只有[H +] 无[OH -] 23.阿伏伽德罗常数是 A .5×1026B . 3.01×1022C . 6.02×1023D .3.01×1022.24.食盐属于 ( ) A .分子晶体 B .原子晶体 C . 离子晶体 D . 金属晶体 25.物质的量的国际单位是 ( ) A .千克 B .克 C .摩尔 D . 米27.非极性分子与非极性分子之间的作用力主要是 ( ) A .取向力 B .诱导力 C .色散力 D . 氢键28.在通常情况下,水的离子积常数.....是 ( ) A . 1×10-8B .1×10-7C .1×10-14D .1×10-1018.下图是元素周期表中某元素的原子结构示意图, ( ) 依据图中信息所得的结论错误的是 A .该元素的原子很容易得到电子 B .C. 该元素在第一主族 D . 该元素是碱金属元素v26.如图表示某可逆反应的化学平衡建立过程,下 列对于图像中的意义分析有错误的是A . 正反应速率在不断的减小B . 逆反应速率不断增大C .达到平衡时正反应和逆反应都停止,速率都为零D .达化学平衡时正、逆反应速率相等,29.某可逆反应的逆反应的平衡常数K 逆为4,则正反应的平衡常数K 正为( ) A .0.25 B .10 C .2 D .530. 金属铝属于 ( ) A . 原子晶体 B . 分子晶体 C .金属晶体 D .离子晶体 二、判断题(正确的打“√”,错误的打“×”;每小题1分,共10分)31.元素周期表中同一周期的元素随着原子序数的递增原子的半径由大变小 ( ) 32.元素周期表中同一主族的元素原子的最外层电子数一定相等 ( ) 33.分子是否有极性取决于整个分子中正负电荷的重心是否重合 ( ) 34.氧化还原反应的特征是有元素化合价的升降 ( ) 35. 强酸弱碱盐水解,溶液呈酸性 p H ﹤7 ( ) 36. 原电池是一种将电能转变为化学能的装置 ( ) 37. 物质的量就是指物质的质量 ( )38. 酸性溶液中[OH -]﹥[H +]﹥1×10-7mol/L ( ) 39.电子云图中的一个小黑点就代表一个电子. ( )40. 在NaAc-HAc 组成的缓冲溶液 中抗酸成分是HAc ( ) 三、填空题(每空1分,共10分)41. 硫酸四氨合铜(Ⅱ)的化学式是 。
《无机化学》期末考试试卷及答案,2016年6月

第1页###########材料科学与工程专业 《无机化学》期末考试试卷 (后附参考答案及评分标准)考试时间:120分钟 考试日期:2016年6月注:学生考试可自带计算器。
一、选择题(请将正确答案填入表中相应题号处,本题共20小题,每题1分,共20分)1. 已知某溶液pH = 0.070,其氢离子浓度的正确值为( ) A. 0.8511 mol ∙L −1 B. 0.851 mol ∙L −1 C. 0.85 mol ∙L −1D. 0.8 mol ∙L −12. 如果体系经过一系列变化后,又回到初始状态,则体系的( ) A. Q = 0, W = 0, ΔU = 0, ΔH = 0 B. Q ≠ 0, W ≠ 0, ΔU = 0 , ΔH = Q C. Q = −W , ΔU = Q + W , ΔH = 0 D. Q ≠ W , ΔU = Q + W , ΔH = 03. 在定温下被抽成真空的玻璃罩中封入两杯页面高度相同的糖水甲和纯水乙。
经过若干时间后,两杯液面的高度将是( ) A. 甲杯高于乙杯 B. 甲杯等于乙杯C. 甲杯低于乙杯D. 视温度而定 4. 25ºC 和1.01 × 105 Pa 时,反应2N 2O 5(g) = 4NO 2(g) + O 2(g) (ΔH = +56.76 kJ ∙mol −1)能自发进行的原因是( )年级 专业 姓名 学号装订线第2页A. 是吸热反应B. 是熵减少的反应C. 是放热反应D. 熵增大效应大于能量效应 5. 升高温度可以加快反应速率的主要原因是( )A. 减小活化能B. 增大Δr G mC. 减小Δr G mD. 增加活化分子数目 6. 下列说法中错误的是( ) A. 角量子数l 决定原子轨道的形状 B. 角量子数l 决定原子轨道在空间的伸展方向 C. 磁量子数m 决定原子轨道在空间的伸展方向 D. 主量子数n 决定原子轨道的分布范围 7. 下列说法中正确的是( ) A. CHCl 3是正四面体形B. CO 2中碳原子为sp 杂化, 为直线形分子C. H 2O 中氧原子为sp 2杂化, 其分子构型为V 形D.4NH +是三角锥形8. 下列情况中引起偶然误差的是( )A. 读取滴定管读数时, 最后一位数字估计不准B. 使用腐蚀的砝码进行称量C. 标定EDTA 溶液时, 所用金属锌不纯D. 所用试剂中含有被测组分 9. 下列说法正确的是( )A. 离子键就是阴阳离子间的静电吸引力B. 所有金属元素与所有非金属间都能形成离子键C. 钠原子与氯原子结合成氯化钠后体系能量降低D. 在离子化合物氯化钙中,两个氯原子间也存在离子键10. 已知32Fe Fe e +-++=, ϕθ= 0.77 V , 今测得()32Fe Fe 0.73V ϕ++=, 则说明电极溶液中的必定是( )A. c (Fe 3+) < 1 mol ∙L −1B. c (Fe 2+) < 1 mol ∙L −1C. c (Fe 3+)/c (Fe 2+) > 1D. c (Fe 3+)/c (Fe 2+) < 1 11. 下列四组量子数组合中,合理的是( )A . 3, 3, 1, −1/2 B. 3, 2, 0, −1/2 C. 3, 2, 3, −1/2 D. 3, 3, −3, −1/2第3页12. 若有一可逆反应()()()()2A 2B C 2D g g g g ++,r m 0H ∆<,则A 和B 达到最大转化率的条件是:( )A. 高温高压B. 低温高压C. 低温低压D. 高温低压 13. 下列物质中,摩尔熵最大的是( )A. MgF 2B. MgOC. MgCO 3D. MgSO 4 14. 按照酸碱质子理论,下列既能做质子酸又能做质子碱的是( )A .-3HCOB .+4NHC .+O H 3D .-3NO15. 关于s 区元素的性质,下列叙述中不正确的是 ( ) A .由于s 区元素的电负性小,所以都形成典型的离子型化合物B .在s 区元素中,Be 、Mg 因表面形成致密的氧化物保护膜而对水较稳定C .s 区元素的单质都有很强的还原性D .由于s 区元素单质的密度很小,它们都可以浸在煤油中保存16. 27℃时,把青蛙的肌肉细胞放在 0.2 mol·L −1的氯化钠水溶液中观察到肌肉细胞收缩,这是因为 ( )A. 细胞内的渗透压大B. 氯化钠水溶液渗透压大C. 两者的渗透压相等D. 与渗透压无关 17. 主量子数n = 3 电子层轨道最多可容纳多少个电子 ( )A. 2B. 8C. 18D. 36 18. 下列现象中属于电化学腐蚀的是 ( )A. 银放入浓硝酸中被溶解B. 生铁在潮湿的空气中生锈C. 铜在含有三价铁离子的溶液中质量减小D. 金属钠与水反应 19. 下列哪一组物质可配制成缓冲溶液 ( )A .NaH 2PO 4—Na 2HPO 4B .HOAc —NaClC .HOAc —HClD .NaOAc —NH 3· H 2O 20. 下列溶液中蒸气压最大的是 ( )A .0.10 mol ·L −1 KCl 溶液B .0.10 mol·L −1C 12H 22O 11溶液 C .1.0 mol·L −1 H 2SO 4溶液D .1.0 mol·L −1 C 12H 22O 11溶液第4页二、填空题(共10小题,每小题2分,共20分)21. 某元素原子序数为24,其原子的电子排布式为 。
大学无机化学期末试卷附详细标准答案

《无机化学》试题学号:姓名:座号:系别:年级:专业:总分合计人:复核人:一、单项选择题(在每小题列出地四个选项中只有一个选项是符合题目要求地,请选出正确选项并在“答题卡”地相应位置上涂黑.多涂、少涂、错误均无分.每小题1分,共40分)1、对于Zn2+/Zn电对,增大Zn2+地浓度,则其标准电极电势将()A 增大B 减小C 不变D 无法判断2、Cu2+离子地外层电子构型为()A 8eB 18e型C 18+2eD 9~17e型3、设氨水地解离平衡常数为K.浓度为m mol·L-1地氨水溶液,b若将其用水稀释一倍,则溶液中OH-地浓度(mol·L-1)为()Am 21 B θb K m ⋅21 C 2/m K b ⋅θ D 2m4、已知θsp K (Ag 3PO 4) = 1.4×10-16,其溶解度为 ( )A 1.1×10-4mol·L -1; B 4.8×10-5mol·L -1; C 1.2×10-8mol·L -1; D 8.3×10-5mol·L -15、下列各组物质,能自发发生反应地是 ( )A Cu 、Cu 2+; B Cr 2O 72-、Cr 3+; C MnO 2、Mn 2+;D SnCl 4、Sn 6、3d轨道地磁量子数可能是( ) A 1,2,3 B 0,1,2 C 0,±1 D 0, ±1, ±27、下列各分子中,以sp 3不等性杂化轨道成键地是 ( )A BeCl 2 B PCl 3 C BF 3 D SiH 48、熔化下列晶体时,只需克服色散力地是 ( )A HF B Ag C KF D CO 29.已知V E A/θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则判断发生歧化反应地是 ( )A 都不能 B Cr 2O 72- C Cr 3+ D Cr 2+10.下列各物质中,熔点最高地是()A K2OB MgOC CaOD Na2O11稀溶液依数性地本质是()A. 渗透压B. 沸点升高C. 蒸汽压下降D. 凝固点降低12要降低反应地活化能,可以采取地手段是( )A. 升高温度B. 降低温度C. 移去产物D. 使用催化剂13如果一个反应地吉布斯自由能变为零,则反应( )A. 能自发进行B. 是吸热反应C. 是放热反应D. 处于平衡状态14.反应A + B C,焓变小于零,若温度升高10℃,其结果是( )A.对反应没有影响B. 使平衡常数增大一倍C.不改变反应速率D.使平衡常数减小15.在HAc-NaAc缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液()A.抗酸能力强于抗碱能力B.抗酸能力弱于抗碱能力C.抗酸能力等于抗碱能力D.无法判断16.在室温下,0.0001mol.L-1NH3水溶液中地pKw是()A. 14B. 10C.4D.817.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱地物质是( )A.Cl-B. NH4+C. HCO3-D. H3O+18.AgCl在纯水中溶解度比0.10 mol·L-1 NaCl溶液中(AgCl: K sp = 1.77×10-10 ) ( )A.大B.小C.一样大D.无法判断19.CaSO4在0.1mol.L-1NaNO3溶液中地溶解度比在纯水中( )A.略有减小B.略有增加C.相等D.无法判断20.已知:Ksp,AgCl=1.8×10-10,Ksp,Ag2CrO4=1.1×10-12在等浓度地CrO42-和Cl-地混合溶液中,逐滴加入AgNO3时:()A.先产生AgCl↓B.先产生Ag2CrO4↓C.两种同时沉淀D.两者都不沉淀21.在酸性溶液中,当适量地KMnO4与Na2SO3反应时出现地现象是()A. 棕色沉淀B. 紫色褪去C.绿色溶液D.都不对22.下列电对中值最大地是( )A. (Ag+/Ag) B. (Ag(NH3)2+/Ag) C. (AgCl /Ag) D. (AgI/Ag)23.当pH = 10 时,氢电极地电极电势是- ( )A.-0.59 VB. -0.30 VC. 0.30 VD. 0.59 V24.4s电子地径向分布图有: ( )A.3个峰B.2个峰C.4个峰D.1个峰25.属于主量子数n= 3 地一个电子地四个量子数n,l,m,m s 取值正确地是( )A. 3,2,1,0B.3,2, -1,C. 3,3,1,D. 3,1, 2,26.量子力学中所说地原子轨道是指( )A.波函数ψn,l,m,ms B.电子云C.波函数ψn,l,m D.概率密度27.ψ(4,2,1)代表简并轨道中地一个轨道是( )A.4p轨道B.4d轨道C.4s轨道D.4f轨道28.下列轨道上地电子,在xy平面上地电子云密度为零地是()A.3S B.3P x C.3Pz D.3Py29.某元素原子基态地电子构型为[Ar] 3d 8 4s2 ,它在元素周期表中地位置是()A.s区B.p区C.d区D.f区30. Ag地价电子层结构是()A.3d 10 4s1 B.3d 9 4s2C.4d 10 5s1D.4d 10 4s2 31下列分子和离子中中心原子成键轨道不是sp2 杂化地是( )A.BF3 B.HCHO C.C2H4 D.NH332按分子轨道理论,O2地键级是-( )A.1 B.1C.2D.233.下列各分子中,偶极矩为零地分子为( )A.H2 O B.NH3 C.BF3 D.HCl34.下列化合物中没有氢键地是( )A.C2H4B.NH3C.HFD.H2O35.NH3中N原子采取地杂化方式是:()A. SP2B. SP3等性C. SP2dD. SP3不等性36.[Ni(en)3]2+离子中镍地价态和配位数是()A .+2,3B . +3,6C . +2,6D . +3,3 37. Fe(Ⅲ)形成地配位数为 6 地外轨配合物中,Fe 3+离子接受孤对电子地空轨道是 ( )A .d 2sp 3B . sp 3d 2C .p 3d 3D . sd 5 38.能够用于鉴定Fe 3+地特效试剂有( )A.KSCN B. HCl C. 邻二氮菲 D. 赤血盐39.在热碱性溶液中,次氯酸根离子不稳定,它地分解产物是 ( )A .Cl -和Cl 2 B .Cl -和ClO 3-C .Cl -和ClO 2-D .Cl -和ClO 4- 40.在温度T 和压力p 时理想气体反应:(ⅰ)2H 2O(g)=2H 2(g)+O 2(g)θ1K ;(ⅱ)CO 2(g)=CO(g)+1/2O 2(g)θ2K 则反应:(ⅲ)CO(g)+H 2O(g)=CO 2(g)+H 2(g)地θ3K 应为( )A θθθ213/K K K = , B θθθ213K K K ⋅= ,C θθθ213/K K K =,D θ3K =θ1K +θ2K二、判断题 (判断正确答案,选项并在“答题卡”地相应位置填涂,认为正确地涂“A”错误地涂“B ”.多涂、少涂、错误均无分,每小题1分,共10分)41.当主量子数n=4,共有4s,4p,4d,4f四个原子轨道. ()42.在任何原子中,3p轨道地能量总比3s轨道地能量高. ()43.由极性键形成地分子一定是极性分子.()44.共价键仅存在于共价型化合物中.()45.在相同原子间形成双键比形成单键地键长要短.()46.BF3分子是非极性分子,而B—F键是极性键.()47.先达到溶度积Ksp地先沉淀.()48.在氧化还原电对中,其氧化态地氧化能力越强,则其还原态地还原能力越弱.()49.通常情况下外轨型配合物地配位原子比内轨型配合物地配位原子地电负性大.()50.通H2S于Al2(SO4)3溶液中,得到Al2S3沉淀. ()三、完成题(本题共15分)(类型说明:完成或填空)51. 完成并配平下列反应(每小题2分,共10分)(1)、Cr2O72- + H+ + Fe2+ =(2)、MnO4- +H2O2 + H+ =(3)、Fe3+ +Cu =(4)、Cu2+ + I- =(5)、AgBr +S2O32- =52..填空(本题5分)元素符号S Ar ____ ____元素名称____ ____ 铜钼所属周期____ ____ ____ ____所属族____ ____ ____ ____价电子层地结____ ____ ____ ____构四、计算题(本题35分)53.已知Ka(HAc)=1.0×10-5 ,在20.0ml0.20mol.L-1 HAc中加入0.20mol.L-1 NaOH溶液,计算:(本题8分)(1)加入10.0mL NaOH溶液,混合溶液地pH为多少?(2)加入20.0mL NaOH溶液,混合溶液地pH为多少?54.(本题10分)试设计一个电池,使其进行下列反应Fe3++Ag Ag++Fe2+(1)写出电池地表示式,并计算298.15K时该电池反应地平衡常数θK;若将过量银粉加到浓度为0.1mol·kg-1地Fe(NO3)3溶液中,求当反应达到平衡后Ag+地浓度为多少?(已知Fe3+/Fe2+和Ag+/Ag地VE A/θ分别为0.771、0.799)55. (本题8分)298K 时,在NH 4Cl 溶液中有0.01 mol·kg-1地Fe 2+,若要使Fe 2+生成Fe(OH)2沉淀,需将pH 调节到多少才开始沉淀?(已知θSP K (Fe(OH)2)=4.87×10-17)56. (本题9分) 已知298K 时,化学反应 CO(g) + NO(g) → CO 2(g) +21N 2(g) θm f H ∆(KJ/mol) -110.52 90.25 -393.51 0 θm S (J/mol·K) 197.56 210.65 213.6 191.5θm f G ∆(KJ·mol) -137.15 86.57 -394.36 0 求此反应地θm r H ∆,θm r S ∆和θm r G ∆(298K),并讨论利用此反应净化汽车尾气中NO 和CO 地可能性.标准答案及评分标准(按试题顺序排列)一、单项选择题(在每小题列出地四个选项中请选出正确选项并在“答题卡”地相应位置上涂黑.多涂、少涂、错误均无分.每小题1分,共40分)ADCBD CBDAB CDDD B ACABA BAACB CBCCC DCCAD CBABC二、判断题(判断正确答案,选项并在“答题卡”地相应位置填涂,认为正确地涂“A”错误地涂“B ”.多涂、少涂、错误均无分,每小题1分,共10分)41.B 42.B 43.B 44.B 45.A46.A 47.A 48.A 49.A50.B 四、完成题(共15分)51. 配平下列各反应方程式: (本题10分)(1)Cr 2O 7- +14 H + + 6Fe 2+ = 2 Cr 3+ +6 Fe 3+ +7 H 2O2)、2MnO 4- +5H 2O 2 + 6H + = 2Mn 2+ +5 O 2 + 8H 2O3)、2Fe 3+ +Cu = 2 Fe 2+ + Cu 2+4)、2Cu 2+ +4 I - = 2CuI + I 25)、AgBr +2S 2O 32- = [Ag{S 2O 32-}2]3- + Br -52. 填空元素符号S Ar __Cu__ __Mo_ 元素名称__硫__ __氩__ 铜 钼 所属周期 __3__ ___3_ __4__ ___5_ 所属族 __6A__ ___零_ __1B__ __6B__价电子层地结构_3S 23P 4_ __3S 23P 6 3d 104S 1 _4d 55S 1___四、计算题(共35分)53. [H +]=Ka·NaAc HAcC C(1)加入10.0mL NaOH 溶液,混合溶液地pH 为5.0(2)加入20.0mL NaOH 溶液,混合溶液地pH 为9.054. 3解:解(1)反应式中Ag 被氧化成Ag +,Fe 3+被还原成Fe 2+,故设计地电池为 (-)Ag│Ag + (1m )‖Fe 3+(2m ), Fe 2+ (3m )│Pt (+))(0286.07998.0771.0//23V E Ag Ag Fe Fe -=-=-=+++θθθϕϕ485.0059.0)0286.0(1059.0lg -=-⨯==θθnE K 故328.0=θK (2)设平衡时Ag +地浓度为x mol·kg -1,则 Ag + Fe 3+ Ag + + Fe 2+平衡时 0.1-xx x 328.01.02=-=x x K θ 得)(08.01-⋅=kg mol x55、解 查表知θSP K (Fe(OH)2)=4.87×10-17因为 Fe(OH)2(s)Fe 2+(aq)+2OH -(aq) 所以θSP K (Fe(OH)2)=m (Fe 2+)·2m (OH) m (OH -)==⨯=-+01.01087.4)())((1722Fe m OH Fe K SP θ 6.98×10-8 pOH =-lg m (OH _)=-lg(6.98×10-8)=7.16 pH =14-pOH =6.8456解:),(),(),(21),(22g NO H g CO H g N H g CO H H m f m f m f m f m r θθθθθ∆-∆-∆+∆=∆ 25.90)52.110(0)51.393(---+-=)(24.3731-⋅-=mol KJ),(),(),(21),(22g NO S g CO S g N S g CO S S m m m m m r θθθθθ--+=∆ 65.21056.1975.191216.213--⨯+=)(9.9811--⋅⋅-=K mol J ),(),(),(21),()298(22g NO G g CO G g N G g CO G K G m f m f m f m f m r θθθθθ∆-∆-∆+∆=∆57.86)15.137(036.394---+-=)(78.3431-⋅-=mol KJ ⑵)(1077.3109.9824.37333K rG rH T m m --⨯=⨯--=∆∆=θθ转 当反应T <T 转(3.77×103K )时都可自发进行.版权申明本文部分内容,包括文字、图片、以及设计等在网上搜集整理.版权为个人所有This article includes some parts, including text, pictures, and design. Copyright is personal ownership.h8c52。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中 山 大 学
无 机 化 学(上)期 末 考 试 试 卷
化学、材料化学、临床医学专业2006级 2007年 1月 17日 姓名: 班别: 学号:
《中山大学授予学士学位工作细则》第六条:
“考试作弊不授予学士学位。
”
一、 选择题: 请把正确答案的字母填在各小题前的( )内。
(共15分)
( ) 1. 某元素多电子原子中,能量最高的电子是具有量子数
(n ,l ,m ,m s )的电子
A. 4,1,+1,+1/2 ;
B. 4,2,0,-1/2 ;
C. 3,2,+1,+1/2 ;
D. 3,2,+2,-1/2
( ) 2. 下列分子、离子中,呈逆磁性的是
A. NO ;
B. O 2 ;
C. NO 2 ;
D. O 22
( ) 3. 存在分子内氢键的是
A. HNO 3 ;
B. H 2O ;
C. NH 3
; D. CH 3-CH 3
( ) 4. 下列分子中,电偶极矩为0的是
A. PF 3 ;
B. NCl 3;
C. BCl 3 ;
D. OF 2
( ) 5. 元素原子第一电离能大小正确的顺序是
A. He < B < N < O ;
B. He > N > O > B;
C. He > O > N > B ;
D. He > B > N > O
( ) 6. 元素原子第一电子亲合能正确的顺序是
A. F < Cl < Br < I ;
B. F < Cl > Br > I ;
C. F > Cl > Br > I ;
D. F < Cl < Br > I
( ) 7. 键长顺序正确的是
A. O2+ < O2- < O22- < O2 ;
B. O22- < O2- <O2 +< O2 ;
C. O2 < O2+ < O2- < O22- ;
D. O2+ < O2 < O2- < O22-( ) 8. 下列化合物分子中, 键角最小的是
A. OF2 ;
B. Cl2O;
C. ClO2 ;
D. XeF2
( ) 9. 下列配离子中, 分裂能∆O最大的是
A. [Fe(CN)6]4- ;
B. [Fe(H2O)6]2+ ;
C. [Os(CN)6]4- ;
D. [Ru(CN)6]4-
( ) 10. 标准电极电位a. φθ(Ag+/Ag) ; b. φθ (AgCl/Ag) ;
c. φθ[Ag(CN)2-/Ag]; φθ大小正确关系是
A. a < b < c;
B. a > b > c;
C. a > b < c;
D. a < b > c
( ) 11. 金属铜晶体为面心立方结构,在单位晶胞内铜原子的数目是
A. 2;
B. 1 ;
C. 6;
D. 4
( ) 12. 下列配离子中, 磁矩最大的是
A. [Fe(H2O)6]3+ ;
B. [Cr(H2O)6]3+ ;
C. [Fe(CN)6]3- ;
D. [Co(NH3)6]3+
( ) 13. 按MO法, 下列分子或离子中键级最大的是
A. O2 ;
B. O2+ ;
C. N2+ ;
D. CO
( ) 14. 晶体熔点高低正确的顺序是
A. SiO2 > KCl > HF > HCl;
B. SiO2 > KCl > HCl > HF ;
C. KCl > SiO2 > HCl > HF ;
D. KCl > SiO2 > HF > HCl
( ) 15. 原子半径大小正确的顺序是
A. Mg > Na > B > Be ;
B. Na > Mg > B > Be ;
C. Na > Mg > Be > B ;
D. Mg > Na > Be > B
二、填空题(共30分)
1. [Cu(NH3)4]2+水溶液呈深蓝色,其原因是,K2Cr2O7水溶液呈橙色,其原因是发生。
2. [CrCl(NH3)(en)2]SO4称为, 六异硫氰酸根合铁(III)酸钾的化学式是。
3. 某元素M的基态原子价电子排布为3d54s2,该元素位于元素周期表的第周期、族,M3+与CN-组成的八面体配合物,其CFSE = 。
4. 与n = 4, l = 2, m = 0对应的原子轨道符号是。
5. “镧系收缩”是指
, 其影响包括:
(1) ;
(2) ;
(3) 。
6. SO2(g)的结构式可表述为
,
其中S - O键级约为。
7. 离子半径: Ag+ 126 pm, I 216 pm。
按“半径比规则”, AgI(s)
应具有型晶格, 而实际上它具有型晶格, 原因是。
8. 按Slater规则计算,21Sc原子4s轨道的能量是eV,
而3d轨道的能量是eV。
9. 铊元素原子基态核外电子排布式:
81Tl 。
10. 按价层电子对排斥模型(VSEPR)预测,ICl2-离子的价电子几何构型是;分子几何构型是。
11. 按MO法,N2+(g)的分子轨道式
是;N - N 键级是,N2+(g)是一种磁性离子。
12. PtCl2(OH)2(NH3)2八面体配合物中,有旋光异构体的一种几何异构体的结构式是。
13. 把反应Zn(s) + 2H+ (1 mol·dm-3) = Zn2+ (0.10 mol·dm-3) + H2 (1 pθ) 设计为原电池, 其表达式
是。
14. 电解熔融KCl, 其阳极反应是; 阴极反应是。
三、配平氧化还原反应方程式:(共10分)
1.氧化数法(要求写出配平步骤,标出元素氧化数的变化):
I2+ OH-(aq)→IO3-(aq) + I-(aq)
2.离子-电子法(要求写出2个“半反应”和总反应):
HNO2(aq)+ Cr2O72-(aq)→NO3-(aq)+ Cr3+(aq)
四、问答题(共20 分)
1. 实验测得NO2、NO2+和NO2-的键长、键角如下:
NO2NO2+NO2-键长/pm 119 110 124
键角132°180°115°
(1) 用杂化轨道理论写出NO2分子的中心原子的杂化成键过程,并指出NO2+、NO2-离子中,N原子的杂化态;
(2) 把VB法和MO法结合, 简要解释上述分子、离子的键长和键角的差异;
(3) 预言NO2分子的磁性和聚合性质,简要解释。
(参考键长: 正常N-O单键140 pm;正常N=O双键115 pm)
(10 分)
2. 实验测得[Co(NH3)6]3+逆磁,而[CoF6]3-的磁矩约为4.9 B.M. (1) 写出[Co(NH3)6]3+的中心离子Co3+的杂化成键过程,并指出[CoF6]3-中,中心离子Co3+的杂化态;
(2) 分别计算[Co(NH3)6]3+和[CoF6]3-的CFSE;
(3) 分别用VB法和晶体场理论讨论这两种配合物的稳定性和几何构型,比较两法的优、缺点。
(10 分)
五、原子结构、分子结构、晶体结构、配合物与配位平衡和氧化还原与电化学小结(2个A4版面,另纸书写)。
(10 分)
六、计算题(15分)一原电池为:
(-) Ag(s) | Ag(CN)2- (1.0 mol/dm3), CN- (1.0 mol/dm3) || OH- (1.0
mol/dm3) | O2(g) (1.0 pθ), Pt(s) (+)
已知:φθ (O2 / OH-) = 0.40 V, φθ(Ag+ / Ag) = 0.80 V. 测得上述原电池的电动势为0.84 V.
1.写出上述原电池放电的负极反应、正极反应和总反应;
2.计算K稳θ [Ag(CN)2-];
3.求下列反应的平衡常数Kθ:
4 Ag(s) + O2(g) + 8 CN-(aq) + 2 H2O = 4 [Ag(CN)2-] + 4 OH-(aq)
4.矿物中的单质银,可否自发溶解在KCN – KOH 混合溶液中(假定空气中O2分压力为0.21 pθ,其余物质在标准态)?。
