分子发光光谱法
分子发光光谱法

内转换
内转换:同多重度电子能级中,等能级间的无辐 射能级交换。 通过内转换和振动弛豫,高激发单重态的电子 跃回第一激发单重态的最低振动能级。
外转换 外转换:激发分子与溶剂或其他 分子之间产生相互作用而转移能 量的非辐射跃迁; 外转换使荧光或磷光减弱或“ 猝灭”。
系间跨越 系间跨越:不同多重态,有重叠的转动能级间的非 辐射跃迁。 改变电子自旋,禁阻跃迁,通过自旋—轨道 耦合进行。
荧光强度对温度变化敏感。
一般地,随温度降低,溶液中荧光物质的量子效率和荧光强
度将增大,并伴随光谱的蓝移。温度增加,碰撞频率增加, 使外转换的去激发几率增加。
(3) pH的影响
对酸碱化合物,溶液pH的影响较大,需要严格控制; 如苯胺:在pH 5-12溶液中,以分子形式存在,有荧光。
pH< 5时以苯胺阳离子形式存在,无荧光
ex em
(3)可变波长同步扫描荧光法:使两单色器在扫描过程中以 不同的速率同时进行扫描,即波长可变。
同步扫描荧光法的特点:
优点:
(1)使光谱简化; (2)使谱带窄化;
(3)减小光谱的重叠现象;
(4)减小散射光的影响。
例如:采用同步扫描技 术检测如图萘、蒽、菲 、芘混合物,可简化光 谱,减少光谱重叠,提 高分辨率。 缺点: 因为同步扫描荧光损失了 其它光谱带所含的信息, 对光谱学的研究不利。
比较法:
在线性范围内,测定标样和试样的荧光强度,直接
比较。
三、荧光分析法的应用
可采用直接测定法或间接测定(荧光猝灭)法
1、无机化合物的分析
与有机试剂配合物后测量;可测量约60多种元素。 铍、铝、硼、镓、硒、镁、稀土常采用荧光分析法; 氟、硫、铁、银、钴、镍采用荧光熄灭法测定; 铜、铍、铁、钴、锇及过氧化氢采用催化荧光法测定; 铬、铌、铀、碲采用低温荧光法测定; 铈、铕、锑、钒、铀采用固体荧光法测定
分子荧光光谱法

磷光是分子吸光成为激发态分子,在返回基态时 的发光现象.
荧光:受光激发的分子从第一激发单重态的最低 振动能级回到基态所发出的辐射。
磷光: 从第一激发三重态的最低振动能级回到基 态所发出的辐射。
1~3 ;
荧光分析法的特点
★★★
因应能试
为用提样
有范供用
态.当吸收一定频率的电磁辐射发生能级跃迁时,可上升到不同激发态
的各振动能级,其中多数分子上升至第一激发单重态这一过程约需10-
15秒.
激发
2 去活化过程
激发态分子的失活: 激发态分子不稳定,它要以辐射 或无辐射跃迁的方式回到基态
☆振动驰豫 (Vibrational relaxation)
☆荧光发射(Fluorescence)
荧光分析法的应用
无机物分析 无机离子中除少数例外一般不发荧光.但很多 无机离子能怀一些有机试剂形成荧光络合物,而进行定量 测定.
生物化学及生理医学方面的应用 荧光法对于生物中许多 重要的化合物具有很多的灵敏度和较好的物效性,故广用 于生物化学分析,生理医学和临床分析.
药物分析
目前还采用荧光分光光度计作为高效液相色谱,薄层色谱 和高效毛细管电泳等的检测器,使有效的分离手段与高灵 敏度,高选择性的测定方法结合起来,可用于测定复杂的混 合物.
荧光与环境因素的关系
★温度降低会使荧光强度增大; ★PH 带有酸性或碱性取代基的芳 香化合物的荧光与pH有关; ★溶剂 溶剂极性增加有时 会使荧光强度增加,荧光波长红移; 若溶剂和荧光物质形成氢键或使荧 光物质电离状态改变,会使荧光强度 、荧光波长改变;含重原子的溶剂 (碘乙烷、四溴化碳)使荧光减弱。 ★溶解氧的存在往往使荧光强度 降低。 ★激发光的照射
第十一章 分子发光―荧光、 磷光和化学发光光谱法Molecular .

已逐步形成一支在这个研究领域中的工作队伍,研究内
容2已020从/6/15经典的荧光分析方扩展到新近发展起来的新技术。
返回第一张
上一张幻灯片 下一张幻灯片
§11-1 分子荧光和磷光光谱法
1.产生机理
在一般温度下,大多数分子处在基态的最低振动 能级。处于基态的分子吸收能量(电能、热能、化 学能或光能等到)后天激发为激发态。激发态是很 不稳定的,它得很快地释放出能量又重新跃迁回 基态。若分子返回基态时以发射的电磁辐射(即光) 的形式释放能量,就称为“发光”;如果物质的 分子吸收了光能而被激发,跃迁回基态所发射的 电磁辐射,称为荧光和磷光。现从分子结构理论 来讨论荧光和磷光的产生机理。
进入二十世纪以后,荧光现象被研究得更多了,在理论 或实验技术上都得到极大的发展。特别是随着激光、计 算机和电子学的新成就及技术的引入,大大推动了荧光 分析法在理论上及实验技术的发展,出现了许多新的理 论和新的方法。
在我国,二十世纪五十年代初期仅有极少数的分析工作
者从事荧光分析方面的研究工作。到了 下一张幻灯片
磷光也是某些物质受紫外光照射后产生的光。1944年 Lewis和Kasha提出了磷光与荧光的不同概念,指出磷光 是分子从亚稳的激发三重态跃迁回基态所发射出的光, 它有别于从激发单态跃迁回基态所发射的荧光。磷光分 析法由于其有某些特点,几十年来的理论研究及应用也 不断得到发展。
2020/6/15
返回第一张
上一张幻灯片 下一张幻灯片
处于分子基态单重态的分子轨道上的电子,激发 时不能直接跃迁至第一激发三重态轨道上(不符 合光谱选择定则),但处于单重激发态的轨道上 的电子,可以通过体系跨越(系间窜跃),转移 到三重态轨道上;在这个过程中,处于激发态的 电子自旋发生变化,这个过程需要时间较长,故 处于三重激发态的寿命为10-4~1s;当其由三重激 发态的最低振动能级跃迁回基态时产生磷光。
第九章分子荧光光谱法Molecular-fluorescence-spectroscopy

特殊点:有两个单色器,光源与检测器通常成直角。 基本流程如图: 单色器:选择激发光波长 的第一单色器和选择发射 光(测量)波长的第二单色 器; 光源:灯和高压汞灯,染 料激光器(可见与紫外区) 检测器:光电倍增管。
仪器框图
该型仪器可进 行荧光、磷光 的发光分析;
同步扫描技术
根据激发和发射单色器在扫描过程中彼此间所保持的 关系,同步扫描可分为固定波长差(Δλ)和固定能量差及可 变波长三种;
辐射复合发光过程:
1. 自由激子复合(X); 2. 导带电子—中性受主复合
(e,A0); 3. 施主—受主对复合
(D0,A0); 4. 束缚于中性施主上的——
激子复合 (D0,X); 5. 中性施主——价带空穴的复合(D0,h);
中性受主、电离施主或受主上的和等电子杂质上的束缚激子复合而发 光。
3.激发光谱与发射光谱的关系
(4)取代基效应:芳环 上有供电基,使荧光增 强。
3.内滤光作用和自吸现象
内滤光作用:溶液中含有能吸收激发光或荧光物质发射 的荧光,如色胺酸中的重铬酸钾;
自吸现象:化合物的荧光发射光谱的短波长端与其吸收 光谱的长波长端重叠,产生自吸收;如蒽化合物。
4、溶液荧光的猝灭
碰撞猝灭: 氧的熄灭作用等。
四、仪器结构流程
2. 激发态分子的失活: 激发态分子不稳定,它要以辐射
或无辐射跃迁的方式回到基态。
λ1
λ2
λ2/
λ3
λ4
无辐射跃迁:
(1) 振动弛豫:激发态分子由同一电子能级中的较高振动能 级转至较低振动能级的过程,其效率较高。 (2) 内转换:相同多重态的两个电子能级间,电子由高能级 回到低能级的分子内过程。 (3) 系间窜越: 激发态分子的电子自旋发生倒转而使分子的 多重态发生变化的过程。 (3) 外转换:激发态分子与溶剂或其它溶质相互作用、能量 转换而使荧光 (或磷光)减弱甚至消失的过程。荧光强度的
分子荧光光谱法

荧光光谱 磷光光谱
辐射跃迁只使激发态分子衰变到基态的不同振动 能级,然后通过振动松弛进一步损失能量。
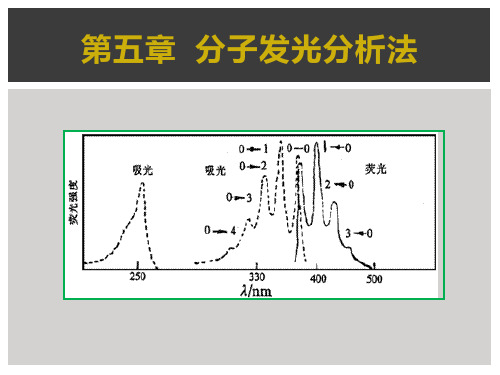
图2 萘的激发光谱I、荧光II和 磷光光谱III
荧光与分子结构的关系
具有大的共轭π键的结构 化合物
ϕF
λex/nm
λem/nm
含有π→π*跃迁能级的芳 苯
0.11
205
278
香族化合物的荧光最强芳环 蒽
0.29
286
321
越大其荧光峰越移向长波长 萘
0.46
365
400
方向,且荧光长度往往比较
丁省
0.60
390
480
强。
戊省
0.52
580
640
取代基的影响
给电子基团,如-0H、-OR、 -NH2、-CN、-NR2等,使 荧光增强。
分子荧光光谱法
molecular fluorescence analysis
CONTENTS
01 概述/ 02 荧பைடு நூலகம்分析基本原理/ 03 荧光分析仪器 /
04 检测结果与分析/ 05 对比与发展 /
Part 01
概述
overview
原子光谱法 分子光谱法
主要研究内容
The Main Contents Of The Research
系间窜越 isc
03 不同多重态的两个电子态间的非辐射跃迁过 程(例如S1---T1,T1---S0)
内转换
振动弛豫
S2
系间跨越
S1
能
量
分子发光分析法
只有在极稀的溶液中,当 b c <0.02时才成立,对于浓度较 高的溶液,由于自猝灭和自吸收等原因,使荧光强度和荧光 物质浓度不呈线性关系。
3 .荧光的产生与分子结构的关系
• 分子产生荧光必须具备两个条件: • 物质分子必须具有能吸收一定频率紫外可见辐射
的特征结构,分子必须具有吸光的结构 • 吸光后被激发的分子还必须具有高的荧光量子产
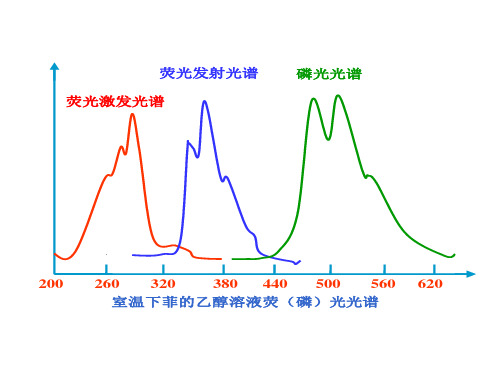
荧光发射光谱 荧光激发光谱
磷光光谱
200 260 320
380 440醇溶液荧(磷)光光谱
7-1 概述
• 分子发光分析法包括荧光分析法、磷光分析法和化学发光 分析法。这三种都是通过测量被激发的分子回到基态时所 发射的光辐射来进行分析的,不同之处在于光谱产生的机 制。
荧光强度 If正比于吸收的光量Ia和荧光量子效率 :
•
If = Ia
•
由朗-比耳定律: Ia = I0(1-10- b c )
•
If = I0(1-10- b c ) = I0(1-e-2.3 b c )
• 浓度很低时,将括号项近似处理后:
•
If = 2.3 I0 b c = Kc
② 荧光 (或磷光)发射光谱
• 固定激发光波长(选最大激发波长), 化合物发射的荧光(或 磷光强度)与发射光波长关系曲线。
荧光发射光谱 荧光激发光谱
磷光光谱
200
260 320
380 440 500 560 620
室温下菲的乙醇溶液荧(磷)光光谱
③ 激发光谱与发射光谱的关系
(1) Stokes(斯托克斯)位移 激发光谱与发射光谱之间的波长差值。发射光谱的波长比
激发光谱的长,振动弛豫消耗了能量。 (2) 荧光光谱的形状与激发波长无关 电子跃迁到不同激发态能级,吸收不同波长的能量(如l2
分子发光光谱法-荧光光谱

分子发光光谱法
荧光光谱
常用术语
激发光 发光分子
荧光(发射光)
紫外灯照射 荧光油墨区域 明亮图案
基态 第一激发态 吸 收 荧 光
E
电子能级跃迁与分子荧光
λex: 荧光激发波长 (excitation wavelength);
λem: 荧光发射波长 (emission wavelength).
一般指最大激发和发射波长, 用于定量分析. 激发光谱 发射光谱 λex λem λ (nm)
激发 发射
激发 发射
分子荧光光谱
分子荧光发射光谱的特性
——斯托克斯(Stokes)位移
分子的荧光发射波
长总是比其相应的
吸收(或激发)光
谱的波长长。
荧光磷光
分子荧光发射光谱的特性——镜像对称规则
分子的荧光发射光
谱与其吸收光谱之
间存在着镜像关系。
分子荧光发射光谱的特性
——荧光发射光谱的形状与激发波长无关
)
101(0bc F F I k I ε--Φ=在稀溶液中, 当εbc<0.05, 荧光强度与浓度呈线性关系
bc
I k I F F ε0Φ= c 荧光物质浓度 φF 荧光量子产率 I 0 激发光强度 ε 摩尔吸光系数 b 光程长度 k 常数
荧光强度和浓度的关系。
分子发光光谱法

由于物理主义的进步,人们发现分子发光光谱的重要性,它的应用也
越来越普遍。
分子发光光谱是一种用来测量分子光学性质的技术。
它
通过测量发光分子的光谱图,可以获得更多完整且准确的信息,而这
些信息有助于揭示分子结构与性质的关系。
分子发光光谱是一种活性技术,它利用光谱来了解化学反应物的结构。
这项技术利用发出的光的频率和强度来分析分子,由于分子的结构它
们发出的光每个都有不同的频率和强度。
另外,分子发光光谱还能够
反映分子间的相互作用,从而在实验室中观察分子间的相互作用。
分子发光光谱法在科学研究中也得到广泛应用,它被用来研究分子的
结构、反应机理、生物活性及其过程,广泛应用于有机合成、药物研
究及生物化学等领域。
它已经成为结构和生物活性异质性测定的重要
手段,其应用范围也得到了显著的扩展。
例如,分子发光光谱被用来
研究有机和无机分子的生物活性和结构特征,以及有机分子間的相互
作用。
它还可以用来分析酶的结构和功能,从而帮助人们了解酶的作
用机制,还可以检测药物的生物学活性和结构。
未来,分子发光光谱将继续在科学研究中得到广泛应用,将在许多实
际领域,如医学、农业等方面发挥重要作用。
它将为人们提供更多关
于分子结构和性质的信息,从而有助于更深入地探索分子的特性和机制。
分子荧光光谱法

菲
线状环结构比非线状 结构的荧光波长长
• 芳香族化合物因具有共轭的不饱和体系, 芳香族化合物因具有共轭的不饱和体系, 多数能发生荧光 • 多环芳烃是重要的环境污染物,可用荧光 多环芳烃是重要的环境污染物, 法测定 • 3,4 - 苯并芘是强致癌物 , 苯并芘是强致癌物
λ ex = 386 nm λem = 430 nm
(二)荧光与有机化合物结构的关系
物质只有吸收了紫外可见光,产生π 物质只有吸收了紫外可见光,产生π → π*,n → π* 跃迁, 跃迁,产生荧光 跃迁相比,摩尔吸收系数大10 π → π*与n → π*跃迁相比,摩尔吸收系数大102~103, 寿命短 跃迁常产生较强的荧光, π → π*跃迁常产生较强的荧光, n → π*跃迁产生的 荧光弱
1. 电子自旋状态的多重性
大多数分子含有偶数电子,基态分子每一个轨道 大多数分子含有偶数电子, 中两个电子自旋方向总是相反的↑↓ 中两个电子自旋方向总是相反的↑↓ ,处于基态单 重态。 当物质受光照射时, 重态。用 “S0” 表示 ;当物质受光照射时,基态 分子吸收光能产生电子能级跃迁, 分子吸收光能产生电子能级跃迁,由基态跃迁至 更高的单重态,电子自旋方向没有改变, 更高的单重态,电子自旋方向没有改变,净自旋 = 0 .这种跃迁是符合光谱选律的 第一激发单重态 S1
VR S2 IC VR S1 ISC
VR:振动驰豫 : IC:内部转换 : ISC:系间窜跃 :
T1
S0 吸光 吸光
S0
3. 荧光光谱的产生—辐射去激 荧光光谱的产生—
处于S 处于S1或T1态的电子返回S0态时,伴随有发光现 态的电子返回S 态时, 象,这种过程叫辐射去激 发光 S0 S1或T1 荧光: (1)荧光: 当电子从第一激发单重态S 当电子从第一激发单重态S1的最低振动能级回到基 态S0各振动能级所产生的光辐射叫荧光 荧光是相同多重态间的允许跃迁,产生速度快, 荧光是相同多重态间的允许跃迁,产生速度快, 10-9~10-6s,又叫快速荧光或瞬时荧光,外部光源停 又叫快速荧光或瞬时荧光, 止照射, 止照射,荧光马上熄灭 无论开始电子被激发至什么高能级,它都经过无辐 无论开始电子被激发至什么高能级, 射去激消耗能量后到S 的最低振动能级,发射荧光, 射去激消耗能量后到S1的最低振动能级,发射荧光, 荧光波长比激发光波长长。 荧光波长比激发光波长长。 λ 荧>λ激
第二章分子发光分析
(3) 刚性平面结构 实验发现,多数具有刚性平面结构的 有机分子具有强烈的荧光。
因为这种结构可以减少分子的振动, 使分子与溶剂或其它溶质分子的相互作用 减少,也就减少了碰 撞去活的可能性。
19
(4)取代基效应
给电子基团,荧光增强(-OH、-OR、-CN、-NH2)
芳环上 取代基ຫໍສະໝຸດ 产生了p-共轭作用,增强了电子共轭程度,使最低 激发单重态与基态之间的跃迁几率增大。
4
2.分子内的光物理过程
其中S0、S1和S2分别表示分子的基态、第一和第二电子激发的单重态
T1和T2则分别表示分子的第一和第二电子激发的三重态。
V=0、1、2、3、…表示基态和激发态的振动能级。
5
非辐射能量传递过程;
S1
S2
T1
S0 吸光1
吸光2
振动弛豫:
在同一电子能级 中,电子由高振 动能级转至低振 动能级,而将多 余的能量以热 的
A + B C* + D C* C + h
36
间接发光是被测物A或B,通过化学反应生成初始激发态产
物C* , C* 不直接发光,而是将其能量转移给F,使F跃迁 回基态,产生发光。
A + B C* + D C*+F F* + E F* F + h
2. 气相化学发光和液相化学发光
(1)气相化学发光
(一)荧光和磷光的产生
从分子结构理论来讨论
振动能级
电子所处的能级
分子中电子
转动能级
的能量状态
S=0, J=1 单重态S表示
(所有电子都是自旋配对的) 电子的多重态 大多数基态分子都处于单重态
J=2S+1
分析化学-分子发光分析法
3. 流式细胞术(FCM) 对悬液中的单细胞或其他生物粒子,通过检测
标记的荧光信号,实现高速、逐一的细胞定量 分析和分选的技术。
§4 化学发光分析法
Chemiluminescence Analysis
基本原理 化学发光反应类型 化学发光测量仪器 化学发光分析法的应用
一、基本原理
化学发光是由于化学反应而导致的光发射。 发生于生命体系的化学发光称为生物发光。 生物发光均有酶(荧光素酶)参加。
最大化学发光强度与发光物质浓度成正 比: Icl max = Kc
化学发光的积分值与发光物质浓度成正 比: Icl = Kc
二、化学发光反应的类型
直接化学发光
A 十 B C* , C* C 十 hν
间接(敏化)化学发光 A 十 B C* + D , C*+ F C 十 F*
F* F 十 hν
三、New technique of fluorescence analysis
1. 激光荧光分析 F 与 I0 成正比,激光的强度大,可提高
荧光法的灵敏度。
2.时间分辨荧光分析
由于不同分子的荧光寿命不同,在激发 和检测之间延缓一段时间,使不同荧光寿命 的物质达到分别检测的目的。
时间分辨荧光免疫法 将稀土元素的螯合物标记抗体,与体液中 的抗原结合。当加入一种增效剂时,稀土 元素被释放出来,形成新的螯合物,能产生 长寿命的 荧光(10 ~1000 μs)。待样品中 蛋白质等物质所发荧光完全衰减后进行测定, 可有效消除背景干扰。 已用于测定甲胎蛋白、促性腺绒毛激素、 皮质醇等体内微量物质的测定。
2.化学发光免疫分析仪
化学发光免疫分析是将化学发光分析和 免疫分析相结合而建立的一种超微量分析 技术。兼具发光分析的高灵敏性和抗原抗 体反应的高特异性的特点。
分子荧光与分子磷光光谱法

(二)激发光谱曲线和荧光、磷光光谱曲线 荧光和磷光均为光致发光,因此必须选择合适的激发光波长,可根 据它们的激发光谱曲线来确定。绘制激发光谱曲线时,固定测量波 长为荧光(或磷光)最大发射波长,然后改变激发波长,根据所测 得的荧光(磷光)强度与激发光波长的关系,即可绘制 激发光谱 曲线。
激发三重态:分子吸收能 量,电子自旋不再配对, 为三重态,称为激发三 重态,以T1,T2….表示。
基态:电子自旋配对, 多重度=2s+1=1,为单 重态,以S0表示。
三重态能级低于单重态 (Hund规则)
3
在单重激发态中,两个电子平行自旋,单重态分子具有抗磁 性,其激发态的平均寿命大约为10-8s,而三重态分子具有顺磁性, 其激发态的平均寿命为10-4 ~ 1s以上(通常用S和T分别表示单重 态和三重态)。
当两个电子能级非常靠近以至其振
动能级有重叠时,常发生电子由高
S2
能级以无辐射跃迁方式转移至低能
级。右图中指出,处于高激发单重
态的电子,通过内转移及振动弛豫,
均跃回到第一激发单重态的最低振
动能级。
S0
内转移
S1 T1
吸光1 吸光2
荧光、磷光 能级图
6
荧光发射
处于第一激发单重态中的电子跃回至
基态各振动能级时,将得到最大波长
指不同多重态间的无辐射跃迁,例如
S1→T1就是一种系间窜跃。通常,发
生系间窜跃时,电子由S1的较低振动
能级转移至T1的较高振动能级处。有
S2
时,通过热激发,有可能发生T1→S1,
然后由S1发生荧光。这是产生延迟荧
光的机理。
系间窜跃
S1 T1
S0 吸光1
吸光2 荧光3
现代生物仪器分析第三章 分子荧光光谱法

第二节 荧光分析的原理
(一)荧光发生机理 物质的基态分子受一激发光源的照射, 被激发至激发态,在返回基态时,产生 波长与入射光相同或较长的荧光。 通过测定物质分子产生的荧光强度进行
分 析 的 方 法 称 为 荧 光 分 析 (fluorescence analysis)。
1、分子的激发态
荧光和磷光这两种光致发光过程的机理不同, 可从实验观察激发态分子寿命的长短来加以区 别: 对于荧光来说,当激发光停止照射后,发光 过程几乎立即停止(在10-9~10-6秒,荧光寿 命fluorescence life time )。 磷光则将持续一段时间(在10-3~10秒)。
荧光分析法发展简史
2、分子荧光和磷光的产生
分子在室温时基本上处于电子能级的基态。当吸 收了紫外—可见光后,基态分子中的电子只能跃 迁到激发单线态的各个不同振动—转动能级,根 据自旋禁阻规律,不能直接跃迁到激发三重态的 各个振--转能级。 处于激发态的分子是不稳定的,它可能通过辐射 跃迁和无辐射跃迁等分子内的去活化过程释放多 余的能量而返回至基态,发射荧光是其中的一条 途径。
世界上第一次记录荧光现象是16世纪 西班牙的内科医生和植物学家 N.Monardes。 1575年他提出在含有一种木头切片的 水溶液中,可观察到极可爱的天蓝色。
1852年,stokes在考察奎宁和叶绿素的 荧光时,用分光光度计观察到其荧光的 波长比入射光的波长稍微长些,从而导 入了荧光是光发射的概念。 18工作。应用铝—桑色素配 合物的荧光进行铝的测定。 19世纪以前,荧光的观察是靠肉眼进行 的,直到1928年,才由Jette和West完成 了第一台荧光计。
激发单重态与激发三重态的性质不同
分子发光分析

荧光强度和荧光光谱不同
26
27
3、荧光猝灭
定义:荧光物质分子与溶剂分子或其它溶质分子
的相互作用引起荧光强度降低的现象 碰撞猝灭荧激光发分单子重以态无的辐荧射光跃分迁子的与方猝式灭回剂到分基子态相碰撞
静态猝灭 荧光物质分子与猝灭剂分子生成非荧光
的络合物
类型 转入三重态的猝灭 溶解氧与荧光物质 发生电子转移反应的猝灭 猝灭剂与荧光物质
2. 荧光与有机化合物结构的关系 (1)跃迁类型
实验证明,对于大多数荧光物质,首先经历 激发,然后经过振动弛豫或其他无辐射 跃迁,再发生 跃迁而得到荧光。 (2)共轭效应 实验证明,容易实现激发 的芳香族化合物 容易发生荧光,增加体系的共轭度荧光效率一般 也将增大,主要是由于增大荧光物质的摩尔吸光 系数,有利于产生更多的激发态分子
4
2.分子内的光物理过程
其中S0、S1和S2分别表示分子的基态、第一和第二电子激发的单重态
T1和T2则分别表示分子的第一和第二电子激发的三重态。
V=0、1、2、3、…表示基态和激发态的振动能级。
5
非辐射能量传递过程;
S1
S2
T1
S0 吸光1
吸光2
振动弛豫:
在同一电子能级 中,电子由高振 动能级转至低振 动能级,而将多 余的能量以热 的
1.如何获得较强的磷光
磷光发射:电子由第一激发三重态的最低振动能级
→基态, T1 → S0跃迁;
电子由S0进入T1的可能过程:( S0 → T1禁阻跃迁)
增加试样的刚性:
低温冷冻
固体磷光法:
吸附于固相载体(滤纸)
分子缔合物的形成:
加入表面活性剂等
重原子效应:
加入含重原子的物质,如银盐等
第四章 分子光谱法

一、概述
分子和原子一样,也有它的特征分子能级, 分子和原子一样 ,也有它的特征分子能级 , 分子内 部的运动可分为价电子运动、 部的运动可分为价电子运动、 分子内原子在平衡位置附 近的振动和分子绕其重心的转动。 近的振动和分子绕其重心的转动。因此分子具有电子能 振动能级和转动能级。 级、振动能级和转动能级。 分子从外界吸收能量后,就能引起分子能级的跃迁, 分子从外界吸收能量后,就能引起分子能级的跃迁, 即从基态跃迁到激发态, 即从基态跃迁到激发态,分子吸收能量同样具有量子化的 特征,即分子只能吸收等于二个能级之差的能量,符合: 特征,即分子只能吸收等于二个能级之差的能量,符合: ⊿E=E2-E1=hν=hc/λ = 由于三种能级跃迁所需能量不同, 由于三种能级跃迁所需能量不同,所以需要不同波长 的电磁辐射使它们跃迁, 的电磁辐射使它们跃迁,即在不同的光学区域出现吸收或 发射谱带。 发射谱带。
第一节
紫外- 紫外-可见吸收光谱法
一、紫外可见吸收光谱
紫外可见吸收光谱法是研究分子吸收190紫外可见吸收光谱法是研究分子吸收 750nm波长范围内的吸收光谱 。 紫外可见吸收 波长范围内的吸收光谱。 波长范围内的吸收光谱 光谱主要产生于分子中价电子在电子能级间的跃 是研究物质电子光谱的分析方法, 迁,是研究物质电子光谱的分析方法,通过测定 分子对紫外可见光的吸收, 分子对紫外可见光的吸收,可以鉴定和测定大量 的无机化合物和有机化合物。 的无机化合物和有机化合物。
2. 分子磷光:处于最低单重激发态的分子以无辐 分子磷光: 射弛豫方式进入第一最低三重激发态, 射弛豫方式进入第一最低三重激发态,再由三重 激发态跃迁回到基态而发出的光。 激发态跃迁回到基态而发出的光。 分子荧光和磷光同属光致发光, 分子荧光和磷光同属光致发光,磷光发射则 在超过10-5s后发生,并且在激发的电磁辐射停止 后发生, 在超过 后发生 照射后,仍能持续数分钟至数小时。 照射后,仍能持续数分钟至数小时。 3. 化学发光:是化学反应物或反应产物受反应释 化学发光: 放的化学能激发而产生的光辐射。 放的化学能激发而产生的光辐射。
分子荧光光谱法

单色器: 第一单色器——选择激发光波长λ1 (>250nm的紫外 光),称为激发单色器。 第二单色器——选择(测量)发射光(荧光)波长λ2 , 与激发光入射方向垂直,称为荧光单色器。
样品池: 采用低荧光材料,通常为石英池。 检测器: 光电倍增管。
Ⅳ、荧光法的应用
荧光法灵敏度高、选择性好,可用于痕量 分析,但是能产生荧光的物质较少,使其 应用范围较小。
(2)Stokes位移 Stokes位移是指激发光谱与荧光光谱之间的波长 差值。 荧光的波长总是大于激发光的波长。这是由于发 射荧光之前的振动驰豫和内转换过程损失了一定的能 量。
(3)荧光光谱的形状与激发光波长无关 电子跃迁到不同激发态,吸收不同波长的能 量,产生不同的吸收带,但荧光均是激发态电子 回到第一激发单重态的最低振动能级再跃迁回到 基态而产生的,这与荧光物质分子被激发至哪一 能级无关。因此,荧光光谱的形状和激发光的波 长λ1无关。
溶液浓度较低时:
F K I 0 2.303bc
当入射光的λ1 和 I0一定时 : F=Kc 即: 在低浓度时,溶液的荧光强度与荧光物质 的浓度成正比。 ————这是荧光法定量的基础。
7.影响荧光强度的因素
(1)内部因素
自猝灭——发光物质分子间碰撞而发生的能量无辐射 转移。自猝灭随溶液浓度的增加而增加。
分子荧光产生机理
1.光谱类型
荧光光谱是物质分子 吸收紫外光后产生的分子 发射光谱。 2.跃迁类型
分子中原子的电子能 级跃迁,伴随振动能级的 跃迁。
3.分子的激发与失活
(1)分子的激发
基态→激发态(S1、S2、激发态振动能级):吸收特定 频率的辐射,跃迁一次到位。 激发态→基态:多种途径和方式,速度最快、激发态 寿命最短的占优势。
分子发光光谱法资料

(b)减弱荧光的取代基 ——-COOH 、 -NO2 、-
COOR 、-NO、-SH 吸电子基团, 使荧光波长蓝移, 荧光强度减弱
芳环上被F、Cl、Br、I 取代后,使系间跨跃加强,磷 光增强,荧光减弱。其荧光强度随卤素原子量增加而 减弱,磷光相应增强,这种效应为重原子效应。
(c)影响不明显的取代基 —— -NH3+、-R、
温度对磷光影响更大
3. pH的影响
大多数含有酸性或碱性基团的芳香族化合物的荧 光性质受溶液pH的影响很大
共轭酸碱对是具有不同荧光性质的两种型体,具 有各自的荧光效率和荧光波长
例: 苯酚
_
OH
O
_
OH
H+
pH≈1有 pH≈13
荧光
无荧光
离子化后, 荧光消失
但两个苯环相连的化合物,又表现出相反的性质, 分子形式无荧光,离子化后显荧光
只有在浓度低时使用,荧光物质测定的是微量或 痕量组分,灵敏度高
浓度高时, If与C不呈线形关系,有时C增大, If 反而降低,有时发生荧光猝灭效应。
14.3 荧光和磷光分析仪器
(一)荧光分析仪器——主要由光源、2个单色器、 液槽、检测器和显示器组成
光源
I0
I
第一单色器
液池
吸收检测器
l ex
与分光光度计有两点不同 ①两个单色器
荧光—荧光分析法
光致发光:以光源来激发而发光 磷光—磷光分析法
电致发光:以电能来激发而发光 生物发光:以生物体释放的能量激发而发光 化学发光:以化学反应能激发而发光—化学发光分析法
二、分子荧光分析法的特点
1. 灵敏度高 荧光强度随激发光强度增强而增强(提高激发光
强度,可提高荧光强度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4. 三维荧光光谱
以荧光强度为激发波长和发射波长的函数得到的光谱图为三 维荧光光谱,也称总发光光谱,等高线光谱。
(1)三维曲线光谱图; (2)平面显示的等强度线光谱图
5、荧光光谱的特征
(1)Stokes位移 由于振动弛豫及溶剂分 子弛豫作用消耗了部分
能量,使发射光谱的波
长比激发光谱的长。
(2) 镜像对称规则
(2)辐射能量传递过程 荧光发射:电子由第一激
荧光发射
发单重态的最低振动能级
→基态( 多为 S1→ S0跃 迁),发射波长为 ’2的 荧光; 10-7~10 -9 s 。 发射荧光的能量比分子
, 2
吸收的能量小, ’2 > 2
> 1;
磷光发射
磷光发射:电子由第一激发三重
态的最低振动能级→基态( T1 → S0跃迁); 电子由S0进入T1的可能过程: ( S0 → T1禁阻跃迁) S0 →激发→振动弛豫→内转移→ 系间跨越→振动弛豫→ T1 发光速度很慢: 10-4~10 s 。 光照停止后,可持续一段时间。
Electron donater Heavy atom effect
Electron accepter
2.影响荧光强度的因素—环境因素
(1)溶剂的影响
除一般溶剂效应外, 溶剂的极性、氢键、 配位键的形成都将使 化合物的荧光发生变 化;极性溶剂使 → * 跃迁能量减小 ,所以Em红移。
(2)温度的影响
(5)内滤作用和自吸现象
内滤作用:溶液中含有能吸收激发光或荧光物质发
射的荧光,如色胺酸中的重铬酸钾; 自吸现象:化合物的荧光发射光谱的短波长端与其 吸收光谱的长波长端重叠,产生自吸收。
§2 分子荧光光谱仪
Molecular fluorescence spectrometer
一、仪器结构
测量荧光的仪器主要组成部分:激发光源、激发单色器、样 品池、发射单色器、检测器。 特殊点:有两个单色器,光源与检测器通常成直角。源自S0→T1 禁阻跃迁; 几率小
2.分子的去激过程
电子处于激发态是不稳定状态,返回基态时,通过辐射跃 迁(发光)和无辐射跃迁等途径和方式失去能量:
传递途径 辐射跃迁 无辐射跃迁
荧光
延迟荧光
磷光
系间跨越 内转移
外转移
振动弛豫
(1)非辐射能量传递过程 振动弛豫 振动弛豫:同一电子能级内以热能量交换形式由高 振动能级至低相邻振动能级间的跃迁。发生振动弛豫 的时间10 -12 s。
分子发光光谱法
(Molecular Luminescence Spectroscopy)
分子发光光谱法包括:
光致发光 (Photoluminescence) 分子荧光(Molecular Fluorescence)
分子磷光(Molecular Phosphorescence) 化学发光(Chemiluminescence) 生物发光(Bioluminescence) 电致发光(Electroluminescence)
在同时扫描激发和发射单色器波长的条件下,测绘光谱图, 所得到的荧光强度—激发波长(或发射波长)曲线为同步荧 光光谱。 测定同步荧光光谱有三种方法: (1)固定波长同步扫描荧光法:在扫描过程中,激发波长和 发射波长有一个固定的波长差,即△λ=λem-λex=常数; (2)固定能量同步扫描荧光法:使发射单色器与激发单色器 之间保持一个恒定的波数差,即 ( 1 1 ) 107 v 常数
pH> 12时以苯胺阴离子形式存在,无荧光
(4)荧光猝灭 Fluorescence Quenching
荧光分子与溶剂或其它溶质分子之间相互作用,使荧光强度 减弱的作用称为荧光猝灭。 能引起荧光强度降低的物质称为猝灭剂。 荧光猝灭包括: 动态猝灭是被激发的荧光分子与猝灭剂发生碰撞,从而使荧 光分子以无辐射形式跃迁回到基态而使荧光猝灭。如:溶解 氧是常见碰撞猝灭剂; 静态猝灭是荧光分子与猝灭剂形成不发荧光的基态配合物从 而使荧光猝灭; 浓度猝灭(自猝灭); 能量转移。
一、特点
(1)灵敏度高、检测限低 灵敏度比紫外-可见分光光度法高2~4个数量级; (2)选择性强 既可依据特征发射光谱,又可根据特征吸收光谱; (3)尤其适合于生物大分子分析和研究
二、定量依据与方法
1、定量依据
荧光强度 If正比于吸收的光强Ia和荧光量子效率 : If = Ia = ( I0 - I) 由朗伯-比耳定律: Ia = I0(1-10- l c ) If = I0(1-10- l c ) = I0(1-e-2.3 l c )
比较法:
在线性范围内,测定标样和试样的荧光强度,直接
比较。
三、荧光分析法的应用
可采用直接测定法或间接测定(荧光猝灭)法
1、无机化合物的分析
与有机试剂配合物后测量;可测量约60多种元素。 铍、铝、硼、镓、硒、镁、稀土常采用荧光分析法; 氟、硫、铁、银、钴、镍采用荧光熄灭法测定; 铜、铍、铁、钴、锇及过氧化氢采用催化荧光法测定; 铬、铌、铀、碲采用低温荧光法测定; 铈、铕、锑、钒、铀采用固体荧光法测定
延迟荧光
延迟荧光(delayed fluorescence)也被称为缓发荧光,它来源 于从第一激发三重态(T1)重新生成的S1态的辐射跃迁。 单重态的寿命一般为10-8秒, 最长可达10-6秒,但有时却可以 观察到单重态寿命长达10-3秒, 这种长寿命的荧光被称为延迟 荧光。其寿命与该物质的分子 磷光相当。 延迟荧光在激发光源熄灭后, 可拖后一段时间,但和磷光 又有本质区别,同一物质的 磷光总比发射荧光长。
2.影响荧光强度的因素—分子结构
(1)跃迁类型:*→的荧光效率高(高于*→n),且系间 跨越过程的速率常数小,有利于荧光的产生; (2)共轭效应:提高共轭度有利于增加荧光效率并产生红移. (3)刚性平面结构: 可降低分子振动,减少 与溶剂的相互作用,故 具有很强的荧光。如荧 光素和酚酞有相似结构, 荧光素有很强的荧光, 酚酞却没有。
λex=260nm
2. 荧光的激发光谱
让不同波长的激发光激发荧光物质使之发生荧光, 而让荧光以固定的发射波长照射到检测器上,然后 以激发光波长为横坐标,以荧光强度为纵坐标所绘 制的图,即为荧光激发光谱。 激发光谱曲线的最高 处,处于激发态的分子 最多,荧光强度最大.
λem=370nm
3. 同步荧光光谱
主要组成部分:
单色器Monochromator:选择激发光波长的第一单色器
和选择发射光(测量)波长的第二单色器;
光源Sources :氙灯(300—1200nm)、高压汞灯、染料激
光器(可见与紫外区);
检测器Detectors :光电倍增管、CCD
仪器光路图
§3 分子荧光光谱法的应用
Application of the molecular fluorescence
内转换
内转换:同多重度电子能级中,等能级间的无辐 射能级交换。 通过内转换和振动弛豫,高激发单重态的电子 跃回第一激发单重态的最低振动能级。
外转换 外转换:激发分子与溶剂或其他 分子之间产生相互作用而转移能 量的非辐射跃迁; 外转换使荧光或磷光减弱或“ 猝灭”。
系间跨越 系间跨越:不同多重态,有重叠的转动能级间的非 辐射跃迁。 改变电子自旋,禁阻跃迁,通过自旋—轨道 耦合进行。
将上式Taylor展开,浓度很低时,近似处理得:
If = 2.303 I0 l c = kc
定量依据
因为If正比于I0,可通过调节光源强度增加荧光强度。
2、定量方法
标准曲线法: 配制一系列标准浓度试样测定荧光强度,绘制标准 曲线,再在相同条件下测量未知试样的荧光强度,在
标准曲线上求出浓度。
§1 分子荧光与磷光的基本原理
Principle of molecular fluorescence and phosphorescence
一、分子荧光与磷光的产生
物质分子在一定条件下吸收辐射能而被激发到较高电子能态后, 再返回基态的过程中将以不同的方式释放能量。 荧光和磷光是以发射辐射的形式释放能量,属于光致发光。
ex em
(3)可变波长同步扫描荧光法:使两单色器在扫描过程中以 不同的速率同时进行扫描,即波长可变。
同步扫描荧光法的特点:
优点:
(1)使光谱简化; (2)使谱带窄化;
(3)减小光谱的重叠现象;
(4)减小散射光的影响。
例如:采用同步扫描技 术检测如图萘、蒽、菲 、芘混合物,可简化光 谱,减少光谱重叠,提 高分辨率。 缺点: 因为同步扫描荧光损失了 其它光谱带所含的信息, 对光谱学的研究不利。
通常荧光发射光谱与它的吸收光谱(与激发光谱形
状一样)成镜像对称关系。
荧光激发光谱
荧光发射光谱
200
250
300 350 400 450 蒽的激发光谱和荧光光谱
500 nm
镜像规则的机理
基态上的各振动能级分布与 第一激发态上的各振动能级 分布类似; 若基态上的 0 振动能级与第一 激发态的2振动能级之间的跃迁 几率最大,相反跃迁也然。
分子对光的吸收和发射能级变化情况可用著名的 Jablonski能级图描述
Jablonski
Professor Aleksander Jabłoński (born in 1898, died in 1980) was a Polish physicist. Fluorescence is schematically illustrated with the classical Jablonski diagram, first proposed by Jablonski in 1935 to describe absorption and emission of light.
二、激发光谱与荧光光谱
Excitation spectrum and Emission spectrum 测量荧光的仪器结构
