原子核外电子的运动特征课件
合集下载
高中化学专题2原子结构与元素的性质第一单元第1课时原子核外电子的运动特征课件苏教版

层符号分别为K、L、M、N、O等。n值的大小表示电子的能量高低和离
核的远近。 n值越大表示电子所在电子层离核越远,电子具有的能量也
越高。对于n=1,2,3…分别称为第一层,第二层……
n 对应电子层 符号 离核远近 能量高低
1 第一层 K
2
3
4
5
… … …
第二层 第三层 第四层 第五层 L M N O
原子核外电子按能量不同分为不同的电子层,各电子层又按能量不同分
为不同的轨道,每个轨道中又分为能量相同但空间取向不同的伸展方向,
每个原子轨道中最多填充2个自旋状态不同的电子。
答案
2.氦原子结构示意图为 错误的打“×”)。 (1)两个电子占有两个轨道(
,试对以下推测进行判断(正确的打“√”, )
(2)两个电子所处的轨道形状不同(
(3)两个电子所处轨道的伸展方向不同(
)
)
(4)两个电子占有同一轨道(
(5)两个电子的能量几乎相同( (6)两个电子分占1s的两个轨道( (7)两个电子的自旋方向不同(
)
) ) ) )
答案 返回
(8)两个电子一个离核近,一个离核远(
重点难点探究
一、核外电子的运动状态描述
1.电子层
原子中由里向外的电子层数 n可取1、2、3、4、5等正整数,对应的电子
A.s轨道呈圆形,p轨道呈纺锤形 B.科学家们采用统计的方法来描述电子在原子核外某一区域出现的机会 C.电子云中小点的密度表示电子的多少 D.f轨道有5个伸展方向
解析 s轨道为球形;
电子云中的小点不是真正的电子,而是电子在这一区域曾经出现过;
f轨道有7个伸展方向。
解析答案
1
2
3
原子核外电子的运动特征PPT课件1

1 2 电子层 第一 第二 原子轨道 1s 2s 2p
n
3 4 第三 第四 3s 3p 3d 4s 4p 4d 4f
1.原子轨道物理意义:表示电子云的形状。
轨道类型不同,轨道的形状也不同。人们用小写的 英文字母s、p、d、f分别表示不同形状的轨道
轨道符号 s p 轨道形状 球形 纺锤形
d 花瓣型
· · f g · · · · · · · · · ·
2.伸展方向
相同形状的原子轨道还可有不同的伸展方向,伸展方 向决定该种类型轨道的个数。 s轨道是球形对称的,只有1个轨道。 p轨道在空间有x、y、z3个伸展方向,所以p轨道含3 个轨道,分别记作:px、py、pz。 d轨道有5个伸展方向,即d轨道含5个轨道。 f轨道有7个伸展方向,即f轨道含7个轨道。
(3)最外层不超过8个(K层2个)
(4)次外层不超过18个,倒数第三层不超过32个。 相互制约,相互联系
原子核外电子在排布时,为什么各电子层最多容纳2n2 个电子? 最外层不超过8个?次外层不超过18个?倒 数第三层不超过32个呢?
量子力学研究表明:处于同一电子层的原子核外 电子,也可以在不同轨道上运动。
(三)电子自旋:
电子不仅在核外空间不停地运动,而且还做自旋 运动。电子的自旋有两种状态,通常采用↑↓ 来表示电子的不同自旋状态。电子自旋并非像地 球绕轴自旋,只是代表电子的两种不同状态。
电子平行自旋: ↑↑
电子反向自旋: ↑↓
电子层
原子轨 道类型
原子轨道 类型数目
可容纳的 电子数目
1 2
3 5
1s 2s,2p
思考: 我们已经知道电子是分层排布的,那么是什么原因导致 电子分层排布——即电子分层排布的依据是什么? 电子层(n): K L M N O P Q 离核远近:近 远 能量高低:低 高 1 K 2 L 3 M 4 N 5 O 6 P 7 Q
n
3 4 第三 第四 3s 3p 3d 4s 4p 4d 4f
1.原子轨道物理意义:表示电子云的形状。
轨道类型不同,轨道的形状也不同。人们用小写的 英文字母s、p、d、f分别表示不同形状的轨道
轨道符号 s p 轨道形状 球形 纺锤形
d 花瓣型
· · f g · · · · · · · · · ·
2.伸展方向
相同形状的原子轨道还可有不同的伸展方向,伸展方 向决定该种类型轨道的个数。 s轨道是球形对称的,只有1个轨道。 p轨道在空间有x、y、z3个伸展方向,所以p轨道含3 个轨道,分别记作:px、py、pz。 d轨道有5个伸展方向,即d轨道含5个轨道。 f轨道有7个伸展方向,即f轨道含7个轨道。
(3)最外层不超过8个(K层2个)
(4)次外层不超过18个,倒数第三层不超过32个。 相互制约,相互联系
原子核外电子在排布时,为什么各电子层最多容纳2n2 个电子? 最外层不超过8个?次外层不超过18个?倒 数第三层不超过32个呢?
量子力学研究表明:处于同一电子层的原子核外 电子,也可以在不同轨道上运动。
(三)电子自旋:
电子不仅在核外空间不停地运动,而且还做自旋 运动。电子的自旋有两种状态,通常采用↑↓ 来表示电子的不同自旋状态。电子自旋并非像地 球绕轴自旋,只是代表电子的两种不同状态。
电子平行自旋: ↑↑
电子反向自旋: ↑↓
电子层
原子轨 道类型
原子轨道 类型数目
可容纳的 电子数目
1 2
3 5
1s 2s,2p
思考: 我们已经知道电子是分层排布的,那么是什么原因导致 电子分层排布——即电子分层排布的依据是什么? 电子层(n): K L M N O P Q 离核远近:近 远 能量高低:低 高 1 K 2 L 3 M 4 N 5 O 6 P 7 Q
原子核外电子的运动特征ppt2 鲁科版
核外电子是如何运动的呢
宏观物体与核外电子运动的比较
宏观物体 质量 速度 位移 很大 较小 可测 可测 可描述(画图或函数描述) 核外电子 很小 很大(接近光速) 位移、能量 不可同时测定 不可确定
能量
轨迹
回顾总结:原子核外电子的运动特征
1、核外电子以极高的速度、在极小的空间里做永不停止的 运动。不遵循宏观物体的运动规律(不能测出在某一时刻 的位置、速度,即不能描画出它的运动轨迹)。
﹛
知识回 顾
自旋平行:
↑↑ ↑↓
自旋相反:
五、轨道能量高低的比较
(从3d轨道开始发生能量交错) 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p
课外思考题
根据原子轨道能量交错现象解释为何原子最 外层电子数不超过8个(K为最外层时不超过 2个)。
描 述 原 子 核 外 电 子 运 动 特 征 的 参 数
内容提 要
电子层 原子轨道 原子轨道的伸展方向 电子自旋
一、电子层(又叫能层)
分层依据:能量的较大差别,以及电子运动的 主要区域或离核远近的不同。
· 电子云
电子分层运动(排布);离核越远;能量越高。
电子层序 数(n) 符号
1 K
2 L
再见!
• • • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
读一本好书,就是和许多高尚的人谈话。 ---歌德 书籍是人类知识的总结。书籍是全世界的营养品。 ---莎士比亚 书籍是巨大的力量。 ---列宁 好的书籍是最贵重的珍宝。 ---别林斯基 任何时候我也不会满足,越是多读书,就越是深刻地感到不满足,越感到自己知识贫乏。 ---马克思 书籍便是这种改造灵魂的工具。人类所需要的,是富有启发性的养料。而阅读,则正是这种养料。 ---雨果 喜欢读书,就等于把生活中寂寞的辰光换成巨大享受的时刻。 ---孟德斯鸠 如果我阅读得和别人一样多,我就知道得和别人一样少。 ---霍伯斯[英国作家] 读书有三种方法:一种是读而不懂,另一种是既读也懂,还有一种是读而懂得书上所没有的东西。 ---克尼雅日宁[俄国剧作家・诗人] 要学会读书,必须首先读的非常慢,直到最后值得你精读的一本书,还是应该很慢地读。 ---法奇(法国科学家) 了解一页书,胜于匆促地阅读一卷书。 ---麦考利[英国作家] 读书而不回想,犹如食物而不消化。 ---伯克[美国想思家] 读书而不能运用,则所读书等于废纸。 ---华盛顿(美国政治家) 书籍使一些人博学多识,但也使一些食而不化的人疯疯颠颠。 ---彼特拉克[意大利诗人] 生活在我们这个世界里,不读书就完全不可能了解人。 ---高尔基 读书越多,越感到腹中空虚。 ---雪莱(英国诗人) 读书是我唯一的娱乐。我不把时间浪费于酒店、赌博或任何一种恶劣的游戏;而我对于事业的勤劳,仍是按照必要,不倦不厌。 ---富兰克林 书读的越多而不加思索,你就会觉得你知道得很多;但当你读书而思考越多的时候,你就会清楚地看到你知道得很少。 ---伏尔泰(法国哲学家、文学家) 读书破万卷,下笔如有神。---杜甫 读万卷书,行万里路。 ---顾炎武 读书之法无他,惟是笃志虚心,反复详玩,为有功耳。 ---朱熹 读书无嗜好,就能尽其多。不先泛览群书,则会无所适从或失之偏好,广然后深,博然后专。 ---鲁迅 读书之法,在循序渐进,熟读而精思。 ---朱煮 读书务在循序渐进;一书已熟,方读一书,勿得卤莽躐等,虽多无益。 ---胡居仁[明] 读书是学习,摘抄是整理,写作是创造。 ---吴晗 看书不能信仰而无思考,要大胆地提出问题,勤于摘录资料,分析资料,找出其中的相互关系,是做学问的一种方法。---顾颉刚 书犹药也,善读之可以医愚。 ---刘向 读书破万卷,胸中无适主,便如暴富儿,颇为用钱苦。 ---郑板桥 知古不知今,谓之落沉。知今不知古,谓之盲瞽。 ---王充 举一纲而万目张,解一卷而众篇明。 ---郑玄
(化学课件)原子核外电子的运动状态

讨论:见课本P5
一个小黑点仅表示电子在此出现了一次。
小黑点的疏密仅表示电子出现几率的大小。
即小黑点较稀的地方表示电子在此出现的机 会少;小黑点较密的地方表示电子在此出现 的机会多。
(三)、决定核外电子运动状态的因素
1、电子层: 在多电子的原子里,它们的运动区域 也不同。能量低的电子通常在离核较近的空间范 围运动,能量高的电子通常在离核较远的空间范 围内运动,
[说明]1、自左向右、自上而下,轨道能量依次递增。
2、每个能级组以ns轨道开始、以np轨道结束。
(3)为什么每个电子层所能容纳的电子数最 多为2n2(n为电子层数)?
1、4d轨道中最多容纳电子数为
A、2
B√ 、 10 C、 14 D、 18
2、下列轨道含有轨道数目为3的是
A、1s B√ 、2p √C、3p D、4d
3、第三电子层含有的轨道数为 A、3 B、 5 C、 7 D√ 、 9
五、电子亚层的能量比较规律
1、相同电子层上电子亚层能量的高低: ns<np<nd<nf
2、形状相同的电子亚层能量的高低: 1s<2s<3s<4s…… 2p<3p<4p<5p…… ……
3、电子层和形状相同的电子亚层的能量相等: 如2px = 2py =2pz
/ / / / / / 1s<—2s<—2p<3—s<3—p<—4s<3d<4—p<5—s<4d<5—p<—6s<4f<5d<6—p<7—s<5f<6d<—7p
结合电子云的形状及伸展方向显然可知:S亚层有 1个轨道,P亚层有3个轨道, d 亚层有5个轨道, f亚层有7个轨道。
四、电子自旋
原子核外电子的运动特征课件

3.电子自旋 原子核外电子还有一种称为“自旋”的运动。通 常用“↑”或“↓”来表示这两种不同的自旋状 态。一个原子轨道上最多可同时容纳两个自旋方
向相反的电子。
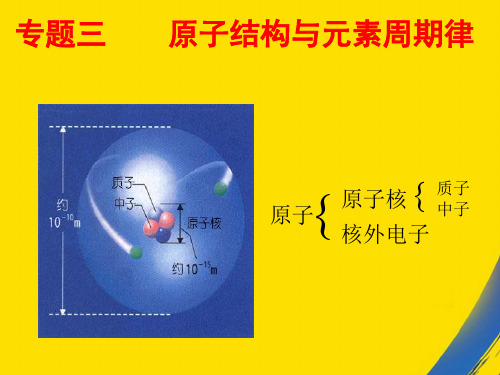
专题二 原子结构与元素的性质
第一单元 原子核外电子的运动(1)
课前自主学案
一.人类对原子结构的认识 1 .原子是由原子核和核外电子构成的,原子核 质子 中子 正 由 _____ 和 _____ 构成。质子带 ___ 电荷,核外电 不带 等于 负 子带 ___ 电荷,中子 _____ 电荷,质子数 _____ 核
纺锤形的,d轨道和f轨道较复杂。
(2)原子轨道的数目:ns有1个原子轨道,np有3
个原子轨道(npx、npy、npz),nd有5个原子轨道, nf有7个原子轨道。 (3)原子轨道能量高低规律: ①相同电子层:ns<np<nd<nf
②形状相同的原子轨道:1s<2s<3s<4s
③电子层和形状相同的原子轨道npx=npy=npz
上运动时,既不放出能量,也不吸收能量。
(2)不同的原子轨道具有不同的能量,原子轨道 不连续 的。 的能量变化是________ (3)原子核外电子可以在能量不同的轨道上发生 跃迁 。 ______
5.原子核外电子的运动特点
(1)原子核外电子以极高的速度、在极小的空间
内做永不停止的运动。 不遵循 宏观物体所具有的 (2)核外电子的运动________ 运动规律 (不能测出在某一时刻的位置、速度,即 不能描画出它的运动轨迹 ) 。描述核外电子运动通 统计 的方法——电子云。 常采用______
特别提醒:(1)各电子层包含的原子轨道数目和 可容纳的电子数 电子层 原子轨道类型 1 2 3 4 n 1s 2s、2p 3s、3p、3d 4s、4p、4d、 4f —
原子核外电子的运动特征PPT3 苏教版

专题2 原子核外电子的运动特征(2)
1、氢原子的3d和4s能级的能量高低是 ( ) B 3d<4s √A 3d>4s C 3d=4s D 无3d,4s轨道,无所谓能量高低 2、比较下列多电子原子的原子轨道的能量高低 (1)1s、3d (2)3s、3p、3d (3)3px、3pz、4p (4)3px,3pz,3py 3、将下列多电子原子的原子轨道按轨道能量由 高到低的顺序排列 1s 4p 2s 3s 5f 4s
专题2 原子核外电子的运动特征
核外电子的运动的特点:
1、核外电子以极高的速度、在极小的空间作应不停止的运转。 不遵循宏观物体的运动规律(不能测出在某一时刻的位置、速度, 即不能描画出它的运动轨迹)。 2、可用统计(图示)的方法研究电子在核外出现的概率。 电子云——电子在核外空间一定范围内出现的机会的大小, 好像带负电荷的云雾笼罩在原子核周围,人们形象的称为电 子云。
电子平行自旋: 电子反向自旋:
每个轨道最多只能排布两个自旋相反的电子。
核外电子的运动状态
小结:
描 述 核 外 电 子 运 动 状 态 的 参 数
电子层n
原子轨道或电子云形状
原子轨道或电子云在空间的伸展方向
电子的自旋状态(或自旋方向)
专题2 原子核外电子的运动特征
(一)电子层(能层):
电子层序 1 数(n) K 符号
2、下面关于多电子原子核外电子的运动 规律的叙述正确的是( AD ) A、核外电子是分层运动的
B、所有电子在同一区域里运动
C、能量高的电子在离核近的区域运动 D、能量低的电子在离核低的区域运动
专题2 原子核外电子的运动特征
(1)电子分层排布的依据是什么? (2)在多电子原子中,每一层上的电子能量一样吗? 运动区域的形状一样吗?
(全)原子核外电子运动状态PPT资料
1926年,薛定谔提出了波动力学(量子力学)概念,在 此基础上建立了现代原子结构模型。核外电子运动状 态用波函数描述,即电子云模型。
一、原子核外电子的运动状态
练习1:写出19号元素、35号元素的原 子结构示意图
练习2:写出Mg、N、Cl、O2、NH3 的电子式
1、能层—电子层〔energy shell)
即n2
(5〕每个轨道最多容纳2个电子。
(6〕每个能层最多容纳电子数: 2 n 2
4、电子的自旋:
原子核外电子除绕原子核高速运动外,还像地 球一样绕自己 的轴自转,自转只有两种相反的 方向---顺时针方向和逆时针方向
总结:原子核外没有运动状态完全相同 的两个电子。
例、钠原子核外电子运动状态有几种? 氯离子核外电子运动状态有几种?
子结构示意图
(2〕能级的表示:s 、p 、d 、f、 核原外子电 核子外运电动子状除态绕用原波子函核数高描速述运,动即外电,子还云像模地型球。一样绕自己 的轴自转,自转只有两种相反的方向---顺时针方向和逆时针方向
一的、电原 子子式核外电子的运动状态 原核子外核 电外子电运子动除状绕态原用子波核函高数速描运述动,外即,电还子像云地模球型一。样绕自己 的轴自转,自转只有两种相反的方向---顺时针方向和逆时针方向 (总5结〕:每原个子轨核道外最没多有容运纳动2状个态电完子全。相同的两个电子。 (N层2〕:各有能4个级能原级子4轨s、道4形p、状4及d伸、展4f 方向:
K层:只有1个能级1s 练匀习称1地:分写布出在1一9号些元同素心、环3上5号,元他素引的入原量子化条件,成功地解释了氢原子光谱。
子(结6〕构每示个意能图层最多容纳电子数: 2 n 2 1为9了13描年述,电玻子尔云综的合形了状普人朗们克把的电量子子出理现论概,率爱约因为斯9坦0%的的光空子间理圈论起和来卢,瑟得福到的电原子子云模的型轮,廓提图出,了人新们的把原电子子模云型的:轮在廓原图子称核为的原周子围轨,道电。子被 匀核称外地 电分子布运在动一状些态同用心波环函上数,描他述引,入即量电子化云条模件型,。成功地解释了氢原子光谱。
一、原子核外电子的运动状态
练习1:写出19号元素、35号元素的原 子结构示意图
练习2:写出Mg、N、Cl、O2、NH3 的电子式
1、能层—电子层〔energy shell)
即n2
(5〕每个轨道最多容纳2个电子。
(6〕每个能层最多容纳电子数: 2 n 2
4、电子的自旋:
原子核外电子除绕原子核高速运动外,还像地 球一样绕自己 的轴自转,自转只有两种相反的 方向---顺时针方向和逆时针方向
总结:原子核外没有运动状态完全相同 的两个电子。
例、钠原子核外电子运动状态有几种? 氯离子核外电子运动状态有几种?
子结构示意图
(2〕能级的表示:s 、p 、d 、f、 核原外子电 核子外运电动子状除态绕用原波子函核数高描速述运,动即外电,子还云像模地型球。一样绕自己 的轴自转,自转只有两种相反的方向---顺时针方向和逆时针方向
一的、电原 子子式核外电子的运动状态 原核子外核 电外子电运子动除状绕态原用子波核函高数速描运述动,外即,电还子像云地模球型一。样绕自己 的轴自转,自转只有两种相反的方向---顺时针方向和逆时针方向 (总5结〕:每原个子轨核道外最没多有容运纳动2状个态电完子全。相同的两个电子。 (N层2〕:各有能4个级能原级子4轨s、道4形p、状4及d伸、展4f 方向:
K层:只有1个能级1s 练匀习称1地:分写布出在1一9号些元同素心、环3上5号,元他素引的入原量子化条件,成功地解释了氢原子光谱。
子(结6〕构每示个意能图层最多容纳电子数: 2 n 2 1为9了13描年述,电玻子尔云综的合形了状普人朗们克把的电量子子出理现论概,率爱约因为斯9坦0%的的光空子间理圈论起和来卢,瑟得福到的电原子子云模的型轮,廓提图出,了人新们的把原电子子模云型的:轮在廓原图子称核为的原周子围轨,道电。子被 匀核称外地 电分子布运在动一状些态同用心波环函上数,描他述引,入即量电子化云条模件型,。成功地解释了氢原子光谱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题2 原子结构与元素的性质
第一单元 原子核外电子的运动
原子核外电子的运动特征
原子结构
分子结构 结 决定 性
构
质
晶体结构
原子核外电子的运动特征
1、原子是由哪些微粒构成的?
2、构成原子的各种微粒是否带有电荷? 为什么原子呈电中性?
3、构成原子的各种微粒在数量上有什 么变化规律?这些微粒的体积和质量有 什么特点?
3、构成原子的各种微粒在数量上有什么变化 规律?这些微粒的体积和质量有什么特点?
构成原子 的微粒
电子
原子核
质子
中子
电性和电量
1个质子带 一个单位正 电荷
1个电子带 一个单位负 电荷
中子不显电 性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-31
相对质量 1/1836 1.007≈1 1.008≈1
(“葡萄干布丁”模型) (西瓜模型) 原子核外电子的运动特征
⑷卢瑟福原子模型(1911年)
原子中心有一个带正电荷的核,它的质量几 乎等于原子的全部质量,电子在它的周围沿着 不同的轨道运转,就象行星环绕太阳运转一样。
(“行星系式”原子模型)
(核式模型) 原子核外电子的运动特征
⑸玻尔原子模型(1913年)
⑵道尔顿原子模型(1803年)
原子在一切化学变化中不可再分,并保持 自己的独特性质;同一元素所有原子的质量、 性质都完全相同。不同元素的原子质量和性 质各不相同;不同元素化合时,原子以简单 整数比结合 。
(化学原子论) 原子核外电子的运动特征
⑶汤姆生原子模型(1904年)
原子是一个平均分布着正电荷的粒 子,其中镶嵌着许多电子,中和了正电 荷,从而形成了中性原子。
宏观物体与核外电子运动的比较
宏观物体
质量
很大
速度
较小
位移
可测
能量
可测
轨迹 可描述(画图或函数描述)
核外电子
很小 很大(接近光速)
位移、能量 不可同时测定
不可确定
原子核外电子的运动特征
二、原子核外电子的运动特点
⑵可用统计(图示)的方法研究电子在核外 出现的几率。
电子云——电子在核外空间一定范围内出现, 好像带负电荷的云雾笼罩在原子核周围,人 们形象的称为电子云。
原子核外电子的运动特征
〖交流与讨论〗——P11
请完成表2-1 几种原子的原子序数、元素 符号和原子结构示意图
原子序数 元素符号 原子结构示意图 8 11 13 18
原子核外电子的运动特征
〖思考与交流〗
①我们已经知道电子是分层排布的,那么是什么原因导致电子分层排布——即电子分层 排布的依据是什么? ②在多电子原子中,每一层上的电子又是怎样运动的?能量一样吗?运动区域的形状一 样吗? ③为什么每个电子层所能容纳的电子数最多为2n2(n为电子层数)?为什么最外层电子 数不超过8个(K为最外层时不超过2个)? ④同一原子中有没有两个完全相同的电子?
原子核外电子的运动特征
数描
述
电子层
原
子
核 外
原子轨道的形状
电
子
运 动
原子轨道的伸展方向
特
征
的 参
电子自旋
原子核外电子的运动特征
1、每个电子层的序数和符号怎样表示? 2、什么叫原子轨道? 3、原子轨道(能级)类型和形状如何? 4、不同电子层的轨道类型、数目、表示方法及所容纳 的最多电子数各是多少? 5、多电子原子中,原子轨道能量高低的规律如何? 6、同一轨道中的电子的自旋方向是否相同?
原子核外电子的运动特征
⑴古希腊原子论
原子是最小的、不可分割的物质粒子。 原子之间存在着虚空,无数原子从古以来就 存在于虚空之中,既不能创生,也不能毁灭, 它们在无限的虚空中运动着构成万物。
古希腊哲学家
原子
(朴素原子论)
( Democritus ,约公元前 460 年—前 370 年) 原子核外电子的运动特征
电子云图中小黑点的疏密表示电子在核外空 间出现机会的大小,与电子在核外空间出现 机会的大小成正比关系。
原子核外电子的运动特征
二、原子核外电子的运动特点
⑶原子核外电子分层排布的规律
① 核外电子是分层排布的 ② 不同电子层上的电子能量不同,离核越近,
能量越低;离核越远,能量越高 ③ 电子优先排布在能量最低的电子层里 ④ 每个电子层所能容纳的电子数最多为2n2 (n为电子层数) ⑤ 最外层电子数不超过8个(K为最外层时不 超过2个), 次外层不超过18个,倒数第三 层不超过32个
②科学家是采取什么方法来研究电子在核外 运动的?
③关于电子在核外的运动,你现在已经知道 哪些规律?
原子核外电子的运动特征
Байду номын сангаас
二、原子核外电子的运动特点
⑴核外电子以极高的速度、在极小的空 间做不停止的运转。不遵循宏观物体的 运动规律(不能测出在某一时刻的位置、 速度,即不能描画出它的运动轨迹)。
原子核外电子的运动特征
电子在原子核外空间的一定轨 道上绕核做高速的圆周运动。
(电子分层排布模型)
原子核外电子的运动特征
⑹电子云模型(1926年)
现代物质结构学说。波粒二象性。
(量子力学模型)
原子核外电子的运动特征
二、原子核外电子的运动特点
〖思考与交流〗
①核外电子质量小带负电荷,运动范围小, 速度快,是否遵循宏观物体的运动规律?电 子在核外运动时是否有一定的规律?
原子核外电子的运动特征
1、原子是由哪些微粒构成的?
{ {质子
原子 原子核 中子 核外电子
原子核外电子的运动特征
2、构成原子的各种微粒是否带有电荷? 为什么原子呈电中性?
1个质子带一个单位正电荷 中子不显电性 1个电子带一个单位负电荷
原子核内的质子数=原子核外的电子数
原子呈电中性 原子核外电子的运动特征
原子核外电子的运动特征
3、构成原子的各种微粒在数量上有什么变化 规律?这些微粒的体积和质量有什么特点?
关系式1:(质量关系) 质量数(A)=质子数(Z)+中子数(N)
关系式2:(电性关系)——在原子中 原子序数=核电荷数=核内质子数=核外电子数
关系式3:(电性关系)——在离子中 原子序数=核电荷数=核内质子数
=核外电子数 +离子所带电荷数
原子核外电子的运动特征
一、人类对原子结构的认识 1、原子的构成
原子核外电子的运动特征
2、原子结构的发展简史——不同时期 的原子结构模型:(请填要点)
⑴古希腊原子论 ⑵道尔顿原子模型(1803年) ⑶汤姆生原子模型(1904年) ⑷卢瑟福原子模型(1911年) ⑸玻尔原子模型(1913年) ⑹电子云模型(1926年)
第一单元 原子核外电子的运动
原子核外电子的运动特征
原子结构
分子结构 结 决定 性
构
质
晶体结构
原子核外电子的运动特征
1、原子是由哪些微粒构成的?
2、构成原子的各种微粒是否带有电荷? 为什么原子呈电中性?
3、构成原子的各种微粒在数量上有什 么变化规律?这些微粒的体积和质量有 什么特点?
3、构成原子的各种微粒在数量上有什么变化 规律?这些微粒的体积和质量有什么特点?
构成原子 的微粒
电子
原子核
质子
中子
电性和电量
1个质子带 一个单位正 电荷
1个电子带 一个单位负 电荷
中子不显电 性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-31
相对质量 1/1836 1.007≈1 1.008≈1
(“葡萄干布丁”模型) (西瓜模型) 原子核外电子的运动特征
⑷卢瑟福原子模型(1911年)
原子中心有一个带正电荷的核,它的质量几 乎等于原子的全部质量,电子在它的周围沿着 不同的轨道运转,就象行星环绕太阳运转一样。
(“行星系式”原子模型)
(核式模型) 原子核外电子的运动特征
⑸玻尔原子模型(1913年)
⑵道尔顿原子模型(1803年)
原子在一切化学变化中不可再分,并保持 自己的独特性质;同一元素所有原子的质量、 性质都完全相同。不同元素的原子质量和性 质各不相同;不同元素化合时,原子以简单 整数比结合 。
(化学原子论) 原子核外电子的运动特征
⑶汤姆生原子模型(1904年)
原子是一个平均分布着正电荷的粒 子,其中镶嵌着许多电子,中和了正电 荷,从而形成了中性原子。
宏观物体与核外电子运动的比较
宏观物体
质量
很大
速度
较小
位移
可测
能量
可测
轨迹 可描述(画图或函数描述)
核外电子
很小 很大(接近光速)
位移、能量 不可同时测定
不可确定
原子核外电子的运动特征
二、原子核外电子的运动特点
⑵可用统计(图示)的方法研究电子在核外 出现的几率。
电子云——电子在核外空间一定范围内出现, 好像带负电荷的云雾笼罩在原子核周围,人 们形象的称为电子云。
原子核外电子的运动特征
〖交流与讨论〗——P11
请完成表2-1 几种原子的原子序数、元素 符号和原子结构示意图
原子序数 元素符号 原子结构示意图 8 11 13 18
原子核外电子的运动特征
〖思考与交流〗
①我们已经知道电子是分层排布的,那么是什么原因导致电子分层排布——即电子分层 排布的依据是什么? ②在多电子原子中,每一层上的电子又是怎样运动的?能量一样吗?运动区域的形状一 样吗? ③为什么每个电子层所能容纳的电子数最多为2n2(n为电子层数)?为什么最外层电子 数不超过8个(K为最外层时不超过2个)? ④同一原子中有没有两个完全相同的电子?
原子核外电子的运动特征
数描
述
电子层
原
子
核 外
原子轨道的形状
电
子
运 动
原子轨道的伸展方向
特
征
的 参
电子自旋
原子核外电子的运动特征
1、每个电子层的序数和符号怎样表示? 2、什么叫原子轨道? 3、原子轨道(能级)类型和形状如何? 4、不同电子层的轨道类型、数目、表示方法及所容纳 的最多电子数各是多少? 5、多电子原子中,原子轨道能量高低的规律如何? 6、同一轨道中的电子的自旋方向是否相同?
原子核外电子的运动特征
⑴古希腊原子论
原子是最小的、不可分割的物质粒子。 原子之间存在着虚空,无数原子从古以来就 存在于虚空之中,既不能创生,也不能毁灭, 它们在无限的虚空中运动着构成万物。
古希腊哲学家
原子
(朴素原子论)
( Democritus ,约公元前 460 年—前 370 年) 原子核外电子的运动特征
电子云图中小黑点的疏密表示电子在核外空 间出现机会的大小,与电子在核外空间出现 机会的大小成正比关系。
原子核外电子的运动特征
二、原子核外电子的运动特点
⑶原子核外电子分层排布的规律
① 核外电子是分层排布的 ② 不同电子层上的电子能量不同,离核越近,
能量越低;离核越远,能量越高 ③ 电子优先排布在能量最低的电子层里 ④ 每个电子层所能容纳的电子数最多为2n2 (n为电子层数) ⑤ 最外层电子数不超过8个(K为最外层时不 超过2个), 次外层不超过18个,倒数第三 层不超过32个
②科学家是采取什么方法来研究电子在核外 运动的?
③关于电子在核外的运动,你现在已经知道 哪些规律?
原子核外电子的运动特征
Байду номын сангаас
二、原子核外电子的运动特点
⑴核外电子以极高的速度、在极小的空 间做不停止的运转。不遵循宏观物体的 运动规律(不能测出在某一时刻的位置、 速度,即不能描画出它的运动轨迹)。
原子核外电子的运动特征
电子在原子核外空间的一定轨 道上绕核做高速的圆周运动。
(电子分层排布模型)
原子核外电子的运动特征
⑹电子云模型(1926年)
现代物质结构学说。波粒二象性。
(量子力学模型)
原子核外电子的运动特征
二、原子核外电子的运动特点
〖思考与交流〗
①核外电子质量小带负电荷,运动范围小, 速度快,是否遵循宏观物体的运动规律?电 子在核外运动时是否有一定的规律?
原子核外电子的运动特征
1、原子是由哪些微粒构成的?
{ {质子
原子 原子核 中子 核外电子
原子核外电子的运动特征
2、构成原子的各种微粒是否带有电荷? 为什么原子呈电中性?
1个质子带一个单位正电荷 中子不显电性 1个电子带一个单位负电荷
原子核内的质子数=原子核外的电子数
原子呈电中性 原子核外电子的运动特征
原子核外电子的运动特征
3、构成原子的各种微粒在数量上有什么变化 规律?这些微粒的体积和质量有什么特点?
关系式1:(质量关系) 质量数(A)=质子数(Z)+中子数(N)
关系式2:(电性关系)——在原子中 原子序数=核电荷数=核内质子数=核外电子数
关系式3:(电性关系)——在离子中 原子序数=核电荷数=核内质子数
=核外电子数 +离子所带电荷数
原子核外电子的运动特征
一、人类对原子结构的认识 1、原子的构成
原子核外电子的运动特征
2、原子结构的发展简史——不同时期 的原子结构模型:(请填要点)
⑴古希腊原子论 ⑵道尔顿原子模型(1803年) ⑶汤姆生原子模型(1904年) ⑷卢瑟福原子模型(1911年) ⑸玻尔原子模型(1913年) ⑹电子云模型(1926年)
