溶剂体系理论
第一章 酸碱理论与非水溶液(中级无机化学课件)

质为碱
H2O中
非质子溶剂
指出:溶剂中增加的阴阳离子,可以是由溶质本身离 解产生,也可由溶质与溶剂发生反应而产生。 P.20
溶剂体系理论
评价:
优点:溶 剂可以不 涉及质子 包含了水离子理论、质子理论 缺点:只适于能发生自电离 溶剂体系
定义:
Lewis G N 美国物理化学家
酸碱反应实质: A + : B → A : B
拉平效应不同的溶剂有不同的区分范围常用溶剂的分辨宽度酸碱区分窗窗的宽度正比于溶剂的自电离常数若两种酸或两种碱组成混合物只要它们有一种落在这些范围之中就可把它们区分开
第一章 酸碱理论与非水溶液
[基本要求]
1、掌握现代酸碱理论的要点及运用范围;
2、掌握软硬酸碱规则及其应用;
3、熟悉有代表性的非水溶剂(液氨体系、硫 酸体系及超酸等)的特征及其典型的酸碱反 应。
2、键的强度
3、酸根的X-稳定性
1、气态二元氢化物
HnX(g) D Hn-1X(g)+H(g)
△rHmθ
Hn-1X-(g) + H+(g) -EA Ip Hn-1X(g) + H(g)
△rHmθ =D+Ip-EA
Ip:相同
△rHmθ =D-EA
△rHmθ = D
- EA
△rHmθ = D - EA
2、二元氢化物溶液 P.35
+
离解焓 结论:
与气态变化规律相同
3、二元氢化物的取代产物
① HARn H+ + ARn-*
诱导效应
② ARn-*
①仅仅是氢质子 脱去,与A上电子 云密度有关
ARn-
R电负性比A大 (R是一个吸电子基团) R电负性比A小 (R是一个斥电子基团)
第一章 电解质溶液理论15

ze
4 0 r 2
2
az 2e2
32 202r4
(1-7b)
第一章 电解质溶液理论
1.1分子间的力
3.偶极子和偶极子之间的作用力,主要来自于偶极子的偶极正负之间的
吸引力和排斥力。
偶极子间的相互作用的势能
1.1分子间的力
4.色散力:中性分子或离子具有瞬间的周期变化的偶极距,伴随这种周 期性变化的偶极距有一同步的电场,它使邻近的分子极化,两者异极 相邻,产生净的吸引力,色散力就是在这样的反变作用力下产生的。 特点:近程且有加和性。
Sis
波GT恩is模 型p,n最本N质8A的zi0缺er0i 点2 是1r没2 有考Tr 虑P离子引入对溶(1-15)
His
剂结构的影响。
Gis
T
Gis T
p,n
NA zie0 2
8 0 ri
的性质必须直接关系到电化学体系中反应进行。
第一章 电解质溶液理论
第一章 电解质溶液理论
❖ 电解质的分为液体电解质和固体电解质两大类。 ❖ 固体电解质:以离子的在电场下的定向运动作为导电机制的固体。 ❖ 液体电解质:以离子的在电场下的定向运动作为导电机制的液体。
液体电解质可分为
溶液电解质 熔盐电解质
与电导。 ❖ 理论建立的方式:分析电解质溶液与理想溶液的差别,分析溶液中
各种粒子间的相互作用情况。
第一章 电解质溶液理论
第一章 电解质溶液理论
❖ 两大理论的核心是离子云模型。 ❖ 离子云模型是描述溶液中离子存
在状态的一种模型。 ❖ 是分析电解质溶液中存在于各种
大学无机化学第七章试题及答案解析

第七章 酸碱解离平衡本章总目标:1:了解酸碱理论发展的概况2:了解同离子效应和盐效应对解离平衡的影响。
3:掌握酸、碱、盐以及缓冲溶液的pH 值的相关计算。
4:了解离子活度、活度因子、离子强度等概念。
5:了解缓冲溶液的组成;缓冲作用原理;缓冲溶液的性质。
各小节的目标:第一节:弱酸和弱碱的解离平衡1:掌握一元弱酸的解离平衡常数的意义、用途和计算。
2a H K c θ+⎡⎤⎣⎦=2;掌握一元弱碱的解离平衡常数的意义、用途和计算。
20b OH K c OH θ--⎡⎤⎣⎦=⎡⎤-⎣⎦当0400b c K θ>时,OH -⎡⎤=⎣⎦3:解离度概念——平衡时已经解离的浓度与起始浓度之比。
4:同离子效应——在弱电解质的溶液中国,加入与其具有相同离子的强 电解质,使弱电解质的解离平衡左移,从而降低弱电解质的解离度。
5:掌握多元弱酸的解离平衡的计算。
6:了解水的离子积常数、溶液的pH 等基本概念。
7:熟练掌握缓冲溶液pH 值的计算:lg a pH pK θ=-(c 酸/c 盐);lg bpOH pK θ=-(C 碱/C 盐) 8:可以解释缓冲溶液可以达到缓冲目的的原因。
第二节:盐的水解1:掌握水解平衡常数的计算:1.弱酸强碱盐:Wh aK K K θθθ=;2.强酸弱碱盐:W h b K K K θθθ=;3.弱酸弱碱盐:W h a b K K K K θθθθ=2:可以运用公式——211211ln ()K H K R T T θθ∆=-来解释升温促进水解的原因。
3:掌握单水解过程的计算——OH -⎡⎤==⎣⎦,H +⎡⎤==⎣⎦ 4;掌握双水解pH值的计算:H +⎡⎤=⎣⎦第三节:电解质溶液理论和酸碱理论的发展1:掌握离子强度、活度的概念和离子强度的计算212i i I b z =∑。
2:理解盐效应对弱电解质解离度的影响。
3:了解酸碱质子理论、酸碱溶剂体系理论和酸碱电子理论。
Ⅱ习题一 选择题1.某弱酸HA 的Ka=2.0×10-5,若需配制pH=5.00的缓冲溶液,与100ml ,1.0mol/L 的NaAc 相混合的1.0mol/LHA 体积应为( )A. 200mlB.50mlC.100mlD.150ml2.已知相同浓度的盐NaA ,NaB,,NaC ,NaD 的水溶液的pH 依次增大,则相同浓度的下列溶液中解离度最大的是()(《无机化学例题与习题》吉大版)A .HA B.HB C.HC D.HD3.pH=3和pH=5的两种HCl溶液,以等体积混合后,溶液的pH是()A .3.0 B.3.3 C.4.0 D.8.04.已知K b0(NH3)=1.8×10-5,其共轭酸的K a0值为()(《无机化学例题与习题》吉大版)A . 1.8×10-9 B. 1.8×10-10 C. 5.6×10-10 D. 5.6×10-55.难溶电解质M2X的溶解度S与溶度积Ksp之间的定量关系式为()A.S =KspB.S=(Ksp/2)1/3C. S =Ksp1/2D.S =(Ksp/4)1/36.下列物质中,既是质子酸,又是质子碱的是()(《无机化学例题与习题》吉大版)A.OH-B.NH4+C.S2-D.PO43-7.欲配制pH=13.00的NaOH溶液10.0L,所需NaOH固体的质量是()(原子量Na=23)A .40g B.4.0g C.4.0×10-11g D.4.0×10-12g8.H2AsO4-的共轭碱是()(《无机化学例题与习题》吉大版)A. H3AsO4B. HAsO42- C . AsO43- D. H2AsO3-9.往银盐溶液中添加HCl使之生成AgCl(Ksp=1.56×10-10)沉淀,直至溶液中Cl-的浓度为0.20mol/L为止。
高中化学竞赛 中级无机化学 质子理论 溶剂体系理论及其拉平效应和区分效应(共24张PPT)

(酸)
2)3HCO3- +3H2O → 3H2O + 3CO2 + 3OH- (碱) 3)3H3O+ + 3OH- → 6H2O
1)+2)+3) :
Fe3+ + 3HCO3- → Fe(OH)3↓ + 3CO2 ↑
NH3 中
CH3COOH + NH3 → CH3COO- + NH4+ (酸)
KH + NH3 → K+ + H2↑ + NH2-
2. 溶剂的拉平效应和区分效应
溶剂不能辨别不同酸碱相对强度的效应叫做溶剂的拉平 效应。
溶剂能辨别不同酸碱相对强度的效应叫做溶剂的区分效 应。
在水中为强酸的物质:如HClO4,HBr,HCl,HI 在水中不能存在 不能区分酸强度:把质子转移给H2O,形成H3O+
Ka > 1
pKa < 0
——强度被水“拉平”到水合质子H3O+的强度
NH4+ + NH2-
与水相似
K = 10-33
中和反应:
水:KOH + H3OI → KI + 2H2O
NH3: KNH2 + NH4I → KI + 2NH3
两性反应:
过量OH-
水:Zn2+ + 2OH- → Zn(OH)2 → Zn(OH)42过量NH2-
NH3: Zn2+ + 2NH2- → Zn(NH2)2 → Zn(NH2)42-
① 纯H2SO4
HAc、HNO3也显碱性 CH3CO2H + H2SO4 → CH3CO2H2+ + HSO4HNO3 + 2H2SO4 → NO2+ + H3O+ + 2HSO4-
第一章-酸碱化学-2

而比较H2SO4和H2SO3的强度, 则可以考虑第二个因 素:高电负性的末端氧原子倾向于吸引 O—H 键的键电 子, 导致O—H键变弱从而提高分子的酸性。
Pauling规则
In SO2(l)
2SO2 →SO2+ + SO32SOCl2 → 2Cl- + SO2+ (酸) Cs2SO3 → 2Cs+ + SO32- (碱) SOCl2 + Cs2SO3 →2CsCl + 2SO2 可用Cs2SO3滴定SOCl2(非水溶液滴定)
• 优点:溶剂可以不 涉及质子 包含了水离子理论、质子理论 • 缺点:只适于能发生自电离 的溶剂体系
三、金属与液氨的作用 M +(x+y)NH3 四、特点 [M(NH3)]y++[e(NH3)x]-
(一)稀的金属氨溶液 1. 稀的金属氨溶液呈亮蓝色,其溶液的颜色与所含 的金属无关; 2. 由氨化电子跃迁产生的电子光谱中有一个很强很 宽的 吸收带,其最大吸收位置大约在1500nm处;
3. 溶液密度与纯液氨几乎一样; 4. 较稀的金属氨溶液是极好的电导体;具有顺磁性 原因:氨溶液中的电子存在于液氨的孔腔中,只被周 围的分子松散的溶剂化,使得电子的行为相当自由。
② 液态HF HF是另一个很有用的酸性质子溶剂,自电离时产生溶剂化 的质子和二氟离子:2HF →H+ + HF2- 3HF → H2F++HF2- 很强的路易斯酸在HF中表现为酸性,如五氟化锑, SbF5+HF →H++SbF6H2O和HNO3在HF中表现为碱性: H2O+2HF → H3O++HF2- HNO3+2HF → H2NO3++HF2-
溶剂化效应的理论研究计算模型 (1)

文献综述题目:溶剂化效应的理论研究计算模型作者:xxx班级:xxx学号:xxx日期:2014年5月21号溶剂化效应的理论研究计算模型摘要本文概述了研究溶剂效应计算模型,到目前的溶剂效应的研究进展和研究现状。
介绍了溶剂化效应和描述溶剂效应的一些参数,以及几种重要的溶剂化模型,并分别介绍了基于不同的模型而发展的不同的理论计算方法。
关键词溶剂化效应计算模型综述一、溶剂化现象在溶液中,溶质被溶剂分子包围的现象称为溶剂化,溶剂化作用是溶剂分子通过它们与离子的相互作用,而累积在离子周围的过程。
该过程形成离子与溶剂分子的络合物,并放出大量的热。
溶剂化作用改变了溶剂和离子的结构。
以水溶液为例,其中一个离子周围水的结构模型如图1所示。
图1图中A为化学水化层,该层中由于离子和水偶极子的强大电场作用,使得水分子与离子结合牢固,因而失去平动自由度,这一层水分子和离子一块移动,且水分子数不受温度影响;B为物理水化层,该层水分子也受到离子的吸引,但由于距离较远,吸引较弱,水分子数随温度改变;C为白由水分子层,该层水分子不受离子电场影响。
溶剂不能被单纯宏观地看成一种以密度、介电常数和折射率等物理常数表示特性的连续介质,而应把它看成是单个相互作用的溶剂分子所组成的不连续的介质。
在溶剂及溶液中各质点之间的相互作用,一方面用气体动力学理论的定律处理则太大,而另一方面,如用固体物理的定律来处理则又太小。
溶剂既不是一种使被溶解物在其中扩散以达到紊乱而又均匀分布的惰性介质;也不是象晶体那样具有某种规则结构的介质。
因此气体和晶体两种可能的模型都不能不加限制地应用于溶液。
由于相互作用的复杂性,有关液体的结构,人们所知甚少,甚至最重要的溶剂一水,其内部精细结构的研究也仍然是目前探索的课题frl。
人们提出过许多不同的模型用来描述水的结构,但是所有这些模型均未能圆满地描述水的物理一化学性质和解释水的异常特性。
因此,用实验和理论方法研究液体的结构和相互作用,是物理化学中最为艰巨的任务。
水溶液中的化学平衡

和 都是平衡常数,表示了弱酸、弱碱解离出离子趋势的大小,K值
越大,表示解离的趋势越大。一般把 小于10-2的酸,称为弱酸;碱也可 以按着 值的大小分类。 (2)酸碱的强弱 可用解离平衡常数来表示酸和碱的强度。一些酸从强 到弱的排列顺序是
HAc在H2O中有
4.1.2弱电解质的解离平衡
Ac-。用c0表示醋酸溶液的起始浓度,用c(H+)、c(Ac-)和c(HAc)分别表示 H+、Ac-和HAc的平衡浓度,则有c(H+)= c(Ac-)·c(HAc)=c0- c(H+)。
4.1.2弱电解质的解离平衡
将各平衡浓度代入式(4-1)中,有:
Kaθ
c(H )2 c0 c(H )
(4-2)
4.1.1 酸碱理论
2. 酸碱的质子理论
由丹麦的布朗斯特和英国的劳莱提出并定义了酸与碱:酸碱质子理论将能 给出质子的分子或离子定义为酸;能接受质子的分子或离子定义为碱。 酸和碱之间的关系是:
满足上述关系的一对酸和碱互为共轭酸碱。 例如:醋酸CH3COOH
其中HAc是Ac-的共轭酸,而Ac-是HAc的共轭碱。 酸越强,它的共轭碱就越弱;酸越弱,它的共轭碱就越强。
当c0不是很小,而α不是很大时。弱酸弱碱溶液的解离度与其浓度的
平方根成反比,与其解离常数的平方根成正比。这一关系称为稀释定律。 平衡常数 和 不随浓度变化,但作为转化百分数的解离度α,
却随起始浓度的变化而变化,只有在浓度相同的条件下,才能用解离度的
大小来比较电解质的相对强弱。起始浓度c0越小,解离度α值越大。
由瑞典化学家阿伦尼乌斯提出并定义了酸与碱:电解质在水溶液中能 电离生成阴、阳离子。酸是指在水溶液中电离时产生的阳离子都是H+离子 的化合物;而碱是指在水溶液中电离时产生的阴离子都是OH-离子的化合 物。即,能电离出H+是酸的特征,能电离出OH-是碱的特征,酸碱的中和 反应生成盐和水。又根据强、弱电解质的概念,将在水中全部电离的酸或 碱,称为强酸和强碱;在水中部分电离的酸或碱,称为弱酸和弱碱。
溶剂化结构 阴离子 溶剂-概述说明以及解释

溶剂化结构阴离子溶剂-概述说明以及解释1.引言1.1 概述溶剂化结构、阴离子和溶剂在溶液中起着至关重要的作用。
溶剂化结构指的是溶质分子在溶剂中形成的有序结构,这种结构可以影响溶质的稳定性、活性和反应性。
阴离子是一种带有负电荷的离子,它在溶液中会与阳离子形成离子对,并影响溶液的性质。
而溶剂则是溶解物质的介质,不同的溶剂对溶质的溶解度、反应速率等都有影响。
本文将重点探讨溶剂化结构、阴离子和溶剂在溶液中的相互作用及影响。
通过对这些关键因素的深入研究,可以更好地理解溶解过程中的分子间相互作用机制,为进一步探索化学反应、生物过程等提供重要的理论基础。
1.2 文章结构文章结构部分主要包括引言、正文和结论三个部分。
在引言部分,作者会对文章进行简要的概述,介绍文章的目的和重要性。
正文部分是文章的主体部分,通常包括多个章节,详细讨论研究对象的相关内容。
结论部分则对研究结果进行总结,提出展望和结论,强调研究的重要性和可行性。
文章结构的设计旨在使读者能够清晰地了解文章的逻辑结构和研究思路,帮助读者理解作者的观点和研究成果。
1.3 目的本文旨在探讨溶剂化结构、阴离子和溶剂之间的相互作用关系,通过深入研究这些关键概念,揭示它们在化学反应和溶液中的重要作用。
通过对这些内容的分析和讨论,可以有助于我们更好地理解溶剂化过程和溶剂中的离子行为,从而为相关领域的研究提供理论支持和实践指导。
同时,本文也旨在促进对溶液化学和配合物化学的深入理解,为相关领域的研究和应用提供新的思路和方法。
最终目的是推动溶剂化结构研究和相关领域的发展,为化学领域的学术研究和实际应用做出贡献。
2.正文2.1 溶剂化结构溶剂化结构是指在溶液中,溶剂分子围绕着溶质分子形成的一种特定的空间结构。
这种结构在化学反应和物理性质中起着重要的作用。
溶剂分子通过静电作用、范德华力、氢键等相互作用与溶质分子发生作用,形成一个稳定的溶剂化层。
这个层结构既能稳定溶质分子的结构,也能影响溶质的反应活性。
第三章 酸碱和溶剂化学

第一节 酸碱概念
第二节 质子酸碱理论及质子酸碱强度
第三节 电子酸碱理论及电子酸碱强度 第四节 非水溶剂化学
第一节 酸碱概念
1. 酸碱的水-离子论
1887年 Arrhenius提出:凡在水溶液中产
生H+的物质叫酸,而在水溶液中产生OH-的 物质叫碱。
优点:能提供一个酸碱强度的定量标度 缺点:只限于水溶液
酸碱反应:
碱
CaO(S)
酸
SO3(l,g)
盐
CaSO4(S)
优点:特别适用于高温下氧化物之间的反应
第二节 质子酸碱理论及质子酸碱强度
2.1 质子酸碱理论和质子溶剂
2.2 质子酸碱强度的量度
2.3 超酸
2.1 质子酸碱和质子溶剂
1、质子理论
酸: 反应中能给出质子的物种(分子或离子), 即质子给予体 碱: 反应中能接受质子的物种(分子或离子) , 即质子接受体 共轭关系: 即 A(酸) B(碱) + H+
与负电荷的分布情况有关,负电荷分散得越好,X-越稳定。 例如:
HClO<HClO2<HClO3<HClO4
4.溶剂的影响
同一溶剂中,酸碱的相对强弱决定于各酸碱的本性, 例如,H2SO4、HAc、NH3 不同溶剂中,同一酸碱的相对强弱则由溶剂的性质决定。 例如,醋酸在水、液氨、无水硫酸中则分别表现为弱酸、强 酸、碱。 物质的酸碱性在不同溶剂作用的影响下,“强可以变弱, 弱也可以变强,酸可以变碱,碱也可以变酸” 。
2H2O= H3O++OH2NH3 = NH4++NH2-
酸
HCl
碱
NaOH
酸碱反应
HCl+NaOH=NaCl+H2O
有机溶剂体系的离子交换理论
第三章 基本理论由于电解质溶液活度系数计算方面的困难,因此很难实现有机溶剂体系中离子交换的数学处理。
但是,通过对这个体系的分析,仍然可以从离子交换树脂的基本模型出发,运用溶剂萃取的基本原理和络合物形成理论,初步探讨有机溶剂体系的离子交换理论。
第一节 离子交换树脂的基本模型 一. 离子交换的交换平衡和动力学 首先研究一定量的离子交换树脂与一定体积的外部溶液中的离子进行离子交换反应。
例如:H +型的阳离子交换树脂与溶液中的Na +离子发生交换反应: RH + Na + = RNa + H + (3-1)由于离子交换反应的可逆性,它们最终会达到一定的交换平衡,可以用等温线来表示不同的离子交换树脂的交换平衡特性。
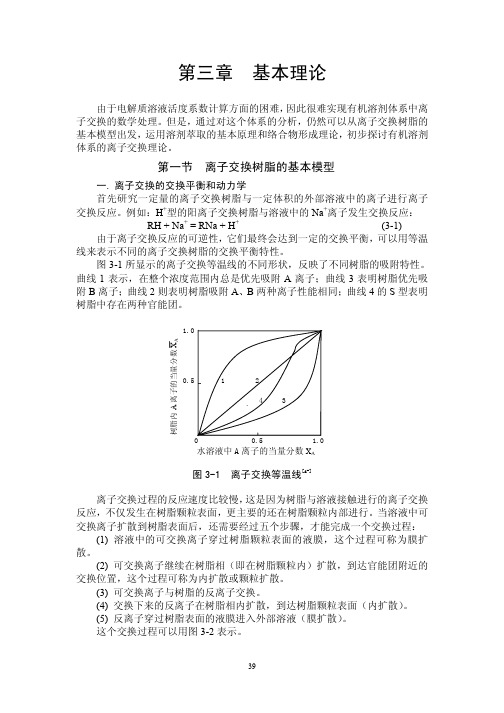
图3-1所显示的离子交换等温线的不同形状,反映了不同树脂的吸附特性。
曲线1表示,在整个浓度范围内总是优先吸附A 离子;曲线3表明树脂优先吸附B 离子;曲线2则表明树脂吸附A 、B 两种离子性能相同;曲线4的S 型表明树脂中存在两种官能团。
1.00.5 1 24 3树脂内A 离子的当量分数X A0 0.5 1.0水溶液中A 离子的当量分数X A图3-1 离子交换等温线[45]离子交换过程的反应速度比较慢,这是因为树脂与溶液接触进行的离子交换反应,不仅发生在树脂颗粒表面,更主要的还在树脂颗粒内部进行。
当溶液中可交换离子扩散到树脂表面后,还需要经过五个步骤,才能完成一个交换过程:(1) 溶液中的可交换离子穿过树脂颗粒表面的液膜,这个过程可称为膜扩散。
(2) 可交换离子继续在树脂相(即在树脂颗粒内)扩散,到达官能团附近的交换位置,这个过程可称为内扩散或颗粒扩散。
(3) 可交换离子与树脂的反离子交换。
(4) 交换下来的反离子在树脂相内扩散,到达树脂颗粒表面(内扩散)。
(5) 反离子穿过树脂表面的液膜进入外部溶液(膜扩散)。
这个交换过程可以用图3-2表示。
图 3-2 离子交换过程示意图实际上在交换位置进行的交换反应速度是很快的,但是离子的扩散速度比较慢,尤其是离子在树脂颗粒内扩散的速度比在水溶液中慢1~2个数量级(见表3-1),这就是树脂的交换反应比水溶液中离子互换反应速度慢的原因。
酸碱理论概述

同样,碱在水溶液中接受质子,也必须有溶剂水分
子参加。如:氨的离解:
半反应1 NH3 + H+ = NH4+
+) 半反应2 H2O = H+ + OH-
NH3 + H2O = OH- + NH4+
碱1
酸2
碱2 酸1
传统称之为“盐的水解”的反应,也是酸碱反应。 如:NH4Cl、NaAc的水解反应:
NH4+ + H2O === H3O+ + NH3 Ac- + H2O === OH- + HAc
盐:酸碱反应的产物
如:H2SO4→2H++SO42-, HNO3→H++NO3所以硫酸与硝酸都是酸; 又如: NaOH→Na++OH-,Ca(OH)2 →Ca2++2OH所以氢氧化钠和氢氧化钙都是碱。
3
意义:首次对酸碱赋予了科学的定义
局限性: ⑴、只适用于水溶液不适用于非水溶液 ⑵、不能解释有的物质( NH3)不含OH-,却
(1)在较稀的弱电解质或极稀的强电解质溶液中,离子的
总浓度很低,离子间力很小,接近于1,可认为a = c。
(2)在一般的强电解质溶液中,离子的总浓度很高,
离子间力较大,就小于1,因此活度就小于浓度。
在这种情况下,严格地讲,各种平衡常数的计算就 不能用离子的浓度,而应用活度 。
(3)中性分子活度系数近似等于1。
H2O HOH
在水溶液中,酸:凡是能够产生H+的为酸, HCl 碱:凡是能够产生OH-的为碱。NaOH
5
又如:液态氨,NH3为溶剂,氨自身电离为: 2NH3 → NH4+ + NH2-
在液氨中,凡能离解出NH4+的物质为酸。 NH4Cl 凡能离解出NH2-的物质为碱。 NaNH2 酸碱反应为:NH4++NH2-→2NH3。
理想溶液吸附理论

理想溶液吸附理论
理想溶液吸附理论是分析多相体系的一种重要理论,它由巴斯利于1961年提出,旨在研究少量溶剂完全溶解有机气体所需要的溶剂容量以及其变化规律。
理想溶液吸附理论指出,当有机气体和溶剂形成多相混合物时,其中气体因气体分压而与溶剂发生络合,从而产生吸附。
理想溶液吸附理论指出,当冷却反应混合物至有机气体的分压以下时,气体将完全溶解于溶剂中,溶剂的容量将达到最大值。
而如果再增加气体的分压,在溶剂的溶解力上限以下,有机气体就会在溶剂表面上吸附。
理想溶液吸附理论用来描述溶剂壳体或固体多相系统,该理论被广泛应用于制作助剂实验。
它也可以用来描述吸附剂对有机气体的吸附作用、水溶剂溶解过程以及非晶软晶体的结构,也可以用来研究复杂的重金属污水处理技术。
理想溶液吸附理论也可以通过分析和模拟来促进实际的生产、操作和管理,克服工艺中的困难,提高运行效率,实现节约能源污染降解。
近年来,它也可以结合分子动力学方法及相平衡理论深入研究离子交换,其结果可以用于更好地计算溶液添加剂的选择以及吸附材料的开发。
总而言之,理想溶液吸附理论在多相体系分析中具有重要作用,及其对溶液化学和固体表面物理学的研究也受到了普遍认可。
加之结合其他组成领域的理论和技术,它的实际应用变得更加广泛,以期达到实际的最优效果。
物理化学中的溶液理论

物理化学中的溶液理论物理化学是研究物质的理论和实验基础的分支学科,其中溶液理论是其重要组成部分之一。
溶液理论是关于溶质在溶剂中的分子间相互作用及其对溶液性质的影响的理论体系。
本文将介绍溶液的基本概念、溶解度的影响因素以及溶液中溶质和溶剂的分子间相互作用。
一、溶液的基本概念溶液是由溶质和溶剂组成的混合体系,其中溶质是以较低浓度存在于溶液中的物质,而溶剂是以较高浓度存在于溶液中的物质。
溶液是物理化学中研究的核心对象,其性质的研究对于理解物质的基本特性具有重要意义。
二、溶解度的影响因素1. 温度:温度是影响溶解度的重要因素之一。
一般情况下,随着温度的升高,溶解度也会增加。
这是因为在高温下,溶液中的分子能量增加,分子热运动加剧,有利于溶质分子与溶剂分子之间的相互作用,从而促进了溶质的溶解过程。
2. 压力:在溶液中,压力对溶解度的影响较小,除非涉及到气体溶液或电解质溶液等特殊情况。
在一般情况下,溶液的压力变化对溶解度的影响可以忽略不计。
3. 物质的特性:不同物质的溶解度往往具有很大的差异。
分子间的相互作用力是影响溶解度的重要因素之一,比如极性物质在极性溶剂中的溶解度往往较高,而非极性物质在非极性溶剂中的溶解度较高。
4. 浓度:在溶质浓度低的情况下,溶解度随着溶质浓度的增加而增加。
然而,当溶质浓度达到一定限度时,继续增加溶质浓度并不会显著影响溶解度。
三、溶液中溶质和溶剂的分子间相互作用1. 溶质-溶质间相互作用:溶质与溶质之间的相互作用对溶解度有重要影响。
当溶质分子之间的相互作用较强,溶质分子间能够形成更稳定的团簇结构,从而导致溶质的溶解度降低。
2. 溶剂-溶剂间相互作用:溶剂与溶剂之间的相互作用也会影响溶液的性质。
当溶剂分子之间的相互作用较强时,溶剂分子间能够形成更稳定的结构,从而导致溶液的溶解度降低。
3. 溶质-溶剂间相互作用:溶质与溶剂之间的相互作用是决定溶液性质的重要因素。
当溶质与溶剂之间的吸引力较强时,溶质分子能够更好地与溶剂分子相互作用,从而有利于溶质的溶解。
大学无机化学第七章试题及解答

第七章 酸碱解离平衡本章总目标:1:了解酸碱理论发展的概况2:了解同离子效应和盐效应对解离平衡的影响。
3:掌握酸、碱、盐以及缓冲溶液的pH 值的相关计算。
4:了解离子活度、活度因子、离子强度等概念。
5:了解缓冲溶液的组成;缓冲作用原理;缓冲溶液的性质。
各小节的目标:第一节:弱酸和弱碱的解离平衡1:掌握一元弱酸的解离平衡常数的意义、用途和计算。
2a H K c θ+⎡⎤⎣⎦=2;掌握一元弱碱的解离平衡常数的意义、用途和计算。
20b OH K c OH θ--⎡⎤⎣⎦=⎡⎤-⎣⎦当 0400b c K θ>时,OH -⎡⎤=⎣⎦3:解离度概念——平衡时已经解离的浓度与起始浓度之比。
4:同离子效应——在弱电解质的溶液中国,加入与其具有相同离子的强 电解质,使弱电解质的解离平衡左移,从而降低弱电解质的解离度。
5:掌握多元弱酸的解离平衡的计算。
6:了解水的离子积常数、溶液的pH 等基本概念。
7:熟练掌握缓冲溶液pH 值的计算:lg a pH pK θ=-(c 酸/c 盐);lg b pOH pK θ=-(C 碱/C 盐)8:可以解释缓冲溶液可以达到缓冲目的的原因。
第二节:盐的水解1:掌握水解平衡常数的计算:1.弱酸强碱盐:Wh aK K K θθθ=;2.强酸弱碱盐:W h b K K K θθθ=;3.弱酸弱碱盐:W h a b K K K K θθθθ=2:可以运用公式——211211ln ()K H K R T T θθ∆=-来解释升温促进水解的原因。
3:掌握单水解过程的计算——OH-⎡⎤=⎣⎦,H+⎡⎤==⎣⎦4;掌握双水解pH值的计算:H+⎡⎤=⎣⎦第三节:电解质溶液理论和酸碱理论的发展1:掌握离子强度、活度的概念和离子强度的计算212i iI b z=∑。
2:理解盐效应对弱电解质解离度的影响。
3:了解酸碱质子理论、酸碱溶剂体系理论和酸碱电子理论。
Ⅱ习题一选择题1.某弱酸HA的Ka=2.0×10-5,若需配制pH=5.00的缓冲溶液,与100ml,1.0mol/L 的NaAc相混合的1.0mol/LHA体积应为()A. 200mlB.50mlC.100mlD.150ml2.已知相同浓度的盐NaA ,NaB,,NaC,NaD的水溶液的pH依次增大,则相同浓度的下列溶液中解离度最大的是()(《无机化学例题与习题》吉大版)A .HA B.HB C.HC D.HD3.pH=3和pH=5的两种HCl溶液,以等体积混合后,溶液的pH是()A .3.0 B.3.3 C.4.0 D.8.04.已知K b0(NH3)=1.8×10-5,其共轭酸的K a0值为()(《无机化学例题与习题》吉大版)A . 1.8×10-9 B. 1.8×10-10 C. 5.6×10-10 D. 5.6×10-55.难溶电解质M2X的溶解度S与溶度积Ksp之间的定量关系式为()A.S =KspB.S=(Ksp/2)1/3C. S =Ksp1/2D.S =(Ksp/4)1/36.下列物质中,既是质子酸,又是质子碱的是()(《无机化学例题与习题》吉大版)A.OH-B.NH4+C.S2-D.PO43-7.欲配制pH=13.00的NaOH溶液10.0L,所需NaOH固体的质量是()(原子量Na=23)A .40g B.4.0g C.4.0×10-11g D.4.0×10-12g8.H2AsO4-的共轭碱是()(《无机化学例题与习题》吉大版)A. H3AsO4B. HAsO42- C . AsO43- D. H2AsO3-9.往银盐溶液中添加HCl使之生成AgCl(Ksp=1.56×10-10)沉淀,直至溶液中Cl-的浓度为0.20mol/L为止。
isc溶剂化结构

isc溶剂化结构ISC(Interface-Selective Control)溶剂化结构是近年来出现的一种新理论,它可以用来描述分子溶剂化层中分子和溶液界面的结构与性质。
此理论的基本思想是将溶剂化结构分为两个不同的区域,分别为界面区域和余液区域。
在两个区域中,溶剂的分子结构和运动方式会有所不同。
中心分子中的离子在这个意义下可以被视为划分和区分这两个区域的属性因素。
ISC溶剂化结构理论发展的奠基之作是由美国科学家Dhavala K. Rao于2014年在Journal of Chemical Physics上发表的一篇论文:“Interface-Selective Control of Ionic Liquid Hydration Structure at Electrified Interfaces”.此后,这种理论方法已经被广泛应用于许多应用研究领域,例如电池和太阳能电池,初始核和晶体制备。
在这篇文章中,我将介绍ISC溶剂化结构的原理、方法和应用,并阐述它在化学领域的科研意义和实际应用价值。
ISC 溶剂化结构的原理ISC溶剂化结构理论的核心思想是溶液分子中存在两个不同的区域,它们对应于“界面区域”和“余液区域”。
在分子溶液中,溶剂密度的变化随着离子距离中心分子的远近而发生变化。
分子靠近中心分子的区域是“界面区域”,分子远离中心分子的区域是“余液区域”。
在这两个区域中,溶剂的分子结构和运动方式会有所不同,ISC溶剂化结构理论可以精确描述这些结构变化。
ISC 溶剂化结构的方法ISC溶剂化结构可以通过计算分子溶液中溶质的水合壳结构描述。
它使用分子动力学模拟技术(MD)来模拟分子溶液体系中分子的动力学行为和相互作用。
这种方法使用来自溶液界面的N水分子定义界面区域的大小和位置,并将分子分为界面区域和余液区域。
然后,它使用分子模拟来确定溶液中离子的构象,并将离子的溶剂化Shell区分为“更靠近”和“更远离”中心分子的两个区域。
酸碱理论

布仑斯惕和劳里提出的酸碱定义是:“凡是能够释放出质子(H+)的物质,无论它是分子、原子或离子,都是酸;凡是能够接受质子的物质,无论它是分子、原子或离子,都是碱。”酸和碱之间存在以下关系: 上式表明酸和碱是相互依赖的。在以下反应中: HCl+H2O===H3O++Cl- HCl和H3O+都能够释放出质子,它们都是酸: H2O和Cl-都能够接受质子,它们都是碱: 上述反应称为质子传递反应,可用一个普遍反应式表示: 酸1+碱2===酸2+碱1当一种分子或离子失去质子起着酸的作用的同时,一定有另一种分子或离子接受质子起着碱的作用。酸1和碱1或酸2和碱2称为共轭酸碱对。 酸碱质子理论的优点是:①扩大了酸的范围。只要能够释放出质子的物质,不论它是在水溶液中;或是非水溶剂 ;或是气相反应;或是熔融状态,它们都是酸,例如NH4+、HCO3-、HSO4-、HS-、H2PO4-、HPO42-、H2O酸。②扩大了碱的范围。NH3和Na2CO3都能接受质子,全是碱: 于是,F-、Cl-、Br-、I-、HSO4-、SO42-等都可算是碱。③一种物质是酸还是碱,是由它在酸碱反应中的作用而定。HCO3-与NaOH反应时放出质子,此时它是一种酸:HCO3-+NaOHNa++CO32-+H2O,HCO3-与HCl反应时,它又接受质子,则是一种碱: 由此可见,酸和碱的概念具有相对性。 当然,酸碱质子理论也有解释不了的问题,例如,无法说明下列反应是酸碱反应:CaO+SO3CaSO4在这个反应中SO3显然是酸,但它并未释放质子;CaO显然是碱,但它并未接受质子。又如实验证明了许多不含氢的化合物(它们不能释放质子) 如AlCl3、BCl3、SnCl4都可以与碱发生反应,但酸碱质子理论无法解释它们是酸。
2.Brownst-Lowry理论,也叫“质子理论”
1酸碱理论1,2

Cu , Ag , Au , Cd2 , Hg22 , Hg2 , HgMe
+
BH3, GaMe3, GaCl3, GaBr3, GaI3, Tl , TiMe3 CH2(卡宾) HO , RO , RS , RSe , Te4 , RTe
+ + + + + + + +
- - - - - - - - - - - -
交界碱 C6H5NH2, C5H5N, N3 , N2 NO2 , SO32 Br
- - -
软 碱 H
- - -
R , C2H4, C6H6, CN , RNC, CO SCN , R3P, (RO)3P, R3As R2S, RSH, RS , S2O32 I
+ + + + + + + + +
Cu , Ag , Au , Cd2 , Hg22 , Hg2 , HgMe
+
BH3, GaMe3, GaCl3, GaBr3, GaI3, Tl , TiMe3 CH2(卡宾) HO , RO , RS , RSe , Te4 , RTe
+ + + + + + + +
交界酸 Fe2 , Co2 , Ni2 , Cu2 , Zn2 Rh3 , Ir3 , Ru3 , Os2 BMe3, GaH3 R3C , C6H5 , Sn2 , Pb2 NO , Sb3 , Bi3
+ + + + + + + + + + + + + + + -
软 酸 Co(CN)53 , Pd2 , Pt2 , Pt4
• 1 判断溶解度; • 2 解释有机溶剂的选择性; • 3 指导掩蔽与解避剂的选择; • 4 对溶液萃取剂的选择等有指导作用; • 5 有利与我们沉淀载体等; • 6 分离性质相似的离子.
什么是酸碱溶剂理论

什么是酸碱溶剂理论
酸碱溶剂理论是指凡是在溶剂中产生该溶剂的特征阳离子的溶质叫酸,产生该溶剂的特征阴离子的溶质叫碱。
简而言之,能生成和溶剂相同的正离子者为酸,能生成与溶剂相同的负离子者为碱。
这一理论最初由富兰克林在1905年提出,后来被化学家戴维确认并推广。
酸碱溶剂理论突破了“质子理论”的限制,将酸碱理论从“质子体系”推广到了“非质子体系”。
然而,这一理论也存在局限性,主要表现在其只适用于能发生自电离的溶剂体系中。
如需了解更多关于酸碱溶剂理论的信息,建议查阅化学书籍或咨询专业化学人士。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H.卡迪和H.P.埃尔西提出的溶剂体系理论时对阿累尼乌斯的电离理论及布朗斯特的质子理论的进一步发展,把酸碱概念扩展到完全不涉及质子的溶剂体系中。该理论认为,凡在溶剂中产生(或通过反应生成)该溶剂的特征阳离子的溶质称作酸,如酸的水溶液、液氨中的铵盐等;而产生(或通过反应产生)该溶剂的特征阴离子的溶质称作碱,如氢氧化钠的水溶液、液氨中的氨基化钠 NaNH2等。 (注① ←→ 表示可逆符号,下同。) 在水中,NH3是碱,CH3COOH是酸 NH3 + H20 ←→ NH4+ + OH-(碱) CH3COOH + H2O ←→ CH3COO- + H3O+(酸) H3O+ + OH- ←→ 2H2O —————————————————————————————————————————————— 净反应:CH3COOH+NH3 ←→ CH3COONH4 在液态二氧化硫中, SOCl2是酸,Cs2SO3是碱: 2SO2 ←→ SO2+ + SO32- SOCl2 ←→ SO2+ + 2Cl- Cs2SO3 ←→ 2Cs+ + SO32- —————————————————————————————————————————————— 净反应:SOCl2 + Cs2SO3 —→ 2CsCl + 2SO2 液态BrF3中SbF3与KF发生反应,BrF3按下式电离: 2BrF3 ←→ BrF2+ + BrF4- ① SbF5和KF分别按下列式子与BrF3反应: SbF5 + BrF3 → BrF2+ SbF6- ,SbF5为酸 KF + BrF3 → BrF4- + K+ ,KF为碱 BrF2+ + BrF4- ←→ 2BrF3 —————————————————————————————————————————————— 净反应: KF+SbF5 → KSbF6 液氨中的酸碱反应包括: 2NaNH2 (碱) + Zn(NH2)2 (两性) → Na2[Zn(NH2)4] 2NH4I (酸) + Zn(NH2)2 (两性) → [Zn(NH3)4)]I2 硝酸在纯硫酸中是碱: HNO3 (碱) + 2H2SO4 → NO2+ + H3O+ + 2HSO4? 液态四氧化二氮中: AgNO3 (碱) + NOCl (酸) → N2O4 + AgCl 中和就是生成溶剂的反应,如在液态二氧化硫体系中: Cs2SO3+SOCl2─→2SO2+2CsCl Cs2SO3和SOCl2滴定,就像在水溶液中酸碱滴定生成水一样。溶剂体系适用于能解离的溶剂。 在非质子溶剂中: N2O4 ? NO+ (亚硝基正离子) + NO3? (硝酸根) 2SbCl3 ? SbCl2+ + SbCl4? 酸导致溶剂阳离子浓度上升,阴离子浓度下降;而碱则导致阳离子浓度下降,阴离子浓度上升。 例如在液氨中,KNH2提供NH2?离子,是强碱,而NH4NO3提供NH4+离子,是强酸。在液态二氧化硫(SO2)中,亚硫酰基化合物是酸,提供SO2+离子;而亚硫酸盐提供SO32?离子,可看作碱。 酸碱溶剂理论中,同一化合物在不同溶剂中可以改变其酸碱性质,比如HClO4在水中是强酸,在乙酸中是弱酸,而在氟磺酸中则是弱碱。 优点:溶剂体系理论可把酸碱概念扩展到完全不涉及质子的溶剂体系中。水-离子理论只是水作为溶剂时的溶剂体系理论的特例。质子理论可看作是对质系理论。
但是,溶剂体系理论只能适用于能发生自电离的溶剂体系中。实际上有不少的物质在烃类(如苯、氯仿、醚具有催化效应等,但这些溶剂几乎不发生自电离作用。我们可以借助路易斯酸碱理论来说明。
