邵逸夫医院药物临床试验申请表
合集下载
药物临床试验申请表 (2)
是否国际多中心:□是□否
试验药物是否免费提供:□是□否
是否进口注册:□否□是,进口许可证批号:
申办单位:
电话:
传真:
CRO公司:
电话:
传真:
CRO联系人:
电话:
邮箱:
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计划完成例数:
本机构计划试验开始时间:年月日
本机构计划试验完成时间:年月日
主要研究者意见:
签名: 日期: 年 月 日
专业负责人意见:
签名: 日期: 年 月 日
机构办公室审查意见:
签名: 日期: 年 月 日
机构负责人审批意见:
签名: 日期: 年 月 日
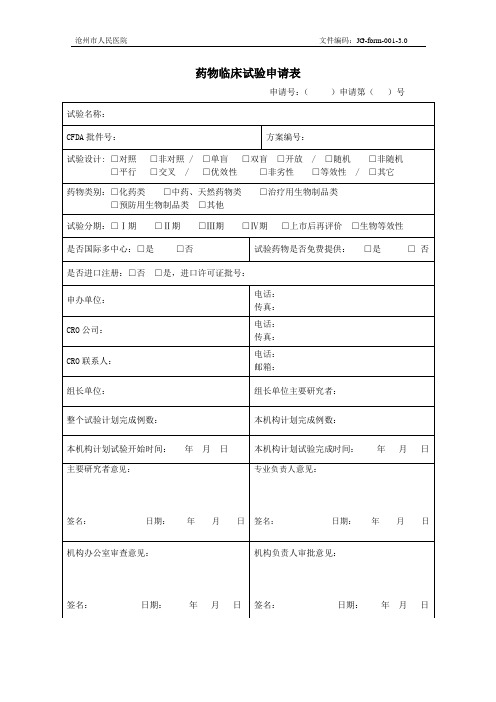
药物临床试验申请表
申请号:()申请第()号
试验名称:
CFDA批件号:
方案编号:
试验设计:□对照□非对照/□单盲□双盲□开放/□随机□非随机
□平行□交叉/□优效性□非劣性□等效性/□其它
药物类别:□化药类□中药、天然药物类□治疗用生物制品类
□预ቤተ መጻሕፍቲ ባይዱ用生物制品类□其他
试验分期:□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□上市后再评价 □生物等效性
试验药物是否免费提供:□是□否
是否进口注册:□否□是,进口许可证批号:
申办单位:
电话:
传真:
CRO公司:
电话:
传真:
CRO联系人:
电话:
邮箱:
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计划完成例数:
本机构计划试验开始时间:年月日
本机构计划试验完成时间:年月日
主要研究者意见:
签名: 日期: 年 月 日
专业负责人意见:
签名: 日期: 年 月 日
机构办公室审查意见:
签名: 日期: 年 月 日
机构负责人审批意见:
签名: 日期: 年 月 日
药物临床试验申请表
申请号:()申请第()号
试验名称:
CFDA批件号:
方案编号:
试验设计:□对照□非对照/□单盲□双盲□开放/□随机□非随机
□平行□交叉/□优效性□非劣性□等效性/□其它
药物类别:□化药类□中药、天然药物类□治疗用生物制品类
□预ቤተ መጻሕፍቲ ባይዱ用生物制品类□其他
试验分期:□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□上市后再评价 □生物等效性
药物临床试验申请表

电话
主要研究者(签字):
所在专业(科室)意见:
专业(科室)负责人(签字):
日期:
机构受理号:
口期:
年月日
药物临床试验申请表
药物名称(中文)
英文药名称
别名
剂型
规格
剂量
药理作用
用法用量
注册分类
试验分期
试验起止时间
受试病种
试验目的
试验专业
试验例数
申办者
CRO
国家食品药品监督管理局批件
组长单位伦理委员会审批批件
口有,口无口目来自三请本中心,伦理委员会审批
组长单位
负责人
参加单位
负责人
负责人
负责人
负责人
负责人
负责人
项目联系人
主要研究者(签字):
所在专业(科室)意见:
专业(科室)负责人(签字):
日期:
机构受理号:
口期:
年月日
药物临床试验申请表
药物名称(中文)
英文药名称
别名
剂型
规格
剂量
药理作用
用法用量
注册分类
试验分期
试验起止时间
受试病种
试验目的
试验专业
试验例数
申办者
CRO
国家食品药品监督管理局批件
组长单位伦理委员会审批批件
口有,口无口目来自三请本中心,伦理委员会审批
组长单位
负责人
参加单位
负责人
负责人
负责人
负责人
负责人
负责人
项目联系人
药物临床试验申请表

药物临床试验申请表填表日期:年月日编号:(由机构填写)有时候想拼命的攀登,但总是力不从心。
可是,每个人境况是不同的,不要拿别人的标准,来塑造自己的人生。
太多的失望,太多的落空,纯属生活的常态。
岁月告诉我:挫败,总会袭人,并且,让你承受,但也,负责让你成长。
人生漫长,却又苦短,幽长的路途充满险阻,谁不曾迷失,谁不曾茫然,谁不曾煎熬?多少美好,毁在了一意孤行的偏执。
好也罢,坏也罢,人生的路,必须自己走过,才能感觉脚上的泡和踏过的坑。
因为懂得,知分寸;因为珍惜,懂进退。
最重要的是,与世界言和,不再为难自己和别人。
《菜根谭》中说:花看半开,酒饮微醉。
就是说,做事不必完美,享乐不可享尽,这是一种含苞待放的人生状态。
即使是最美的月亮,也会有盈亏的自然之道。
否则便是过犹不及,弄巧成拙。
心灵松绑了,活着才自由。
半生已过,走走停停,看透了生活,选择了顺流的方式,行走。
流水今日,明月前身。
感谢每一粒种子,每一缕清风,每一个阳光的日子,于时光的碎屑中,静品一盏流年的香茗。
撕开浮云的遮掩,其实,每个人心中都有各自的山水,都有一段难捱的时光,好在,总有一天,你的淡然低调,你的暗自努力,你的理性豁达,终将点燃你的整个世界,让故事的结局,美好而温柔。
苏轼在《水调歌头》里写道:人有悲欢离合,月有阴晴圆缺,此事古难全。
是的,层次越高的人,越懂得,人生本就不是尽善尽美,也正因为有了缺憾,才显得是那么的多姿多彩。
心情平和,与是非渐行渐远,再多的兵荒马乱,也抵不过时光的洪流,唯有日常才惊天动地。
夫切菜,妻拌菜,菜菜交缠,洒在热腾腾的面条上,剥头蒜就着,哧啦哧啦的,心里爽透了。
这世间最美的,不就是这样的烟火么。
人生,是一个苏醒的过程。
一首经典,低徊吟唱,年少不知歌者意,再听已是曲中人。
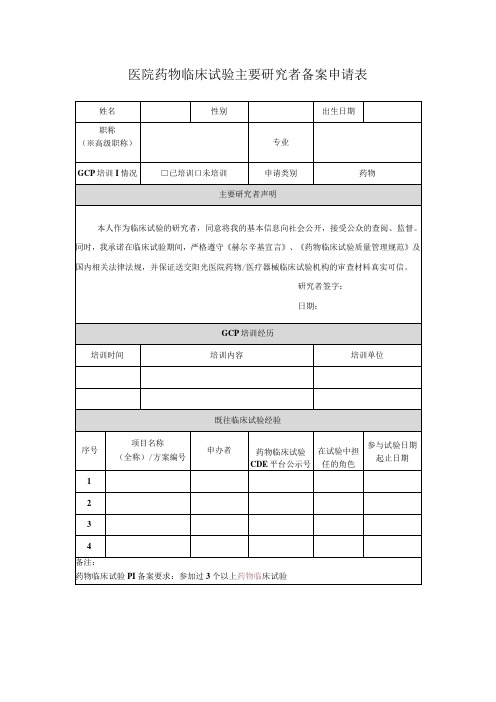
医院药物临床试验主要研究者备案申请表
医院药物临床试验主要研究者备案申请表
姓名
性别
出生日期
职称
(※高级职称)
专业
GCP培训I情况
□已培训口未培训
申请类别
药物
主要研究者声明
本人作为临床试验的研究者,同意将我的基本信息向社会公开,接受公众的查阅、监督。同时,我承诺在临床试验期间,严格遵守《赫尔辛基宣言》、《药物临床试验ห้องสมุดไป่ตู้量管理规范》及国内相关法律法规,并保证送交阳光医院药物/医疗器械临床试验机构的审查材料真实可信。
□最新研究者简历
□最新GCP证书
口执业证书(执业地点为本院)
口资格证书
口既往参与临床试验授权分工表复印件/扫描件
研究者签字:
日期:
GCP培训经历
培训时间
培训内容
培训单位
既往临床试验经验
序号
项目名称
(全称)/方案编号
申办者
药物临床试验CDE平台公示号
在试验中担任的角色
参与试验日期起止日期
1
2
3
4
备注:
药物临床试验PI备案要求:参加过3个以上药物临床试验
科室主任意见:
签字:日期:
机构负责人意见:
签字:日期:
研究者提供的材料(请划“4”)
姓名
性别
出生日期
职称
(※高级职称)
专业
GCP培训I情况
□已培训口未培训
申请类别
药物
主要研究者声明
本人作为临床试验的研究者,同意将我的基本信息向社会公开,接受公众的查阅、监督。同时,我承诺在临床试验期间,严格遵守《赫尔辛基宣言》、《药物临床试验ห้องสมุดไป่ตู้量管理规范》及国内相关法律法规,并保证送交阳光医院药物/医疗器械临床试验机构的审查材料真实可信。
□最新研究者简历
□最新GCP证书
口执业证书(执业地点为本院)
口资格证书
口既往参与临床试验授权分工表复印件/扫描件
研究者签字:
日期:
GCP培训经历
培训时间
培训内容
培训单位
既往临床试验经验
序号
项目名称
(全称)/方案编号
申办者
药物临床试验CDE平台公示号
在试验中担任的角色
参与试验日期起止日期
1
2
3
4
备注:
药物临床试验PI备案要求:参加过3个以上药物临床试验
科室主任意见:
签字:日期:
机构负责人意见:
签字:日期:
研究者提供的材料(请划“4”)
药物临床试验项目立项申请表

□
□
□
申请书、受理文件、批件或备案证明
6
已签名的临床试验方案(版本、版本日期)
□
□
—
需申办方签字页的复印件并盖章、组长单位PI签字页的复印件以及本中心PI签字页的原件各1份
7
研究者手册
□
□
□
申办方盖章
8
病例报告表(样表)
□
□
□
9
电子病例报告表(样表)
□ห้องสมุดไป่ตู้
□
□
10
知情同意书(版本、版本日期)
□
□
□
申办方或CRo盖章
编号
文件资料
有
无
不适用
备注
1
申办方或CRO委托临床试验机构进行临床试验的委托函
□
□
—
2
药物临床试验批件/临床试验通知
□
□
□
注册药物临床试验提供
3
药品注册批件
□
□
□
非注册药物临床试睑或临床研究提供
4
组长单位伦理批件和伦理委员会成员表
□
□
□
如组长单位伦理为修改后同意,需同时提供审查意见函
5
人类遗传资源采集、保藏、利用、对外提供的寄往审批/备案材料
□
□
设施与条件是否能保证安全、有效地进行临床试验
□
□
其他:例如申办方是否为研究者配备CRC
□
□
备注:
既往或在研项目因质量问题处于整改期的专业暂停承接新项目;
机构办公室审查意见:
□同意立项□不同意立项(请注明原因)
机构办主任签名:年—月—日
机构主任(副主任)签名:年一月—B
□
□
申请书、受理文件、批件或备案证明
6
已签名的临床试验方案(版本、版本日期)
□
□
—
需申办方签字页的复印件并盖章、组长单位PI签字页的复印件以及本中心PI签字页的原件各1份
7
研究者手册
□
□
□
申办方盖章
8
病例报告表(样表)
□
□
□
9
电子病例报告表(样表)
□ห้องสมุดไป่ตู้
□
□
10
知情同意书(版本、版本日期)
□
□
□
申办方或CRo盖章
编号
文件资料
有
无
不适用
备注
1
申办方或CRO委托临床试验机构进行临床试验的委托函
□
□
—
2
药物临床试验批件/临床试验通知
□
□
□
注册药物临床试验提供
3
药品注册批件
□
□
□
非注册药物临床试睑或临床研究提供
4
组长单位伦理批件和伦理委员会成员表
□
□
□
如组长单位伦理为修改后同意,需同时提供审查意见函
5
人类遗传资源采集、保藏、利用、对外提供的寄往审批/备案材料
□
□
设施与条件是否能保证安全、有效地进行临床试验
□
□
其他:例如申办方是否为研究者配备CRC
□
□
备注:
既往或在研项目因质量问题处于整改期的专业暂停承接新项目;
机构办公室审查意见:
□同意立项□不同意立项(请注明原因)
机构办主任签名:年—月—日
机构主任(副主任)签名:年一月—B
药物临床试验申请表【模板】
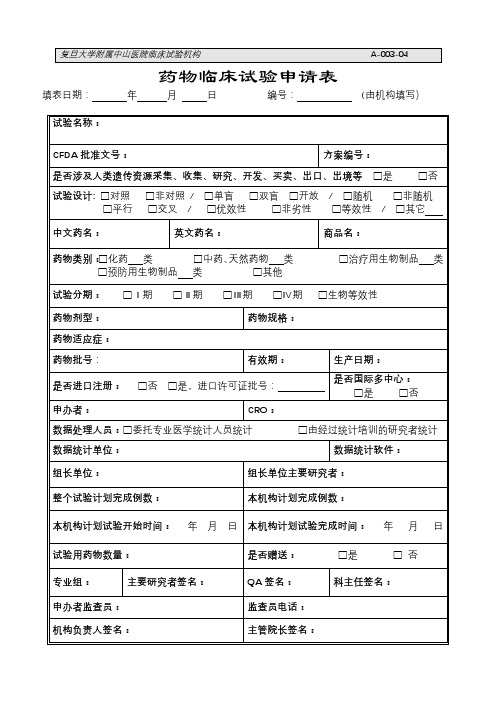
注:请准确填写此申请表。试验结束后,以此申请表的内容为依据,由机构上报给CFDA。
数据统计单位:
数据统计软件:
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计划完成例数:
本机构计划试验开始时间:年 月日
本机构计划试验完成时间:年 月 日
试验用药物数量:
是否赠送:□是 □ 否
专业组:
主要研究者签名:
QA签名:
科主任签名:
申办者监查员:
监查员电话:
机构负责人签名:
主管院长签名:
药物临床试验申请表
填表日期:年月日编号:(由机构填写)
试验名称:
CFDA批准文号:
方案编号:
是否涉及人类遗传资源采集、收集、研究、开发、买卖、出口、出境等□是□否
试验设计:□对照 □非对照 / □单盲 □双盲 □开放 / □随机 □非随机
□平行 □交叉 / □优效性 □非劣性 □等效性 / □其它
中文药名:英文药名:商名:药物类别:□化药类□中药、天然药物类□治疗用生物制品类
□预防用生物制品类□其他
试验分期:□Ⅰ期 □Ⅱ期 □Ⅲ期 □Ⅳ期 □生物等效性
药物剂型:
药物规格:
药物适应症:
药物批号:
有效期:
生产日期:
是否进口注册:□否 □是,进口许可证批号:
是否国际多中心:
□是□否
申办者:
CRO:
数据处理人员:□委托专业医学统计人员统计□由经过统计培训的研究者统计
数据统计单位:
数据统计软件:
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计划完成例数:
本机构计划试验开始时间:年 月日
本机构计划试验完成时间:年 月 日
试验用药物数量:
是否赠送:□是 □ 否
专业组:
主要研究者签名:
QA签名:
科主任签名:
申办者监查员:
监查员电话:
机构负责人签名:
主管院长签名:
药物临床试验申请表
填表日期:年月日编号:(由机构填写)
试验名称:
CFDA批准文号:
方案编号:
是否涉及人类遗传资源采集、收集、研究、开发、买卖、出口、出境等□是□否
试验设计:□对照 □非对照 / □单盲 □双盲 □开放 / □随机 □非随机
□平行 □交叉 / □优效性 □非劣性 □等效性 / □其它
中文药名:英文药名:商名:药物类别:□化药类□中药、天然药物类□治疗用生物制品类
□预防用生物制品类□其他
试验分期:□Ⅰ期 □Ⅱ期 □Ⅲ期 □Ⅳ期 □生物等效性
药物剂型:
药物规格:
药物适应症:
药物批号:
有效期:
生产日期:
是否进口注册:□否 □是,进口许可证批号:
是否国际多中心:
□是□否
申办者:
CRO:
数据处理人员:□委托专业医学统计人员统计□由经过统计培训的研究者统计
药物临床试验申请表药物临床试验申请表
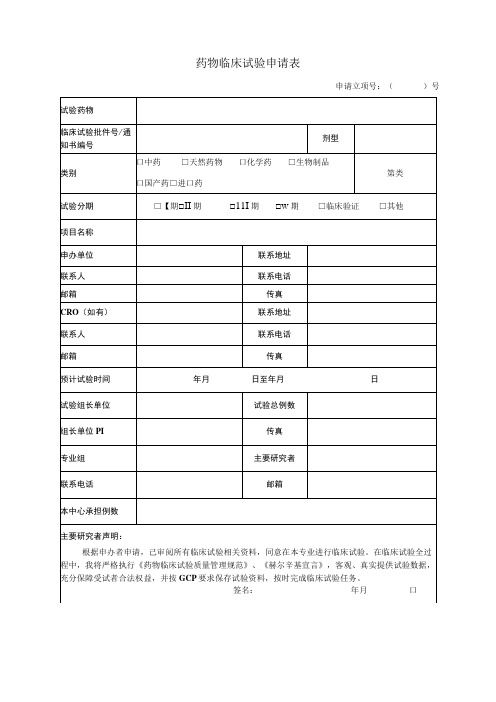
药物临床试验申请表
申请立项号:()号
试验药物
临床试验批件号/通知书编号
剂型
类别
口中药□天然药物口化学药□生物制品
口国产药□进口药
第类
试验分期
□【期□II期□11I期□w期□临床验证□其他
项目名称
申办单位
联系地址
联系人
联系电话
邮箱
传真
CRO(如有)
联系地址
联系人
联系电话
邮箱
传真
预计试验时间
年月日至年月日
□
□
15
招募受试者材料(包括广告)
□
□
16
保险凭证
□
□
17
其他有关资料(受试者日记卡、试验协议初稿、光盘、
CRC授权委托书等,如有必要请自行增加)
□
□
递交人(PI):日期:年月日
机构办公室审核人签字:日期:年月日
备注:1、递交的材料封面均盖上公章,递交一份完整资料即可;
2、如有特殊情况,请在备注栏说明。
□
□
7
病例报告表(样表)
□
□
8
知情同意书(盖章)
□
□
9
申办者/合同研究组织;第三方检测机构资质证明
□
□
10
申办者对监查员的授权委托书
□
□
11
试验药物的药检证明
□
□
12
对照药品的药检证明、药品说明书
□
□
13
研究团队的人员组成名单及分工表
□
□
14
主要研究者及参加试验其他研究者的最新简历
(签名并注明日期)
签名:年月口
机构办公室审查意见:
申请立项号:()号
试验药物
临床试验批件号/通知书编号
剂型
类别
口中药□天然药物口化学药□生物制品
口国产药□进口药
第类
试验分期
□【期□II期□11I期□w期□临床验证□其他
项目名称
申办单位
联系地址
联系人
联系电话
邮箱
传真
CRO(如有)
联系地址
联系人
联系电话
邮箱
传真
预计试验时间
年月日至年月日
□
□
15
招募受试者材料(包括广告)
□
□
16
保险凭证
□
□
17
其他有关资料(受试者日记卡、试验协议初稿、光盘、
CRC授权委托书等,如有必要请自行增加)
□
□
递交人(PI):日期:年月日
机构办公室审核人签字:日期:年月日
备注:1、递交的材料封面均盖上公章,递交一份完整资料即可;
2、如有特殊情况,请在备注栏说明。
□
□
7
病例报告表(样表)
□
□
8
知情同意书(盖章)
□
□
9
申办者/合同研究组织;第三方检测机构资质证明
□
□
10
申办者对监查员的授权委托书
□
□
11
试验药物的药检证明
□
□
12
对照药品的药检证明、药品说明书
□
□
13
研究团队的人员组成名单及分工表
□
□
14
主要研究者及参加试验其他研究者的最新简历
(签名并注明日期)
签名:年月口
机构办公室审查意见:
药物临床试验申请表

药物临床试验申请表
机构受理号:填表日期:年月日
试验名称:
临床试验批件号/沟通函:
方案编号:
试验设计:□对照□非对照/□单盲□双盲□开放/□随机□非随机
□平行□交叉/□优效性□非劣性□等效性/□其它
中文药名:
英文药名:
商品名:
药物类别:□化药类□中药、天然药物类
□治疗用生物制品类□预防用生物制品类
□其他
本机构计划试验开始时间:年月日
本机构计划试验完成时间:年月日
是否涉及遗传资源的申报:□是□否
本机构申请专业:
专业组负责人签名:
主要研究者签名:
机构办受理人签名
机构办主任签名
注:请准确填写此申请表。
试验分期:□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□生物等效性
药物剂型:
药物规格:
药物适应症:
是否进口注册:□否□是,进口许可证批号:
是否国际多中心:□是□否
申办者:
CRO:
数据处理人员:□委托专业医学统计人员统计□由经过统计培训的研究者统计
数据统计单位:
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计完成例数:
机构受理号:填表日期:年月日
试验名称:
临床试验批件号/沟通函:
方案编号:
试验设计:□对照□非对照/□单盲□双盲□开放/□随机□非随机
□平行□交叉/□优效性□非劣性□等效性/□其它
中文药名:
英文药名:
商品名:
药物类别:□化药类□中药、天然药物类
□治疗用生物制品类□预防用生物制品类
□其他
本机构计划试验开始时间:年月日
本机构计划试验完成时间:年月日
是否涉及遗传资源的申报:□是□否
本机构申请专业:
专业组负责人签名:
主要研究者签名:
机构办受理人签名
机构办主任签名
注:请准确填写此申请表。
试验分期:□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□生物等效性
药物剂型:
药物规格:
药物适应症:
是否进口注册:□否□是,进口许可证批号:
是否国际多中心:□是□否
申办者:
CRO:
数据处理人员:□委托专业医学统计人员统计□由经过统计培训的研究者统计
数据统计单位:
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计完成例数:
药物临床试验申请表
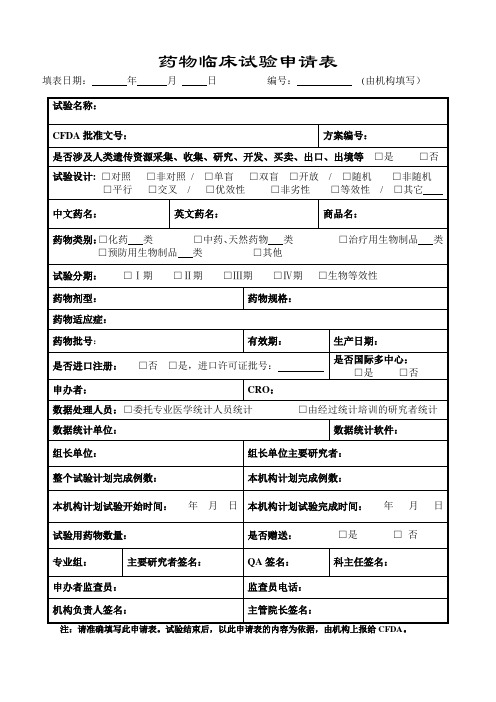
本机构计划完成例数:
本机构计划试验开始时间:年月日
本机构计划试验完成时间:年月日
试验用药物数量:
是否赠送:□是□否
专业组:
主要研究者签名:
QA签名:
科主任签名:
申办者监查员:
监查员电话:
机构负责人签名:
主管院长签名:
注:请准确填写此申请表。试验结束后,以此申请表的内容为依据,由机构上报给CFDA。
药物临床试验申请表
填表日期:年月日编号:(由机构填写)
试验名称:
CFDA批准文号:
方案编号:
是否涉及人类遗传资源采集、收集、研究、开发、买卖、出口、出境等□是□否
试验设计:□对照□非对照/□单盲□双盲□开放/□随机□非随机
□平行□交叉/□优效性□非劣性□等效性/□其它
中文药名:
英文药名:
商品名:
药物类别:□化药类□中药、天然药物类□治疗用生物制品类
□预防用生物制品类□其他
试验分期:□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□生物等效性
药物剂型:
药物规格:
药物适应症:
药物批号:
有效期:
生产日期:
是否进口注册:□否□是,进口许可证批号:
是否国际多中心:
□是□否
申办者:
CRO:
数据处理人员:□委托专业医学统计人员统计□由经过统计培训的研究者统计
数据统计单位:
数据统计软件:
药物临床试验申请表

5
申办者资质(药品生产许可证、GMP证书、营位伦理批件/其他伦理委员会对申请研究项目的重要决定的说明
7
研究者手册并加盖单位红章
8
临床试验方案(方案上应有本院课题负责人、申办方临床试验负责人签名)(注明版本号和版本日期)并加盖单位红章
9
知情同意书样本(注明版本号和版本日期)并加盖单位红章
10
病例报告表样表(注明版本号和版本日期)并加盖单位红章
11
研究病历(注明版本号和版本日期)并加盖单位红章
12
受试者日记卡并加盖单位红章
13
保险并加盖单位红章
14
申办方委托CRO的委托书,双方盖章
15
申办方或CRO委托我院开展研究的委托书并加盖申办方或CRo单位红章
16
主要研究者简历、GCP培训证书
1
监查员的委托书原件,监查员身份证、GCP培训证书、简历并加盖单位红章
2
项目经理的委托书原件,项目经理身份证,GCP培训证书并加盖单位红章。确保监查员的工作能够跟踪
3
国家药品监督管理局《药物临床试验批件》或与CDE沟通相关文件(上市药物应有药品注册证书),并加盖单位红章
4
试验药物的合格检验报告并加盖单位红章
17
药物临床试验研究团队成员表
18
研究者声明、签名表
19
受试者招募广告(如有)并加盖单位红章
20
提供材料的真实性说明并加盖单位红章
21
正式合同需法人签字,如非法人签字,需加盖公章的委托授权书
22
其他文件
主要研究者(签名)
机构收件时间
年月日
受理编号:
药物临床试验机构办秘书签名:
填表说明:
1完成此表格后请发送电子版资料到机构办
申办者资质(药品生产许可证、GMP证书、营位伦理批件/其他伦理委员会对申请研究项目的重要决定的说明
7
研究者手册并加盖单位红章
8
临床试验方案(方案上应有本院课题负责人、申办方临床试验负责人签名)(注明版本号和版本日期)并加盖单位红章
9
知情同意书样本(注明版本号和版本日期)并加盖单位红章
10
病例报告表样表(注明版本号和版本日期)并加盖单位红章
11
研究病历(注明版本号和版本日期)并加盖单位红章
12
受试者日记卡并加盖单位红章
13
保险并加盖单位红章
14
申办方委托CRO的委托书,双方盖章
15
申办方或CRO委托我院开展研究的委托书并加盖申办方或CRo单位红章
16
主要研究者简历、GCP培训证书
1
监查员的委托书原件,监查员身份证、GCP培训证书、简历并加盖单位红章
2
项目经理的委托书原件,项目经理身份证,GCP培训证书并加盖单位红章。确保监查员的工作能够跟踪
3
国家药品监督管理局《药物临床试验批件》或与CDE沟通相关文件(上市药物应有药品注册证书),并加盖单位红章
4
试验药物的合格检验报告并加盖单位红章
17
药物临床试验研究团队成员表
18
研究者声明、签名表
19
受试者招募广告(如有)并加盖单位红章
20
提供材料的真实性说明并加盖单位红章
21
正式合同需法人签字,如非法人签字,需加盖公章的委托授权书
22
其他文件
主要研究者(签名)
机构收件时间
年月日
受理编号:
药物临床试验机构办秘书签名:
填表说明:
1完成此表格后请发送电子版资料到机构办
药物临床试验申请表
□治疗用生物制品类
试验分期:□Ⅰ期 □Ⅱ期 □Ⅲ期 □Ⅳ期 □生物等效性 □其他,
药物剂型:
药物,进口许可证批号:
申办者:
CRO:
是否国际多中心: □是 □否
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计划完成例数:
本机构计划试验开始时间: 年 月 日 本机构计划试验完成时间: 年 月 日
监查员: 项目经理: 专业科室:
监查员电话: 项目经理电话: 主要研究者:
主要研究者签字: 日期: 年 月 日
专业科室负责人签字: 日期: 年
月日
机构受理人签字: 日期: 年 月 日
机构办公室主任签字: 日期: 年
月日
注:请准确填写此申请表。一式二份,一份伦理委员会存档,一份归入研究者档案。
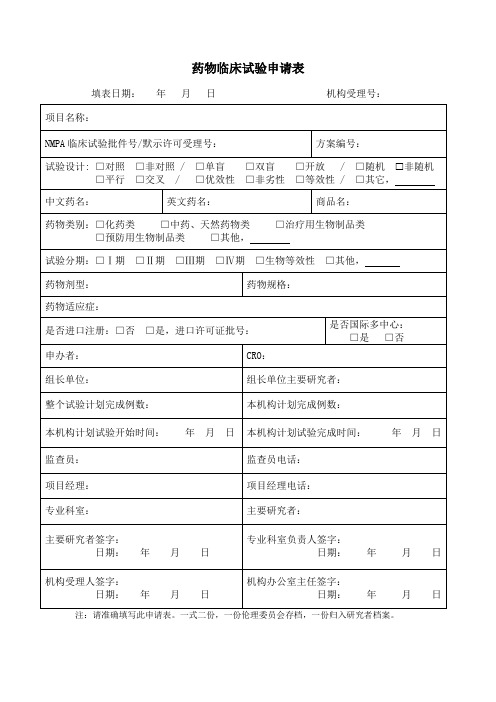
药物临床试验申请表
填表日期: 年 月 日 项目名称:
机构受理号:
NMPA 临床试验批件号/默示许可受理号:
方案编号:
试验设计: □对照 □非对照 / □单盲 □双盲 □开放 / □随机 非随机 □平行 □交叉 / □优效性 □非劣性 □等效性 / □其它,
中文药名:
英文药名:
商品名:
药物类别:□化药类 □中药、天然药物类 □预防用生物制品类 □其他,
药物临床试验审查备案申请表

6、招募受试者的相关材料(包括广告):
①依临床试验性质而定,试验需要则必备
②注明版本号或日期,如有英文版本需同时递送
7、研究者手册(注明版本号及日期,如有英文版本需同时递送)
8、研究原始记录(注明版本号及日期,如有英文版本需同时递送)
9、病例报告表(注明版本号及日期,如有英文版本需同时递送)
10、受试者信息卡(注明版本号及日期,如有英文版本需同时递送)
主要研究者签字:
日期:
机构办秘书签字:
日期:
注:上述资料中的某些文件不适用于本研究过程,可删除;以下各项顺序号依次提前。
18、中心伦理的批件复印件,或其他伦理委员会对申请研究项目重要决定的说明
19、试验用药品检验合格报告
20、产品说明书(阳性对照药和已上市产品需要)
21、保险合同
22、申办方相关资质证明:
①包括GMP证书及药品生产许可证等
②或/及申办方委托CRO的证明
23、研究项目经费来源说明
24、其他(如承诺书等)
药物临床试验审查(备案)申请表
项目名称
申请文件
1、CFDA药物临床试验申请受理通知书复印件;
2、关于“自受理缴费之日起60日内,未收到药审中心否定或质疑意见”的说明
3、临床试验方案摘要
4、试验方案(注明版木号及日期,申பைடு நூலகம்方及主要研究者签字或盖章,如有英文版本需同时递送)
5、知情同意书(注明版本号及日期,如有英文版本需同时递送)
11、受试者日记(注明版本号及日期,如有英文版本需同时递送)
12、临床试验小组成员名单(本院)
13、研究者履历(签名,签署日期)
14、研究者GCP证书复印件
15、主要研究者遵照GCP要求开展工作的声明(签名,签署日期)
①依临床试验性质而定,试验需要则必备
②注明版本号或日期,如有英文版本需同时递送
7、研究者手册(注明版本号及日期,如有英文版本需同时递送)
8、研究原始记录(注明版本号及日期,如有英文版本需同时递送)
9、病例报告表(注明版本号及日期,如有英文版本需同时递送)
10、受试者信息卡(注明版本号及日期,如有英文版本需同时递送)
主要研究者签字:
日期:
机构办秘书签字:
日期:
注:上述资料中的某些文件不适用于本研究过程,可删除;以下各项顺序号依次提前。
18、中心伦理的批件复印件,或其他伦理委员会对申请研究项目重要决定的说明
19、试验用药品检验合格报告
20、产品说明书(阳性对照药和已上市产品需要)
21、保险合同
22、申办方相关资质证明:
①包括GMP证书及药品生产许可证等
②或/及申办方委托CRO的证明
23、研究项目经费来源说明
24、其他(如承诺书等)
药物临床试验审查(备案)申请表
项目名称
申请文件
1、CFDA药物临床试验申请受理通知书复印件;
2、关于“自受理缴费之日起60日内,未收到药审中心否定或质疑意见”的说明
3、临床试验方案摘要
4、试验方案(注明版木号及日期,申பைடு நூலகம்方及主要研究者签字或盖章,如有英文版本需同时递送)
5、知情同意书(注明版本号及日期,如有英文版本需同时递送)
11、受试者日记(注明版本号及日期,如有英文版本需同时递送)
12、临床试验小组成员名单(本院)
13、研究者履历(签名,签署日期)
14、研究者GCP证书复印件
15、主要研究者遵照GCP要求开展工作的声明(签名,签署日期)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
□是 □否
5
研究者手册
□是 □否
6
试验方案
□是 □否
7
病例报告表样本(CRF)
□是 □否
8
知情同意书样本
□是 □否
9
受试者招募广告(若有)
□是 □否
10
研究者履历及GCP证书
□是 □否
11
试验用相关表格(如:筛选入选表、鉴认代码表、受试者日记卡等)
□是 □否
12
严重不良事件报告表样本
□是 □否
13
设盲试验的破盲规程(若设盲需提供)
□是 □否
14
保险条款或相关文件
□是 □否
15
中心伦理同意批件复印件(若有)
□是 □否
16
申办方资质(企业三证,生产许可证,GMP证书)
□是 □否
17
CRO资质(企业三证)、申办方与CRO的委托书(若有CRO,需提供)
□是 □否
18
申办方责任声明
□是 □否
19
多方协议(药物临床试验批件转让、委托生产协议、产品转让协议等)(若有)
在研项(招募中项)完成项
需提交的文件
1
CFDA临床试验批件(适用于注册性临床试验)
□是 □否
2
试验药物的药检报告(若为生物制品,则需提供中检所的检验报告)
□是 □否
3
进口药物注册证/药品注册证(对照药品、联合用药品、IV期药物临床试验试验药物等)
□是 □否
4
药品说明书(对照药品、联合用药品、IV期药物临床试验试验药物等)
□仿制药一致性评价研究 □生物等效性研究 □人体药代动力学研究
□其它
国际多中心
□是 □否
试验中心数
试验期限
方案设计总例数
本机构病例数
中心组长单位
□有□无
试验药物生产厂家
生物样本测定单位
申办方
项目负责人
联系电话
CRO
□有□无
监查员姓名
联系电话
PI(签名)
PI委托负责人(签名)
其他研究者(签名)
主要研究者正在开展的和已经完成的临床试验项目
□是 □否
20
临床研究原始记录(若有)
□是 □否
21
其他材料(若有):
□是 □否
PI(签名):日期:
.
邵逸夫医院药物临床试验申请表
申请科室:
试验项目名称
方案编号
临床试验批件号
□有□无
试验药物名称
适应症
给药途径
试验药物
注册分类
□中药、天然药物(类)□化学药物(类)□生物制品(类)
□放射性药物□进口பைடு நூலகம்物 □其它
试验药物剂型
试验药物规格
研究内容
(可多选)
□药学研究 □药理学研究 □安全性研究
□临床研究Ⅰ □临床研究Ⅱ □临床研究Ⅲ □临床研究Ⅳ
5
研究者手册
□是 □否
6
试验方案
□是 □否
7
病例报告表样本(CRF)
□是 □否
8
知情同意书样本
□是 □否
9
受试者招募广告(若有)
□是 □否
10
研究者履历及GCP证书
□是 □否
11
试验用相关表格(如:筛选入选表、鉴认代码表、受试者日记卡等)
□是 □否
12
严重不良事件报告表样本
□是 □否
13
设盲试验的破盲规程(若设盲需提供)
□是 □否
14
保险条款或相关文件
□是 □否
15
中心伦理同意批件复印件(若有)
□是 □否
16
申办方资质(企业三证,生产许可证,GMP证书)
□是 □否
17
CRO资质(企业三证)、申办方与CRO的委托书(若有CRO,需提供)
□是 □否
18
申办方责任声明
□是 □否
19
多方协议(药物临床试验批件转让、委托生产协议、产品转让协议等)(若有)
在研项(招募中项)完成项
需提交的文件
1
CFDA临床试验批件(适用于注册性临床试验)
□是 □否
2
试验药物的药检报告(若为生物制品,则需提供中检所的检验报告)
□是 □否
3
进口药物注册证/药品注册证(对照药品、联合用药品、IV期药物临床试验试验药物等)
□是 □否
4
药品说明书(对照药品、联合用药品、IV期药物临床试验试验药物等)
□仿制药一致性评价研究 □生物等效性研究 □人体药代动力学研究
□其它
国际多中心
□是 □否
试验中心数
试验期限
方案设计总例数
本机构病例数
中心组长单位
□有□无
试验药物生产厂家
生物样本测定单位
申办方
项目负责人
联系电话
CRO
□有□无
监查员姓名
联系电话
PI(签名)
PI委托负责人(签名)
其他研究者(签名)
主要研究者正在开展的和已经完成的临床试验项目
□是 □否
20
临床研究原始记录(若有)
□是 □否
21
其他材料(若有):
□是 □否
PI(签名):日期:
.
邵逸夫医院药物临床试验申请表
申请科室:
试验项目名称
方案编号
临床试验批件号
□有□无
试验药物名称
适应症
给药途径
试验药物
注册分类
□中药、天然药物(类)□化学药物(类)□生物制品(类)
□放射性药物□进口பைடு நூலகம்物 □其它
试验药物剂型
试验药物规格
研究内容
(可多选)
□药学研究 □药理学研究 □安全性研究
□临床研究Ⅰ □临床研究Ⅱ □临床研究Ⅲ □临床研究Ⅳ
