如何判断分子的杂化类型
如何判断分子的杂化类型

如何判断分子的杂化类型1.杂化杂化轨道杂化是指在形成分子时,由于原子的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道。
这种轨道重新组合的过程叫杂化,所形成的新轨道就称为杂化轨道。
2.杂化的过程杂化轨道理论认为在形成分子时,通常存在激发、杂化和轨道重叠等过程。
如ch4分子的形成过程:碳原子2s轨道中1个电子吸收能量跃迁到2p空轨道上,这个过程称为激发,但此时各个轨道的能量并不完全相同,于是1个2s轨道和3个2p轨道“混合”起来,形成能量相等、成分相同的4个sp3杂化轨道。
然后4个sp3杂化轨道上的电子间相互排斥,使四个杂化轨道指向空间距离最远的正四面体的四个顶点,碳原子的4个sp3杂化轨道分别与4个h原子的1s 轨道形成4个相同的σ键,从而形成ch4分子。
由于四个c-h键完全相同,所以形成的ch4分子为正四面体,键角109º28'。
3.杂化轨道的类型⑴sp杂化sp杂化轨道是由一个ns轨道和一个np轨道组合而成的。
sp杂化轨道间的夹角使180º,呈直线形。
例如,气态的becl2分子的结构。
be原子的电子层结构是1s22s2,从表面上看be原子似乎不能形成共价键,但是激发状态下,be的一个2s电子可以进入2p轨道,经过杂化形成两个sp杂化轨道,与氯原子的3p轨道重叠形成两个sp-pσ键。
由于杂化轨道间的夹角为180º,所以形成的becl2分子的空间构型是直线形的。
⑵sp2杂化sp2杂化是由一个ns轨道和两个np轨道组合而成的。
sp2杂化轨道间的夹角使120º,呈平面三角形。
例如bf3分子的结构。
b原子的电子层结构是1s22s22px1,当硼原子与氟原子反应时,硼原子的一个2s电子激发到一个空的2p轨道中,使b原子的电子层结构是1s22s22px12py1。
硼原子的2s轨道和两个2p轨道杂化组合成三个sp2杂化轨道,硼原子的三个sp2杂化轨道分别与三个氟原子的各一个2p轨道重叠形成三个sp2-p的σ键,由于三个sp2杂化轨道在同一个平面而且杂化轨道间的夹角为120º,所以bf3分子具有平面三角形结构。
化学分子杂化的判断方法

化学分子杂化的判断方法化学分子杂化是指原子轨道相互作用产生一个新的杂化轨道的过程。
通过分子杂化,分子的化学性质可以发生显著改变,从而影响其物理性质和反应性质。
判断化学分子的杂化方法有很多种,下面将介绍其中几种常见的方法。
1. 原子轨道形状和排布:判断分子是否发生杂化可以通过观察原子轨道形状和排布来确定。
一般来说,如果分子中的原子存在杂化,则它们的轨道形状和排布会发生变化。
常见的杂化形式有sp、sp2、sp3和dsp3等。
2. 分子几何构型:分子杂化还可以通过观察分子的几何构型来判断。
杂化的原子轨道将以最佳方式组合,使得分子达到最稳定的几何构型。
因此,通过观察分子的几何形状,可以推断出分子中原子的杂化形式。
3. 分子的键合:化学键的形成与分子的杂化密切相关。
通过观察分子中的化学键,特别是双键和三键,可以推断出原子之间是否发生了杂化。
双键通常表明存在sp2杂化,而三键通常表明存在sp杂化。
4. 分子的反应性质:分子的反应性质也可以提供一些关于杂化的线索。
不同杂化形式的原子在化学反应中表现出不同的反应行为。
通过分析分子的反应性质,可以推断出分子中原子的杂化状态。
5. 分子的光谱性质:分子杂化还可以通过分析分子的光谱性质来判断。
分子吸收和发射的光谱特征可以提供关于分子杂化的信息。
通过测量分子的UV/Vis、紫外可见光谱或者荧光光谱等,可以确定分子中原子的杂化状态。
综上所述,化学分子的杂化状态可以通过多种方法进行判断。
观察原子轨道形状和排布、分子的几何构型、分子的键合、分子的反应性质以及分子的光谱性质等都可以提供关于分子杂化的线索。
通过这些方法的综合运用,可以有效地确定化学分子的杂化状态,从而深入了解分子的化学性质和反应行为。
杂化类型的简单判断

中心原子的族序号加上周围原子的族序号(氧族算0,卤族算1)除以2,等于4为sp3,等于3为sp2,等于2为sp,除不尽就进一算
氧族卤族做中心原子的时候用原本的序号
中心原子的族序数加上周围原子族序数的和(氧族卤族做中心原子时用原本的序号,做配位原子时氧族算0,卤族算1)除以2,结果为2,3,4,时分别为sp,sp2,sp3杂化
(1)线性分子,中心原子为sp杂化,如乙炔
(2)平面内的分子形如乙烯的,中心原子为sp2杂化
(3)空间(正)四面体,中心原子sp3杂化,如四氯化碳
(4)空间六面体/三角双锥(形如两个空间正四面体底对底拼在一起),中心原子为sp3d杂化
(5)空间八面体(形如两个金字塔底对底拼在一起),中心原子为sp3d2杂化
还有一些,比如“平面正方形”“四角锥”等,为杂化的内轨外轨之分。
有一点还要切记!就是如果中心原子杂化轨道中有孤对电子存在的话,分子构型显然体现不出来,但是考虑中心原子杂化类型时孤对电子是要考虑进去的,不然肯定犯错。
sp3d杂化:sp3d杂化轨道是由1个ns、3个np和1个nd组合而成的,它的特点是5个杂化轨道在空间呈三角双锥形,杂化轨道间夹角为90°,120°或180°。
sp3d2杂化:sp3d2杂化轨道是由1个ns和3个np及2个nd轨道组合而成,共有6条杂化轨道.六个sp3d2轨道指向正八面体的六个顶点,杂化轨道间的夹角为90°或180°,空间构型为正八面体.
1,分子结构模型
用塑料小球代替分子中的原子,塑料棒代替化学键,搭成无机分子模型.用杂化理论和价层电子对互斥理论简单说明理由.。
如何判断分子的杂化类型

如何判断分子的杂化类型直线型sp杂化A-B-A 如CO2sp CO CO2, CS2,N2O, C2H2BeCl2,BeH2,Ag(NH3)2+, Cu(NH3)2+ Cu (CN)2-sp2 BF3, NO3- BBr3SO3,SO2, NO2O3,平面三角型SP2杂化如BCl3V型Sp3不等性杂化如H2O三角锥型SP3不等性杂化如NH3正四面体型SP3杂化如CH4sp3 CH4, CCl4, NH4+, SO42-, SiX4SiH4NH3 , PH3NF3,PX3,ClO3- ,H 2O ,H2S ,OF2, Cl2OZnCl42- FeCl4- Zn(CN)42-sp3d PF5 , PCl5,SF4, TeCl4, ICl4+ClF3, BrF3XeF2, ICl2-, I3-三角双锥型SP3d杂化如PCl5正八面体型SP3d2杂化如常见的六氟化物8.杂化与分子构型的关系:杂化类型sp sp2sp3d2sp3或sp3d2等性等性不等性等性不等性不等性等性不等性分子形状直线形Δ形V形正四面体三角锥角形参加杂化的轨道数目 2 3 3 4 4 4 6 6杂化轨道中孤电子对数目0 0 1 0 1 2杂化轨道的几何图形直线形正Δ形Δ正四面体四面体四面体八面体键角180°120°109°28,180°90°例C2H2C2H4 SO2CH4NH3H2O [Cu(H2O)6]2+判断物质的杂化类型,空间结构首先可以根据经验判断,先记住几种杂化的典型物质,再将给出的物质与她们相互比较一下,一般同族的而且化学式类似,杂化类型相同。
eg:判断下列分子的杂化类型并判断分子的空间构型及就是否具有极性 H2S,PH3,NF3,CCl4,解:(1)H2S,中心原子就是S,我们学过H2O就是SP3不等性杂化,V字型,具有极性,O与S就是同族元素,而且H 2S与H2O分子式非常类似,所以H2S也就是SP3不等性杂化,V字型,具有极性。
2-2.4杂化类型及分子构型的判断
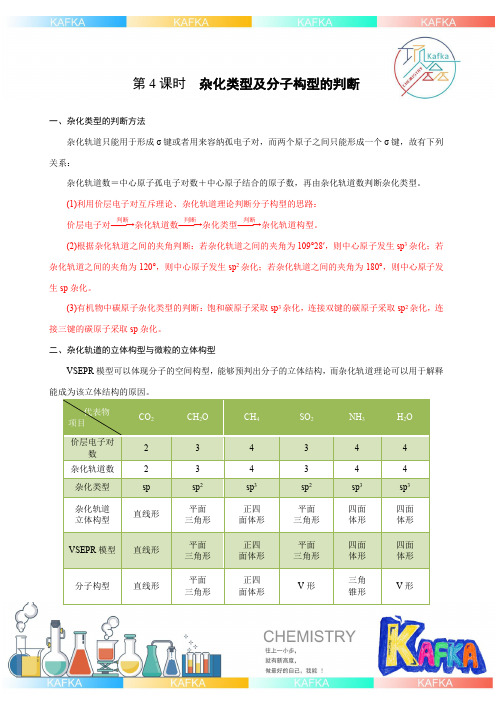
第4课时 杂化类型及分子构型的判断一、杂化类型的判断方法杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:杂化轨道数=中心原子孤电子对数+中心原子结合的原子数,再由杂化轨道数判断杂化类型。
(1)利用价层电子对互斥理论、杂化轨道理论判断分子构型的思路: 价层电子对――→判断杂化轨道数――→判断杂化类型――→判断杂化轨道构型。
(2)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28′,则中心原子发生sp 3杂化;若杂化轨道之间的夹角为120°,则中心原子发生sp 2杂化;若杂化轨道之间的夹角为180°,则中心原子发生sp 杂化。
(3)有机物中碳原子杂化类型的判断:饱和碳原子采取sp 3杂化,连接双键的碳原子采取sp 2杂化,连接三键的碳原子采取sp 杂化。
二、杂化轨道的立体构型与微粒的立体构型VSEPR 模型可以体现分子的空间构型,能够预判出分子的立体结构,而杂化轨道理论可以用于解释能成为该立体结构的原因。
代表物 项目 CO 2 CH 2O CH 4 SO 2 NH 3 H 2O 价层电子对数 2 3 4 3 4 4 杂化轨道数 2 3 4 3 4 4 杂化类型 sp sp 2 sp 3 sp 2 sp 3 sp 3 杂化轨道 立体构型 直线形平面 三角形 正四 面体形 平面 三角形 四面 体形 四面 体形 VSEPR 模型直线形平面 三角形 正四 面体形 平面 三角形 四面 体形 四面 体形 分子构型 直线形平面 三角形正四 面体形V 形三角 锥形V 形三、杂化轨道类型与分子的立体构型关系价层电子数VSEPR(理想模型)杂化类型理想键角分子立体构型2直线型sp180°直线型3平面(正)三角形sp2120°视有无孤电子对4(正)四面体型sp3109°28′视有无孤电子对注意:1.孤电子对的排斥能力比σ电子对排斥能力强,因此含有孤电子对的键角小于理想键角。
如何判断分子的杂化类型

如何判断分子的杂化类型分子的杂化类型可以通过以下几种方法来判断:1. VSEPR理论:VSEPR(或称空间位阻理论)依据分子的中心原子周围电子对的排列来预测分子的几何形状。
通过观察分子的几何形状,可以推断出中心原子的杂化类型。
例如,一氧化碳(CO)分子的几何形状为线性,因此可以推断出其C原子的杂化类型为sp。
2. 轨道重叠理论:根据分子中C-C、C-H或其他键的键长、键能和分子的稳定性,可以推断出中心原子的杂化类型。
理论认为,sp杂化的碳原子上有一个σ键,sp2杂化的碳原子上有一个σ键和两个π键,sp3杂化的碳原子上有四个σ键。
通过测量这些物理性质,可以得出杂化类型的信息。
3. 光谱:通过分子的红外光谱、拉曼光谱或核磁共振光谱等分析技术,可以获得关于分子结构的信息。
例如,分子中共振频率为2600-3300 cm-1的吸收峰表明分子中存在sp3杂化的C-H键。
4. 总键级:总键级指的是分子中的所有键的强度和个数的总和。
通过实验测定总键级,可以推测出中心原子的杂化类型。
对于一个碳原子而言,sp杂化将具有一个总键级为2的σ键和与其相连的其他原子的σ*键,总键级为2;sp2杂化将具有总键级为3的σ键和与其相连的其他原子的σ*键,总键级为3;sp3杂化将具有总键级为4的σ键和与其相连的其他原子的σ*键,总键级为4需要注意的是,以上方法并不是单一可靠的判断分子杂化类型的方法。
实际上,在一些分子中,中心原子可能具有多个杂化类型,特别是当杂化轨道重叠的程度不同或分子电子密度不均匀的情况下。
因此,存粹通过杂化类型来判断分子的结构是不准确的,必须结合其他实验数据和理论方法来综合分析。
分子或离子空间构型的判断方法

分子或离子空间构型的判断方法在高考试题中,分子或离子空间构型的判断是一种常考的问题,要求“能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或离子的空间结构”。
现将几种判断粒子空间构型的简单方法总结如下。
一、根据杂化理论判断。
即中心原子的杂化方式的判断方法。
杂化轨道数=中心原子所结合的原子数+(中心原子的价电子数﹣周边原子未成对电子总数)/2(ABm型)说明:若是离子,中心原子的价电子数还应加上负离子的电荷数或减去正离子的电荷数。
判断思路:先判断中心原子杂化方式,然后根据中心原子所结合的原子数和孤电子对数再判断分子的空间构型。
例1.推测常见分子的杂化方式与空间构型:CO2、BF3、CH4、NH3、H2O。
O2:2+(4-4)/2=2BF3:3+(3-3)/2=3CH4:4+(4-4)/2=4NH3:3+(5-3)/2=4H2O:2+(6-2)/2=4中心原子是分别采用sp、sp2、sp3、sp3、sp3杂化,杂化轨道形状分别为直线形(夹角为180º)、平面正三角形(夹角为120º)、正四面体形(夹角为109º28′)、正四面体形、正四面体形。
由于CO2、BF3、CH4中没有孤对电子,分子的空间构型与杂化轨道的空间形状一致。
由于NH3、H2O分别有1对、2对孤对电子,分子的空间构型与杂化轨道的空间形状不一致,所以NH3呈三角锥形,受1对孤对电子的排斥,键角变小,键角是107º18′;H2O呈V形,受2对孤对电子的排斥,排斥作用比NH3更强,键角变得更小些,键角是104.5º。
例2.推测下列微粒的杂化方式与空间构型:SO3、SO2、CO32-、O4。
SO3:3+(6-6)/2=3SO2:2+(6-4)/2=3CO32-:3+(6-6)/2=3O4:3+(6-6)/2=3(O4以其中1个O原子作为中心原子,其余3个O原子作为配位原子)。
杂化轨道数全是3,中心原子均是采用sp2杂化;由于SO3、O4、CO32-均没有孤对电子,均呈平面正三角形,键角等于120º。
文档:资料:单元课6-正确判断分子构型和杂化类型(教师版)
正确判断分子构型和杂化类型教学目标:★★★★☆☆学生能够正确判断分子构型和杂化类型.问题层级图目标层级图正确理解共价键一、 正确得出价层电子对的数目(★★★★☆☆)1. 价层电子对互斥理论(1)价层电子对互斥理论认为,分子的立体构型是“________”相互排斥的结果。
价层电子对是指分子中的________上的电子对,包括________和________。
(2)σ键电子对数可由________确定。
而中心原子上的孤电子对数,确定方法如下: 中心原子上的孤电子对数=________;a 为________;x 为________;b 为与中心原子结合的原子________。
答案:(1)价层电子对 中心原子 σ键电子对 中心原子上的孤电子对(2)分子式 12(a -xb ) 中心原子的价电子数 与中心原子结合的原子数 最多能接受的电子数【过关检测】(5min)1. 判断正误,正确的划“√”,错误的划“×”① H 2O 的中心原子为O ,形成两个H —Oσ键,即O 有两对σ键电子对。
( )② 中心原子上的孤电子对数=12(a -xb ) 对于阳离子,a =价电子数-离子电荷数;对于阴离子,a =价电子数+|离子电荷数|。
( )③ SO 2中O 原子上的孤电子对数为1。
( ) ④ NH 4+中N 原子上的孤电子对数为0。
( )答案:√;√;×;√;2. 如何确定CO 2-3和NH +4的中心原子的孤电子对数?。
答案:NH +4中中心原子为N ,a =5-1,b =1,x =4,所以中心原子孤电子对数=12(a -xb )=12(4-4×1)=0。
CO 2-3中中心原子为C ,a =4+2,b =2,x =3,所以中心原子孤电子对数=12(a -xb )=12(6-3×2)=0。
二、正确判断VSEPR 构型和分子构型(★★★★☆☆)1. 根据分子中成σ键电子对数和孤电子对数,可以依据下面的方法确定相应的较稳定分子空间构型:σ键电子对数+孤电子对数=价层电子对数――→价层电子对互斥理论VSEPR 模型――→略去孤电子对分子立体构型。
杂化类型的判断方法

杂化类型的判断方法
1)例如常见的简单分子,C2H2、CO2为直线型分子,键角为180°,推断其C原子的杂化轨道类型为sp;C2H4、C6H6为平面型分子,键角为120°,推断其C原子的杂化轨道类型为sp2;CH4、CCl4为正四面体,键角109.5°,推断其C原子的杂化轨道类型为sp3.扩展到以共价键形成的晶体,如:已知金刚石中的碳原子、晶体硅和石英中的硅原子,都是以正四面体结构形成共价键的,所以也都是采用sp3杂化;已知石墨的二维结构平面内,每个碳原子与其它三个碳原子结合,形成六元环层,键角为120°,由此判断石墨的碳原子采用sp2杂化.
2)根据价层电子对互斥理论判断杂化类型:
AB m型杂化类型的判断:
中心原子电子对计算公式:价电子对数n(中心原子的价电子数+配位原子的价电子数×m±电荷数)
注意:①当上述公式中电荷数为正值时取“﹣”,电荷数为负值时取“+”.
②当配位原子为氧原子或硫原子时,成键电子数为零.
根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化.
3)对于有机物利用杂化轨道数=孤对电子对数+σ键数进行判断.如:C2H2分子中碳原子形成1个C﹣H,1个C≡C(含1个σ键),C原子杂化轨道数为1+1=2,采取sp杂化方式,C2H4分子中碳原子形成2个C﹣H,1个C═C双键(含1个σ键),C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式.
第1页共1页。
杂化判断

如何判断分子的空间构型和原子的杂化如何判断分子的空间构型和一个分子的中心原子究竟采取哪种类型的杂化是高考的一个重点也是一个难点。
可以用“价层电子对互斥理论(VSEPR)”判断分子的空间构型,也可以借助“杂化轨道理论”来判断分子的空间构型。
这里来介绍“价层电子对互斥理论”的应用及判断一个分子的中心原子杂化类型的方法。
“价层电子对互斥理论(VSEPR)”认为:ABx型分子的空间构型总是采取中心原子A 价层电子对相互排斥最小的那种几何构型。
第一步:确定中心原子A的价层电子对数目。
中心原子A的价层电子对是指分子中的中心原子上的电子对,包括δ键电子对(也称成键电子对)和中心原子上的孤电子对。
δ键电子对数有分子式确定:对ABx型分子,x就是中心原子A的δ键电子对数目。
如BCl3分子中,中心原子B的δ键电子对数= 3;H2O中O的δ键电子对数= 4 SO3中S的δ键电子对数=3而中心原子的孤电子对数=(a-xb)/2式中的a为中心原子的价电子数,对主族元素来说,价电子数等于原子的最外层电子数;x为与中心原子结合的原子数(即ABx分子中的x);b为与中心原子结合的原子最多结合的电子数,H为1,其它原子等于“8-该原子的价电子数”如果讨论的是离子,对阳离子a为中心原子的价电子数减去离子的电荷数,对阴离子a为中心原子的价电子数加上离子的电荷数;例如CCl4中δ键电子对数为4,孤电子对数=(4-4 ×1)/2=0C的价层电子对数= 4 + 0 = 4SO3中δ键电子对数为3;孤电子对数=(6-3×2)/2=0S的价层电子对数=3 + 0 = 3H2O中δ键电子对数为2;孤电子对数=(6-2×1)/2=2O的价层电子对数= 2 +2 = 4NH4+中δ键电子对数为4;孤电子对数=(5-1-4×1)/2=0N的价层电子对数= 4 + 0 = 4SO42—中δ键电子对数为4;孤电子对数=(6+2-4×2)/2=0S的价层电子对数= 4 + 0 = 4PO43—中δ键电子对数为4;孤电子对数=(5+3-4×2)/2=0P的价层电子对数=4 + 0 = 4如果价层电子对数出现小数,可把这个单电子当作电子对看待四,如果对分子空间构型比较清楚的话,也可以根据分子的空间构型判断中心原子的杂化,直线型的中心原子发生SP杂化,如CO2、乙炔中的碳原子发生SP杂化;平面三角形结构的中心原子发生SP2杂化,如烯烃中形成的C=C、苯环、醛基、羧基、羰基、石墨、石墨烯中的C原子发生SP2杂化;呈正四面体结构,以SP3杂化方式。
杂化类型的简单判断

中心原子的族序号加上周围原子的族序号(氧族算0,卤族算1)除以2,等于4为sp3,等于3为sp2,等于2为sp,除不尽就进一算
氧族卤族做中心原子的时候用原本的序号
中心原子的族序数加上周围原子族序数的和(氧族卤族做中心原子时用原本的序号,做配位原子时氧族算0,卤族算1)除以2,结果为2,3,4,时分别为sp,sp2,sp3杂化
(1)线性分子,中心原子为sp杂化,如乙炔
(2)平面内的分子形如乙烯的,中心原子为sp2杂化
(3)空间(正)四面体,中心原子sp3杂化,如四氯化碳
(4)空间六面体/三角双锥(形如两个空间正四面体底对底拼在一起),中心原子为sp3d杂化
(5)空间八面体(形如两个金字塔底对底拼在一起),中心原子为sp3d2杂化
还有一些,比如“平面正方形”“四角锥”等,为杂化的内轨外轨之分。
]
有一点还要切记!就是如果中心原子杂化轨道中有孤对电子存在的话,分子构型显然体现不出来,但是考虑中心原子杂化类型时孤对电子是要考虑进去的,不然肯定犯错。
sp3d杂化:sp3d杂化轨道是由1个ns、3个np和1个nd组合而成的,它的特点是5个杂化轨道在空间呈三角双锥形,杂化轨道间夹角为90°,120°或180°。
sp3d2杂化:sp3d2杂化轨道是由1个ns和3个np及2个nd轨道组合而成,共有6条杂化轨道.六个sp3d2轨道指向正八面体的六个顶点,杂化轨道间的夹角为90°或180°,空间构型为正八面体.
1,分子结构模型
用塑料小球代替分子中的原子,塑料棒代替化学键,搭成无机分子模型.用杂化理论和价层电子对互斥理论简单说明理由.
)。
分子的立体构型及杂化方式的判断方法

分子的立体构型及杂化方式的判断方法1.VSEPR理论:VSEPR理论是根据分子中的电子对的排斥效应来预测分子的立体构型。
根据这一理论,分子中的电子对(包括原子间键合电子对和孤对电子对)会尽量远离彼此,从而使得分子呈现出一定的几何形状。
通过确定分子中原子的中心原子、其他原子和孤对电子对的数量,可以用VSEPR理论预测分子的构型。
2.分子对称性:分子的对称性可以提供有关分子构型的重要信息。
通过观察分子的对称轴、平面反转中心、镜面反射面等,可以推断分子的几何结构。
例如,如果一个分子具有旋转轴,那么该分子很可能是线性的;若分子具有反射面,则可能是平面的。
3. 分子轨道理论:分子轨道理论描述了分子中电子的分布情况,指出原子轨道会经过一个或多个杂化过程而形成分子轨道。
通过观察分子中的化学键及相关杂化轨道的形状,可以推断出分子的杂化方式。
例如,如果分子中存在 sigma 键,则可判断该分子中原子的杂化方式为 sp 杂化;如果分子中存在 pi 键,则可判断杂化方式为 sp2 或 sp3 杂化。
4.光谱学方法:光谱学方法可以通过分析分子在不同波长下吸收和发射的电磁辐射来研究分子的构型和杂化。
例如,红外光谱可以提供分子中不同键弯曲、拉伸等振动模式的信息,从而帮助确定分子的立体构型;核磁共振光谱可以提供分子中不同核磁共振信号的信息,从而揭示出分子中不同原子的环境和构型。
5.计算化学方法:计算化学方法可以通过理论计算来预测分子的构型和杂化。
例如,量子力学方法(如密度泛函理论)可以计算分子的电子结构和能量,从而推测分子的构型和杂化方式。
总之,分子的立体构型和杂化方式可以通过VSEPR理论、分子对称性、分子轨道理论、光谱学方法和计算化学方法等多种途径来判断。
这些方法的使用取决于具体分子的性质和研究目的。
等电子体与杂化类型的判断方法归纳

等电子体杂化类型判断方法了解“等电子原理”的含义,能结合实例说明“等电子原理”的应用;能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型(对d轨道参与杂化和AB5型以上复杂分子或离子的空间构型不作要求)。
围绕这两个考点设计的问题应该是很容易作答的,但学生实际作答时错误率极高,经分析发现关键在于等电子体确定、中心原子的杂化类型判断上缺乏方法,就此两个问题的分析方法作如下归纳。
一、等电子体的判断具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为等电子原理。
如果仅从概念字面出发,判断与A粒子互为等电子体的B粒子的化学式,往往感觉无从下手,或东拼西凑的试写,试写也往往只注意“价电子数”或“原子数”相同某一方面而错答。
如写CH4分子的等电子体时许多学生写成NH3(原子数不同)、CCl4(价电子数不同)等,至于再稍复杂一些的,错的更多,实际体现为问题解决方法的欠缺。
等电子体的判断一般可采取以下几种方法:1、同族元素互换法即将既定粒子中的某元素换成它的同族元素。
如:(1)CCl4的等电子体确定:换IVA族元素有SiCl4 、GeCl4 等;换VIIA族元素有CF4 、CBr4 、CI4、CFCl3、……;同时换可有SiF4、SiFCl3、……。
(2)CO2的等电子体确定:可将O原子换为S原子得COS、CS2,注意不能将C原子换为Si原子,因为CO2和SiO2的结构不同(前者为分子晶体,后者为原子晶体)。
同理,不能将BeCl2的等电子体确定为MgCl2或BeF2(后两种为离子晶体)。
(3)SO42-的等电子体确定:将一个O原子换为S原子得S2O32-;NO3-的等电子体可确定为PO3-。
(4)对于原子晶体类也可作类似推导:金刚石Cn与晶体硅Sin互为等电子体。
2、价电子迁移法即将既定粒子中的某元素原子的价电子逐一转移给组成中的另一种元素的原子,相应原子的质子数也随之减少或增加,变换为具有相应质子数的元素。
2020届高三化学选修三物质结构和性质常考题型——立体结构和杂化类型判断

2020届高三化学选修三物质结构与性质常考题型——立体结构和杂化类型判断.DOC【方法和规律】1、立体构型的判断方法——价层电子对互斥理论(1) 中心原子价层电子对数===σ键电子对数+孤电子对数中心原子的价电子数配位原子的化合价的总和(2)中心原子的价层电子对数2中心原子的最外层电子数配位原子的化合价的总和中心原子的价层电子对数2【微点拨】① 配位原子是指中心原子以外的其它原子(即与中心原子结合的原子)② 若是离子,则应加上或减去与离子所带的电荷数(阴加阳减)③氧、硫原子若为配位原子,则其化合价规定为" 零”,若为中心原子,则价电子数为6 (3)价层电子对互斥理论判断分子空间构型的具体方法PO43—H3O+2、中心原子的杂化类型判断规律:杂化轨道数==价层电子对数==σ键电子对数+孤电子对数价层电子对数杂化方式4sp3杂化3sp2杂化2sp 杂化用中心原子的价层电子对数中心原子的价电子数配位原子的化合价的总和,2来迅速判断(见上表)技巧2:若有多个中心原子时,则根据:“ 杂化轨道数==价层电子对数==σ键电子对数+孤电子对数”来判断如:三聚氰胺分子的结构简式如图所示,分析氮原子、碳原子的杂化类型杂化类型价层电子对数σ键电子对数孤电子对数孤电子对数确定方法环外氮原子sp3431氮原子最外层有5 个电子,形成了3环上氮原子sp2321对共用电子对,则有一对孤对电子环上碳原子sp2330碳原子最外层4 个电子,形成了4 对共用电子对,所以碳上无孤对电子技巧3:根据杂化轨道的空间分布构型判断①若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子发生sp3杂化②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp 杂化技巧4:根据杂化轨道之间的夹角判断①若杂化轨道之间的夹角为109°28,′则分子的中心原子发生sp3杂化②若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化③若杂化轨道之间的夹角为180°,则分子的中心原子发生sp 杂化技巧5:根据等电子原理进行判断CO 2是直线形分子,CNS -、N3-与CO 2是等电子体,所以分子构型均为直线形,中心原子均采用sp 杂化技巧6:根据分子或离子中有无π键及π键数目判断没有π键为sp3杂化,含一个π键为sp2杂化,含两个π键为sp 杂化【真题感悟】1、[2019·全国卷Ⅰ ·节选]乙二胺(H 2NCH 2CH 2NH 2)是一种有机化合物,分子中氮、碳的杂化类型分别是 _______________2、[2019 ·全国卷Ⅱ ·节选]元素As与N 同族。
如何判断分子的杂化类型

如何判断分子的杂化类型分子的杂化类型决定了分子中原子之间的化学键类型和分子的形状。
要判断分子的杂化类型,首先需要了解杂化的概念和原理。
杂化是指当一个原子参与到化学键的形成时,其原子轨道混合形成一些新的杂化轨道,以适应分子的形状和键的要求。
下面将介绍几种常见的杂化类型及其判断方法。
1. sp杂化sp杂化是指一个原子的一个s轨道和两个p轨道进行混合形成三个等价的sp杂化轨道。
这种杂化形式常见于直线形分子。
判断方法:若分子中一个原子形成两个单键和一个孤对电子,则该原子为sp杂化。
2. sp²杂化sp²杂化是指一个原子的一个s轨道和两个p轨道进行混合形成三个等价的sp²杂化轨道。
这种杂化形式常见于三角形平面分子。
判断方法:若分子中一个原子形成一个碳碳双键和两个单键,则该原子为sp²杂化。
3. sp³杂化sp³杂化是指一个原子的一个s轨道和三个p轨道进行混合形成四个等价的sp³杂化轨道。
这种杂化形式常见于四面体形状分子。
判断方法:若分子中一个原子形成一个碳碳三键和三个单键,则该原子为sp³杂化。
4. dsp²杂化dsp²杂化是指一个原子的两个d轨道、一个s轨道和两个p轨道进行混合形成五个等价的dsp²杂化轨道。
这种杂化形式常见于五角形平面分子。
判断方法:若分子中一个原子形成一个金属与五个配体的配位键,则该原子为dsp²杂化。
以上是一些常见的杂化类型及判断方法。
在实际判断分子的杂化类型时,需要观察分子中各原子的成键情况和分子的形状,并结合分子的化学键和分子轨道理论进行分析判断。
需要注意的是,这里只是对常见情况的介绍,实际上有时一个原子的杂化类型可能是一种混合形式。
最后,判断分子的杂化类型是理解和解释分子的结构和性质的基础之一,它对于有机化学、配位化学、化学键以及轨道理论等方面都有着重要的作用。
如何判断分子的杂化类型

如何判断分子的杂化类型直线型 sp杂化 A-B-A 如CO2sp CO CO2, CS2,N2O, C2H2BeCl2,BeH2,Ag(NH3)2+, Cu(NH3)2+ Cu (CN)2-sp2 BF3, NO3- BBr3SO3,SO2, NO2O3,平面三角型 SP2杂化如 BCl3V型 Sp3不等性杂化如H2O三角锥型 SP3不等性杂化如NH3正四面体型 SP3杂化如 CH4sp3 CH4, CCl4, NH4+, SO42-, SiX4SiH4NH3 , PH3NF3,PX3,ClO3- ,H 2O ,H2S ,OF2, Cl2OZnCl42- FeCl4- Zn(CN)42-sp3d PF5 , PCl5,SF4, TeCl4, ICl4+ClF3, BrF3XeF2, ICl2-, I3-三角双锥型 SP3d杂化如PCl5正八面体型 SP3d2杂化如常见的六氟化物8.杂化与分子构型的关系:杂化类型 sp sp2 sp3 d2sp3或sp3d2等性等性不等性等性不等性不等性等性不等性分子形状直线形Δ形 V形正四面体三角锥角形参加杂化的轨道数目 2 3 3 4 4 4 6 6杂化轨道中孤电子对数目 0 0 1 0 1 2杂化轨道的几何图形直线形正Δ形Δ正四面体四面体四面体八面体键角 180° 120° 109°28, 180°90°例 C2H2C2H4SO2CH4NH3H2O [Cu(H2O)6]2+判断物质的杂化类型,空间结构首先可以根据经验判断,先记住几种杂化的典型物质,再将给出的物质和他们相互比较一下,一般同族的而且化学式类似,杂化类型相同。
eg:判断下列分子的杂化类型并判断分子的空间构型及是否具有极性 H2S,PH3,NF3,CCl4,解:(1)H2S,中心原子是S,我们学过H2O是SP3不等性杂化,V字型,具有极性,O和S是同族元素,而且H2S和H2O分子式非常类似,所以H2S也是SP3不等性杂化,V字型,具有极性。
如何判断分子的杂化类型

如何判断分子的杂化类型直线型sp杂化A-B-A 如CO2sp CO CO2, CS2,N2O, C2H2 BeCl2 ,B e H2,Ag(NH3)2+, Cu(NH3)2+Cu (CN)2-sp2 BF3, NO3- BBr3SO3,SO2, NO2 O3,平面三角型SP2杂化如BCl3V型Sp3不等性杂化如H2O三角锥型SP3不等性杂化如NH3正四面体型SP3杂化如CH4sp3 CH4, CCl4, NH4+, SO42-, SiX4 SiH4NH3 , PH3 NF3 ,PX3 ,ClO3- ,H2O ,H2S ,OF2 , Cl2OZnCl42- FeCl4- Zn(CN)42-sp3d PF5 , PCl5,SF4, TeCl4, ICl4+ClF3, BrF3XeF2, ICl2-, I3-三角双锥型SP3d杂化如PCl5正八面体型SP3d2杂化如常见的六氟化物精选word8.杂化与分子构型的关系:杂化类型sp sp2sp3d2sp3或sp3d2等性等性不等性等性不等性不等性等性不等性分子形状直线形Δ形V形正四面体三角锥角形参加杂化的轨道数目 2 3 3 4 4 4 6 6杂化轨道中孤电子对数目0 0 1 0 1 2杂化轨道的几何图形直线形正Δ形Δ正四面体四面体四面体八面体键角180°120°109°28,180°90°例C2H2C2H4 SO2CH4NH3H2O [Cu(H2O)6]2+判断物质的杂化类型,空间结构首先可以根据经验判断,先记住几种杂化的典型物质,再将给出的物质和他们相互比较一下,一般同族的而且化学式类似,杂化类型相同。
eg:判断下列分子的杂化类型并判断分子的空间构型及是否具有极性H2S,PH3,NF3,CCl4,解:(1)H2S,中心原子是S,我们学过H2O是SP3不等性杂化,V字型,具有极性,O和S是同族元素,而且H2S和H2O分子式非常类似,所以H2S也是SP3不等性杂化,V字型,具有极性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
如何判断分子的杂化类型直线型sp杂化A-B-A 如CO2
sp CO CO
2, CS
2
,N
2
O, C
2
H
2
BeCl
2
,B
e
H
2
,Ag(NH
3
)
2
+, Cu(NH3)
2
+ Cu (CN)
2
-
sp2 BF
3, NO
3
- BBr
3
SO
3,SO
2
, NO
2
O
3
,
平面三角型SP2杂化如BCl3
V型Sp3不等性杂化如H2O
三角锥型SP3不等性杂化如NH3正四面体型SP3杂化如CH4
sp3 CH
4, CCl
4
, NH
4
+, SO
4
2-, SiX
4
SiH
4
NH
3 , PH
3
NF
3
,PX
3
,ClO
3
- ,
H 2O ,H
2
S ,OF
2
, Cl
2
O
ZnCl
42- FeCl
4
- Zn(CN)
4
2-
sp3d PF
5 , PCl
5
,
SF
4, TeCl
4
, ICl
4
+
ClF
3, BrF
3
XeF
2, ICl
2
-, I
3
-
三角双锥型SP3d杂化如PCl5
正八面体型SP3d2杂化如常见的六氟化物
8.杂化与分子构型的关系:
杂化类型sp sp2sp3d2sp3或sp3d2
等性等性不等性等性不等性不等性等性不等性
分子形状直线形Δ形V形正四面体三角锥角形
参加杂化的
轨道数目 2 3 3 4 4 4 6 6
杂化轨道中
孤电子对数目0 0 1 0 1 2
杂化轨道的
几何图形直线形正Δ形Δ正四面体四面体四面体八面体
键角180°120°109°28,180°90°
例C2H2C2H4 SO2CH4NH3H2O [Cu(H2O)6]2+
判断物质的杂化类型,空间结构
首先可以根据经验判断,先记住几种杂化的典型物质,再将给出的物质和他们相互比较一下,一般同族的而且化学式类似,杂化类型相同。
eg:判断下列分子的杂化类型并判断分子的空间构型及是否具有极性 H
2S,PH
3
,NF
3
,CCl
4
,
解:(1)H
2S,中心原子是S,我们学过H
2
O是SP3不等性杂化,V字型,具有极性,O和S是同族元素,而
且H
2S和H
2
O分子式非常类似,所以H
2
S也是SP3不等性杂化,V字型,具有极性。
(2)PH
3
,中心原子是P,我们学过NH
3
是不等性杂化,三角锥型,具有极性,N和P是同族元素,
而且NH
3和PH
3
分子式非常类似,所以PH
3
也是SP3不等性杂化,三角锥型,具有极性。
(3)CCl
4
,中心原子C,我们学过CH
4
,为SP3等性杂化,正四面体,非极性分子,CCL
4
和CH
4
分子
式非常相似,所以CCl
4
也为SP3等性杂化,正四面体,非极性分子。
如果C相连接的四个原子不完全相同,C依然是SP3等性杂化但空间构型为四面体,极性分子。
(4)NF
3
,也是SP3不等性杂化,三角锥,极性分子。
(5)判断分子中C原子的杂化类型,首先数和C直接连接的原子个数,有几个原子就需要多少条杂化轨道,可以找出相应的杂化类型,eg:HCN,与C直接相连的原子有两个,需要两条杂化轨道,所以是SP杂化,直线型分子。
其次,如果分子式和学过的典型的分子式有较大差异,而且有的还是离子,那根据上述方法就无从判断,可以里用价层电子对互斥理论判断。
杂化轨道理论只是解释的理论,不能预测分子的空间构型。
而价层电子对互斥理论,它可以预测分子的空间构型。
公式为n=(a+b+c)/2 其中a为中心原子的价电子数,
eg 氧原子a=6,氮原子a=5
b为和中心原子相连接的原子如果是卤族和H,取1*原子数,如果是氧族取0*原子数。
c为电荷数,如果是负电荷,取+,正电荷取-。
n值如果是小数四舍五入。
分子需要n条杂化轨道,即可判断中心原子的杂化类型,如果,n小于与中心原子直接相连接的原子个数,为不等性杂化,如果等于则为等性杂化。
eg:判断下列分子离子的杂化类型
碳酸根:为SP2等性杂化。
a=4,b=0,C=+2,所以n=3,需要三条杂化轨道,直接与C相连的原子数为3与n相等.
氨根离子:SP3等性杂化,a=5,b=1*4,C=-1,所以n=4,需要四条杂化轨道,直接与N相连的原子为4与n相等。
硫酸根离子:SP3等性杂化.a=6,b=0,c=+2,所以n=4,需要四条杂化轨道,直接与N相连的原子为4与n相等。
SO2:sp2不等性杂化.a=6,b=0,c=o,所以,n=3,需要三条杂化轨道,直接与S相连的原子个数为2,与n不相等。
首先判断配位数,配位数是几,就需要几条杂化轨道,如果是2,则为SP杂化,如果是4则可能为SP3,和dsp2,如果是6,
则为SP3d2,d2SP3。
