付克酰基化反应机理
傅克反应资料讲解

傅克反应傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
傅克酰基化反应基理

傅克酰基化反应基理
Friedel-Crafts酰基化反应,简称傅-克酰基化反应,是一种傅-克反应。
在质子酸或路易斯酸(如三氯化铝)催化下,芳香性化合物与酰卤或酸酐发生的亲电子取代反应,为一改良的亲电子取代反应。
傅-克酰基化反应的出现,主要是为了合成的用途,因为烷基在进行取代反应形成碳阳离子容易进行重排,但是酰化反应中形成的酰阳离子(acylium ion)并不会发生重排现象,因为酰阳离子有个很重要的共振结构,而酰阳离子就会借着共振来稳定,才不会形成碳阳离子重排,因此傅-克酰化反应有个很重要的用途就是避免碳阳离子发生重排,再经由Clemmensen还原反应或Wolff-Kishner还原反应,消除酰基上的氧得到烷基,此过程也称傅-克烷基化反应。
傅克酰基化反应加入硝基苯促进反应的原因_解释说明

傅克酰基化反应加入硝基苯促进反应的原因解释说明1. 引言1.1 概述傅克酰基化反应是一种重要的有机合成方法,以其高效、经济和可控性而受到广泛关注。
该反应通过将傅克试剂与酰化试剂反应生成酰基化合物,在构建碳-碳键和碳-氧键方面具有巨大的潜力。
众多研究表明,在傅克酰基化反应中加入硝基苯可以显著提高反应的速率和产率,因此引起了人们的重视。
1.2 文章结构本文主要围绕着傅克酰基化反应中加入硝基苯促进反应的原因进行深入探讨。
首先,我们将介绍傅克酰基化反应的机制、应用领域以及常见的反应条件和催化剂选择。
接下来,我们将详细解释硝基苯在傅克酰基化反应中所起到的作用,并分析影响其促进作用的因素。
最后,我们将通过实验验证并讨论结果,以得出结论并展望未来可能的研究方向。
1.3 目的本文旨在阐明为何硝基苯可以促进傅克酰基化反应,并探究其影响因素和反应机理。
通过深入了解硝基苯的催化效果和作用机制,我们可以更好地理解该反应中的关键步骤,并为进一步优化傅克酰基化反应提供有益的指导和启示。
这对于提高有机合成的效率、选择性和可控性具有重要意义。
2. 傅克酰基化反应的介绍:傅克酰基化反应是有机化学中一种重要的取代反应,广泛应用于合成和功能材料等领域。
该反应以亲电试剂与芳香化合物进行取代反应,并在芳香环上引入酰基基团。
傅克酰基化反应具有高度的化学选择性和功能多样性,因此成为了有机合成里重要的方法之一。
2.1 反应机制:傅克酰基化反应通常遵循亲电取代反应机制,其中亲电试剂可以是氯代烷或酸酐等。
在反应过程中,亲电试剂与芳香环发生强相互作用并进行取代,形成相应的缩脲盐中间体。
这个过程中所需要的能量比较低,使得傅克酰基化反应对于含有易失活官能团(如羟基和氨基)的底物也具有很好的适用性。
2.2 应用领域:傅克酰基化反应在药物合成、农药合成、高分子材料合成以及生物活性分子的修饰等领域中发挥着重要作用。
在药物合成中,傅克酰基化反应可以用于引入天然产物骨架上的功能团,并通过功能团的选择性改变化合物的生理活性。
傅克酰基化反应 文档

傅克酰基化反应文档傅克酰基化反应是一种重要的有机合成反应,通常指酚和羧酸酯之间的酯化反应。
该反应是一种经典的羧酰基化反应,可以在实验室中进行,也可以工业上进行大规模生产。
其应用范围十分广泛,主要用于有机合成、医药化学、农药合成、材料科学等领域。
傅克酰基化反应的机理可以分为两步,第一步是酯化反应,酸性质子(H+)与羧基的氧原子脱去水分子,生成羧酰衍生物的反应,它是一个平衡反应,所以利用过多的酯和水来推动反应向右移动平衡。
第二步是脱酸反应,通过加入鹼,使酸当中的甲基水解并结合表面,形成CH3OH,并进一步再加上水,生成醇类和羧酸衍生物。
傅克酰基化反应一般是在弱酸性条件下进行,很少使用较强的有机酸,如硫酸等。
主要有以下几种方法:1. 环状酯化反应:具有环状结构的羧酸可以通过环状酯化反应与醇建立酯键。
该方法中羧酸与醇的反应速率很快,可在常温常压下进行。
2. 磺酸盐酯化反应:用磺酸盐作为反应催化剂,将酯成分直接与酚部分反应生成酯。
它具有催化速率快、反应条件温和等优点,适用于大规模工业生产。
3. 酸催化剂酯化反应:酸催化剂如三氟化硼、五氟化磷会吸引电子,增强酯基的亲电性,从而使反应更容易进行。
该方法操作简便、效果明显、成本低,适用于实验室规模的反应。
4. 催化酯化反应:酯化催化剂可以采用多种材料,如金属催化剂、封闭酚环的新型离子催化剂、嫁接酚基的均聚体催化剂和酰氯催化剂等。
其中金属催化剂表现出良好的催化活性和选择性,但催化通常需要高温和高压。
傅克酰基化反应也有一些局限性,如在过多的水的存在下,反应会变慢甚至停止,同时酯化反应的平衡性也会影响到反应的效率,因此需要优化反应条件,调节反应中各组分的平衡关系,以提高反应的产率。
傅-克酰基化反应机理

傅-克酰基化反应机理
傅-克酰基化反应(Fujiwara-Moritani酰基化反应)是一种有机合成中常用的方法,用于将芳香化合物上的氢原子取代为酰基基团。
下面我将从多个角度对傅-克酰基化反应的机理进行全面解释。
傅-克酰基化反应的机理可以分为以下几个步骤:
1. 氟化反应,首先,芳香化合物经过氟化反应,将氟原子引入芳环上的位点。
这一步骤通常使用氟化亚铁(FeF3)或氟化亚锡(SnF2)等作为催化剂。
2. 氟基离去,在氟化反应后,芳香化合物中的氟原子会发生离去,生成芳香环上的正离子中间体。
这一步骤是整个反应的关键步骤,也是决定产物选择性的重要因素。
3. 酰基化反应,生成的正离子中间体与酰化试剂反应,将酰基基团引入芳香环上的位点。
常用的酰化试剂包括酰氯、酰酸酐或酰胺等。
4. 氢原子转移,在酰基化反应后,产生的芳香化合物中的负离
子中间体会发生氢原子的转移,形成最终的酰基化产物。
需要注意的是,傅-克酰基化反应是一个复杂的反应过程,具体的机理可能会因具体的底物和试剂而有所不同。
此外,催化剂的选择和反应条件的调节也会对反应的选择性和效率产生影响。
总结起来,傅-克酰基化反应是一种将芳香化合物上的氢原子取代为酰基基团的有机合成方法。
通过氟化反应、氟基离去、酰基化反应和氢原子转移等步骤,可以实现对芳香化合物的酰基化修饰。
这种反应在药物合成、材料科学等领域具有广泛的应用前景。
苯甲酸钠傅克酰基化反应机理

苯甲酸钠傅克酰基化反应机理
苯甲酸钠傅克酰基化反应是一种有机化学中常见的酰基化反应,通常用于合成酰氯化合物。
以下是其大致机理:
1. 生成酰氯中间体: 首先,苯甲酸钠(NaOCOCH3)与无水盐酸(HCl)反应生成苯甲酰氯中间体(PhCOCl),同时产生NaCl和水。
2. 脱质子化: 苯甲酰氯中间体可被酸或碱脱去产生对应的酰基物质。
在酸性条件下,氯离子(Cl-)可与氢离子(H+)中和形成盐酸,进一步质子化的苯甲酰氯中间体会脱去HCl生成苯甲酰阳离子中间体。
3. 攻击性亲核反应: 若反应中存在亲核试剂(如醇、胺等),亲核试剂中的亲核离子(如OH-、NH2-等)会与苯甲酰阳离子发生酸碱反应,生成相应的酯或酰胺。
综上所述,苯甲酸钠傅克酰基化反应机理包括生成酰氯中间体、脱质子化和攻击性亲核反应等步骤。
请注意本回答仅涉及化学反应机理,与具体合成情况有所差异,请在实验室或相关专业指导下进行具体操作。
傅克反应

多取代物。
3、烷基化反应是可逆反应,催化剂对逆反应也具催化作用。
二、傅-克酰基化反应
酰基化反应:指芳香化合物在酸(路易斯酸或质子酸) 催化作用下与亲电试剂酰卤作用,在芳环上导入酰基 的反应。
试剂:酰卤、酸酐、羧酸
例如:
反应机理
2)酰基化试剂:酰卤、酸酐、羧酸 3)催化剂:可分两类,路易斯酸类(在有机化学中,能
吸收电子云的分子或原子团称为路易斯酸)如AlCl3、 FHe2CSlO3、4、SHnC3Pl4O、4B等F。3、(T两iC类l4催、Z化n剂C的l2等活性;由质大子到酸小类的顺如序H取代基时,傅-克反 应则无法进行。
当苯与三个或三个以上的C组成的卤代 烃发生反应时,生成的主要产物是重排 产物。
傅瑞德尔( Charles Friedel ,1832--1899 ,法国化学家)
傅瑞德尔生于法国斯特拉斯堡( strasboury ),在 武慈指导下学习化学, 1869 年获得博士学位, 1876 年任教授,八年后接替武慈首席有机化学教授位置。
在催化剂作用下,酰化试剂首先生成酰 基正离子,然后和芳环发生亲电取代反 应。
酰基化反应的特点
1、酰基正离子比较稳定,故酰基化不会发生 重排或异构化作用;
2、酰基化反应是不可逆的,并且由于酰基是 芳环的钝化基团,故酰基化反应一般得到的是 单取代产物;
3、催化剂一般都大于1。如,酮能与氯化铝生 成络合物,因此氯化铝的用量应略超过酰氯的 物质的量,如用酸酐为原料,由于副产物羧酸 也能与氯化铝络合,后者用量略超过酸酐物质 的量的二倍。
傅瑞德尔对矿物学和有机化学的研究很有成就。合成 了异丙醇,乳酸和甘油,从 1874 年至 1891 年和美 国化学家克拉夫茨( Crafts )合作,发现无水三氯 化铝催化下把卤代烷加到苯中,便会反应。以他们名 字名的称为 Friedel-Crafts 烷基化和酰基化反应。
傅克反应资料讲解

傅克反应资料讲解傅克反应傅-克反应傅⾥德-克拉夫茨反应,简称傅-克反应,是⼀类芳⾹族亲电取代反应,1877年由法国化学家查尔斯·傅⾥德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使⽤卤代烃对⼀个芳环进⾏烷基化。
假设使⽤⽆⽔氯化铁作为催化剂,在氯化铁的作⽤下,卤代物产⽣碳正离⼦,碳正离⼦进攻苯环并取代环上的氢,最后产⽣烷基芳⾹族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物⽐起原料具有更⾼的亲核性,于是产物苯环上的另⼀个氢继续被烷基所取代,导致了过烷基化现象⽽形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移⾄空间位阻较⼩、热⼒学稳定的间位产物。
另外如果氯不是处于三级碳原⼦(叔碳原⼦)上,还有可能发⽣碳正离⼦重排反应,⽽这取决于碳正离⼦的稳定性:即三级碳>⼆级碳>⼀级碳。
空间位阻效应可以被利⽤于限制烷基化的数量,⽐如1,4-⼆甲氧基苯的叔丁基化反应。
1,4-⼆甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使⽤任何的碳正离⼦中间体参与反应,如⼀些烯烃,质⼦酸,路易斯酸,烯酮,环氧化合物的衍⽣物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进⾏反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选⽤由烯烃和NBS⽣成的溴离⼦。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离⼦形成中活化了NBS的供卤素能⼒。
傅-克去烷基化反应傅-克烷基化是⼀个可逆反应。
分子内傅克酰基化

分子内傅克酰基化
分子内傅克酰基化是有机化学中一种重要的反应类型,通常指的是一个分子中的两个官能团之间发生酰基转移反应。
其反应机理与多种因素有关,包括电子效应、轨道杂化、立体效应等等。
以下是分子内傅克酰基化的一些基本知识:
1. 反应机理
分子内傅克酰基化反应的机理较为复杂,一般包括以下几步:1) 亲核试剂攻击酯的羰基碳;2) 反应中间体的形成;3) 中间体的内攻转移酰基;4) 消除反应生成产物。
2. 电子效应
反应物中的官能团的电子效应通常会对分子内傅克酰基化反应的速率和产物选择性产生较大的影响。
如,酯的羰基碳原子上的卤素等引入的强电子效应会使反应更易进行。
3. 轨道杂化
轨道杂化是反应机理中的重要环节之一。
在傅克酰基化过程中,反应物分子内的两个官能团之间会形成一个反应中间体,中间体的生成与轨道杂化关系密切。
4. 立体效应
分子内傅克酰基化反应的产物选择性与其立体效应密切相关。
一般而言,反应物分子中的官能团的立体构型会对反应产生重要的影响。
5. 应用领域
分子内傅克酰基化反应是有机合成中常用的一种反应类型,对于制备具有生物活性的分子有着重要的应用。
此外,分子内傅克酰基化反应也可以被用于构建复杂的天然产物和药物分子,是合成中的一种关键转化反应。
总之,分子内傅克酰基化反应是有机化学中一种重要的反应类型,其机理、电子效应、轨道杂化、立体效应等都是有机合成中不容忽视的重要内容。
在合成制备过程中,研究分子内傅克酰基化反应的条件和机理,能够帮助我们更好地理解化学反应的本质,并指导我们精准地合成需要的化合物。
2017.8.14-傅克反应

(3)由于烷基化反应是可逆的,烷基苯在强酸的催化下,能够发生烷基 的歧化和转移。当苯过量时,则有利于发生烷基的转移,使多烷基苯向单 烷基苯转化。利用这一性质,在制备单取代烷基苯时,可使副产物的多烷 基苯与苯发生烷基转移,即脱烷基再与苯进行烷基化,以增加单取代烷基 苯的收率。 (4)芳环上的取代基对傅克烷基化反应有较大影响,当芳环上连有硝基、 氰基等吸电子基团时,反应不易进行,甚至不能发生。
傅克反应原理及实验技巧
目录
简介
Friedel–Crafts 烷基化反应
Friedel–Crafts 酰基化反应 傅克反应的操作方法 烷基化与酰基化的异同
一、简介
傅里德-克拉夫茨反应,简称傅-克反应,英文Friedel–Crafts reaction,是 一类芳香族亲电取代反应,1877年由法国化学家查尔斯· 傅里德(Friedel C) 和美国化学家詹姆斯· 克拉夫茨(Crafts J)共同发现。 Friedel–Crafts 反应是一种重要的形成碳碳单键的反应,而碳碳单键的形 成是有机合成中极为重要的一部分内容。
ቤተ መጻሕፍቲ ባይዱ
离产物。
如用氟化氢作催化剂,就把反应物溶解在大量液体氟化氢中, 在室温下放置一定时间,让氟化氢自行蒸发掉,设备要用聚乙 烯材料,铜、镍和不锈钢器具也可以用。 用氟化硼为催化剂时,可以把反应物和溶剂混合,在搅拌下通 入氟化硼气体。
五、烷基化与酰基化的异同
相同点:催化剂相同;反应机理相似;苯环上带有强吸电子基时 (如硝基、磺基、酰基和氰基等),一般不发生反应。 不同点:烷基化反应是可逆的,而酰基化反应不可逆;由于烷基 化反应的可逆性,所以常常伴随着歧化反应,即一份子的烷基苯 脱烷基,另一分子则增加烷基。
傅克反应酰基化分解水生成酸的例子

傅克反应酰基化分解水生成酸的例子【实用版】目录1.傅克反应的概述2.酰基化反应的概念3.傅克反应酰基化分解水生成酸的例子4.反应的机理5.结论正文一、傅克反应的概述傅克反应,又称弗克反应,是一种在有机化学中常见的反应,主要用于合成醇、酸和酯等化合物。
它是由德国化学家约瑟夫·弗克(Joseph Vogt)于 1905 年发现的。
傅克反应的特点是使用催化剂,通常为钴、铑或钯等,反应条件温和,且产率高。
二、酰基化反应的概念酰基化反应是一种有机化学反应,指的是将一个酰基(-CO-)引入到有机化合物中的过程。
酰基可以来源于酰氯、酸酐、酯等化合物。
酰基化反应在有机合成中具有重要意义,常用于合成醇、酸和酯等化合物。
三、傅克反应酰基化分解水生成酸的例子以邻苯二甲酰氯为酰基化试剂,对苯二酚为反应底物,进行傅克反应酰基化,可得到邻苯二甲酸。
该反应过程中,酰基与酚羟基发生反应,生成一个水解稳定的酯,然后水分子进攻酯键,生成酸和离去基团。
反应的化学方程式如下:C6H4(OH)2 + COCl2Ph → C6H4(COPh)2 + H2OC6H4(COPh)2 → C6H4(CO2Ph) + H+四、反应的机理傅克反应酰基化分解水生成酸的机理主要包括以下几个步骤:1.酰基与酚羟基发生亲核取代反应,生成一个水解稳定的酯。
2.水分子进攻酯键,生成酸和离去基团。
3.离去基团离去,生成酸。
五、结论通过对傅克反应酰基化分解水生成酸的例子进行分析,我们可以看到傅克反应在有机合成中的重要应用。
通过选择合适的反应条件和试剂,可以高效地合成所需的有机化合物。
傅克反应

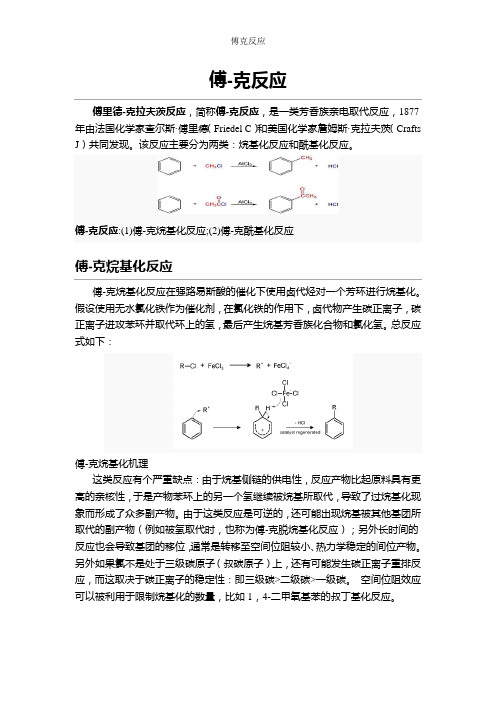
傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
傅克反应
傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
傅克反应酰基化机理

傅克反应酰基化机理
《福克反应酰基化机理》
福克反应(Friedel-Crafts reaction)是一种广泛的反应形式,可以用于将酰基(即醛或酮)接到芳香环上,通常被称为“Friedel-Crafts酰基化反应”,这是古老且重要的化学反应。
福
克反应酰基化反应可直接在芳环上形成酰基,在有机化合物及,有机胺合成中均有应用。
福克反应酰基化反应机理大致分为三步:第一步是福克反应发生,即最重要的步骤;第二
步是由醌亲核质子转移造成的,这就是Friedel-Crafts加成反应;第三步是去除质子,这
就是Friedel-Crafts酰基化的最终反应,产物为一个酰基。
福克反应发生的过程如下:由于受到官能团的强烈负荷,底物(如烃类、醛、酮等)和醌(如氯醌或甲苯醌)受到活性催化剂(如络合物、氢氧化钠、硝酸钾)的催化作用,使共
价键发生破坏,得到一个具有两个可以转移的官能团的质子,该质子可以向芳香环的C-H 键进行质点转移,于是芳香环上形成酰基。
福克反应酰基化反应是一种高效率及易用的合成方法,可以快速高效的获得有机亲核环上
的酰基,不仅在工业应用中起着重要的作用,在药物合成中也有广泛的应用,因此,研究
福克反应酰基化反应机理具有重要的意义。
定位基和傅克酰基化

定位基和傅克酰基化摘要:一、引言二、定位基的定义和作用1.定位基的概念2.定位基在生物化学中的作用三、傅克酰基化反应的原理1.傅克酰基化反应的基本过程2.傅克酰基化反应在生物化学中的应用四、定位基与傅克酰基化反应的关系1.定位基在傅克酰基化反应中的作用2.定位基对傅克酰基化反应的影响五、定位基和傅克酰基化反应在生物化学研究中的应用六、结论正文:一、引言定位基和傅克酰基化是生物化学中的两个重要概念,它们在生物大分子的结构研究中发挥着关键作用。
本文将对这两个概念进行详细阐述,并探讨它们之间的关系以及在生物化学研究中的应用。
二、定位基的定义和作用1.定位基的概念定位基是一种可以精确地定位生物大分子中某个官能团的化学基团。
通过引入定位基,研究者可以更准确地了解生物大分子的空间结构,进而揭示其功能和作用机制。
2.定位基在生物化学中的作用定位基主要用于生物大分子的结构研究中,例如蛋白质、核酸等。
通过引入定位基,研究者可以获取到生物大分子的三维结构信息,从而更好地理解其功能和生物学意义。
三、傅克酰基化反应的原理1.傅克酰基化反应的基本过程傅克酰基化反应是一种在生物大分子中引入傅克酰基(-C(O)-R)的化学反应。
该反应通常涉及到亲核加成和质子转移两个步骤,可以在温和的条件下进行。
2.傅克酰基化反应在生物化学中的应用傅克酰基化反应广泛应用于生物大分子的结构研究中,例如蛋白质、核酸等。
通过傅克酰基化反应,研究者可以在生物大分子中引入特定的官能团,从而实现对其结构的调控和解析。
四、定位基与傅克酰基化反应的关系1.定位基在傅克酰基化反应中的作用定位基通常作为傅克酰基化反应的导向基团,通过与生物大分子中的特定官能团结合,实现对傅克酰基化反应的精确控制。
2.定位基对傅克酰基化反应的影响定位基的性质和结构会直接影响傅克酰基化反应的选择性和效率。
因此,在设计和选择定位基时,需要充分考虑其对傅克酰基化反应的影响。
五、定位基和傅克酰基化反应在生物化学研究中的应用本文以蛋白质为例,介绍了定位基和傅克酰基化反应在生物化学研究中的应用。
傅克酰基化机理

傅克酰基化机理
傅克酰基化是一种在苯环上连”-酰基-R”的有机反应,反应要在质子酸存在的条件下才能进行,因为质子酸在反应机理里起到了重要的作用。
关于反应机理,说大白话就是
1: 质子酸抢了酰基氧的电子,酰基氧带了正电于是抢了边上酰卤键的电子
2: 酰基的正电荷从氧转移到碳上,于是正电荷受到苯环离域派键的吸引和苯环其中一个碳相连
3: 脱氢
不过哎想理解这个过程,需要你有有机化学关于电子云排布,亲电取代,诱导效应,碳正离子重排的基础知识做铺垫。
强烈建议你先好好看懂基础知识,不然你没有地基就要盖楼,就有点儿不稳了的说。
傅-克酰基化反应是可逆反应

傅-克酰基化反应是可逆反应傅-克酰基化反应是有机化学中一种重要的反应类型,它常常被用于合成酰基化合物。
这个反应是可逆的,也就是说,酰基化产物可以通过逆反应再次转化为原始物质。
傅-克酰基化反应的机理是通过酰氯或酸酐与醇或酚反应生成酯或酰醇。
这个反应需要一个催化剂,通常是一种酸或碱。
催化剂的作用是促进反应的进行,降低活化能,提高反应速率。
在酸性条件下,酰氯或酸酐会先与催化剂反应生成酸中间体,然后与醇或酚发生反应生成酯或酰醇。
由于傅-克酰基化反应是可逆的,当反应达到平衡时,反应物和产物之间会达到一个动态平衡。
这意味着反应物和产物的浓度会保持稳定,而不会继续转化。
当外界条件发生改变时,比如温度、压力或反应物浓度的变化,反应会重新达到平衡。
傅-克酰基化反应的可逆性使得它在化学合成中具有广泛的应用。
通过控制反应条件,可以选择性地合成不同的酰基化合物。
此外,由于反应是可逆的,产物也可以再次转化为原始物质,从而为进一步的合成提供了便利。
傅-克酰基化反应在有机合成中有许多重要的应用。
例如,它可以用于合成酯类化合物,这些化合物在医药、香料和涂料等领域中有广泛的应用。
此外,傅-克酰基化反应还可以用于合成酮类化合物,这些化合物在有机合成中也具有重要的地位。
傅-克酰基化反应的可逆性是它的一个重要特点,也是它在合成中的一个优势。
通过逆反应,可以将产物再次转化为反应物,从而实现一系列的化学转化。
这种可逆性为有机化学的研究和应用提供了更多的可能性。
傅-克酰基化反应是一种重要的有机反应,它可以用于合成酯和酰醇等化合物。
这个反应是可逆的,可以通过逆反应再次转化为原始物质。
傅-克酰基化反应的可逆性使得它在有机合成中具有广泛的应用前景,为化学研究和应用提供了更多的选择。
傅_克酰基化反应的机理及动力学研究进展

专利介绍这类反应, 它在学术或者工业领域上迅速成为 有机合成化学的基础反应. 由于傅-克酰基化反应是实 现碳碳成键的最有效方式之一, 并且是制备各种芳基 酮, 杂环芳烃酮等的重要手段, 所以它在医药、农药、 染料、香料等工业生产中具有非常广泛的应用, 因此化 学家们对傅-克酰基化反应一直怀有很高的兴趣[33~44]. 一般来讲, 傅-克酰基化反应使用的是路易斯酸, 如氯 化锌、氯化铝、氯化铁、四氯化锡、四氯化钛等或者是 很强的质子酸, 如氢氟酸、硫酸等. 在反应结束以后, 这 些路易斯酸与产物配位从而以配合物的形式存在, 所以 在水解后才可以得到目标产物, 这就会造成环境的污 染[45,47]. 所以, 在过去的几十年里, 傅-克酰基化反应一 直努力朝着绿色化学的方向发展. 通过开发更加有效的 催化剂, 比如催化量的 Ln(OTf)3[47,48]. 使得反应效率得 到提高, 或者优化反应条件, 如微波条件下, 离子液体 中的傅-克酰基化反应[31,34,35,38], 实现催化剂的回收再利 用; 抑或是使用石墨作为固体催化剂, 以及各种异相催 化剂的发展都使得傅-克酰基化反应不断地向前推 进[49~53].
776
有机化学
Vol. 31, 2011
Scheme 2
1877 年, Friedel 和 Crafts[18,19]试图通过 Gustavson 反 应将 1,1,1-三氯乙烷(苯作溶剂)在铝粉和碘单质存在条 件下转化为 1,1,1-三碘乙烷, 但出乎意料的是他们再次 得到了 Zincke 反应的产物. 为了证实这点, 他们又用 1氯戊烷替代 1,1,1-三氯乙烷重复上面的反应, 结果是依 然得到了 Zincke 反应的产物. 这次他们没有忽视体系中 存在的三碘化铝, 并提出了两点猜测: 铝粉在生成三碘 化铝之前就已经催化了 Zincke 反应; 或者铝根本不是 Zincke 反应的催化剂, 真正的催化剂是三碘化铝. 随后 他们发现用三氯化铝与 1-氯戊烷和苯的混合液反应, 居 然更高产率的得到了戊苯(Eq. 1).
