金属离子沉淀pH值表
金属离子沉淀PH值表
(2012-03-1520:42:28)转载▼
标签:杂分类:复习备考
谈
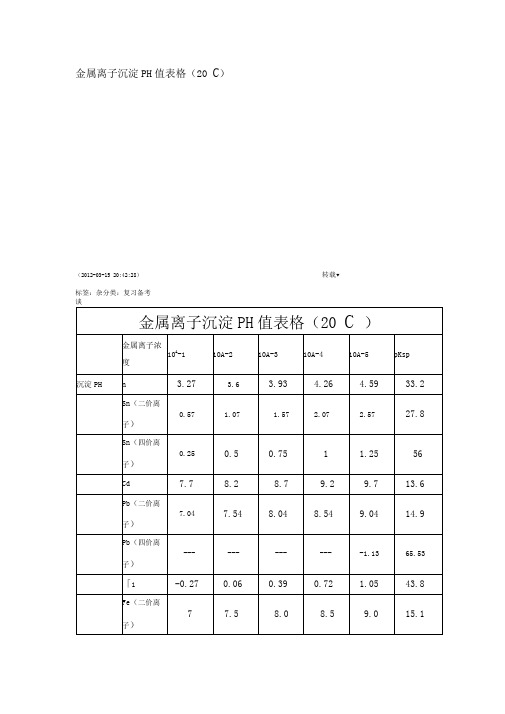
金属离子沉淀PH值表格(20C)
金属离子浓
度
10A-1
10A-2
10A-3
10A-4
10A-5
pKsp
沉淀PH
n
3.27
3.6
3.93
4.26
4.59
33.2
Sn(二价离
子)
0.57
1.07
1.57
Cu
4.7
5.2
5.7
6.2
6.7
19.6
Ni
7.2
7.7
8.2
8.7
9.2
14.7
Mn
8.1
8.6
9.1
9.6
10.1
12.73
Mg
9.1
9.6
10.1
10.6
11.1
10.74
Zn
6.04
6.54
7.04
7.54
8.04
16.92
Sb
0.53
0.86
1.19
1.52
1.85
41.4
Ti
1
1.33
个原理。
(注:表格素材和资料部分来自网络,供参考。只是收取少量整理收集费用,请 预览后才下载,期待你的好评与关注)
子)
7
7.5
8.0
8.5
9.0
15.1
Fe(三价离
子)
1.9
2.2
2.5
2.9
3.2
37.4
Co(二价离
子)
7.15
7.65
常见沉淀的PH值

10.5
12~13
Ag2O
6。2
8.2
11.212。7-来自Fe(OH)26。5
7.5
9。7
13。5
-
氢氧化物
开始沉淀时的PH
沉淀完全时PH(残留离子浓度<10-5mol·L—1
沉淀开始溶解的PH
沉淀完全溶解时的PH
初浓度[Mn+]
1mol·L—1
0.01mol·L-1
Co(OH)2
6.6
7.6
9。2
—
—
Sn(OH)2
0。9
2.1
4。7
10
13。5
ZrO(OH)2
1.3
2。3
3。8
—
-
HgO
1。3
2.4
5.0
11.5
—
Fe(OH)3
1。5
2。3
4.1
14
Al(OH)3
3。3
4。0
5。2
7。8
10。8
Cr(OH)3
4.0
4.9
6。8
12
15
Be(OH)2
5.2
6。2
8.8
-
-
Zn(OH)2
5。4
6。4
常见沉淀的PH值
(1)金属氧化物沉淀物的PH(包括形成氢氧配离子的大约值)
氢氧化物
开始沉淀时的PH
沉淀完全时PH(残留离子浓度<10—5mol·L-1
沉淀开始溶解的PH
沉淀完全溶解时的PH
初浓度[Mn+]
1mol·L—1
0。01mol·L—1
Sn(OH)4
0
0。5
1
各种金属离子沉淀的ph值

各种金属离子沉淀的pH值范围如下:
1.铁离子:铁离子的开始沉淀pH值范围为6-12,完全沉淀的pH 值大于10.5。
在pH值为6-8.5时,铁离子主要以Fe(OH)3的形式沉淀;当pH值大于8.5时,铁离子会以Fe(OH)2的形式反溶。
2.铝离子:铝离子的开始沉淀pH值范围为5.5-8,完全沉淀的pH 值大于8.5。
在pH值为5.5-6.5时,铝离子主要以Al(OH)3的形式沉淀;当pH值大于6.5时,铝离子会以Al(OH)2+的形式反溶。
3.铜离子:铜离子的开始沉淀pH值范围大于8,完全沉淀的pH 值大于10。
4.锌离子:锌离子的开始沉淀pH值范围为9-10,完全沉淀的pH 值大于10.5。
5.亚铁离子:亚铁离子的开始沉淀pH值范围为1-7,完全沉淀的pH值大于9。
各种金属离子沉淀的ph值

各种金属离子沉淀的ph值【最新版】目录一、引言二、金属离子沉淀的 ph 值范围1.铁离子2.铝离子3.铜离子4.锌离子5.镍离子6.锰离子三、结论正文一、引言在化学实验和工业生产过程中,金属离子沉淀是一个重要的步骤。
了解金属离子沉淀的 ph 值对于控制沉淀过程和提高沉淀效率至关重要。
本文将探讨不同金属离子沉淀的 ph 值范围。
二、金属离子沉淀的 ph 值范围1.铁离子:铁离子的开始沉淀 ph 值范围为 6-12,完全沉淀的 ph 值大于 10.5。
在 ph 值为 6-8.5 时,铁离子主要以 Fe(OH)3 的形式沉淀;当 ph 值大于 8.5 时,铁离子会以 Fe(OH)2 的形式反溶。
2.铝离子:铝离子的开始沉淀 ph 值范围为 5.5-8,完全沉淀的 ph 值大于 8.5。
在 ph 值为 5.5-6.5 时,铝离子主要以 Al(OH)3 的形式沉淀;当 ph 值大于 8.5 时,铝离子会以 Al(OH)2 的形式反溶。
3.铜离子:铜离子的开始沉淀 ph 值大于 8。
在 ph 值大于 8 时,铜离子主要以 Cu(OH)2 的形式沉淀。
4.锌离子:锌离子的开始沉淀 ph 值范围为 9-10,完全沉淀的 ph 值大于 10.5。
在 ph 值为 9-10 时,锌离子主要以 Zn(OH)2 的形式沉淀;当 ph 值大于 10.5 时,锌离子会以 Zn(OH)4 的形式反溶。
5.镍离子:镍离子的开始沉淀 ph 值大于 9.5。
在 ph 值大于 9.5 时,镍离子主要以 Ni(OH)2 的形式沉淀。
6.锰离子:锰离子的开始沉淀 ph 值范围为 10-14。
在 ph 值 10-14 时,锰离子主要以 Mn(OH)2 的形式沉淀。
三、结论综上所述,不同金属离子沉淀的 ph 值范围有所不同。
常见沉淀的PH值

-
Sn(OH)2
10
ZrO(OH)2
-
-
HgO
-
Fe(OH)3
14
Al(OH)3
Cr(OH)3
12
15
Be(OH)2
-
-
Zn(OH)2
12~13
Ag2O
-
Fe(OH)2
-
氢氧化物<10-5mol·L-1
沉淀开始溶解的PH
沉淀完全溶解时的PH
初浓度[Mn+]
罕见沉淀的PH值之巴公井开创作
(1)金属氧化物沉淀物的PH(包含形成氢氧配离子的大约值)
氢氧化物
开始沉淀时的PH
沉淀完全时PH(残留离子浓度<10-5mol·L-1
沉淀开始溶解的PH
沉淀完全溶解时的PH
初浓度[Mn+]
1mol·L-1
0.01mol·L-1
Sn(OH)4
0
1
13
15
TiO(OH)2
0
ZnS
CoS
NiS
FeS
MnS
盐酸浓度/mol·L-1
12
pH
被硫化氢所沉淀的金属
1
Cu,Ag,Hg,Pb,Bi,Cd,Rh,Pd,Os,As,Au,Pt,Sb,Ir,Ge,Se,Te,Mo
2~3
Zn,Ti,In,Ga
5~6
Co,Ni
>7
Mn,Fe
下表是在水溶液中硫化物能沉淀时的最高浓度
硫化物
Ag2S
HgS
CuS
Sb2S3
Bi2S3
SnS2
CdS
PbS
SnS
1mol·L-1
0.01mol·L-1
各种金属离子沉淀的ph值

各种金属离子沉淀的ph值(原创版)目录一、引言二、金属离子沉淀的 ph 值范围1.铁离子2.铝离子3.铜离子4.锌离子5.镍离子6.锰离子三、影响金属离子沉淀的因素1.离子浓度2.水的温度3.水的离子积四、金属离子沉淀的应用1.污水处理2.重金属离子脱除五、结论正文一、引言在化学反应中,金属离子的沉淀是一个常见的现象。
了解金属离子沉淀的 ph 值对于污水处理和重金属离子脱除具有重要意义。
本文将探讨不同金属离子沉淀的 ph 值范围、影响因素以及应用。
二、金属离子沉淀的 ph 值范围1.铁离子:铁离子开始沉淀的 ph 值为 5-12,完全沉淀的 ph 值为1.86-3。
2.铝离子:铝离子开始沉淀的 ph 值为 5.5-8,完全沉淀的 ph 值大于 8.5。
3.铜离子:铜离子开始沉淀的 ph 值为大于 8。
4.锌离子:锌离子开始沉淀的 ph 值为 9-10,完全沉淀的 ph 值大于 10.5。
5.镍离子:镍离子开始沉淀的 ph 值为大于 9.5。
6.锰离子:锰离子开始沉淀的 ph 值为 10-14。
三、影响金属离子沉淀的因素1.离子浓度:金属离子的沉淀程度受其初始浓度的影响。
一般情况下,离子浓度越高,沉淀效果越明显。
2.水的温度:水的温度对金属离子的沉淀有一定影响。
温度越高,沉淀反应速率越快,但沉淀效果受离子积的影响。
3.水的离子积:水的离子积对金属离子沉淀有显著影响。
当离子积大于一定值时,金属离子开始沉淀。
不同金属离子的沉淀离子积值不同。
四、金属离子沉淀的应用1.污水处理:金属离子沉淀技术可用于污水处理,去除废水中的重金属离子。
通过调节 ph 值和添加沉淀剂,使金属离子沉淀,从而达到净化水质的目的。
2.重金属离子脱除:金属离子沉淀技术还可用于重金属离子脱除,例如饮用水处理、食品工业和制药工业等领域。
五、结论了解不同金属离子沉淀的 ph 值范围、影响因素和应用对于污水处理和重金属离子脱除具有重要意义。
ph为多少时金属离子沉淀数据

ph为多少时金属离子沉淀数据金属离子沉淀是化学实验中常见的现象,通过控制pH值可以调节金属离子的沉淀行为。
本文将探讨在不同pH值下金属离子沉淀的数据及其意义。
我们需要了解什么是金属离子沉淀。
金属离子是指金属元素失去电子后形成的带正电荷的离子。
在溶液中,金属离子与溶剂分子相互作用,形成溶剂和金属离子的溶液态。
当溶剂发生变化,如pH值的改变,金属离子可能会发生沉淀反应,从溶液中析出形成固体沉淀物。
接下来,我们将讨论在不同pH值下常见金属离子的沉淀数据。
以下是一些常见金属离子的沉淀数据及其pH值:1. 铁离子(Fe3+):在pH>3的溶液中,铁离子会与水中的氢氧根离子(OH-)反应形成铁(III)氢氧化物(Fe(OH)3)沉淀。
当pH>8时,铁离子会与水中的碳酸根离子(CO32-)反应形成铁(III)碳酸盐(Fe2(CO3)3)沉淀。
2. 铝离子(Al3+):在pH>4.5的溶液中,铝离子会与水中的氢氧根离子反应形成铝(III)氢氧化物(Al(OH)3)沉淀。
3. 钙离子(Ca2+):在pH>12的溶液中,钙离子会与水中的氢氧根离子反应形成氢氧化钙(Ca(OH)2)沉淀。
4. 镁离子(Mg2+):在pH>10的溶液中,镁离子会与水中的氢氧根离子反应形成氢氧化镁(Mg(OH)2)沉淀。
以上数据仅供参考,实际沉淀行为可能受到其他因素的影响,如温度、离子浓度等。
在实际实验中,我们需要根据具体情况调整pH 值以控制金属离子的沉淀。
金属离子沉淀数据的研究对于环境保护、水处理、化学分析等领域具有重要意义。
例如,在水处理过程中,我们可以利用金属离子沉淀来去除水中的重金属离子,净化水质。
此外,金属离子沉淀还可以用于化学分析中,通过观察沉淀行为来确定金属离子的存在与浓度。
金属离子沉淀是一种常见的化学现象,通过调节溶液的pH值可以控制金属离子的沉淀行为。
不同金属离子在不同pH值下会发生不同的沉淀反应,这些数据对于环境保护和化学分析具有重要意义。
