官能团红外吸收特征频率表
红外光谱频率与官能团特征吸收峰总结表

内弯曲振动的倍频或组频吸收),是进一步确定取代苯的重要旁证。
苯 670cm-1(S) 单取代苯 770~730 cm-1(VS),710~690 cm-1(S)
1,2-二取代苯 770~735 cm-1(VS)
1,3-二取代苯 810~750 cm-1(VS),725~680 cm-1(m~S)
1,4-二取代苯 860~800 cm-1(VS) 五、卤化物
1、σC=O 1750~1735 cm-1 处出现(饱和酯 σC=O 位于 1740cm-1 处),受相邻基 团的影响,吸收峰的位置会发生变化。
2、σC-O 一般有两个吸收峰,1300~1150 cm-1,1140~1030 cm-1 十一、酰卤
σC=O 由于卤素的吸电子作用,使 C=O 双键性增强,从而出现在较高波数处, 一般在~1800cm-1 处,如果有乙烯基或苯环与 C=O 共轭,,会使 σC=O 变小,一 般在 1780~1740cm-1 处。 十二、酸酐
1、σC=O 由于羰基的振动偶合,导致 σC=O 有两个吸收,分别处在 1860~1800 cm-1 和 1800~1750 cm-1 区域,两个峰相距 60 cm-1。 2、σC-O 为一强吸收峰,开链酸酐的 σC-O 在 1175~1045 cm-1 处,环状酸酐 1310~1210 cm-1 处。 十三、酰胺
σ C C 出现在 2140—2100 cm-1,二元取代炔烃在 2260—2190 cm-1,当两个取
代基的性质相差太大时,炔化物极性增强,吸收峰的强度增大。当
处
于分子的对称中心时,σ C为C红外非活性。 3、σ C C H 炔烃变形振动发生在 680—610 cm-1。
四、芳烃
芳烃的红外吸收主要为苯环上的 C-H 键及环骨架中的 C=C 键振动所引起。
总结 红外光谱频率与官能团特征吸收峰
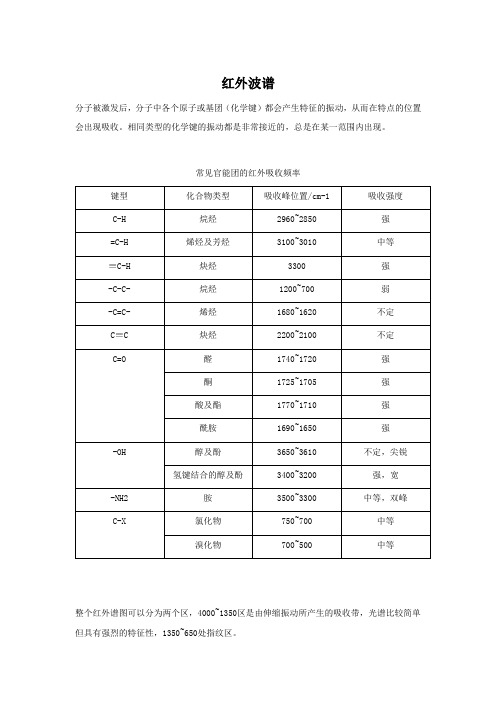
红外波谱分子被激发后,分子中各个原子或基团(化学键)都会产生特征的振动,从而在特点的位置会出现吸收。
相同类型的化学键的振动都是非常接近的,总是在某一范围内出现。
常见官能团的红外吸收频率整个红外谱图可以分为两个区,4000~1350区是由伸缩振动所产生的吸收带,光谱比较简单但具有强烈的特征性,1350~650处指纹区。
通常,4000~2500处高波数端,有与折合质量小的氢原子相结合的官能团O-H, N-H, C-H, S-H 键的伸缩振动吸收带,在2500-1900波数范围内常常出现力常数大的三件、累积双键如:- C≡C-,- C≡N, -C=C=C-, -C=C=O, -N=C=O等的伸缩振动吸收带。
在1900以下的波数端有-C=C-, -C=O, -C=N-, -C=O等的伸缩振动以及芳环的骨架振动。
1350~650指纹区处,有C-O, C-X的伸缩振动以及C-C的骨架振动,还有力常数较小的弯曲振动产生的吸收峰,因此光谱非常复杂。
该区域各峰的吸收位置受整体分子结构的影响较大,分子结构稍有不同,吸收也会有细微的差别,所以指纹区对于用已知物来鉴别未知物十分重要。
有机化学有机化合物红外吸收光谱σ伸缩振动,δ面内弯曲振动,γ面外弯曲振动一、烷烃饱和烷烃IR光谱主要由C-H键的骨架振动所引起,而其中以C-H键的伸缩振动最为有用。
在确定分子结构时,也常借助于C-H键的变形振动和C-C键骨架振动吸收。
烷烃有下列四种振动吸收。
1、σC-H在2975—2845 cm-1范围,包括甲基、亚甲基和次甲基的对称与不对称伸缩振动2、δC-H在1460 cm-1和1380 cm-1处有特征吸收,前者归因于甲基及亚甲基C-H 的σas,后者归因于甲基C-H的σs。
1380 cm-1峰对结构敏感,对于识别甲基很有用。
共存基团的电负性对1380 cm-1峰位置有影响,相邻基团电负性愈强,愈移向高波数区,例如,在CH3F中此峰移至1475 cm-1。
常见官能团红外吸收特征频率表

l6O-200j
枪
3610,尖I屮]
1200,1
160-2OOj
分子耽it:
Wl
:耕
3600-3500
Ir豪多彙体的吸收∙hu
多耕
3600,%[fi]
⅜fA4∙:
多元暉
360(13500
[50-100]
«41
3600-3500
3200-250Ot
X(W]
化合IJ类巾
⅛ ⅛ W
吸收频*(CTn ')
1725-1705l
尖[3(XK
IF状・
大ft Wff
1720-17OOI
尖[ttal
六员环
1725-1705,
尖!极ad
血员环
1750-1740.尖限気
四员环
1刀5•尖
IM.
三员环
18血尖
(««)
不饱和IW
Sp•不»W*I
~ ^ "\
1685-1665.
1650-1601)
xιw⅛)
1
化合物矣刑
Irfit团
二制;
OQI I -C-C-
I73Q-1710,尖极%丨
当阴个裁基不相隹时.M*HbI
S≡状他和■的啜收(«1
Ulfll
1690-1660.尖我做]
MiaI
9m
1650.
MM
2820[¾ L
2720[«]
1740-1720.尖[极劃
fc<knι
α申不AM
O•血y.d・不悯和If
Ar-CHO
1705-168(). ^iMI 1680-1660,
2975」中]
I
红外光谱频率与官能团特征吸收峰总结表

三、炔烃
在 IR 光谱中,炔烃基团很容易识别,它主要有三种特征吸收。
1、σC C H 该振动吸收非常特征,吸收峰位置在 3300—3310 cm-1,中等强度。 σN-H 值与 σC-H 值相同,但前者为宽峰、后者为尖峰,易于识别。
2、σ C C 一般
C C键的伸缩振动吸收都较弱。一元取代炔烃 RC CH
σ C C 出现在 2140—2100 cm-1,二元取代炔烃在 2260—2190 cm-1,当两个取
代基的性质相差太大时,炔化物极性增强,吸收峰的强度增大。当
处
于分子的对称中心时,σ C为C红外非活性。 3、σ C C H 炔烃变形振动发生在 680—610 cm-1。
四、芳烃
芳烃的红外吸收主要为苯环上的 C-H 键及环骨架中的 C=C 键振动所引起。
1、σC=O 1750~1735 cm-1 处出现(饱和酯 σC=O 位于 1740cm-1 处),受相邻基 团的影响,吸收峰的位置会发生变化。
2、σC-O 一般有两个吸收峰,1300~1150 cm-1,1140~1030 cm-1 十一、酰卤
σC=O 由于卤素的吸电子作用,使 C=O 双键性增强,从而出现在较高波数处, 一般在~1800cm-1 处,如果有乙烯基或苯环与 C=O 共轭,,会使 σC=O 变小,一 般在 1780~1740cm-1 处。 十二、酸酐
随着卤素原子的增加,σC-X 降低。如 C-F(1100~1000 cm-1);C-C(l 750~700 cm-1);C-Br(600~500 cm-1);C-I(500~200 cm-1)。此外,C-X 吸收峰的频率 容易受到邻近基团的影响,吸收峰位置变化较大,尤其是含氟、含氯的化合物变 化更大,而且用溶液法或液膜法测定时,常出现不同构象引起的几个伸缩吸收带。 因此 IR 光谱对含卤素有机化合物的鉴定受到一定限制。 六、醇和酚 醇和酚类化合物有相同的羟基,其特征吸收是 O-H 和 C-O 键的振动频率。 1、 σO-H 一般在 3670~3200 cm-1 区域。游离羟基吸收出现在 3640~3610 cm-1, 峰形尖锐,无干扰,极易识别(溶剂中微量游离水吸收位于 3710 cm-1)。OH 是 个强极性基团,因此羟基化合物的缔合现象非常显著,羟基形成氢键的缔合峰一 般出现在 3550~3200 cm-1。
红外吸收光谱特征峰

表15.1 典型有机化合物的重要基团频率(/cm-1)化合物基团X-H伸缩振动区叁键区双键伸缩振动区部分单键振动和指纹区烷烃-CH3asCH:2962±10(s) asCH:1450±10(m)sCH:2872±10(s)sCH:1375±5(s)-CH2-asCH:2926±10(s)CH:1465±20(m)sCH:2853±10(s)CH:2890±10(s)CH:~1340(w)烯烃CH:3040~3010(m) C=C:1695~1540(m) CH:1310~1295(m)CH:770~665(s)CH:3040~3010(m) C=C:1695~1540(w) CH:970~960(s)炔烃-C≡C-HCH:≈3300(m)C≡C:2270~2100(w)芳烃CH:3100~3000(变)泛频:2000~1667(w)C=C:1650~1430(m)2~4个峰CH:1250~1000(w) CH:910~665单取代:770~730(vs)≈700(s)邻双取代:770~735(vs) 间双取代:810~750(vs)725~680(m)900~860(m) ~对双取代:860~790(vs)醇类R-OHOH:3700~3200(变) OH:1410~1260(w)CO :1250~1000(s)OH :750~650(s)酚类 Ar-OHOH :3705~3125(s)C=C :1650~1430(m) OH :1390~1315(m)CO :1335~1165(s)脂肪醚 R-O-R 'CO :1230~1010(s)酮C=O :≈1715(vs)醛CH :≈2820,≈2720(w)双峰C=O :≈1725(vs)羧酸OH :3400~2500(m)C=O :1740~1690(m)OH :1450~1410(w)CO :1266~1205(m)酸酐C=O :1850~1880(s) C=O :1780~1740(s)CO :1170~1050(s)酯泛频C=O :≈3450(w)C=O :1770~1720(s) COC :1300~1000(s)胺 -NH 2NH2:3500~3300(m) 双峰NH :1650~1590(s,m) CN (脂肪):1220~1020(m,w)CN (芳香):1340~1250(s)-NHNH :3500~3300(m)NH :1650~1550(vw)CN (脂肪):1220~1020(m,w)CN (芳香):1350~1280(s)酰胺asNH :≈3350(s)C=O :1680~1650(s) CN :1420~1400(m)sNH:≈3180(s)NH:1650~1250(s) NH2:750~600(m)NH:≈3270(s)C=O:1680~1630(s)NH+CN:1750~1515(m)CN+NH:1310~1200(m)C=O:1670~1630酰卤C=O:1810~1790(s)腈-C≡NC≡N:2260~2240(s)硝基化合物R-N02NO2:1565~1543(s) NO2:1385~1360(s)CN:920~800(m)Ar-NO2NO2:1550~1510(s) NO2:1365~1335(s)CN:860~840(s)不明:≈750(s)吡啶类CH:≈3030(w)C=C及C=N:1667~1430(m) CH:1175~1000(w) CH:910~665(s)嘧啶类CH:3060~3010(w) C=C及C=N:1580~1520(m) CH:1000~960(m) CH:825~775(m)*表中vs,s,m,w,vw用于定性地表示吸收强度很强,强,中,弱,很弱。
主要官能团的红外吸收峰频率特征

νC━O━C在1330~1050cm-1有两个吸收带,即νasC=O和νsC━O━C。其中νasC=O在1330~1150cm-1,峰强大且宽,在酯的红外光谱中常为第一强峰。酯的νasC=O与结构有关。
内酯的νC=O与环的大小及共轭基团和吸电子取代基团的连接位置有关。羰基与双键个共轭时,νC=O频率减小;内酯的氧原子与双键连接时νC=O增大。α,β-不饱和内酯和γ-内酯常有两个νC=O吸收带,在~1780,~1755 cm-1附近。这是羰基的α位的δCH(881cm-1附近附近)的倍频与νC=O发生费米共振的结果。
仲酰胺
νNH吸收:在稀溶液中伯酰胺在有一个很尖的吸收,在仪器分辨率很高时,可以分裂为相似的双线,是由于顺反异构产生。在压片法或浓溶液中,仲酰胺的νNH可能会出现几个吸收带,这是由于顺反两种异构产生的靠氢键连接的多聚物所致。
νC=O:即酰胺Ⅰ带。仲酰胺在1680~1630cm-1有一个强吸收是νC=O,叫酰胺Ⅰ带。
δNH和νC━N之间偶合造成酰胺Ⅱ带和酰胺Ⅲ带。酰胺Ⅱ带在1570~1510cm-1。酰胺Ⅲ带在1335~1200cm-1。
其它:在和附近还会有酰胺的Ⅳ、Ⅴ、Ⅵ带,但应用上不如前面谱带那么重要
叔酰胺
叔酰胺的氮上没有质子,其唯一的特征谱带是νC=O,在1680~1630cm-1。
在955~915cm-1有一特征性宽峰,是酸的二聚体中OH···O=的面外变形振动引起的,可用于确认羧基的存在
νC=O高于酮的νC=O,这是OH的作用结果
羧酸盐中的━COO-无νC=O吸收。COO-是一个多电子的共轭体系, ,两个C=O振动偶合,故在两个地方出现其强吸收,其中反对称伸缩振动在1610~1560cm-1;对称伸缩振动在1440~1360cm-1,强度弱于反对称伸缩振动吸收,并且常是两个或三个较宽的峰。
常见官能团红外吸收特征频率表

常见官能团红外吸收特征频率表附录3 常见官能团红外吸收特征频率表吸收频率(cm-1)化合物类型官能团4000~2500 2500~2000 2000~15001500~900 900以下备注—CH32960,尖[70]2870,尖[30]1460,[<15]1380,[15]1.甲基氧、氮原⼦相连时,2870的吸收移向低波数2.借⼆甲基使1380的吸收产⽣双峰—CH22925,尖[75]2825,尖[45]1470,[8] 725~720[3]1.与氧、氮原⼦相连时,2850吸收移向低波数。
2.—(CH2)n—中,n>4时⽅有725~720的吸收,当n⼩时往⾼波数移动烷基△三员碳环3000~3080[变化]三员环上有氢时,⽅有此吸收—CH23080,[30] 2975,[中]—CH— 3020,[中]C—C 1675~1600[中~弱]共轭烯移向较低波数不饱和烃—CH—CH2990,尖[50] 910,尖[110]续表吸收频率(cm-1)化合物类型官能团4000~2500 2500~2000 2000~1500 1500~900900以下备注2000~1600,[5]当该区⽆别的吸收峰时,可见⼏个弱吸收峰900~850,[中]苯环上弧⽴氢(如苯环上五取代)860~800,尖[强]苯环上两个相邻氢,常出现在820~800处800~750,尖[强]苯环上有三个相邻氢770~730,尖[强]苯环上有四个或五个相邻氢苯环及稠芳环710~690,尖[强] 苯环单取代;1,3-⼆取代;1,3,5-及1,2,3-三取代时附加此吸收吡啶3075~3020尖[强]1620~1590[中]1500[中]920~720,尖[强]900以下吸收近似于苯环的吸收位置(以相邻氢的数⽬考虑)呋喃3165~3125[中,弱]~1600,~1500 ~1400吡咯3490,尖[强]3125~3100[弱]1600~1500[变化](两个吸收峰)NH产⽣的吸收—CH产⽣的吸收杂芳环噻吩 3125~3050 ~1520 ~1410 750~690,[强]续表吸收频率(cm-1)化合物类型官能团4000~2500 2500~2000 2000~1500 1500~900900以下备注游离态:存在于⾮极性溶剂的稀溶液中伯醇—CH2OH 3640,尖[70] 1050,尖[60~200]仲醇|CHOH—3630,尖[55]1100,尖[60~200]叔醇|C OH|——3620,尖[45]1150,尖[60~200]酚 3610,尖[中] 1200,尖[60~200]分⼦间氢键:同上⼆聚体 3600~3500 常被多聚体的吸收峰掩盖多聚体 3600,宽[强]分⼦内氢键:多元醇3600~3500 [50~100]-π氢键3600~3500 醇和酚聚合键3200~2500,宽[弱]续表吸收频率(cm-1)化合物类型官能团4000~25002500~20002000~1500 1500~900 900以下备注C—O—C 1150~1070,[强]—C—O—C 1275~1200,[强]1075~1020,[强]3050~3000[中,弱]环上有氢时⽅有此吸收峰1250,[强]950~810,[强]醚840~750,[强]链状饱和酮1725~1705,尖[300~600]环状酮⼤于七员环1720~1700,尖[极强]六员环1725~1705,尖[极强]五员环1750~1740,尖[极强]四员环1775,尖[极强]三员环1850,尖[极强]不饱和酮α,β-不饱和酮1685~1665,尖[极强]羰基吸收酮1650~1600,尖[极强]烯键吸收续表吸收频率(cm-1)化合物类型官能团4000~25002500~20002000~1500 1500~900 900以下备注Ar—CO—1700~1680,尖[极强]羰基吸收1670~1660,尖[极强]羰基吸收Ar CO Ar,,,-αβαβ′′——不饱和酮α-取代酮:α-卤代酮α-⼆卤代酮1745~1725,尖[极强]1765~1745,尖[极强]⼆酮:1730~1710,尖[极强]当两个羰基不相连时,基本上回复到链状饱和酮的吸收位置醌:1,2苯醌1690~1660,尖[极强]1,4苯醌酮草酮1650,尖[极强]饱和醛28020[弱],2720[弱]1740~1720,尖[极强]醛不饱和醛α,β-不饱和醛α,β,γ,δ-不饱和醛Ar—CHO1705~1680,尖[极强]1680~1660,尖[极强]1715~1695,尖[极强]续表吸收频率(cm-1)化合物类型官能团4000~2500 2500~20002000~1500 1500~900 900以下备注羰酸饱和羰酸 3000~2500,宽 1760[1500]1440~1395[中,强]1760为单体吸收1725~1700 [1500] 1320~1210[强]920宽[中]1725~1700为⼆聚体吸收,可能见到两个吸收,分别为单体及⼆聚体吸收α,β-不饱和腈1720[极强]1715~1690[极强]分别为单体及⼆聚体吸收Ar COOH —1700~1680 [极强]α-卤代羰酸1740~1720 [极强]饱和、链状酸酯1820[极强]1760[极强]1170~1045[极强]α,β-不饱和酸酐1775[极强] 1720[极强]六员环酸酐1800[极强]1750[极强]1300~1175[极强]酸酐五员环酸酐1865[极强]1785[极强]1300~1200[极强]羰酸酯饱和链状羰酸酯1750~1730,尖[500~1000]1300~1050(两个峰)[极强]。
最全的官能团化合物的红外吸收峰特征-h2o的红外吸收峰
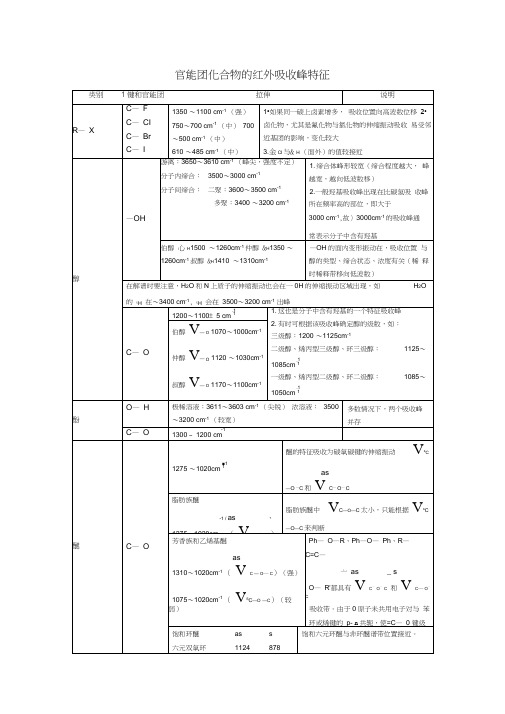
官能团化合物的红外吸收峰特征表15. 1曲型有机化合物的重要基团频率< /on-1)烷炬-CHI'uH: 2962±10(s)^SJ Q-.H50± 10(m)2872=10(3)6 滔:I375±5(s>-CH-2936 ± ID (s)&羽.打65±30侃Sb :朗国±L0(曲—~v Cc: 2S50* 10(a)& :H :~ 1340tv)>-<HHVCE ; 3040^3010 Gn) 1695-1 MOW® a ; 1310-1296 W770-^665 何HH Xv Cf=;3M(r-3O10(m) 性 Y 1695^1540 (v)y 970-960 (s)-C=C-H!>=: ^3300(*)^t =::22fl 0^21 OOM◎叫生 J1DD~ 3000(变);£^-2000^1S67(T )6CH: J 250^ 10DOM1165O^I43O(n)^^;?1C^6652^4-tlllS单取牝:770^ 730 (v?)^700 (s]哪惡取代,770-735(vs )间职取优.B10^75D(vs>72B-680(>)册 S6D®"对旣取代:80。
"TOO (vs)酹其R-CH":孤 3700^3300 (S)& ttt : 1*10^* 1260 Mv:0: 1250-1000 (s)酚类ArVH“葩:3705-3125(s)垠酸R-$-OH0 V CH2 22820,22720(”)双旌k c«: 3400^2500(R)S—汪频"":S450 (w)胺-HH卜肚:3500~3300(n)-HH^XH-3500-3300 (m) v c<:1650-1430(m)叫y: a 1715(vs)"x:2 1725(vs)v c<: 1740^169C (m)%E:】850~18EO(S)% k: 1780〜1740(s)A CY:1770~1720(S)6XH:165O~1590(S・2^XH- 1650-1553 (vw)Y OH: 750- 650 (s)6K:1390~13155)1335〜1165(s)v.o: 1230-1010(s)酰竣_V_NH2n 叫曲2 3350® J:1680~1650(s) 6:K:1450^1410(V) v:o: 1266-1205 (I0 fo:1170~1050(s)v:oc: 1300-1000(s)^CN(!gW):1220- 1020 (m.w)f (芳§):1340-1250 (s)(脂肪):1220- 1020 (m,w)a ex(芳香)7350- 1280 (s)k CN: 1420-1400(B)E096〜000=芒93 S99-OI6普 a (3002〜P 二 393S ?2 0S-O98召、 0)3£2〜ss d E f 338宁S 2茂A t y3S 9〜OSL0A (60£龙〜2.991 (S O E -O S U 娶空3 S 1S T 8^? (S O P &〜s Z T F y(S)06U 〜OI2JE 2-019二匕、 g g -巴zoqueaeq(s )〔s I 〜s 9p (M o s e〜08C 芒一ZCN-K异<M 乍S I tnM ffi a m ? f f i x l rc 器c 負—I(S )O R ?\XHNIg —誓感工城旺AAWSS-聚-Rg中红外光谱区一般划分为官能团区和指纹区两个区域,而每个区域又可以分为若干个波段。
常见官能团的红外吸收范围
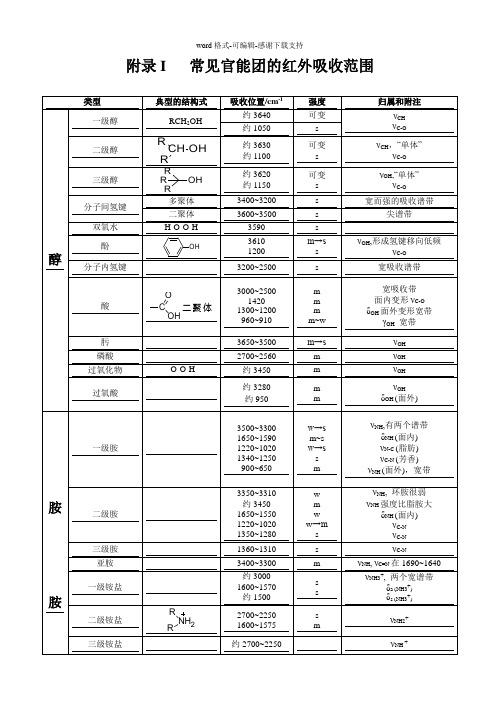
吸收位置/cm-1 约 3640 约 1050
约 3630 约 1100
约 3620 约 1150
3400~3200 3600~3500
3590 3610 1200
3200~2500
O C 二聚体
OH
3000~2500 1420
1300~1200 960~910
-O-O-H
3650~3500 2700~2560
vs
R N CO
1400~1350
w
2200~2100
s
RNC
1594
w
1715~1710
vs
1325~1215
s
约 1100
m
1675±10
vs
1735±10
vs
1725±10
vs
1700±10
vs
1640~1540
vs
1690±10
vs
1225~1075
s
1300
m
1665±5
vs
1645±10
δa (CH3)
νa (CH2) νs (CH2) δCH2 r (CH2) n≥4 时出现此带 νa (CH2) νs (CH2) 骨架振动 νa (CH2) 骨架振动
δCH2
δCH2 骨架振动
基
环氧乙烷
酮
酸 烯炔
硫化物 卤代烷
叁
炔
键
和
腈
累
重氮盐
积
双
丙二烯
键 烯酮
叠氮
异氰酸酯 异腈
羰
脂酮
α, β-不饱和酮
附录 I
word 格式-可编辑-感谢下载支持
常见官能团的红外吸收范围
常见官能团红外吸收特征频率表

续表 化合物类型 官 能 | —C 团 4000~2500 CH 2 965,尖[100] 800~650, [40~100] 840~800, 尖[40] 3300,尖[100] 2140~2100,[5] 2260~2190,[1] 1600, 尖[<100] 苯环及稠芳 环 C—C 1580[变] 1500, 尖[<100] —CH 3030[<60] 1450,[中] 末端炔基 中间炔基 常出峰于 730~675 吸收频率(cm ) 2500~2000 2000~1500 1500~900 900 以下 895, 尖[100~150]
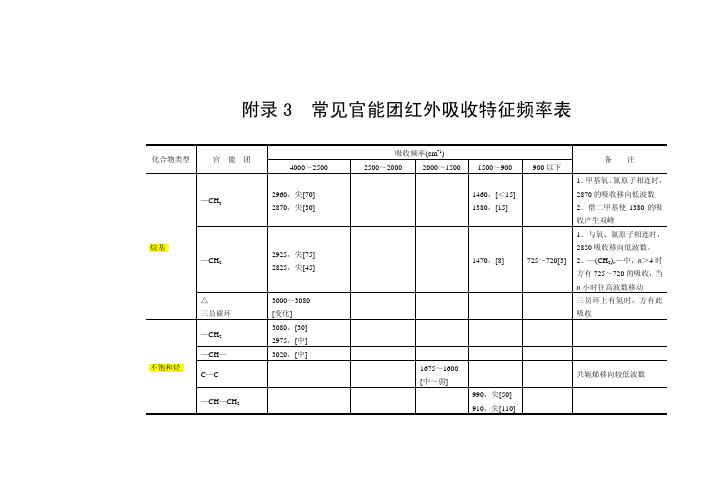
附录 3 常见官能团红外吸收特征频率表
化合物类型 官 能 团 吸收频率(cm-1) 4000~2500 2960,尖[70] 2870,尖[30] 2500~2000 2000~1500 1500~900 1460,[<15] 1380,[15] 900 以下 备 注
1. 甲基氧、 氮原子相连时, —CH3 2870 的吸收移向低波数 2.借二甲基使 1380 的吸 收产生双峰 1.与氧、氮原子相连时, 烷基 —CH2 2925,尖[75] 2825,尖[45] 2850 吸收移向低波数。 1470,[8] 725~720[3] 2.—(CH2)n—中,n>4 时 方有 725~720 的吸收, 当 n 小时往高波数移动 △ 三员碳环 —CH2 —CH— 不饱和烃 C—C —CH—CH2 3000~3080 [变化] 3080,[30] 2975,[中] 3020,[中] 1675~1600 [中~弱] 990,尖[50] 910,尖[110] 共轭烯移向较低波数 三员环上有氢时,方有此 吸收
吡啶
杂芳环
呋喃
吡咯 噻吩
续表 化合物类型 官 能 团 吸收频率(cm ) 4000~2500 2500~2000 2000~1500 1500~900 900 以下 液中 3640,尖[70] 1050,尖 [60~200]
红外吸收光谱特征峰特别整理版
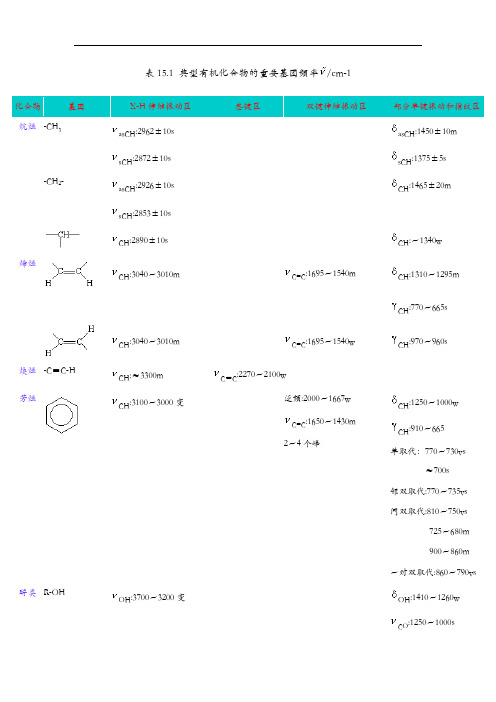
表15.1 典型有机化合物的重要基团频率/cm-1化合物基团X-H伸缩振动区叁键区双键伸缩振动区部分单键振动和指纹区烷烃-CH3asCH:2962±10s asCH:1450±10msCH:2872±10s sCH:1375±5s-CH2-asCH:2926±10s CH:1465±20msCH:2853±10sCH:2890±10s CH:~1340w烯烃CH:3040~3010m C=C:1695~1540m CH:1310~1295mCH:770~665sCH:3040~3010m C=C:1695~1540w CH:970~960s炔烃-C≡C-HCH:≈3300m C≡C:2270~2100w芳烃CH:3100~3000变泛频:2000~1667wC=C:1650~1430m2~4个峰CH:1250~1000w CH:910~665单取代:770~730vs≈700s邻双取代:770~735vs 间双取代:810~750vs725~680m900~860m ~对双取代:860~790vs醇类R-OHOH:3700~3200变OH:1410~1260wCO:1250~1000sOH :750~650s酚类 Ar-OHOH :3705~3125sC=C :1650~1430mOH :1390~1315mCO :1335~1165s脂肪醚 R-O-R 'CO :1230~1010s酮C=O :≈1715vs醛CH :≈2820;≈2720w双峰C=O :≈1725vs羧酸OH :3400~2500mC=O :1740~1690mOH :1450~1410w CO :1266~1205m酸酐C=O :1850~1880s C=O :1780~1740sCO :1170~1050s酯泛频C=O :≈3450wC=O :1770~1720sCOC :1300~1000s胺-NH 2NH2:3500~3300m双峰NH :1650~1590s;m CN 脂肪:1220~1020m;wCN 芳香:1340~1250s-NHNH :3500~3300mNH :1650~1550vwCN 脂肪:1220~1020m;wCN 芳香:1350~1280s酰胺asNH :≈3350sC=O :1680~1650sCN :1420~1400msNH :≈3180sNH :1650~1250sNH2:750~600mNH:≈3270sC=O :1680~1630sNH +CN :1750~1515mCN +NH :1310~1200mC=O:1670~1630 酰卤C=O:1810~1790s腈-C≡NC≡N:2260~2240s硝基化合物R-N02NO2:1565~1543s NO2:1385~1360sCN:920~800mAr-NO2NO2:1550~1510s NO2:1365~1335sCN:860~840s不明:≈750s吡啶类CH:≈3030w C=C及C=N:1667~1430m CH:1175~1000w CH:910~665s嘧啶类CH:3060~3010w C=C及C=N:1580~1520m CH:1000~960m CH:825~775m表中vs;s;m;w;vw用于定性地表示吸收强度很强;强;中;弱;很弱..中红外光谱区一般划分为官能团区和指纹区两个区域;而每个区域又可以分为若干个波段..官能团区官能团区或称基团频率区波数范围为4000~1300cm-1; 又可以分为四个波段..★4000~2500cm-1为含氢基团x—Hx为O、N、C的伸缩振动区;因为折合质量小;所以波数高;主要有以下五种基团吸收●醇、酚中O—H:3700~3200cm-1;无缔合的O—H在高一侧;峰形尖锐; 强度为s缔合的O—H在低一侧; 峰形宽钝; 强度为s●羧基中O—H:3600~2500cm-1;无缔合的O—H在高一侧;峰形尖锐; 强度为s缔合可延伸至2500 cm-1;峰非常宽钝; 强度为s●N —H:3500~3300 cm-1; 伯胺有两个H;有对称和非对称两个峰; 强度为s—m叔胺无H;故无吸收峰●C—H:<3000 cm-1为饱和C:~2960 cm -1;~2870 cm-1强度为m-s~2925 cm-1;~2850 cm-1强度为m-s~2890 cm-1强度为w>3000 cm-1为不饱和C:及苯环上C-H3090~3030cm-1强度为m~3300 cm-1强度为m●醛基中C—H:~2820及~2720两个峰强度为m-s★2500~2000 cm-1为叁键和累积双键伸缩振动吸收峰;主要包括-C≡C-、-C≡N叁键的伸缩振动及、等累积双键的非对称伸缩振动;呈现中等强度的吸收..在此波段区中;还有S—H、Si—H、P—H、B—H的伸缩振动..★2000~1500 cm-1为双键的伸缩振动吸收区;这个波段也是比较重要的区域;主要包括以下几种吸收峰带..●C=O伸缩振动;出现在1960~1650 cm-1;是红外光谱中很特征的且往往是最强的吸收峰;以此很容易判断酮类、醛类、酸类、酯类、酸酐及酰胺、酰卤等含有C=O的有机化合物..●C=N、C=C、N=O的伸缩振动;出现在1675~1500 cm-1..在这波段区中;单核芳烃的C=C骨架振动呼吸呈现2~4个峰中等至弱的吸收的特征吸收峰;通常分为两组;分别出现在1600 cm -1和1500 cm-1左右;在确定有否芳核的存在时具有重要意义..●苯的衍生物在2000~1670 cm-1波段出现C—H面外弯曲振动的倍频或组合数..由于吸收强度太弱;应用价值不如指纹区中的面外变形振动吸收峰;如图15.9所示..如在分析中有必要;可加大样品浓度以提高其强度..图15.9 苯环取代类型在2000~1667cm-1和900~600cm-1的谱形★1500~1300 cm-1饱和C—H变形振动吸收峰;—CH3出现在1380及1450 cm-1两个峰;出现在1470 cm-1;出现在1340 cm-1..这些吸收带强度均为m至w ..指纹区指纹区:波数范围为1300~600cm-1..指纹区可以分为两个波段:★1300~900cm-1这个波段区的光谱信息很丰富;较为主要的有如下几种:●几乎所有不含H的单键的伸缩振动;如C—O、C—N、C—S、C—F、C—P、Si—O、P—O等;其中C—O的伸缩振动在1300~1000cm-1;是该区吸收最强的峰;较易识别..●部分含H基团的弯曲振动;如RCH=CH2;端烯基C—H弯曲振动为990、910cm-1的两个吸收峰;RCH=CHR反式结构的C—H吸收峰为970 cm-1顺式为690 cm-1等..●某些较重原子的双键伸缩振动;如C=S、S=O、P=O等..此外;某些分子的整体骨架振动也在此区产生吸收..★900~600cm-1这波段中较为有价值的两种特征吸收:●长碳链饱和烃;;n≥4时;呈现722cm-1有一中至强的吸收峰;n减小时; 变大;●苯环上C—H面外变形振动吸收峰的变化;可以判断取代情况;此区域的吸收峰比泛频带2000~1670cm-1灵敏;因此更具使用价值;见图15.9所示..其吸收峰位置为:无取代的6个C—H;670~680cm-1;单吸收带;苯:单取代苯:5个C—H;690~700cm-1;740~750cm-1;两个吸收带;邻位双取代4个C—H;740~750cm-1;单吸收带;苯:间位双取代3个C—H;690~700cm-1;780~800cm-1;两个吸收带;苯:另一个C—H;~860cm-1;弱带;供参考;对位双取代2个C—H;800~850cm-1;单吸收带..苯:这些吸收带的强度为中等有时强。
(完整版)红外主要官能团对应谱图

主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~11403.33~3.523.37~3.473.49~3.526.71~7.418.00~8.77中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~9653.23~3.335.90~6.137.00~7.759.90~15.410.05~10.1510.99~11.0513.70~15.3810.20~10.36中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~3.034.41~4.767.94~8.0315.50~16.25中中强四、取代苯类CH伸泛频峰骨架振动(CC)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~6653.23~3.335.00~6.006.25±0.086.67±0.106.33±0.046.90±0.108.00~10.0010.99~15.03变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~86012.99~13.7012.99~13.7012.35~13.3311.12~11.6311.63~12.5012.35~13.3311.44~11.9811.30~11.6311.63~12.5011.63~12.5011.63~12.5011.56~12.35~11.63极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢五、醇类、酚类OH伸OH弯(面内)C—O伸O—H弯(面外)3700~32001410~12601260~1000750~6502.70~3.137.09~7.937.94~10.0013.33~15.38变弱强强液态有此峰OH伸缩频率游离OH分子间氢键分子内氢键OH弯或C—O伸伯醇(饱和)仲醇(饱和)叔醇(饱和)酚类(ФOH)OH伸OH伸OH伸(单桥)OH弯(面内)C—O伸OH弯(面内)C—O伸OH弯(面内)C—O伸OH弯(面内)Ф—O伸3650~35903500~33003570~3450~14001250~1000~14001125~1000~14001210~11001390~13301260~11802.74~2.792.86~3.032.80~2.90~7.148.00~10.00~7.148.89~10.00~7.148.26~9.097.20~7.527.94~8.47强强强强强强强强强中强锐峰钝峰(稀释向低频移动*)钝峰(稀释无影响)六、醚类C—O—C伸1270~1010 7.87~9.90 强或标C—O伸脂链醚脂环醚芳醚(氧与芳环相连)C—O—C伸C—O—C伸(反称)C—O—C伸(对称)=C—O—C伸(反称)=C—O—C伸(对称)CH伸1225~10601100~1030980~9001270~12301050~1000~28258.16~9.439.09~9.7110.20~11.117.87~8.139.52~10.00~3.53强强强强中弱氧与侧链碳相连的芳醚同脂醚O—CH3的特征峰七、醛类(—CHO)CH伸C=O伸CH弯(面外)2850~27101755~1665975~7803.51~3.695.70~6.0010.2~12.80弱很强中一般~2820及~2720cm-1两个带饱和脂肪醛α,β-不饱和醛芳醛C=O伸C=O伸C=O伸~1725~1685~1695~5.80~5.93~5.90强强强八、酮类OC C=O伸C—C伸泛频1700~16301250~10303510~33905.78~6.138.00~9.702.85~2.95极强弱很弱脂酮饱和链状酮α,β-不饱和酮β二酮芳酮类Ar—CO C=O伸C=O伸C=O伸C=O伸C=O伸1725~17051690~16751640~15401700~16301690~16805.80~5.865.92~5.976.10~6.495.88~6.145.92~5.95强强强强强C=O与C=C共轭向低频移动谱带较宽二芳基酮1-酮基-2-羟基(或氨基)芳酮脂环酮四环元酮五元环酮六元、七元环酮C =O 伸C =O 伸C =O 伸C =O 伸C =O 伸1670~1660 1665~1635~1775 1750~1740 1745~1725 5.99~6.02 6.01~6.12~5.63 5.71~5.75 5.73~5.80 强强强强强九、羧酸类(—COOH )OH 伸C =O 伸OH 弯(面内)C —O 伸OH 弯(面外)3400~2500 1740~1650 ~1430 ~1300 950~9002.94~4.00 5.75~6.06 ~6.99 ~7.69 10.53~11.11中强弱中弱在稀溶液中,单体酸为锐峰在~3350cm -1;二聚体为宽峰,以~3000cm -1为中心脂肪酸R —COOH α,β-不饱和酸芳酸C =O 伸C =O 伸C =O 伸1725~1700 1705~1690 1700~16505.80~5.88 5.87~5.91 5.88~6.06强强强氢键十、酸酐链酸酐C =O 伸(反称)C =O 伸(对称)C —O 伸1850~1800 1780~1740 1170~1050 5.41~5.56 5.62~5.75 8.55~9.52 强强强共轭时每个谱带降20 cm-1环酸酐(五元环)C =O 伸(反称)C =O 伸(对称)C —O 伸1870~1820 1800~1750 1300~1200 5.35~5.49 5.56~5.71 7.69~8.33 强强强共轭时每个谱带降20cm-1十一、酯类C OR OC =O 伸(泛频)C =O 伸C —O —C 伸~3450 1770~1720 1280—1100~2.90 5.65~5.81 7.81~9.09弱强强多数酯C =O 伸缩振动正常饱和酯α,β-不饱和酯δ-内酯γ-内酯(饱和)β-内酯C =O 伸C =O 伸C =O 伸C =O 伸C =O 伸1744~1739 ~1720 1750~1735 1780~1760 ~1820 5.73~5.75 ~5.81 5.71~5.76 5.62~5.68 ~5.50 强强强强强十二、胺NH 伸NH 弯(面内)C —N 伸NH 弯(面外)3500~3300 1650~1550 1340~1020 900~650 2.86~3.03 6.06~6.45 7.46~9.80 11.1~15.4 中中强伯胺强,中;仲胺极弱伯胺类仲胺类叔胺类NH 伸(反称、对称)NH 弯(面内)C —N 伸NH 伸NH 弯(面内)C —N 伸C —N 伸(芳香)3500~3400 1650~1590 1340~1020 3500—3300 1650—1550 1350—1020 1360~10202.86~2.94 6.06~6.29 7.46~9.80 2.86—3.03 6.06—6.45 7.41—9.80 7.35~9.80中、中强、中中、弱中极弱中、弱中、弱双峰一个峰十三、酰胺(脂肪与芳香酰胺数据类似)NH伸C=O伸NH弯(面内)C—N伸3500~31001680~16301640~15501420~14002.86~3.225.95~6.136.10~6.457.04~7.14强强强中伯酰胺双峰仲酰胺单峰谱带Ⅰ谱带Ⅱ谱带Ⅲ伯酰胺仲酰胺叔酰胺NH伸(反称)(对称)C=O伸NH弯(剪式)C—N伸NH2面内摇NH2面外摇NH伸C=O伸NH弯+C—N伸C—N伸+NH弯C=O伸~3350~31801680~16501650~16201420~1400~1150750~600~32701680~16301570~15151310~12001670~1630~2.98~3.145.95~6.066.06~6.157.04~7.14~8.701.33~1.67~3.095.95~6.136.37~6.607.63~8.335.99~6.13强强强强中弱中强强中中两峰重合两峰重合十四、氰类化合物脂肪族氰α、β芳香氰α、β不饱和氰C≡N伸C≡N伸C≡N伸2260~22402240~22202235~22154.43~4.464.46~4.514.47~4.52强强强十五、硝基化合物R—NO2 Ar—NO2NO2伸(反称)NO2伸(对称)NO2伸(反称)NO2伸(对称)1590~15301390~13501530~15101350~13306.29~6.547.19~7.416.54~6.627.41~7.52强强强强。
红外主要官能团对应谱图

红外主要官能团对应谱图各种基团都有其独特的红外光谱特征,这些特征可以用于鉴定化合物的结构和组成。
下面列出了主要基团的红外特征吸收峰。
一、烷烃类基团的红外特征吸收峰包括CH伸、CH伸(反称)、CH伸(对称)、CH弯(面内)和C-C伸等。
这些振动类型的波数范围分别为3000~2843 cm-1、2972~2880 cm-1、2882~2843 cm-1、1490~1350 cm-1和1250~1140 cm-1.二、烯烃类基团的红外特征吸收峰包括CH伸、C=C伸、CH弯(面内)和CH弯(面外)等。
这些振动类型的波数范围分别为3100~3000 cm-1、1695~1630 cm-1、1430~1290cm-1和1010~650 cm-1.此外,单取代和双取代烯烃类基团的吸收峰也有所不同,顺式和反式烯烃类基团的吸收峰也有所不同。
三、炔烃类基团的红外特征吸收峰包括CH伸、C≡C伸、CH弯(面内)和CH弯(面外)等。
这些振动类型的波数范围分别为2270~2100 cm-1、1260~1245 cm-1、645~615 cm-1和3100~3000 cm-1.四、取代苯类基团的红外特征吸收峰包括泛频峰、骨架振动(νC=C)、CH弯(面内)和CH弯(面外)等。
这些振动类型的波数范围分别为2000~1667 cm-1、1600±20 cm-1、1500±25 cm-1和1450±20 cm-1.此外,单取代、邻双取代、间双取代和对双取代取代苯类基团的吸收峰也有所不同,1,2,3-三取代、1,3,5-三取代和1,2,4-三取代取代苯类基团的吸收峰也有所不同。
总之,红外光谱分析是一种非常有用的手段,可以用于鉴定化合物的结构和组成。
各种基团的红外特征吸收峰可以提供重要的信息,帮助我们更好地理解化学反应和分析化合物。
以下是格式错误已经删除的文章:CH弯(面外)的取代位置有很多种,其中包括1,2,3,4四个取代位和1,2,4,5四个取代位等。
(详细版)红外各官能团特征峰对照表

(详细版)红外各官能团特征峰对照表
本文档旨在提供红外各官能团特征峰的对照表。
以下是各种常见官能团的红外特征峰及其对应的波数范围:
羟基官能团
- 醇:3330 – 3280 cm^-1
- 酚:3600 – 3200 cm^-1
羰基官能团
- 酮:1720 – 1710 cm^-1
- 酸:1710 – 1690 cm^-1
- 酯:1750 – 1735 cm^-1
- 醛:1740 – 1720 cm^-1
氨基官能团
- 氨:3350 – 3300 cm^-1
- 氨基丙烯酸:1660 – 1650 cm^-1
硫醇官能团
- 巯基:2550 – 2530 cm^-1
- 磺酸:1350 – 1200 cm^-1
硝基官能团
- 硝基酸:1560 – 1545 cm^-1
- 亚硝基:1650 – 1600 cm^-1
苯环官能团
- 间位取代:1600 – 1580 cm^-1
- 邻位取代:1530 – 1500 cm^-1
请注意,以上波数范围仅为常见情况下的大致范围,具体情况可能会有一定的变化。
此处列出的波数范围仅供参考,应结合实际红外光谱数据进行分析和判断。
红外各官能团的特征峰对照表将对化学分析、有机合成等领域的研究和实验提供重要参考。
望本文档能为相关领域的研究人员和实验人员提供便利。
---
注:本文档中列出的内容为常见情况下的特征峰和波数范围,但不排除有特殊情况的存在。
在进行具体分析时,请结合实际情况以及相关文献进行判断和验证。
红外吸收光谱特征峰特别整理版

表15.1 典型有机化合物的重要基团频率(/cm-1)化合物基团X-H伸缩振动区叁键区双键伸缩振动区部分单键振动和指纹区烷烃-CH3asCH:2962±10(s) asCH:1450±10(m)sCH:2872±10(s)sCH:1375±5(s)-CH2-asCH:2926±10(s)CH:1465±20(m)sCH:2853±10(s)CH:2890±10(s)CH:~1340(w)烯烃CH:3040~3010(m) C=C:1695~1540(m) CH:1310~1295(m)CH:770~665(s)CH:3040~3010(m) C=C:1695~1540(w) CH:970~960(s)炔烃-C≡C-HCH:≈3300(m) C≡C:2270~2100(w)芳烃CH:3100~3000(变)泛频:2000~1667(w)C=C:1650~1430(m)2~4个峰CH:1250~1000(w) CH:910~665单取代:770~730(vs)≈700(s)邻双取代:770~735(vs) 间双取代:810~750(vs)725~680(m)900~860(m) ~对双取代:860~790(vs)醇类R-OHOH:3700~3200(变) OH:1410~1260(w)CO:1250~1000(s)OH:750~650(s) 酚类Ar-OHOH:3705~3125(s) C=C:1650~1430(m) OH:1390~1315(m)CO:1335~1165(s)脂肪醚R-O-R'CO:1230~1010(s)酮C=O:≈1715(vs)醛CH:≈2820,≈2720(w)双峰C=O:≈1725(vs)羧酸OH:3400~2500(m) C=O:1740~1690(m) OH:1450~1410(w)CO:1266~1205(m)酸酐C=O:1850~1880(s)C=O:1780~1740(s)CO:1170~1050(s)酯泛频C=O:≈3450(w) C=O:1770~1720(s) COC:1300~1000(s)胺-NH2NH2:3500~3300(m)双峰NH:1650~1590(s,m) CN(脂肪):1220~1020(m,w)CN(芳香):1340~1250(s)-NHNH:3500~3300(m) NH:1650~1550(vw) CN(脂肪):1220~1020(m,w)CN(芳香):1350~1280(s)酰胺asNH:≈3350(s) C=O:1680~1650(s) CN:1420~1400(m)sNH:≈3180(s) NH:1650~1250(s) NH2:750~600(m)NH:≈3270(s) C=O:1680~1630(s)NH+CN:1750~1515(m)CN+NH:1310~1200(m)C=O:1670~1630酰卤C=O:1810~1790(s)腈-C≡NC≡N:2260~2240(s)硝基化合物R-N02NO2:1565~1543(s) NO2:1385~1360(s)CN:920~800(m)Ar-NO2NO2:1550~1510(s) NO2:1365~1335(s)CN:860~840(s)不明:≈750(s)吡啶类CH:≈3030(w) C=C及C=N:1667~1430(m) CH:1175~1000(w) CH:910~665(s)嘧啶类CH:3060~3010(w) C=C及C=N:1580~1520(m) CH:1000~960(m) CH:825~775(m)*表中vs,s,m,w,vw用于定性地表示吸收强度很强,强,中,弱,很弱。
总结 红外光谱频率与官能团特征吸收峰分析

红外波谱分子被激发后,分子中各个原子或基团(化学键)都会产生特征的振动,从而在特点的位置会出现吸收。
相同类型的化学键的振动都是非常接近的,总是在某一范围内出现。
常见官能团的红外吸收频率整个红外谱图可以分为两个区,4000~1350区是由伸缩振动所产生的吸收带,光谱比较简单但具有强烈的特征性,1350~650处指纹区。
通常,4000~2500处高波数端,有与折合质量小的氢原子相结合的官能团O-H, N-H, C-H, S-H 键的伸缩振动吸收带,在2500-1900波数范围内常常出现力常数大的三件、累积双键如:- C≡C-,- C≡N, -C=C=C-, -C=C=O, -N=C=O等的伸缩振动吸收带。
在1900以下的波数端有-C=C-, -C=O, -C=N-, -C=O等的伸缩振动以及芳环的骨架振动。
1350~650指纹区处,有C-O, C-X的伸缩振动以及C-C的骨架振动,还有力常数较小的弯曲振动产生的吸收峰,因此光谱非常复杂。
该区域各峰的吸收位置受整体分子结构的影响较大,分子结构稍有不同,吸收也会有细微的差别,所以指纹区对于用已知物来鉴别未知物十分重要。
有机化学有机化合物红外吸收光谱σ伸缩振动,δ面内弯曲振动,γ面外弯曲振动一、烷烃饱和烷烃IR光谱主要由C-H键的骨架振动所引起,而其中以C-H键的伸缩振动最为有用。
在确定分子结构时,也常借助于C-H键的变形振动和C-C键骨架振动吸收。
烷烃有下列四种振动吸收。
1、σC-H在2975—2845 cm-1范围,包括甲基、亚甲基和次甲基的对称与不对称伸缩振动2、δC-H在1460 cm-1和1380 cm-1处有特征吸收,前者归因于甲基及亚甲基C-H 的σas,后者归因于甲基C-H的σs。
1380 cm-1峰对结构敏感,对于识别甲基很有用。
共存基团的电负性对1380 cm-1峰位置有影响,相邻基团电负性愈强,愈移向高波数区,例如,在CH3F中此峰移至1475 cm-1。
常见官能团的红外吸收范围

类型
典型的结构式
吸收位置/cm-1
强度
归属和附注
醇
一级醇
RCH2OH
约3640
可变
νCH
νC-O
约1050
s
二级醇
约3630
约1100
可变
s
νCH,“单体”
νC-O
三级醇
约3620
约1150
可变
s
νOH,“单体”
νC-O
分子间氢键
多聚体
3400~3200
s
宽而强的吸收谱带
m
m
νNH,缔合在3300
δNH3070为倍频
内酰胺
3440
m
νNH
甲
基
烷烃
2960±10
2870±10
1450±20
1375±15
m~s
m
m
m~s
νa(CH3)
νs(CH3)
δa(CH3)
δs(CH3)很特征
异丙基
1385~1365
1170~1140
m
m~s
δs(CH3)双谱带
骨架振动
叔丁基
1395~1365
约1500
s
s
νNH3+,两个宽谱带
δa(NH3+)
δs(NH3+)
二级铵盐
2700~2250
1600~1575
s
m
νNH2+
三级铵盐
约2700~2250
νNH+
四级铵盐
R4N+
没有特征吸收
一级酰胺
3500~3400
1640~1600
官能团红外吸收特征频率表
900 以下
2000~1600,[5]
900~850, [中] 860~800, 尖[强] 800~750, 尖[强] 770~730, 尖[强]
710~690, 尖[强]
1620~1590[中] 1500[中]
920~720, 尖[强]
续表
备注
当该区无别的吸收峰时,可 见几个弱吸收峰 苯环上弧立氢(如苯环上五 取代) 苯环上两个相邻氢,常出现 在 820~800 处
官能团
异硫氰酸酯
R—N C S Ar—N C S
亚胺 肟 重氰
硝基
—N N R —NO2 Ar —NO 2
硝酸酯 亚硝基 亚硝酸酯
—O—NO2 — NO — ONO
4000~2500
吸收频率(cm-1)
2500~2000
2000~1500
2140~1990,
尖[极强]
2130~2040,
尖[极强]
1690~1630,[中]
续表 备注
共轭时移向低波数方向 3650~3500 的吸收在缔 合时移向低波数方向
化合物类型
官能团
硫醇, —SH
4000~2500 2600~2550[弱]
亚砜
含硫化合物 砜
卤化物
磺酸盐 R —SO3−M+
磺酰胺
C—F C—Cl C—Br C—I
2500~2000
吸收频率(cm-1) 2000~1500
α,β-不饱和酰氯
酰胺
伯酰胺 —CONH2
4000~2500 2500~2000
吸收频率(cm-1) 2000~1500
1500~900
1780~1760[极强]
1610~1550[强] 1815~1770,尖[极强]
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-1
备注
α-取代酮: α-卤代酮 α-二卤代酮
酮 二酮:
1745~1725,尖[极强] 1765~1745,尖[极强] 当两个羰基不相连时, 1730~1710,尖[极强] 基本上回复到链状饱和 酮的吸收位置
醌: 1,2 苯醌 1,4 苯醌 草酮 饱和醛 醛 不饱和醛 28020[弱], 2720[弱]
-1
备
注
当该区无别的吸收峰时, 可 见几个弱吸收峰 苯环上弧立氢(如苯环上五 取代) 苯环上两个相邻氢, 常出现 在 820~800 处 苯环上有三个相邻氢 苯环上有四个或五个相邻 氢 苯环单取代; 1, 3-二取代; 1,3,5-及 1,2,3-三取 代时附加此吸收 900 以下吸收近似于苯环 的吸收位置(以相邻氢的数 目考虑)
-1
备注
α,β-不饱和酮
续表 化合物类型 官 能 团 Ar—CO—
⎧Ar —CO —Ar ⎨ ⎩α , β ,α ′, β ′-不饱和酮
吸收频率(cm ) 4000~2500 2500~2000 2000~1500 1700~1680,尖[极强] 1670~1660,尖[极强] 1500~900 900 以下 羰基吸收 羰基吸收
π- 氢键
聚合键
续表 化合物类型 官 能 团 C—O—C —C—O—C 3050~3000 醚 [中,弱] 1250,[强] 950 ~ 810 , [强] 840 ~ 750 ,环 酮 五员环 四员环 三员环 不饱和酮 1720~1700,尖[极强] 1725~1705,尖[极强] 1750~1740,尖[极强] 1775,尖[极强] 1850,尖[极强] 1685~1665,尖[极强] 1650~1600,尖[极强] 羰基吸收 烯键吸收 1725~1705, 尖[300~600] 吸收频率(cm ) 4000~2500 2500~2000 2000~1500 1500~900 1150~1070, [强] 1275~1200, [强] 1075~1020, [强] 环上有氢时方有此吸收峰 900 以下
1690~1660,尖[极强]
1650,尖[极强] 1740~1720,尖[极强] 1705~1680,尖[极强] 1680~1660,尖[极强] 1715~1695,尖[极强]
α,β-不饱和醛 α,β,γ,δ-不饱和醛
Ar—CHO
续表 化合物类型 羰酸 官 能 团 饱和羰酸 吸收频率(cm ) 4000~2500 3000~2500,宽 2500~2000 2000~1500 1760[1500] 1725~1700 [1500] 1720[极强] 1715~1690[极强] 1700~1680 [极强] 1740~1720 [极强] 1820[极强] 1760[极强] 1775[极强] 1720[极强] 1800[极强] 1750[极强] 1865[极强] 1785[极强] 1750~1730,尖 [500~1000] 1300~1175[极强] 1300~1200[极强] 1300~1050 (两个峰) [极强] 1170~1045[极强] 1500~900 1440~1395[中, 强] 1320~1210[强] 920 宽[中] 900 以下
续表 化合物类型 官 能 | —C 团 4000~2500 CH 2 965,尖[100] 800~650, [40~100] 840~800, 尖[40] 3300,尖[100] 2140~2100,[5] 2260~2190,[1] 1600, 尖[<100] 苯环及稠芳 环 C—C 1580[变] 1500, 尖[<100] —CH 3030[<60] 1450,[中] 末端炔基 中间炔基 常出峰于 730~675 吸收频率(cm ) 2500~2000 2000~1500 1500~900 900 以下 895, 尖[100~150]
| 叔醇 — C —OH |
3630,尖[55] 3620,尖[45] 3610,尖[中]
1100,尖 [60~200] 1150,尖 [60~200] 1200,尖 [60~200] 同上 常被多聚体的吸收峰掩盖
醇和酚
酚 分子间氢键: 二聚体 多聚体 分子内氢键: 多元醇
3600~3500 3600,宽[强] 3600~3500 [50~100] 3600~3500 3200~2500, 宽[弱]
吡啶
杂芳环
呋喃
吡咯 噻吩
续表 化合物类型 官 能 团 吸收频率(cm ) 4000~2500 2500~2000 2000~1500 1500~900 900 以下 液中 3640,尖[70] 1050,尖 [60~200]
-1
备
注
游离态:
存在于非极性溶剂的稀溶
伯醇—CH2OH
| 仲醇 — C HOH
附录 3 常见官能团红外吸收特征频率表
化合物类型 官 能 团 吸收频率(cm-1) 4000~2500 2960,尖[70] 2870,尖[30] 2500~2000 2000~1500 1500~900 1460,[<15] 1380,[15] 900 以下 备 注
1. 甲基氧、 氮原子相连时, —CH3 2870 的吸收移向低波数 2.借二甲基使 1380 的吸 收产生双峰 1.与氧、氮原子相连时, 烷基 —CH2 2925,尖[75] 2825,尖[45] 2850 吸收移向低波数。 1470,[8] 725~720[3] 2.—(CH2)n—中,n>4 时 方有 725~720 的吸收, 当 n 小时往高波数移动 △ 三员碳环 —CH2 —CH— 不饱和烃 C—C —CH—CH2 3000~3080 [变化] 3080,[30] 2975,[中] 3020,[中] 1675~1600 [中~弱] 990,尖[50] 910,尖[110] 共轭烯移向较低波数 三员环上有氢时,方有此 吸收
-1
备
注
反式二氢 顺式二氢 不饱和烃 三取代烯 ≡ CH — C ≡ C—
续表 化合物类型 官 能 团 吸收频率(cm ) 4000~2500 2500~2000 2000~1500 2000~1600,[5] 900~850, [中] 860~800, 苯环及稠芳 环 尖[强] 800~750, 尖[强] 770~730, 尖[强] 710~690, 尖[强] 3075~3020 尖[强] 3165~3125 [中,弱] 3490,尖[强] 3125~3100[弱] 3125~3050 1620~1590[中] 1500[中] ~1600,~1500 1600 ~ 1500[ 变 化](两个吸收峰) ~1520 ~1410 750~690, [强] ~1400 NH 产生的吸收—CH 产生 的吸收 920~720, 尖[强] 1500~900 900 以下
-1
备注 1760 为单体吸收 1725~1700 为二聚体吸 收,可能见到两个吸收, 分别为单体及二聚体吸 收
α,β-不饱和腈
Ar —COOH
分别为单体及二聚体吸 收
α-卤代羰酸
饱和、链状酸酯
α,β-不饱和酸酐
酸酐 六员环酸酐
五员环酸酐
羰酸酯
饱和链状羰酸酯
