化学仿制药参比制剂目录(第三十二批)(征求意见稿)
仿制药参比制剂目录(1-10批)

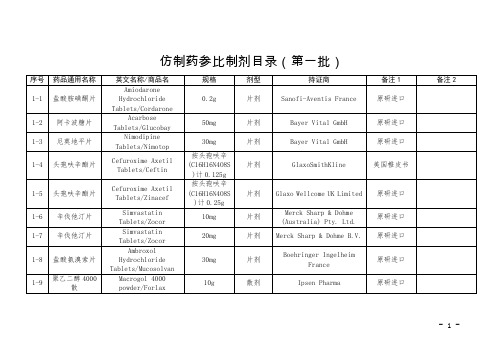
阿莫西林克拉维酸钾片
Amoxicillin and Clavulanate Potassium Tablets/Augmentin
0.625g(C16H19N3O5S 0.5g与C8H9NO5 0.125g)
片剂
Beecham Group Plc
原研进口
1-21
阿莫西林克拉维酸钾片
Amoxicillin and Clavulanate Potassium Tablets/Augmentin
5mg
片剂
OtsukaPharmaceuticalCo.Ltd
美国橙皮书
1-32
阿立哌唑片
AripiprazoleTablets/Abilify
10mg
片剂
OtsukaPharmaceuticalCo.Ltd
美国橙皮书
1-33
阿立哌唑口崩片
AripiprazoleOrally Disintegrating tablets/Abilify
1-42
硫唑嘌呤片
Azathioprine Tablets/Imuran
50mg
片剂
Aspen Pharmacare Australia Pty Ltd
原研进口
1-43
奈韦拉平片
Nevirapine Tablets/Viramune
0.2g
片剂
Boehringer Ingelheim Pharmaceuticals INC
Cefuroxime Axetil Tablets/Ceftin
按头孢呋辛(C16H16N4O8S)计0.5g
片剂
GlaxoSmithKline
美国橙皮书
2-4
头孢呋辛酯干混悬剂
国家食品药品监督管理总局关于征求化学仿制药生物等效性试验备案管理规定(征求意见稿)意见的公告

国家食品药品监督管理总局关于征求化学仿制药生物等效性试验备案管理规定(征求意见稿)意见的公告文章属性•【公布机关】国家食品药品监督管理总局•【公布日期】2015.11.06•【分类】征求意见稿正文国家食品药品监督管理总局关于征求化学仿制药生物等效性试验备案管理规定(征求意见稿)意见的公告(国家食品药品监督管理总局公告2015年第221号)为贯彻落实《国务院关于改革药品医疗器审评审批制度的意见》(国发〔2015〕44号),简化药品审批程序,食品药品监管总局组织起草了《化学仿制药生物等效性试验备案管理规定(征求意见稿)》,现向社会公开征求意见。
请将修改意见于2015年11月20日前通过电子邮件反馈至食品药品监管总局。
联系人:王晓刚、柳雨时联系电话:************电子邮箱:**************.cn特此公告。
附件:化学仿制药生物等效性试验备案管理规定(征求意见稿)国家食品药品监管总局2015年11月6日附件化学仿制药生物等效性试验备案管理规定(征求意见稿)第一章总则第一条为落实药品审评审批制度改革要求,优化仿制药审批流程,根据《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《药品注册管理办法》《药物非临床研究质量管理规范》《药物临床试验质量管理规范》等,制定本规定。
第二条在中华人民共和国境内以药品注册、仿制药质量疗效一致性评价为目的开展化学仿制药生物等效性试验(BE试验)的备案和监督管理,适用本规定。
第三条化学仿制药BE试验备案,是指化学仿制药BE试验备案申请人(以下简称申请人)在化学仿制药研究过程中,在国家食品药品监督管理总局指定的信息平台按照要求提交备案资料,获得备案号后自行开展并完成BE试验的全过程。
第四条申请人提出备案申请并开展BE试验属于药品申请受理前的自主研制阶段,申请人应按照药品注册或仿制药质量疗效一致性评价的相关法律法规和技术要求开展研究,对研究的合法性、合理性、科学性、伦理符合性承担全部责任。
仿制药参比制剂目录(CFDA)
1-44
米索前列醇片
Misoprostol Tablets/Cytotec
0.2mg
片剂
Pharmacia Limited
原研进口
1-45
马来酸依那普利片
Enalapril Maleate Tablets/Renitec
5mg
片剂
Merck Sharp & Dohme(Australia)Pty. Ltd.
10mg
片剂
Merck Sharp & Dohme (Australia) Pty. Ltd.
原研进口
1-7
辛伐他汀片
Simvastatin Tablets/Zocor
20mg
片剂
Merck Sharp & Dohme B.V.
原研进口
1-8
盐酸氨溴索片
Ambroxol Hydrochloride Tablets/Mucosolvan
50mg
片剂
Bayer Vital GmbH
原研进口
1-3
尼莫地平片
Nimodipine Tablets/Nimotop
30mg
片剂
Bayer Vital GmbH
原研进口
1-4
头孢呋辛酯片
Cefuroxime Axetil Tablets/Ceftin
按头孢呋辛(C16H16N4O8S)计0.125g
片剂
GlaxoSmithKline
美国橙皮书
1-5
头孢呋辛酯片
Cefuroxime Axetil Tablets/Zinacef
按头孢呋辛(C16H16N4O8S)计0.25g
片剂
化学仿制药参比制剂目录(第三十一批)

Topiramate Extended-release Capsules/Qudexy XR
100mg
Upsher Smith Laboratories LLC
未进口原研药品
美国橙皮书
31-26
托吡酯缓释胶囊
Topiramate Extended-release Capsules/Qudexy XR
25mg
Upsher Smith Laboratories LLC
未进口原研药品
美国橙皮书
31-24
托吡酯缓释胶囊
Topiramate Extended-release Capsules/Qudexy XR
50mg
Upsher Smith Laboratories LLC
未进口原研药品
美国橙皮书
31-25
0.25g
Glaxosmithkline S.P.A/Glaxosmithkline Laboratory
未进口原研药品
欧盟上市
31-35
注射用紫杉醇(白蛋白结合型)
Paclitaxel For Injection(Albumin Bound)/Abraxane
100mg
Abraxis Bioscience LLC
未进口原研药品
美国橙皮书
31-6
盐酸右哌甲酯片
Dexmethylphenidate Hydrochloride Tablets /Focalin
10mg
Novartis Pharmaceuticals Corporation
未进口原研药品
美国橙皮书
31-7
奥美沙坦酯氨氯地平氢氯噻嗪片
Olmesartan Medoxomil and Amlodipine and Hydrochlorothiazide Tablets/Tribenzor
CFDA发布的仿制药参比制剂目录汇总

Amoxicillin for Suspension/Clamoxyl Amoxicillin Capsules/Amoxil Amoxicillin Capsules/Amoxil Amoxicillin Chewable Tablets/Amoxicillin Amoxicillin Chewable Tablets/Amoxicillin Amoxicillin Chewable Tablets/Amoxicillin Amoxicillin Chewable Tablets/Amoxicillin Amoxicillin and Clavulanate Potassium for Suspension/Augmentin Amoxicillin and Clavulanate Potassium for Suspension/Augmentin
1-19 1-20 1-21 3-16
8-8 8-219 8-9 7-1 4-33 3-27 3-26 4-31 4-32 7-97 6-35 3-13 3-13 4-20 4-20 4-19 4-19 3-14 3-15 10-1 10-271 3-18 3-19 4-26
8-10 8-11 8-12 8-13 8-14
8-17
Aminobutyric Acid Tablets/GAMMALON Amlodipine Besylate and Atorvastatin Calcium Tablets/-Amlodipine Besylate and Atorvastatin Calcium Tablets/-Amlodipine Besylate and Atorvastatin Calcium Tablets/-Olanzapine Orally Disintegrating Tablets/ Zyprexa Olanzapine Orally Disintegrating Tablets/ Zyprexa Olanzapine Orally Disintegrating Tablets/ Zyprexa Olanzapine Orally Disintegrating Tablets/ Zyprexa Olanzapine Tablets/ Zyprexa Olanzapine Tablets/ Zyprexa Olanzapine Tablets/ Zyprexa Oxcarbazepine Tablets/Trileptal Oxcarbazepine Tablets/Trileptal Oxcarbazepine Tablets/Trileptal Orlistat Capsules/Alli Orlistat Capsules/Xenical
国家药监局关于发布仿制药参比制剂目录(第三十批)的通告

国家药监局关于发布仿制药参比制剂目录(第三十
批)的通告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2020.08.31
•【文号】国家药品监督管理局通告2020年第56号
•【施行日期】2020.08.31
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局通告
2020年第56号
国家药监局关于发布仿制药参比制剂目录(第三十批)的通
告
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第三十批)。
特此通告。
附件:仿制药参比制剂目录(第三十批)
国家药监局
2020年8月31日。
化学仿制药尚未发布参比制剂目录

Belcher Pharmaceuticals , LLC/BPI Labs, LLC
未进口原研药品
增加持证商BPI Labs, LLC
23-197
依折麦布瑞舒伐他汀钙片
Ezetimibe Rosuvastatin Calcium Film-Coated Tablet
依折麦布10mg/瑞舒伐他汀10mg
氯法齐明软胶囊
Clofazimine Soft Capsules /Lamprene
50mg
Novartቤተ መጻሕፍቲ ባይዱs Pharma AG
未进口原研药品
瑞士上市
69-27
氯法齐明软胶囊
Clofazimine Soft Capsules /Lamprene
100mg
Novartis Pharma AG
未进口原研药品
Oryz-Aspergillus Enzyme And Pancreatin Tablet/慷彼申/Combizym
每片含米曲菌酶提取物24mg,胰酶220mg
Bridging Pharma GmbH
国内上市的原研药品
原研进口
69-3
帕拉米韦氯化钠注射液
Peramivir and Sodium Chloride Injection/力纬
5-11
格列本脲片
Glibenclamide tablets/EUGLUCON
2.5mg
sanofi K.K./太陽ファルマ株式会社
日本上市原研
持证商发生变更,增加变更后的持证商太陽ファルマ株式会社
30-150
盐酸肾上腺素注射液/肾上腺素注射液
Epinephrine Injection/EPINEPHRINE
化学仿制药参比制剂目录(第三十批)(征求意见稿)【模板】
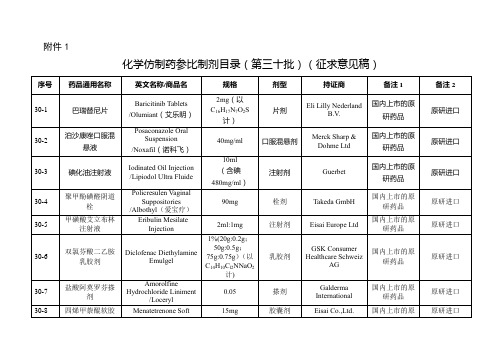
Fresenius Medical Care North America
未进口原研药品
美国橙皮书
30-29
地拉罗司片
Deferasirox Tablets/Jadenu
90mg
片剂
Novartis Pharmaceuticals Corporation
未进口原研药品
美国橙皮书
30-30
地拉罗司片
/Temodar
100mg
胶囊剂
Merck Sharp and Dohme Corp
未进口原研药品
美国橙皮书
30-45
替莫唑胺胶囊
Temozolomide Capsules
125μg
胶囊剂
IBSA Institut Biochimique SA
未进口原研药品
美国橙皮书
30-21
L-甲状腺素钠软胶囊
Levothyroxine Sodium Soft Capsules/Tirosint
137μg
胶囊剂
IBSA Institut Biochimique SA
未进口原研药品
美国橙皮书
氨氯地平5mg和阿托伐他汀40mg
片剂
Pfizer Inc
未进口原研药品
美国橙皮书
30-43
替莫唑胺胶囊
Temozolomide Capsules
/Temodar
20mg
胶囊剂
Merck Sharp and Dohme Corp
未进口原研药品
美国橙皮书
30-44
替莫唑胺胶囊
Temozolomide Capsules
30-16
L-甲状腺素钠软胶囊
仿制药参比制剂目录1-27批
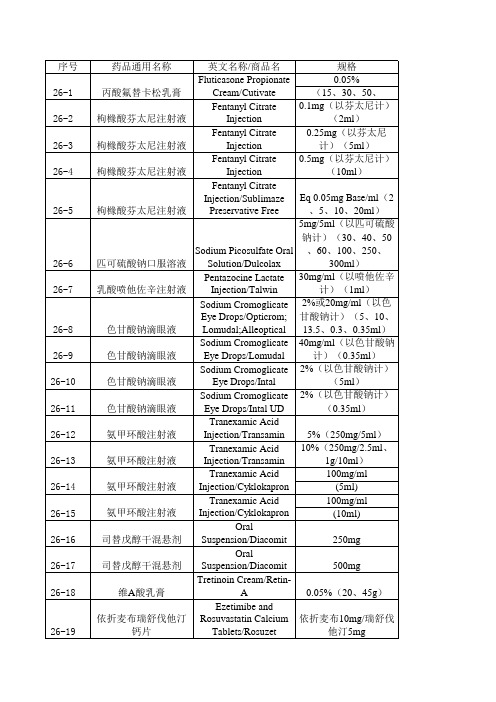
Tablets/Zyprexa
5mg
26-53 26-54 26-55 26-56 26-57 26-58 26-59 26-60 26-61 26-62 26-63 26-64 26-65 26-66 26-67 26-68
奥氮平片 奥氮平片 奥氮平片 奥氮平片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 奥氮平口崩片 阿哌沙班片
美奇)
75IU FSH+75IU LH
Indocyaninegreen for Injection/
OnIcd-aGnrseeetrnon Hydrochloride Injection/Zophren; OnZdaonfrsaentron Hydrochloride Injection/Zophren;
μg。(10ml)
Fat-Soluble Vitamin Injection(Ⅱ) /Vitalipid Adult; Vitalipide Adultes
1ml:维生素A 99μg、维 生素D2 0.5μg、维生素 E 910μg、维生素K1 15
μg。(10ml)
Highly Purified
Menotrophin for Injection/Menopur(贺
Arginine and Ibuprofen
精氨酸布洛芬颗粒
Granules/Spedifen;
Spididol
200mg(以布洛芬计)
地平10mg 阿齐沙坦20mg/氨氯地
TAazbilseatsrt/aZnacarnads Amlodipine
平2.5mg 阿齐沙坦20mg/氨氯地
仿制药质量和疗效一致性评价参比制剂备案与推荐程序(征求意见稿)剖析

附件仿制药质量与疗效一致性评价参比制剂备案与推荐程序(征求意见稿)为贯彻落实国务院办公厅《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)的任务要求,进一步明确参比制剂的选择流程,制定本备案与推荐程序。
一、本程序所述参比制剂备案与推荐工作,是指药品生产企业、行业协会、原研药品生产企业、国际公认的同种药物生产企业等作为申请人或推荐人,参照《普通口服固体制剂参比制剂选择和确定指导原则》,通过备案、推荐、申报等方式,选择参比制剂的过程。
二、药品生产企业可通过备案的方式选择参比制剂。
生产企业填写《参比制剂备案表》(附件1);撰写《综述资料》(附件4),详述参比制剂选择理由;提交所生产品种现行有效的批准证明文件,生产产品首次批准和上市后变更等历史沿革情况的说明。
三、行业协会可组织同品种生产企业提出参比制剂的推荐意见。
行业协会填写《参比制剂推荐表》(附件2);撰写《综述资料》(附件4),详述参比制剂选择理由;提交行业协会资质证明复印件、推荐过程记录与说明、相关同品种生产企业同意推荐的证明性文件。
四、原研药品生产企业、国际公认的同种药物生产企业其产品如可满足参比制剂的条件,可主动申报作为参比制剂。
生产企业填写《参比制剂申报表》(附件3);撰写《综述资料》(附件4),详述参比制剂选择理由;提供申报参比制剂品种近三年生产、销售情况说明。
进口原研药品申报参比制剂,申报者需同时提交生产证明、销售证明、出口证明等证明文件,及进口原研药品与其原产国上市药品一致的承诺书。
原研地产化药品申报参比制剂,申报者需同时提交原研地产化药品与原研药品一致的相关证明材料,具体要求见《原研地产化产品申报口服固体制剂参比制剂资料要求》(附件5)。
五、申请人或推荐人应对提交资料的真实性负责。
纸质版邮寄至中国食品药品检定研究院仿制药质量研究中心,并标注“一致性评价参比制剂备案与推荐材料”;电子版同时发送至cbzjbatj@,邮件标题为“申请人名称—参比制剂备案与推荐”。
化学仿制药参比制剂目录(第三十六批)(征求意见稿)【模板】

原研进口
36-10
吡仑帕奈片
Perampanel Tablets/Fycompa(卫克泰)
4mg
Eisai Europe Limited
国内上市的原研药品
原研进口
36-11
吡仑帕奈片
Perampanel Tablets/Fycompa
2mg
Eisai Inc
未进口原研药品
美国橙皮书
附件2
已发布化学仿制药参比制剂目录(增补)(征求意见稿)
序号
药品通用名称
英文名称/商品名
规格
持证商
备注1
备注2
36-34
双氯芬酸钠缓释片
Diclofenac Sodium extended release tablet/Voltaren SR 100
0.1g
Novartis Pharma AG
国内上市的原研药品
Palbociclib Tablets/Ibrance
75mg
Pfizer Inc
未进口原研药品
美国橙皮书
36-17
哌柏西利片
Palbociclib Tablets/Ibrance
100mg
Pfizer Inc
未进口原研药品
美国橙皮书
36-18
哌柏西利片
Palbociclib Tablets/Ibrance
150mg /15mL (10mg /mL)
Nabriva Therapeutics Ireland DAC
未进口原研药品
美国橙皮书
36-15
硫酸长春新碱注射液
Vincriscristine Sulfate Injection
化学仿制药参比制剂目录(第三十二批)(征求意见稿)
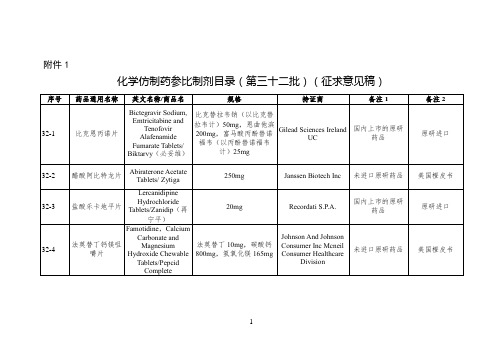
1g/20ml
Fresenius Kabi USA LLC
国际公认的同种药品
美国橙皮书
32-47
氟尿嘧啶注射液
Fluorouracil Injection/Fluorouracil
1g/20ml
AccordHealthcareINC
未进口原研药品
美国橙皮书
32-21
阿立哌唑口崩片
AripiprazoleOrally Disintegrating tablets/Abilify
15mg
Otsuka Pharmaceutical Co. Ltd
未进口原研药品
美国橙皮书
32-22
复方磺胺甲噁唑片
Compound Sulfamethoxazole Tablets/Bactrim
盐酸咪达普利片
Imidapril Hydrochloride Tablets/ Tanatril
2.5mg
田辺三菱製薬株式会社
未进口原研药品
日本上市
32-39
注射用阿莫西林钠克拉维酸钾
Amoxicillin Sodium and Clavulanate Potassium for injection(10:1)
Lidocaine Cataplasms/ Lidoderm
5%
Teikoku Pharma Usa Inc
未进口原研药品
美国橙皮书
32-28
洛索洛芬钠凝胶
Loxoprofen sodium hydrate gel
1%
第一三共株式会社
未进口原研药品
日本上市
32-29
6.化学仿制药参比制剂申请资料要求

二、参比制剂申请资料要求
附件1 .《化学仿制药参比制剂申请自查表》
1.药品通用名称 2.药物活性成分名称 3.剂型/规格
一、基本信息
4.原研是否明确
□是(需提供证据支持) 原研企业: 最早上市时间: 最早上市国家:
□否○
5.安全性、有效性是否明确
□是(需提供证据支持) □否★
二、参比制剂申请资料要求
化学仿制药参比制剂申请资料要求
国家药品监督管理局药品审评中心 2020年7月
一 参比制剂遴选工作进展
内
二 参比制剂申请资料要求
容
三 案例分析
一、参比制剂遴选工作进展
2016年 2019年
2016年3月国家局发布 《普通口服固体制剂参比制剂选择和确定指导原则》 (2016年第61号)
2019年3月国家局发布 《关于发布化学仿制药参比制剂遴选与确定程序的公告》 (2019年第25号)
工
作
提出拟推荐意见
模
优化
式
征求审评团队意见
申请人提交申请 工作组梳理 审评团队审核
专家委员会审议
药审中心公示,国家局发布
一、参比制剂遴选工作进展
为
公
参比制剂作为仿制药的标杆
众
参比制剂
提
供
研发
审评
高
质
量
的
为加快参比制剂遴选效率,更好地服务于申请人:
仿
制
《化学仿制药参比制剂遴选申请资料要求》
药
一 参比制剂遴选工作进展
二、拟申请参比制剂概况
6. 申 请 参 比 制□未发布参比制剂
□已发布/公示参比制剂存疑
剂原因
请填写已发布/公示参比制剂信息:
仿制药参比制剂目录(第三十一至四十批)

Guanfacine Hydrochloride Extended Release Tablets/
Intuniv Guanfacine Hydrochloride Extended Release Tablets/
Intuniv Guanfacine Hydrochloride Extended Release Tablets/
片
Tablets/Odefsey
Bimatoprost ophthalmic 31-24 贝美前列素涂剂
solution/Latisse
3ml:0.9mg
Allergan INC
31-25 奥泽沙星乳膏 Ozenoxacin Cream/Xepi 1%(10g、30g、45g)Ferrer Internacional SA
Intuniv
Lidocaine and Tetracaine Cream/Pliaglis
规格 15mg 30mg
1mg
持证商 Specgx LLC Specgx LLC
Shire Development Inc
2mg
Shire Development Inc
3mg
Shire Development Inc
Infants' Motrin
40mg:ml(15ml、 30ml)
Johnson And Johnson Consumer Inc Mcneil Consumer Healthcare
Divisioon
利巴韦林冻干粉 Ribavirin For Inhalation
31-17
6g
吸入剂
Solution/Virazole
化学仿制药参比制剂遴选申请资料要求(征求意见稿)2020.08

化学仿制药参比制剂遴选申请资料要求(征求意见稿)一、申请综述(一)品种基本信息1.药品通用名称2.药物活性成分名称3.剂型和规格4.适应症简述5.各国药典收载情况简要说明各国药典收载情况,并注明药典出版时间或版本号。
6.参比制剂发布/公示情况国家药品监督管理局已于第xx批《化学仿制药参比制剂目录》中发布本品种参比制剂,详见下表。
或本品国家药品监督管理局尚未发布参比制剂。
表xx:本品种已发布/已公示参比制剂情况表7.1原研是否明确是/否。
简要概述原研产品上市情况(建议包括但不限于原研企业,上市时间、最早上市国家、商品名、剂型、规格等)。
如持证商发生变更,请说明时间节点和变更情况。
应提供原研调研信息及相关证明性文件。
7.2临床安全有效性是否明确是/否。
简要概述原研药品上市前、后临床研究信息。
综上,本品属于(原研明确、疗效明确;原研不明、疗效明确;原研明确、疗效不明;原研不明、疗效不明)类化学药品。
(二)参比制剂申请依据根据《化学仿制药参比制剂遴选与确定程序》进行综合评估,包括但不限于以下内容:1.参比制剂申请原因如国家药品监督管理局尚未发布参比制剂,或对已发布参比制剂存在异议(需明确具体原因,并提供相关证明性文件)。
2.拟申请参比制剂是否为原研应明确拟申请参比制剂是否为原研,持证商,以及来源。
3.拟申请参比制剂上市时是否有完整和充分的安全、有效性数据如拟申请参比制剂为原研产品,则此项内容可填写为同“(一)品种基本信息下7.2项”,无需赘述。
如拟申请参比制剂为其他国际公认产品,需简要评价产品作为参比制剂的依据及其安全有效性。
4.拟申请参比制剂的质量是否可控、是否符合现行的国际通用技术要求(如ICH等)如尚未开展相关研究,说明情况即可。
如已有研究数据,可简要概述拟申请参比制剂质量是否可控。
5.拟申请参比制剂是否可及提供销售数据或其他能够证明可及性的文件均可。
6.拟申请参比制剂在美、欧、日及国内上市的处方是否一致结合调研信息,简要概述拟申请参比制剂在美、欧、日及国内的处方情况,明确是否一致,如不一致可简要分析处方差异对产品的影响。
化学仿制药参比制剂目录(第三十批)(征求意见稿)

30-41
氨氯地平阿托伐他汀钙片
Amlodipine Besylate and Atorvastatin Calcium Tablets/Caduet
氨氯地平5mg和阿托伐他汀20mg
片剂
Pfizer Inc
未进口原研药品
美国橙皮书
30-42
氨氯地平阿托伐他汀钙片
Amlodipine Besylate and Atorvastatin Calcium Tablets/Caduet
未进口原研药品
美国橙皮书
30-38
卡格列净二甲双胍缓释片
Canagliflozin and Metformin Hydrochloride Extended Release Tables
/Invokamet XR
卡格列净50mg和盐酸二甲双胍1000mg
片剂
Janssen Pharmaceuticals Inc
醋酸钙口服溶液
Calcium Acetate Oral Solution/Phoslyra
667mg/5ml
口服溶液剂
Fresenius Medical Care North America
未进口原研药品
美国橙皮书
30-29
地拉罗司片
Deferasirox Tablets/Jadenu
90mg
片剂
Novartis Pharmaceuticals Corporation
2ml:1mg
注射剂
Eisai Europe Ltd
国内上市的原研药品
原研进口
30-6
双氯芬酸二乙胺乳胶剂
Diclofenac Diethylamine Emulgel
化学仿制药参比制剂目录(第三十二批))
IBSA Farmaceutici Italia Srl
未进口原研药品
欧盟上市
32-10
阿普司特片
Apremilast Tablets/Otezla
10mg
Celgene Europe B.V.
未进口原研药品
欧盟上市
32-11
阿普司特片
Apremilast Tablets/Otezla
国际公认的同种药品
美国橙皮书
32-48
注射用替加环素
Tigecycline for Injection/Tygacil
50mg
PF Prism CV
未进口原研药品
美国橙皮书
32-49
他克莫司胶囊
Tacrolimus Capsules/ Prograf
5mg
Astellas Pharma US Inc
化学仿制药参比制剂目录(第三十二批)
序号
药品通用名称
英文名称/商品名
规格
持证商
备注1
备注2
32-1
比克恩丙诺片
Bictegravir Sodium, Emtricitabine and Tenofovir Alafenamide Fumarate Tablets/ Biktarvy(必妥维)
比克替拉韦钠(以比克替拉韦计)50mg,恩曲他滨200mg,富马酸丙酚替诺福韦(以丙酚替诺福韦计)25mg
未进口原研药品
日本上市
32-26
氯化锰口服溶液
Manganese Chloride Oral Solution / Bothdel Oral Solution 10
250mL/袋,含有36mg氯化锰四水合物(相当于锰10mg)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Melinta Subsidiary Corp
未进口原研药品
美国橙皮书
32-30
盐酸氯米帕明注射液
Clomipramine Hydrochloride Injection / Anafranil
25mg/2ml
Alfasigma France/
Alfasigma S.p.A.
未进口原研药品
国际公认的同种药品
美国橙皮书
32-48
注射用替加环素
Tigecycline for Injection/Tygacil
50mg
PFPrism CV
未进口原研药品
美国橙皮书
32-49
他克莫司胶囊
Tacrolimus Capsules/ Prograf
5mg
Astellas Pharma US Inc
未进口原研药品
32-34
克霉唑乳膏
Clotrimazole Cream/Canesten
1%
Bayer Inc
未进口原研药品
加拿大上市
32-35
曲安奈德乳膏
Triamcinolone Acetonide Cream
0.1%
Fougera Pharmaceuticals Inc
国际公认的同种药品
美国橙皮书
32-36
磺胺甲噁唑800g,甲氧苄啶160mg
Sun Pharmaceutical Industries Inc
未进口原研药品
美国橙皮书
32-23
苯磺顺阿曲库铵注射液
Cisatracurium Besylate Injection/Nimbex
2.5ml:5mg
Aspen Pharma Trading Limited
Fluorouracil Injection/Fluorouracil
1g/20ml
Fresenius Kabi USA LLC
国际公认的同种药品
美国橙皮书
32-47
氟尿嘧啶注射液
Fluorouracil Injection/Fluorouracil
1g/20ml
AccordHealthcareINC
5mg
大日本住友製薬株式会社
未进口原研药品
日本上市
32-17
丙酸倍氯米松吸入气雾剂
Beclometasone Dipropionate Inhalation Aerosol /Qvar
每瓶200揿,每揿含丙酸倍氯米松50μg
Teva UK Limited
未进口原研药品
欧盟上市
32-18
丙酸倍氯米松吸入气雾剂
附件1
化学仿制药参比制剂目录(第三十二批)(征求意见稿)
序号
药品通用名称
英文名称/商品名
规格
持证商
备注1
备注2
32-1
比克恩丙诺片
Bictegravir Sodium, Emtricitabine and Tenofovir Alafenamide Fumarate Tablets/Biktarvy(必妥维)
Lidocaine Cataplasms/ Lidoderm
5%
Teikoku Pharma Usa Inc
未进口原研药品
美国橙皮书
32-28
洛索洛芬钠凝胶
Loxoprofen sodium hydrate gel
1%
第一三共株式会社
未进口原研药品
日本上市
32-29
注射用德拉沙星
Delafloxacin for Injection / Baxdela
25mg
Novartis Pharmaceuticals Corporation
未进口原研药品
美国橙皮书
32-33
硫酸亚铁缓释片
Ferrous Sulfate Extended-release Tablets/Fero-Gradumet
105mg(以铁元素计)
マイランEPD合同会社
未进口原研药品
日本上市
注射用伏立康唑
Voriconazole for Injection/Vfend
200mg
PF Prism CV
未进口原研药品
美国橙皮书
32-37
碳酸司维拉姆片
Sevelamer Carbonate Tablets / Renvela
800mg
Sanofi Genzyme
未进口原研药品
美国橙皮书
32-38
未进口原研药品
欧盟上市
32-15
卡泊三醇搽剂
Calcipotriol Scalp Solution/Daivonex(达力士)
0.005%(30ml:1.50mg)
LEO Pharma A/S
国内上市的原研药品
原研进口
32-16
盐酸阿罗洛尔片
Arotinolol Hydrochloride Tablets
未进口原研药品
欧盟上市
32-24
伏立康唑片
Voriconazole Tablets/Vfend
50mg
PF Prism CV
未进口原研药品
美国橙皮书
32-25
盐酸法舒地尔注射液
Fasudil Hydrochloride Injection/Eril
2ml:30mg
Asahi Kasei Pharma Corporatio
未进口原研药品
日本上市
32-26
氯化锰口服溶液
Manganese Chloride Oral Solution / Bothdel Oral Solution 10
250mL/袋,含有36mg氯化锰四水合物(相当于锰10mg)
Meiji Seikaファルマ株式会社
未进口原研药品
日本上市
32-27
利多卡因凝胶贴膏
欧盟上市
32-31
盐酸托莫西汀口服溶液
Atomoxetine Hydrochloride Oral Solution /Strattera
100ml∶0.4g
日本イーライリリー株式会社
未进口原研药品
日本上市
32-32
艾曲泊帕乙醇胺片
Eltrombopag Olamine Tablets/Promacta
美国橙皮书
32-50
他克莫司胶囊
Tacrolimus Capsules/ Prograf
1mg
Astellas Pharma US Inc
未进口原研药品
美国橙皮书
原研进口
32-13
利福平胶囊
Rifampicin Capsules/RIFADIN
150mg
Sanofi
未进口原研药品
欧盟上市
32-14
倍他米松磷酸钠注射液
Betamethasone phosphate sodium injection/Celestone
4mg/ml(以倍他米松计)(1ml)
MSD Belgium BVBA/SPRL/MSD Sharp& DohmeGMBH/Merck Sharp & Dohme BV/MSD Polska Sp. z o.o.
未进口原研药品
美国橙皮书
32-21
阿立哌唑口崩片
AripiprazoleOrally Disintegrating tablets/Abilify
15mg
Otsuka Pharmaceutical Co. Ltd
未进口原研药品
美国橙皮书
32-22
复方磺胺甲噁唑片
Compound Sulfamethoxazole Tablets/Bactrim
200mg
Polichem S.R.L./ Polichem SA
未进口原研药品
欧盟上市
32-43
美沙拉秦灌肠液
Mesalazine Enemas/ Rowasa
4g/60ml
Mylan Specialty LP
未进口原研药品
美国橙皮书
32-44
马尿酸乌洛托品片
Methenamine Hippurate Tablets/Hippex
30mg
Celgene Europe B.V.
未进口原研药品
欧盟上市
32-12
来迪派韦索磷布韦片
Ledipasvirand Sofosbuvir Tablets/ Harvoni(夏帆宁)
90mg来迪派韦,400mg索磷布韦
Gilead Sciences International Ltd.
国内上市的原研药品
1.112ml:25mg
IBSA Farmaceutici Italia Srl
未进口原研药品
欧盟上市
32-10
阿普司特片
Apremilast Tablets/Otezla
10mg
Celgene Europe B.V.
未进口原研药品
欧盟上市
32-11
阿普司特片
Apremilast Tablets/Otezla
比克替拉韦钠(以比克替拉韦计)50mg,恩曲他滨200mg,富马酸丙酚替诺福韦(以丙酚替诺福韦计)25mg
Gilead Sciences Ireland UC
国内上市的原研药品
原研进口
32-2醋酸阿ຫໍສະໝຸດ 特龙片Abiraterone Acetate Tablets/ Zytiga
250mg
Janssen Biotech Inc
Beclometasone Dipropionate Inhalation Aerosol /Qvar
每瓶200揿,每揿含丙酸倍氯米松50μg
