全自动生化分析仪产品技术要求mairui
全自动生化分析仪产品技术要求帝迈生物技术

1.性能指标1.1.外观与结构a)面板上图形符号和文字应准确、清晰、均匀、不得有划痕;b)紧固件连接应牢固可靠,不得有松动;c)运动部件应平稳,不应卡住、突跳及显著空回,键组回跳应灵活。
1.2.性能要求1.2.1.杂散光吸光度不小于4.0。
1.2.2.吸光度线性范围相对偏倚在±5%范围内的最大吸光度应不小于 3.5。
1.2.3.吸光度准确度吸光度准确度应满足表2的要求。
表2吸光度准确度要求吸光度值允许误差0.5±0.0251.0±0.071.2.4.吸光度的稳定性吸光度的变化≤0.01。
1.2.5.吸光度的重复性用变异系数(CV)表示,≤1%。
1.2.6.温度准确度与波动度温度值在设定值的±0.2℃,波动度不大于±0.1℃。
1.2.7.临床项目的批内精密度分析仪对项目浓度范围应满足表3的规定。
表3临床项目的批内精密度要求项目名称浓度范围变异系数CV要求ALT(丙氨酸氨基转移酶)30U/L~50U/L≤4% UREA(尿素)7.0mmol/L~11.0mmol/L≤2.5%TP(总蛋白)50.0g/L~70.0g/L≤2.0%1.3.功能要求1.3.1.测试功能具有样本测试功能;测试结果查询、编辑、打印、传输和历史数据查看功能。
1.3.2.定标功能具有定标,定标曲线查看功能。
1.3.3.质控管理具有质控测试、质控设置,质控数据查看、结果查询和导出功能。
具有质控图查看功能。
1.3.4.项目管理能设置项目参数、参考范围;可以设置盘型、项目测试参数。
1.3.5.统计功能具有测试数据统计功能。
1.3.6.维护功能具有日志查看、温度状态查看功能。
1.3.7.设置功能能设置医院信息;能进行打印设置、LIS通信设置和条码扫描设置;具有用户信息和权限管理、软件版本查看和软件升级功能。
1.3.8.报警功能具有故障报警功能。
1.4.电气安全要求应符合GB4793.1-2007、GB4793.9-2013及YY0648-2008的要求。
全自动血液细胞分析仪产品技术要求mairui1
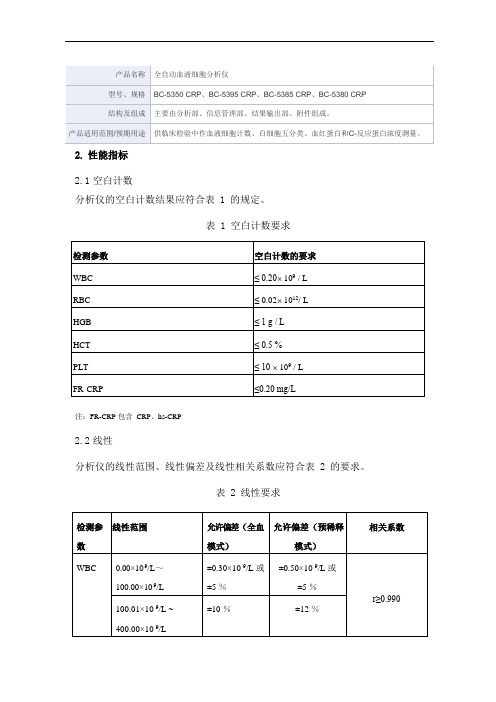
2.性能指标2.1空白计数分析仪的空白计数结果应符合表 1 的规定。
表 1 空白计数要求注:FR-CRP 包含CRP、hs-CRP2.2线性分析仪的线性范围、线性偏差及线性相关系数应符合表 2 的要求。
表 2 线性要求注:FR-CRP 包含CRP、hs-CRP2.3准确度分析仪的准确度相对偏差应满足表 3 的要求。
表 3 准确度要求2.4白细胞分类准确性试验分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞测试结果应在按照附录 B 试验方法所得结果的允许范围之内(99%可信区间)。
注:当参考方法检测结果为 0,而分析仪检测结果≤1.0%时,检测结论为合格。
2.5精密度精密度应满足符合表4的要求。
表 4 精密度要求注:FR-CRP 包含CRP、hs-CRP2.6携带污染率分析仪的携带污染率应满足符合表5的要求。
表 5 携带污染率要求注:FR-CRP 包含CRP、hs-CRP2.7仪器相关性仪器测定 FR-CRP 结果,与对照仪器结果相关性应满足:r≥0.975。
2.8分析仪基本功能2.8.1开关机和登录注销功能分析仪应具有开关机、登录、注销的功能。
2.8.2分析功能分析仪应能对样本进行分析,并能输出检测结果、直方图、散点图。
2.8.3用户管理功能分析仪应设有密码,不同级别的用户应可进行相应功能的操作。
2.8.4样本和病人信息管理功能分析仪至少应能提供样本和病人信息的录入、编辑、保存、浏览、删除的功能。
2.8.5检测结果数据管理功能分析仪至少应能提供检测结果的复检提示、存储(具体存储量见附录 A)、回顾、查询、审核、打印、备份和导出的功能。
2.8.6复检功能分析仪能够定义复检规则并以字符方式通信该条样本所违反复检规则的具体内容,且复检规则定义具备Delta check功能。
2.8.7急诊自动进样过程中具备急诊插入功能。
(适用自动进样机型)2.8.8预稀释模式复检预稀释模式支持复检,一次配比支持两次测量。
全自动生化分析仪技术指标

全自动生化分析仪技术指标一、参数要求1、全自动,分立/任选式2、测试速度:≥280 测试/小时(纯生化)3、测试方法: 终点法、速率法、两点终点法,两点速率法、双波长法、免疫比浊法、双试剂法、非线性检测等4、测试范围:0.0-6.0Abs5、样品位:45个样品位,并可提供20个虚拟样品盘,可单次输入680个标本。
6、样本量:2μL -100μL 0.1μL递增7、试剂位:≧60个试剂位8、试剂量:5μL-500μL 0.5μL递增9、冷藏功能:试剂盘具备冷藏功能(2-8℃)10、加样针液面感应:加样针具备液面感应、随量跟踪功能11、加样针清洗系统:内外壁自动清洗12、加样针防撞功能:具有立体防撞系统13、搅拌系统:独立臂搅拌14、光学系统:全封闭、斩波后分光光学系统,光路系统终身保修15、波长范围:340nm ~ 800 nm,共10个波长,波长精度为±2nm16、反应位:≧120个反应位17、最小反应量:150μL19、温度控制:37℃±0.1℃20、比色杯:≧120个硬质比色杯21、比色杯清洗系统:自动清洗系统,比色杯清洗具有独立的清洗液通道23、光源:长寿命卤素灯,12V/20W,具有光源灯自动休眠功能24、报警功能:废液溢出报警;蒸馏水不足报警;清洗液不足报警;试剂不足报警,实时显示试剂余量及可测数目25、质控:仪器在测试过程中可随时插入质控。
26、监控功能:比色杯在线监控,可自动跳过不合格比色杯。
27、急诊:支持急诊样本优先测试28、软件管理:多级权限管理,保证数据信息安全29、线性扩展功能:测量点最佳范围二次选择,无需重测样本。
定标测量可根据测量出的曲线选择最佳测试点,无需二次定标。
提高工作效率,节约试剂成本。
30、网络功能:支持LIS系统31、耗水量:≤4L/H蒸馏水二、服务及其他要求1、制造厂商具有ISO9001、ISO13485、CMD认证,仪器具有CE认证2、能提供同品牌实验室信息管理系统(LIS系统),方便检验科数据管理(提供证件)3、能提供同品牌检验分析用纯水设备(纯水机),保证实验室用水达到一级用水标准(提供检验分析用纯水设备SFDA注册证)4、能提供同品牌配套生化试剂(25个项目以上)、清洗液、标准品5、成交的供应商在签订合同时须提供所有所投产品制造厂家针对本项目的授权书原件。
全自动生化分析仪产品技术要求新产业

医疗器械产品技术要求编号:全自动生化分析仪2.性能指标生化分析模块2.1杂散光吸光度不小于3.2。
2.2吸光度线性范围相对偏倚在±5%范围内的最大吸光度应不小于2.8。
2.3吸光度准确度应符合表1的规定。
表1 吸光度准确度要求2.4吸光度的稳定性吸光度的变化应不大于0.01。
2.5吸光度的重复性用变异系数表示,应不大于1.5%。
2.6温度准确度与波动度温度值在设定值的±0.3℃内,波动度不大于±0.2℃。
2.7样品携带污染率样品携带污染率应不大于 0.5%。
2.8加样准确性与重复性对仪器标称的样品最小、最大加样量,以及在 5μ L 附近的一个加样量,进行检测,加样准确性误差不超过±5%,变异系数不超过±2%;对仪器标称的试剂最小、最大加样量,进行检测,加样准确度误差不超过± 5%,变异系数不超过±2%。
2.9临床项目的批内精密度批内精密度的变异系数(CV)应满足表 2 的要求。
表2 批内精密度要求电解质分析模块2.10准确度应符合表 3 的要求。
2.11精密度应符合表 3 的要求。
2.12线性仪器线性偏差应符合表 3 的要求。
2.13稳定性仪器稳定性应符合表 3 的要求。
2.14携带污染率携带污染率应符合表 3 的要求。
表 3 电解质模块性能要求2.15外观与结构2.15.1面板上图形符号和文字应准确、清晰、均匀、不得有划痕;2.15.2紧固件连接应牢固可靠,不得有松动;2.15.3运动部分应平稳,不应卡住、突跳及显着空回,键组回跳应灵活;无显著噪音;2.15.4整机应清洁平整,无伤痕和裂纹;2.15.5油漆表面应色泽均匀,无明显色差;2.15.6金属制件表面不应有明显麻点和毛刺出现。
2.16安全要求应符合 GB 4793.1-2007、GB 4793.9-2013 和 YY 0648-2008 的要求。
2.17环境试验要求环境试验要求应符合 GB/T 14710-2009 中气候环境试验Ⅰ组、机械环境试验ІІ 组的规定,低温贮存-20℃。
全自动生化分析仪主要技术参数要求

全自动生化分析仪主要技术参数要求*1、分析仪类型:原装进口,随机任选式、平行模块组合式(各模块分析速度、分析项目相同),一体机,标配电解质分析单元。
*2、运行方式:比色法试剂和参数全开放(可以根据试剂盒要求自行修改),支持进口及国产试剂。
且具有原装配套试剂和校准品、质控品,能提供溯源性文件。
*3、运行速度:恒速(比色法)≥3000测试/小时,离子≥900测试/小时。
4、分析方法:比色法至少包括终点法、速率法、固定时间法、免疫透射比浊法等。
5、同时在线测定项目:比色法≥90项。
可以进行常规生化、电解质、药物浓度、特定蛋白测定。
可进行质控、校准的操作修改,监控及必要的系数调整。
6、试剂仓位:在线冷藏,冰箱质保至少5年。
7、条码阅读器:至少标配病人信息条形码、试剂条形码、样品架条形码、急诊条形码阅读。
8、校准方法:至少包括一点、两点、多点、直线回归、非线性校准等方式9、最小反应体积:以结果准确为前提,请各厂家列出最低反应体积。
10、进样系统:轨道式进样,同时放置样品量≥300样品,可随意无限制追加。
急诊优先。
11、数据处理:可存储≥50000样品,≥15000急诊样品。
≥100000条反应曲线并可回归分析。
具有其他如血清指数、样品空白补偿、项目间演算、实时质控、样品空白修正、反应吸光度检查、稀释重测、自动再检功能等等。
*12、光路:具有光栅后分光系统,吸光度范围≥2.5A,波长340-800nm,≥13个波长。
灵敏度0.0001 Abs。
永久性无需更换比色杯。
*13、恒温系统:先进的恒温系统,无需特殊维护和消耗。
14、安全保护:样品针、试剂针具有静电液面感应、随量跟踪、立体防撞及堵针报警等功能。
15、检验结果溯源性:检验结果具有良好的可比性,能提供溯源性文件,提供CE等质量认证证明,需提供仪器或试剂的SOP文件。
16、其他支持功能:睡眠模式,自动开关机;操作信息管理,操作者认证管理;实时在线帮助,远程通讯、维修等。
多项免疫复合定值质控品产品技术要求mairui

性能指标
2.1外观和性状
2.1.1颜色性状
质控品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为透明塑料管,应盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、参考值表应完整、清晰牢固。
塑料外盖与塑料管身配合后应无渗漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶质控品容量应不少于2.0 mL。
2.3测量准确度
2.3.1质控参考值表
质控品应可提供一份参考值表,包含适用型号的迈瑞化学发光免疫分析系统
的检测项目参考值及参考范围。
2.3.2赋值准确性
经校准的迈瑞全自动化学发光免疫分析仪检测质控品所包含的检测项目,结果应在参考范围内(不同批次的质控品参考范围参见参考值表)。
2.4均一性
2.4.1瓶内均一性
质控品瓶内均一性应满足变异系数CV≤8.0%。
2.4.2瓶间均一性
质控品瓶间均一性应满足变异系数CV≤5.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂
灵敏度的检测试剂,对质控品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
1。
全自动生化分析仪技术要求1.仪器类型原装进口全自动生化

全自动生化分析仪技术要求1.仪器类型:原装进口全自动生化分析仪一台2.*分析速度:分光光度法≥800测试/小时,离子选择电极法≥600测试/小时3.检测项目:包括但不限于生化,免疫,肿瘤标记物,药物检测,毒品检测,电解质检测,同工酶测定,脂类测定等。
4.分析方法:终点法,速率法,固定时间法等。
5.同时检测项目:≥63项(含电解质)6.最小样品体积:≤1.6ul7.最小总反应体积:≤120ul8.最小试剂量:≤15ul9.孵育温度:37℃10*温控系统:干式恒温系统,免维护保养11.试剂位置:≥106个,试剂仓温度4-12℃冷藏12.比色杯:永久性硬质石英玻璃杯13.*样本平台:双进样系统,轨道方式或圆盘方式,一次样本上机数量≥150个,急诊样本优先检测14.质控和校准管理:使用独立冷藏样品盘,质控和定标可随时测定15*.检测波长:≥13个固定波长,波长范围340-800nm,可单/双波长测定16.光度线性范围:0-3.0Abs,确保异常样本检测17.探针功能:具有样品探针液面探测及防撞保护功能、防堵针报警及自动处理功能18.样品质量监测功能:具备乳糜血,黄疸,溶血,血凝块及纤维蛋白探测及报警和自动处理能力。
19.操作系统:基于Windows平台的图形化操作界面,可进行远程诊断20.耗水量:≤30L/小时21*试剂系统:且具备与仪器同品牌的原装配套试剂、校准品和质控品,具有溯源性22.售后服务:保修一年,终身维修,所在省份设有原厂维修站,提供24小时内维修、应用、培训服务.双目视力筛选仪技术要求1.原装进口双目视力筛选仪一台2.适用对象:6个月-100岁3.双眼同时进行测量。
4.*筛查内容:屈光筛查(近视、远视、散光、屈光参差)、眼位变化、瞳孔大小及间距、矫正视力。
5.凝视系统:多彩交替灯光及雨林环境音效。
6.测试距离:1m。
7.测量瞳孔直径要求:4-9mm。
可测量散瞳病人。
8.距被测者距离提示:系统主动测距提示过远或过近。
全自动血液细胞分析仪产品技术要求mairui4

2性能指标2.1空白计数分析仪的空白计数结果应符合表1、表2的规定。
表 1 血液模式空白计数要求注:FR-CRP包含CRP、hs-CRP表2体液模式空白计数要求2.2线性血液模式及体液模式线性范围和线性误差应分别符合表3、表4规定。
表3血液模式线性要求注:FR-CRP包含CRP、hs-CRP表4体液模式线性要求2.3准确度分析仪准确度相对偏差满足表5要求。
表5准确度要求2.4白细胞分类准确性试验分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞和未成熟粒细胞测试结果应在按照附录B试验方法所得结果的允许范围之内(99%可信区间)。
注:当参考方法检测结果为0,而分析仪检测结果≤1.0%时,检测结论为合格。
2.5精密度血液模式及体液模式精密度应分别满足符合表6、表7的要求。
表6血液模式精密度要求注:FR-CRP包含CRP、hs-CRP表7 体液模式精密度指标要求2.6携带污染率高浓度样本对低浓度样本的携带污染程度,血液及体液检测精密度应分别满足符合表8、表9的要求。
表8血液模式携带污染率要求注:FR-CRP包含CRP、hs-CRP表9体液模式携带污染率要求2.7相关性与对照仪器的相关性应满足表10的要求。
表10相关性要求注:FR-CRP包含CRP、hs-CRP2.8体液检测准确性表11相关性要求2.9分析仪基本功能2.9.1开关机和登录注销功能分析仪应具有开关机、登录、注销的功能。
2.9.2分析功能分析仪可对样本进行分析,并输出检测结果。
2.9.3用户管理功能分析仪应设有密码,不同级别的用户应可进行相应功能的操作。
2.9.4样本和病人信息管理功能分析仪至少应提供样本和病人信息的录入、编辑、浏览、删除功能。
2.9.5检测结果数据管理功能分析仪至少应提供检测结果的存储、回顾、查询、打印和导出的功能。
2.9.6质控管理功能分析仪至少提供两种质控方法。
2.9.7校准管理功能分析仪应至少提供两种校准方式。
全自动生化分析仪技术参数规格

全自动生化分析仪(迈瑞BS-330)一、技术参数1、试速度≥300/小时(不含电解质)。
2、分析主机:全自动任选分立式。
3、试剂位:≥40个独立试剂位(可24小时不间断冷藏)。
4、样本位:≥40个位置,可放置多种规格的原始采血管、离心管及样本杯。
5、反应位:≥80个独立反应位,无杯间交叉污染。
采用一次性比色杯6、吸样针:具有自动液面检测、随量跟踪技术、防碰撞安全保护功能以及试剂预加热、余量监控功能的多功能一体化加样针。
7、有独立的搅拌针。
8、先进的后分光技术,可进行双波长检测。
9、杂散光≤0.3%10、反应测试最小体积:≤180ul。
11、波长选择:具备8个以上波长,可进行双波长检测。
12、吸光度范围:0.1~4.0ABS13、有自动预稀释重测功能。
14、软件系统:全中文操作界面,全中文报告单。
Windows操作平台。
15、反应温度:37±0.1℃,实时温度显示16、质控要求:最少有3种质控规则。
17、具有24小时连续开机功能。
18、携带污染率≤0.1%19、试剂系统:试剂全开放,并能提供原厂生产,经SFDA注册的配套试剂校准品≥25个(提供注册证)二、售后服务及配件供应1、售后服务厂家在本省有工商注册的售后服务机构(要求提供营业执照副本复印件)2、售后服务提供维修工程师名单,并有完善的售后服务计划,本省具有完备的配件库三、用户数量提供本省生化用户名单(附联系方式)≥200家(要求提供同系列产品二级及以上医院名单)、同系列设备三级医院用户不得≤5家四、资质证明文件1、提供医疗器械注册证和医疗器械注册登记表复印件2、投标机型CE认证复印件,同系列FDA认证复印件3、提供生产厂家通过ISO-9001体系认证或同级认证复印件4、提供CMDC质量体系认证复印件5、制造商参与制定《全自动生化分析仪行业标准》6、必须提供所投产品的医疗器械注册证和登记表及销售授权书60速全自动血液细胞分析仪(迈瑞BC-3600)技术参数二、商务部分:1、 必须提供所投产品的医疗器械注册证和登记表及销售授权书。
全自动生化分析仪技术参数要求

全自动生化分析仪技术参数要求(*为重要参数)一、技术参数:1.基本参数*1.1原装进口全自动生化分析仪一台*1.2分析速度:生化≥400测试/h,电解质≥400测试/h1.3可测样品种类:血清、血浆、尿液、脑脊液、胸腹水1.4.测试范围:常规生化、急诊生化、电解质、免疫球蛋白、补体等1.5.测试原理及方法:含终点法、速率法、两点法、K、Na、CL采用离子选择电极法1.6校准方法包括:单点、两点、多点线性及非线性模式等1.7测定温度及控温精度:37±0.1℃,温控方式:干式恒温系统或循环恒温水浴系统1.8同时测定项目:可同时测定≥55项生化项目,具有扩展性,可连接免疫分析模块检测肿瘤标志物等免疫分析项目1.9仪器用水量:平均15-40L/h1.10.产品质量认证:SFDA、FDA、GE、CE、ISO9000、ISO140012.试剂系统参数2.1试剂位:基本位≥55个或双试剂位≥110个2.2反应体积:最小≤100ul2.3试剂开放程度:完全开放、部分开放2.4有试剂冷藏技术,试剂加样针具有防撞针保护功能2.5试剂盒有条码,试剂仓有条码识别功能2.6全工作过程中试剂盒装载无须停机3.样品处理及进样系统3.1加样精度:最小可达0.1ul步进3.2进样方式:轨道式、圆盘式、轨道圆盘结合式3.3样品管可使用范围:真空采血管、一次性塑料试管、样品杯等3.4有自动检测功能3.5有自动稀释功能3.6有样品液面探测功能3.7有样品条码识别功能3.8样品最小使用量:1-2ul3.9搅拌功能:机械搅拌方式或超声波混匀3.10进样方式:易操作,加样针具有防撞针保护功能3.11比色杯::石英玻璃杯或UV塑料杯3.12有血清指数功能,对溶血、黄疸、高血脂等有提示功能4.光学系统4.1光学系统:采用光栅,后分光检测技术4.2波长范围:340nm-800nm,≥13种波长4.3光源:脉冲式氙灯或卤素灯4.4.灯泡寿命:≥1000小时4.5反应比色杯数量:≥70个4.6测光方式:单波长、双波长5.质量保证及质控5.1有质量管理软件系统,可自动绘制和储存质控结果5.2能提供原厂的质控品、校准品、具有溯源性、并有批准文号6.软件及控制单元参数6.1电脑系统:WindowsXP、Pentium处理器、DVD-RAM内存1G,硬盘160G 6.2显示器:操作单元17寸触摸式显示屏,中文系统19寸液晶显示器6.3打印机:可出激光中文打印报告6.4工作电压:220VAC±10%6.5电流:50/60Hz6.6温湿度要求:工作温度:15----35℃, 工作湿度:45%----85%6.7数据通讯模式:双向连接,RS-232串口6.8具有远程诊断功能7.水/废液参数7.1制水机:提供优质品牌制水机7.2水参数:≥1MΩ与仪器匹配的纯水机7.3制量:大于40L/h7.4水压:0.5-3.5kg/cm7.5废液处理:系统后的单独容器或管道处理8.UPS延时稳压电源知名品牌UPS延时稳压电源一台,断电延时大于2小时二、商务要求:1.厂家应出具医疗器械生产许可证和国食药监械(进)字号医疗器械注册证及登记表;代理单位应出具经营许可证及产品销售授权书,同时出具产品国食药监械(进)字号医疗器械注册证及登记表。
全自动血液细胞分析仪产品技术要求mairui1

2.性能指标2.1空白计数分析仪的空白计数结果应符合表 1 的规定。
表 1 空白计数要求注:FR-CRP 包含CRP、hs-CRP2.2线性分析仪的线性范围、线性偏差及线性相关系数应符合表 2 的要求。
表 2 线性要求注:FR-CRP 包含CRP、hs-CRP2.3准确度分析仪的准确度相对偏差应满足表 3 的要求。
表 3 准确度要求2.4白细胞分类准确性试验分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞测试结果应在按照附录 B 试验方法所得结果的允许范围之内(99%可信区间)。
注:当参考方法检测结果为 0,而分析仪检测结果≤1.0%时,检测结论为合格。
2.5精密度精密度应满足符合表4的要求。
表 4 精密度要求注:FR-CRP 包含CRP、hs-CRP2.6携带污染率分析仪的携带污染率应满足符合表5的要求。
表 5 携带污染率要求注:FR-CRP 包含CRP、hs-CRP2.7仪器相关性仪器测定 FR-CRP 结果,与对照仪器结果相关性应满足:r≥0.975。
2.8分析仪基本功能2.8.1开关机和登录注销功能分析仪应具有开关机、登录、注销的功能。
2.8.2分析功能分析仪应能对样本进行分析,并能输出检测结果、直方图、散点图。
2.8.3用户管理功能分析仪应设有密码,不同级别的用户应可进行相应功能的操作。
2.8.4样本和病人信息管理功能分析仪至少应能提供样本和病人信息的录入、编辑、保存、浏览、删除的功能。
2.8.5检测结果数据管理功能分析仪至少应能提供检测结果的复检提示、存储(具体存储量见附录 A)、回顾、查询、审核、打印、备份和导出的功能。
2.8.6复检功能分析仪能够定义复检规则并以字符方式通信该条样本所违反复检规则的具体内容,且复检规则定义具备Delta check功能。
2.8.7急诊自动进样过程中具备急诊插入功能。
(适用自动进样机型)2.8.8预稀释模式复检预稀释模式支持复检,一次配比支持两次测量。
全自动生化分析仪产品技术要求深圳市普康电子

2. 性能指标2.1 杂散光吸光度不小于4.8。
2.2 吸光度线性范围相对偏倚在±5%范围内的最大吸光度应不小于3.4。
2.3 吸光度准确度应符合表1的规定。
表1 吸光度准确度要求2.4 吸光度的稳定性吸光度的变化应不大于0.01。
2.5 吸光度的重复性用变异系数表示,应不大于1%。
2.6温度准确度与波动度温度值在设定值的±0.3℃内,波动度为±0.1℃。
2.7 样品携带污染率样品携带污染率应不大于0.1%。
2.8加样准确度与重复性加样准确度和重复性应满足表2的要求表2 加样准确度和重复性2.9 临床项目的批内精密度分析仪对项目浓度范围满足表3的质控血清进行重复测量的变异系数(CV)应满足表3的要求。
表3 临床项目批内精密度要求2.10功能2.10.1 样本管理应具有常规/急诊样本的申请,测试结果查询、编辑、传输功能,样本预稀释功能。
2.10.2 校准管理应具有校准申请,校准参数设置,校准曲线观察,校准有效期管理功能。
2.10.3 质控管理应具有质控申请,实时质控,质控数据与质控图观察功能。
2.10.4 试剂管理应具有试剂设置,试剂余量检测,试剂空白报警,试剂效期管理功能。
2.10.5 测试管理应具有开始测试、加样暂停、在线试剂装载、紧急停止功能,具有反应杯自动清洗功能、液面检测功能、去离子水预加热功能、杯空白自检报警功能、样本针/试剂针防撞功能、按样本排序的优化测试流程功能、测试过程中自动按避免交叉污染安排测试流程功能,PF-200、PF-230选配了条形码模块可以扫描样本、扫描试剂。
2.10.6 仪器管理应具有观察系统状态、仪器状态、休眠唤醒功能。
2.10.7 项目管理应支持生化项目、血清指数,组合项目、计算项目。
2.10.8 系统设置应能设置系统参数,具有用户权限管理、软件版本和项目数据库在线升级功能。
2.10.9 维护功能应具有维护功能,支持定期维护、维护日志功能。
全自动生化分析仪技术参数要求

全自动生化分析仪技术参数要求
1、机型:分立式全自动:
2、测试速度>200测试/小时;
3、测试方法:终点法+固定时间法(亮点法)+动力法;
4、分光方式:后分光,支持单/双波检测;
5、样本量2—60ul
6、试剂盘≥60个试剂位;
7、试剂冷藏:可24小时连续冷藏;
8、试剂量:6—450ul;
9、样本针/试剂针:具有液面检测及垂直防撞功能、试剂预加温功能;
10、最小反应液体积≤150 ul;
11、具有样本自动稀释重测功能;
12、光学比色杯数量>120;
13、反应温度准确度37±0.2℃;
14、一个以上独立的搅拌针:
15、波长≥8个;
16、软件操作系统:中文操作,WindowsXP或以上;
17、仪器配置:分析仪主机一台、操作软件一套、电脑及17寸液晶显示器一套、装机试剂一套、中文说明书一套、UPS电源一台、激光打印机一套、免费提供同一品牌纯水制水机一台。
18、提供原厂生产的具有注册证的配套试剂、校准品、质控品、原厂配套试剂项目数≥40种,同时具备开放试剂。
19、售后服务:保修期自验收合格日起一年(含一年)以上,终身维修,一个工作日内上门服务。
20、管理系统:具备LIS系统接口。
21、厂家在江西省内有经工商注册的正规售后服务中心,厂家注册服务工程师≥4人(投标时需提供证明文件并加盖红章)。
生化分析仪电解质模块血清测试用定标液(离子选择电极法)产品技术要求mairui
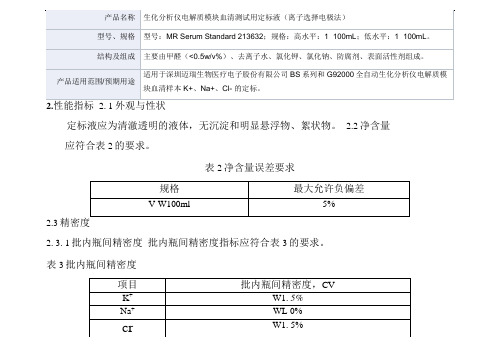
cr
W1.5%
批间精密度指标应符合表4的要求。
表4批间精密度
项目
批间精密度,CV
K+
W3.0%
逾
W3.0%
C1"
W3.0%
2.4准确度
对血清基质的定值参考物质进行测试,测试结果应满足表5的要求。 表5定标液准确度
项目
准确度,mmol/L
K+
靶值土靶值X 3%
Na+
靶值土靶值X 3%
Cl"
靶值土靶值X 3%
2.性能指标2.1外观与性状
定标液应为清澈透明的液体,无沉淀和明显悬浮物、絮状物。2.2净含量
应符பைடு நூலகம்表2的要求。
表2净含量误差要求
规格
最大允许负偏差
VW100ml
5%
2.3精密度
2. 3.1批内瓶间精密度 批内瓶间精密度指标应符合表3的要求。
表3批内瓶间精密度
项目
批内瓶间精密度,CV
K+
W1.5%
Na+
产品名称
生化分析仪电解质模块血清测试用定标液(离子选择电极法)
型号、规格
型号:MR Serum Standard 213632;规格:高水平:1×100mL;低水平:1×100mL。
结构及组成
主要由甲醛(<0.5w/v%)、去离子水、氯化钾、氯化钠、防腐剂、表面活性剂组成。
产品适用范围/预期用途
适用于深圳迈瑞生物医疗电子股份有限公司BS系列和G92000全自动生化分析仪电解质模块血清样本K+、Na+、Cl-的定标。
全自动生化分析仪产品技术要求

全自动生化分析仪1范围本标准规定了全自动生化分析仪(以下简称分析仪)的术语和定义、分类与命名、要求、试验方法、检验规则、标志、标签、使用说明书和包装、运输、贮存。
本标准适用于全自动生化分析仪。
分析仪适用于医疗机构对人体血清、血浆或尿液样本中成分的定量检测。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191-2008 包装储运图示标志GB 4793.1-2007 测量、控制和实验室用电气设备的安全要求第一部分:通用要求GB/T 9969-2008 工业产品使用说明书总则GB/T 14710-2009 医用电器环境要求及试验方法GB/T 18268.1-2010 测量、控制和实验室用的电设备电磁兼容性要求第1部分:通用要求GB/T 18268.26-2010 测量、控制和实验室用的电设备电磁兼容性要求第26部分:特殊要求体外诊断(IVD)医疗设备YY/T 0466.1-2009 医疗器械用于医疗器械标签、标记和提示信息的符号第一部分:通用要求YY 0648-2008 测量、控制和实验室用电气设备的安全要求第2-101部分:体外诊断(IVD)医用设备的专用要求YY/T 0654-2008 全自动生化分析仪《医疗器械说明书和标签管理规定》3术语和定义下列术语和定义适用于本文件。
3.1吸光度 Absorbance透射光强度与入射光强度的比值为透射率,透射率倒数的常用对数值称为吸光度。
注:本标准中,所有的吸光度值均指光径为10mm时的值。
3.2全自动生化分析仪 Automatic chemistry analyzer所有分析过程(包括样品和试剂的加注、互相反应、化学和生物分析、结果计算和结果读出)都实施了自动化的生化分析仪。
3.3携带污染 Carry-over由测量系统将一个检测样品反应携带到另一个检测样品反应的分析物不连续量,由此错误地影响了另一个检测样品的表现量。
生化分析仪电解质模块用尿液质控物(离子选择电极法)产品技术要求mairui

批间精密度,CV
K+
≤5.0%
Na+
≤5.0%
Cl-
≤5.0%
11.4
质控物两个水平的测试结果,应满足表4的要求。
表4质控物测定允许变化范围
Na+,mmol/L
K+,mmol/L
Cl-,mmol/L
高水平
靶值±5
靶值±3
靶值±6
低水平
靶值±5
靶值±3
靶值±5
11.5
质控物应在检测阶段提供赋值程序的文件和至少一个批次的赋值记录。
11.1
质控物应为清澈透明液体,无沉淀、悬浮物和絮状物。
11.2
测量结果应大于95mL。
11.3
1.3.1 批内瓶间精密度
批内瓶间精密度指标应符合表2的要求。
表2 批内精密度
项目
批内瓶间精密度,CV
K+
≤3.5%
Na+
≤3.5%
Cl-
≤3.5%
1.3.2 批间精密度
批间精密度指标应符合表3的要求。
表3 批间精密度(离子选择电极法)
型号、规格
高水平:1×100mL;低水平:1×100mL
结构及组成
主要由甲醛(<0.5w/v%)、去离子水、氯化钾、氯化钠、防腐剂、表面活性剂组成。
产品适用范围/预期用途
适用于深圳迈瑞生物医疗电子股份有限公司生产的BS系列和G92000全自动生化分析仪电解质模块尿液样本的K+、Na+、Cl-参数的质控,以监控和评价电解质模块尿液样本检测结果的精密度。
醛固酮校准品产品技术要求mairui

1 性能指标
2.1外观和性状
2.1.1颜色性状
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为塑料管,盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、校准卡应完整、清晰牢固。
塑料外盖与塑料管身配合后应无渗漏;塑料外盖应无明显划痕、崩缺。
2.2装量
校准品C0、C1 和C2 容量应不少于 1.0 mL。
2.3溯源性
2.3.1校准信息卡
校准品应可提供一份校准卡,包含校准品有效期和校准品各浓度水平的信息。
2.3.2赋值准确性
经校准品校准的迈瑞全自动化学发光免疫分析仪检测具有溯源性的两个浓度水平的正确度控制品,结果的偏倚应在±10.0% 范围内。
2.4均一性
2.4.1瓶内均一性
校准品瓶内均一性C0以标准偏差SD为指标,满足SD≤14.5pg/mL;C1和C2以变异系数CV为指标,满足CV≤10.0%。
2.4.2瓶间均一性
校准品瓶间均一性C0以标准偏差SD为指标,满足SD≤14.5pg/mL;C1和C2以变异系数CV为指标,满足CV≤10.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II
型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
全自动生化分析仪产品技术要求mairui

2.性能指标2.1主要性能指标2.1.1杂散光BS-200E、BS-220E:吸光度应不小于4.6。
BS-360E、BS-360S、BS-370E:吸光度应不小于4.9。
2.1.2吸光度线性范围BS-200E、BS-220E:相对偏倚在±5%范围内的最大吸光度应不小于3.3。
BS-360E、BS-360S、BS-370E:相对偏倚在±5%范围内的最大吸光度应不小于3.5。
2.1.3吸光度准确度应满足表1的要求。
表 1 吸光度准确度2.1.4吸光度的稳定性吸光度变化应不大于0.01。
2.1.5吸光度的重复性用变异系数(CV值)表示,应不大于1%。
2.1.6反应杯温度准确度与波动度恒温室的温度应在37±0.3℃内,温度波动范围应不大于±0.1℃。
2.1.7样品携带污染率BS-200E、BS-220E:样品携带污染率应不大于0.1%。
BS-360E、BS-360S、BS-370E:样品携带污染率应不大于0.05%。
2.1.8加样准确度与重复性加样准确度与重复性应满足表2的要求。
表 2 加样准确度和重复性2.1.9电解质分析模块携带污染率电解质分析模块的携带污染率应满足表 3 的要求。
2.1.10电解质分析模块稳定性电解质分析模块的稳定性应满足表 3 的要求。
2.1.11电解质分析模块准确度电解质分析模块准确度应满足表 3 的要求。
2.1.12电解质分析模块精密度电解质分析模块的精密度应满足表 3 的要求。
2.1.13电解质分析模块线性电解质分析模块的线性应满足表 3 的要求。
表 3 电解质分析模块性能要求2.1.14临床项目的批内精密度变异系数(CV)应满足表4的要求。
表 4 临床项目批内精密度要求2.2功能2.2.1样本管理应具有常规/急诊样本申请,测试结果查询、编辑、审核、打印、双向 LIS 传输、手工结果编辑与查看功能。
2.2.2定标管理应具有定标/试剂空白申请,定标参数查询和打印,定标曲线观察和打印,定标参数重新计算,试剂空白结果观察和打印功能。
全自动生化分析仪产品技术要求参考

医疗器械产品技术要求编号全自动生化分析仪1.产品型号/规格及其划分说明1.1结构组成产品由分析部(主机)和操作部(电脑计算机等)组成。
1.2型号命名1.2.1主机型号以“1”、“2”、“3”分别表示不同型号产品代号1.2.2嵌入式软件版本Version1.0.0.01.2.3版本命名规则软件版本命名规则为X.Y.Z.B;其中X表示重大增强类软件更新,初始值为1,当软件进行了重大增强类软件更新,该号码加1;Y表示轻微增强类软件更新,初始值为0,当软件进行了轻微增强类软件更新,该号码加1;Z表示纠正类软件更新,初始值为0,当软件进行了纠正类软件更新,该号码加1;B表示构建,初始值为000000,当软件进行了构建,以构建当日的日期的后六位数字表示;则软件完整版本为V1.0.0.000000,软件发布版本为V1.0。
2.性能参数产品性能:(1)杂散光:吸光度≥4.5(2)吸光度线性范围:340nm相对偏倚在±5%范围内的最大吸光度应≥3.5,510nm相对偏倚在±5%范围内的最大吸光度应≥4.0。
(3)吸光度准确度:吸光度值0.5,允许误差:±0.02;吸光度值1.0,允许误差:±0.04(4)吸光度稳定性:吸光度的变化应<0.01。
(5)吸光度重复性:用变异系数表示,应<1.5%。
(6)温度准确度与波动度:温度准确度在设定值的±0.3℃以内,温度波动度≤0.2℃。
(7)样品携带污染率:样品携带污染率应≤0.01%。
(8)加样误差与变异系数:体积2μL,准确度误差±5%,变异系数≤2%;体积5μL,准确度误差±5%,变异系数≤2%;体积500μL,准确度误差±5%,变异系数≤1%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.性能指标
2.1主要性能指标
2.1.1杂散光
BS-200E、BS-220E:吸光度应不小于4.6。
BS-360E、BS-360S、BS-370E:吸光度应不小于4.9。
2.1.2吸光度线性范围
BS-200E、BS-220E:相对偏倚在±5%范围内的最大吸光度应不小于3.3。
BS-360E、BS-360S、BS-370E:相对偏倚在±5%范围内的最大吸光度应不小于3.5。
2.1.3吸光度准确度
应满足表1的要求。
表 1 吸光度准确度
2.1.4吸光度的稳定性
吸光度变化应不大于0.01。
2.1.5吸光度的重复性
用变异系数(CV值)表示,应不大于1%。
2.1.6反应杯温度准确度与波动度
恒温室的温度应在37±0.3℃内,温度波动范围应不大于±0.1℃。
2.1.7样品携带污染率
BS-200E、BS-220E:样品携带污染率应不大于0.1%。
BS-360E、BS-360S、BS-370E:样品携带污染率应不大于0.05%。
2.1.8加样准确度与重复性
加样准确度与重复性应满足表2的要求。
表 2 加样准确度和重复性
2.1.9电解质分析模块携带污染率
电解质分析模块的携带污染率应满足表 3 的要求。
2.1.10电解质分析模块稳定性
电解质分析模块的稳定性应满足表 3 的要求。
2.1.11电解质分析模块准确度
电解质分析模块准确度应满足表 3 的要求。
2.1.12电解质分析模块精密度
电解质分析模块的精密度应满足表 3 的要求。
2.1.13电解质分析模块线性
电解质分析模块的线性应满足表 3 的要求。
表 3 电解质分析模块性能要求
2.1.14临床项目的批内精密度
变异系数(CV)应满足表4的要求。
表 4 临床项目批内精密度要求
2.2功能
2.2.1样本管理
应具有常规/急诊样本申请,测试结果查询、编辑、审核、打印、双向 LIS 传输、手工结果编辑与查看功能。
2.2.2定标管理
应具有定标/试剂空白申请,定标参数查询和打印,定标曲线观察和打印,定标参数重新计算,试剂空白结果观察和打印功能。
2.2.3质控管理
应具有质控申请,实时质控、日内质控、日间质控的质控数据与质控图观察和打印功能。
2.2.4试剂管理
应具有试剂设置,试剂余量检测与观察功能。
2.2.5测试管理
BS-200E、BS-220E:应具有开始测试、加样暂停、插入急诊、紧急停止、自动稀释,测试过程中应能自动按交叉污染安排测试流程功能。
BS-360E、BS-360S、BS-370E:应具有扫描样本,开始测试,加样暂停,急诊优先,紧急停止功能,自动稀释,反应杯清洗功能,液面探测功能,清洗剂和去离子水预加热功能,杯空自检报警功能,样本/试剂针防撞功能,自动重测功能,在线试剂装载功能,随量跟踪功能,测试过程中应能自动按交叉污染安排测试流程功能,如果选配了条形码模块
应具有条形码判读功能,如果选配了堵针检测模块应具有样本针堵针检测功能,支持全血检测。
2.2.6状态管理
应能观察样本盘、试剂盘、反应盘状态,观察每个测试进行过程,查看和打印反应曲线。
2.2.7参数设置
应能设置项目参数、参考范围、项目组合、交叉污染关系、定标规则、质控规则、计算项目、手工项目。
2.2.8统计功能
BS-200E、BS-220E:应能测试统计、结果统计、工作量统计和费用统计。
BS-360E、BS-360S、BS-370E:应能测试统计、结果统计。
2.2.9系统设置
应能设置系统参数,医院信息,用户信息;设置打印机,打印方式,打印模板。
2.2.10维护功能
应能观察仪器状态,进行日常维护操作,数据维护,故障日志。
2.2.11电解质分析模块功能
BS-200E、BS-220E:应可供选择电解质测试模式、设置常规/质控样本的测试参考范围、定标、试剂余量的查询、测试无样本时报警功能、测试管道自动定时灌注定标 A 液、电解质分析模块清洗、电解质电极状况查询及电极更换的功能、电解质尿液测试等。
BS-360E、BS-360S、BS-370E:应可供选择电解质测试模式、设置常规/质控样本的测试参考范围、定标、试剂余量的查询、测试无样本时报警功能、测试管道自动定时灌注定标 A 液、电解质分析模块清洗、电解质电极状况查询及电极更换的功能、电解质尿液测试等。
能设置时间和日期,用专用校正液进行一点和两点校正。
提供电极相应的电位值,能对仪器测试数据进行保存和打印。
2.2.12参数查询与配置功能
BS-360E、BS-370E:应具有参数查询与配置功能。
2.2.13操作日志查询功能
BS-360E、BS-360S:操作日志查询功能。
2.3外观与结构
2.3.1分析仪面板上的图形符号和文字应准确、清晰、均匀、不得有划痕;
2.3.2分析仪紧固件连接应牢固可靠,不得有松动;
2.3.3分析仪运动部件应平稳,不应卡住、突跳及显著空回,键组回跳应灵活;
2.3.4分析仪外形应端正,不得有明显划痕、凹凸、锋棱、毛刺。
2.4环境试验要求
2.4.1气候环境试验参照 GB/T14710-2009 中
3.3 气候环境试验 I 组(环境温度范围改为15℃~30℃,相对湿度范围改为 35%RH~85%RH,贮存环境温度范围改为0℃~40℃,相对湿度范围改为 30%RH~85%RH)的规定,应符合表 5 的要求。
2.4.2机械环境试验参照 GB/T14710-2009 中
3.3 机械环境试验 I 组的规定,应符合表 5 的要求。
2.4.3运输试验应符合 GB/T14710-2009 中第4 章的规定。
2.4.4对电源的适应能力应符合 GB/T14710-2009 中5.1 的规定。
表 5 气候及机械环境实验顺序、方法及检测项目
2.5安全要求
应符合 GB 4793.1-2007、GB 4793.6 -2008、GB 4793.9-2013 和 YY 0648-2008 的要求。
