完成下列化学反应方程式
完成下列化学方程式

完成下列化学方程式镁+氧气点燃氧化镁碳+氧气点燃二氧化碳硫+氧气点燃二氧化硫磷+氧气点燃五氧化二磷铁+氧气点燃四氧化三铁氢气+氧气点燃水铜+氧气加热氧化铜水+二氧化碳—-碳酸碱式碳酸铜△氧化铜+二氧化碳+水高锰酸钾加热锰酸钾+二氧化锰+氧气过氧化氢二氧化锰水+ 氧气水通电氢气+氧气碳酸氢铵加热氨气+ 二氧化碳+ 水碳酸加热二氧化碳+ 水碳酸钙+ 盐酸——氯化钙+ 二氧化碳+ 水二氧化碳+ 氢氧化钙—碳酸钙+ 水碳酸钠+盐酸—氯化钠+二氧化碳+水碳酸钙+稀硫酸—硫酸钙+二氧化碳+水硫酸铜+ 氢氧化钠—氢氧化铜+ 硫酸钠化学反应中的质量关系1. 现将10gA 和足量的B 混合加热,A 和B 发生化学反应。
10gA 完全反应后生成8gC 和4gD ,则参加反应的A 与B 的质量比是 ( )A .1:1 B. 2:1 C. 5:1 D. 4:12. 现有化学反应A+B=C ,若将a 克A 与b 克B 在适当条件下充分反应后,分析得知,剩余为一混合物,则生成C 的质量为 ( )A.等于(a+b)克B.大于(a+b)克C.小于(a+b)克D.不大于(a+b)克 3. 蜡烛燃烧前的质量为a g ,燃烧后的质量为b g ,生产的CO 2为c g ,水蒸气为d g ,则产物共 g ,参加反应的氧气的质量为 g 。
4. 在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反映后。
测得反应前后各物质的质量如下表:下列说法错误的是 ( )A.该反应是分解反应 B.甲可能是该反应的催化剂 C.乙、丙变化的质量比为9:8 D.反应后甲的质量为0g5. 在一密闭容器中,盛放A 、B 、D 三种物质各30克,经电火花引燃,充分反应后,各物质的质量变化如下:关于此反应,下列认识不正确的是 ( )A. C 物质中所含有的元素种类是A 、B 、D 三种物质中所有元素种类之和B. 变化后待测的A 质量为5克C. 该变化的基本反应类型是分解反应D. A 物质有可能是单质6.联肼(N2H4)和一氧化氮(NO)反应产生的能量可以作为火箭发射的动力,反应后生成两种物质,其中一种是空气中含量最高的气体,另一种是植物光合作用的原料之一,这两种物质是 ( ) A.N2和CO 2 B.N2和H2O C.N2和O 2D.O2和H2O7. 某物质在空气中完全燃烧生成8.8克二氧化碳和5.4克水,则关于这种物质的组成描述正确的是()A.该物质只含有碳元素和氢元素B.该物质中碳元素与氢元素的质量比为12:1C.该物质一定含有碳元素和氢元素,可能含有氧元素D.该物质的分子中碳原子和氢原子的个数比为1:28、常用燃烧法测定有机物的组成,现取3.2克某有机物在足量氧气中充分燃烧,生成 4.4克二氧化碳和 3.6克水,则该有机物中()A、一定含有C、H两种元素,可能含有氧元素B、.一定含有C、H、O三种元素C、一定含有C、O两种元素, 可能含有H元素D、只含有C、H两种元素9.A、B、C三种物质各15克,它们化合时只能生成30克新物质D。
大学有机化学试题1..
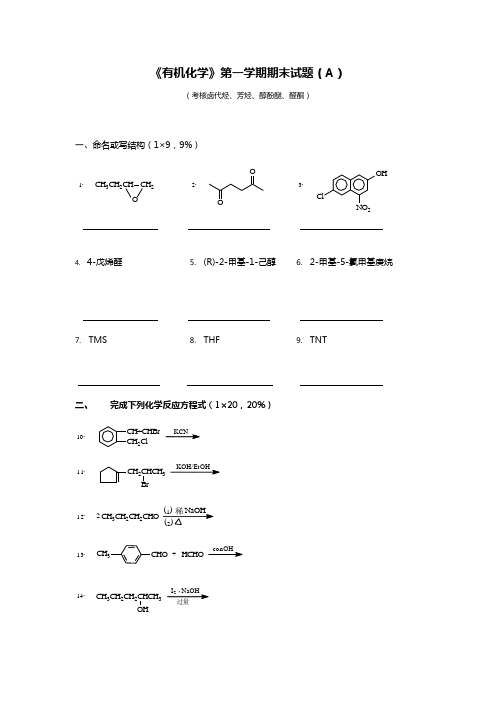
《有机化学》第一学期期末试题(A )(考核卤代烃、芳烃、醇酚醚、醛酮)一、命名或写结构(1×9,9%)CH 3CH 2CH CH 2O1.OO2.ClNO 2OH3.4. 4-戊烯醛5. (R)-2-甲基-1-己醇6. 2-甲基-5-氯甲基庚烷7. TMS8. THF9. TNT二、完成下列化学反应方程式(1×20,20%)CH=CHBr CH 2ClKCN10.CH 2CHCH 3BrKOH/EtOH11.CH 3CH 2CH 2CHO212.CHOCH 3HCHOconOH-+13.CH 3CH 2CH 2CHCH 3OHI 2 NaOH 过量14.(CH 3)2CHOHPBr 315.CH 3(CH 2)3Cl+16.AlCl 3OH OHH+17.CH 3MgBr18.HCHO 乙醚,H 3O+OPh 3P=CH 2+20.CH 3CH 2CH 2CHO21.+NaHSO 3(饱和O CO22.(CH 3)2CHMgBr23.O(1)醚(2)2+OCH 2CH=CHREt Me200C。
24.OHH 2SO 4HNO 325.HCHOHCl26.++ZnCl 2无水CH 3CH=CHCH 2CH 2CHOAg(NH 3)2+OH-27.C CH 3H 3C OHCHON H++H+28.2C 2H 5OH Odry HCl29.+三、有机理论部分(5×5,25%)30按沸点从大到小排列成序,并简要说明理由。
CH 2CH CH 2OH OH OHCH 3CH 2CH 2OH CH 3CH 2CH 2OCH 3CH 2CH CH 2OH OH OCH 3(a)(b)(c)(d)31.按羰基的活性从大到小排列成序,并简要说明理由。
CH 3CH O CH 3CCHOO CH 3CCH 2CH 3O (CH 3)3CCC(CH 3)3O(a)(b)(c)(d)32.解释:为什么化合物无论是进行S N 1还是进行S N 2反应都十分困难?33.写出反应机理CH 2CH 2ClClCH CH 3+(过量)AlCl 3无水34.写出反应机理OO四、有机结构分析部分(4×4,16%)35.用化学方法鉴别化合物C2H5Br CH3O CH2Br C2H5OHA B C36.用化学方法鉴别化合物O OH OHOHA B C D37.根据所给化学式、IR、NMR主要数据,推测化合物的结构C4H8O IR/cm-1: 2970, 2878, 2825, 2718, 1724; NMR: δH: 9.5(三重峰,1H)38.化合物A的分子式为C8H14O。
宋天佑无机(二)习题答案

12-2 完成并配平下列反应的化学方程式。
(1) H2+Ca=CaH2(2) Fe2O3+3Na2O2=2Na2FeO4+Na2O(3) BaO2+H2SO4=BaSO4+H2O2(4) Li2CO3=Li2O+CO2(5) 5Na2O2+2MnO4-+16H+=5O2+2Mn2++10Na++8H2O(6) 2Na2O2+2H2O=4NaOH+O2(7) 2Na2O2+2CO2=2Na2CO3+O2(8) 4KO3+2H2O=4KOH+5O2(9) Mg3N2+6H2O=3Mg(OH)2+2NH3(10) TiCl4+4Na=4NaCl+Ti12-6 拟除掉BaCl2溶液中的少量FeCl3杂质,试分析加入Ba(OH)2和BaCO3哪种试剂更好。
解:加入Ba(OH)2更好。
Ba(OH)2和BaCO3与FeCl3发生的反应分别为:2FeCl3+3BaCO3+3H2O=2Fe(OH)3+3BaCl2+3CO22FeCl3+3Ba(OH)2=2Fe(OH)3+3BaCl2由反应方程式可知,BaCO3与FeCl3反应产物中有CO2,CO2不能完全脱离体系,有杂质存在。
而Ba(OH)2与FeCl3反应没有杂质生成,若Ba(OH)2过量可以定量加入HCl转化为BaCl2。
12-16 在温度高于1020 K条件下,BeCl2气体以单分子形态存在,其中Be为杂化;当BeCl2气体温度低于该温度时,以二聚体形式存在,其中Be为sp2杂化;无水固态BeCl2具有链状结构,其中Be为sp3杂化。
试分析上述各种BeCl2的成键形式与空间构型。
解:单分子中Be以sp方式杂化,形成两个有单电子的杂化轨道,在空间呈直线型分布。
每个含有单电子的sp杂化轨道与Cl原子的单电子轨道重叠形成σ键,故BeCl2单分子呈直线型。
ClBe Cl二聚体中,Be 以sp 2方式杂化,形成两个有单电子的杂化轨道和一个空的杂化轨道,杂化轨道为平面三角形。
陈金珠编有机化学全部答案

第1章 饱和烃(一)思考题部分思考题1-1写出分子式为C 6H 14烷烃的所有构造异构体。
CH 3CH 2CH 2CH 2CH 2CH 3CH 3CHCH 2CH 2CH 3CH 3CH 3CH 2CHCH 2CH 33CH 3CHCHCH 3CH 3CH 3CH 3CCH 2CH 33CH 3思考题1-2下列化合物哪些是同一化合物?哪些是构造异构体?同一化合物:(2)和(6);(3)、(4)和(5) 构造异构体:(1)、(2)和(3)思考题1-3用系统命名法命名下列化合物。
(1)2,2,4-三甲基戊烷 (2) 3,6-二甲基-4-乙基-5-丙基辛烷 (3)2,3,4-三甲基-5-乙基辛烷 思考题1-4写出下列化合物的构造式(1) CH 3CH 22CH 33CH 3 (2) CH 3CCH 3CH 3CH CH 3CH 3(3) CH 3CHCH 2CH 2CH 33思考题1-5写出下列每一个构象式所对应的烷烃的构造式。
(1) CH 3CHCH 33(2)CH 3CHCH 2CH 3CH 3(3) CH 3CH 22CH 3CH 3CH 3思考题1-6写出下列化合物最稳定的构象式,分别用伞形式和Newman 投影式表示。
(1)C HCH 12 (2)C HCH 12思考题1-7比较下列各组化合物的沸点高低,并说明理由。
(1)正丁烷>异丁烷 (2) 正辛烷>2,2,3,3-四甲基丁烷(3) 庚烷>2-甲基己烷>3,3-二甲基戊烷理由:烷烃异构体中,直链烷烃的沸点比支链烷烃沸点高。
思考题1-8已知烷烃分子式为C 5H 12,根据氯代反应产物的不同,试推测各烷烃的结构并写出结构式。
(1)和(4):C 3H 3C CH 3CH 3(2) CH 3CH 2CH 2CH 2CH 3 (3)CH 3CH CH 23CH 3思考题1-9试写出分子式为C 6H 12的环烷烃的所有构造异构体并命名。
有1,2,3-三甲基环丙烷(这个也有一对顺反异构体)、1-甲基-2-乙基环丙烷(注意1号碳和2 号碳都是手性碳原子,所以有4个旋光异构体)、1,1,2-三甲基环丙烷(2号碳为手性碳原子,有一对旋光异构体)、1-正丙基环丙烷、1-异丙基环丙烷、1-甲基-1-乙基环丙烷、1-乙基环丁烷、1,1-二甲基环丁烷、1,2-二甲基环丁烷(注意1号碳和2号碳都是手性碳原子,有3个旋光异构体,其中两个互为对映体,另一个是内消旋体)、1,3-二甲基环丁烷(这个也有一对顺反异构体)、1-甲基环戊烷、环己烷。
大学有机化学试题1

《有机化学》第一学期期末试题(A)(考核卤代烃、芳烃、醇酚醚、醛酮)一、命名或写结构(1×9,9%)CH3CH2CHCH2O1.OO2.ClNO2OH3.4. 4-戊烯醛5. (R)-2-甲基-1-己醇6. 2-甲基-5-氯甲基庚烷7. TMS 8. THF9. TNT二、完成下列化学反应方程式(1×20,20%)CH=CHBrCH2Cl KCN10.CH2CHCH3Br KOH/EtOH11.CH3CH2CH2CHO2(2)NaOH(1)稀12.CHOCH3HCHO conOH-+13.CH 3CH2CH2CHCH3OH I2NaOH,过量14.(CH3)2CHOH PBr315.CH 3(CH2)3Cl+16.AlCl3OHOH H+17.CH 3MgBr18.HCHO乙醚,H3O+OPh 3P=CH2+20.CH3CH2CH2CHO21.+NaHSO3(饱和)OCO22.混酸(CH3)2CHMgBr23.O(1)醚(2)H2O/H+OCH2CH=CHREtMe200C。
24.OH H2SO4HNO325.HCHO HCl26.++ZnCl 2无水CH3CH=CHCH2CH2CHO Ag(NH 3)2+OH-27.CCH3H3C OHCHON H++H +28.2C 2H5OH O dry HCl29.+三、有机理论部分(5×5,25%)30按沸点从大到小排列成序,并简要说明理由。
CH2CHCH2OHOHOHCH3CH2CH2OHCH3CH2CH2OCH3CH2CHCH2OHOHOCH3(a)(b)(c)(d) 31.按羰基的活性从大到小排列成序,并简要说明理由。
CH3CHOCH3CCHOOCH3CCH2CH3O(CH3)3CCC(CH3)3O(a)(b)(c)(d)32.解释:为什么化合物无论是进行S N1还是进行S N2反应都十分困难?33.写出反应机理ClCH2CH2ClCl CHCH3+(过量)AlCl3无水34.写出反应机理O KOH, H2O OO四、有机结构分析部分(4×4,16%)35.用化学方法鉴别化合物C2H5BrCH3OCH2BrC2H5OH ABC36.用化学方法鉴别化合物O H OOHOH ABCD37.根据所给化学式、IR、NMR主要数据,推测化合物的结构C4H8O IR/cm-1: 2970, 2878, 2825, 2718, 1724; NMR: δH: 9.5(三重峰,1H) 38.化合物A的分子式为C8H14O。
写出下列反应的化学方程式:(1)...

(2010?昆明)写出下列反应的化学方程式:
(1)二氧化碳和水反应;
(2)电解水;
(3)一氧化碳高温还原磁铁矿(主要成分Fe3 O4);
(4)乙烯(C2H4)燃烧生成二氧化碳和水;
(5)向空中播撒碘化银(AgI)微粒可进行人工降雨,碘化银在光照条件下可分解为碘单质(I2)和银单质.
【答案】分析:(1)根据二氧化碳和水会发生化合反应生成碳酸进行书写,
(2)根据水在通电的条件下生成氢气和氧气进行书写,
(3)根据一氧化碳还原氧化铁的原理书写方程式,
(4)根据有机物燃烧会生成二氧化碳和水进行书写,
(5)根据碘化银分解的原理进行书写.
根据题中给出的叙述确定反应物、生成物以及反应条件,依据书写方程式的原则进行书写方程式.
解答:解:(1)二氧化碳和水反应生活成碳酸,所以方程式为:CO2+H2O=H2CO3,
(2)水在通电的条件下生成氢气和氧气,所以方程式为:2H2O2H2↑+O2↑,
(3)一氧化碳和四氧化三铁在高温的条件下生成铁和二氧化碳,所以方程式为:4CO+Fe3O43Fe+4CO2,
(4)反应物是乙烯和氧气,生成物是水和二氧化碳,反应条件是点燃,所以方程式为:C2H4+3O22CO2+2H2O,
(5)反应物是碘化银,生成物是银和碘单质,反应条件是光照,所以方程式为:2AgI2Ag+I2.
点评:依据题中所给的条件书写方程式是考试的热点问题,在平时的学习中要加强这方面的记忆.。
高中化学反应方程式

高中化学反应方程式高中化学反应方程式:1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl- =AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH –+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH –+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3- +H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3- +CH3COOH=CO2 ↑+H2O+CH3COO -7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3- +Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH –=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH –=CaCO3↓+H2O10 、澄清石灰水与少量小苏打溶液混合:Ca2++OH –+HCO3- =CaCO3↓+H2O11 、澄清石灰水通入少量CO2:Ca2++2OH –+CO3=CaCO3↓+H2O12 、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13 、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH –+2HCO3- =CaCO3↓+CO32– +2H2O14 、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH –+Ca2+=CaCO3↓+H2O15 、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH –+NH4++HCO3- =BaCO3↓+H2O+NH3?H2O16 、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或 CO32–+2H+=CO2↑+H2O17 、向氢氧化钠溶液中通入少量的CO2?:CO2+2OH–=CO32 –+H2O18 、过量的 CO2 通入氢氧化钠溶液中:CO2+OH–=HCO3-19 、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH –=NH3↑+CO32–+2H2O20 、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21 、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO- +CO2↑+H2O。
方程式总结习题答案

方程式总结习题答案1、完成并配平下列反应方程式:+H2O(1) XeF4+CIO3- XeOF4+CI2+H2O(2) XeF4+Xe ----- 2XeF2(4)6XeF4+12H2O^ 2XeO3+3Xe+24HF+3O2(5)2XeO3+2Ba(OH)2Ba2XeO6+Xe+O2+H 2O(6) 2XeF6+SiO22XeOF4+SiF42、写出过氧化钠和下列物质的反应式:NaCrO2,CO2,H2O,H2SO4 (稀)。
2NaCrO2+3Na2O2+2H2^ 2Na2CrO4+4NaOH2CO2+2Na?O2 = 2Na?CO3+O2 彳2H2O+2Na2O2^= 4NaOH+O2|2H?SO4(稀)+2Na2O2^^^^ ZNa z SO q+ZH g O+O 2^3、以反应式表示下列反应过程并注明反应条件(1)用过量HCIO3处理12:2HCIO3+I2 2HIO3+CI2紫黑色或棕色I2消失,并有CI2气体生成。
(2)氯气长时间通入KI溶液中CI2+2KI ^=2KCI+I25CI2+I2+6H2O 2HIO3+10HCI先有I2生成,溶液由无色变黄、变橙、变棕直至析出紫黑色沉淀,最后紫黑色沉淀消失得无色溶液。
(3)氯水滴水KBr、KI混合液中CI2+2KI ^=2KCI+l25CI2+12+6H 2O 2HIO 3+10HCICS+2KBr ^=2KCI+Br2溶液先变黄或橙,又变浅至近无色,最后又变黄或橙。
4、完成并配平下列反应式:(1) H2S 4H2O2 H2SO4 4H2OH2S4H (^=H2SQ+ 4H O(2)H2S 4Br2 4H 2O H 2SO4 8HBr(3)H2S l2 2HI S,(4)H2S O2 = 2S軌2出0(5)3H2S CIO「^ 3S』W CI 一3H2O(6)2Na2S Na2SO3 6H 3S 3H2O 6Na(7)2Na2S2O3 I Na2S4O6 2NaI(8)Na2S2O3 4CI2 5H2O Na2SO4 H2SO4 8HCI(9)SO2 2H2O Cl2H2SO4 2HCI(10)5H2O2 2KMnO 4 6H 2Mn 2 5O2 8H2O(11)2Na2O2 2CO22Na2CO3 O2(12)2KO2 2H2。
化学反应方程式以及计算

化学反应方程式一、怎样用一个式子来表示化学反应呢?如:木炭在氧气中燃烧生成二氧化碳,我们可以写成:碳+ 氧气点燃二氧化碳但该式子确实能表示反应物、生成物及反应条件;但书写不方便、国际上也不通用且不能体现质量守恒定律,那我们是否能像写化学式一样来表示一个化学反应呢?二、给你一个化学反应方程式如:P+O2点燃P2O5 ,你能从中获取哪些信息呢?三、你知道电解多少个水分子可以得到1个氢分子吗?如果需要2克氢气,需要电解多少克水呢?你的计算方法是怎么样的?例1、写出氢气在氧气中完全燃烧生成水的化学方程式______________________ _____ ,每份质量的氢气与足量的氧气反应,可生成份质量的水。
现有0.4克氢气在氧气燃烧可生成克水.练习1、写出硫在氧气中燃烧生成二氧化硫的化学方程式______________________ ,那么,3.2克硫在足量的氧气中完全燃烧,可生成克二氧化硫.例2.下列化学方程式中,完全正确的是( )A.P+O2点燃P2O5B.C+2O点燃CO2C.Mg2+O2点燃2MgOD.3Fe+2O2点燃Fe3O4例3.配平和完成下列化学方程式:−∆P2O5+Fe(1)P+FeO−→(2) Fe(红热)+ H2O(气)——Fe3O4+H2(3) N2+H2——NH3(4) Al+Fe3O4——Fe+Al2O3例4、写出下列反应的化学方程式并配平:1、镁在空气中燃烧:________________2、铁在氧气中燃烧:____________________3、氢气中空气中燃烧:__________ __________4、红磷在空气中燃烧:_______________5、硫粉在空气中燃烧:___________ _6、碳在氧气中充分燃烧:______________________7、利用过氧化氢和二氧化锰的混合物制氧气:_________________________________8、加热氯酸钾:___________________9、加热高锰酸钾:__________________________10、水在直流电的作用下分解:____________________例4、加热分解6g高锰酸钾,可以得到多少克氧气?【基础训练】1、书写化学方程式时常发生以下错误:A 、物质的化学式书写错误B 、化学方程式没有配平C 、漏写或错写反应条件D 、“↑”或“↓”符号使用不当或遗漏 2、请指出下列反应的错误类型:⑴3Fe+2O 2加热Fe 3O 4( ) ⑵C+O 2点燃CO 2↑ ( ) ⑶2P 2+5O 2点燃2P 2O 5 ( )⑷CH 4+O 2−−→−点燃CO 2+H 2O( ) 3、化学方程式C+O 2点燃CO 2的正确读法是( )A 、碳加氧气等于二氧化碳B 、1个碳分子加1个氧分子,在点燃的条件下生成1个二氧化碳分子C 、碳和氧气在点燃的条件下生成二氧化碳D 、1个碳原子和2个氧原子在点燃的条件下生成1个二氧化碳分子 3.化学方程式 2H 2O+O 2点燃2H 2O 中等号表示( )A.水由氢气和氧气组成B.参加反应的氢、氧分子数之和等于生成的水的分子数C.参加反应的氢气、氧气质量之和等于生成的水的质量D.参加反应的氢质量等于水中氢气的质量 4、完成下列化学反应方程式:(1)氢气+氧气−−→−点燃水_____________________________________;(1)铝+氧气−−→−点燃氧化铝_____________________________________; (1)石灰水Ca(OH)2+二氧化碳→碳酸钙(沉淀)和水___________________;(1)铝+四氧化三铁−−→−高温氧化铝+铁______________________________; (1)___C 2H 5OH+___O 2−−→−点燃___CO 2+___H 2O (1)氧化铁+ 一氧化碳−−→−高温铁+二氧化碳____________ 5.配平下列化学方程式(1)__________Cu+__________O 2点燃__________CuO(2)__________C 3H 8+__________O 2点燃__________CO 2+__________H 2O (3)__________FeS 2+__________O 2高温__________Fe 2O 3+__________SO 2(4)__________Cu 2(OH )2CO 3 △__________CuO+__________H 2O+__________CO 25.在3Fe+2O 2点燃Fe 3O 4反应中:(1)反应物是___________和_____________。
写出下列化学反应方程式

写出下列化学反应方程式○1镁在空气中燃烧○2铁在氧气中燃烧○3在空气中加热铜○4氢气在空气中燃烧○5红磷在空气中燃烧生成五氧化二磷○6电解水○7过氧化氢溶液与二氧化锰制取氧气○8硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠○9大理石(主要成分是碳酸钙)和稀盐酸反应生成氯化钙、水和二氧化碳。
○10乙炔(C2H2)在空气中燃烧○11氧化铝在通电的条件下生成铝和氧气○12二氧化碳和水反应生成碳酸(H2CO3)○13氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水○14光合作用(水和二氧化碳反应生成葡萄糖和氧气,葡萄糖化学式:C6H12O6)○15镁和盐酸反应生成氯化镁和氢气○16碳酸钠和盐酸反应生成氯化钠、水和二氧化碳○17氧化铁和盐酸反应生成氯化铁和水○18硝酸银溶液和盐酸反应生成氯化银沉淀和硝酸○19铁和盐酸反应生成氯化亚铁和氢气○20氯化钡溶液和硫酸反应生成硫酸钡沉淀和盐酸○21氧化钙和水反应生成氢氧化钙○22碳酸钙高温分解生成氧化钙和二氧化碳○23氢氧化钠溶液和氯化铜溶液反应生成氢氧化铜沉淀和氯化钠○24氢氧化钙溶液和氯化铜溶液反应生成氢氧化铜沉淀和氯化钙○25二氧化碳和氢氧化钠反应生成碳酸钠和水○26二氧化碳和氢氧化钙溶液反应生成碳酸钙沉淀和水○27碳酸钠和氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠○28氢氧化钠和盐酸反应生成氯化钠和水○29氯化镁和氢氧化钙溶液反应生成氢氧化镁沉淀和氯化钙○30碳不充分燃烧生成一氧化碳○31碳在高温下与二氧化碳反应生成一氧化碳○32二氧化碳与水、碳酸钙反应生成碳酸氢钙(Ca(HCO3)2)○33碳酸氢钙(Ca(HCO3)2)受热分解生成水、二氧化碳和碳酸钙○34甲烷(CH4)在空气中燃烧○35氯化镁在通电的条件下反应生成镁和氯气○36氢氧化镁和盐酸反应生成氯化镁和水○37碳酸氢钠(NaHCO3)受热分解生成碳酸钠、水和二氧化碳○38碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳○39碳酸钠和氯化钡溶液反应生成氯化钠和硫酸钡沉淀○40氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳○41铝在空气中燃烧生成氧化铝○42铁和硫酸铜反应生成铜和硫酸亚铁○43铜和硝酸银反应生成银和硝酸铜○44碳酸钙和二氧化硅在高温条件下反应生成硅酸钙(CaSiO3)和二氧化碳○45碳酸钠和二氧化硅在高温条件下反应生成硅酸钠(Na2SiO3)和二氧化碳○46硫酸铵和氢氧化钙反应生成硫酸钙、氨气(NH3)和水○47硝酸铵和氢氧化钙反应生成硝酸钙、氨气(NH3)和水○48碳酸氢铵在加热的条件下反应生成氨气、水和二氧化碳。
完成下列反应方程式

一、完成下列反应方程式.1、PbO2+ 4HCl (浓)====PbCl2 +Cl2 +H2O;2、2S2O3 2-+ I2 ==== S4O6 2-+ 2I-3、Hg2I2 (s) + KI (过量) ====K2[HgI4] +Hg4、2KMnO4+ 10KI + 8H2SO4 =====2MnSO4 +5 I2 + 6K2SO4 +8H2O5. Cr2O72- + 3H2S +8H+===2Cr3++3 S + 7H2O6. HgCl2 + SnCl2(过量) ===Hg+ SnCl47. Na2S2O3 + 4Cl2 + 5 H2O === Na2SO4 + H2SO4+8HCl8. 5NaBiO3 +2Mn2+ + 14H+ ===2 MnO4 -+5Bi3+ +5Na+ +7H2O9. HgCl2 + SnCl2(过量) ===Hg + SnCl410、Cu2 O + 2H+ ===== Cu2++ Cu + H2O11. S2O32-+ 4Cl2 + 5H2O ==== 2SO42-+8Cl- +10H+;12. 2Cr3+ + 3S2- + 6H2O=== 2Cr(OH)3 + 3H2S13. Cr2O72-+ 6 I-+ 14 H+ ===== 2Cr3+ + 3 I2 + 7H2O14、Cr2O72- +2Pb2+ +H2O == 2PbCrO4 +2H+;15、MnO2 +4HCl == MnCl2 + Cl2+2H2O;16、2HgCl2+SnCl2(适量)=Hg2Cl2+SnCl4。
17.Cu2++ Cu + 2Cl- ==2CuCl18、2Cu2++ 4 I-====2CuI +I2;19、H2S + 2Fe3+ ===S + 2Fe2++ 2H+;20、2Sn2++ O2 + 4H+ ==== 2Sn4++2H2O;21、SbCl3 + H2O === SbOCl +2HCl;22、AgBr + 2S2O32- ===[Ag(S2O3)2]3-。
无机化学试题库完成反应方程弣

完成反应方程式183 Fe 3O 4+H 2∆−→− 184 WO 3+H 2∆−→− 185 CuO+H 2∆−→− 186 SiCl 4+H 2→187 TiCl 4+H 2→188 KH+H 2O →189 CaH 2+H 2O →190 TiCl 4+NaH →191 Na+H 2300CO −→−−− 192 Li+H 2−→−∆193 Na+O 2(空气)−→−∆194 Ca+N 2−→−∆195 Mg+N 2∆−→− 196 B 2O 3+Mg ∆−→− 197 Be+OH -+H 2O →198 Na+TiCl 4∆−→− 199 Be+NH 31000C O −→−−−200 KNO 3+K →201 NaH+H 2O →202 从Na 2O 2制备Na 2O 。
203 Na 2O 2+CO 2→204 Na 2O 2+H 2SO 4(稀)→205 KO 2+CO 2→206 超氧化钾与水反应。
207 Na 2O 2(s)+MnO 4-+H +→208 CaH 2+H 2O →209 BeO+OH -+H 2O →210 在镁盐溶液中加入碳酸钠溶液。
211 MgCl 2·6H 2O ∆−→− 212 BaO 2+H 2O →213 Mg 3N 2+H 2O →214 Ca 3N 2+H 2O →215 XeF 2+H 2→216 XeF 6+HCl →217 XeO 3+HCl →218 XeF 2+H 2O →219 XeF 6+SiO 2→220 XeF 2+BrO 3-+H 2O →221 XeF 2+KClO 3+H 2O →222 XeF 4+Hg →223 XeF 2+H 2O 2→224 XeF 4+BCl 3→P 区元素593 BCl 3+H 2O →594 B 2H 6+H 2O →595 乙硼烷在空气中燃烧。
596 H 3BO 3+OH -→597 Na 2B 4O 7+NiO ∆−→− 598 Na 2B 4O 7+CoO ∆−→− 599 Na 2B 4O 7+Cr 2O 3∆−→− 600 Na 2B 4O 7与MnO 共熔。
一、化学反应的四种基本类型与化合价变化

一、化学反应的四种基本类型与化合价变化两种或两种物质化合成一种物质的反应。
有的化合反应前后有元素化合价变化,有的化合反应前后没有元素化合价变化 有变化的如:C 0+O O2==C +4O -22 ;铁生锈4 F 0e +3O 02==2 F +3e 2 O -23 ;完成下列化学方程式:铁、红磷、氢气、硫磺在氧气中燃烧,木炭不充分燃烧、铜丝在空气中加热。
①、 ② ;③ ;④ ⑤、 ;⑥、 。
反应前后没有元素化合价变化的如:C +2aO -2+H +12O -2= C +2a (O -2H +1)2 ;完成下列化学方程式:氧化钠、氧化钾、氧化钡、二氧化碳、二氧化硫、三氧化硫、五氧化二磷、五氧化二氮与水反应,碳酸钙变成碳酸氢钙。
① ,② ,③ ④ ,⑤ ,⑥ ,⑧ ,⑨ 有的分解反应前后有元素化合价变化,有的分解反应前后没有元素化合价变化。
有变化的如: 如:2H +I 2O -12==2H +12O -2+O O2↑; 2H +2gO -2==2H Og +O O2↑。
完成下列化学方程式:电解水、加热氯酸钾制氧气、加热高锰酸钾制氧气,① ② 、③ 。
反应前后没有元素化合价变化的如:小苏打受热分解 2N +1aH +1C +4O -23==N +1a 2C +4O -23+C +4O -22↑+H +12O -2;完成下列化学方程式:①煅烧石灰石 ,②碳酸分解 ③碳酸氢銨受热分解 ,④碳酸氢钾受热分解 ⑤氨水分解 ,⑥碳酸氢钙受热分解单质+化合物=新单质+新化合物,反应前后一定有元素化合价变化如Z On +2H +1C -1l =H 02↑+Z +2nC -1l 2 ;F 0e +C +2uS +6O -24=F +2eS +6O -24+C 0u ;3C O +2F +3e 2O -23=4F 0e +3C +4O -22↑;H 02+C +2uO -2 = C 0u +H +12O -2完成下列化学方程式:① Fe +H 2SO 4= + ;② Al + H 2SO 4= + ;③ Mg +HCl = + ;④Zn +H 2SO 4= + ;⑤ Al + HCl = + ;⑥ Fe + HCl = + ;⑦C + CuO = + ;⑧ C + Fe 3O 4= + ;⑨H 2+ CuO = + ;⑩ H 2+ Fe 3O 4= + ;1+化2=化3+化4,因为只是化合物之间交换成分,故反应前后没有元素化合价变化。
化学方程式配平练习含答案

1.配平下列氧化还原反应方程式:(1 Mn(NO3 2+ PbO2+ HNO3 — HMnO4+ Pb(NO3 2+ H2O(2 Ag3AsO 4+ Zn+ H2SO 4 — Ag+ ZnSO4+ AsH3+ H2O(3 Fe(OH3+ NaOH+ Cl2 — Na2FeO 4+ NaCl+ H2O(4 KMnO4+ NaOH+ PH3 — Na2MnO 4+ K2MnO 4+ Na3PO 4+ H2O(5 (NH4 2 PtCl6 — Pt+ NH4Cl + HCl+N2↑2.配平下列氧化还原反应方程式:(1 Na2O 2+ CO2= Na2CO 3+ O2(2 Fe(NO3 2+ HNO3= Fe(NO3 3+ NO+ H2O(3 Mn(NO 32+ PbO2+ HNO3= HMnO4+ Pb(NO 32+ H2O(4 Ag3AsO 4+ Zn+ H2SO 4=Ag↓+ ZnSO4+ AsH3+ H2O(5 KMnO4+ NaOH+ PH3= K2MnO 4+ NaMnO4+ Na3PO 4(6 K2Cr 2O 7+ Fe3O 4+ H2SO 4= Cr2(SO 43+ Fe(SO 433.Cu +在酸性条件下发生自身氧化还原反应,生成Cu 和Cu 2+。
白色的亚铜化合物[Cu(NH4SO 3]难溶于水,若与足量的10 mol /L 的硫酸溶液混合并微热,生成铜、二氧化硫和溶液。
回答下列问题:(1 完成并配平下列化学方程式:__ Cu(NH4SO 3+__ H2SO 4__Cu+__ SO2+__ ________+__ _________+ __ H2O(2 按上述反应,生成单质铜的最高产率为___________。
4.Fe 3P 与稀HNO 3反应生成Fe(NO3 3、NO 、H 3PO 4和H 2O 。
(1 写出反应的化学方程式并配平:___________________________________________________________________;(2 上述反应中,当生成1.8 mol Fe 3+时,放出NO 的体积(标准状况下是__________L,消耗的HNO 3是__________mol;(3 上述反应中,当有21 mol电子发生转移时,生成H 3PO 4是_________mol,被还原的HNO 3是___________g。
23无机化学万题库(问答题)(10-15)

(十)氢稀有气体1.完成下列反应方程式:⑴XeF2+H2O2→⑵XeF2+BrO3-→⑶XeF2+Hg →⑷XeF4+Xe →⑸XeF6+NH3→***2.就XeF2、XeF4、XeF6回答:⑴它们的氧化性哪个最强?⑵用价层电子对理论推断XeF2和XeF4分子的空间构型;⑶分别写出它们和水反应的化学方程式。
***3.现有锌粒、铝片、稀硫酸、氢氧化钠、水、焦炭六种物质,试给出五种不同的制备氢气的方法,写出有关反应方程式。
**4.试判断下列Xe 的化合物分子或离子的空间几何构型,并指出Xe 原子的杂化轨道类型:XeF2XeF4 XeOF4 XeO3XeO4 XeO64-***5.写出由Xe制备XeF2、XeF4、XeF6的反应方程式和这些化合物水解反应的方程式。
***6.写出高氙酸钠(Na4XeO6)在酸性介质中将Mn2+氧化为MnO4-的离子反应方程式(高氙酸钠被还原为氧化氙)。
高氙酸钠作为氧化剂在分析锰、铈、铬等元素时,有什么特别的优越性?***7.根据含氧酸酸性变化的鲍林规则,推断高氙酸H4XeO6 应当是强酸还是弱酸?****8.下列反应都可以产生氢气,试各举一例并写出反应方程式:⑴金属与水;⑵金属与酸;⑶金属与碱;⑷非金属单质与水蒸气;⑸非金属单质与碱。
**9.完成下列反应方程式:⑴XeF6+SiO2→⑵XeO3+HCl →⑶ XeO 3 + O 3 + NaOH + H 2O → ⑷ Na 4XeO 6 + MnSO 4 + H 2O →⑸ XeF 2 + Cr 3++ H 2O → ***10.试写出氢的同位素符号和中文名称,指出氢的成键特征。
**11.如图所示,在一黏土烧成的素烧瓷筒(气体分子可自由通过)中盛有1 / 3 体积的水,用橡皮塞塞紧,塞子中央插入一根玻璃管,直到水面之下。
当H 2 用一充满氢气的大烧杯将素烧瓷筒罩住时,可以看 到有水从玻璃管中溢出。
试解释此现象。
*** [39-208-1]12.什么叫盐型氢化物?什么样的元素可以形成盐型氢化物?如何证明盐型氢化物中含有H -离子?*** [39-208-2]13.氢气和氧气化合为水的反应是一个强放热反应,但室温下混合氢气和氧气却看不到反应现象,当加热至600℃以上时,却发生爆炸式反应,试解释之。
