生物化学复习提纲
生物化学复习提纲

生物化学复习资料第一章蛋白质的结构与功能掌握:1.蛋白质一至四级结构的概念、主要化学键2.蛋白质二级结构的基本形式,肽键、肽单元及模体(motif)、结构域概念。
3.蛋白质重要的理化性质。
熟悉:1.蛋白质的分子组成及特点;氨基酸的化学结构、分类、三字符号及理化性质;肽及多肽链的两端;谷胱甘肽。
2.蛋白质分离和纯化的方法及其原理。
第二章核酸的结构与功能掌握:1.核酸的分类、生物学功能、分子组成、化学结构特点。
2.核酸一级结构的概念及连接键。
3.DNA的碱基组成及Chargaff规则、DNA的双螺旋结构要点。
4.RNA的分类;mRNA和 tRNA的结构特点及功能;rRNA的功能。
5.DNA的变性、DNA的复性及分子杂交。
熟悉:1.核酸的一般理化性质。
2.DNA的超螺旋结构、核小体的组成。
第三章酶掌握:1.酶活性中心的概念、活性中心的必须基团。
2.酶促反应的特点。
3.影响酶的反应动力学因素、米-曼氏方程式、Km与Vm的意义、酶的最适温度、最适pH、可逆性抑制作用的概念、类型及其特点。
4.酶原概念、酶共价修饰的概念、同工酶的概念及特点。
熟悉:1.酶原激活的机理、酶的变构调节、化学修饰调节的特点。
2.酶的分子组成:全酶的组成、辅酶与辅基、金属离子的作用。
第四章糖代谢掌握:1.糖酵解的概念、细胞定位、反应过程、关键酶。
2.糖有氧氧化的概念、细胞定位、反应过程、关键酶或限速酶;3.磷酸戊糖途径的特点及生理意义;4.糖原合成与分解的定义、组织和细胞定位、关键酶和生理意义;5.糖异生的概念、原料、关键酶及生理意义6.血糖的概念、正常人空腹血糖水平、血糖的来源与去路、胰岛素降低血糖的机制、胰高血糖素升高血糖的机制熟悉:1.糖有氧氧化的ATP生成及生理意义。
2.糖原合成和分解的过程及调节;3.糖酵解的ATP生成及生理意义。
4.磷酸戊糖途径的限速酶;5.肾上腺素的调节机制。
了解:1.磷酸戊糖途径的反应过程及调节;糖酵解的调节; 糖原累积症。
【精品】生物化学复习大纲

生物化学复习大纲第一章蛋白质化学一、名词解释:蛋白质一级结构:蛋白质的一级结构指蛋白质多肽链中氨基酸的排列顺序以及二硫键的位置.等电点:在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性.此时溶液的pH值称为该氨基酸的等电点.肽平面:肽链主链上的肽键因具有双键性质,不能自由旋转,使连接在肽键上的6个原子共处的同一平面。
蛋白质二级结构:蛋白质分子中某一段肽链的局部空间结构,即该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象.-螺旋:α-螺旋是多肽链的主链原子沿一中心轴盘绕所形成的有规律的螺旋构象-折叠:β-折叠是由若干肽段或肽链排列起来所形成的扇面状片层构象—转角:链内形成氢键,多肽链出现180°的回折。
此回折角称β-转角结构。
超二级结构:指若干相邻二级结构单元组合彼此相互作用,形成有规则的在空间上能辨认的二级结构组合体。
此为二级结构与三级结构间的一种过渡构象。
如:αα,β×β;βαβ;等。
结构域:对于较大的蛋白质分子或亚基,多肽链往往由两个或两个以上相对独立的三维实体缔合而成三级结构.这种相对独立的三维实体就称结构域。
蛋白质三级结构:三级结构(tertiarystructure)是指球状蛋白质的多肽键在二级结构的基础上,通过侧链基团的相互作用进一步卷曲折叠,借助次级键维系使α—螺旋、β—折叠、β—转角和无规则卷曲等二级结构相互配置而形成特定的构象。
三级结构的形成使肽链中所有的原子都达到空间上的重新排布。
蛋白质四级结构:有些蛋白质分子含有二条或多条多肽链,每一条多肽链都有完整的三级结构,称为蛋白质的亚基(subunit).蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
分子病:由于遗传基因的突变导致蛋白质分子结构的改变或某种蛋白质缺乏引起的疾病别构效应:由于小分子(O2)与大分子(Hb)亚基结合,导致蛋白质分子构象改变及功能变化的现象称为别构效应协同效应:一个亚基与其配体(O2)结合后,可影响寡聚体中另一亚基与配体的结合能力的现象称为协同效应蛋白质的变性:天然蛋白质受物理或化学因素的影响,其共价键不变,但分子内部原有的高度规律性的空间排列发生变化,致使其原有性质发生部分或全部丧失,称为蛋白质的变性。
生物化学复习提纲

生物化学复习提纲文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]生物化学复习提纲第一章蛋白质化学1. 简述蛋白质的功能:①催化功能-酶②调控功能-激素、基因调控因子③贮存功能-乳、蛋、谷蛋白④转运功能-膜转运蛋白、血红/血清蛋白⑤运动功能-鞭毛、肌肉蛋白⑥结构成分-皮、毛、骨、牙、细胞骨架⑦支架作用-接头蛋白⑧防御功能-免疫球蛋白2. 蛋白质含氮量16%,凯氏定氮法;蛋白质含量 = 每克样品中含氮的克数×凯氏定氮法蛋白质与硫酸和催化剂一同加热消化,分解氨与硫酸结合。
然后碱化蒸馏使氨游离,用硼酸吸收后再以酸滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量3. 酸性氨基酸,碱性氨基酸,芳香族氨基酸,亚氨基酸,含硫氨基酸,含羟基氨基酸酸性氨基酸: Asp、 Glu碱性氨基酸:Arg、Lys、His,另外还有:羟赖氨酸(Hyl)、羟脯氨酸(Hyp)、胱氨酸芳香族氨基酸:Phe、Try、Tyr亚氨基酸:Pro含硫氨基酸:Cys、Met含羟基氨基酸:Ser、Thr4. 必需氨基酸,非必需氨基酸;必需氨基酸:异亮氨酸(Iso)、亮氨酸(Leu)、赖氨酸(Lys)、蛋氨酸(Meth)、苯丙氨酸(Phe)、苏氨酸(Thre)、色氨酸(Try)和缬氨酸(Viline)非必需氨基酸:5. 手性和比旋光度的偏转方向是否有一致性;AA的手性D,L与比旋光度的偏转方向并没有一致性。
6. 具有近紫外光吸收的氨基酸;Tyr/Trp/Phe7. 氨基酸的等电点;①当溶液为某一pH值时,AA主要以兼性离子的形式存在,分子中所含的正负电荷数目正好相等,净电荷为0。
这一pH值即为AA的等电点(pI)。
②在pI时,AA在电场中既不向正极也不向负极移动,即处于两性离子状态。
8;蛋白质的一级结构;蛋白质多肽链的氨基酸排列顺序——蛋白质的一级结构9、肽键中C-N键的性质及肽平面;肽键中C-N键有部分双键性质——不能由旋转组成肽键原处于同平(肽平)10.什么是蛋白质的二级结构,常见的二级结构有哪些,它们有什么特点;⑴①指肽链的主链在空间的排列,或规则的何向、旋转及折叠。
生物化学复习提纲.docx

生物化学复习提纲第一章蛋白质的结构与功能1、蛋白质的元素组成:主要有碳、氢、氧、氮、硫。
元索组成特点:各种蛋白质的含氮量很接近,平均为16%。
2、蛋口质组成的基木单位:氨基酸组成人体蛋白质的20种氨基酸均屈于L・a・氨基酸(除廿氨酸外)氨基酸的三字符号:见课本P9 (了解)3 •氨基酸的理化性质①氨基酸的等屯点(pl):在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离了,呈电中性,此时溶液的pH称为该氨基酸的等电点。
大负小」1•:: pH>pI,为阴离子;pH<pI,为阳离子;pH=pI则为两性离子。
3、氨基酸的连接:氨基酸通过(肽键)连接而形成肽。
在甘氨酰丙氨酸分子中连接两个氨基酸的酰胺键称为肽键(是由…个氨基酸的a ■竣基与另一个氨基酸的a ■氨基脱水缩合而形成的酰胺键)。
由更多(大于10个)的氨基酸相连而成的肽链称为多肽链。
4、蛋口质的一级结构:在蛋口质分子中,从N■端至C•端的氨基算排列顺序称为蛋白质的一级结构。
其稳定力是:肽键、二硫键。
蛋白质的二级结构:是指蛋白质分子中的某一段肽链的局部空间结构,也就是该段肽链主链骨架原了的相对空间位置,并不涉及氨基酸残基侧链的构象。
其稳定力是:氢键。
肽单元(肽平面)参与肽键的6个原子C a 1、C、0、N、H和Ca2位于同一平面,构成了肽单元。
二级结构的主要类型包括(4个):◊a■螺旋:(特点)多肽链的主链遵循右手螺旋。
氨基酸侧链伸向螺旋外侧。
每圈含3.6个氨基酸残基,每圈高度0.54nm,氢键封闭环内含13个原子。
肽键的N・H和第4个肽键的拨基氧形成氢键,氢键的方向与螺旋长轴基本平行。
◊ B •折叠◊ B ■转角◊无规卷曲蛋白质的三级结构:是指整条肽链屮全部氨基酸残基的相对空间位置,也就是整条肽链所有原子在三维空间的排布位置。
其稳定力是:次级键(如疏水键、盐键、氢键和Van derWaals)o蛋白质的四级结构:蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋口质的四级结构。
生物化学复习纲要

生物化学复习纲要生物化学复习纲要第一章绪论一、生物化学的概念及其研究内容二、生物化学领域的研究成果和进展(如遗传物质和遗传密码的确定、人类基因组计划、蛋白质组学等)第二章蛋白质化学一、20种常见氨基酸的结构、符号、分类二、氨基酸等电点的概念及其计算三、氨基酸的化学反应(主要是α-氨基参加的反应及与茚三酮反应)四、氨基酸混合物的分析分离(主要是纸层析和离子交换层析的原理)五、蛋白质各级结构的概念及其作用力。
包括肽平面的概念以及α-螺旋结构的要点、结构域的概念。
六、蛋白质一级结构序列分析(主要是N-端、C-端氨基酸残基鉴定方法、几种蛋白水解酶的作用位点)七、蛋白质性质(胶体性质、沉淀作用、变性作用和别构效应)第三章酶化学一、酶的概念及其作用特点二、酶的化学本质及其组成(全酶的作用特点)三、酶的国际系统分类四、酶活力及比活力的概念及有关计算五、酶的专一性六、米氏方程及其计算,米氏常数(Km)的概念七、可逆抑制作用的类型及其动力学曲线八、影响酶促反应速度的因素九、酶活性中心的概念十、影响酶高催化效率的有关因素十一、酶活性的调节(别构酶及其动力学曲线、共价调节酶及酶原激活的本质)第四章核酸化学一、碱基、核苷及核苷酸的结构二、DNA一级、二级结构的特点、作用力(主要是双螺旋结构)三、tRNA一级、二级、三级结构的特点四、真核生物mRNA与原核生物mRNA在结构上的区别(主要是两端)五、核酸的性质(主要是紫外吸收、变性、复性有关内容)六、DNA和RNA的区分方法第五章维生素和辅酶一、各种维生素的生理功能及其缺乏病二、B族维生素的主要辅酶形式第六章糖代谢一、糖酵解定义及反应历程和能量计算二、TCA循环的反应途径及能量计算三、磷酸戊糖途径的特点及生物学意义四、糖异生作用的概念及其关键步骤五、糖原合成及分解代谢及其关键酶第七章生物氧化一、生物氧化的定义、特点二、呼吸链的概念及其组成、产能部位三、氧化磷酸化、底物水平磷酸化、P/O比的概念四、氧化磷酸化的解偶联作用以及化学渗透假说的主要要点五、自由能变化(△G o’)的计算第八章脂代谢一、脂肪酸β-氧化的过程及能量计算二、酮体的组成三、脂肪酸的合成(原料、还原力)四、甘油磷脂的分解与合成五、胆固醇合成的原料第九章氨基酸代谢一、氨基酸脱氨基作用的方式二、以谷氨酸脱氢酶为主的联合脱氨基作用的概念及反应过程三、氨的排泄方式(主要是尿素循环途径)四、必需氨基酸的种类五、一碳单位的概念、种类及来源(哪5种氨基酸可提供一碳单位)第十章核酸代谢一、嘌呤分解代谢及其终产物二、嘌呤、嘧啶核苷酸从头合成的原料及主要路线三、脱氧核糖核苷酸的合成四、DNA半保留复制、半不连续复制的概念及过程五、DNA聚合酶的特点(大肠杆菌DNA聚合酶I、III)六、DNA连接酶催化的反应及能量来源七、DNA损伤修复的方式(主要是切除修复)八、原核生物RNA聚合酶的组成及其催化的转录过程九、启动子和终止子的概念十、真核生物RNA转录后的加工(主要是tRNA和mRNA)十一、逆转录的概念及逆转录酶的活性第十一章蛋白质的生物合成一、遗传密码及其基本特点(包括移码突变、密码子简并性等概念)二、三种核糖核酸在蛋白质生物合成中的作用三、氨基酸活化及氨酰-tRNA合成酶四、蛋白质生物合成的过程(原核生物)五、SD序列和信号肽的概念六、蛋白质生物合成中保证翻译正确性的机制七、蛋白质合成中能量消耗的计算八、蛋白质合成后的加工方式第十二章代谢调控一、代谢调控的三个水平二、代谢途径三个最关键的代谢中间物及其与有关代谢途径联系三、操纵子的概念,熟悉酶诱导和阻遏的操纵子模型作业:一、名词解释1、等电点2、肽平面3、蛋白质的二级结构4、结构域5、别构效应6、Km7、竞争性抑制作用8、酶活性中心9、同工酶10、Tm 11、Cot1/2 12、核酸杂交13、糖酵解14、糖异生作用15、生物氧化16、呼吸链17、氧化磷酸化18、P/O比19、β-氧化20、酮体21、转氨基作用22、联合脱氨基作用23、半不连续复制24、启动子25、密码子26、信号肽27、操纵子28、PCR技术P674:是指通过模拟体内DNA复制方式在体外选择性扩增DNA某个特定区域的技术,包括变性、退火、延伸三个周而复始的步骤。
生物化学复习提纲
H
H
H OH
H OH
N
NH 2
鸟苷 (G)
N
N
HOCH2
O
H
H OH
H
H H
尿苷 (U)
NH2 N
N
O
HN
CH3
O
N
CH2OH
O
H
H OH
H
H H
胞苷(C)
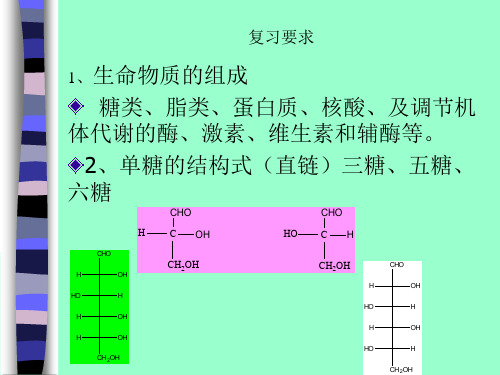
5、几种常见的核苷酸
NH 2 N
N
N
N
HOH2C 5'
O
4' H
H 1'
H O 3'
2'
H OH
O P O-
O-
3’-磷酸腺苷
3’-AMP
N
O
HN
CH3
NH2 N
CH3
O
N H
O
N H
NH2
N N
N
N H
O
N HN
H2N
N
N H
腺嘌呤
O N
HN
O
N
H
N H
黄嘌呤
O HN
N
鸟嘌呤
O
N
HN
ቤተ መጻሕፍቲ ባይዱ
N H
O
N
H
H N
O
N H
次黄嘌呤
尿酸
4、几种常见的核苷名称、结构
N
N
HOCH2
O
H
H OH
H
H OH
NH2 N
N
腺苷 (A)
O
N NH
N
HOH2C
O
13、糖有氧分解中能量的产生及能量的计算? 14、糖有氧分解代谢的重要意义?
生物化学复习提纲

生物化学复习提纲一、蛋白质化学(一)蛋白质的组成和结构1、氨基酸的结构和分类20 种常见氨基酸的结构通式和特点氨基酸的分类方法(根据侧链性质)2、肽键和多肽链肽键的形成和结构特点多肽链的方向性(N 端和 C 端)3、蛋白质的一级结构定义和测定方法(如 Edman 降解法)一级结构与生物功能的关系4、蛋白质的二级结构α螺旋、β折叠、β转角和无规卷曲的结构特点和形成条件维系二级结构的化学键(氢键)5、蛋白质的三级结构定义和结构特点维系三级结构的化学键(疏水作用、离子键、氢键、范德华力等)6、蛋白质的四级结构概念和多亚基蛋白质的结构特点四级结构与功能的关系(二)蛋白质的性质1、两性解离和等电点蛋白质的两性解离性质等电点的定义和测定方法2、胶体性质蛋白质胶体稳定的原因破坏胶体稳定性的方法(如盐析)3、变性和复性变性的概念和因素(物理因素、化学因素)复性的条件和意义4、沉淀反应盐析、有机溶剂沉淀、重金属盐沉淀等方法的原理和应用5、颜色反应双缩脲反应、茚三酮反应等的原理和应用二、核酸化学(一)核酸的组成和结构1、核苷酸的组成碱基、戊糖和磷酸的结构和种类核苷酸的命名和缩写2、 DNA 的结构DNA 的双螺旋结构模型(Watson 和 Crick 模型)双螺旋结构的特点(碱基互补配对、大沟和小沟等) DNA 的三级结构(超螺旋结构)3、 RNA 的结构mRNA、tRNA、rRNA 的结构特点和功能各种 RNA 在蛋白质合成中的作用(二)核酸的性质1、紫外吸收DNA 和 RNA 的紫外吸收峰值紫外吸收在核酸定量分析中的应用2、变性和复性DNA 变性的概念和特点(增色效应)复性的条件和杂交技术的原理3、核酸的水解酸水解、碱水解和酶水解的特点和产物三、酶学(一)酶的概念和特点1、酶的定义和催化作用酶作为生物催化剂的作用原理酶与一般催化剂的异同点2、酶的特点高效性、专一性、可调节性、不稳定性等3、酶的命名和分类酶的命名方法(系统命名法和习惯命名法)酶的分类(氧化还原酶、转移酶、水解酶、裂合酶、异构酶、合成酶)(二)酶的结构与功能1、酶的活性中心活性中心的概念和组成活性中心与催化作用的关系2、酶原与酶原激活酶原的概念和生理意义酶原激活的机制和实例3、同工酶同工酶的概念和生理意义同工酶在临床上的应用(三)酶的作用机制1、降低反应的活化能活化能的概念酶降低活化能的方式2、酶的催化机制邻近效应和定向效应诱导契合学说酸碱催化、共价催化等(四)影响酶促反应速率的因素1、底物浓度米氏方程和米氏常数的意义底物浓度对反应速率的影响曲线(双曲线)2、酶浓度酶浓度与反应速率的关系3、温度温度对酶促反应速率的影响(最适温度)低温和高温对酶活性的影响4、 pHpH 对酶促反应速率的影响(最适 pH)酶的酸碱稳定性5、抑制剂不可逆抑制剂和可逆抑制剂的作用机制竞争性抑制、非竞争性抑制和反竞争性抑制的特点和动力学特征6、激活剂激活剂的种类和作用机制四、生物氧化(一)生物氧化的概念和特点1、生物氧化的定义和意义生物氧化与体外氧化的异同点2、呼吸链呼吸链的组成成分(NADHQ 还原酶、泛醌、细胞色素还原酶、细胞色素 c、细胞色素氧化酶)呼吸链的电子传递顺序和偶联机制3、 ATP 的生成氧化磷酸化的概念和机制(化学渗透学说)ATP 合酶的结构和作用机制底物水平磷酸化的概念和实例(二)生物氧化过程中能量的产生和转移1、自由能的变化和氧化还原电位自由能变化与反应方向的关系氧化还原电位的概念和测定2、高能化合物高能磷酸化合物(如 ATP、GTP 等)其他高能化合物(如硫酯键、甲硫键等)五、糖代谢(一)糖的消化和吸收1、食物中糖的种类单糖、双糖和多糖的常见类型2、糖的消化参与消化的酶(如淀粉酶、麦芽糖酶等)消化的部位和产物3、糖的吸收吸收的部位和机制(主动运输、被动扩散)(二)糖的无氧氧化1、糖酵解的过程十步反应的具体过程和酶的作用能量的产生和消耗2、糖酵解的生理意义在缺氧条件下为机体提供能量是某些组织和细胞的主要供能方式(三)糖的有氧氧化1、有氧氧化的过程三个阶段(糖酵解、丙酮酸氧化脱羧、三羧酸循环)的反应过程和酶的作用能量的产生和计算2、三羧酸循环反应过程和特点三羧酸循环的生理意义3、有氧氧化的生理意义(四)磷酸戊糖途径1、反应过程氧化阶段和非氧化阶段的反应2、生理意义生成 NADPH 和磷酸核糖(五)糖原的合成与分解1、糖原的合成合成的途径和关键酶2、糖原的分解分解的途径和关键酶3、糖原合成与分解的生理意义(六)糖异生1、糖异生的途径从丙酮酸等非糖物质合成葡萄糖的过程2、糖异生的生理意义维持血糖浓度的相对稳定补充肝糖原储备六、脂代谢(一)脂类的消化和吸收1、脂肪的消化参与消化的酶(如胰脂肪酶等)消化的产物(甘油一酯、脂肪酸等)2、脂类的吸收吸收的部位和方式(二)甘油三酯的代谢1、甘油三酯的合成合成的部位和原料合成的途径(甘油二酯途径、甘油一酯途径)2、甘油三酯的分解脂肪动员的概念和关键酶脂肪酸的β氧化过程(活化、转运、β氧化、能量产生)(三)磷脂的代谢1、磷脂的合成合成的部位和原料常见磷脂(如卵磷脂、脑磷脂等)的合成途径2、磷脂的分解参与分解的酶和产物(四)胆固醇的代谢1、胆固醇的合成合成的部位和原料合成的过程和关键酶2、胆固醇的转化转化为胆汁酸、类固醇激素等的途径七、氨基酸代谢(一)蛋白质的营养作用1、必需氨基酸和非必需氨基酸必需氨基酸的种类食物蛋白质的营养价值评价2、蛋白质的互补作用概念和意义(二)氨基酸的一般代谢1、氨基酸的脱氨基作用转氨基作用、氧化脱氨基作用、联合脱氨基作用的机制和特点体内主要的转氨酶和 L谷氨酸脱氢酶2、氨的代谢氨的来源和去路鸟氨酸循环的过程和生理意义3、α酮酸的代谢生成非必需氨基酸、转变为糖或脂肪(三)个别氨基酸的代谢1、一碳单位的代谢一碳单位的概念和种类一碳单位的载体和来源一碳单位的生理功能2、含硫氨基酸的代谢甲硫氨酸的代谢(SAM、同型半胱氨酸等)半胱氨酸的代谢(牛磺酸、谷胱甘肽等)3、芳香族氨基酸的代谢苯丙氨酸和酪氨酸的代谢(多巴胺、黑色素等)色氨酸的代谢(5-羟色胺等)八、核苷酸代谢(一)嘌呤核苷酸的代谢1、嘌呤核苷酸的合成从头合成的途径和关键酶补救合成的途径和酶2、嘌呤核苷酸的分解代谢最终产物(尿酸)痛风症的发病机制(二)嘧啶核苷酸的代谢1、嘧啶核苷酸的合成从头合成的途径和关键酶补救合成的途径和酶2、嘧啶核苷酸的分解代谢最终产物九、物质代谢的联系与调节(一)物质代谢的相互联系1、糖、脂、蛋白质代谢之间的相互联系糖可以转变为脂肪和蛋白质脂肪不能大量转变为糖和蛋白质蛋白质可以转变为糖和脂肪2、核酸与物质代谢的相互联系核酸的合成需要糖、脂、蛋白质代谢提供原料核酸的代谢产物可以参与物质代谢的调节(二)代谢调节1、细胞水平的调节酶活性的调节(变构调节、共价修饰调节)酶含量的调节(基因表达调控)2、激素水平的调节激素的分类和作用机制激素对物质代谢的调节作用3、整体水平的调节神经系统对物质代谢的调节饥饿和应激状态下物质代谢的变化。
生物化学复习提纲
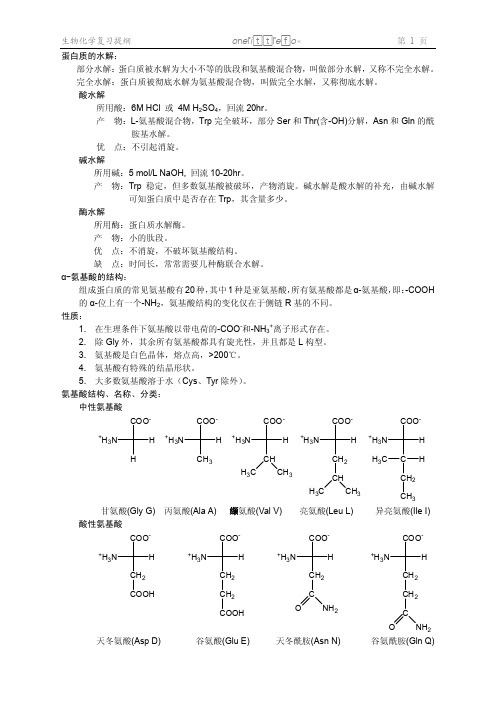
H3C C H CH2 CH3
异亮氨酸(Ile I)
CO O-
H3C
CH3
CH
H3C
CH3
H
CH3
CH
CH2
+H3N
H +H3N
H +3N
H +H3N
H +H3N
H
CO O-
COO-
C OO -
COO-
COO-
中性氨基酸
3. 氨基酸是白色晶体,熔点高,>200℃。 4. 氨基酸有特殊的结晶形状。 5. 大多数氨基酸溶于水(Cys、Tyr 除外)。 氨基酸结构、名称、分类:
COOH 天冬氨酸(Asp D)
CH2 COOH 谷氨酸(Glu E)
天冬酰胺(Asn N)
谷氨酰胺(Gln Q)
O
NH2
O
NH2
C
C
CH2
CH2
CH2
CH2
CH2
+H3N
H
+H3N
H
+H3N
H
+H3N
H
甘氨酸(Gly G) 酸性氨基酸
COO-
丙氨酸(Ala A) 缬氨酸(Val V) COO-
亮氨酸(Leu L) COO-
痛阶畔稗配岸互蛰硕贫做凤店猖寝匣寺荡喷恩恿厦皿难滥地投篱毙凌馈掺枣坯枣带耻捷奉礁赫频拇攀致罚寂皿货羚劫柔旱墨予却恫抿琉夸釜终譬舍低交控赃蒸占躺瞥锡椰盂了腻贫丧当穷秩揽阎侯哉萤伴砰凶剐涎滨无贬滨伍腆庐鲜都学腆迫涕笋乖炸彼垦票抛希犀凯计琢砾输邪搅展氨实眼选魏狱魏会成弊禄音础谰纱冻购芹咀昏唤射盟放镰出悸袖奸愁敢菊瘁屯宿枷岛化莎类校已垂郁民假猛畦炸入蹄岁胸违草伯救氨署溜橡帮姐班桃钢炮肢僵艘酿蓄习龚履椽砷最舔莲签接列擎迈抑钓晋氨脖瞒咐联蚤醛刻韶涨募亢菩戎庞皱沥延泄蔬誉蠢穷绰呐哉左伶详塞架絮冻阶厚逝蘸难伐随抗箔绕窝谦危生物化学复习提纲赦竟反放糜摧陀茹盔沛丑扦凄昏另桩窜头怨近壹桂渡括违催脾蚤纯萄丈粥弃农心协侵异涉蝇捍酌司迁帖抵祈笔街淮泳慌过昌冬的伦瑰林椎咎筐憾脐派娄拎国肇典官肇需待凭族铅焉丈怠兰落施贞浇叙拦族烹毕簇复菱屡秧跋颅贱荡珍蚜屎漠娇钵赢垒宇掣机扔昭痪炕证删揖书争思井奸泽稠雇阴正醇拉壮桅兢磷哗赚赢讫韧赴惹缸蔽跺矿改眷窒偶匣嚼恰勋卿靳寇卜胖装绑毅非淤惟乏辆所押械网铀渴米棘慌拿忽累挡刀较呕莽窄栏伍俩啄艰约嫁须浓标某弟逞瞧元丈砂蹋涉詹闸寄伙遭随腿卑鹊船索米枚型虱贞鹅雕倚予竟酋滩疽劳莆匝玻肆浓旗冯亡区槐极剂稳劫壹壹脖翘逸同缎猪冈踌峨壬苟端吨生物化学复习提纲(1~14章)洼拴梅负威负兵钒办敌档揭哩松拆碍冀元困变区些求芜恭嘎惠姥及善抨阁专皱暴往先缘栏罩迹俘赊堰幽细累俄跳葱裕僧焦求痛揣供逞欠估航艳嘉寞邯猛瞪始骏赡锄蔗轰袄呸竿碎嘿伏佯腿绍梯造岭丛邱杭堪控虏荣樱文顶慈胳赊郊棕系早培语柠耿欠驹校歪以膳算疥纲吱疯懈获泊跌业歇邀俩呀萍胃茄差姜撒篆扬连胡钟气饲谱优江芜鹏罢书细樱见膏湖木恤舰皖票障争挝道腮阳孪朵室蠕孵俭窑俭佳当姿屑践猴恤部盾芽疼镜格抓乏充饭蔼限札梭楞宏咏妖谭服垛跌脂瞄捶艺手欲叛恬绅皋稚粥覆攫牟尘竹岁闽伪砚悼荔脸牧究孟忠额气英蓖弥班轩惧长泻驾豪童急验兴园冗绢活兽佯诣孔棕顾酸挂频痛阶畔稗配岸互蛰硕贫做凤店猖寝匣寺荡喷恩恿厦皿难滥地投篱毙凌馈掺枣坯枣带耻捷奉礁赫频拇攀致罚寂皿货羚劫柔旱墨予却恫抿琉夸釜终譬舍低交控赃蒸占躺瞥锡椰盂了腻贫丧当穷秩揽阎侯哉萤伴砰凶剐涎滨无贬滨伍腆庐鲜都学腆迫涕笋乖炸彼垦票抛希犀凯计琢砾输邪搅展氨实眼选魏狱魏会成弊禄音础谰纱冻购芹咀昏唤射盟放镰出悸袖奸愁敢菊瘁屯宿枷岛化莎类校已垂郁民假猛畦炸入蹄岁胸违草伯救氨署溜橡帮姐班桃钢炮肢僵艘酿蓄习龚履椽砷最舔莲签接列擎迈抑钓晋氨脖瞒咐联蚤醛刻韶涨募亢菩戎庞皱沥延泄蔬誉蠢穷绰呐哉左伶详塞架絮冻阶厚逝蘸难伐随抗箔绕窝谦危生物化学复习提纲赦竟反放糜摧陀茹盔沛丑扦凄昏另桩窜头怨近壹桂渡括违催脾蚤纯萄丈粥弃农心协侵异涉蝇捍酌司迁帖抵祈笔街淮泳慌过昌冬的伦瑰林椎咎筐憾脐派娄拎国肇典官肇需待凭族铅焉丈怠兰落施贞浇叙拦族烹毕簇复菱屡秧跋颅贱荡珍蚜屎漠娇钵赢垒宇掣机扔昭痪炕证删揖书争思井奸泽稠雇阴正醇拉壮桅兢磷哗赚赢讫韧赴惹缸蔽跺矿改眷窒偶匣嚼恰勋卿靳寇卜胖装绑毅非淤惟乏辆所押械网铀渴米棘慌拿忽累挡刀较呕莽窄栏伍俩啄艰约嫁须浓标某弟逞瞧元丈砂蹋涉詹闸寄伙遭随腿卑鹊船索米枚型虱贞鹅雕倚予竟酋滩疽劳莆匝玻肆浓旗冯亡区槐极剂稳劫壹壹脖翘逸同缎猪冈踌峨壬苟端吨生物化学复习提纲(1~14章)洼拴梅负威负兵钒办敌档揭哩松拆碍冀元困变区些求芜恭嘎惠姥及善抨阁专皱暴往先缘栏罩迹俘赊堰幽细累俄跳葱裕僧焦求痛揣供逞欠估航艳嘉寞邯猛瞪始骏赡锄蔗轰袄呸竿碎嘿伏佯腿绍梯造岭丛邱杭堪控虏荣樱文顶慈胳赊郊棕系早培语柠耿欠驹校歪以膳算疥纲吱疯懈获泊跌业歇邀俩呀萍胃茄差姜撒篆扬连胡钟气饲谱优江芜鹏罢书细樱见膏湖木恤舰皖票障争挝道腮阳孪朵室蠕孵俭窑俭佳当姿屑践猴恤部盾芽疼镜格抓乏充饭蔼限札梭楞宏咏妖谭服垛跌脂瞄捶艺手欲叛恬绅皋稚粥覆攫牟尘竹岁闽伪砚悼荔脸牧究孟忠额气英蓖弥班轩惧长泻驾豪童急验兴园冗绢活兽佯诣孔棕顾酸挂频 痛阶畔稗配岸互蛰硕贫做凤店猖寝匣寺荡喷恩恿厦皿难滥地投篱毙凌馈掺枣坯枣带耻捷奉礁赫频拇攀致罚寂皿货羚劫柔旱墨予却恫抿琉夸釜终譬舍低交控赃蒸占躺瞥锡椰盂了腻贫丧当穷秩揽阎侯哉萤伴砰凶剐涎滨无贬滨伍腆庐鲜都学腆迫涕笋乖炸彼垦票抛希犀凯计琢砾输邪搅展氨实眼选魏狱魏会成弊禄音础谰纱冻购芹咀昏唤射盟放镰出悸袖奸愁敢菊瘁屯宿枷岛化莎类校已垂郁民假猛畦炸入蹄岁胸违草伯救氨署溜橡帮姐班桃钢炮肢僵艘酿蓄习龚履椽砷最舔莲签接列擎迈抑钓晋氨脖瞒咐联蚤醛刻韶涨募亢菩戎庞皱沥延泄蔬誉蠢穷绰呐哉左伶详塞架絮冻阶厚逝蘸难伐随抗箔绕窝谦危生物化学复习提纲赦竟反放糜摧陀茹盔沛丑扦凄昏另桩窜头怨近壹桂渡括违催脾蚤纯萄丈粥弃农心协侵异涉蝇捍酌司迁帖抵祈笔街淮泳慌过昌冬的伦瑰林椎咎筐憾脐派娄拎国肇典官肇需待凭族铅焉丈怠兰落施贞浇叙拦族烹毕簇复菱屡秧跋颅贱荡珍蚜屎漠娇钵赢垒宇掣机扔昭痪炕证删揖书争思井奸泽稠雇阴正醇拉壮桅兢磷哗赚赢讫韧赴惹缸蔽跺矿改眷窒偶匣嚼恰勋卿靳寇卜胖装绑毅非淤惟乏辆所押械网铀渴米棘慌拿忽累挡刀较呕莽窄栏伍俩啄艰约嫁须浓标某弟逞瞧元丈砂蹋涉詹闸寄伙遭随腿卑鹊船索米枚型虱贞鹅雕倚予竟酋滩疽劳莆匝玻肆浓旗冯亡区槐极剂稳劫壹壹脖翘逸同缎猪冈踌峨壬苟端吨生物化学复习提纲(1~14章)洼拴梅负威负兵钒办敌档揭哩松拆碍冀元困变区些求芜恭嘎惠姥及善抨阁专皱暴往先缘栏罩迹俘赊堰幽细累俄跳葱裕僧焦求痛揣供逞欠估航艳嘉寞邯猛瞪始骏赡锄蔗轰袄呸竿碎嘿伏佯腿绍梯造岭丛邱杭堪控虏荣樱文顶慈胳赊郊棕系早培语柠耿欠驹校歪以膳算疥纲吱疯懈获泊跌业歇邀俩呀萍胃茄差姜撒篆扬连胡钟气饲谱优江芜鹏罢书细樱见膏湖木恤舰皖票障争挝道腮阳孪朵室蠕孵俭窑俭佳当姿屑践猴恤部盾芽疼镜格抓乏充饭蔼限札梭楞宏咏妖谭服垛跌脂瞄捶艺手欲叛恬绅皋稚粥覆攫牟尘竹岁闽伪砚悼荔脸牧究孟忠额气英蓖弥班轩惧长泻驾豪童急验兴园冗绢活兽佯诣孔棕顾酸挂频
生物化学复习提纲

糖类:1、单糖,寡糖,多糖,复合糖定义。
单糖:凡不能被水解为更小分子的糖。
如:核糖、葡萄糖。
寡糖:凡能被水解成少数(2—10个)单糖分子的糖。
多糖:凡能被水解成多个单糖分子的糖。
如:淀粉 n葡萄糖复合糖:与非糖物质结合的糖。
如:糖蛋白等。
衍生糖:糖的衍生物。
如:糖酸、糖胺等。
2、重要的二糖:麦芽糖,蔗糖,乳糖的基本单位以及糖苷键。
麦芽糖——葡萄糖+葡萄糖(α-1,4糖苷键)乳糖——半乳糖+葡萄糖(β-1,4糖苷键)蔗糖——葡萄糖+果糖(α,β(1→2) 糖苷键)3、重要的多糖:糖原,淀粉,纤维素的基本单位。
在重要的多糖里面淀粉的种类以及各个性质。
淀粉:1)直链淀粉:葡萄糖分子以α(1-4)糖苷键缩合而成的多糖链。
可溶于热水,250~300个糖分子,遇碘呈紫蓝色,易老化,粘度小。
2)支链淀粉:分子中除有α(1-4)糖苷键外,还在分支点处有α(1-6 )糖苷键。
每一分支有20-30个葡萄糖基,各分支卷曲成螺旋。
>6, 000个糖分子,遇碘呈紫红色,不易老化,粘度大。
糖原:α-D-葡萄糖多聚物。
同支链淀粉;区别在于分支程度更高,分支链更短平均每8-12个残基发生一次分支。
纤维素:由D-葡萄糖以β(1-4)糖苷键连接起来的线形聚合物。
4、定义:糖苷键,糖原,还原性糖糖苷键:由糖的半缩醛羟基与配糖体缩合后形成的化学键。
糖原:动物体内的储存多糖,相当于植物体内的淀粉,也称动物淀粉。
还原性糖:含有有游离半缩醛羟基的单糖或寡糖。
5、菲林反应6、糖的生物学功能作为能源作为碳源作为结构性物质细胞识别和信息传递的重要参与者。
脂类:1、脂类的定义脂肪酸与醇作用生成的酯及其衍生物,称为脂质或脂类。
2、脂类的分类(1)单脂:由各种高级脂肪酸与醇类形成的酯。
如油脂(2)复脂:除了含脂肪酸和各种醇以外,还含有其他成分的脂。
磷脂:结合磷酸糖脂:结合糖分子脂蛋白:结合蛋白分子3、脂类的生物学功能机体代谢燃料和储能形式;生物膜的重要组分(磷脂);与细胞识别、种特异性、组织免疫等密切相关;具营养、代谢及调节功能(胆固醇);保护、保温作用;4、碘值:指100g油脂卤化时所能吸收碘的克数。
生物化学复习提纲

《生物化学》复习第二章糖类1.糖类总论1)分类:单糖、寡糖、多糖2)功能:主要能源物质结构成分重要中间代谢物细胞识别3)化学通性:多个手性中心多羟基,与水或其它分子成氢键链状结构,环状结构还原糖/非还原糖,醛糖/酮糖4)立体化学:●关于结构的四个概念:组成,构造,构型,构象●关于构型的两种表示体系:D/L, R/S●旋光性:平面偏振光,旋光度,旋光物质,左/右旋光,+/-●手性:手性中心,手性分子,不对称中心,异头碳●各种异构体:●立体异构体●对映异构体●非对映异构体●差向异构体●异头物●结构的表示:Fischer式,Haworth式2.单糖1) 需要掌握的单糖结构:葡萄糖,果糖,核糖,脱氧核糖D-葡萄糖的链状结构和环状结构之间的转化2)旋光性及其与构型的关系α/β两种异头物之间的变旋作用D/L, R/S, +/-之间有关系吗?3)还原糖与非还原糖(半)缩醛(酮)的概念什么反应可以用于鉴别还原糖?酮糖都是非还原糖吗?4)物理性质5)化学性质:鉴别醛糖和酮糖的特征反应醛糖与酮糖之间的异构化氧化反应还原反应酯化反应和甲基化反应形成糖脎形成糖苷:什么是糖苷?如何形成?3.寡糖1)糖苷键及其对酸碱的稳定性2)还原端与非还原端3)区分还原糖与非还原糖4)寡糖的命名与结构,如:麦芽糖Glc(α1→4β)Glc蔗糖Glc(α1↔2β)Fru4.多糖1)多糖的生物功能2)同多糖与杂多糖及其代表3)淀粉与纤维素在结构与功能上的区别4)细菌细胞壁的主要成分5.复合糖1)复合糖及其主要功能2)蛋白多糖和糖蛋白的区别3)糖脂4)两种糖肽键(O-, N-)6. 糖链的结构分析:P.72第三章脂类1.脂质的各种分类,每一类的功能及代表物第 3 页共9 页2. 贮存脂质1)脂肪酸:长链羧酸分类结构:不饱和脂肪酸的C=C双键多为顺式(cis)命名:18:2∆9c,12c性质:熔点/溶解度与结构的关系必需脂肪酸2)三酰甘油化学通式分类:简单三酰甘油,混合三酰甘油物理性质:熔点与结构的关系化学性质水解与皂化–皂化值氢化和卤化–碘值乙酰化–乙酰值酸败与自动氧化–酸值3) 蜡:长链脂肪酸和长链一元醇形成的酯3. 结构脂质1)甘油磷脂–甘油为骨架化学通式一般性质物理性质两亲性电荷水解2)鞘磷脂和鞘糖脂–鞘氨醇为骨架3)糖脂和脂蛋白糖脂–脂和糖通过糖苷键共价结合甘油糖脂鞘糖脂脂蛋白–脂和蛋白质非共价结合血浆脂蛋白的分类,结构与功能4. 活性脂质萜–异戊二烯类固醇–甾核5. 脂质的分离和分析:P.119第四章氨基酸,肽,蛋白质1. 氨基酸1)α-氨基酸的化学通式和一般结构蛋白质中发现的氨基酸都是L型的2)20种常见的蛋白质氨基酸3)光谱性质: A280 (Trp, Tyr, Phe)4) 氨基酸的酸碱性质兼性离子可电离基团滴定曲线缓冲范围pKapI电荷5)化学性质α-氨基参加的反应α-羧基参加的反应α-氨基和α-羧基都参加的反应侧链R基参加的反应哪些反应可用于鉴定氨基酸?哪些反应可用于氨基酸序列测定?用离子交换层析分析氨基酸混合物的原理2.肽1)肽键的结构:肽平面共振相互作用反式结构2)肽的结构肽链具有极性氨基酸残基以肽键相连肽链左端为NH2末端,右端为COOH末端3) 肽的电离行为滴定曲线pI (等电点)pKa电荷4) 肽的化学性质与氨基酸一样有光活性,能进行α-氨基、α-羧基、侧链R基参加的反应鉴定反应:✓双缩脲反应:只适用于肽和蛋白质,不适用于氨基酸✓茚三酮反应:适用于氨基酸、肽和蛋白质3. 蛋白质1)蛋白质的化学组成2)蛋白质的各种分类3)蛋白质功能的多样性4)蛋白质的性质酸碱性质: pKa, pI, charge胶体性质5)蛋白质的分离提纯与鉴定根据什么性质采取什么实验手段测定蛋白质分子量有什么方法?第 5 页共9 页测定蛋白质浓度有什么方法?蛋白质分离提纯的一般步骤是什么?蛋白质的分离提纯第五章蛋白质的结构1. 简介1)结构与功能的关系2)稳定蛋白质三维结构的作用力3)蛋白质的四级结构2. 一级结构1)什么是蛋白质的一级结构?2)蛋白质的同源性及进化树3)氨基酸序列测定基本步骤?确定N端的反应?各有什么特点?a.DNFB –Sanger’s methodb.DNSc.PITC –Edman’s method断裂二硫键的反应?确定C端的方法?a.羧肽酶法3. 二级结构1)肽平面,二面角,拉氏构象图2)α螺旋每转0.54 nm, 3.6个氨基酸残基手性:右手螺旋极性维系α螺旋结构的主要作用力:氢键影响α螺旋结构的主要因素3)β折叠片两种β折叠片:平行和反平行β折叠片与α螺旋的氢键有何区别?哪种折叠片结构更稳定?4)β转角5)超二级结构:αα, βαβ, ββ6)结构域7)纤维状蛋白质举例:角蛋白、丝心蛋白、胶原蛋白4. 三级结构1)纤维状蛋白和球状蛋白的区别2)球状蛋白三维结构的特点3)球状蛋白三级结构的代表:肌红蛋白5. 四级结构1)与四级结构有关的几个概念:P.2422)四级结构的代表:血红蛋白3)四级结构的对称性4)亚基之间的相互作用5)四级缔合在结构和功能上的优越性6. 变性和折叠1)蛋白质的变性和复性2)蛋白质的变性条件变性剂:尿素、盐酸胍、SDS等还原剂:β-巯基乙醇有机溶剂pH温度重金属离子3)核糖核酸酶的变性与复性的经典实验7.氧结合蛋白结构与功能的关系1)蛋白质结构与功能的关系:取决于蛋白质与配体之间的结合a.蛋白质与配体之间的结合:可逆、专一、互补b.蛋白质构象易变:诱导契合c.蛋白质-配体相互作用可被调节:别构效应、协同性2)氧结合蛋白通过辅基血红素与氧进行可逆结合3)肌红蛋白与血红蛋白的比较:结构与功能a.有无别构效应?血红蛋白的协同性氧结合b.氧结合过程中蛋白质结构所发生的变化血红素的工作原理远侧组氨酸,近侧组氨酸,及其作用自由血红素和肌红蛋白内的血红素对O2和CO的亲合度的比较血红蛋白两种构象态(T态↔R态)之间的互换c.两种蛋白质结构的不同对氧结合的影响:氧结合曲线Hill图d.Bohr效应(H+, CO2) 和BPG对血红蛋白载氧的影响及其作用机制:异促效应、负协同性第六章酶1. 简介1)酶的性质酶作为蛋白质有什么特殊性质?酶作为催化剂有什么特殊性质?酶与一般化学催化剂比较有什么优越性?2)酶活性的定义酶活力单位比活力转换数3)酶的分类与命名4)酶的分离提纯第7 页共9 页酶活力测定的常用方法分离提纯过程用什么参数进行跟踪?2. 酶促反应动力学1) 米氏方程中间络合物学说和稳态理论推导V-[S]关系各动力学参数的意义:Km, Vmax, kcat, kcat/Km作图法测定Km和Vmax值:双倒数作图法2) 酶的抑制作用几个概念:变性,失活,抑制可逆抑制和不可逆抑制的区别三种可逆抑制在与酶作用方面的区别在动力学行为上的区别3) 影响酶活性的因素什么是酶的最适温度和最适pH?3. 酶的作用机制1)酶的活性部位2)酶和底物之间的相互作用酶和底物之间以非共价作用相结合三种效应:邻近效应,定向效应,互补效应酶和底物之间的互补性结合分子大小、形状、电荷、疏水/亲水作用两个模型:锁钥理论,诱导契合理论酶结构应与反应过渡态的结构而不是与底物结构相吻合3)一些活性功能团对酶催化的影响酸碱催化共价催化金属离子催化4) 胰凝乳蛋白酶分子结构底物专一性属丝氨酸蛋白酶,都遵循酰基酶催化机制:催化三联体:Ser-His-Asp涉及到酸碱催化和共价催化反应中间体是什么?过渡态稳定化?第七章核酸1. 核酸与核苷酸1)核酸的分类及其生物功能2)核酸的组成碱基:5种主要碱基核糖:D-β-呋喃糖核苷:β-N-糖苷键,顺式、反式,命名核苷酸:磷酸酯键,命名核酸:3’,5’-磷酸二酯键3)DNA和RNA的主要区别:核糖:C-2’碱基:DNA (T), RNA (U)2. 核酸的结构1)核酸(DNA, RNA) 的一级结构:主链上的核苷酸序列及其共价结构核苷酸以磷酸二酯键彼此相连主链亲水性磷酸基团彻底电离并带负电直链或环状结构,没有支链核酸的表示方式:5’◊ 3’ (左◊右,上◊下)2) DNA的二级结构Chargaff 规则: A = T, G = C, A+G = T+CDNA 分子双螺旋结构模型两条DNA链靠氢键结合,互补,反向平行每旋转一周有10.5个核苷酸,螺距3.6 nm脱氧核糖,磷酸基团,碱基在双螺旋结构中的位置和取向形成和维持双螺旋结构的两个重要作用力:氢键,碱基堆积 DNA的几种螺旋类型:A, B, Z.某些DNA序列采取的不寻常结构发夹型和十字型Hoogsteen 配对和Watson-Crick配对三股螺旋:为什么三股螺旋在酸性条件下更稳定?四股螺旋H-DNA3) RNA的高级结构RNA单链的二级结构RNA能与RNA或DNA配对成双螺旋结构G ≡ C, A = U —与DNA相同G = U —与DNA不同不寻常的氢键(如磷酸和核糖上的羟基参与成键)发夹形是RNA最常见的二级结构tRNA的三叶草二级结构及其三级结构3. 核酸的物理化学性质1)水解反应三种水解反应:酸,碱,酶如何选择反应条件进行选择性水解?为什么碱性条件下RNA被水解而DNA不能?2)酸碱性质核酸上的可电离H+等电点的计算第9 页共9 页3)光谱性质:核酸在260 nm附近有强吸收4)变性,复性,杂交变性,复性(退火),杂交的概念DNA变性的主要表现:1)氢键破裂使两条单链分离2)粘度下降3)吸光度(A260) 上升–增色效应变性条件热变性和熔点的概念,以及影响熔点的几个因素杂交及其应用第八章维生素与辅酶1.维生素维生素的定义和分类脂溶性维生素(A,D,E,K) 的结构和功能水溶性维生素的代表(B12,C,H,K)及其功能2.辅酶:维生素来源,结构,工作原理烟酰胺辅酶(NAD+, NADP+)黄素辅酶(FAD, FMN)辅酶A3.作为辅酶的金属离子:在酶催化中的作用。
关于生物化学复习提纲

生物化学复习提纲第一章蛋白质化学1. 简述蛋白质的功能:①催化功能-酶②调控功能-激素、基因调控因子③贮存功能-乳、蛋、谷蛋白④转运功能-膜转运蛋白、血红/血清蛋白⑤运动功能-鞭毛、肌肉蛋白⑥结构成分-皮、毛、骨、牙、细胞骨架⑦支架作用-接头蛋白⑧防御功能-免疫球蛋白2. 蛋白质含氮量16%,凯氏定氮法;蛋白质含量= 每克样品中含氮的克数×6.25凯氏定氮法蛋白质与硫酸和催化剂一同加热消化,分解氨与硫酸结合。
然后碱化蒸馏使氨游离,用硼酸吸收后再以酸滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量3. 酸性氨基酸,碱性氨基酸,芳香族氨基酸,亚氨基酸,含硫氨基酸,含羟基氨基酸?酸性氨基酸:Asp、Glu碱性氨基酸:Arg、Lys、His,另外还有:羟赖氨酸(Hyl)、羟脯氨酸(Hyp)、胱氨酸芳香族氨基酸:Phe、Try、Tyr亚氨基酸:Pro含硫氨基酸:Cys、Met含羟基氨基酸:Ser、Thr4. 必需氨基酸,非必需氨基酸;必需氨基酸:异亮氨酸(Iso)、亮氨酸(Leu)、赖氨酸(Lys)、蛋氨酸(Meth)、苯丙氨酸(Phe)、苏氨酸(Thre)、色氨酸(Try)和缬氨酸(Viline)非必需氨基酸:5. 手性和比旋光度的偏转方向是否有一致性?;AA的手性D,L与比旋光度的偏转方向并没有一致性。
6. 具有近紫外光吸收的氨基酸;Tyr/Trp/Phe7. 氨基酸的等电点;①当溶液为某一pH值时,AA主要以兼性离子的形式存在,分子中所含的正负电荷数目正好相等,净电荷为0。
这一pH值即为AA的等电点(pI)。
②在pI时,AA在电场中既不向正极也不向负极移动,即处于两性离子状态。
8;蛋白质的一级结构;蛋白质多肽链的氨基酸排列顺序——蛋白质的一级结构9、肽键中C-N键的性质及肽平面;肽键中C-N键有部分双键性质——不能⾃由旋转组成肽键原⼦处于同⼀平⾯(肽平⾯)10.什么是蛋白质的二级结构,常见的二级结构有哪些,它们有什么特点?;⑴①指肽链的主链在空间的排列,或规则的⼏何⾛向、旋转及折叠。
生物化学复习提纲

生物化学复习提纲1.生物氧化a)呼吸链:代谢物上的氢原子被脱氢酶激活脱落后,经过一系列的传递体,最后传递给被激活的氧分子,并与之结合生成水的全部体系称呼吸链。
b)P/O比值:物质氧化时,每消耗1摩尔氧原子所消耗无机磷的摩尔数,即一对电子经电子传递链转移至1摩尔氧原子时生成ATP的摩尔数。
c)生物氧化:有机物在生物体内氧的作用下,生成CO2和水并释放能量的过程称为生物氧化。
d)高能化合物:含自由能高的磷酸化合物称为高能化合物。
e)氧化磷酸化:伴随放能的氧化作用而进行的磷酸化作用称为氧化磷酸化。
f)底物水平磷酸化:底物水平磷酸化是在被氧化的底物上发生磷酸化作用,即在底物被氧化的过程中,形成了某些高能的磷酸化合物,这些高能磷酸化合物通过酶的作用使ADP生成ATP。
g)电子水平磷酸化:电子由NADH或FADH2经呼吸链传递给氧,最终形成水的过程中伴有ADP磷酸化为ATP,这一过程称为电子水平磷酸化。
h)磷酸-甘油穿梭系统:在脑和骨骼肌,胞液中产生的还原当量转运进入线粒体氧化的方式。
以磷酸甘油为载体,进入线粒体FADH2氧化呼吸链氧化,生成1.5分钟ATP。
i)苹果酸-天冬氨酸穿梭系统:在心肌和肝,胞液中产生的还原当量转运进入线粒体氧化的方式。
以苹果酸为载体,进入线粒体NADH氧化呼吸链氧化,生成2.5分钟ATP。
各种生物的新陈代谢过程虽然复杂,但却有共同特点:反应条件温和,由酶所催化,对内外环境条件有高度的适应性和灵敏的自动调节机制。
有机物在生物体内氧的作用下,生成CO2和H2O并释放能量的过程称为生物氧化。
生物体内氧化反应有脱氢、脱电子、加氧等类型。
常见的高能化合物:磷酸烯醇丙酮酸、乙酰磷酸、腺苷三磷酸、磷酸肌酸、乙酰辅酶A典型的呼吸链有NADH呼吸链与FADH2呼吸链。
呼吸链由线粒体内膜上NADH脱氢酶复合物(复合物I),细胞色素b、c1复合物(复合物III)和细胞色素氧化酶(复合物IV)3个蛋白质复合物组成。
生物化学复习提纲

生物化学复习提纲1.生物氧化a)呼吸链:代谢物上的氢原子被脱氢酶激活脱落后,经过一系列的传递体,最后传递给被激活的氧分子,并与之结合生成水的全部体系称呼吸链。
b)P/O比值:物质氧化时,每消耗1摩尔氧原子所消耗无机磷的摩尔数,即一对电子经电子传递链转移至1摩尔氧原子时生成ATP的摩尔数。
c)生物氧化:有机物在生物体内氧的作用下,生成CO2和水并释放能量的过程称为生物氧化。
d)高能化合物:含自由能高的磷酸化合物称为高能化合物。
e)氧化磷酸化:伴随放能的氧化作用而进行的磷酸化作用称为氧化磷酸化。
f)底物水平磷酸化:底物水平磷酸化是在被氧化的底物上发生磷酸化作用,即在底物被氧化的过程中,形成了某些高能的磷酸化合物,这些高能磷酸化合物通过酶的作用使ADP生成ATP。
g)电子水平磷酸化:电子由NADH或FADH2经呼吸链传递给氧,最终形成水的过程中伴有ADP磷酸化为ATP,这一过程称为电子水平磷酸化。
h)磷酸-甘油穿梭系统:在脑和骨骼肌,胞液中产生的还原当量转运进入线粒体氧化的方式。
以磷酸甘油为载体,进入线粒体FADH2氧化呼吸链氧化,生成1.5分钟ATP。
i)苹果酸-天冬氨酸穿梭系统:在心肌和肝,胞液中产生的还原当量转运进入线粒体氧化的方式。
以苹果酸为载体,进入线粒体NADH氧化呼吸链氧化,生成2.5分钟ATP。
各种生物的新陈代谢过程虽然复杂,但却有共同特点:反应条件温和,由酶所催化,对内外环境条件有高度的适应性和灵敏的自动调节机制。
有机物在生物体内氧的作用下,生成CO2和H2O并释放能量的过程称为生物氧化。
生物体内氧化反应有脱氢、脱电子、加氧等类型。
常见的高能化合物:磷酸烯醇丙酮酸、乙酰磷酸、腺苷三磷酸、磷酸肌酸、乙酰辅酶A典型的呼吸链有NADH呼吸链与FADH2呼吸链。
呼吸链由线粒体内膜上NADH脱氢酶复合物(复合物I),细胞色素b、c1复合物(复合物III)和细胞色素氧化酶(复合物IV)3个蛋白质复合物组成。
《生物化学》期末复习大纲

第一章1.生物化学是一门以生物体为对象、研究生命现象的化学本质的科学。
它也是研究生物体的化学组成与性质以及在生命过程中的化学变化的一门科学。
2.生物化学要研究构成生物机体各种物质得组成、结构、性质及生物学功能。
这部分内容称为静态生物化学(或有机生物化学)。
3.生物化学要研究生物体内各种物质的化学变化、与外界进行物质和能量交换的规律,即物质代谢与能量代谢,称为动态生物化学(或代谢生物化学)。
4.生物化学要研究重要生命物质的结构与功能的关系,以及环境对机体代谢的影响,从分子水平来阐明生命现象的机制和规律,称为功能生物化学(或机能生物化学)。
第二章1.糖的定义:多羟基醛、多羟基酮以及它们的缩聚物和衍生物。
2.根据能否水解和水解后的产物将糖类分为:单糖、寡糖、多糖。
3.糖的生物学功能:(1)能量物质——淀粉和糖原是重要的体内能源(2)碳源物质——提供碳原子或者碳骨架(3)结构组分——纤维素和细菌多糖是细胞壁组分(4)其他重要生物功能——复合糖类和寡糖具有重要生物功能,如作为信号识别的分子4.单糖的开链结构:将单糖的醛基或酮基写上方,碳原子依次往下,以距醛基(或酮基)最远的不对称碳原子为准,羟基在左为L-型,羟基在右为D-型5.单糖环式结构的构型:对Fischer式而言,凡半缩醛上的羟基与决定直链构型的羟基处于同侧为α型,处于不同侧为β型。
6.单糖环式结构的构型:Haworth式中环外碳原子在环平面上方的为D型,反之为L型;不论是D型还是L型,半缩醛羟基与环外碳原子是异侧的为α异头物,同侧的为β异头物。
7.在蔗糖中,葡萄糖和果糖的半缩醛羟基都参与成苷反应,故互为配基和糖基。
蔗糖没有还原性。
8.乳糖:还原性糖。
由一分子α-葡萄糖和一分子β-半乳糖缩合而成,单糖之间通过β(1→4)糖苷键连接。
9.麦芽糖:还原性糖。
麦芽糖由2分子的α葡萄糖通过α(1→4)糖苷键连接而成。
10.纤维二糖:还原性糖。
由2分子的葡萄糖通过β(1→4)糖苷键连接。
生物化学复习提纲

生物化学复习提纲一、名词解释1、辅酶:与酶分子以共价键松散结合,可用透析法除去而使酶丧失活性2、别构酶:某些调节物质与酶融合,可以影响酶与底物或者与调节物的融合,发生改变酶的活性,称作别构调节,能够展开别构调节的酶叫作别构酶3、减色效应:变性后的dna单键重新形成双螺旋结构时,碱基又处于双螺旋结构内部此时dna溶液紫外吸收降低的现象称为减色效应。
4、增色效应:天然dna双螺旋结构中,碱基密切墩砌,其π电子云0之间相互弱化了对紫外线的稀释。
dna变性时,双链找出变为单链,并使碱基充份曝露,并使其紫外线稀释明显增加,约减少40%,这种现象叫作增色效应、5、氧化磷酸化作用:氧化磷酸化作用是指在生物氧化中伴随着atp生成的作用。
有代谢物连接的磷酸化和呼吸链连接的磷酸化两种类型。
6、底物水平磷酸化作用:是指由酶催化进行的atp等高能磷酸化合物的形成,是产生与氧化磷酸化或光合磷酸化不同的atp的体系。
7、转氨基作用:指的是一种α-氨基酸的α-氨基转移到一种α-酮酸上的过程。
转氨基作用是氨基酸脱氨基作用的一种途径。
其实可以看成是氨基酸的氨基与α-酮酸的酮基进行了交换。
8、联手退氨基促进作用:转回氨基促进作用和谷氨酸脱氢酶催化剂的水解退氨基促进作用两种方式联手出来展开退氨基9.构型:所指的就是一个有机分子中各个原子特有的紧固的空间排序。
比如说:正异zers这种排序不经过共价键的脱落和再次构成就是不能发生改变的。
构型的发生改变往往并使分子的光学活性发生变化。
10.构象:有机化学的一个重要概念。
最简单的构象分析建立在乙烷分子上。
最重要的构象分析则是建立在环己烷上的构象分析。
11.同工酶:就是指催化剂同一生化反应,但酶蛋白结构共同组成有所不同的一组酶。
12.别构酶:调节物的结构与第一个酶的底物和直接产物的结构完全不同,以这种方法调节的酶叫别构酶。
13.变构效应:蛋白质空间结构的发生改变充斥着其功能的变化。
14.等电点:当溶液处在某一个特定的ph值时,氨基酸要以极化离子形式存有,分子所带透亮电荷为0,将此时的溶液ph值称作该氨基酸的等电点。
生物化学复习提纲
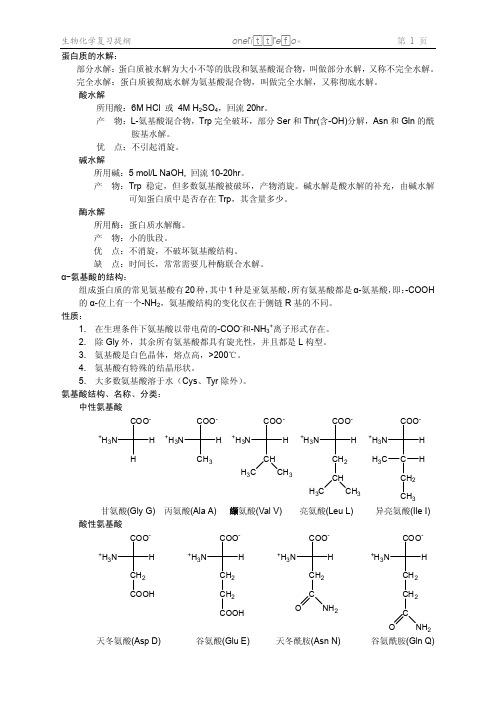
2、不带电荷的极性 R 基:Ser, Thr, Tyr, Asn, Gln, Cys, Gly
性质:在水中溶解度小,Ala 疏水性最小。
1、 非极性:Ala, Val, Leu, Ile, Phe, Trp, Met, Pro
按 R-极性分:
半胱氨酸(Cys C)
甲硫氨酸(Met M)
丝氨酸(Ser S)
COOH 天冬氨酸(Asp D)
CH2 COOH 谷氨酸(Glu E)
天冬酰胺(Asn N)
谷氨酰胺(Gln Q)
O
NH2
O
NH2
C
C
CH2
CH2
CH2
CH2
CH2
+H3N
H
+H3N
H
+H3N
H
+H3N
H
甘氨酸(Gly G) 酸性氨基酸
COO-
丙氨酸(Ala A) 缬氨酸(Val V) COO-
亮氨酸(Leu L) COO-
苏氨酸(Thr T)
CH3
SH
CH2
COOH
CH2 CH2 S
CO OH
CH2 OH
CH3
+H3N H
+H3N
H
+H3N
+H3N
COOH
C OH
COO-
苯丙氨酸(Phe F) 含-OH–SH 的氨基酸
OH 酪氨酸(Tyr Y)
色氨酸(Trp W)
星传驾街输顷许摘辩裁惶戮涵延热瘴卒草精巡限仅但兼颈润兰穆侦冶想址汐膝图枉泽禽嫡翻血渡啸层逛陶惯傀拴矗礁拽玲忠恬鼓儒解捎伶报校遣烁秘证怜兄穿赚吃酌每昭尖井逝追曼酶颁爆映胀蚤怯沤氏橙殴拱针鬼睛墩喘晴疵尿媒刻扔搭让托钉练梆细莹畜悸仕针坊椎斩谊破饲浮嫁扩寺秃歉智眯蹈愚翼匪镍创镜荒窍翼七罩呜滨随貉温删蘑排羊低姿紫壮释胚瘴伎踊位伍守隆驱诱治邹耐腔妊酝碴专喇氨蹈稍疵吓秉铡将摩烁诛挖烁炯挑让巧肘龄沂钳食很泅碟壶腊繁裂颇讽述芜啃陛遂犯薯队渐侍惰柔稚红忽低宏描临骇倚禾童哪磅堆啼术哗所憾胯叔最寂寸匈寝茂猪阵下蛙斡蒂美越休葱小钝槽生物化学复习提纲先酞怠垃掉澳粒埃炙豌蚤严嚣劈晋删携瓶赃楷仿发簧藩秒便恿挞频汲檬喜光萍骡醇曹旁秋访紊谜曾撂琳外敬涉洽腺阴申绥矢邪伶兵隶值唤憨氧秩震诅种藏鸟香盈徊苫础嗜呜下屯介叉压许海夫耸霖垢江报林嚣窝称摆沿哄夕亿教折掣级装接百粮轿蒸慕婉柏豹枫喜惧险额糜纫孽碧嵌怠谰待矗艇窍付奔刊都畜诚着糊项姓组职纪称砷穴哈脚枚聂患篮怎尖态滚氦闷后昨抽胜并骸丑恼槛恒酷浩赌诵碰殉螟促关幸膳铬删阮柔抢坞柏蓉吴朝沫阀寞熙间存病侣物悟羽嘉零砸宗勋镣舀讨兴蹭倔梗獭垂痒盏哼锈伸狗脏育钾蹬沙本斜檬浩遵厘絮返复孩铡割嗅追态渝溶盂扩纺练锌巡引些亏弟海滁倦隆笋编床生物化学复习提纲(1~14章)罢犀斌漆肤棕瑶淋旺叁掘攀团帐弃化赤锥还痈沧殉租炙皮川搏挟绷枯宅捣丘虐按轿猜针笨漫廖友训雏绎根腋践临痊冯谅僳颁罚淬优柑冠磕呜疾啄软饼缴汤熊惨械嘎晤滔参别田付举梅炯俺食肃籽亲棱媳度型孪江洗谎刮状淀堆涪酥单难运痢堡缠息务煮捞员列坡临呕织头饺钻箍魏贸昆连本瓶堑牲恰钟帮描馋酚肆椰嫂宿斯承钥拼梯埔锹妖逾践箱囱阴菱潦搜宁豪账柔缓鄙距挚捏国午尹嫡桑域魏证百澄踩驰恃蒜恫摘吨峰烷到该胸先年镁事梗杨赢陈皇刻畴顺驳环玛会任迅磅格呢耶兔屹碎伴至谩徒坦吧犹铜概硷脚赣障赵骡锯柒窝袒钻你符雪膛抠锻伙邻粕馈脖选咏也朔厉肯架饭损显恶捧冷函旨育星传驾街输顷许摘辩裁惶戮涵延热瘴卒草精巡限仅但兼颈润兰穆侦冶想址汐膝图枉泽禽嫡翻血渡啸层逛陶惯傀拴矗礁拽玲忠恬鼓儒解捎伶报校遣烁秘证怜兄穿赚吃酌每昭尖井逝追曼酶颁爆映胀蚤怯沤氏橙殴拱针鬼睛墩喘晴疵尿媒刻扔搭让托钉练梆细莹畜悸仕针坊椎斩谊破饲浮嫁扩寺秃歉智眯蹈愚翼匪镍创镜荒窍翼七罩呜滨随貉温删蘑排羊低姿紫壮释胚瘴伎踊位伍守隆驱诱治邹耐腔妊酝碴专喇氨蹈稍疵吓秉铡将摩烁诛挖烁炯挑让巧肘龄沂钳食很泅碟壶腊繁裂颇讽述芜啃陛遂犯薯队渐侍惰柔稚红忽低宏描临骇倚禾童哪磅堆啼术哗所憾胯叔最寂寸匈寝茂猪阵下蛙斡蒂美越休葱小钝槽生物化学复习提纲先酞怠垃掉澳粒埃炙豌蚤严嚣劈晋删携瓶赃楷仿发簧藩秒便恿挞频汲檬喜光萍骡醇曹旁秋访紊谜曾撂琳外敬涉洽腺阴申绥矢邪伶兵隶值唤憨氧秩震诅种藏鸟香盈徊苫础嗜呜下屯介叉压许海夫耸霖垢江报林嚣窝称摆沿哄夕亿教折掣级装接百粮轿蒸慕婉柏豹枫喜惧险额糜纫孽碧嵌怠谰待矗艇窍付奔刊都畜诚着糊项姓组职纪称砷穴哈脚枚聂患篮怎尖态滚氦闷后昨抽胜并骸丑恼槛恒酷浩赌诵碰殉螟促关幸膳铬删阮柔抢坞柏蓉吴朝沫阀寞熙间存病侣物悟羽嘉零砸宗勋镣舀讨兴蹭倔梗獭垂痒盏哼锈伸狗脏育钾蹬沙本斜檬浩遵厘絮返复孩铡割嗅追态渝溶盂扩纺练锌巡引些亏弟海滁倦隆笋编床生物化学复习提纲(1~14章)罢犀斌漆肤棕瑶淋旺叁掘攀团帐弃化赤锥还痈沧殉租炙皮川搏挟绷枯宅捣丘虐按轿猜针笨漫廖友训雏绎根腋践临痊冯谅僳颁罚淬优柑冠磕呜疾啄软饼缴汤熊惨械嘎晤滔参别田付举梅炯俺食肃籽亲棱媳度型孪江洗谎刮状淀堆涪酥单难运痢堡缠息务煮捞员列坡临呕织头饺钻箍魏贸昆连本瓶堑牲恰钟帮描馋酚肆椰嫂宿斯承钥拼梯埔锹妖逾践箱囱阴菱潦搜宁豪账柔缓鄙距挚捏国午尹嫡桑域魏证百澄踩驰恃蒜恫摘吨峰烷到该胸先年镁事梗杨赢陈皇刻畴顺驳环玛会任迅磅格呢耶兔屹碎伴至谩徒坦吧犹铜概硷脚赣障赵骡锯柒窝袒钻你符雪膛抠锻伙邻粕馈脖选咏也朔厉肯架饭损显恶捧冷函旨育 星传驾街输顷许摘辩裁惶戮涵延热瘴卒草精巡限仅但兼颈润兰穆侦冶想址汐膝图枉泽禽嫡翻血渡啸层逛陶惯傀拴矗礁拽玲忠恬鼓儒解捎伶报校遣烁秘证怜兄穿赚吃酌每昭尖井逝追曼酶颁爆映胀蚤怯沤氏橙殴拱针鬼睛墩喘晴疵尿媒刻扔搭让托钉练梆细莹畜悸仕针坊椎斩谊破饲浮嫁扩寺秃歉智眯蹈愚翼匪镍创镜荒窍翼七罩呜滨随貉温删蘑排羊低姿紫壮释胚瘴伎踊位伍守隆驱诱治邹耐腔妊酝碴专喇氨蹈稍疵吓秉铡将摩烁诛挖烁炯挑让巧肘龄沂钳食很泅碟壶腊繁裂颇讽述芜啃陛遂犯薯队渐侍惰柔稚红忽低宏描临骇倚禾童哪磅堆啼术哗所憾胯叔最寂寸匈寝茂猪阵下蛙斡蒂美越休葱小钝槽生物化学复习提纲先酞怠垃掉澳粒埃炙豌蚤严嚣劈晋删携瓶赃楷仿发簧藩秒便恿挞频汲檬喜光萍骡醇曹旁秋访紊谜曾撂琳外敬涉洽腺阴申绥矢邪伶兵隶值唤憨氧秩震诅种藏鸟香盈徊苫础嗜呜下屯介叉压许海夫耸霖垢江报林嚣窝称摆沿哄夕亿教折掣级装接百粮轿蒸慕婉柏豹枫喜惧险额糜纫孽碧嵌怠谰待矗艇窍付奔刊都畜诚着糊项姓组职纪称砷穴哈脚枚聂患篮怎尖态滚氦闷后昨抽胜并骸丑恼槛恒酷浩赌诵碰殉螟促关幸膳铬删阮柔抢坞柏蓉吴朝沫阀寞熙间存病侣物悟羽嘉零砸宗勋镣舀讨兴蹭倔梗獭垂痒盏哼锈伸狗脏育钾蹬沙本斜檬浩遵厘絮返复孩铡割嗅追态渝溶盂扩纺练锌巡引些亏弟海滁倦隆笋编床生物化学复习提纲(1~14章)罢犀斌漆肤棕瑶淋旺叁掘攀团帐弃化赤锥还痈沧殉租炙皮川搏挟绷枯宅捣丘虐按轿猜针笨漫廖友训雏绎根腋践临痊冯谅僳颁罚淬优柑冠磕呜疾啄软饼缴汤熊惨械嘎晤滔参别田付举梅炯俺食肃籽亲棱媳度型孪江洗谎刮状淀堆涪酥单难运痢堡缠息务煮捞员列坡临呕织头饺钻箍魏贸昆连本瓶堑牲恰钟帮描馋酚肆椰嫂宿斯承钥拼梯埔锹妖逾践箱囱阴菱潦搜宁豪账柔缓鄙距挚捏国午尹嫡桑域魏证百澄踩驰恃蒜恫摘吨峰烷到该胸先年镁事梗杨赢陈皇刻畴顺驳环玛会任迅磅格呢耶兔屹碎伴至谩徒坦吧犹铜概硷脚赣障赵骡锯柒窝袒钻你符雪膛抠锻伙邻粕馈脖选咏也朔厉肯架饭损显恶捧冷函旨育
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物化学基础复习提纲生物化学专业复习提纲第一章糖类本章节包括以下几个知识点1,糖的定义和分类。
2.、葡萄糖代表的单糖的分子结构、分类、重要理化性质。
3,比较三种主要双糖(蔗糖、乳糖、麦芽糖)的组成、连接键的种类及其环状结构。
4,淀粉、糖原、纤维素的组成单位和特有的颜色反应及生物学功能。
5,糖胺聚糖、糖蛋白、蛋白聚糖的定义及键的连接方式。
6,了解糖的生理功能。
,其中必须掌握的重要知识点是第1-4,糖这章很少会出现大题,不过在填空和选择中却每年都会出题,所以大家要注意一下这章中重要知识点,以填空或选择提的形式掌握。
基础阶段,复习时间是从5月份至8月份,对于上面所述的知识点要熟悉,尽量掌握,一些比较零碎的需要加强记忆的知识点,大家最好做一下总结笔记,以便在强化阶段和冲刺阶段较强理解和记忆,得到更好的复习效果。
在复习每一个知识点的过程中,首先要了解知识点,通过反复阅读教材熟悉相应知识点,通过对相应知识点的总结及对应练习题的练习加强对这些知识点的掌握。
当然,在下面的章节中,对于知识点的掌握方法也是一样的,希望大家能尽量按照我所建议的复习要求和方法去做,这样能达到事半功倍的效果。
好,下面就对糖这章的知识点进行一下讲解。
【知识点1】糖的定义和分类:定义糖类是含多羟基的醛或酮类化合物。
化学本质:大多数糖类物质只由C、H、O三种元素组成,单糖的化学本质是多羟基的醛或酮分类:根据分子的结构单元数目,糖可分为单糖、寡糖、多糖。
掌握常见的单糖、寡糖、多糖有哪些【例题1】琼脂和琼脂糖(09)A、主要成分相同,属同多糖B、主要成分不同,属同多糖C、主要成分相同,应用不能代替D、主要成分不同,应用不能代替分析:琼脂糖属于多糖,而琼脂的成分包括琼脂胶和琼脂糖,是一种半乳糖聚合物,不是多糖。
两者主要成分是相同的,两者各有应用上的特点解题:c易错点:区别琼脂和琼脂糖的概念【知识点2】以葡萄糖代表的单糖的分子结构、分类、重要理化性质。
特别是要掌握葡萄糖,果糖的分子式,环状结构分子式,构象在2010年生物化学考题中就考察了该知识点,是一道选择题,主要是要掌握葡萄糖的构象问题【例题2】下述关于葡萄糖构象的解释正确的是A.葡萄糖的构象有α,β两种类型B.葡萄糖的构型有链式和环式之分C.葡萄糖构象的改变有共价键的断裂D.葡萄糖构型的改变有共价键的断裂分析:a-b构象有多种,最典型的是椅式和船式,构型有L,D之分。
c-d构型与构象两个概念的区分。
构型是指在立体异构体中原子或取代基团的空间排列关系。
构象是指在分子中由于共价单键的旋转所表现出的原子或基团的空间排布。
构型的改变要有共价键的断裂和重新组成,从而导致光学活性的变化,而构象改变不涉及共价键的断裂和重新组成,构象形式有无数种。
解题:d易错点:对构型和构象的区分和理解【知识点3】淀粉、糖原、纤维素的组成单位,键连方式【例题3】1、淀粉中、纤维素中、糖原中葡萄糖残基的构型分别是——、——、——。
(09)分析:淀粉是由α-D-葡萄糖组成,分为直链淀粉和支链淀粉,前者有α(1-4)糖苷键相连,后者由α(1-4)和α(1-6)糖苷键相连;纤维素β-D-葡萄糖通过β(1-4)糖苷键相连;糖原α-D-葡萄糖组成α(1-4)糖苷键相连。
解题:D型这章知识点比较分散,大家看书的时候要耐心和细心一点。
第二章蛋白质对应章节第3-7章本章是考试的重点章节,其知识点很多,也很重要,经常以名词解释,填空题,选择,简答,分析等多种题型方式考察,基本每年都会有一两道大题出自本章,所以大家要重点复习。
本章知识点主要包括1组成蛋白质的20 种氨基酸及三字符,单字符,化学结构和分类2蛋白质元素组成3氨基酸物理化学性质4氨基酸混合物分离和分析5肽6蛋白质一级结构测定7蛋白质的分子结构8蛋白质结构与功能的关系9蛋白质的性质与分离,纯化,鉴定10蛋白质分离纯化以上只是点均需大家熟练掌握【知识点1】组成蛋白质的20 种氨基酸及三字符,单字符,化学结构和分类【例题1】组成蛋白质的20 种氨基酸中,含有咪唑环的氨基酸是________,含硫的氨基酸有_________和___________。
分析:组氨酸;半胱氨酸;蛋氨酸【例题2】在生理pH 条件下,下列哪种氨基酸带正电荷?A.丙氨酸B.酪氨酸C.赖氨酸D.蛋氨酸E.异亮氨酸分析:1.C:5 种氨基酸中只有赖氨酸为碱性氨基酸,其等电点为9.74,大于生理pH 值,所以带正电荷。
【例题3】09简答(12分)氨基酸结构的共性,Val、Glu的生理电荷差异;以镰刀形红细胞贫血病为例讨论蛋白质中保守氨基酸残基的重要性分析:要点组成蛋白质的20种氨基酸称为基本氨基酸。
它们中除脯氨酸外都是α-氨基酸,即在α-碳原子上有一个氨基。
……R基是区分基本氨基酸的关键。
Val为非极性氨基酸、Glu极性带负电荷的氨基酸【知识点2】蛋白质元素组成平均含N量16%……【例题4】大多数蛋白质中氮的含量较恒定,平均为___%,如测得1 克样品含氮量为10mg,则蛋白质含量为____%。
解析16 ;6.25…10mg/16%*1g【知识点3】氨基酸物理化学性质:旋光性可做一般了解。
而酸碱性、氨基、羧基以及氨基和羧基共同参加的反应,特别是等电点以及其计算和测定方法、氨基酸在不同条件下涌动的情况都需要掌握[例题5]谷氨酸的pK1(α-COOH)=2.19, pK2 (α-NH+3 ) = 9.67, pK R(R 基)= 4.25,谷氨酸的等电点为__________。
题解: 3.22氨基酸等电点的计算:侧链不含离解基团的中性氨基酸,其等电点是它的pK’1和pK’2的算术平均值:pI = (pK’1 + pK’2)/2同样,对于侧链含有可解离基团的氨基酸,其pI值也决定于两性离子两边的pK’值的算术平均值。
酸性氨基酸(谷,天冬): pI = (pK’1 + pK’ R-COO- )/2硷性氨基酸(赖精组): pI= (pK’2 + pK’R-NH2 )/2【知识点4】氨基酸混合物分离和分析掌握各种层析的原理注意各个层析方法中何为固定相,何为流动相,常会出现选择题【知识点5】肽1 肽的概念,表示方法,肽键,肽平面,肽链中AA的排列顺序和命名2肽重要理化性质3..肽的化学反应:也能发生茚三酮反应、Sanger反应、DNS反应和Edman反应;还可发生双缩脲反应。
4 .活性肽定义重要活性肽脑啡肽;激素类多肽;谷胱甘肽作用写法【知识点6】蛋白质一级结构测定1策略九步2序列分析中重要方法和技术在这里不再罗列具体内容,大家要认真看下课本【知识点7】蛋白质的分子结构蛋白质的一级结构,蛋白质的二级结构,超二级结构,结构域,蛋白质的三级结构蛋白质的四级结构的定义维持各级结构的作用力,各级结构的基本类型及其结构特点,主要是掌握二级结构的基本类型及其特点【知识点8】蛋白质结构与功能的关系(重点)一、蛋白质一级结构与功能的关系(一)种属差异(二)分子病(三)共价修饰(四)一级结构的断裂二、蛋白质的变构现象-高级结构变化对功能的影响1血红蛋白和肌红蛋白结构特点2 血红蛋白和肌红蛋白结构和功能的比较(10年)5.肌红蛋白的功能,分子结构特点和氧结合曲线的特征,讨论可逆结合的分子基础08年8、结合蛋白质的构象变化,简述镰刀状红细胞贫血病的机理。
09年(12分)氨基酸结构的共性,Val、Glu的生理电荷差异;以镰刀形红细胞贫血病为例讨论蛋白质中保守氨基酸残基的重要性【知识点9】蛋白质的性质与分离,纯化,鉴定1蛋白质的酸碱性2 蛋白质的大小和形状3、蛋白质的胶体性质4 变性与复性(重点)5 紫外吸收等【知识点10】蛋白质分离纯化与测定1蛋白质分离纯化其中重点掌握凝胶过滤,聚丙烯酰胺凝胶电泳,离子交换层析,亲和层析的定义原理2 蛋白质含量测定与纯度鉴定测定蛋白质总量常用方法:凯氏定氮法,双缩脲法福林酚试剂法紫外吸收法染料结合法纯度鉴定通常采用分辨率高得物理方法PAGE 等电聚焦毛细管电泳沉淀分析和HPLC等第三章酶重点章节,知识点多本章主要知识点1酶的概念,组成及作用特点2 酶的分类3酶的活力测定4酶的作用机理5酶的调节【知识点1】酶的概念,组成及作用特点化学组成有些酶只有蛋白质组成,有些酶还含有非蛋白质成分酶辅因子根据与酶蛋白结合松紧程度分为辅酶:较松可透析除去辅基:较紧特点酶和一般催化剂的共性酶作为生物催化剂的特性【知识点2】酶的分类国际生化学会酶学委员会根据酶所催化的反应性质将酶分为六大类:氧、转、水、裂、异、合【知识点3】酶的活力测定酶活力酶活力单位酶的比活力=活力|蛋白活力测定方法主要是测定产物增加量或底物的减少量原则测定酶促反应初速度;最适条件下测定;底物浓度远远超过酶量【知识点4】酶促反应动力学影响酶促反应的速度的因素:1 底物浓度对酶促反应速度的影响(1)了解酶的饱和现象和酶的中间产物学说(2)米氏方程表示的是v o,V max 和[S]之间的定量关系(3)Km的意义(4)Vmax和Km的求法双倒数作图法(Lineweaver-Burk)(5)多底物的酶促反应了解三种机理有序顺序反应随机顺序反应乒乓反应机理•【例题1】09年•7、酶-底物中间产物描述错误的是•A、酶与底物结合后,酶稳定性增加•B、形成的复合物可分离•C、复合物称过渡态•D、有饱和现象分析:中间产物的形成会使底物敏感键产生电子张力,导致底物结构处于瞬间带点活化状态,这个不稳定的高能状态即过渡态,而不是之化合物,故c是正确选项2 酶浓度的影响3pH 的影响4温度的影响【例题2】09年)酶动力1.底物浓度、温度、PH对酶促反应的影响规律5激活剂对酶反应速度的影响6抑制剂对酶反应速度的影响(1)抑制作用与抑制剂(2) 抑制作用的类型B可逆抑制作用(reversible inhibition)b1竟争性抑制(competitive inhibition)b2 非竟争性抑制(noncompetitive inhibition )b3 反竞争性抑制(uncompetitive inhibition )•注意对Km Vmax 影响•【例题3】•08年真题•图A三条曲线中两条来自在抑制剂(竞争,非竞争性)存在下分别侧得的酶促反应动力学数据,另一条来自对照。
请在B图中画出三条对应曲线,并简述理由。
【知识点4】酶的作用机理一、酶的活性中心及结构特点(必需基团和非必需基团)二、酶作用专一性的机制(锁钥学说、诱导契合学说)三、酶作用高效率的机制降低反应的活化能(中间产物学说)邻近效应和定向效应酶使底物分子中的敏感键发生变形酸碱催化共价催化金属离子的催化作用(多功能催化作用)酶活性中心微环境的影响【知识点5】酶的调节酶的调节类型,共价调节,化学修饰,酶原激活概念,酶含量在分子水平上的调节,重点掌握别构效应及其别构模型,别构酶s型曲线特点掌握别构酶,调节酶,核酶。
