湖北省监利一中高二化学 酯化反应方程式书写专题练习(无答案)
湖北省监利县第一中学高中化学 有机合成专题一训练题(无答案)新人教版选修5

有机合成训练题一1.下面是有机合成的三个步骤:①对不同的合成路线进行优选 ②由目标分子逆推原料分子并设计合成路线 ③观察目标分子的结构。
正确的顺序为( )A .①②③B .③②①C .②③①D .②①③2.在有机合成中,要求过程科学、简捷,下列相关过程不合理的是( ) CH 2CH 2CH 2CH 2BrBr CH 2CH 2OH OH A . 乙烯乙二醇加成取代 B.溴乙烷→乙醇:CH 3CH 2Br −−−→消去CH 2=CH 2 −−−→加成CH 3CH 2OHC.乙醛→乙烯:CH 3CHO −−−→加成CH 3CH 2OH −−−→消去CH 2=CH 2D.乙醇→乙酸:CH 3CH 2OH −−−→氧化CH 3CHO −−−→氧化CH 3COOH 3.乙烯酮在一定条件下能与含活泼氢的化合物发生加成:,它与下列试剂发生加成反应时所生成的产物不正确的是( )A .与HCl 加成生成CH 3COClB .与H 2O 加成生成CH 3COOHC .与CH 3OH 加成生成CH 3COCH 2OHD .与CH 3COOH 加成生成(CH 3CO)2O4.以溴乙烷为原料制备1,2-二溴乙烷,下列方案中最合理的是( ) A.CH 3CH 2Br NaOH −−−→水CH 3CH 2OH 170−−−→浓硫酸℃CH 2=CH 2Br 2−−−→CH 2BrCH 2Br B.CH 3CH 2Br Br 2−−−→CH 2BrCH 2BrC.CH 3CH 2BrNaOH 醇溶液加热CH 2=CH 2HBr −−−→CH 2BrCH 3Br 2−−−→CH 2BrCH 2Br D.CH 3CH 2Br NaOH 醇溶液加热CH 2=CH 2Br 2−−−→CH 2Br CH 2Br 5.下列有机化学反应类型的归类,不正确的是( )A .工业合成聚乙烯:加聚反应D .C 2H 5OH +HBr CH 3CH 2Br +H 2O :取代反应6.对某结构为右图所示的化合物,则有关生成该物质的叙述正确的是 ( )A .由两分子乙醇分子间脱水而成B .由乙酸与乙二醇酯化而成C .由两分子乙二醇脱水而成D .苯酚经加氢而成7.以乙醇为原料,用下述6种类型的反应来合成乙二酸乙二酯(结构简式为 ),正确的顺序是( )①氧化②消去③加成④酯化⑤水解⑥加聚A.①⑤②③④ B.①②③④⑤ C.②③⑤①④ D.②③⑤①⑥8.某种有机物的结构简式为COOOOCCH3OOCCH2CH3当它完全水解时,不可能得到的产物是( )A.CH3COOHB.CH3CH2COOHC.CH3OHD. COOH OH9.已知:某一元氯代烃A分子式为C6H11Cl,可以发生如下图所示的转化:结构分析表明F分子中含有两个甲基且没有支链。
监利县第一中学校2018-2019学年高二9月月考化学试题解析

监利县第一中学校2018-2019学年高二9月月考化学试题解析班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.下列各组中的物质均能发生加成反应的是()A.乙烯和乙醇B.苯和氯乙烯C.乙酸和溴乙烷D.丙烯和丙烷2.下列说法正确的是A.碘单质的升华过程中,只需克服分子间作用力B.NH4Cl属于离子化合物,该物质中只存在离子键C.在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成D.金刚石和足球烯(C60)均为原子晶体3.不论以何种比例混合,将甲和乙两种混合气体同时通入丙溶液中,一定能产生沉淀的组合是()A.②③④B.②④C.①③D.②④⑤4.从化学试剂商店买来的无水乙醇试剂瓶上所贴的危险化学品标志是()A.腐蚀品B.爆炸品C.易燃液体D.剧毒品5.乙醇分子中不同的化学键如下图所示,对乙醇在各种反应中应断裂的键说明错误的是()A.和金属钠作用时,键①断裂B.在Cu的催化作用下和O2反应时,键①和③断裂C.与乙酸、浓硫酸共热发生酯化反应时,键②断裂D.与乙酸、浓硫酸共热发生酯化反应时,键①断裂6.如图是四种常见有机物的比例模型示意图,下列说法正确的是A.甲能发生氧化反应B.乙通入溴的四氯化碳溶液,最后得到无色溶液不能和液溴反应C.煤干馏得到的煤焦油可以分离出丙,丙是无色无味的液态烃D.丁发生催化氧化得到的产物不能与金属钠反应7.下列离子方程式正确的是()A.石灰水与过量碳酸氢钠溶液反应:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2OB.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2OC.氧化铜与稀硫酸反应:2H++O2﹣═H2OD.碳酸氢钠溶液中加入盐酸:CO32﹣+2H+═CO2↑+H2O8.【2017新课标1卷】已知(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是()A.b的同分异构体只有d和p两种B.b、d、p的二氯代物均只有三种C.b、d、p均可与酸性高锰酸钾溶液反应D.b、d、p中只有b的所有原子处于同一平面9.在一定温度下,溶液发生催化分解。
湖北省监利县第一中学高中化学 第一章 第一节 有机化
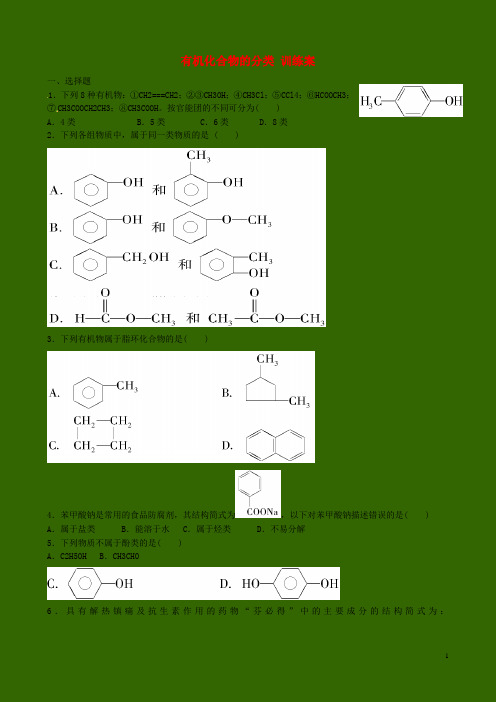
有机化合物的分类训练案一、选择题1.下列8种有机物:①CH2===CH2;②③CH3OH;④CH3Cl;⑤CCl4;⑥HCOOCH3;⑦CH3COOCH2CH3;⑧CH3COOH。
按官能团的不同可分为( )A.4类B.5类 C.6类 D.8类2.下列各组物质中,属于同一类物质的是 ( )3.下列有机物属于脂环化合物的是( )4.苯甲酸钠是常用的食品防腐剂,其结构简式为,以下对苯甲酸钠描述错误的是( ) A.属于盐类 B.能溶于水 C.属于烃类D.不易分解5.下列物质不属于酚类的是( )A.C2H5OH B.CH3CHO6.具有解热镇痛及抗生素作用的药物“芬必得”中的主要成分的结构简式为:,它属于( )A.芳香烃 B.易升华物质C.易溶于水的有机酸D.苯甲酸的同系物7.某有机物的比例模型为,有关该物质的推断不正确的是( )A.分子中可能含有羟基 B.分子中可能含有羧基C.分子中可能含有氨基 D.该物质的分子式为C3H6O38.历史上最早应用的还原性染料是靛蓝,其结构简式为,下列关于靛蓝的叙述中错误的是()A.靛蓝由碳、氢、氧、氮四种元素组成 B.它的分子式是C16H14N2O2C.该物质属于芳香化合物 D.它含有碳碳双键和酯基9.从结构上分析,有一种物质不同于其他三种,该物质是( )10.现代家居装修材料中,普遍存在着甲醛、苯及苯的同系物等有毒物质,如果不处理,就会对人体产生极大的危害。
按照有机物的分类,甲醛属于醛类有机物;苯及苯的同系物属于芳香烃。
下面各项对有机物的分类方法与此方法相同的是( )11.近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件。
断肠草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式。
下列有关说法正确的是( )A.②中所含官能团种类比③中多B.①、④互为同系物C.①、②、③、④均由C、H、O三种元素组成D.等物质的量的②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少二、简答题12.酚酞是常用的酸碱指示剂,其结构简式如下所示:(1)酚酞的分子式为:__________________________________。
湖北省监利一中高二上学期期中考试(化学).doc

湖北省监利一中高二上学期期中考试(化学)考试时间:100分钟第I 卷(共54分)可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32一、选择题(本题包含18小题,每小题3分,共54分,每小题只有一个选项)1.下列说法中不正确的是A .与煤、柴油相比较,天然气是一种比较清洁的化石燃料B .煤转化为水煤气再燃烧放出的热量不会增加,因此煤的气化无意义C .利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量D .乙醇是一种可再生能源,作为燃料的优点的是完全燃烧的产物不污染环境2.对有气体参加的某化学反应来说,在下图中可能作为横坐标的是A .温度B .压强C .反应物浓度D .反应时间3.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是A.加入KHSO 4固体 B.不用铁片,改用铁粉C.滴加少量硫酸铜溶液 D.加入KNO 3固体4.制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现( ) ①)()()(3)(23300气气气固H SiHCl HCl Si C ++︒ ②HCl Si H SiHCl C 395023++︒对上述两个反应的下列叙述中,错误..的是 A.两个反应都是置换反应B.两个反应都是氧化还原反应 C.两个反应互为可逆反应D. 反应②是放热反应 5.某温度时,浓度都是1mol·L -1的两种气体X 2、Y 2,在密闭容器中反应生成气体Z ,达到平衡时c(X 2)=0.4mol·L -1、c(Y 2)=0.8mol·L -1、c(Z)=0.4mol·L -1,则该反应的反应式是A. X 2+2Y 22XY 2 B. 2X 2+Y 22X 2Y C. 3X 2+Y 2 2X 3Y D. X 2+3Y 22XY 3 6.对可逆反应N 2 + 3H 2 2NH 3 ,下列描述能说明反应已达平衡的是△H = -381 kJ/molA .单位时间内有a mol N 2消耗,同时生成2a mol NH 3B .氨气的浓度不再变化C .容器内氮气、氢气、氨气的浓度之比为1︰3︰2D .化学反应速率关系是:2v 正(NH 3) = 3v 逆(H 2)7.已知:①1molH 2分子中化学键断裂时需要吸收436kJ 的能量②1molCl 2分子中化学键断裂时需要吸收243kJ 的能量③由H 原子和Cl 原子形成1molHCl 分子时释放431kJ 的能量下列叙述正确的是A .氢气与氯气反应生成1mol 氯化氢气体,反应的△H =—183kJ/molB .氢气与氯气反应生成2mol 氯化氢气体,反应的△H =+183kJ/molC .氢气与氯气反应生成氯化氢气体的反应是吸热反应,D .氢气和氯气反应的热化学方程式是H 2(g )+Cl 2(g )=2HCl (g )△H =—183kJ/mol8、下列说法正确的是A .增大反应物浓度,可增大单位体积内活化分子百分数,使单位时间内有效碰撞次数增大B .有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大C .升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数D .催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率9.在密闭容器中达到平衡的化学反应 N 2O 4(g) 2NO 2(g) △H>0,改变条件,下列说法不正确的是A .温度不变体积减小,反应速率增大,再次平衡时混合气颜色变浅B .温度和体积不变,加入少许NO 2,再次平衡时混合气中NO 2的百分含量减少C .体积不变时加入少许N 2O 4,再度平衡时颜色变深D .体积不变时升高温度,再次平衡时混合气颜色变深10.某探究小组利用丙酮的溴代反应(CH 3COCH 3 + Br 2 CH 3COCH 2Br + HBr )来研究反应物浓度与反应速率的关系。
2020-2021学年湖北省荆州市监利县第一中学高二化学联考试题含解析

2020-2021学年湖北省荆州市监利县第一中学高二化学联考试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 某有机物A的分子式为C6H12O2,已知A~E有如右图转化关系。
则A的结构可能有A.1种 B.2种 C.3种 D.4种参考答案:A略2. 下列说法正确的是A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大C.升高温度能使化学反应速率增大,主要是增加了反应物分子中活化分子的百分数D.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率参考答案:C3. 下列属于放热反应的是()A.铝和盐酸反应 B.焦炭和二氧化碳共热 C.石灰石的分解 D.氯化铵与氢氧化钡反应参考答案:A略4. 以N A代表阿伏伽德罗常数,则关于热化学方程式C2H2(g)+O2(g)===2CO2(g)+H2O(l)ΔH=-1300 kJ/mol的说法中,正确的是() A.当12N A个电子转移时,该反应放出1300 kJ的能量B.当1N A个水分子生成且为液体时,吸收1300 kJ的能量C.当有2N A个碳氧共用电子对生成时,放出1300 kJ的能量D.当有8N A个碳氧共用电子对生成时,放出1300 kJ的能量参考答案:D略5. 下列说法中错误的是()A.用联合制碱法制造纯碱和氯化铵,原料的利用率高,完全不必考虑环境保护的问题B.化工生产技术始终是在不断创新中发展,侯氏制碱法也还需要改进C.社会对纯碱的需求是纯碱生产技术创新发展的原动力D.纯碱生产技术的再创新需要多门学科、多种技术的协同作用参考答案:A解析:化工生产一般都会产生污染物,要科学地评价纯碱生产技术及其他化工生产技术。
6. SiCl4的分子结构与CCl4类似,对其作出如下推测,其中不正确的是A.SiCl4晶体是分子晶体B.常温常压下SiCl4是气体C.SiCl4分子是由极性键形成的非极性分子D.SiCl4熔点高于CCl4参考答案:B试题分析:SiCl4的分子结构与CCl4类似,与CCl4根据的结构和性质分析,CCl4属于分子晶体,常温为液体,含有共价键,分子晶体的相对分子质量越大,熔点越高,A、SiCl4与CCl4结构相似,则常温常压下SiCl4是分子晶体,A正确;B、②SiCl4与CCl4结构相似,常温常压下SiCl4是液体,B错误;C、CCl4分子是由极性键形成的非极性分子,则SiCl4分子是由极性键形成的非极性分子,C正确;D、分子晶体的相对分子质量越大,熔点越高,则SiCl4熔点高于CCl4,D正确;答案选B。
湖北省监利中学高二上学期第一次月考(化学)(无答案).doc

湖北省监利中学高二上学期第一次月考(化学)(无答案)(时间:100分钟满分:100分)一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)1.下列热化学方程式书写正确的是A.C(s)+O2(g)==CO2(g);△H=+393.5kJ/molB.2SO2+O2==2SO3;△H= —196.6kJ/molC.H2(g)+1/2O2(g)==H2O(l);△H= —85.8kJ/molD.2H2(g)+O2(g)==2H2O(l);△H= —571.6KJ2.下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/molB.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0kJ/molC.需要加热才能发生的反应一定是吸热反应D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热3.下列说法或表示方法正确的是A.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多B.由C(石墨)=C(金刚石);△H=+1.90 kJ/mol可知,金刚石比石墨稳定C.在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)= 2H2O(l); △H=-285.8kJ/molD.在稀溶液中,H+(aq)+ OH-(aq) = H2O(l); △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ4.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g)+1/2O2(g)=H2O(l);△H=-285.8 kJ/molCO(g)+1/2O2(g)=CO2(g);△H=-283.0 kJ/molC8H18(l)+25/2O2(g)= 8CO2(g)+9H2O(l);△H=-5518 kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3 kJ/mol相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是A .H 2(g)B .CO(g)C .C 8H 18(l)D .CH 4(g)5.在36 g 碳不完全燃烧所得气体中,CO 占1/3体积,CO 2占2/3体积。
最新-湖北省监利一中2018学年高二化学 下学期周测(二)

湖北省监利一中2018-2018学年高二周测(二)化学试题班级 姓名选择题 (每小题有一个或两答案符合题,共60分)1、下列物质属于醇类的是 ( )A . OH COOHB .CH 2OHC .CH 3OHD .2、下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是 ( )A.CH 3CH 2CH 3B.CH 3COCH 2CH 3C.CH 3CH 2OHD.CH 3OCH 33、下列说法不正确的是 ( )A .分子式为C 3H 8与C 6H 14的两种有机物一定互为同系物B .具有相同通式的有机物不一定互为同系物C .两个相邻同系物的相对分子质量数值一定相差14D .分子组成相差一个或若干个CH 2原子团的化合物必定互为同系物4、某烃与氢气加成后得到2,2-二甲基丁烷,该烃的名称是 ( )A .3, 3-二甲基-1-丁炔B .2,2-二甲基-2-丁烯C .2,2-二甲基-1-丁烯D .3,3-二甲基-1-丁烯5、下列各组有机物中,其一氯代物的数目不相等的是 ( )A .正戊烷和正己烷B .苯和乙烷C .对二甲苯和2,2-二甲基丙烷D .甲苯和2-甲基丙烷6、从烷烃(C n H 2n +2),烯烃(C n H 2n ),二烯烃(C n H 2n -2)的通式分析,某种只含碳碳双键官能团的烃的分子式为C x H y ,其中所含双键数目是 ( )A .y/2B .(y -x)/2C .(y +2-x)/2D .(2x +2-y)/27、10 mL 某种烃,在50 mL O 2中充分燃烧,得液态水和体积为35 mL 的混合气体(所有气体体积在同温同压下测定),则该烃是 ( )A .乙烷B .丙烷C .丙烯D .1,3-丁二烯8、甲烷是以碳原子为中心的正四面体结构而不是正方形的平面结构,理由是( )A .甲烷中的四个键的键长、键角相等B .CH 4是非极性分子C .二氯甲烷只有一种结构D .三氯甲烷只有一种结构9、分子式为C 5H 7Cl 的有机物,其结构不可能是 ( )A .只含有1个双键的直链有机物B .含2个双键的直链有机物C.含1个双键的环状有机物 D.含一个三键的直链有机物10、下列哪个选项属于碳链异构()A.CH3CH2 CH2CH3和CH3CH(CH3)2B.CH2=C(CH3)2和CH3CH=CHCH3C.CH3CH2OH和CH3OCH3D.CH3CH2 CH2COOH 和CH3COOCH2 CH211、下列选项属于官能团异构的是()A.CH3CH2 CH2CH3和CH3CH(CH3)2B.CH2=C(CH3)2和CH3CH=CHCH3C.CH3CH2OH和CH3OCH3D.CH3CH2 CH2COOH 和CH3COOCH2 CH212、分子式为C7H16的烷烃中,在结构中含有3个甲基支链的异构体数目是 ( )A.2种 B.3种 C.4种 D.5种13、下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系:(1)2-甲基丁烷和丁烷_______________ (2)正戊烷和2,2-二甲基丙烷_____________(3)间二甲苯和乙苯__________________(4)1-已烯和环已烷__________________14、某只含一种官能团的不饱和链烃A与氢气加成后生成2-甲基丁烷,则A的可能结构简式和对应的名称是:15、已知-NH2连在苯环上显碱性,-CONH2连在苯环上显中性。
监利县第一中学2018-2019学年高二上学期第一次月考试卷化学

监利县第一中学2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________ 一、选择题1.根据合成氨反应的能量变化示意图,下列有关说法正确的是A.N2(g)+3H2(g)=2NH3(g)△H=-2(a-b)kJ·mol-1B.断裂0.5moIN2(g)和1.5molH2(g)中所有的化学键释放aKJ 热量C.2NH3(l)= N2(g)+3H2(g)△H=2(b+c-a)kJ·mol-1D.若合成氨反应使用催化剂,反应放出的热量增多2.【2017北京卷】我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:的是()下列说法不正确...A.反应①的产物中含有水B.反应②中只有碳碳键形成C.汽油主要是C5~C11的烃类混合物D.图中a的名称是2-甲基丁烷3.用N A表示阿伏加德罗常数的值,下列说法中正确的是()A.1 mol N2所含有的原子数为N AB.标准状况下,22.4 L水中含有的水分子数为N AC.标准状况下,22.4 L氯化氢所含的原子数为N AD.24 g O2分子和24 g O3分子所含的氧原子数目相等的是4.某原电池装置如右图所示,下列有关说法不正确...A.锌是该电池的负极B.锌电极上发生氧化反应C .铜电极的电极反应式为:2H ++2e -=H 2↑D .若将电解质溶液换成AgNO 3溶液,两电极的反应式均发生改变 5. 一种合成某药物中间体Z 的方法如下。
下列说法正确的是A .1mol X 最多能消耗溴水中的2 mol Br 2B .Y 可以发生消去反应C .Z 中所有碳原子可以在同一平面D .用银氨溶液可以检验Z 中是否混有X6. 废水脱氮工艺中有一种方法是在废水中加入过量NaClO 使NH 4+完全转化为N 2,该反应可表示为4222NH 3ClO N 3Cl 2H 3H O +--++=+++。
湖北省监利一中2024届化学高一上期中调研试题含解析

湖北省监利一中2024届化学高一上期中调研试题注意事项1.考试结束后,请将本试卷和答题卡一并交回.2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置. 3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符.4.作答选择题,必须用2B 铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案.作答非选择题,必须用05毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效. 5.如需作图,须用2B 铅笔绘、写清楚,线条、符号等须加黑、加粗.一、选择题(每题只有一个选项符合题意) 1、下列叙述正确的是A .1mol 任何气体的体积一定是22.4LB .标准状况下,22.4L 的任何气体中都约含有6.02×1023个分子C .在标准状况下,体积为22.4L 的物质都是1molD .在非标准状况下,1mol 任何气体的体积不可能是22.4L2、一块表面已被氧化为Na 2O 的钠块10.8g ,将其投入100g 水中,产生H 2 0.2g ,则被氧化的钠是 ( ) A .9.2gB .10.6gC .6.2gD .4.6g3、下列谚语或俗语中包含化学变化的是A .只要功夫深,铁杵磨成针B .冰冻三尺非一日之寒C .墙内开花墙外香D .生米已成熟饭4、下列物质在水溶液中电离,电离方程式错误的是( ) A .NaHSO 4=Na ++H ++24SO -B .Mg(NO 3)2=Mg 2++23NO -C .NaHCO 3=Na ++H ++23CO -D .Na 2SO 4=2Na ++24SO -5、下列叙述中正确的是( )A .任何条件下氯化氢气体的密度都小于二氧化氮B .2.3 g 钠与1.12 L 氯气反应后,生成5.85 g 氯化钠C .常温常压下,1 g 氦气和1 g 氧气的体积比为2∶1D .在同温同体积时,气体物质的物质的量越大,压强越大 6、设N A 代表阿伏加德罗常数的值,下列说法正确的是 A .2.3 g 金属钠变为钠离子时失去的电子数目为0.1N A B .在常温常压下、11.2 L 氢气所含的原子数目为N A C .32 g 氧气所含的原子数目为N AD .1 mol·L -1 CaCl 2溶液中含有的氯离子数为2N A7、运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应5KClO3+6P===3P2O5+5KCl,下列有关该反应的叙述错误的是()A.KClO3是氧化剂B.P2O5是氧化产物C.1 mol KClO3参加反应有6 mol e﹣转移D.每有6 mol P被还原,生成5 mol KCl8、下列溶液中,跟100 mL 0.5 mol·L-1NaCl溶液所含的Cl-的物质的量浓度相同的是( )A.100 mL 0.5 mol·L-1MgCl2溶液B.200 mL 0.25 mol·L-1CaCl2溶液C.50 mL 1 mol·L-1NaCl溶液D.200 mL 0.25 mol·L-1HCl溶液9、下列说法正确的是A.将钠放入水中,钠将沉入水底B.金属钠着火时,可以用泡沫灭火器或用干燥的沙土灭火C.将一小块钠放入CuSO4溶液中发生反应:2Na+CuSO4 = Na2SO4+CuD.钠块放置于空气中,表面变暗;加热时,钠燃烧,发出黄色火焰10、下列实验操作或记录正确的是( )A.常温常压下测得1molN2的质量为28gB.用量筒测得排水法收集制得的氢气体积为50.28mLC.将洗净的锥形瓶和容量瓶放入烘箱中烘干D.用托盘天平称取2.50g胆矾,受热充分失水后,固体质量减轻0.90g11、下列离子方程式书写正确的是()A.氧化钠投入水中发生反应:O2-+H2O=2OH-B.向澄清石灰水中通入足量二氧化碳:OH-+CO2=HCO3-C.硝酸银溶液中加入铜粉:Ag++Cu=Cu2++AgD.金属铁溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑12、下列各组物质中,所含分子数相同的是A.10g H2和10g O2B.标况下5.6L N2和11g CO2C.9g H2O和1mol O2D.标况下224mL N2和0.1mol N213、在生产生活中,对于易燃、易爆、有毒的化学物质,按规定会在其包装上面贴上危险警告标签。
湖北省荆州市监利县第一中学高二化学月考试题含解析

湖北省荆州市监利县第一中学高二化学月考试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下列化学式中,只表示一种物质的是A.C2H6O B.C3H8 C.C3H6Cl2 D.C3H6参考答案:B略2. 下列说法正确的是 ()A.绿色食品是不含任何化学物质的食品B.灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素C.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀D.称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液.则放出氢气的体积(同温同压下)不相等参考答案:C略3. 下列描述中,不符合生产实际的是()A.电解熔融的氧化铝制取金属铝,用铁作阳极B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极D.在镀件上电镀锌,用锌作阳极参考答案:A当电解熔融的氧化铝制取金属铝时,活泼金属做阳极,活泼金属先失电子被氧化,所以一般除电镀池外活泼金属不能做阳极。
4. 下列情况会对人体健康造成较大危害的是A.自来水中通入少量Cl2进行消毒杀菌B.用SO2漂白食品C.用食醋清洗热水瓶胆内壁附着的水垢D.用小苏打(NaHCO3)发酵面团制作馒头参考答案:B试题分析:A.因Cl2与水反应生成强氧化性的HClO,具有杀菌消毒作用,一般浓度较小,对人体危害较小,故A不选;B.SO2本身有毒,不能用来漂白食物,SO2溶于水变成H2SO3,遇食物中硝酸盐物质会将其变成亚硝酸盐,而亚硝酸盐具致癌作用,因此使食品具有毒害作用,故B选;C、米醋的主要成分是醋酸,对人体无害,因CaCO3与CH3COOH反应:CaCO3+2CH3COOH=(CH3COO)2Ca+H2O+CO2↑,(CH3COO)2Ca 易溶于水,故C不选;D、因加热时NaHCO3分解产生气体:2NaHCO3Na2CO3+H2O+CO2,使蒸出的馒头松软多孔,故D不选;故选B。
2025届湖北省监利一中高二化学第一学期期中经典模拟试题含解析

2025届湖北省监利一中高二化学第一学期期中经典模拟试题注意事项:1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
4.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题(每题只有一个选项符合题意)1、已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是A.加入适量稀盐酸B.加入适量稀硝酸C.加入适量烧碱固体D.加水稀释2、莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是A.H的分子式为C17H14O4B.Q中所有碳原子不可能都共面C.1mol绿原酸与足量NaHCO3溶液反应,最多放出1molCO2D.H、Q、W均能发生氧化反应、取代反应、显色反应3、在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g) △H<0达到甲平衡。
在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是()A.图Ⅰ是加入反应物的变化情况B.图Ⅱ是扩大容器体积的变化情况C .图Ⅲ是增大压强的变化情况D .图Ⅲ是升高温度的变化情况4、下列说法正确的是A .糖类化合物都具有相同的官能团B .酯类物质是形成水果香味的主要成分C .油脂的皂化反应生成脂肪酸和丙醇D .蛋白质的水解产物都含有羧基和羟基5、下列各种方法中:①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④在金属表面进行电镀⑤使金属表面形成致密的氧化物薄膜,能对金属起到防护或减缓腐蚀作用的是 A .全部 B .①③④⑤ C .①②④⑤ D .①②③④ 6、某温度下,在一容积可变的容器中,反应2A (g )+B (g )2C (g )达到平衡时,A 、B 和C 的物质的量分别为4mol 、2mol 和4mol 。
湖北省监利一中高二化学 酯化反应方程式书写专题练习(无答案)

班级姓名
一、一元羧酸与一元醇的酯化
1、 乙酸与乙醇的酯化:
2、硝酸与乙醇的酯化:
3、甲酸与乙醇的酯化:
4、甲酸与甲醇酯化:
二、一元羧酸与二元醇的酯化
1、乙酸与乙二醇酯化:
2、硝酸与乙二醇酯化:
三、二元羧酸与一元醇的酯化
1、乙二酸与乙醇完全酯化:
乙二酸与乙醇不完全酯化:
2、对苯二甲酸与乙醇完全酯化:
3、硫酸与乙醇的酯化(生成硫酸氢乙酯):
四、一元羧酸与多元醇酯化:
1、硬脂酸与丙三醇酯化:
2、软脂酸与丙三醇酯化:
3、油酸与丙三醇完全酯化:
油酸甘油酯的氢化:
4、硝酸与丙三醇酯化:
5、硝酸与纤维素酯化生成硝酸纤维:
五、二元羧酸与二元醇酯化:
1、乙二酸与乙二醇酯化
(1)、生成简单链酯(1:1)
4、分子间酯化(2:2)生成链酯
5、分子间酯化(2:2)生成环酯
6、分子间酯化(1:1)生成聚酯
(聚乳酸塑料——在土壤中可自动降解)
七、能力练习(将上述反应中的醇改为胺——醇羟基改为氨基,写出与酯化反应相似的酰胺化反应方程式:羧脱羟基氨脱氢)
(2)、生成简单环酯(1:1)
(3)生成简单链酯(1:2)
(4)生成简单链酯(2:1)
(5)生成聚酯(1:1)(聚酯纤维)
2、对苯二甲酸与乙二醇酯化,生成涤纶树脂
六、羟基羧酸的酯化(以α-羟基丙酸也叫“乳酸”为例)
1、分子内酯化(生成内酯)
2、分子间酯化(1:1)生成链酯
3、分子间酯化(1:1)生成环酯
湖北省监利县第一中学高中化学 第三章第三节 羧酸 酯

第三章第三节羧酸酯第2课时目标要求1.认识酯的结构,理解酯的性质。
2.会书写酯的同分异构体。
知识梳理一、酯的概念和结构1.概念酯是羧酸分子中的__________被__________取代后的产物。
2.组成和结构酯的结构通式:________,R和R′可以相同也可以不同,其官能团名称为______。
饱和一元羧酸和饱和一元醇形成的酯的分子通式为______________。
3.命名酯类化合物是根据生成酯的酸和醇的名称来命名的。
命名时,羧酸的名称写在前面,醇的名称写在后面,去掉醇换成酯。
如:二、酯的性质1.物理性质酯的密度一般比水____,____溶于水,____溶于乙醇、乙醚等有机溶剂。
低级酯是具有__________的____体,存在于各种水果和花草中。
2.酯的水解反应在酸或碱存在的条件下,酯能发生________,生成相应的________和________。
如乙酸乙酯的水解反应方程式为酸性条件下:________________________________________________________________________________________________________________________________________________。
碱性条件下:________________________________________________________________________。
[课前预习检测]知识点1酯的组成和结构1.将下列酯的结构与名称连线12.乳酸( )自身可形成多种酯,请按相对分子质量由小到大的顺序________写出酯的结构简式____________________、____________________、____________、____________________。
知识点2酯的性质3.乙酸乙酯在KOH溶液中水解,得到的产物是( )①乙酸钾②甲醇③乙醇④乙酸A.①② B.②③ C.①③ D.②④4.分子式均为C3H6O2的三种常见有机物,它们共同具有的性质最可能是( )A.都能发生加成反应 B.都能发生水解反应C.都能跟稀H2SO4反应 D.都能跟NaOH溶液反应5.完成下列酯在NaOH溶液中水解的化学方程式。
湖北省监利一中高二化学 期末复习6 化学反应原理测试(无答案)

高二化学期末复习6---化学反应原理2011-6-16(化学反应与能量 化学平衡)班级 姓名一、选择题1. 下列说法不正确...的是 ( ) A 、焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行 B 、自发进行的反应一定能迅速进行C 、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大D 、一个反应能否自发进行,与焓变和熵变的共同影响有关2.下列事实,不能用勒夏特列原理解释的是 ( )A .溴水中有平衡:Br 2+ H 2O HBr+ HBrO 加入 AgNO 3溶液后溶液颜色变浅B .对CO(g) + NO 2 (g)CO 2 (g)+ NO(g) 平衡体系增大压强可使颜色变深C .升高温度能够增大硝酸钾在水中的溶解度D .合成 NH 3反应,为提高 NH 3的产率,理论上应采取相对较低温度的措施3. 强酸与强碱的稀溶液发生中和反应的热效应:H +(aq)+OH -(aq)=H 2O(1) ⊿H=-57.3kJ /mol 向1L0.5mol /L 的NaOH 溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H 1、⊿H 2、⊿H 3的关系正确的是 ( ) A.⊿H 1>⊿H 2>⊿H 3 B.⊿H 1<⊿H 3<⊿H 2 C.⊿H 1<⊿H 2<⊿H 3 D.⊿H 1>⊿H 3>⊿H 24.把足量铝条放入盛有一定体积的稀盐酸的试管中,可使反应速率降低且不影响H 2产生量的操作是 ( )A .加入适量CH 3COONa 溶液B .加入适量KNO 3溶液C .加入适量的K 2CO 3溶液D .加入适量Na 2SO 4溶液5.四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:① v(A)=0.15mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)= 0.4mol/(L·s) ④v(D)= 0.45mol/(L·s)。
湖北省监利县第一中学高二化学上学期第二次月考试题新人教版

1 考试时间:2013年12月27日下午 试卷满分:100分本试卷可能用到的相对原子质量:C :12 N :14 O :16 Cl: 35.5 Ag: 108第Ⅰ卷(选择题 共48分)一、选择题(本题包括16小题,每小题只有一个选项符合题意,每小题3分,共计48分)1.据新浪网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:激光↑+↑222222O H TiO O H 。
有下列几种说法:①水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③使用氢气作燃料有助于控制温室效应;④氢气是一级能源。
其中叙述正确的是 ( )A .①②B .③④C .②③D .①②③④2.下列电离方程式中,书写错误的是( )A .Ba(OH)2 = Ba 2+ + 2 OH -B .H 3PO 4 3 H + + PO 43- C .HClO H + + ClO - D .NH 3·H 2O NH 4+ + OH -3.在密闭容器中进行A 与B 反应生成C 的可逆反应,反应速率v (A )、v (B )、v (C )之间存在以下关系:3 v (C )=2 v (A )、v (C )=2 v (B ) 则该反应可以表示为( )A .A+BC B .2A+2B 3C C .A+3B 2CD .3A+B 2C4.下列关于实验现象的描述不正确的是( )A .把铜片插入三氯化铁溶液中,在铜片表面出现一层铁B .把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡C .用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜D .把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快5.对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知( )A .正反应进行的程度大,正反应速率一定大B .化学平衡发生移动时,化学反应速率一定变化C .化学反应速率变化时,化学平衡一定发生移动D .只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况6.下列关于化学反应的自发性叙述中正确的是( )A .自发反应在恰当条件下才能实现B .焓变和熵变都小于0的反应肯定是自发的C .焓变和熵变都大于0的反应肯定是自发的D .自发反应一定是熵增大,非自发反应一定是熵减小7.在蒸发皿中加热蒸干下列物质的溶液然后灼烧,可以得到该物质的固体的是( )A .AlCl 3B .NaHCO 3C .(NH 4)2CO 3D .MgSO 48.有等体积、等pH 的Ba(OH)2、NaOH 和NH 3·H 2O 三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V 1、V 2、V 3,则三者的大小关系正确的是( )A .V 3>V 2>V 1B .V 3=V 2=V 1C .V 1=V 2>V 3D .V 3>V 2=V 19.中国首条“生态马路”近期在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO 和CO 转化成N 2和CO 2。
湖北省监利一中高二化学 期末复习7 化学反应原理练习(无答案)

高二化学期末复习7---化学反应原理2020-6-18(水溶液中的离子平衡)班级姓名1.某溶液中存在较多的H+、SO42—、NO3—,则其中还可能大量存在的离子组是()A.Al3+、CH3COO—、Cl— B.Mg2+、Ba2+、Br—C.Mg2+、Cl—、Fe2+D.Na+、NH4+、Cl—2.有等体积、等pH的Ca(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是 ( )A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V33. 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是 ( )A c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—)B c(K+)+ c(S2—) = 0.3mol/LC c(K+)=c(S2—)+c(HS—)+c(H2S)D c(OH-)=c(H+)+c(HS—)+2c(H2S)4.下列混合溶液中,各离子浓度的大小顺序正确的是()A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合c(Cl—)> c(NH4+)> c(OH—)> c(H+)B. 10mL0.1mol/L NH4 Cl溶液与5mL0.2mol/L NaOH溶液混合c(Na+)=c(Cl—)> c(OH—)> c(H+)C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/L NaOH溶液混合,c(Na+)=c(CH3COO—)> c(OH—)> c(H+)D.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合c(Cl—)>c(Na+)> c(OH—)> c(H+)5.常温时,向pH =2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,溶液变成红色,该溶液可能是()A.pH =12 的Ba(OH)2 B.pH =12的氨水C.0.005mol/L NaOH D.0.05mol/LBaCl26.下列说法正确的是()A.pH=2和pH=1的硝酸中c(H+)之比为1:10)之比为2:1B.Na2CO3溶液c(Na+)与c(CO 23C.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1D.pH=1的硫酸中加入等体积0.05 mol/L的BaCl2溶液,恰好反应时c (SO42-)=07.下列物质能跟镁反应并生成氢气的是 ( )A.甲酸溶液B. 氢氧化钠溶液C. 氯化铵溶液D.碳酸钠溶液8.1体积硫酸恰好与10体积pH=11氢氧化钠溶液反应,二者物质的量浓度之比为()A.10:1 B.5:1 C.1:1 D.1:109.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是()A.生成了一种强酸弱碱盐B.弱酸溶液和强碱溶液反应C.强酸溶液和弱碱溶液反应D.一元强酸溶液和一元强碱溶液反应10.下列溶液加热蒸干后,能析出原溶质固体的是()A.AlCl3B.KHCO3C.Fe2(SO4)3D.NH4HCO311.下列式子不属于盐的水解反应的是 ( )A.HCO3-+H2O H3O++CO32-B.Fe3++3H2O Fe(OH)3+3H+C.HS-+H2O H2S+OH-D.NH4++H2O NH3·H2O+H+12.下列操作中,能使电离平衡H2O H++OH-,向右移动且溶液呈酸性的是()A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=613.(1)25℃时, 0.05mol/LH2SO4溶液的pH= ;0.05mol/LBa(OH)2溶液c(H+)= (2)某温度下纯水中的c(H+)= 2×10-7mol/L,则此时溶液中的c(OH-)= ;若温度不变,滴入稀盐酸,使c(H+)= 5×10-4mol/L,则溶液中c(OH-)= ,此时溶液中由水电离产生的c(H+)=14.在2mL0.1mol/L的NaCl溶液中,加入2mL0.1mol/L的AgNO3溶液,可观察到,此反应的离子方程式。
湖北省荆州市监利县第一中学2022年高二化学上学期期末试题含解析

湖北省荆州市监利县第一中学2022年高二化学上学期期末试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下列各项与反应热的大小无关的是( )A.反应物和生成物的状态B.反应物量的多少 C.反应物的性质 D.反应的快慢参考答案:D2. 下列物质的鉴别方法不正确的是()A.用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液B.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液C.用品红试液鉴别SO2和CO2两种气体D.用焰色反应鉴别NaCl、KCl和Na2SO4参考答案:D略3. 制取氯乙烷,采用的最佳方法是:A.乙烷和氯气取代反应 B.乙烯和氯气加成反应C.乙烷和HCl作用 D.乙烯和HCl加成反应参考答案:D略4. 下列叙述正确的是 A. CH2ClCH2C1的系统命名是二氯乙烷B. 乙烯的最简式是C2H4C. 四氯化碳的电子式是D. 2,5-二甲基己烷的核磁氢谱中出现三组峰参考答案:D5. 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是()A.a点表示溶液中c(CH3COO﹣)约为10﹣3 mol/LB.b点表示的溶液中c(Na+)>c(CH3COO﹣)C.c点表示CH3COOH和NaOH恰好反应完全D.d点表示的溶液中大于K参考答案:A考点:酸碱混合时的定性判断及有关ph的计算.专题:电离平衡与溶液的pH专题.分析:A.酸能抑制水的电离,再根据弱电解质的性质分析溶液中醋酸根离子的浓度.B.任何溶液一定满足电荷守恒,根据电荷守恒进行判断;C、根据醋酸和氢氧化钠生成盐的类型判断恰好反应时溶液的酸碱性,从而确定该选项是错误的;D、电离平衡常数只与温度有关,与其它任何条件都无关.解答:解:A.a点是c(H+)=10﹣3mol/L,由于醋酸为弱酸,酸能抑制水的电离,醋酸的电离远远大于水的电离,所以溶液中氢离子浓度近似等于醋酸根离子浓度,即c(CH3COO﹣)约为10﹣3 mol/L,故A正确;B.溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),b点时,溶液显示酸性,c (H+)>c(OH﹣),则有c(CH3COO﹣)>c(Na+),故B错误;C、醋酸和氢氧化钠反应生成醋酸钠,醋酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;D、d点时溶液的温度没有变化,所以d点表示的溶液中=K,故D错误;故选A.点评:本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,注意平衡常数K只与温度有关,与其它任何条件都无关,能够根据电荷守恒、物料守恒比较溶液中离子浓度大小6. 某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有(不考虑顺反异构)A.2种 B.3种 C.4种 D.5种.参考答案:C略7. 右图是已经合成的最著名硫-氮化合物分子结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、硫酸与乙醇的酯化(生成硫酸氢乙酯):
四、一元羧酸与多元醇酯化:
1、硬脂酸与丙三醇酯化:
2、软脂酸与丙三醇酯化:
3、油酸与丙三醇完全酯化:
油酸甘油酯的氢化:
4、硝酸与丙三醇酯化:
5、硝酸与纤维素酯化生成硝酸纤维:
五、二元羧酸与二元醇酯化:
1、乙二酸与乙二醇酯化
(1)、生成简单链酯(1:1)
4、分子间酯化(2:2)生成链酯
5、分子间酯化(2:2)生成环酯
6、分子间酯化(1:1)生成聚酯
(聚乳酸塑料——在土壤中可自动降解)
七、能力练习(将上述反应中的醇改为胺——醇羟基改为氨基,写出与酯化反应相似的酰胺化反应方程式:羧脱羟基氨脱氢)
(2)、生成简单环酯(1:1)
(3)生成简单链酯(聚酯纤维)
2、对苯二甲酸与乙二醇酯化,生成涤纶树脂
六、羟基羧酸的酯化(以α-羟基丙酸也叫“乳酸”为例)
1、分子内酯化(生成内酯)
2、分子间酯化(1:1)生成链酯
3、分子间酯化(1:1)生成环酯
高二化学酯化反应方程式书写专题练习
班级姓名
一、一元羧酸与一元醇的酯化
1、 乙酸与乙醇的酯化:
2、硝酸与乙醇的酯化:
3、甲酸与乙醇的酯化:
4、甲酸与甲醇酯化:
二、一元羧酸与二元醇的酯化
1、乙酸与乙二醇酯化:
2、硝酸与乙二醇酯化:
三、二元羧酸与一元醇的酯化
1、乙二酸与乙醇完全酯化:
乙二酸与乙醇不完全酯化:
